- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
两种具有铁不依赖的黄酮3-羟化酶活性的黄酮醇合酶的表征gydF4y2Baornithogalum caudatum.gydF4y2BaJACQ.gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba19gydF4y2Ba文章编号:gydF4y2Ba195gydF4y2Ba(gydF4y2Ba2019年gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
黄酮醇合成酶(FLS)是负责黄酮化合物生物合成的关键酶,这是具有多种药物作用的丰富的黄酮类化合物。Flavonol合酶以前在其他物种中发现,但尚未进入gydF4y2Baornithogalum caudatum.gydF4y2Ba.gydF4y2Ba
结果gydF4y2Ba
一个黄酮醇合酶基因家族的转录组范围挖掘和功能特征gydF4y2Bao . caudatumgydF4y2Ba据报道。具体来说,窝藏两个成员,OCFLS1和OCFLS2的小霉菌基因族gydF4y2Bao . caudatumgydF4y2Ba基于全转录组挖掘。系统发育分析表明,这两个蛋白与FLS蛋白的亲缘关系最密切。体外酶学分析表明,OcFLS1和OcFLS2为黄酮醇合成酶,催化二氢黄酮醇向黄酮醇的转化,并以铁依赖方式进行。此外,两种蛋白均具有黄酮3β-羟化酶(F3H)活性,将黄酮羟化形成二氢黄酮醇。与单一的F3H酶不同,OcFLS1和OcFLS2的F3H活性并不完全需要铁。然而,存在足够的铁gydF4y2Ba2+gydF4y2Ba被证明有利于连续催化黄烷酮至黄酮醇。QRT-PCR分析表明,两种基因在叶子,灯泡和花中表达,在叶子中特别高。此外,它们的表达受发育和环境条件调节。gydF4y2Ba
结论gydF4y2Ba
来自OcFLS1和OcFLS2gydF4y2Bao . caudatumgydF4y2Ba被证明是具有无依赖铁的黄烷酮3-羟化酶活性的黄酮醇合成酶。gydF4y2Ba
背景gydF4y2Ba
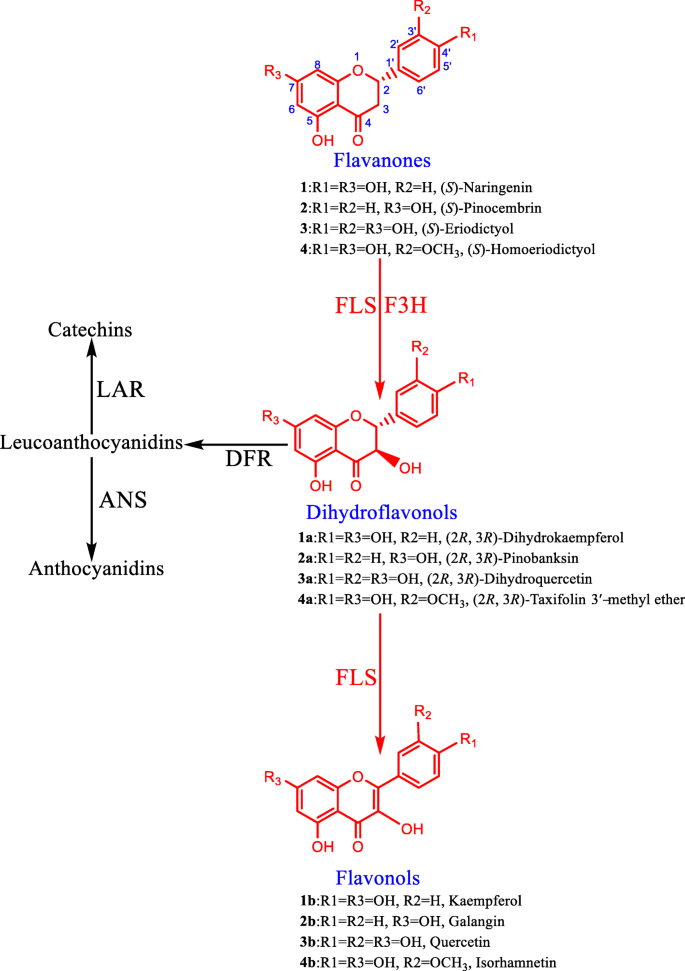
黄酮醇是自然中最丰富和广泛分布的黄酮类化合物[gydF4y2Ba1gydF4y2Ba].黄酮酚显示出广泛的生物活性,如抗氧化效果[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba],抗癌活动[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba],抗炎特性[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba],以及抗糖尿病作用[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba].黄酮醇的多种活性使其成为药物开发的理想分子,黄酮醇的生物合成也因此越来越受到研究者的关注[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba].从黄酮开始的黄酮醇的生物合成包括两个步骤(图。gydF4y2Ba1gydF4y2Ba).首先,黄酮通过黄酮3-羟化酶(F3H)羟基化,生成二氢黄酮醇,二氢黄酮醇随后可能通过黄酮醇合酶(FLS)的作用,在C-2和C-3之间引入双键,转化为黄酮醇。一种非血红素亚铁酶,属于2-氧戊二酸依赖性双加氧酶(2-ODD)家族。另外,二氢黄酮醇可能通过二氢黄酮醇4-还原酶(DFR)还原为白色素花青素,从而形成儿茶素和花青素(图)。gydF4y2Ba1gydF4y2Ba).因此,FLSs位于分叉分支,将代谢通量转向黄酮醇。除了FLS活性外,黄酮醇合成酶还具有F3H活性,接受黄酮作为底物[gydF4y2Ba18gydF4y2Ba].因此,肉类被认为是具有宽底物特异性的黄酮2 - 次数,并且代表黄酮酚生物合成中的关键结构蛋白(图。gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
FLS最初是由Britsch等人在欧芹悬浮培养中发现的[gydF4y2Ba20.gydF4y2Ba]作为一种二恶英酶酶。随后,证明了FLS在各种物种中广泛普及,例如gydF4y2BaPetroselinum霍顿斯gydF4y2BaHoffm。[gydF4y2Ba20.gydF4y2Ba],gydF4y2Ba荔枝中华人员gydF4y2Ba[gydF4y2Ba21gydF4y2Ba],gydF4y2Ba仙客来purpurascensgydF4y2Ba[gydF4y2Ba22gydF4y2Ba]等等。由于它们在黄酮化生物合成中的重要作用,将霉菌基因引入不同的微生物中以构建用于黄酮酚的绿色制剂的工程化细胞[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba].然而,这些工程菌株中目标黄酮醇的实际产量不足以实现工业化生产。提高这些细胞工厂中黄酮醇产量的一个策略是应用具有更高催化活性的黄酮醇合酶。因此,从不同的生物体中分离新的FLS基因,如gydF4y2Baornithogalum caudatum.gydF4y2Ba,是一种有效的方法来识别具有更好催化活性的优良候选。gydF4y2Ba
ornithogalum caudatum.gydF4y2Ba是一种富含黄酮醇及其苷类的药用植物,如槲皮素、山奈酚、异鼠李素、槲皮素3-gydF4y2BaOgydF4y2Ba-β-D-葡糖吡喃糖苷,Kaempferol 3-gydF4y2BaOgydF4y2Ba-β- d -glucopyranoside,芦丁,山奈酚gydF4y2BaOgydF4y2Ba-β-rutinoside [gydF4y2Ba32gydF4y2Ba],提示该物种含有编码黄酮醇合酶的基因。因此,选择该植物作为FLS基因分离的起始材料。在这里,一个黄酮醇合酶基因家族的转录组范围的挖掘和功能特征gydF4y2Bao . caudatumgydF4y2Ba报告。具体地说,一个小的FLS基因家族包含两个成员gydF4y2Bao . caudatumgydF4y2Ba.体外酶学分析表明,两种FLS酶能够以铁依赖的方式将二氢黄酮醇转化为黄酮醇。此外,两种酶均具有F3H作用,在不需要亚铁的情况下催化黄酮生成二氢黄酮醇。然而,存在足够的铁gydF4y2Ba2+gydF4y2Ba导致来自黄黄酮的黄酮酚的高效生物转化。植物中两种基因的表达谱表明,它们的表达是通过发育和环境条件调节的。这些发现深化了我们对黄酮合成酶的理解,从而拓宽了其应用。gydF4y2Ba
结果gydF4y2Ba
在编码杂物的硅胶识别中gydF4y2Ba
在功能注释之后,从RNA-SEQ数据检索四个unigenes,即未成熟的61,710,27,929,76,508和101,341,显示与黄酮醇合成酶的高序列相似性(附加文件gydF4y2Ba1gydF4y2Ba:图S1)。Unigene 61,710长1280 bp,包含1008 bp的ORF(附加文件)gydF4y2Ba1gydF4y2Ba:图S1)。此外,该unigene包含81 bp的5 ' -非翻译区(5 ' -UTR)和191 bp的3 ' -UTR(附加文件)gydF4y2Ba1gydF4y2Ba:图S1)。其他3个ungene分别为unigene 27,929、76,508和101,341,分别为878、246和298 bp(附加文件)gydF4y2Ba1gydF4y2Ba:图S1)。没有一个unigenes包含全长orf。序列比对显示,未叶烯27,929,76,508和101,341显示与5'末端,3'-末端和中间部分的序列相同gydF4y2BaFLS的gydF4y2Ba基因(附加文件gydF4y2Ba1gydF4y2Ba:图S1)。Unigene 27,929包含52 bp的5 ' -UTR和826 bp的5 ' - ORF区域。Unigene 76,508的区域长度为188 bp,为ORF的3 '端,3 ' -UTR为66 bp。Unigene 101,341长298 bp,核苷酸跨度613至910gydF4y2BaFLS的gydF4y2Ba基因。此外,unigenes 27,929和101,341以及unigenes 76,508和101,341存在序列重叠,提示这3个unigenes可能位于同一序列中(附加文件)gydF4y2Ba1gydF4y2Ba:图S1)。因此,这些unigenes组装成具有1126bp的更长的未植物,包括52bp的5'-utr,ORF为1008bp,以及66bp的3'-UTR(附加文件gydF4y2Ba1gydF4y2Ba:图S1)。数据表明,有一个小基因家族至少包含两个成员gydF4y2Bao . caudatumgydF4y2Ba基因组,一个成员对应于unigene 61710,而另一个gydF4y2BaFLS的gydF4y2Ba基因包括未成熟的27,929,76,508和101,341。因此,选择这两种类似的unigenes进行进一步调查。gydF4y2Ba
cDNA序列分离和分析gydF4y2Ba
为了确定这些unigenes的身份,采用嵌套pcr方法分离相应的cdnagydF4y2Bao . caudatumgydF4y2BacDNA作为模板。使用Unigene 61,710特定的引物(附加文件gydF4y2Ba12gydF4y2Ba:表S1),这种基于PCR的方法导致扩增指定为OCFLS1的1008bp cDNA片段(附加文件gydF4y2Ba2gydF4y2Ba:图S2)。此外,还分离到另一个PCR片段,命名为OcFLS2gydF4y2Bao . caudatumgydF4y2Ba由与unigene 27,929对应的正向引物和与unigene 76,508对应的反向引物组合得到的cDNA(附加文件gydF4y2Ba2gydF4y2Ba:图S2)。将OcFLS1和OcFLS2克隆到pEASY-Blunt中,形成两个重组质粒pEASY-OcFLS1和pEASY-OcFLS2进行测序(附加文件)gydF4y2Ba12gydF4y2Ba:表S2)。利用Blast N软件进行序列比对,OcFLS1对unigene 61,710的同源性为99%。此外,如我们所料,OcFLS2由unigene 27,929, 76,508和101,341组成(附加文件gydF4y2Ba1gydF4y2Ba:图S1)。这表明OcFLS1和OcFLS2是善意基因gydF4y2Bao . caudatumgydF4y2Ba基因组。因此,两种序列被提交给Genbank,注释NH748569(OCFLS1)和MH748570(OCFLS2)。gydF4y2Ba
OcFLS1的ORF长度为1008 bp,编码335个氨基酸(aa),预测分子量为37.835 kDa,等电点(pI)为5.57。OcFLS2基因的ORF全长为1008 bp。使用Compute pI/Mw工具计算OcFLS2的分子质量和理论pI (gydF4y2Bahttps://web.expasy.org/compute_pi/gydF4y2Ba)分别为37.643 kda和5.38。OCFLS1编码的氨基酸序列显示了OCFLS2的94%的同一性。gydF4y2Ba
TMHMM服务器预测,OCFLS1或OCFLS2中没有发现跨膜螺旋(gydF4y2Bahttp://www.cbs.dtu.dk/services/tmmm/#opennewWindow.gydF4y2Ba).两种OCFL蛋白显示出高度相似性与来自其他植物的先前报道的霉菌,例如CPURFLS1(BBA27023.1)和CPURFLS2(BBA024.1)gydF4y2Ba仙客来purpurascensgydF4y2Ba[gydF4y2Ba22gydF4y2Ba],ACFL(AFA55179.1)来自gydF4y2Ba金合欢混淆gydF4y2Ba[gydF4y2Ba33gydF4y2Ba), FtFLS1 (AEC33116.1)gydF4y2BaFagopyrum tataricumgydF4y2Ba[gydF4y2Ba34gydF4y2Ba]以及ATFLS1(NP_196481.1)和ATFLS3(NP_201164.1)来自gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba[gydF4y2Ba35gydF4y2Ba].多序列比对表明,两个蛋白均具有高度保守的亚铁结合基序HXDXgydF4y2Ba53.gydF4y2BaH(在这些基模中X代表任何氨基酸)和2-氧戊二酸结合基模RXS,表明两者都属于2-ODDs(附加文件gydF4y2Ba3.gydF4y2Ba:图S3)。gydF4y2Ba
总共36种黄酮2-赔率用于系统发育分析(附加文件gydF4y2Ba4gydF4y2Ba:图S4)。这些2-ODD序列被聚为4个不同的分支,即FSI、F3H、ANS和FLS。FSI、F3H、ANS和FLS进化支的成员是黄酮合酶I (FSI)、黄酮3-羟化酶、花青素合酶(ANS)和黄酮醇合酶的编码序列。OcFLS1和OcFLS2与其他fls聚类在fls相关分支中。两种蛋白均与FLS蛋白亲缘关系最密切gydF4y2BaAllium Cepa.gydF4y2Ba(附加文件gydF4y2Ba4gydF4y2Ba:图S4),与单子叶纳群岛内的较近植物关系相关联。gydF4y2Ba
异种表达及蛋白纯化gydF4y2Ba
将OcFLS1和OcFLS2亚克隆到pET-28a(+)中,得到pET28a-OcFLS1和pET28a-OcFLS2(附加文件)gydF4y2Ba12gydF4y2Ba:表S2),然后转化为gydF4y2Ba大肠杆菌转化gydF4y2BaETTA(DE3)用于异源表达。OCFLS1和OCFLS2的可溶性表达式gydF4y2Ba反式gydF4y2Baetta (DE3)用SDS-PAGE进行验证。如图所示。gydF4y2Ba2gydF4y2Ba,表示OCFLS1的强烈乐队存在于总提取物中gydF4y2Ba反式gydF4y2BaETTA(DE3)[PET28A-OCFLS1]。相反,在控制应变的相同位置未检测到相应的频带gydF4y2Ba反式gydF4y2BaETTA(DE3)[PET-28A(+)],建议OCFLS1已成功表达gydF4y2Ba大肠杆菌gydF4y2Ba以可溶的形式。同样,在SDS-PAGE分析中可以观察到OcFLS2的可溶性表达(图。gydF4y2Ba2gydF4y2Ba).将两种重组蛋白纯化至接近均匀,纯化后的蛋白定量为32.729 (OcFLS1)和80.25 mg/ml (OcFLS2)(图2)。gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
重组OcFLS1的SDS-PAGE分析(gydF4y2Ba一个gydF4y2Ba)及OcFLS2 (gydF4y2BabgydF4y2Ba).Lane 1,表达重组OcFLS1 (gydF4y2Ba一个gydF4y2Ba)及OcFLS2 (gydF4y2BabgydF4y2Ba).列2,不表达重组OcFLS1 (gydF4y2Ba一个gydF4y2Ba)及OcFLS2 (gydF4y2BabgydF4y2Ba);泳道3,纯化的重组OCFLS1(gydF4y2Ba一个gydF4y2Ba)及OcFLS2 (gydF4y2BabgydF4y2Ba); M Lane,标准蛋白标记物的迁移用凝胶左侧的kDa表示gydF4y2Ba
OcFLSs的黄酮醇合酶活性gydF4y2Ba
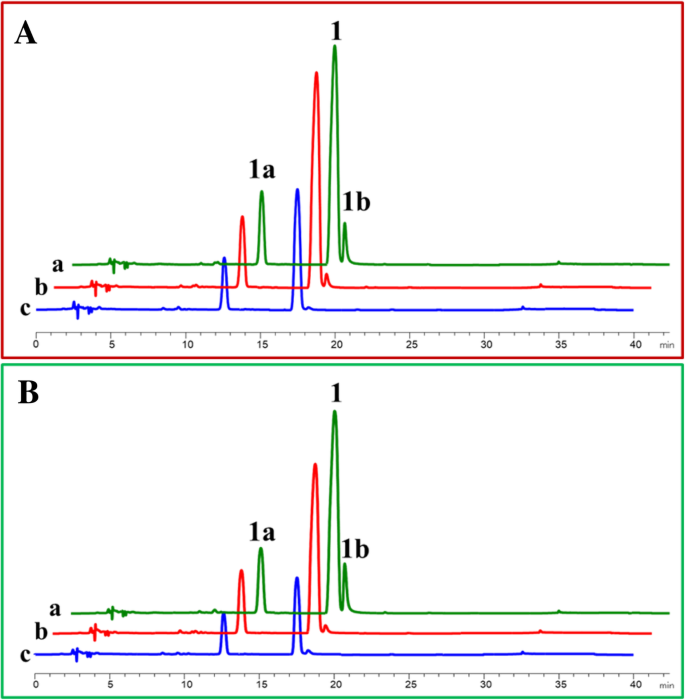
虽然OcFLS1和OcFLS2属于黄酮醇合成酶家族,但由于类黄酮相关双加氧酶的序列高度一致,因此需要进行全面的生化特性分析[gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba].没有特别的解释,本研究中使用的生物催化剂是纯化的酶。测试OCFLS1,Dihydrokaempferol(gydF4y2Ba1gydF4y2Ba)作为底物,在α-酮戊二酸、硫酸亚铁和抗坏血酸存在下纯化OcFLS1。20℃孵育2 h后,反应混合物中出现一个新峰,保留时间(Rt)为18.4 min(图)。gydF4y2Ba3.gydF4y2Baa).此峰显示与真正标准山奈酚相同的紫外光谱(gydF4y2Ba1 bgydF4y2Ba),建议新产品与Kaempferol的类似结构类似(gydF4y2Ba1 bgydF4y2Ba)(图。gydF4y2Ba3.gydF4y2Bab)。进一步的MS频谱([M-H]gydF4y2Ba-gydF4y2Ba离子在gydF4y2Bam / zgydF4y2Ba285.02060)(图。gydF4y2Ba3.gydF4y2BaC)与标准山奈酚共洗脱(gydF4y2Ba1 bgydF4y2Ba)(图。gydF4y2Ba3.gydF4y2BaA)确认新代谢物为山奈酚(gydF4y2Ba1 bgydF4y2Ba).gydF4y2Ba
山奈酚的生物转化(gydF4y2Ba1 bgydF4y2Ba),由二氢山奈酚(gydF4y2Ba1gydF4y2Ba)由OCFLS1催化(gydF4y2Ba一个gydF4y2Ba-gydF4y2BacgydF4y2Ba)或OCFLS2(gydF4y2BadgydF4y2Ba-gydF4y2BafgydF4y2Ba).gydF4y2Ba一个gydF4y2Ba,gydF4y2BadgydF4y2Ba:二氢山奈酚反应产物的HPLC色谱图(gydF4y2Ba1gydF4y2Ba)与OcFLS1 (gydF4y2Ba一个gydF4y2Ba)及OcFLS2 (gydF4y2BadgydF4y2Ba).gydF4y2Ba一个gydF4y2Ba,与正品山奈酚共洗脱(gydF4y2Ba1 bgydF4y2Ba).gydF4y2BabgydF4y2Ba,二氢山奈酚的反应产物(gydF4y2Ba1gydF4y2Ba)。gydF4y2BacgydF4y2Ba,二氢山奈酚的反应产物(gydF4y2Ba1gydF4y2Ba)没有纯化的蛋白质。gydF4y2BabgydF4y2Ba,gydF4y2BaegydF4y2Ba:反应产物的紫外光谱gydF4y2Ba1 bgydF4y2Ba(蓝线)和真正的山奈酚(红线)。gydF4y2BacgydF4y2Ba,gydF4y2BafgydF4y2Ba:反应产物的质谱图gydF4y2Ba1 bgydF4y2Ba由OcFLS1制作(gydF4y2BacgydF4y2Ba)及OcFLS2 (gydF4y2BafgydF4y2Ba)gydF4y2Ba
除了dihydrokaempferol (gydF4y2Ba1gydF4y2Ba)、其他二氢黄酮醇,如木黄酮(gydF4y2Ba2gydF4y2Ba)(附加文件gydF4y2Ba5gydF4y2Ba:图S5),二氢槲皮素(gydF4y2Ba3AgydF4y2Ba)(附加文件gydF4y2Ba6gydF4y2Ba:图S6)和3'-gydF4y2BaOgydF4y2Ba- 甲基紫外兰(gydF4y2Ba4AgydF4y2Ba)(附加文件gydF4y2Ba7gydF4y2Ba:图S7)可以通过OCFLS1氧化,从而产生相应的黄酮醇[Galangin(gydF4y2Ba2 bgydF4y2Ba)、槲皮素(gydF4y2Ba3B.gydF4y2Ba)和isorhamnetin(gydF4y2Ba4B.gydF4y2Ba)]。然而,OcFLS1对其他化合物没有活性,gydF4y2Ba5gydF4y2Ba- - - - - -gydF4y2Ba15,gydF4y2Ba列入其他文件gydF4y2Ba8gydF4y2Ba:图S8。对OcFLS2也做了类似的观察(图。gydF4y2Ba3.gydF4y2Ba和额外的文件gydF4y2Ba5gydF4y2Ba:图S5附加文件gydF4y2Ba6gydF4y2Ba:图S6附加文件gydF4y2Ba7gydF4y2Ba:图S7)。这些数据表明,这两种酶都是黄酮醇合成酶,专为二氢黄酮醇。gydF4y2Ba
温度对这两种酶的FLS活性的影响是相似的。gydF4y2Ba4gydF4y2Ba).这两种酶在大约20°C时表现出最佳活性(图。gydF4y2Ba4gydF4y2Ba).这两种酶都具有耐寒性,在0°C条件下都能保持至少60%的活性。然而,这两种酶在50℃完全失活(图。gydF4y2Ba4gydF4y2Ba).差异地显示两种酶的FLS活性的pH谱(图。gydF4y2Ba4gydF4y2Ba).两种蛋白质在pH 6.0时显示出最佳的液体活性。当pH超过6.0时,OCFLS1的FLS活性略微下降(图。gydF4y2Ba4gydF4y2Ba).当pH为9.0时,OCFLS1保留约80%的活性(图。gydF4y2Ba4gydF4y2Ba).由于pH继续上升,OCFLS1活动显着下降。当pH达到11.0时,OCFLS1的残余活性约为10%(图。gydF4y2Ba4gydF4y2Ba).相反,当pH大于6.0时,OcFLS2的FLS活性显著降低(图2)。gydF4y2Ba4gydF4y2Ba).当pH为10.0时,OcFLS2完全失去FLS活性(图2)。gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
温度的影响(gydF4y2Ba一个gydF4y2Ba-gydF4y2BadgydF4y2Ba)及pH值(gydF4y2BaegydF4y2Ba-gydF4y2BahgydF4y2Ba)关于酶活性。gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba,温度对FLS的影响(gydF4y2Ba一个gydF4y2Ba)及F3H活动(gydF4y2BacgydF4y2BaOcFLS1);gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,温度对FLS的影响(gydF4y2BabgydF4y2Ba)及F3H活动(gydF4y2BadgydF4y2BaOcFLS2);gydF4y2BaegydF4y2Ba,gydF4y2BaggydF4y2Ba, pH对FLS的影响(gydF4y2BaegydF4y2Ba)及F3H活动(gydF4y2BaggydF4y2BaOcFLS1);gydF4y2BafgydF4y2Ba,gydF4y2BahgydF4y2Ba, pH对FLS的影响(gydF4y2BafgydF4y2Ba)及F3H活动(gydF4y2BahgydF4y2Ba)OCFLS2。数据被呈现为三个生物复制的平均值±标准偏差值gydF4y2Ba
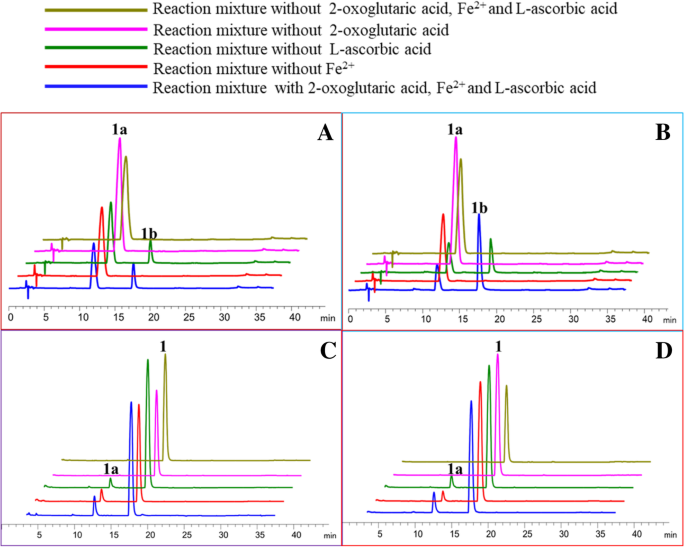
使用二氢戊醛研究两种酶的携带型舒收依赖性(gydF4y2Ba1gydF4y2Ba)作为衬底(图。gydF4y2Ba5gydF4y2Ba).遗漏的fegydF4y2Ba2+gydF4y2Ba和(或)2-氧戊二酸导致两种酶的FLS活性完全丧失,提示铁gydF4y2Ba2+gydF4y2Ba和(或)2-氧戊二酸是两个FLS活性所必需的(图。gydF4y2Ba5gydF4y2Ba- a和- b)。遗漏的L-抗坏血酸不会导致OCFLS1和OCFLS2的活性显着降低(图。gydF4y2Ba5gydF4y2Ba- a和- b)。两种OcFLS蛋白的辅助因子依赖性与杨树黄酮醇合酶(PFLS)的辅助因子依赖性有所不同。当反应混合物中不含2-氧戊二酸和(或)l -抗坏血酸时,PFLS活性完全消除。相反,PFLS在不含铁的情况下仍保持35%的活性gydF4y2Ba2+gydF4y2Ba,表明FEgydF4y2Ba2+gydF4y2BaPFLS活动不是绝对必需的[gydF4y2Ba26gydF4y2Ba].gydF4y2Ba
OCFLS1的辅助因子依赖性(gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba)及OcFLS2 (gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba).gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba,辅助因素对FLS的影响(gydF4y2Ba一个gydF4y2Ba)或f3h活动(gydF4y2BacgydF4y2BaOcFLS1);gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,辅助因素对FLS的影响(gydF4y2BabgydF4y2Ba)或f3h活动(gydF4y2BadgydF4y2Ba) OcFLS2gydF4y2Ba
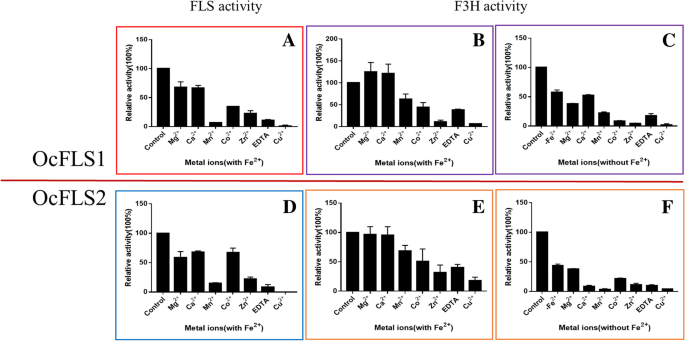
在最适pH和最适温度下,研究了金属离子和螯合剂对两种酶FLS活性的影响。这些金属离子对两种酶的FLS活性有抑制作用(图)。gydF4y2Ba6gydF4y2Ba).这些被测试的金属离子,铜gydF4y2Ba2+gydF4y2Ba展示了两种酶的最有效的抑制作用,两者都接近0(图。gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
金属离子和螯合剂对OcFLS1和OcFLS2活性的影响。gydF4y2Ba一个gydF4y2Ba,gydF4y2BadgydF4y2Ba,金属离子和螯合剂对OcFLS1 FLS活性的影响(gydF4y2Ba一个gydF4y2Ba)及OcFLS2 (gydF4y2BadgydF4y2Ba)在铁的存在下gydF4y2Ba2+gydF4y2Ba.gydF4y2BabgydF4y2Ba,gydF4y2BaegydF4y2Ba,金属离子和螯合剂对OcFLS1 F3H活性的影响(gydF4y2BabgydF4y2Ba)及OcFLS2 (gydF4y2BaegydF4y2Ba)在铁的存在下gydF4y2Ba2+gydF4y2Ba.仅含铁的缓冲液中的酶活性gydF4y2Ba2+gydF4y2Ba设置为100%。gydF4y2BacgydF4y2Ba,gydF4y2BafgydF4y2Ba,金属离子和螯合剂对OcFLS1 F3H活性的影响(gydF4y2BacgydF4y2Ba)及OcFLS2 (gydF4y2BafgydF4y2Ba)在没有铁的情况下gydF4y2Ba2+gydF4y2Ba.没有任何金属离子的缓冲液中的酶活性设定为100%。数据被呈现为三个生物复制的平均值±标准偏差值gydF4y2Ba
OcFLS1和OcFLS2对二氢山奈酚的FLS活性动力学特性(gydF4y2Ba1gydF4y2Ba)在最适pH和温度下进一步测定。明显的gydF4y2BaKgydF4y2Ba米gydF4y2Ba和V.gydF4y2Ba最大限度gydF4y2Badihydrokaempferol (gydF4y2Ba1gydF4y2Ba从Lineweaver-Burk图计算的)总结在表中gydF4y2Ba1gydF4y2Ba.gydF4y2Ba
黄酮类3-羟化酶的活性gydF4y2Ba
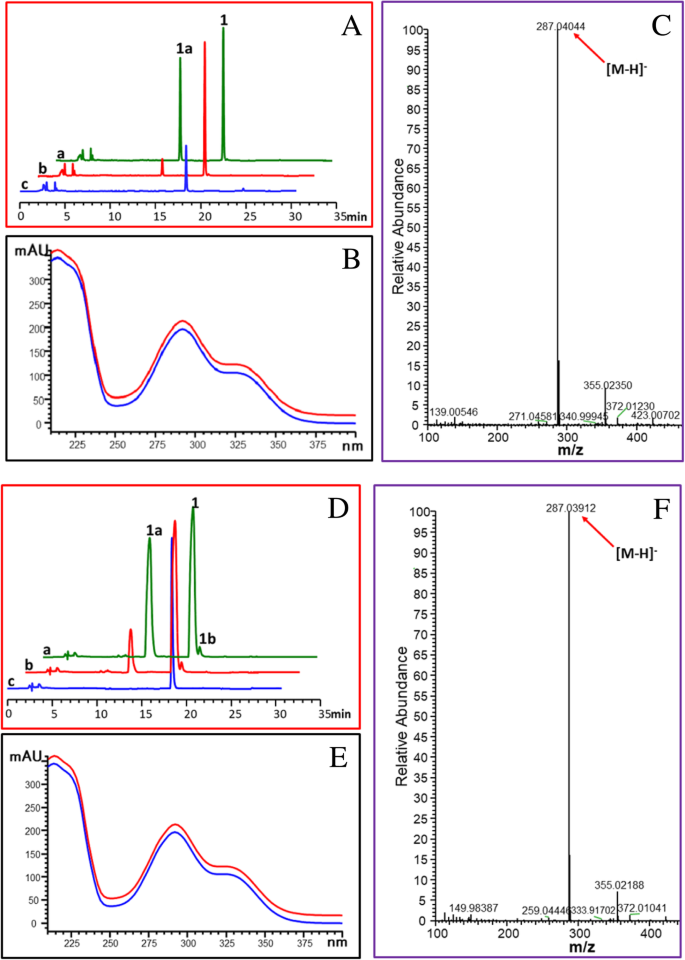
对黄酮合成酶进行证明是双官能二氧化根酸盐,将二氢酚醇转化为黄酮醇或催化黄烷酮的3-羟基化至二氢烷醇[gydF4y2Ba18gydF4y2Ba].因此,还研究了OCFLS1和OCFLS2的黄万酮3-羟化酶活性。(gydF4y2Ba年代gydF4y2Ba)-Naringenin(gydF4y2Ba1gydF4y2Ba)作为代表黄酮与重组OcFLS蛋白反应。如图所示。gydF4y2Ba7gydF4y2Ba,孵育(gydF4y2Ba年代gydF4y2Ba)-Naringenin(gydF4y2Ba1gydF4y2Ba),在反应混合物中检测到一个新的峰。新形成的产物的紫外光谱与二氢山奈酚(gydF4y2Ba1gydF4y2Ba),表明它与二氢山奈酚(gydF4y2Ba1gydF4y2Ba).此外,新形成的化合物显示出[M-H]gydF4y2Ba-gydF4y2Ba巅峰gydF4y2Bam / zgydF4y2Ba287.04044,表明它是一种单羟基化产物(gydF4y2Ba年代gydF4y2Ba)-Naringenin(gydF4y2Ba1gydF4y2Ba).进一步用标准二氢山奈酚(gydF4y2Ba1gydF4y2Ba)确认新生成的化合物为二氢山奈酚(gydF4y2Ba1gydF4y2Ba)(图。gydF4y2Ba7gydF4y2Ba).同样,OCFLS2可以催化(gydF4y2Ba年代gydF4y2Ba)-Naringenin(gydF4y2Ba1gydF4y2Ba)形成二氢山奈酚(gydF4y2Ba1gydF4y2Ba)(图。gydF4y2Ba7gydF4y2Ba).此外,这两种酶被证明可以催化3β羟化gydF4y2Ba年代gydF4y2Ba)-pinocembrin(gydF4y2Ba2gydF4y2Ba),(gydF4y2Ba年代gydF4y2Ba)-eriodictyol(gydF4y2Ba3.gydF4y2Ba)和(gydF4y2Ba年代gydF4y2Ba) -homoeriodictyol (gydF4y2Ba4gydF4y2Ba),从而形成各自的二氢黄酮醇产物pinobanksin (gydF4y2Ba2gydF4y2Ba)(附加文件gydF4y2Ba9gydF4y2Ba:图S9),Dihydroquercetin(gydF4y2Ba3AgydF4y2Ba)(附加文件gydF4y2Ba10gydF4y2Ba:图S10)和3 ' -gydF4y2BaOgydF4y2Ba- 甲基紫外兰(gydF4y2Ba4AgydF4y2Ba)(附加文件gydF4y2Ba11gydF4y2Ba:图S11)分别。这些数据指示OCFLS1和OCFLS2具有F3H活动。gydF4y2Ba
转换(gydF4y2Ba年代gydF4y2Ba)-Naringenin(gydF4y2Ba1gydF4y2Ba)至二氢山奈酚(gydF4y2Ba1gydF4y2Ba)由OCFLS1催化(gydF4y2Ba一个gydF4y2Ba-gydF4y2BacgydF4y2Ba)及OcFLS2 (gydF4y2BadgydF4y2Ba-gydF4y2BafgydF4y2Ba)在铁的存在下gydF4y2Ba2+gydF4y2Ba.gydF4y2Ba一个gydF4y2Ba,gydF4y2BadgydF4y2Ba:HPLC的反应产物的色谱图(gydF4y2Ba年代gydF4y2Ba)-Naringenin(gydF4y2Ba1gydF4y2Ba)与OcFLS1 (gydF4y2Ba一个gydF4y2Ba)及OcFLS2 (gydF4y2BadgydF4y2Ba).gydF4y2Ba一个gydF4y2Ba,用真正的二氢戊酮蛋白共洗脱反应产物(gydF4y2Ba1gydF4y2Ba).gydF4y2BabgydF4y2Ba,(gydF4y2Ba年代gydF4y2Ba)-Naringenin(gydF4y2Ba1gydF4y2Ba)用纯化的蛋白质。gydF4y2BacgydF4y2Ba,(gydF4y2Ba年代gydF4y2Ba)-Naringenin(gydF4y2Ba1gydF4y2Ba)没有纯化的蛋白质。gydF4y2BabgydF4y2Ba,gydF4y2BaegydF4y2Ba:反应产物的紫外光谱gydF4y2Ba1gydF4y2Ba(蓝线)和真正的二氢水石蛋白(红线)。gydF4y2BacgydF4y2Ba,gydF4y2BafgydF4y2Ba:反应产物的质谱图gydF4y2Ba1gydF4y2Ba由OcFLS1制作(gydF4y2BacgydF4y2Ba)及OcFLS2 (gydF4y2BafgydF4y2Ba)gydF4y2Ba
温度对两种酶F3H活性的影响相似。如图所示。gydF4y2Ba4gydF4y2Ba,两个OCFLS都显示出宽的温度耐受性,并在20°C下显示最佳活动。当温度降至4℃时,两种酶的F3H活性仍然高,接近90%。然而,当温度高于20℃时,两种酶的F3H活性显着降低。当温度达到60℃时,两种酶的残留F3H活性小于20%。两种酶在6.0的酸性pH下显示出最佳的F3H活性(图。gydF4y2Ba4gydF4y2Ba),低于来自f3h酶的值低于gydF4y2Ba佩妮矮牵牛gydF4y2Ba[gydF4y2Ba38gydF4y2Ba],gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba39gydF4y2Ba),而gydF4y2Ba青蒿gydF4y2BaL (gydF4y2Ba40gydF4y2Ba].如图所示。gydF4y2Ba4gydF4y2Ba,当pH超过6.0时,OcFLS1和OcFLS2的F3H活性急剧下降。gydF4y2Ba
辅助因子2-氧戊二酸、铁gydF4y2Ba2+gydF4y2Ba, l -抗坏血酸对OcFLSs的F3H活性也进行了研究(图。gydF4y2Ba5gydF4y2Ba).省略2-氧氧杂种酸导致两种OCFL酶的几乎完全丧失活性(图。gydF4y2Ba5gydF4y2Ba- c和- d)。然而,当l -抗坏血酸或铁gydF4y2Ba2+gydF4y2Ba在反应混合物中并不存在,两种蛋白质的F3H活性完全消失,但略微下降,表明L-抗坏血酸或FEgydF4y2Ba2+gydF4y2Ba对OCFLS1和OCFLS2的F3H活动不是绝对必要的(图。gydF4y2Ba5gydF4y2Ba- c和- d)。l -抗坏血酸和铁gydF4y2Ba2+gydF4y2Ba这两种FLS酶的-独立特性与之前报道的单一F3H酶不一致,后者被认为是l -抗坏血酸和FegydF4y2Ba2+gydF4y2Ba端依赖加氧酶(gydF4y2Ba38gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba].gydF4y2Ba
考虑到铁gydF4y2Ba2+gydF4y2BaF3H活性不需要,在有或没有Fe的反应系统中测定金属离子和螯合剂对两种酶F3H活性的影响gydF4y2Ba2+gydF4y2Ba(图。gydF4y2Ba6gydF4y2Ba).当反应混合物含有没有FegydF4y2Ba2+gydF4y2Ba,金属离子和螯合剂的加入导致OcFLS1和OcFLS2的F3H活性降低。当铜gydF4y2Ba2+gydF4y2Ba加入反应混合物中,OCFLS1和OCFLS2的F3H活性几乎完全丢失。或者,在含有铁离子的缓冲液中,金属离子对这两种蛋白质的影响是不同的。当Mn.gydF4y2Ba2+gydF4y2Ba、有限公司gydF4y2Ba2+gydF4y2Ba、锌gydF4y2Ba2+gydF4y2Ba,EDTA-2NA或CUgydF4y2Ba2+gydF4y2Ba被添加到含Fe的缓冲区中gydF4y2Ba2+gydF4y2Ba,OCFLS1和OCFLS2的F3H活性被抑制到不同程度。此外,米格gydF4y2Ba2+gydF4y2Ba和CagydF4y2Ba2+gydF4y2Ba对OCFLS2的F3H活性有轻微的抑制作用。相反,这两个金属离子在Fe存在下显示了对OCFLS1的F3H活性的刺激作用gydF4y2Ba2+gydF4y2Ba(图。gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
的gydF4y2BaKgydF4y2Ba米gydF4y2Ba和V.gydF4y2Ba最大限度gydF4y2BaOcFLS1和OcFLS2的值gydF4y2Ba年代gydF4y2Ba)-Naringenin(gydF4y2Ba1gydF4y2Ba)通过Lineweaver-Burk Plot(表格)计算gydF4y2Ba1gydF4y2Ba).F3h活性的表观迈克莱斯常数低于OCFLS1和OCFLS2的相应值,表明两种黄酮合酶的亲和力(gydF4y2Ba年代gydF4y2Ba)-Naringenin(gydF4y2Ba1gydF4y2Ba)强于二氢山奈酚(gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
菲gydF4y2Ba2+gydF4y2Ba有利于黄烷酮的生物转化转移到黄酮醇gydF4y2Ba
将OCFLS1和OCFLS2证明是双官能酶,将二氢烷醇催化至黄酮醇或进行黄酮转化为二氢烷醇。因此,在OCFLS1或OCFLS2的作用下,可以通过两次连续反应转化黄烷酮至黄酮醇(图。gydF4y2Ba1gydF4y2Ba).然而,在黄兰酮的OCFLS1或OCFLS2催化转化中检测到少量或没有黄酮醇(图。gydF4y2Ba7gydF4y2Ba和额外的文件gydF4y2Ba9gydF4y2Ba:图S9附加文件gydF4y2Ba10gydF4y2Ba:图S10附加文件gydF4y2Ba11gydF4y2Ba:图S11)。如图所示。gydF4y2Ba7gydF4y2Ba, OcFLS1催化(gydF4y2Ba年代gydF4y2Ba)-Naringenin(gydF4y2Ba1gydF4y2Ba)形成二氢山奈酚(gydF4y2Ba1gydF4y2Ba)但没有进一步催化二氢戊酮蛋白(gydF4y2Ba1gydF4y2Ba)产生山奈酚(gydF4y2Ba1 bgydF4y2Ba)(图。gydF4y2Ba7gydF4y2Baa).在含有OcFLS2和(gydF4y2Ba年代gydF4y2Ba)-Naringenin(gydF4y2Ba1gydF4y2Ba),尽管两gydF4y2Ba1gydF4y2Ba和gydF4y2Ba1 bgydF4y2Ba被检测到,产量gydF4y2Ba1 bgydF4y2Ba相对较低(图。gydF4y2Ba7gydF4y2Bad). OcFLS1和OcFLS2对(gydF4y2Ba年代gydF4y2Ba)-Naringenin(gydF4y2Ba1gydF4y2Ba)和其他黄酮的反应表明,OcFLSs不能有效地催化黄酮生成相应的黄酮醇。这种不一致性可能与铁的减少有关gydF4y2Ba2+gydF4y2Ba在反应混合物中。当铁gydF4y2Ba2+gydF4y2Ba被添加到溶液中,它将与空气中的氧气反应形成FegydF4y2Ba3 +gydF4y2Ba,导致铁的减少gydF4y2Ba2+gydF4y2Ba.菲gydF4y2Ba2+gydF4y2Ba对于OCFLS的F3H活动并非绝对需要,以及减少FEgydF4y2Ba2+gydF4y2Ba因此对F3H的活性没有显著影响。因此,一定比例的黄酮被转化为二氢黄酮醇(图。gydF4y2Ba7gydF4y2Ba和额外的文件gydF4y2Ba9gydF4y2Ba:图S9附加文件gydF4y2Ba10gydF4y2Ba:图S10附加文件gydF4y2Ba11gydF4y2Ba:图S11)。相反,铁gydF4y2Ba2+gydF4y2Ba对OcFLSs的FLS活性和FegydF4y2Ba2+gydF4y2Ba从而导致OcFLSs的FLS活性降低,从而导致反应混合物中黄酮醇含量低或无法检测(图)。gydF4y2Ba7gydF4y2Ba和额外的文件gydF4y2Ba9gydF4y2Ba:图S9附加文件gydF4y2Ba10gydF4y2Ba:图S10附加文件gydF4y2Ba11gydF4y2Ba:图S11)。测试这种猜测,OCFLS1和OCFLS2催化的生物转化(gydF4y2Ba年代gydF4y2Ba)-Naringenin(gydF4y2Ba1gydF4y2Ba)检查。在20°C孵育2小时后,在反应混合物中加入5 μl硫酸亚铁(20 mM),然后继续孵育2小时。结果表明,该产品的收率gydF4y2Ba1 bgydF4y2Ba在补充有硫代硫酸铁的反应混合物中,对照显着升高,表明FEgydF4y2Ba2+gydF4y2Ba在ocfls的连续催化中发挥了重要作用(图。gydF4y2Ba8gydF4y2Ba).此外,延长2小时至4小时的反应时间可以增加产量gydF4y2Ba1 bgydF4y2Ba(图。gydF4y2Ba8gydF4y2Ba).gydF4y2Ba
OCFLS1-(gydF4y2Ba一个gydF4y2Ba)和OCFLS2催化的生物转化(gydF4y2BabgydF4y2Ba) (gydF4y2Ba年代gydF4y2Ba)-Naringenin(gydF4y2Ba1gydF4y2Ba)形成二氢山奈酚(gydF4y2Ba1gydF4y2Ba)和kaempferol(gydF4y2Ba1 bgydF4y2Ba).gydF4y2Ba一个gydF4y2Ba,反应4 h,加入硫酸亚铁2 h。gydF4y2BabgydF4y2Ba,反应进行4 h,不添加硫酸亚铁。gydF4y2BacgydF4y2Ba,对反应进行2小时,不加压硫酸亚铁gydF4y2Ba
不同组织中OcFLS1和OcFLS2的表达谱gydF4y2Ba
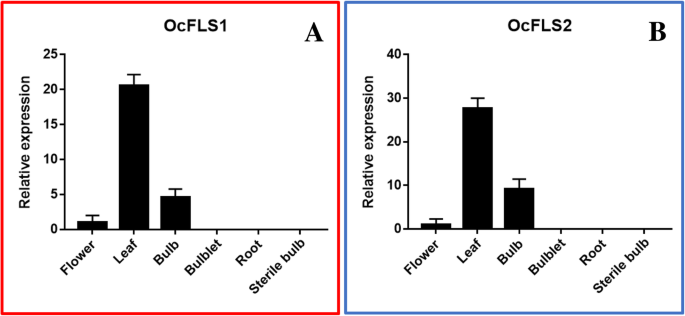
中OcFLS1和OcFLS2的表达谱gydF4y2Bao . caudatumgydF4y2Ba通过QRT-PCR分析研究。如图所示。gydF4y2Ba9gydF4y2Ba, OcFLS1和OcFLS2在叶片、鳞茎和花中表达。OcFLS1和OcFLS2在叶片中表达量最高,鳞茎中表达量次之(图2)。gydF4y2Ba9gydF4y2Ba).OCFLS1和OCFLS2显示了鲜花中最低表达水平。相反,两种蛋白质在根,子片和无菌灯泡中难以表达(图。gydF4y2Ba9gydF4y2Ba).推年是少灯。OCFLS1和OCFLS2的子弹和灯泡中的差异表达水平表明它们的表达被发育调节。无菌鳞茎在无菌和黑暗条件下栽培。在连续的延长培养后,这些无菌灯泡变成了白色灯泡。灯泡和无菌灯泡中的OCFL和OCFLS2的不同表达水平显示,它们的表达受环境条件调节。累积地,通过发育和环境条件调节这两种OCFL基因的表达。gydF4y2Ba
讨论gydF4y2Ba
o . caudatumgydF4y2Ba是一种药用植物[gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba].在该物种中检测到几种活性黄酮醇[gydF4y2Ba32gydF4y2Ba].然而,与黄酮化生物合成相关的酶的开采相对较差。在这项调查中,首先从含有两个成员的霉菌基因家族gydF4y2Bao . caudatumgydF4y2Ba基于转录组挖掘,然后通过体外实验进行功能表征。数据显示,两种黄酮醇合成酶OcFLS1和OcFLS2不仅能催化二氢黄酮醇生成黄酮醇,还能介导黄酮醇氧化生成相应的二氢黄酮醇,这种活性通常与F3H酶有关。黄酮醇合成酶是黄酮醇生物合成的关键控制者。因此,OcFLS1和OcFLS2的成功克隆和功能鉴定将有助于黄酮类醇生物合成途径的解析gydF4y2Bao . caudatumgydF4y2Ba.gydF4y2Ba
此外,需要对OCFLS1和OCFLS2的详细生化分析是为了促进其作为用于工程菌株中黄酮化生物合成的途径重建的基因。黄酮醇是创新药物的重要来源[gydF4y2Ba1gydF4y2Ba].黄酮醇的制备也面临问题,例如繁琐的提取和困难的合成。因此,我们的团队已经致力于合成生物技术合成黄酮酚;也就是说,在微生物中重建黄酮酚生物合成的生物合成途径,例如gydF4y2Ba大肠杆菌gydF4y2Ba和gydF4y2Ba酿酒酵母gydF4y2Ba,通过将与黄酮醇生物合成相关的基因导入这些菌株。这些途径酶在用作途径重建的遗传元件之前需要详细描述。尽管生物信息学工具可以快速预测基因功能,但这种预测并不特别准确。Owens等人鉴定了5个与黄酮醇合酶高度相似的候选基因。然而,只有一个fls样基因被证明可以编码催化活性蛋白[gydF4y2Ba47gydF4y2Ba].这些数据表明,黄酮醇合酶的确切活性需要进行详细的生化研究。因此,我们对OcFLS1和OcFLS2进行了功能鉴定。显然,这些数据加深了我们对黄酮醇合成酶的认识,为这两个黄酮醇合成酶基因在合成生物学中的应用奠定了坚实的基础。gydF4y2Ba
黄酮醇合酶是一种双功能双加氧酶,同时具有f3h样和FLS活性[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba48gydF4y2Ba].这种双功能使黄酮合成酶更广泛地用于合成生物学。在工程细胞的建设中,只有一个gydF4y2BaFLS的gydF4y2Ba需要基因来实现从黄烷酮转化为黄酮醇,而不引入两者gydF4y2BaF3h.gydF4y2Ba和gydF4y2BaFLS的gydF4y2Ba基因。外源基因导入较少,微生物代谢负担较低,有利于工程菌株的生长。因此,有必要对FLS的这两种活动进行深入的研究。然而,自从首次发现双功能黄酮醇合酶[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba48gydF4y2Ba],对黄酮醇合成酶的双官能活性进行了综合性研究。在此,我们对OCFLS1和OCFLS2的F3H样和杂种活性进行了彻底的研究,并发现了一些有趣的结果。首先,观察到OCFLS1和OCFLS2的F3H样和杂志的活动,以差异为FEgydF4y2Ba2+gydF4y2Ba.之前的报道表明,黄酮醇合成酶是一种FEgydF4y2Ba2+gydF4y2Ba端依赖加双氧酶(gydF4y2Ba18gydF4y2Ba,gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba].事实上,黄酮醇合酶需要铁gydF4y2Ba2+gydF4y2Ba只有当它执行FLS活动时,而不是当它执行f3h类活动时。此外,我们还揭示了充分的铁gydF4y2Ba2+gydF4y2Ba是黄酮合成黄酮醇的连续催化反应所必需的。这一结果表明,维持足够的铁是必要的gydF4y2Ba2+gydF4y2Ba在构建工程细胞工厂时,在工程细胞中转化黄黄酮的转化。gydF4y2Ba
此外,本研究还考察了金属离子和EDTA-2Na对OcFLS1和OcFLS2酶活性的影响(图)。gydF4y2Ba6gydF4y2Ba).如图所示。gydF4y2Ba6gydF4y2Ba-c和-f,当其他金属离子加入到不含铁的混合物中gydF4y2Ba2+gydF4y2Ba,OCFLS1和OCFLS2的F3H活性降低。这可能是由在反应混合物中具有类黄酮(0.5mm)的这些金属离子(1mm)的络合引起的,其改变了类黄酮的结构并防止基材进入酶的反应中心。当向反应混合物中加入EDTA-2NA时,反应混合物的pH值降低,从而导致F3H活性的下降(图。gydF4y2Ba6gydF4y2Ba- c和- f)。如果菲gydF4y2Ba2+gydF4y2Ba将这些金属离子或EDTA-2Na加入反应混合物中,亚铁可与酶结合,作为共同的辅助因子提高OcFLSs的活性。因此,在含铁的反应溶液中酶的活性gydF4y2Ba2+gydF4y2Ba比不含FegydF4y2Ba2+gydF4y2Ba,尽管整体活性仍然受到抑制(图。gydF4y2Ba6gydF4y2Ba-b和-e)。另外,因为EDTA-2NA可以螯合FEgydF4y2Ba2+gydF4y2Ba,用Fe引入EDTA-2NA进入反应溶液中gydF4y2Ba2+gydF4y2Ba可能导致F3H活动的减少。同样地,将其他金属离子和EDTA-2NA加入到含有Fe的反应溶液中gydF4y2Ba2+gydF4y2Ba也导致两种酶的FLS活性降低(图。gydF4y2Ba6gydF4y2Ba-a和-d)。gydF4y2Ba
结论gydF4y2Ba
OcFLS1和OcFLS2分离自gydF4y2Bao . caudatumgydF4y2Ba基于转录组的开采并证明是双官能黄酮合成酶,将二氢烷醇转化为黄酮或黄烷酮的3-羟基化催化至二氢烷醇。与先前报道的单一F3H酶不同,其被视为L-抗坏血酸和FegydF4y2Ba2+gydF4y2Ba-依赖双加氧酶,OcFLS1和OcFLS2分别为l -抗坏血酸和铁gydF4y2Ba2+gydF4y2Ba独立。此外,充足的铁gydF4y2Ba2+gydF4y2Ba确定了从黄酮中连续催化黄酮醇的必要条件。qRT-PCR分析表明,它们的表达受发育和环境条件的调控。gydF4y2Ba
方法gydF4y2Ba
化学物质gydF4y2Ba
在附加文件中列出的基板gydF4y2Ba8gydF4y2Ba:图S8购自中国昆明BioBioPha Co. Ltd.和中国成都Push Bio-Technology。四黄烷酮基板gydF4y2Ba1gydF4y2Ba- - - - - -gydF4y2Ba4gydF4y2Ba是(2gydF4y2Ba年代gydF4y2Ba)对映体。其他化学物质在可用时为试剂级或分析级。gydF4y2Ba
FLS编码ungenes的转录组挖掘gydF4y2Ba
转录组测序gydF4y2Bao . caudatumgydF4y2Ba是在我们实验室进行的[gydF4y2Ba46gydF4y2Ba].Blast X将得到的unigenes与nr、Swiss-Prot、KEGG、COG等蛋白数据库进行比对,检索到与黄酮醇合酶序列相似性最高的unigene编码蛋白。gydF4y2Ba
全长液体CDNA分离和序列生物信息分析gydF4y2Ba
整个植物gydF4y2Bao . caudatumgydF4y2Ba在我们实验室的盆中栽培。总RNA的提取和纯化gydF4y2Bao . caudatumgydF4y2Ba随后的cDNA合成常规进行[gydF4y2Ba43gydF4y2Ba].以获得的cDNA为模板,利用ungene特异性引物分离FLS编码序列(附加文件)gydF4y2Ba12gydF4y2Ba:表S1) [gydF4y2Ba45gydF4y2Ba].放大的开放阅读框(ORF)序列gydF4y2BaOCFLgydF4y2Ba将基因插入到Peasy-Blunt(Transgen Co. Ltd.,北京),以创建用于测序的重组构建体(附加文件gydF4y2Ba12gydF4y2Ba:表S2)。获得的gydF4y2BaOCFLgydF4y2Ba使用在线生物信息工具(如前所述)分析序列[gydF4y2Ba50.gydF4y2Ba].gydF4y2Ba
异种表达及蛋白纯化gydF4y2Ba
全长ORFgydF4y2BaOCFLgydF4y2Ba从它们相应的植物钝的衍生质粒中扩增基因,然后插入gydF4y2Ba生态gydF4y2Ba我和gydF4y2Ba后gydF4y2BaIII位点pET-28a (+) (Novagen, Madison, USA)根据制造商说明使用克隆express II试剂盒(Vazyme, Nanjing, China)。结果pET28a-OcFLS2转化为gydF4y2Ba大肠杆菌转化gydF4y2Baetta (DE3) (TransGen Co. Ltd, Beijing, China)进行重组表达。另一个质粒pET28a-OcFLS1共转化gydF4y2Ba大肠杆菌gydF4y2BaBL21(DE3)菌株与伴侣质粒pgro7(大连大连,中国大连生物科技有限公司),以改善以前报道的可溶性表达[gydF4y2Ba42gydF4y2Ba,gydF4y2Ba51.gydF4y2Ba].将重组细胞培养至600 nm (OD)光密度gydF4y2Ba600gydF4y2Ba)达到0.6,并在20°C下加入异丙基- d -硫代半乳糖苷(IPTG)过夜诱导至终浓度为0.3 mM。的可溶表达式gydF4y2BaOCFLgydF4y2Ba基因在gydF4y2Ba大肠杆菌gydF4y2Ba经十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)验证。接下来,如前所述,对细菌产生的OcFLS蛋白进行纯化和定量[gydF4y2Ba52.gydF4y2Ba,gydF4y2Ba53.gydF4y2Ba].gydF4y2Ba
ocfls活性测定gydF4y2Ba
酶促反应在含有α-酮戊二酸(1 mM)、硫酸亚铁(0.5 mM)、抗坏血酸(1 mM)、纯化蛋白(1 μl)和底物(0.5 mM)的PBS缓冲液(20 mM, pH 6.0)中进行,总体积为200 μl。20℃孵育2 h,加入甲醇(100 μl)和乙酸(10 μl)停止孵育。混合均匀,12000 rpm离心10 min分离溶剂层。所得溶剂经0.22 μm膜过滤。采用高效液相色谱(HPLC)、液相色谱-高分辨质谱(LC-HRMS)对50 μl溶剂进行分析。gydF4y2Ba
HPLC和LC-MS分析gydF4y2Ba
采用Agilent 1200高效液相色谱(Agilent Technologies Co. Ltd, CA, USA),采用SilGreen-C18色谱柱(粒径5 μm, 4.6 × 250 mm;北京绿草科技发展有限公司,北京)。HPLC条件概述在附加文件中gydF4y2Ba12gydF4y2Ba:表S3。gydF4y2Ba
使用由Orbitrap Mass Spector(Active,Thermofisher Scientific,Inc.,Bremen,Bermany)组成的LC-MS系统进行LC-MS分析,与U-HPLC系统(Accela,Thermofisher Scientific,Inc。,德国不来梅).壁图-Sms配有一个以负离子模式操作的集成电喷雾电离(ESI)源。使用全MS扫描模式获取所有数据范围gydF4y2Bam / zgydF4y2Ba100年到1000年。gydF4y2Ba
酶学性质测定gydF4y2Ba
在4℃、20℃、30℃、37℃、42℃、50℃、60℃条件下PBS缓冲液(pH 6.0)中研究酶活性的最优温度为2 h。在20°C条件下,用HAc-NaAc缓冲液(pH 4.0-6.0)、PBS缓冲液(pH 6.0-9.0)和Na检测酶活性对pH的依赖性gydF4y2Ba2gydF4y2Ba有限公司gydF4y2Ba3.gydF4y2Ba-NaHCOgydF4y2Ba3.gydF4y2Ba(ph 9.0-11.0)2小时。辅因子(α-酮戊酸,硫酸亚铁和抗坏血酸)和金属离子的影响(EDTA-2NA,MNClgydF4y2Ba2gydF4y2Ba, MgClgydF4y2Ba2gydF4y2Ba, CaClgydF4y2Ba2gydF4y2Ba,Cocl.gydF4y2Ba2gydF4y2Ba, ZnClgydF4y2Ba2gydF4y2Ba, CuClgydF4y2Ba2gydF4y2Ba)在20°C的PBS缓冲液(pH 6.0)中检测2 h。每个金属离子的最终浓度是1mm。测量一式三份。gydF4y2Ba
采用8种不同浓度(20 mM、10 mM、5 mM、2.5 mM、1.25 mM、0.625 mM、0.312 mM和0.156 mM)的基质,在最优pH和温度下测试其动力学特性。表观动力学参数(gydF4y2BaKgydF4y2Ba米gydF4y2Ba和V.gydF4y2Ba最大限度gydF4y2Ba)由米凯利斯-曼登方程推导的Lineweaver-Burk图确定。gydF4y2Ba
存在分析gydF4y2Ba
采用定量逆转录-聚合酶链反应(qRT-PCR)分析OcFLS1和OcFLS2在根、鳞茎、叶、花、不育鳞茎和小鳞茎等不同组织中的表达谱[gydF4y2Ba44gydF4y2Ba,gydF4y2Ba50.gydF4y2Ba].使用甘油醛-3-磷酸脱氢酶(GAPDH2,GenBank登录号KM370884)作为内部参考基因。基因特异性引物列于附加文件中gydF4y2Ba12gydF4y2BaS1:表。具体程序与前文所述相同[gydF4y2Ba42gydF4y2Ba,gydF4y2Ba44gydF4y2Ba,gydF4y2Ba50.gydF4y2Ba].使用2计算OCFL表达的相对定量gydF4y2Ba——ΔΔCtgydF4y2Ba方法。gydF4y2Ba
缩写gydF4y2Ba
- 2-ODD:gydF4y2Ba
-
2-oxoglutarate-dependent加双氧酶gydF4y2Ba
- aa:gydF4y2Ba
-
氨基酸gydF4y2Ba
- ANS:gydF4y2Ba
-
花青素合成酶gydF4y2Ba
- DFR:gydF4y2Ba
-
Dihydroflavonol 4-reductasegydF4y2Ba
- F3H:gydF4y2Ba
-
黄烷酮3-羟化酶gydF4y2Ba
- 读者:gydF4y2Ba
-
黄酮醇合成酶gydF4y2Ba
- 投资策略基金会:gydF4y2Ba
-
黄酮合成酶I.gydF4y2Ba
- GAPDH:gydF4y2Ba
-
Glyceraldehyde-3-phosphate脱氢酶gydF4y2Ba
- HPLC:gydF4y2Ba
-
高效液相色谱法gydF4y2Ba
- IPTG:gydF4y2Ba
-
异丙基β-D-thiogalactosidegydF4y2Ba
- LC-HRMS:gydF4y2Ba
-
液相色谱-高分辨质谱gydF4y2Ba
- 子:gydF4y2Ba
-
开放阅读框架gydF4y2Ba
- PI:gydF4y2Ba
-
等电点gydF4y2Ba
- QRT-PCR:gydF4y2Ba
-
定量逆转录 - 聚合酶链反应gydF4y2Ba
- sds - page:gydF4y2Ba
-
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳gydF4y2Ba
- UTR:gydF4y2Ba
-
翻译区gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
黄酮醇与心血管疾病。中华医学杂志。2010;31(6):478-94。gydF4y2Ba
- 2.gydF4y2Ba
Hopia A,Heinonen M.黄酮醇糖苷酮和它们在甲基Limolate中的糖苷的抗氧化活性。J AM Oil Chem SoC。1999; 76(1):139-44。gydF4y2Ba
- 3.gydF4y2Ba
Hichri F,Salah NB,Omri A,Hossan Asm,Jannet HB。来自突尼斯的新的抗氧化C-糖基黄酮和黄酮酚衍生物gydF4y2Ba阿喀琉斯acreticagydF4y2Ba中国生物医学工程学报。2018;116:1-5。gydF4y2Ba
- 4.gydF4y2Ba
Corsino J, Silva DHS, Zanoni MVB, Bolzani VDS, França SC, Pereira AMS, Furlan M.抗氧化剂黄酮-3-醇和黄酮醇苷gydF4y2BaMaytenus aquifolium.gydF4y2Ba.Phytother杂志2003;17(8):913 - 6。gydF4y2Ba
- 5。gydF4y2Ba
JiménezM,García-carmona f.yyricetin,抗氧化黄酮醇,是多酚氧化酶的基材。j sci食物agr。1999年; 79(14):1993-2000。gydF4y2Ba
- 6。gydF4y2Ba
Marzouk Ms,Moharram Fa,Haggag eg,易卜拉欣MT,巴拉德OA。抗氧化黄酮醇糖苷来自gydF4y2BaSchinus molle是的gydF4y2Ba.Phytother杂志2006;20(3):200 - 5。gydF4y2Ba
- 7。gydF4y2Ba
Britton Rg,Horner-Glister E,Pomenya Oa,Smith Ee,Denton R,Jenkins Pr等。新型黄酮类作为潜在抗前列腺癌药物的合成及生物学评价。EUR J Med Chem。2012年; 54:952-8。gydF4y2Ba
- 8。gydF4y2Ba
DiaS TA,Duarte Cl,Lima Cf,ProençaMF,Pereira-Wilson C.卤代杀菌剂和黄酮醇的优越抗癌活性在天然黄酮醇槲皮素上。EUR J Med Chem。2013; 65:500-10。gydF4y2Ba
- 9。gydF4y2Ba
李胜,董鹏,王军,张军,顾军,吴旭,等。淫羊藿苷是一种天然黄酮醇苷,通过ROS/ jnk依赖的线粒体途径诱导人肝癌SMMC-7721细胞凋亡。癌症。2010;298(2):222 - 30。gydF4y2Ba
- 10.gydF4y2Ba
麦片S,Czerwińskame,żyżyńska-granica b,Kiss AK。抗氧化剂和抗炎黄酮葡萄糖醇来自gydF4y2Ba蓼属植物avicularegydF4y2BaL. Fitoterapia。2013; 91:180-8。gydF4y2Ba
- 11.gydF4y2Ba
Ortega YH, Foubert K, Berghe WV, Chirumamilla CS, Pieters L, Mosquera DMG, Apers sgydF4y2BaBoldoa Purpurascens.gydF4y2Ba以及它们的消炎特性。Phytochem。2017;19:71-6。gydF4y2Ba
- 12.gydF4y2Ba
Tahiri O, Atmani-Kilani D, Sanchez-Fidalgo S, Aparicio-Soto M, Alarcón-de-la-Lastra C, Barrajón-Catalán E,等。的flavonol-enrichedgydF4y2BaCistus alphidus.gydF4y2Ba氯仿提取物具有体内抗炎和抗伤害活性。J属植物。2017; 209:210-8。gydF4y2Ba
- 13.gydF4y2Ba
李艳,丁颖。杨梅素对糖尿病的治疗潜力综述。食品科学。2012;1(1):19-25。gydF4y2Ba
- 14.gydF4y2Ba
金属黄酮醇复合物锌-桑色素的设计、合成、表征及其对HFD-STZ诱导的大鼠2型糖尿病的抗糖尿病作用。Chem Biol Interact. 2014; 19:9 - 17。gydF4y2Ba
- 15.gydF4y2Ba
Şöhretoğlu D, Sari S, Barut B, Özel A.发现有效α-葡萄糖苷酶抑制剂黄酮醇:通过抑制动力学和对接模拟了解作用机制。Bioorg化学。2018;79:257 - 64。gydF4y2Ba
- 16。gydF4y2Ba
Preußa,stracke r,Weisshaar B,Hillebrecht A,Matern U,Martens S.gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba表达第二个功能性黄酮合酶。费用。2009; 583(12):1981-6。gydF4y2Ba
- 17。gydF4y2Ba
Nakatsuka T,Abe Y,Kakizaki Y,Yamamura S,Nishihara M.通过多种类黄酮生物合成基因的基因工程生产红花植物。植物细胞代表2007; 26(11):1951-9。gydF4y2Ba
- 18。gydF4y2Ba
Lukačinr,Wellmann F,Britsch L,Martens S,Matern U.Flavonol合成酶gydF4y2Ba柑橘unshiu.gydF4y2Ba是双官能的二恶英酶。植物化学。2003; 62(3):287-92。gydF4y2Ba
- 19。gydF4y2Ba
Holton Ta,Brugliera F,Tanaka Y. Flavonol合成酶的克隆和表达gydF4y2Ba佩妮矮牵牛gydF4y2Ba.植物j . 1993; 4(6): 1003 - 10。gydF4y2Ba
- 20.gydF4y2Ba
王志强,王志强,王志强,等。西芹细胞培养物中黄酮转化为黄酮、二氢黄酮醇和黄酮醇的研究进展。中国科学(d辑:地球科学)1981;36(10):742-50。gydF4y2Ba
- 21。gydF4y2Ba
刘柳,萧Z,风扇C,江N,萌X,Xiang X.克隆合成酶基因的克隆与鉴定gydF4y2Ba荔枝中华人员gydF4y2Ba荔枝品种不同水果成熟时期的变异。前植物SCI。2018; 9:567。gydF4y2Ba
- 22。gydF4y2Ba
Akita Y,Kitamura S,Mikami R,Ishizaka H.识别功能gydF4y2Ba黄酮醇合成酶gydF4y2Ba野生香仙客来(gydF4y2Ba仙客来purpurascensgydF4y2Ba).植物生物化学学报,2018;27(2):147-55。gydF4y2Ba
- 23。gydF4y2Ba
Kallscheuer N,Vogt M,Bott M,Marienhagen J.植物衍生的功能表达gydF4y2BaOgydF4y2Ba- 甲基转移酶,黄烷酮3-羟化酶和黄酮合成酶gydF4y2BaCoryneBacterium谷氨酰胺gydF4y2Ba用于生产pterostilbene,Kaempferol和槲皮素。j biotechnol。2017; 258:190-6。gydF4y2Ba
- 24。gydF4y2Ba
Park SR, paijh, Ahn MS, Park JW, Yoon YJ。植物特异性黄酮和黄酮醇的生物合成gydF4y2BaStreptomyces委内瑞拉gydF4y2Ba.中华微生物学杂志。2010;20(9):1295-9。gydF4y2Ba
- 25.gydF4y2Ba
杨思敏,韩胜,金BG,安JH。山奈酚3-的生产gydF4y2BaOgydF4y2Ba从葡萄糖使用工程化--RhamnosidegydF4y2Ba大肠杆菌gydF4y2Ba.中华微生物学杂志。2014;41(8):1311-8。gydF4y2Ba
- 26.gydF4y2Ba
Kim BG, Joe EJ, Ahn JH。杨树黄酮醇合成酶的分子特征及其在3-gydF4y2BaOgydF4y2Ba-methylkaempferol。Biotechnol。2010;32(4):579 - 84。gydF4y2Ba
- 27.gydF4y2Ba
Miyahisa I,Funa N,Ohnishi Y,Martens S,Moriguchi T,Horinouchi S.Flavones和Flavonols的组合生物合成gydF4y2Ba大肠杆菌gydF4y2Ba.苹果microbiol biot。2006; 71(1):53-8。gydF4y2Ba
- 28.gydF4y2Ba
1 .黄酮类化合物羟化酶的表达及其在植物体内的功能gydF4y2Ba大肠杆菌gydF4y2Ba.Metab Eng。2006; 8(2):172-81。gydF4y2Ba
- 29.gydF4y2Ba
等。发酵生产黄酮类化合物的酵母代谢工程。Bioresour抛光工艺。2017;245:1645-54。gydF4y2Ba
- 30.gydF4y2Ba
段L,丁W,刘X,程X,Cai J,Hua E,江H.生物合成和Kaempferol的生物合成和工程gydF4y2Ba酿酒酵母gydF4y2Ba.微b细胞工厂。2017;16(1):165。gydF4y2Ba
- 31。gydF4y2Ba
Trantas E,Panopoulos N,Ververidis F.完整途径的代谢工程,导致各种类黄酮和斯蒂屈剂的异源生物合成gydF4y2Ba酿酒酵母gydF4y2Ba.金属底座Eng。2009;11(6):355 - 66。gydF4y2Ba
- 32。gydF4y2Ba
唐一平,余波,胡杰,吴涛,惠永忠。植物鳞茎的化学成分gydF4y2Baornithogalum caudatum.gydF4y2Ba.j chin pharmaceut sci。2001; 10(4):169-72。gydF4y2Ba
- 33.gydF4y2Ba
杜兴中,王少英,张圣,朱福华。黄酮醇合酶的分子克隆与鉴定gydF4y2Ba金合欢组合gydF4y2Ba.树遗传学基因组织。2013; 9(1):85-92。gydF4y2Ba
- 34.gydF4y2Ba
李c,白y,li s,陈h,汉x,zhao h等。黄酮合成酶基因的克隆,表征和活性分析gydF4y2BaFtFLS1gydF4y2Ba及其与苦荞麦类黄酮含量的关系。食品化学。2012;60(20):5161-8。gydF4y2Ba
- 35.gydF4y2Ba
孙泽勋,侯淑英,杨卫东,韩永华。外源水杨酸增加了芦丁的积累,影响了芦丁生物合成相关基因的表达模式gydF4y2BaFagopyrum Tartaricum Gaertn.gydF4y2Ba树叶。植物生长调节。2012; 68(1):9-15。gydF4y2Ba
- 36.gydF4y2Ba
Gebhardt Y,Witte S,Forkmann G,Lukacin R,Matern U,Martens S. Flavonoid DiOxygenase在家庭Apiaceae中的分子演变。植物化学。2005; 66(11):1273-84。gydF4y2Ba
- 37.gydF4y2Ba
Martens S,Forkmann G,Britsch L,Wellmann F,Matern U,LukačinR.在欧芹中的黄酮类化合物2-氧缺乏症依赖性二恶英酶的发散演变。费用。2003; 544(1-3):93-8。gydF4y2Ba
- 38.gydF4y2Ba
Britsch L,Grisebach H.纯化和表征(2gydF4y2Ba年代gydF4y2Ba)黄烷酮3-hydroxylase从gydF4y2Ba佩妮矮牵牛gydF4y2Ba.acta Biochem. sinica(生物医学工程学报),1986;6(3):569-77。gydF4y2Ba
- 39.gydF4y2Ba
欧文斯DK,Crosby Kc,Runac J,Howard Ba,Winkel BSJ。生物化学和遗传表征gydF4y2Ba拟南芥gydF4y2Ba黄烷酮3β羟化酶。植物生理学报。2008;46(10):833-43。gydF4y2Ba
- 40.gydF4y2Ba
熊胜,田楠,龙军,陈勇,秦勇,冯军,等。黄酮类3-羟化酶基因的克隆与鉴定gydF4y2Ba青蒿gydF4y2Baacta botanica yunnanica(云南植物研究),2016;gydF4y2Ba
- 41.gydF4y2Ba
Kim JH,Lee Yj,Kim Bg,Lim Y,Ahn J.Flavanone3β-羟基酶3β-羟基酶,用于小玉米醇和花青素生物合成。mol细胞。2008; 25(2):312。gydF4y2Ba
- 42.gydF4y2Ba
尹松,孙玉军,刘敏,李丽娜,孔建强。UDP-d-glucuronic acid 4-epimerase家族的cDNA分离及功能鉴定gydF4y2Baornithogalum caudatum.gydF4y2Ba.分子。2016;(11):1505。gydF4y2Ba
- 43.gydF4y2Ba
尹松,刘敏,孔建强。crhs1和OcUER1参与鼠李糖合成的功能分析gydF4y2Baornithogalum caudatum.gydF4y2Ba.植物理性生物生物。2016; 109:536-48。gydF4y2Ba
- 44.gydF4y2Ba
尹胜,孔建强。参与抗肿瘤多糖生物合成的两个udp -糖4-epimerase家族的转录组引导发现和功能表征gydF4y2Baornithogalum caudatum.gydF4y2Ba.RSC放置2016;6(44):37370 - 84。gydF4y2Ba
- 45。gydF4y2Ba
尹胜,孔建强。来自美国的udp -木糖合酶和udp -d- apose / udp -d-木糖合酶家族的转录组引导基因分离和功能鉴定gydF4y2Baornithogalum caudatum.gydF4y2Ba河中的小岛。植物学报2016;35(11):2403-21。gydF4y2Ba
- 46。gydF4y2Ba
郭玲,陈旭,李丽娜,唐伟,潘玉涛,孔建强。相关酶的转录组发现和功能表征(2gydF4y2Ba年代gydF4y2Ba)松属素生物合成gydF4y2Baornithogalum caudatum.gydF4y2Ba及其在代谢工程中的应用。微b细胞工厂。2016;15(1):27。gydF4y2Ba
- 47。gydF4y2Ba
Owens DK, Alerding AB, Crosby KC, Bandara AB, Westwood JH, Winkel BSJ。拟南芥黄酮醇合酶基因家族的功能分析。植物杂志。2008;147(3):1046 - 61。gydF4y2Ba
- 48。gydF4y2Ba
Prescott AG, Stamford NPJ, Wheeler G, Firmin JL。重组黄酮醇合酶的体外性质gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba.植物化学。2002; 60(6):589-93。gydF4y2Ba
- 49.gydF4y2Ba
Martens S,Preußa,母乳U.多功能类黄酮类二氧化酶:黄酮醇和花青素生物合成gydF4y2Ba拟南芥蒂利亚纳gydF4y2BaL. Phytochemistry。2010; 71(10):1040-9。gydF4y2Ba
- 50。gydF4y2Ba
李琳,孔建强。蔗糖合酶基因的转录组范围鉴定gydF4y2Baornithogalum caudatum.gydF4y2Ba.rsc adv。2016; 6(23):18778-92。gydF4y2Ba
- 51。gydF4y2Ba
刘M,孔杰克。酰胺化甾体糖苷的酶生物合成及其细胞毒性活性。Acta Pharm Sin B. 2018; 8(6):981-94。gydF4y2Ba
- 52。gydF4y2Ba
袁氏,刘米,杨烨,何杰米,王烨,孔杰。具有糖苷酶活性的Aurone糖基转移酶的转录物覆盖gydF4y2BaOrnithogalum saundersiaegydF4y2Ba.基因。2018;9(7):327。gydF4y2Ba
- 53。gydF4y2Ba
刘米,李兰,潘伊特,孔杰克。角鲨烯合酶基因的cDNA分离和功能表征gydF4y2Baornithogalum caudatum.gydF4y2Ba.蛋白质表达脲。2017; 130:63-72。gydF4y2Ba
确认gydF4y2Ba
我们感谢编辑和审稿人为提高文章质量提出的建设性意见和意见。gydF4y2Ba
资金gydF4y2Ba
国家重大创新药物项目(no . 2018ZX09711001-006);中国医学科学院医学创新基金项目(no . 2016-I2M-3-012);北京市自然科学基金项目(no . 7172143)。资助人没有参与实验设计、数据收集和分析或手稿的准备。gydF4y2Ba
可用性数据和材料gydF4y2Ba
本研究产生的数据和资料包括在本文及其补充信息文件中。编码黄酮醇合成酶的基因存在于GenBank的MH748569 (OcFLS1)和MH748570 (OcFLS2)标识下。gydF4y2Ba
作者信息gydF4y2Ba
隶属关系gydF4y2Ba
贡献gydF4y2Ba
YJS进行了实验工作。JMH分析数据。JQK设计研究,分析数据,撰写手稿。所有作者阅读并批准了最终的手稿。gydF4y2Ba
通讯作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版物gydF4y2Ba
不适用。gydF4y2Ba
利益争夺gydF4y2Ba
提交人声明他们没有竞争利益。gydF4y2Ba
出版商的注意事项gydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。gydF4y2Ba
附加文件gydF4y2Ba
额外的文件1:gydF4y2Ba
图S1。gydF4y2Baunigenes的示意图,显示与vs基因的序列同一性。(Doc 143 KB)gydF4y2Ba
附加文件2:gydF4y2Ba
图S2。gydF4y2BaOcFLS cdna的巢式pcr扩增。Lane 1, OcFLS1 (A)或OcFLS2 (B)的PCR产物;M巷,DNA分子标记显示左侧bp。(医生296 kb)gydF4y2Ba
附加文件3:gydF4y2Ba
图S3。gydF4y2Ba氨基酸序列对准OCFLS1和OCFLS2与其他FLS蛋白。推定的亚铁(HXDX53H)和2-氧杂机结合基序(RXS)分别标有红色和蓝色五角星。(DOC 2483 KB)gydF4y2Ba
附加文件4:gydF4y2Ba
图S4。gydF4y2BaOcFLS1和OcFLS2与其他2-ODD蛋白的系统进化树分析。利用MEGA5.1程序中的邻居连接方法构建系统发育树。这些数字表示引导值(10,000次重复)。(医生188 kb)gydF4y2Ba
附加文件5:gydF4y2Ba
图S5。gydF4y2Ba从Pinobanksin转换(gydF4y2Ba2gydF4y2Ba)及高良姜(gydF4y2Ba2 bgydF4y2Ba),由OcFLS1 (A-C)或OcFLS2 (D-F)催化。A, D:皮诺桔黄素反应产物的HPLC图谱(gydF4y2Ba2gydF4y2Ba)用OCFLS1(A)或OCFLS2(D)。A,Pinobanksin的反应产物(gydF4y2Ba2gydF4y2Ba)。B,Pinobanksin的反应产物(gydF4y2Ba2gydF4y2Ba)没有纯化的蛋白质。B,E:反应产物的紫外线谱gydF4y2Ba2 bgydF4y2Ba.C、F:反应产物的质谱gydF4y2Ba2 bgydF4y2Ba.(医生118 kb)gydF4y2Ba
附加文件6:gydF4y2Ba
图S6。gydF4y2Ba二氢槲皮素(gydF4y2Ba3AgydF4y2Ba)到槲皮素(gydF4y2Ba3B.gydF4y2Ba),由OcFLS1 (A-C)或OcFLS2 (D-F)催化。A,D:二氢槲皮素反应产物的HPLC色谱图(gydF4y2Ba3AgydF4y2Ba)与OcFLS1 (A)或OcFLS2 (D)反应。A为二氢槲皮素(gydF4y2Ba3AgydF4y2Ba)。B、二氢槲皮素(gydF4y2Ba3AgydF4y2Ba)没有纯化的蛋白质。B,E:反应产物的紫外线谱gydF4y2Ba3B.gydF4y2Ba.C、F:反应产物的质谱gydF4y2Ba3B.gydF4y2Ba.(医生133 kb)gydF4y2Ba
附加文件7:gydF4y2Ba
图S7。gydF4y2Ba从Taxifolin 3'-甲醚的转化率(gydF4y2Ba4AgydF4y2Ba)转化为异鼠李素(gydF4y2Ba4B.gydF4y2Ba),由OcFLS1 (A-C)或OcFLS2 (D-F)催化。A,D:Taxifolin 3'-甲醚的反应产物的HPLC色谱图(gydF4y2Ba4AgydF4y2Ba)与OcFLS1 (A)或OcFLS2 (D)的反应产物。A为taxifolin 3’-甲基醚(gydF4y2Ba4AgydF4y2Ba)。B、杉木素3 ' -甲基醚的反应产物(gydF4y2Ba4AgydF4y2Ba)没有纯化的蛋白质.b,E:反应产物的紫外线gydF4y2Ba4B.gydF4y2Ba.C、F:反应产物的质谱gydF4y2Ba4B.gydF4y2Ba.(Doc 124 KB)gydF4y2Ba
附加文件8:gydF4y2Ba
图S8。gydF4y2Ba本研究中使用的化合物。(Doc 94 KB)gydF4y2Ba
附加文件9:gydF4y2Ba
图S9。gydF4y2Ba转换(gydF4y2Ba年代gydF4y2Ba)-pinocembrin(gydF4y2Ba2gydF4y2Ba)到银行(gydF4y2Ba2gydF4y2Ba),由OcFLS1 (A-C)或OcFLS2 (D-F)催化。A,D:反应产物的HPLC色谱图(gydF4y2Ba年代gydF4y2Ba)-pinocembrin(gydF4y2Ba2gydF4y2Ba)与OcFLS1 (A)或OcFLS2 (D)的反应产物gydF4y2Ba年代gydF4y2Ba)-pinocembrin(gydF4y2Ba2gydF4y2Ba)。B,(gydF4y2Ba年代gydF4y2Ba)-pinocembrin(gydF4y2Ba2gydF4y2Ba)没有纯化的蛋白质。B,E:反应产物的紫外线谱gydF4y2Ba2gydF4y2Ba.C、F:反应产物的质谱gydF4y2Ba2gydF4y2Ba.(医生142 kb)gydF4y2Ba
额外的文件10:gydF4y2Ba
图S10。gydF4y2Ba转换(gydF4y2Ba年代gydF4y2Ba)-eriodictyol(gydF4y2Ba3.gydF4y2Ba)Dihydroquercetin(gydF4y2Ba3AgydF4y2Ba),由OcFLS1 (A-C)或OcFLS2 (D-F)催化。A,D:反应产物的HPLC色谱图(gydF4y2Ba年代gydF4y2Ba)-eriodictyol(gydF4y2Ba3.gydF4y2Ba)与OcFLS1 (A)或OcFLS2 (D)的反应产物gydF4y2Ba年代gydF4y2Ba)-eriodictyol(gydF4y2Ba3.gydF4y2Ba)。B,(gydF4y2Ba年代gydF4y2Ba)-eriodictyol(gydF4y2Ba3.gydF4y2Ba)没有纯化的蛋白质。B,E:反应产物的紫外线谱gydF4y2Ba3AgydF4y2Ba.C、F:反应产物的质谱gydF4y2Ba3AgydF4y2Ba.(医生152 kb)gydF4y2Ba
额外的文件11:gydF4y2Ba
图S11。gydF4y2Ba转换(gydF4y2Ba年代gydF4y2Ba) -homoeriodictyol (gydF4y2Ba4gydF4y2Ba)到Taxifolin 3'-甲醚(gydF4y2Ba4AgydF4y2Ba),由OcFLS1 (A-C)或OcFLS2 (D-F)催化。A,D:反应产物的HPLC色谱图(gydF4y2Ba年代gydF4y2Ba) -homoeriodictyol (gydF4y2Ba4gydF4y2Ba)与OcFLS1 (A)或OcFLS2 (D)的反应产物gydF4y2Ba年代gydF4y2Ba) -homoeriodictyol (gydF4y2Ba4gydF4y2Ba)用纯化的蛋白质.b,反应产物(gydF4y2Ba年代gydF4y2Ba) -homoeriodictyol (gydF4y2Ba4gydF4y2Ba)没有纯化的蛋白质。B,E:反应产物的紫外线谱gydF4y2Ba4AgydF4y2Ba.C、F:反应产物的质谱gydF4y2Ba4AgydF4y2Ba.(Doc 149 KB)gydF4y2Ba
额外的文件12:gydF4y2Ba
表S1。gydF4y2Ba本研究中使用的引物。gydF4y2Ba表S2gydF4y2Ba本研究使用的质粒和菌株。gydF4y2Ba表S3gydF4y2Ba本研究中使用的HPLC条件。(Doc 59 KB)gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除非另有说明,否则适用于本文中提供的数据。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
太阳,YJ。,He, JM. & Kong, JQ. Characterization of two flavonol synthases with iron-independent flavanone 3-hydroxylase activity fromornithogalum caudatum.gydF4y2BaJacq。gydF4y2BaBMC植物BIOL.gydF4y2Ba19,gydF4y2Ba195(2019)。https://doi.org/10.1186/s12870-019-1787-xgydF4y2Ba
已收到gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-019-1787-xgydF4y2Ba
关键字gydF4y2Ba
- 黄酮醇合成酶gydF4y2Ba
- ornithogalum caudatum.gydF4y2Ba
- 黄烷酮3-羟化酶gydF4y2Ba