抽象的
背景
由于它们的发现,真空加工酶(VPE)一致地被调查为编程的细胞死亡(PCD)引发剂和植物开发的引发剂和参与者,以及对生物或非生物胁迫的反应,部分原因是与凋亡调节剂Caspase-1的相似性。然而,最近的研究表明VPE在西红柿中的其他功能,特别是在蔗糖积聚和果实成熟中。
结果
在此,我们评估了VPE从甘薯的功能,最初在表达模式分析中IBVPE1.在发育和衰老过程中。随后,我们通过过度表达来识别生理功能IBVPE1.在拟南芥,叶片大小和数量减少,开花早,并阐明了潜在的分子机制。
结论
目前的研究结果表明,VPE基因家族在植物的发育和衰老过程中发挥着重要的作用,在植物的开花期、叶片大小和数量以及衰老表型的调控中发挥着重要的作用拟南芥.
背景
叶片发育受激素、酶、转录因子和microRNA的复杂网络控制。在叶片的生命周期中,这些因素有助于形成叶片形状和控制叶片大小。这些和其他叶片特征在不同物种之间存在很大差异,同一植物内部的差异反映了不同的发育阶段和不同的环境条件,以及内源激素和转录因子的调节作用。在拟南芥在植物中,植物特异性转录因子teosinite branched1/cycloidea/pcf (TCP)参与了细胞增殖和分化的控制,以及叶片发育的调控[1].随后的阶段被称为花的过渡,并受到多种途径的调控,这些途径可能受到环境和内源因素的影响[2].许多开花相关基因已被鉴定拟南芥植物,包括LFY,AP1,SOC1,有限公司,英国《金融时报》,星期五,方法,BN1,BN2,平安险,FVE,FCA.,LD.这些基因通过控制激素或直接影响花器官的形成来调控开花。
植物衰老是植物发育的主要和必要方法,叶片衰老是植物老化的可见铭牌。叶绿素的有效停止和叶绿素的降解受许多外部和内源性因素的调节,包括环境提示,激素,ROS,转录因子和营养缺陷[3.,4].Chl分解是叶片衰老的一个视觉特征,导致绿色丧失和类胡萝卜素或花青素的积累[5,6].近年来,Chl分解代谢途径在高等植物中已经有了明确的特征,在拟南芥中有如下基因Clh pao rccr pph sgr和纽约,均编码Chl分解代谢的关键酶。
真空加工酶(VPES)是具有在逼血蛋白的处理中具有功能的半胱氨酸蛋白酶和种子储存蛋白的成熟[7,8,9,10,11].自从发现VPE及其对合成caspase-1底物的蛋白水解活性以来,VPE的功能被认为与发育和应激诱导的程序性细胞死亡(PCD)有关[12].在拟南芥中,VPE在所有组织中表达[13,14],编码VPE蛋白的基因被分类为营养型蛋白,如αVPE和γVPE [15和βVPE在胚胎和种子中的作用[16]和δVPE, δVPE在种子发育初期在种皮的两层细胞中瞬时特异表达[17].VPEs在植物发育和衰老过程中起着至关重要的作用- pcd,并参与贮藏蛋白的积累[18].许多关于植物性VPEs的研究已经确定了其在非生物或生物胁迫条件下的功能,如盐、伤害、病原体感染、茉莉酸等激素的治疗[14,19],以及由衰老引起的细胞死亡[11或疾病[20.,21].有报道称VPEs在花瓣和叶片衰老过程中上调,表明VPEs在植物衰老过程中可能发挥作用[19].植物性VPEs (NtVPE1)沉默抑制tmv介导的超敏细胞死亡[21[据报道,在拟南芥植物中,据报道,VPE涉及种子整体的Fumonisin诱导的细胞死亡和发育细胞死亡[17].综上所述,这些研究表明VPEs在植物发育和衰老过程中,以及在应对各种胁迫时,对各种类型的细胞死亡都是必不可少的。
大量VPEs研究揭示了pcd相关生物过程的功能,包括与发育和应激反应相关的过程。然而,VPE在植物生长过程中与pcd无关的功能却知之甚少。在本研究中,我们阐明了VPEs在植物发育和衰老中的作用。具体来说,我们的数据证明了这一点IBVPE1.通过调节AP1和CHL分解酵素途径的TCP转录因子和基因来影响植物发育和衰老。
结果
识别和表达模式IBVPE1.在甜蜜帕托特
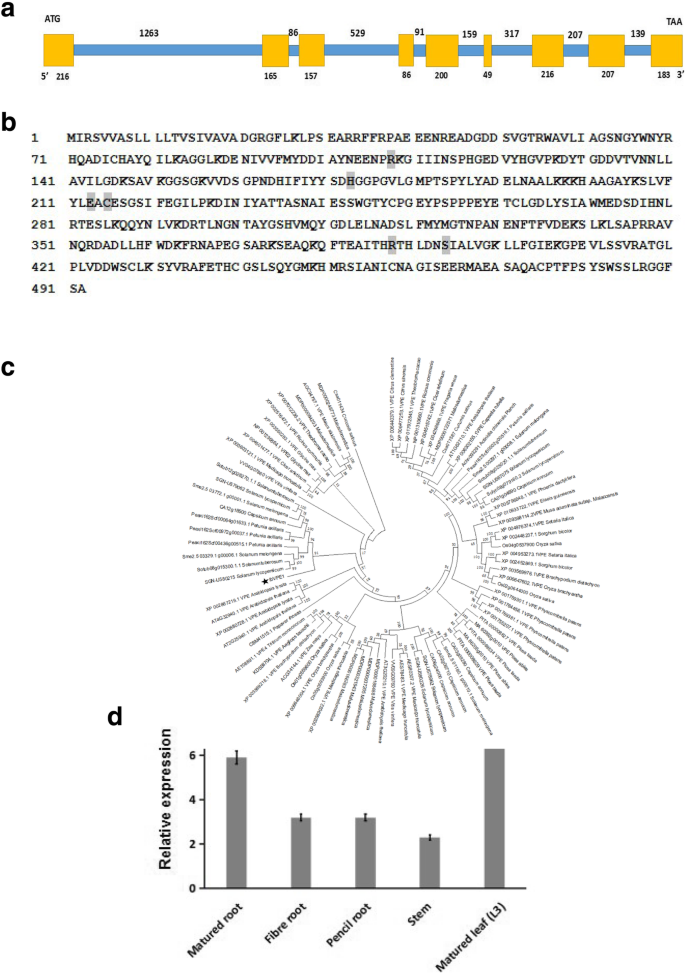
为了确定VPEs在甘薯中的作用,我们对VPEs的功能进行了鉴定和分析IBVPE1.通过筛选江苏师范大学植物完整性重点实验室构建的“Xu18 fosmid”基因文库,获得了该文库。经测序和序列比对分析,获得了该植物的全长cDNA和基因组DNAIBVPE1.被确定。cDNA和基因组DNA的比较表明IBVPE1.包含九个外显子和八个内含子(图。1并编码492个氨基酸的肽。此外,根据caspase-1的活性确定催化活性必需氨基酸和底物结合袋(图)。1b) (13,22,23].随后,我们使用Mega 5.0软件构建了一个系统发育树,并显示了壁橱atvpe.来IBVPE1.是gama-AtVPE,建议它可以被分类为植物类型gama-AtVPE(图。1c)。
分析的表达模式IBVPE1.在甘薯中,我们使用定量RT-PCR (qRT-PCR)检测了不同组织和发育阶段的转录水平,并对甘薯叶片形态进行了相关基因表达分析。2这些分析表明IBVPE1.表达于所有组织(图。2然而,b)。IBVPE1.叶片、根系发育和叶片衰老过程中的表达量分别是成熟叶片和根系的10-40倍和30-90倍。2c).这些结果表明甘薯IBVPE1.在叶子和根部发育期间和叶片衰老期间强烈转录。
本地化和表达模式IBVPE1.在转基因植物中
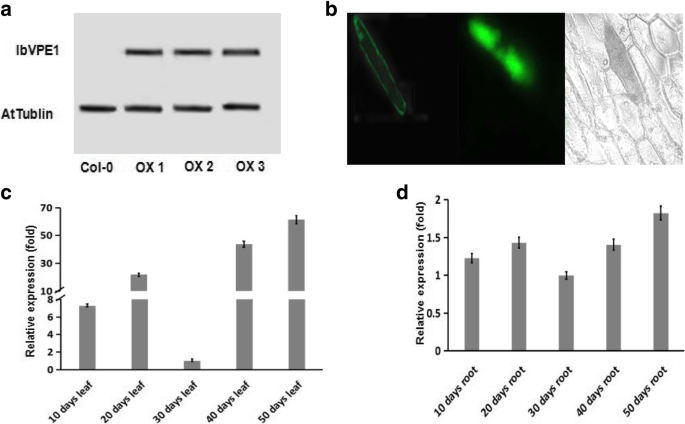
研究职能IBVPE1.我们生成了IBVPE1.overexpressing拟南芥植物。RT-PCR分析证实T3转基因纯合子幼苗表达较强IBVPE1.在OX-1、OX-2和OX-3突变体幼苗中与WT幼苗进行比较(图2)。3.一个)。
确认亚细胞本地化IBVPE1.,全长cDNA在35S启动子的控制下与GFP融合(图。3.b).随后,我们使用GFP空载体作为阴性对照,用中性红染料染色洋葱液泡作为阳性对照,荧光显微镜观察到洋葱表皮细胞中与阳性对照类似的液泡定位。
调查表达式模式IBVPE1.在转基因植物中,我们确定各种组织和发育阶段的转录水平(图。3.c)通过表达IBVPE1.- 在转基因拟南芥植物中驱动的Promoter驱动的GUS构建体。这些实验表明,与成熟的叶片(30天老叶子)相比,甘薯在甘薯(Methypotato)中观察到的那些表达模式,包括显影和老化叶子的强烈表达。然而,IBVPE1.在根部开发期间表达水平没有显着变化,表明了重要作用IBVPE1.在甘薯根管开发期间。
IBVPE1.通过调节几个TCP转录因子和叶片开发和开花时间来影响叶片开发和开花时间AP1
在长日条件下,叶株的叶片形状与螺栓阶段的WT植物中的叶片形状不同(图。4a).此外,叶片性状的定量分析表明,OX植株的叶柄长度与宽型植株相似(附加文件)1:图S4a),而OX植物叶片长度减少(附加文件1:图S4b),刀片宽度(附加文件1:图S4c),刀片周长(附加文件1:图S4d),叶片面积(附加文件1:图S4e)与野生型相比,开花较早(图S4d)。4b).在抽薹时测定株龄和莲座叶片数时,OX植株比WT植株开花平均早5天(附加文件)1:图S4f)和莲座叶片的平均数量显著低于野生型(附加文件1:图S4 g)。这些结果表明IBVPE1.影响叶片发展并加速开花。
表型分析IBVPE1.在WT和OX植物中;一个WT和OX植株抽薹期叶片形状和数量;bWT和OX植物的开花时间。叶柄长、叶片长、叶片宽、叶片周长、叶片面积和莲座叶片数的定量数据见附加文件1:图S4
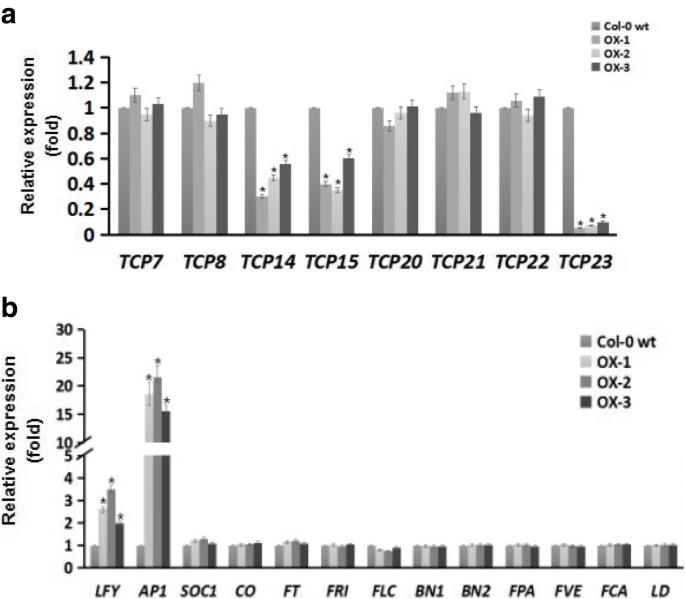
植物特异性转录因子TCP家族通过控制细胞增殖和分化来调控植物表型,分为I类和II类基因。在拟南芥,一类TCP基因包括AtTCP7,AtTCP8,AtTCP14,AtTCP15,AtTCP20,AtTCP21,AtTCP22,AtTCP23据报道,通过控制细胞周期基因的表达来调节细胞增殖和叶片开发[24,25,26,27].因此,为了研究I类TCP基因在叶片表型改变中的作用,我们使用qRT-PCR分析了其表达水平。这些实验显示了AtTCP15,AtTCP14,AtTCP23与WT植物中的那些相比,在牛植物中和其他类型TCP基因的微小变化(图。5这些数据表明IBVPE1.通过调节I类TCP基因来影响叶片开发。
除了叶片发育的改变,我们还观察到OX植物与野生型植物相比开花早。因此,我们测定了4周大的野生型和转基因植物的基因转录水平,这些植物以前被认为与开花有关,包括LFY,AP1,SOC1,有限公司,英国《金融时报》,星期五,方法,BN1,BN2,平安险,FVE,FCA.,LD.在这些基因表达分析中,AP1表达显著增加约20倍LFY与野生型相比,OX的表达量适度增加。然而,OX和WT植物中其他开花相关基因的转录水平没有差异(图2)。5b),这表明IBVPE1.主要通过上调开花速度AP1表达式。
IBVPE1.在黑暗诱导的衰老期间加速叶绿素分解
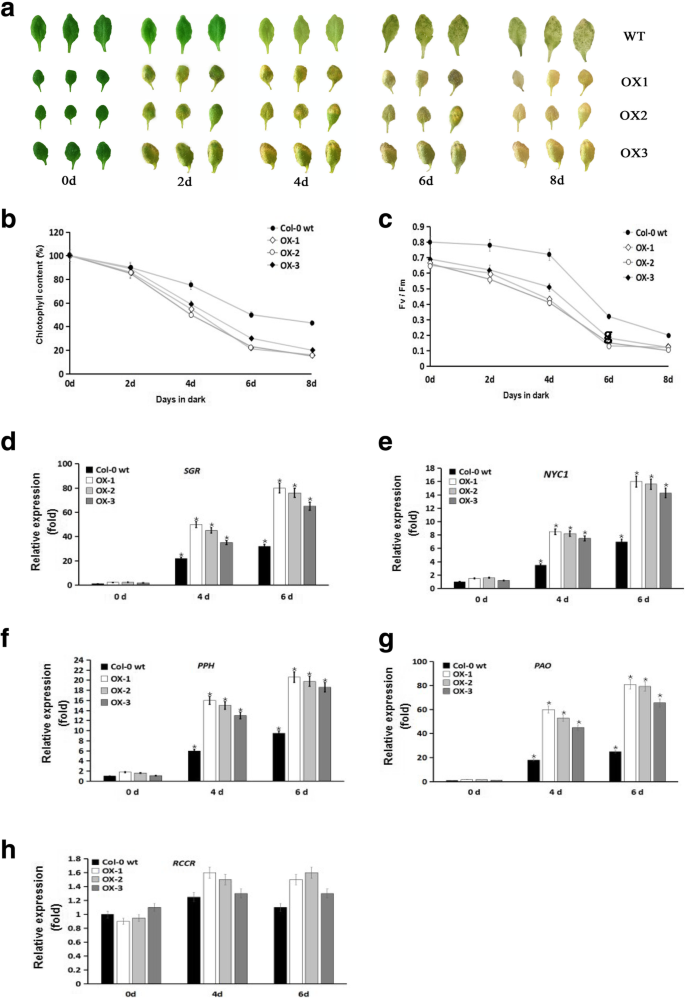
因为IBVPE1.在甘薯叶片衰老期间表达显着增加,我们确定了吗?IBVPE1.促进叶片衰老。Chl分解代谢是一种清晰可见的叶片衰老和果实成熟指示剂,并且涉及CHL分解的基因已经详细描述了[24,25,26,27].因此,在本研究中,我们通过将离体叶片置于黑暗环境中8天来诱导叶片衰老,然后研究叶片衰老的作用IBVPE1.衰老诱导的Chl降解。在这些条件下,WT叶片仍然比OX叶片更绿,表明在黑暗条件下8天Chl保留量更大(图2)。6a).为了定量地证实这些观察结果,我们分析了Chl,在黑暗仅2天后,OX叶片的Chl含量显著低于WT叶片(图2)。6b).因此,为了研究叶绿素含量的降低是否伴随着光合活性的变化,我们测定了光系统II (PSII)的最大量子产量。在这些试验中,WT叶片的Fv/Fm值约为0.8,而OX叶片的Fv/Fm值约为0.65,表明PSII活性相对较低(图2)。6c).在随后的暗处理中,OX植株的Fv/Fm值在4 d后比WT叶片平均下降40%。然而,在暗处理4天后,WT叶片的Fv/Fm值下降了15%,在6天后进一步下降,反映了PSII量子效率的进行性损害(图)。6c).先前的研究表明基因岩石,NYC1.,产后大出血,p,RCCH,是Chl分解的中心。因此,我们证明了这一点岩石,NYC1.,产后大出血,p在牛叶中表达水平显着上调,与WT叶片在暗处理中叶4和6天(图。6d - h)。这些结果表明IBVPE1.积极刺激CHL分解途径并加速叶片衰老。
讨论
最初将VPE蛋白质蛋白质鉴定为一组半胱氨酸蛋白酶,其具有作用于液压渣中的种子储存蛋白质的作用[7,28].然而,与烟草植物中的凋亡蛋白质caspase-1的结构和功能相似度的鉴定导致VPE系列作为植物细胞死亡的介质[12].随后,VPE在PCD中的作用在各种应激刺激反应的实验中被迅速定义[29,30.,31,32].这些研究掩盖了VPEs的额外代谢作用,这些研究在很大程度上仍是未知的。然而,最近的研究表明VPEs在番茄植株发育中的作用。特别是抑制SlVPE5使用特异性RNAi降低了酸转化酶的活性,其参与蔗糖的水解。此外,他们发现这种水解酶的活性与RNAi的mRNA表达完全相关SlVPE5植物(33,表明蔗糖在果实中积累的转录后调控SIVPE5.同样,的转录后功能SlVPE3与番茄果实成熟和抗病调控有关。在这项研究中,SlVPE3是丝氨酸蛋白酶抑制剂裂解所必需的吗kti4.,这有助于抵抗真菌病原体b . cinereal[34].因此,VPE可能在植物开发中涉及未被发现的生理功能。在此,我们研究了甘薯VPE基因的功能IBVPE1.利用一个方便的拟南芥过表达模型,并对其作用进行了表征IBVPE1.在植物发育和叶片衰老过程中。虽然VPE在植物对环境胁迫、病原菌感染和蔗糖积累的反应中与PCD有关[23,33],我们的结果表明,转基因甘薯VPE(在IBVPE1.)拟南芥影响叶片形态、开花时间和暗诱导叶绿素分解。
识别IBVPE1.,研究了红薯组织和发育阶段特异性表达模式。IBVPE1.在所有组织中观察到表达,但随着发育阶段的显着变化,表达叶片和根部具有显着更高的表达,以及衰老叶中的最高表达。因此,确认角色IBVPE1.在发育和衰老方面,我们分析了转基因的表达模式IBVPE1.在各种发育阶段的拟南芥组织中。这些实验表明IBVPE1.各组织中均有表达,其中发育叶和衰老叶中表达量最大。相对IBVPE1.拟南芥根系的表达水平与甘薯不同的含量不同。
IBVPE1.通过调控I类TCPs和,影响叶片发育和开花时间AP1
与角色一致IBVPE1.在叶片发育方面,转基因拟南芥植株减少了莲座叶片的大小和数量。叶的大小和形状反映了叶发育过程中细胞的分裂、分化和扩张[35,36, ttcp是叶片发育的调节者和叶片形态的决定因素[35,37].TCP基因用氨基酸非规范基本螺旋环 - 螺旋(BHLH)编码保守域,其参与DNA结合和二聚化[38,39].在拟南芥中,已经鉴定了24个TCP,以前将它们分类为基于序列同源性的I(13个蛋白)和II类转录因子[39].在第一类TCP基因中,AtTCP7, AtTCP8, AtTCP14, AtTCP15, AtTCP20, AtTCP21, AtTCP22,AtTCP23调控参与茎尖分生组织和叶片发育的基因表达,具有与II类TCP转录因子相似的功能[40].在功能缺失的研究中,这些基因与叶片大小、形态和开花时间有关TCP14和TCP15在发育的叶片和特定的花组织中调节细胞增殖[41].此外,淘汰一类TCP.基因TCP23-1减少莲座叶数并产生早花表型[42与本研究中显示的相似。此外,同时突变TCP8.,TCP15,TCP21,TCP22,TCP23拟南芥植物叶片发育特征的改变[43],提示目前的形态学观察IBVPE1.OX植物反映了TCP转录因子的调控。因此,目前叶片中8个I类ttcp的转录比较(图。5a) II类tcp表达水平发生显著变化TCP14,TCP15,TCP23在IBVPE1.黄牛植物。基因TCP14,TCP15,TCP23以前被分类为TCP8和TCP22并被证明聚集在染色体1上[41,可能导致一般功能冗余,这是通过比较单个和多个TCP突变体得出的结论,这表明单个TCP因子对细胞增殖的影响很小,且依赖于环境。因此,表型反映了多个tcp对细胞分裂的累积效应,需要调节信号的协调。此外,目前观察到的莲座叶大小和数量减少IBVPE1.OX植物可能遵循功能下降和细胞增殖增加的平衡。
目前的IBVPE1.牛拟南芥植物也表现出早期开花表型,如先前的功能丧失研究所示TCP23[42].花的起始是植物状态向生殖状态的重要生理转换[44].随后,开花时间受到环境信号(昼长、温度、水分和养分利用率)和内源信号(发育阶段)的严格控制,以最大限度地提高繁殖成功率。因此,而IBVPE1.影响了在目前正常长日照条件下调控开花的内源信号通路,需要进一步的研究来解释直接和间接的影响,或识别受影响的转录因子和激素。在此,我们测定了13个开花相关基因的表达水平,并观察到其转录水平增加了10倍AP1和显著的归纳法LFY在IBVPE1.黄牛植物。AP1据报道,激活基因LFY和菜花促进花分生组织(FM)的形成[45.,46.,47.,48.,49.].一致地,花萼腋的成花被抑制AP1突变体,导致未能建立FMS [48.,50.,51.].这些研究表明,随着我们的结果,提出了这一点IBVPE1.通过上调拟南芥的开花时间AP1和LFY.但是,它需要被揭示是否IbVPE直接或间接地影响转录水平。
表达式IbVPE在暗诱导衰老过程中,通过激活叶绿素分解代谢,导致叶绿素加速分解
众多研究将特定的激素和基因与衰老的开始,促进和抑制相关[52.,53.,54.,55.,56.,57.],其诱导衰老可能是多种因素共同作用的结果。在高等植物的衰老激素中,乙烯和细胞分裂素分别被认为是促进衰老的因子和延缓衰老的因子[58.,59.].据报道,aba处理水仙花衰老过程中可高度诱导包括液泡处理酶在内的几种半胱氨酸蛋白酶[60.Chl分解伴随着叶绿体的退化和光合作用的中断,这是叶片衰老的一个明显特征[5,6,55.,56.].虽然据报道乙烯诱导表达SlVPE3,这相反地通过正反馈回路调节西红柿中的乙烯合成[34], VPE在Chl分解代谢和光合作用中的作用尚不清楚。
在此,我们评估了黑暗诱导的叶片衰老IBVPE1.OX拟南芥,因为这一过程在单个莲座叶片中持续出现,而不是在整个植株中[61.].这些实验表明表达IBVPE1.在暗诱导的叶片衰老过程中,除红色Chl分解物还原酶(red Chl catolite reductase, RCCR)外,与Chl分解代谢相关的基因编码酶的转录增加。同样,据报道,Chl基因在no缺陷突变体nos1/noa1中上调,而在no1 /noa1中仅轻微下调RCCRRCCR活性在叶片发育过程中保持恒定[52.,62.].叶绿素含量和光合Chl荧光参数(Fv/Fm)均降低IBVPE1.离体叶片OX值与WT离体叶片OX值比较。
结论
本实验证明了这一点IBVPE1.影响开花时间,叶片发育和衰老以及开花相关基因的表达,例如TCP转录因子和编码CHL分解代谢酶的基因。这些数据表明,除了在PCD中的角色之外,VPES会影响发展和衰老拟南芥树叶。需要进一步的研究来阐明转录后和蛋白质 - 蛋白质相互作用IBVPE1.与植物中发育的分子有关。
方法
植物材料和生长条件
甘薯植物的分支(Ipomoea Batatas.(l)林。利用江苏徐州农业科学研究所采集的6-8片发育完全的叶片,对其进行了分析IBVPE1.表达水平。根据尺寸,叶子分为L1-L5发育阶段。L1-L5阶段定义为未开封的未成材叶片,不完全膨胀的未成熟叶,完全扩张的成熟叶片,部分(早)和完全(晚期)黄变衰老叶。从3和6之间的位置收集L3成熟叶,并从枝条上向下计数。在4,8和12周收集各种根样品,包括纤维根(直径为5mm),铅笔根(<15mm <15mm),肿胀的根(> 15mm)和成熟根,分别在种植后。
野生型(哥伦比亚,Col-0)和IBVPE1.过度抑制植物(牛线)在长期16-H光/ 8-H暗条件下在23℃下在土壤混合物中的60%湿度下在23℃下生长。对于组织特异性的表达分析,在30天内收集根,茎和叶子,在外观时收集花和石。对于根源和叶片的分析阶段,在种植后10,20,30,40和50天收集标本。
序列和系统发育分析
的IBVPE1.通过对江苏师范大学生命科学学院综合植物生物学研究所构建的“Xu18 fosmid文库”进行筛选和测序,获得序列。氨基酸序列IBVPE1.使用扩展性翻译工具解码(http://web.expasy.org/translate/).其他已发表的VPE蛋白序列是从多个数据库中使用BLAST搜索得到的IBVPE1.基因序列。使用具有MEGA 7.0软件的邻近方法构建系统发育树。用于构造树的氨基酸序列列于附加文件中1:图S1。
转基因和植物转化的构建
采用Plant RNeasy Kit (Qiagen)从红薯(Xu18)叶片中分离总RNA。采用GoScript™反转录系统(Promega)合成cDNA。生成IBVPE1.过度表达植物使用COL-0作为背景,全长编码序列(CD)IBVPE1.是用附加文件中列出的引物首次扩增的2然后通过XbaI和smi酶切位点克隆到克隆载体PBI121中IbVPE启动子t通过XbaI和SacI克隆到PBI121:GUS中,生成PBI121-proibvpe:格斯。拟南芥使用真空浸润进行转化[63.)与根癌土壤杆菌GV3101压力。
亚细胞定位分析
用克隆全长进行亚细胞定位分析IBVPE1.将CDS蛋白导入pCAMBIA1300-GFP载体中,在GFP的控制下与GFP融合表达Camv35s.启动子。PCMBIA1301-35S熔接结构:IBVPE1.通过渗透转化为洋葱表皮细胞转化为洋葱表皮细胞根癌土壤杆菌采用488 nm荧光显微镜观察菌株GV3101和绿色荧光蛋白(GFP)信号。
表型分析
在主茎伸长0.5 cm后抽薹期计数莲座叶片数。虽然不计算子叶,但在抽薹期测定第5叶片的叶柄长度、叶片长度、叶片宽度、叶片周长和叶片面积。使用LeafJ分析数据[64.]使用ImageJ软件(https://imagej.nih.gov/ij/),如前所述[24].
基因表达分析
使用植物RNeasy提取试剂盒(Qiagen, Valencia, CA, USA)从样品中提取总RNA。转录分析使用real-time PCR with Rotor-Gene Q real-time thermal cycle system (Qiagen, CA, USA), quantitative SYBR Green RT-PCR kits (Qiagen, CA, USA), 200 ng RNA样本,35 cycles和附加文件中列出的引物进行2:如前所述的表S1 [65.,66.].
衰老感应
深色诱导的叶片衰老是在离体叶片3周后实现的。这些叶子最初被放置在装有两层滤纸的培养皿中,滤纸浸泡在15毫升蒸馏水中。随后,培养皿被铝箔覆盖,并像前面描述的那样置于23°C的黑暗中[52.].
叶绿素测量
在暗诱导后,用80% (V/V)丙酮从叶片中提取叶绿素,然后用645和663 nm波长的分光光度计测定叶绿素含量,如前所述[52.,67.].
叶绿素荧光测量
PSII的最大光化学效率由可变(Fv)与最大(Fm)荧光(Fv/Fm)的比值确定,使用LI-6400XT便携式光合作用系统(LI-COR Biosciences, Lincoln, Nebraska USA),如前所述[52.].
统计分析
所有实验重复3次,数据以平均值±SE表示。使用SPSS软件(19.0版本)的学生t检验确定了转基因和野生型(WT)植物之间的差异,当p< 0.05.
突出了
IBVPE1.调节花期,叶片大小和数量,和衰老A. Thaliana.植物。
叶绿素内容物IBVPE1.在暗诱导衰老条件下,OX植物比WT植物下降更快。
缩写
- AP1:
-
APETALA1
- bHLH:
-
基本helix-loop-helix
- BN1/2:
-
脆NODE1/2
- 有限公司:
-
概要
- 方法:
-
开花轨迹C
- FM:
-
植物分生组织
- 星期五:
-
fr
- 英国《金融时报》:
-
开花轨迹T
- GFP:
-
绿色荧光蛋白
- LD:
-
Lu MINID EPENTENS.
- LFY:
-
多叶的
- NYC1:
-
NON-YELLOW COLORING1
- PAO:
-
含氧氧酶
- 纤毛运动:
-
编程细胞死亡
- PPH:
-
PHEOPHYTINASE
- PSII:
-
光系统II
- RCCH:
-
红Chl分解代谢物还原酶
- SGR:
-
住环保旅馆
- SOC1:
-
超表达式COI
- TCP:
-
Teosinite branched1 / Cycloidea / Pcf
- 烟草花叶病毒:
-
烟草马赛克病毒
- 副总裁:
-
在液泡加工酶
参考文献
- 1.
郭东曙,王宝业,王志军,王金哲,王金哲,王志军,李丽佳。TIE1转录抑制因子对拟南芥叶片发育的调控作用。植物合成。2013;25:421-37。
- 2.
Yruela I.工厂发展规定:概述和观点。J植物理性。2015; 182:62-78。
- 3.
费舍尔。衰老的复杂调节。Crit Rev Plant Sci. 2012; 31:124-47。
- 4.
陈志强,陈志强,陈志强,等。乙烯和转录因子在植物叶片衰老过程中的作用。植物科学学报。2014;5:650。
- 5。
植物衰老过程中的叶绿素降解。植物学报2006;57:55-77。
- 6。
保持绿色调节衰老过程中的叶绿素和叶绿素结合蛋白降解。植物学报。2009;14:155-62。
- 7。
一种独特的液泡处理酶,负责将几种蛋白前体转化为成熟形式。2月。1991;294:89 - 93。
- 8。
王勇,朱胜,刘胜,姜玲,陈丽,任艳,韩旭,刘芳,纪胜,刘旭,等。液泡加工酶OsVPE1是水稻谷蛋白高效加工所必需的。植物j . 2009; 58:606-17。
- 9。
鲁瓦,邓米,郭F,王米,曾Z,韩南,杨y,朱米,卞H.抑制osvpe3的抑制通过在编程细胞死亡期间衰减液泡破裂来增强耐盐性,影响水稻口气发育。米。2016; 9:65。
- 10.
液泡加工酶是通过连续去除c端和N端前肽而自我催化活化的。2月。1999;447:213-6。
- 11.
Rojo E, Martin R, Carter C, Zouhar J, Pan S, Plotnikova J, Jin H, Paneque M, Sanchez-Serrano JJ, Baker B,等。VPEgamma表现出一种caspase样活性,有助于防御病原体。咕咕叫医学杂志。2004;14:1897 - 906。
- 12.
Del Po,Lam E. Caspases和编程的细胞死亡,在植物的过敏反应到病原体。Curr Biol。1998年; 8:R896。
- 13.
陈志强,陈志强,陈志强,等。蛋白质贮藏液泡和溶解液泡中液泡加工酶的研究进展。植物生理学报。1998;52:668 - 74。
- 14.
引用本文:王志强,王志强,王志强,等。植物液泡功能的VPE家族研究进展。杂志杆菌。2005;123:369 - 75。
- 15.
Kinoshita T,Nishimura M,Hara-Nishimura I.在不同器官中表达的真空加工酶的同源物拟南芥.acta botanica sinica(云南植物学报),1995;29:81-9。
- 16。
Kinoshita T,Nishimura M,Hara-Nishimura I.γ-VPE基因的序列和表达,用于真空加工酶的三种基因家族的一个成员拟南芥.植物细胞生理。1995年; 36:1555-62。
- 17。
Nakaune S,Yamada K,Kondo M,Kato T,Tabata S,Nishimura M,Hara-Nishimura I.一种真空加工酶,Deltavpe,参与种子发育早期的种子涂层形成。植物细胞。2005; 17:876-87。
- 18。
植物半胱氨酸蛋白酶的研究进展。生物化学学报2004;51:609-24。
- 19。
Kinoshita T,Yamada K,Hiraiwa N,Kondo M,Nishimura M,Hara-Nishimura I.衰老在衰老和各种压力条件下的植物组织的裂解液泡中抑制了真菌。工厂J. 1999; 19:43-53。
- 20.
范德本特A,霍伯里希茨FA。植物caspase存在吗?植物杂志。2002;130:1764-9。
- 21.
Hatsugai N, Kuroyanagi M, Yamada K, Meshi T, Tsuda S, Kondo M, Nishimura M, Hara-Nishimura I.一种植物液泡蛋白酶,VPE,介导病毒诱导的超敏感细胞死亡。科学。2004;5685:855-8。
- 22.
尼科尔森DW。凋亡细胞死亡中的胱天蛋白酶结构,蛋白水解基质和功能。细胞死亡有所不同。1999年; 6:1028-42。
- 23.
Hatsugai N,Yamada K,Goto-yamada S,Nara-Nishimura I.植物预示的细胞死亡中的真空加工酶。前植物SCI。2015; 6:234。
- 24.
Rosybel Drury Stefan Hörtensteiner Iain Donnison Colin R. Bird Graham B. Seymour:香蕉果实成熟后果皮的叶绿素分解代谢和基因表达。杂志。1999;(1):107。
- 25.
Herve C, Dabos P, Bardet C, Jauneau A, Auriac MC, Ramboer A, Lacout F, Tremousaygue D.体内对AtTCP20功能的干扰会导致植物严重的生长改变,并使许多重要基因的表达失控。植物杂志。2009;149:1462 - 77。
- 26.
Selahattin Danisman Froukje van der细胞膜,Stijn Dhondt,威茨,Stefan de Folter安德里亚·女人Aalt DJ·冯·,Jose m . Muino卢卡斯Cutri马塞洛·c·Dornelas Gerco c . Angenent理查德G.H. Immink:拟南芥类I和II级TCP转录因子调节茉莉酸代谢和叶片发育对抗性。植物杂志。2012;159:1511-23。
- 27.
李泽,李斌,董王。拟南芥转录因子attcp15通过调节关键细胞周期基因的表达来调节宿主。莫尔植物。2012; 5:270-80。
- 28.
血吸虫半胱氨酸相关液泡加工酶的分子特性研究。植物细胞。1993;5:1651-9。
- 29.
臭氧诱导的细胞程序性死亡中,阴离子通道活性的增加是不可避免的。《公共科学图书馆•综合》。2010;5:e13373。
- 30.
邓敏,卞洪,谢勇,金勇,王伟,林恩,曾志,郭飞,潘杰,韩宁,等。在水稻中,Bcl-2通过OsVPE2和OsVPE3抑制过氧化氢诱导的程序性细胞死亡,而不是通过OsVPE1和OsVPE4。2月j . 2011; 278:4797 - 810。
- 31.
Misas-Villamil JC, Toenges G, Kolodziejek I, Sadaghiani AM, Kaschani F, Colby T, Bogyo M, van der Hoorn RA。液泡处理酶的活性分析揭示了VPE在卵菌感染过程中的作用。植物j . 2013; 73:689 - 700。
- 32.
金勇,王敏,白勇,曾志,郭芳,韩宁,边华,王军,潘军,朱明。Bcl-2通过抑制胞质钙离子来抑制VPEs的活化2+nacl诱导的水稻PCD中K+外流水平升高植物生理学报。2014;80:168-75。
- 33.
Wang N,Duhita N,Arizumi T,Ezura H.染色素加工酶Slvpe5参与番茄蔗糖积累中转化酶的转述过程中的转录过程。植物理性生物化学。2016; 108:71-8。
- 34.
王W,Cai J,王P,田S,秦G.番茄果实成熟与抗病性抗病的转录调控通过真空蛋白酶Slvpe3。基因组Biol。2017年; 18:47。
- 35.
Nath U,Crawford Bc,Carpenter R,Coen E.表面曲率的遗传控制。科学。2003; 299:1404-7。
- 36.
Kuchen EE, Fox S, de Reuille PB, Kennaway R, Bensmihen S, Avondo J, Calder GM, Southam P, Robinson S, Bangham A, et al.;通过早期的生长模式和组织极性生成叶片形状。科学。2012;335:1092-6。
- 37.
Palatnik JF,Allen E,Wu X,Schommer C,Schwab R,Carrington JC,Weigel D. MicroRNA的控制形态发生控制。自然。2003; 425:257-63。
- 38.
Aggarwal P, Das GM, Joseph AP, Chatterjee N, Srinivasan N, Nath U. Identification of specific DNA binding残基拟南芥.植物细胞。2010;22:1174 - 89。
- 39。
TCP结构域:在调节植物生长和发育的蛋白质中发现的一个基序。植物j . 1999; 18:215-22。
- 40.
Uberti-Manassero NG, Lucero LE, Viola IL, Vegetti AC, Gonzalez DH。I类蛋白AtTCP15通过与类似cin的TCP蛋白重叠的途径调控植物发育。J Exp Bot. 2012; 63:809-23。
- 41.
Kieffer M,Master V,Waites R,Davies B. TCP14和TCP15影响节间长度和叶形拟南芥.植物j . 2011; 68:147-58。
- 42.
Balsemao-Pires E,Andrade LR,Sachetto-Martins G. TCP23的功能研究拟南芥在工厂的发展。植物生理学报。2013;67:120-5。
- 43.
陈志强,陈志强,陈志强,等。拟南芥I类TCP基因AtTCP7、AtTCP8、AtTCP22和AtTCP23在叶片发育中的作用。植物科学学报2013;4:406。
- 44.
李志刚,李志刚,李志刚,等。水稻、拟南芥和谷类植物季节性开花的分子调控。安机器人。2014;114:1445-58。
- 45.
李志刚,李志刚,李志刚,等。拟南芥aptala1基因对拟南芥花发育的影响[J]。发展。1993;119:721-43。
- 46.
Kempin SA,萨维奇B,Yanofsky MF。花椰菜表型的分子基础拟南芥.科学。1995年; 267:522-5。
- 47.
Mandel MA, Yanofsky MF。花的形成的基因拟南芥.自然。1995年; 377:522-4。
- 48.
韩义,jiaoy. apetala1通过调节细胞素稳态来确定花卉分发拟南芥.植物信号表现。2015; 10:E98903911。
- 49.
Ferrandiz C,GU Q,Martienssen R,Yanofsky MF。Fruitfull,Apetala1和Cauliflower的冗余调节效果和植物架构。发展。2000; 127:725-34。
- 50.
爱尔兰VF,苏塞克斯IM。拟南芥无瓣基因1在花发育中的作用。植物细胞。1990;2:741-53。
- 51.
Mandel Ma,Gustafson-Brown C,Savide B,Yanofsky MF。拟南芥花卉归气基因Apetala1的分子表征。自然。1992年; 360:273-7。
- 52.
关键词:暗胁迫,叶绿素分解,类囊体膜,稳定性拟南芥.Plos一个。2013; 8:E563452。
- 53.
基里诺男,Noh YS, Himelblau E, Amasino RM。叶子衰老的分子方面。植物科学进展2000;5:278-82。
- 54.
布坎安沃顿V,Earl S,哈里森E,Mathas E,Navabpour S,Page T,Pink D.叶片衰老的分子分析 - 基因组学方法。植物Biotechnol J. 2003; 1:3-22。
- 55.
王志强,王志强,王志强。植物衰老:保守策略和新途径。植物医学杂志。2003;5:455 - 64。
- 56.
郭艳芳,甘绍生。叶片衰老的信号、执行和调控。在:夏腾GP,编辑。发育生物学最新主题;2005.p。83。
- 57.
林宝,金hj,nam hg。叶衰老。Annu Rev植物Biol。2007; 58:115-36。
- 58.
甘ss,amasino rm。抑制叶片衰老通过自动调节生产细胞素素。科学。1995年; 270:1986-8。
- 59.
乙烯调控植物叶片衰老的时间拟南芥.工厂J.995; 8:595-602。
- 60.
脱落酸对水仙花花被衰老的影响杂志。2004;121:313-21。
- 61.
acta opheica sinica, 2009, 34 (3): 441 - 442 . acta opheica sinica, 2009, 34 (3): 441 - 442拟南芥.植物细胞。1993年; 5:553-64。
- 62.
Pruzinska A, Tanner G, Aubry S, Anders I, Moser S, Muller T, Ongania KH, Krautler B, Youn JY, liljgren SJ,等。衰老过程中的叶绿素分解拟南芥树叶。叶绿素分子和叶绿素分解代谢酶的表征参与解法反应。植物理性。2005; 139:52-63。
- 63.
农杆菌介导的植物成虫转化拟南芥植物通过真空渗透。方法Mol Biol。1998年; 82:259-66。
- 64.
Maloof Jn,Nozue K,Mumbach Mr,Palmer Cm。Leafj:半自动叶片形状测量的Imagej插件。j Vis exp。2013:71:50028。
- 65.
郭克杰,金与,姜hs。对转基因拟南芥在高盐度,脱水或冷应激下过表达GR-RBP4的植物。J Exp Bot。2005; 56:3007-16。
- 66.
关键词:SRRP1,叶绿体,S1结构域,基因工程,基因工程引用本文拟南芥ABA对幼苗生长的影响。植物生理学报。2015;49(4):441 - 446。
- 67.
亚迪。分离叶绿体中的铜酶多酚氧化酶。植物杂志。1949;24:1-15。
确认
我们感谢审稿人和编辑对改进稿件提出的有益建议。感谢徐涛博士(江苏师范大学生命科学学院,徐州,中国)和孙建英博士(江苏师范大学生命科学学院,徐州,中国)对本文的帮助。
资金
这项工作得到了中国国家自然科学基金(31771367)的资助,江苏高等教育机构(PAPD),中国农业研究系统(CARS-10-B3)的优先学术计划发展。该基金在研究设计,数据收集,数据分析,数据解释或写作稿件中没有作用。
可用性数据和材料
支持这个手稿的结论的数据集包括在文章和它的附加文件。
作者信息
从属关系
贡献
ZL和YH设计了这项研究。JJ、JH和RT进行了实验。JJ、JH、YH和ZL对结果进行了分析。JJ, JH, YH和ZL撰写了手稿。所有作者阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
江,J。,胡,J.,Tan,R.et al。表达式IBVPE1.影响拟南芥中甘薯的叶片发育、开花时间和叶绿素分解代谢。BMC植物BIOL.19,184(2019)。https://doi.org/10.1186/s12870-019-1789-8
收到了:
接受:
发表:
关键字
- 液泡加工酶(VPEs)
- 拟南芥
- 地瓜
- 叶发育
- 开花
- 衰老