抽象的
背景
枣树(Ziziphus Jujuba.是一种非更年期的果实;然而,这个物种成熟的潜在机制和脱落酸在这个过程中的作用还不清楚。
结果
本研究确定了内源ABA的动态变化与枣树成熟开始时间呈正相关关系。转录分析表明编码基因之间的表达平衡nine-cis-epoxycarotenoid加双氧酶(ZjNCED3),ABA-8的羟化酶(zjcyp707a2.),beta-glucosidase(ZjBG4,ZjBG5,ZjBG8,ZjBG9)在维持ABA积累中起重要作用,而受体(Zjpyl8.),蛋白磷酸酶2摄氏度(ZJPP2C4-8),蔗糖非发酵1相关的蛋白激酶2(ZjSnRK2-2和ZjSnRK2-5)在调节果实对ABA的敏感性方面起重要作用。另外,采收白色成熟‘东早’果实,添加50 mg L处理−1aba或50 mg l−1以去甲双氢愈疮木酸(NDGA)为研究对象,探讨ABA在枣果实成熟中的作用。通过比较转录组分析,外源ABA和NDGA处理后第1天的差异表达基因分别为1103和505个。这些DEGs与光合作用、次生代谢、脂质代谢、细胞壁代谢、淀粉代谢和糖代谢过程相关,表明ABA参与了枣果实成熟的调控。此外,ABA还与其他植物激素和转录因子发生了串音,表明ABA对枣果实成熟具有调控网络。
结论
我们的研究进一步阐明了ABA相关的代谢和监管过程。这些发现有助于改善枣果实储存的策略,并用于了解复杂的非中小学果实成熟过程的见解。
背景
枣树(Ziziphus Jujuba.米尔)是一个受欢迎的水果作物品种原产于中国和消费者由于水果的丰富营养和健康的好处[非常希望全世界1,2].然而,肉枣果实具有非常短的保质期,在收获后2-3天内的快速脱水或水浸泡劣化下划线下划线[3.].因此,果实储存和质量维护一直是大枣行业发展中最紧迫的挑战之一,而缺乏与其成熟特征和规定相关的知识。在过去的几十年里,阐明了澄清果实成熟的调控,已经取得了大踏步研究[4];乙烯和脱落酸(ABA)被认为是直接或间接参与更年期和非更年期果实成熟的最重要的植物激素[5,6].最近,大枣被认为是一种非更年期的水果,但仍需要基本水平的乙烯来维持果实完全成熟[7].这些结果也揭示了红枣果实成熟的调控机制是相对复杂的,需要进一步探索这些机制,以加深我们对红枣果实成熟的认识。
关于ABA,已经有报道称,包括葡萄在内的几种水果作物在成熟开始时,果实中ABA水平显著增加[8甜樱桃[9),黄瓜10,西瓜11,柿子[5],这表明ABA在触发果实成熟的过程中起着重要的作用[8].此外,外源ABA和nordihydroguaiaretic acid (NDGA,一种ABA生物合成抑制剂)的应用使我们能够识别ABA依赖的途径[12,13];研究成果的数量增加建议,促进可溶性糖的代谢和积累[ABA的积极作用12,14]形成剥离的形成[15,16],以及细胞壁分解代谢的修饰[17],从而加速成熟过程[5].果实成熟是一个高度整合的过程,涉及激素控制和串扰,以及转录因子(TFs)转录本数量的改变[18,19].越来越多的转录组测序数据为我们提供了更广泛的分子机制和调控网络的见解。例如,ABA调节绝大多数参与草莓果实成熟的基因的表达[19], ABA对乙烯、生长素和赤霉素(GAs)的代谢和信号转导也有潜在的影响[12,20.,21,22].然而,ABA参与枣非更年期果实成熟调控的报道却很少。
本研究旨在探讨ABA在枣树果实成熟调控中的作用。通过测定果实成熟过程中ABA水平的动态变化,对刚开始成熟的果实进行采摘,并对其进行外源ABA和NDGA处理,研究ABA依赖的途径和代谢过程。利用枣树参考基因组(LPXJ00000000.1),我们鉴定了参与ABA生物合成、代谢和信号转导的基因。1),并通过qRT-PCR检测其在果实发育和成熟过程中的表达。此外,通过转录组测序,我们同时检测了aba相关的成熟代谢和包括激素串音和转录因子活性的调控网络。这些结果为进一步研究非更年期成熟过程中ABA网络提供了依据。
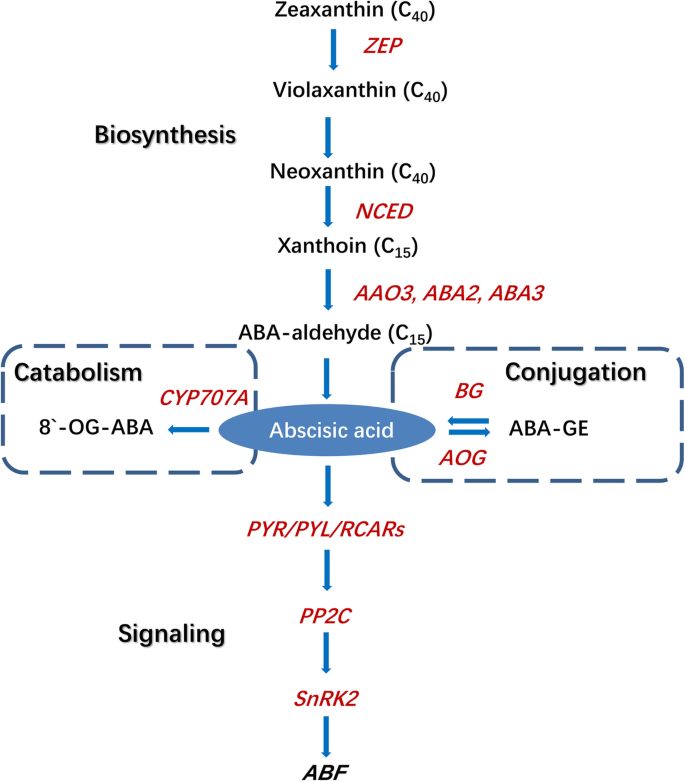
根据LENG等人,ABA生物合成,分解代谢,缀合和信号通路。(2014)[5].在手稿测定基因的红色着色的表达
结果
内源ABA的积累与枣果实发育成熟的关系
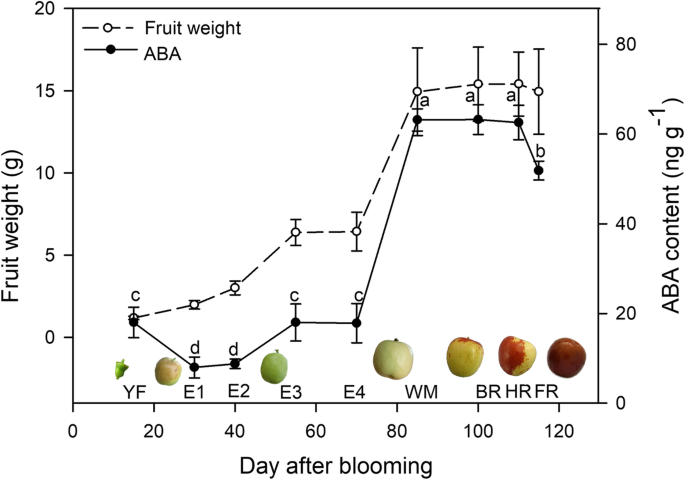
‘东早’果实的整体动态生长呈双s型。2),来自E2至E3的两种快速生长相,其次是E4至WM。WM阶段被定义为果实成熟的发作,在此期间,果实颜色变白,重量累积率明显减少。内源性ABA的含量与果实生长过程一起测定,在未成熟的水果中具有低且稳定的水平;内容显示在WM的最大增加,并且在BR和HR果实中保持高水平。之后,含量在FR阶段下降,其水平相对较低,而不是在HR果实中观察到的水平。我们通过使用人的相关模型进行了统计分析,结果显示了ABA含量和果实重量之间的显着相关性,R平方值= 0.9254(p < 0.0001, two tailed).
中国冬枣果实发育和成熟过程中的ABA生物合成基因相对表达
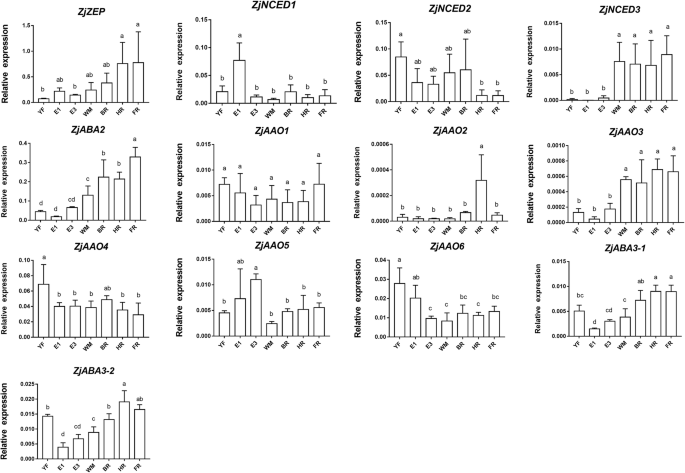
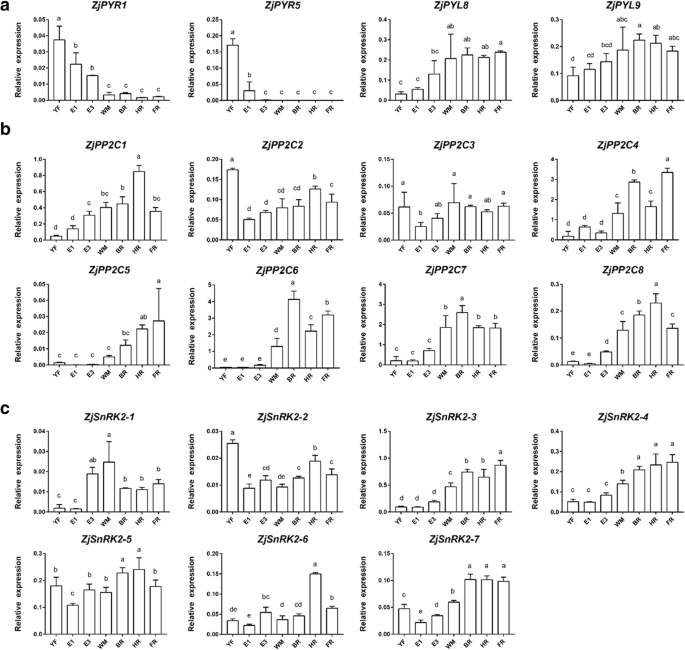
在ABA生物合成途径中,从参考红枣基因组中鉴定出13个基因,其中1个为外源基因玉米黄质环氧酶(ZEP), 3数控, 1黄氧脱氢酶(ABA2), 6脱落醛氧化酶(AAO), 2钼辅因子sulfurtransferase(ABA3)基因。的相对表达ZjZEP果实发育和成熟过程中无显著变化。3.).ZjNCED1在整个生长过程中持续表达,除了在E1阶段,在此期间中检测到相对高的表达。ZjNCED2还显示出一种稳定的表达模式,但在HR和FR阶段的水平略低于另一个阶段。ZjNCED3在WM期表达迅速增加,在果实成熟过程中保持较高水平。ZjABA2在未成熟的水果中没有高度表达,但在WM阶段后转录物的数量显着增加。ZjAAO3在低水平表达,但在WM其表达迅速增加和成熟过程中仍然很高,而相对表达ZjAAO1,ZjAAO2,ZjAAO4,ZjAAO5,ZjAAO6与ABA积累无关。此外,ZjABA3-1和ZjABA3-2WM期后的表达量高于未成熟果实。
ABA代谢基因在枣果实发育和成熟过程中的相对表达
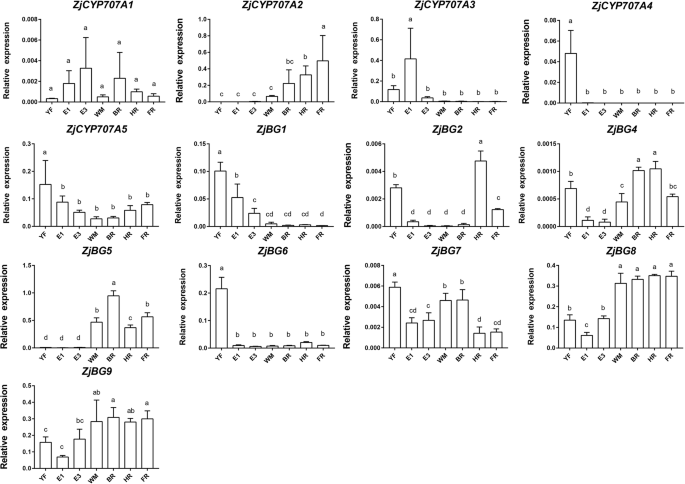
在ABA分解代谢途径中,我们确定了五个CYP707A的相对表达zjcyp707a1.在果实发育和成熟过程中变化不显著。4).zjcyp707a2.表现出未成熟的果实相对低的表达;然而,其转录强劲增长,这是伴随着ABA的积累,并达成在FR阶段最高水平。zjcyp707a3.在E1果实中表现出相对高的表达,但随后这种表达减少到非常低的水平。zjcyp707a4.仅在YF期高表达。zjcyp707a5.在YF期表达相对较高,但在YF期后表达降低,无明显差异。
在ABA稳态通路,8BGS被确定。其中,ZjBG4,ZjBG5,ZjBG8,ZjBG9ABA的积累与表达模式相似;这些基因在未成熟果实中的表达量较低,但在WM期后表达量增加。ZjBG1在YF和E1期表达量高于其他期,但随后表达量下降,且无明显变化。ZjBG2在HR、FR和YF阶段的表达高于其他阶段。ZjBG6在YF显示出相对高的表达,并且在其他阶段没有显着变化。ZjBG7在YF,WM,和BR阶段显示出更高的表达比在其他阶段。此外,我们还确定了两个ABA-glucosyltransferases(AOG)但它们的表达水平极低,并且在图中未示出。
ABA信号通路基因在红枣果实发育和成熟过程中的相对表达
在信号通路方面,有6个编码ABA受体的基因PYR /所有/ RCAR被确定。ZjPYR1和ZjPYR5在YF和E1期表达相对较高,但在成熟开始后表达非常低(图2)。5a).的表达水平Zjpyl8.和Zjpyl9.在未成熟果实中含量较低,但在WM后略有增加。此外,ZjPYL2和Zjpyl4.在冬枣果实中不表达。
在八个确定PP2C年代,ZjPP2C4,ZjPP2C5,ZjPP2C6,ZjPP2C7,ZjPP2C8随着ABA积累,表达模式相似,在WM期表达迅速增加(图2)。5然而,b)。ZjPP2C1在YF和E1阶段显示出较低的表达,但HR果实表达更高。ZjPP2C2在YF期表现出相对高的表达,但之后的表达是一致的。的相对表达ZjPP2C3在整个果实生长过程中也没有显着改变。
七个SnRK2从中国大枣基因组中鉴定出。ZjSnRK2-3,ZjSnRK2-4和ZjSnRK2-7在未成熟的果实中表现出相对较低的表达,但它们的表达随着ABA积累而显着增加。此外,ZjSnRK2-1在YF和E1期表达量低于其他期,但在E3期开始表达量增加,在WM期表达量最大(图2)。5c)。ZjSnRK2-2在YF时表达相对较高,但在其他阶段表达保持一致。ZjSnRK2-5和ZjSnRK2-6在果实发育和成熟过程中表现出相对一致的表达模式ZjSnRK2-6在人力资源果实中显示出最大的表达。
关于ABA和NDGA的WM Chinese Jujube Fruit的成熟和激素水平的变化
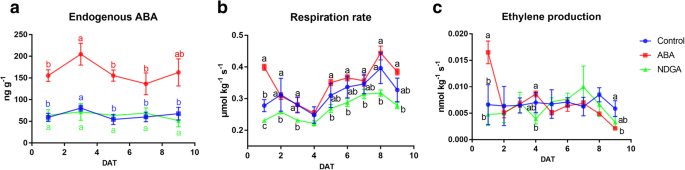
为探讨ABA对大枣果实成熟的调控作用,采用外源ABA或NDGA处理大枣果实。正如预期的那样,ABA处理后的果实在贮藏期间内源ABA浓度显著增加并保持在较高水平(图2)。6a). 3 DAT时,CK和ABA处理的果实ABA含量均达到一个中等峰值,而ndga处理的果实ABA含量略低。在贮藏过程中,呼吸速率的变化先趋于减小,后趋于中度增加(图1)。6b).外源ABA处理显著提高了1 DAT时的呼吸速率,但随后的效果并不显著。NDGA显著抑制果实呼吸作用,处理果实呼吸作用水平较对照降低。此外,乙烯产量很低,ABA处理在1 DAT时显著增加,而NDGA对乙烯产量的影响有限(图2)。6c)。
比较转录组分析中DEGs的鉴定
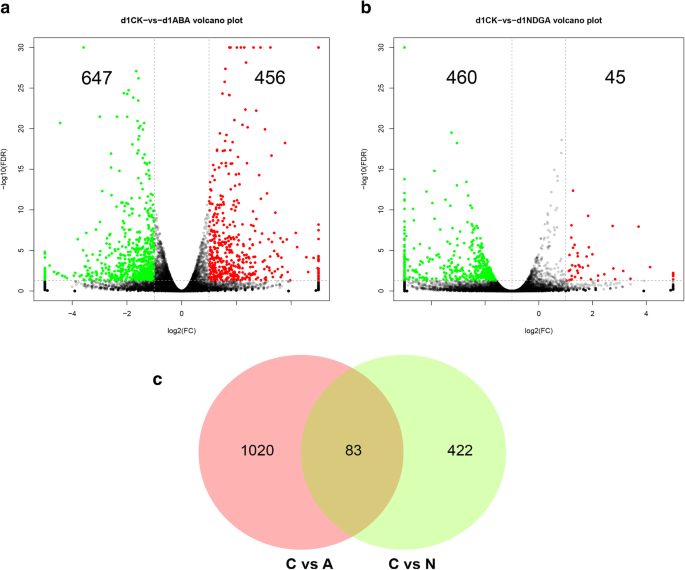
为了研究ABA相关成熟过程的分子基础,我们在1dat对经过ABA和NDGA处理的WM枣果实进行转录组测序。总共产生了41.26 Gb原始测序数据,包含275,139,538个reads;在质量控制后,271,970,678个干净读取被用于进一步分析(附加文件1).通过与大枣基因组比对,每个文库(附加文件)中平均有87.42%的reads被唯一映射2),并计算的31031个转录物的相对表达水平。通过比较转录组分析,1103度的视角进行了鉴定,与456个上调和下调647转录响应外源性ABA(图检测到。7a).此外,505个基因转录本在NDGA处理后发生显著变化,其中45个基因表达上调,460个基因表达下调(图4)。7b).当比较这些输出时,ABA和NDGA同时诱导了83个deg(图。7c)。
通过GO,KEGG和MAPMAN分析进行富集的DEGS
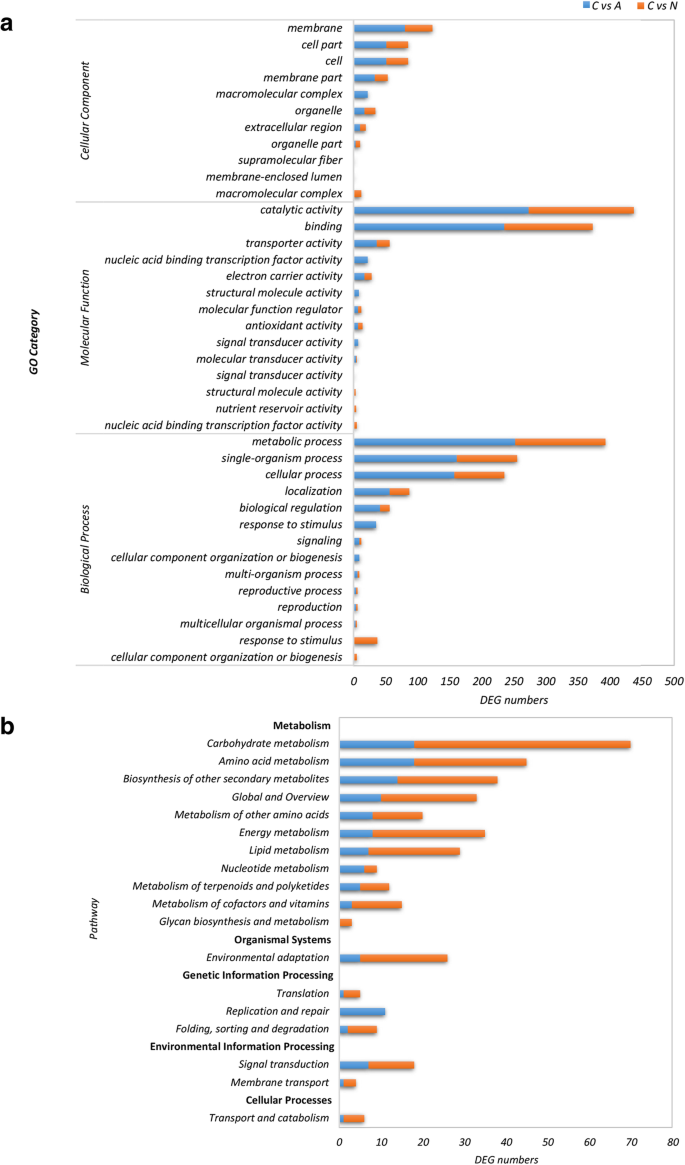
为了揭示ABA和NDGA处理对枣果实成熟影响的差异,我们利用GO注释充实了特定DEGs的假设功能,分别为ABA(1020)和NDGA(422)处理生成了31和32个2级类(附加文件)3.).膜,细胞部分和细胞类别在细胞组分中高度表示(图。8a).催化活性和结合类分子功能高度富集。最后,代谢过程、单生物过程和细胞过程是最丰富的生物过程。
KEGG通路分析将DEGs分别富集到ABA和NDGA处理的83和72条通路中(补充文件)4).这些途径大多与10个代谢过程相关(图。8b)包括影响碳水化合物,氨基酸,其他次级代谢物的生物合成的人,其它氨基酸,能量,脂质,核苷酸,三萜和聚酮化合物,辅因子和维生素,以及聚糖生物合成和代谢。此外,与环境适应,翻译,复制和修复,折叠,分选和降解,信号转导,膜运输和转移以及分解代谢相关的基因也在途径富集的途径浓缩中的高度代表。
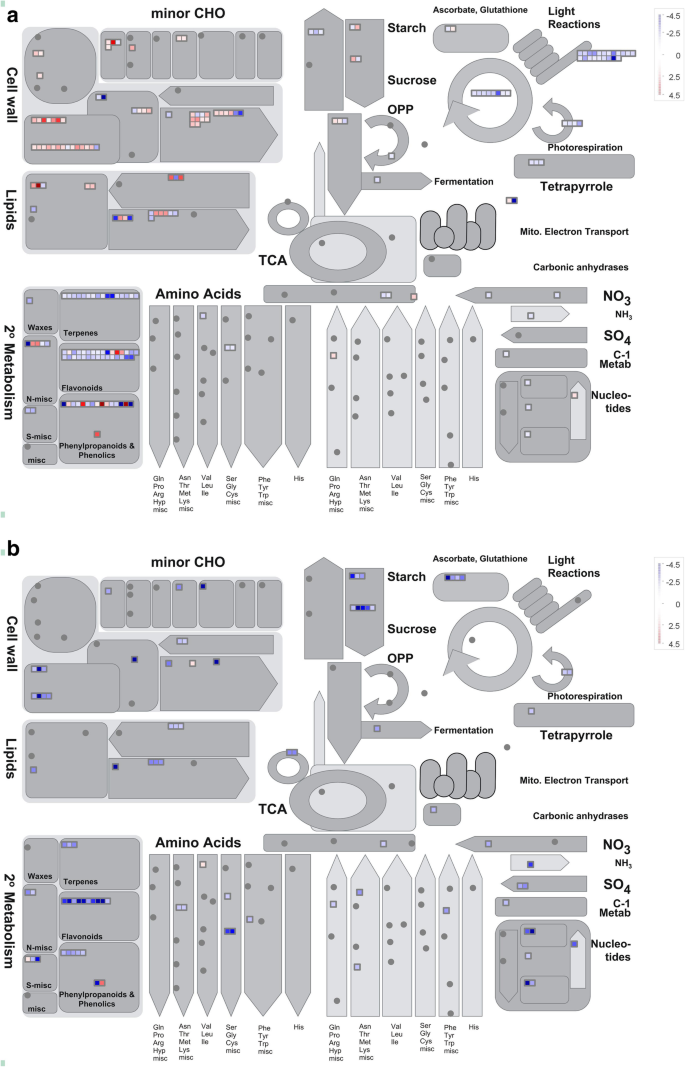
此外,MAPMAN分析允许我们概述ABA和NDGA治疗后代谢过程的转录变化。响应于外源性ABA,显着抑制了与光合作用代谢和几种次级代谢物(萜类代谢物)的DEGs,而细胞壁改性,脂质代谢和淀粉和蔗糖代谢稍微促进(图。9一个额外的文件5).此外,NDGA显著抑制了这些代谢过程,包括次生代谢、细胞壁修饰、脂质代谢、氨基酸代谢以及淀粉和蔗糖代谢(图2)。9b,额外的文件5).
与植物激素代谢和响应ABA和NDGA处理信令度的视角
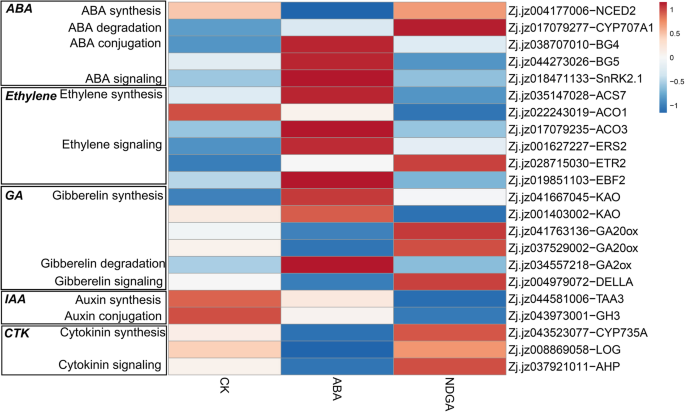
鉴定出一些与植物激素代谢和信号转导相关的deg(图。10额外的文件6).在ABA新陈代谢,外源ABA下调了表达ZjNCED2(ZJ.JZ004177006)并上调了两种β-葡糖苷酶的表达(ZjBG4Zj.jz038707010;ZjBG5, Zj.jz044273026), NDGA促进zjcyp707a1.(Zj.jz017079277),并抑制ZjBG5(Zj.jz044273026)。在信号通路中,外源ABA和NDGA诱导的基因表达不显著。
控制乙烯生物合成的基因的转录物,包括1-氨基环丙烷-1-羧酸盐合酶(ACS71-氨基环丙烷-1-羧酸氧化酶(ACO3,ZJ.JZ017079235),响应于ABA治疗而显着积累。但是,响应NDGA,表达ACO1(Zj.jz022243019)表达下调。在乙烯信号转导中,受体的表达ERS2(Zj.jz001627227)被ABA强化ETR2(Zj.jz028715030)中的溶液高度上调响应于NDGA。参与信令其他基因几乎不受任一处理诱导;另外,乙烯 - 不敏感的3结合的F-box(EBF, Zj.jz019851103),它调制乙烯不敏感3-like (EIN3 /面纱在翻译后水平上,ABA表达上调,而NDGA表达不显著。
an的表达ent-Kaureno酸羟化酶(花王参与赤霉素生物合成早期步骤的基因表达上调花王(Zj.jz001403002)被NDGA下调。此外,两种ga -20氧化酶(Ga0ox., Zj。jz041763136, Zj.jz037529002)参与活性GA的生物合成,响应外源ABA而下调。对于GA的降解,一个GA-2氧化酶(GA2ox,ZJ.JZ034557218)在ABA处理的果实中显示出相对高的表达。关于信号通路,转录DELLA1(ZJ.JZ004979072)由ABA下调,但NDGA未显着诱导。
参与促进剂代谢和信号传导的基因的相对表达几乎不能被外源aba诱导;然而,一种色氨酸氨基转移酶(TAA在植物生长素生物合成的色氨酸依赖途径和一个gretchen hagen 3 (GH3NDGA处理同时下调了与偶联相关的基因Zj.jz043973001。此外,外源ABA下调了控制细胞分裂素生物合成的两个基因的表达,包括CYP735A(Zj.jz043523077),编码细胞分裂素反羟化酶日志(Zj.jz008869058),它编码一个细胞分裂素核苷5 ' -单磷酸磷酸水解酶。在信号转导中,只有含有组氨酸的磷酸转移酶(AHP.)的表达量受到ABA的下调,NDGA对这些基因的表达量影响有限。
ABA和NDGA处理对转录因子的影响
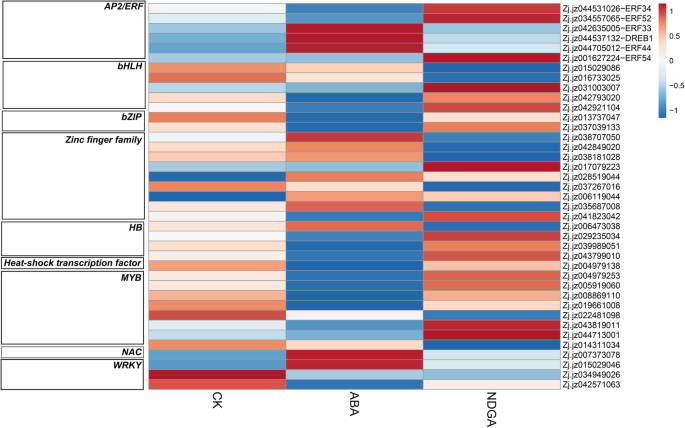
我们还鉴定了几个在ABA和NDGA处理下差异表达的tf(图)。11额外的文件7).外源ABA上调表达3 APETALA2 / ethylene-responsive元素(AP2 /小块土地, Zj。jz042635005, Zj。jz044705012和Zj.jz044537132),二锌指蛋白(Zj.jz028519044和Zj.jz006119044),1-南汽domain-containing蛋白质(Zj.jz007373078),和1个WRKY基因(Zj.jz015029046)。此外,ABA下调了2AP2 /小块土地年代(Zj。jz044531026和Zj.jz034557065), 2Bhlh.S(Zj.jz042793020和Zj.jz042921104),2-Bzip.年代(Zj。jz0137047 and Zj.jz037039133), 1锌指蛋白(Zj.jz041823042) 3同源框(乙肝)转录因子(Zj.jz029235034,Zj.jz039989051,和Zj.jz043799010),1-热休克特遣部队(HSF,Zj.jz004979138),6my年代(Zj。jz004979253, Zj。jz005919060, Zj。jz008869110, Zj。jz019661008, Zj。jz041121020, Zj。jz043819011和Zj.jz044713001)WRKYS(Zj.jz034949026和Zj.jz042571063)。
NDGA还诱导了几种与TFs相关的deg的表达,包括2AP2 /小块土地s (ZjERF52, Zj。jz034557065 and Zj.jz001627224), 1Bhlh.(Zj.jz031003007), 1锌图蛋白质(Zj.jz017079223), 1my(Zj.jz044713001)。下调基因包括2Bhlh.年代(Zj。jz015029086和Zj.jz016733025), 5锌指蛋白(Zj。jz038707050, Zj。jz042849020, Zj。jz038181028, Zj。jz037267016和Zj.jz035687008), 1乙肝(Zj.jz006473038), 2my年代(Zj。jz022481098和Zj.jz014311034)。
转录组表达水平的验证
选择十七基因通过qPCR来验证转录表达水平。的RNA-SEQ数据和相对表达从0.838-1.0范围之间的相关系数(附加文件8),从而确认RNA-seq数据的可靠性。
讨论
红枣果实成熟过程中内源ABA的动态积累
研究了内源ABA在枣果实发育和成熟过程中的动态积累。一些研究表明内源性ABA是由果肉组织合成的,而不是由种子运输的[8,11,23].红枣YF期初期内源ABA含量较高,可诱导同化产物的吸收和蔗糖的积累[8,9],而在WM阶段的迅速增加,响应于与色素积聚,糖代谢,在水果细胞壁降解熟化相关的发作[24].ABA的增加也被报道在更年期和非更年期的果实中,如番茄[5],桃子[25],柿子[26)、葡萄(24),草莓27]和西瓜[11].ABA在诱导枣果实成熟过程中起着重要作用,因为在我们上一项研究中报道的‘东枣’果实WM期乙烯排放有限[7].FR果实中乙烯产量略有增加,ABA含量同时下降。我们提出可以存在一种互补机制,如SlNCED1 RNAi番茄植株ABA含量较低,但乙烯产量较高[28].然而,这些发现表明ABA在调节枣树果实成熟的发生和维持过程催熟作用。
ABA生物合成和代谢途径基因在枣果实发育和成熟过程中的表达表明ABA在调控过程中发挥了平衡作用数控,CYP707A,BG基因并确定内源性ABA的积累[5,29,30.].虽然ZjNCED3表达量不高,有增加的趋势,这与ABA的积累有关;的ZjNCED3蛋白质的氨基酸序列相似性为64%AtNCED6(AT3G24220)蛋白,在ABA合成调控中起关键作用拟南芥.这些结果表明ZjNCED3也可能是在确定中国冬枣果实ABA的生物合成非常重要的。虽然表达ZjNCED1和ZjNCED2未能平行ABA积累,这些基因可能也参与了这个过程;例如,CsNCED2似乎起到ABA积累起辅助作用,如基因产物在限制为包含有色体组织柑橘类水果 [31].而CYP707As被证明能催化ABA降解[32,33],我们发现表达了zjcyp707a3.,zjcyp707a4.,zjcyp707a5.在枣果成熟开始时减少,提示发育阶段依赖的表达模式[27],在西瓜(Cla020637和Cla016011) [11]和桑树(MaCYP707-1-4) [34].此外,zjcyp707a2.在FR期表达量增加,我们认为这可能与FR期ABA含量下降有关。关于BGS,编码酶催化糖基化 - ABA的水解,迅速增加植物组织中免费ABA的含量[35].我们的研究结果表明,ZjBG4,ZjBG5,ZjBG8,ZjBG9由于它们的表达模式与ABA的动态变化一致,因此可能参与了ABA积累的调控[5,23];抑制的表达FaBG3减少了ABA含量和延迟草莓果实成熟[36].在黄瓜,两个BGs也被鉴定为参与了ABA积累的调节[23].
我们的研究也确定了ABA生物合成途径中其他几个基因的表达,但关于它们在果实成熟过程中的表达的报道很少。ZjZEP大枣果实发育过程中持续表达和成熟,并在其表达也没有涉及到ABA积累varcinium myrtillus.水果 [37].ZjABA2在ABA的动态变化后表现出增加的表达ATABA2.-过表达植株也表现出较高的ABA积累[38];但在果实成熟过程中未检测到相关性varcinium myrtillus.[37].在Jujube,只有ZjAAO3表达量与ABA的动态变化一致;AAOS属于一个小的基因家族,其成员被认为是功能冗余的AtAAO3参与ABA的生物合成拟南芥[39,40].此外,表示ZjABA3-1符合的ZjAAO3;ABA3编码钼辅助因子硫酶并与AAO3[30.].之前的一项研究也表明ATABA3.ABA含量与拟南芥[41].
ABA信号通路基因在枣子发育和成熟过程中的转录
ABA的信号传导途径,包括p/塔/RCAR-PP2C-SnRK2,已在植物中广泛报道[5].在我们的研究中,ZjPYR1和Zjpyl5.在不成熟的水果中表达了相对较高的水平,但成熟后,它们的表情低于Zjpyl8.和Zjpyl9.呈现相反的趋势,在成熟阶段表达量相对较高。根据系统发育分析的结果(附加文件9),ZjPYR1属于进化支IIIZjpyl5.属于进化枝II。这两个分支也显示它们的表达和积累ABA之间的负相关柑橘类水果(CsPYR1,cspyl4.,cspyl5.) [42].Zjpyl8.和Zjpyl9.随着ABA水平的增加,与该进化支相关的基因也在逐渐积累cspyl8.和cspyl9.基因柑橘类[42];SlPYL1,SlPYL2,SlPYL3在番茄43];和FaPYR1在草莓44].因此,我们的研究结果表明,ZjPYR1和Zjpyl5.是枣子未成熟果实ABA信号转导的关键基因,而Zjpyl8.和Zjpyl9.在果实成熟过程中维持信号传递更为重要。
PP2C蛋白充当ABA信号转导负调节[45],它们可以与受体结合并形成蛋白激酶复合物的组分,这调节对ABA信号的果实敏感性[42,46,47].我们的研究确定了8个基因属于PP2C-亚族,其中5个(ZjPP2C4- - - - - -8)随着ABA积累而上调。以往的一些研究也表明,局部表达PP2C在果实成熟过程中累积柑橘类(CsABI1,cshab1.,CsAHG1,CsAHG3,CsHAI3), 番茄 (SlPP2C1和SlPP2C5),和葡萄(VvPP2C3,VvPP2C6,VvPP2C7,VvPP2C9) [42,43,48].然而,还需要更多的证据来阐明两者之间的关系PP2C对ABA信号的敏感性。
此外,7SnRK2S在我们的研究中被确定,并根据两者的研究将其分为三个分支柑橘类和番茄42,43].然而,由于富集的ASP(D)残基,仅提出了Clade III,该途径参与了ABA信号通路,其位于C末端序列内,并且称为激酶结合位点[49].我们的研究只发现了这一点ZjSnRK2-2和ZjSnRK2-5属于这个思工(附加文件9),其转录本与ABA含量之间无显著相关性。这一现象与之前的研究结果一致柑橘类,西红柿和苹果水果[42,43,50].对于分支I和II,ZjSnRK2-3,ZjSnRK2-4,ZjSnRK2-7也随着ABA含量的增加而积累,说明这些基因参与了成熟调控而不参与ABA信号[51].尽管如此,ZjSnRK2-2和ZjSnRK2-5对维持大枣果实的ABA信号相对重要。
ABA在红枣果实成熟过程中起正向调节作用
为进一步研究ABA对枣果实成熟的调控作用,采用低浓度ABA或NDGA处理WM‘东枣’果实。结果表明,ABA处理促进了果实内源ABA的快速积累,在一定程度上促进了果实呼吸作用和乙烯生成。这些结果与最近的一项研究结果相似,该研究表明50毫克L−1ABA促进WM‘东早’果实成熟,降低果实采后贮藏品质[52].此外,我们的研究表明50毫克L−1NDGA抑制在3 DAT内源性ABA的增加,显著降低水果的呼吸,但略受影响乙烯生产在我们的研究。NDGA是ABA生物合成的抑制剂,因为它可以与NCED酶就其渗透速度相互作用[53].因此,NDGA减少了ABA生物合成,但没有完全抑制过程[54,55].上述结果表明,ABA在红枣果实成熟过程中起着潜在的正调节作用。
比较转录组分析提供了与代谢过程改变响应的deg相关的概述。前人研究表明,ABA诱导果实成熟背后的转变与抑制营养生长代谢和激活成熟特异性途径有关[14,56].在我们的研究中,发现与光合代谢和几个次级代谢产物基因由ABA(附加文件有所下调5).光合新陈代谢被认为是诱导到通过下调基因表达的过渡到果实逐渐过渡的转变,响应于外源ABA [13,14,57].此外,1 DAT ABA下调了黄酮、黄烷醇和黄酮类化合物代谢相关基因的表达,表明外源ABA可能对红枣果实产生胁迫反应。在葡萄中,ABA在处理后20 h也下调了苯丙素生物合成和类黄酮生物合成相关基因的表达,但在处理后44 h上调了表达[14].我们推测,由于其在调节次生代谢物中的积极作用,ABA之后,ABA将积极地诱导二次新陈代谢;这个过程对番茄,葡萄和草莓是常见的[13,16,58].
另一方面,我们发现,ABA和NDGA对脂质、细胞壁修饰、淀粉和蔗糖代谢等相关基因具有一定的正向诱导作用,表明ABA与成熟相关代谢之间存在相关性。在脂质途径中,改变的基因表达参与细胞膜的修饰,芳香化合物的生物合成,以及由损伤引起的木质素化。12,19,59,60].在细胞壁修饰方面,纤维素合成、细胞壁蛋白、细胞壁降解和修饰相关基因均被ABA上调,说明ABA在调控果实质地变化方面具有潜在作用[5,17,61].在淀粉生物合成途径中,通过ABA下调编码ADP-葡萄糖焦磷酸化酶和异戊聚糖酶的基因,而NDGA下调了控制淀粉降解的基因的表达,包括两个α-淀粉酶和编码β-淀粉酶编码基因。这些结果表明,ABA参与淀粉代谢,就像ZmEREB156通过蔗糖和ABA的协同作用正调控玉米淀粉生物合成[62].在蔗糖代谢中,编码液泡转化,己糖激酶,和糖转运基因显著由ABA诱导,表明ABA促进蔗糖降解但维持葡萄糖和果糖的含量,而这些基因的表达NDGA处理后抑制。这se results suggest a putative role of ABA in regulating sucrose metabolism, and genes related to sucrose metabolism were also found to be activated after 44 h in grape fruit treated with exogenous ABA [14].总的来说,我们的研究提供了全面深入了解ABA的作用,在调节枣树果实成熟相关的代谢,仍需要进一步的研究来阐明所涉及的复杂的监管机制。
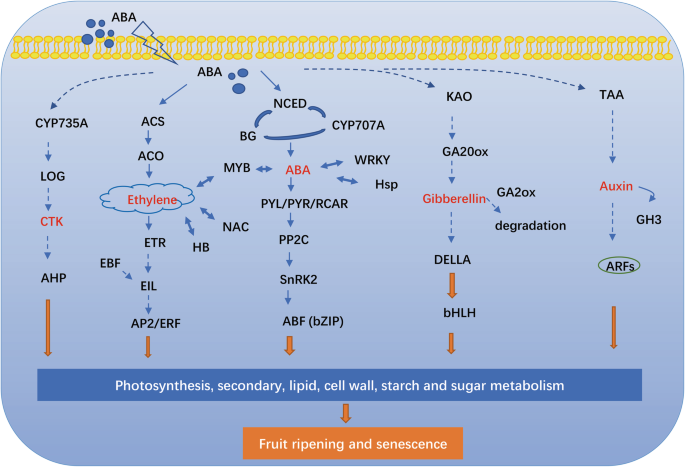
ABA在调节中国冬枣果实成熟的调控网络
本研究通过转录组数据分析了ABA与其他植物激素和转录因子之间的串扰(图2)。12).外源ABA促进了处理果实内源ABA的快速积累,但抑制了外源ABA的表达ZjNCED2,表明响应外源ABA的负反馈调节,就像这样的情况CsNCED1在柑橘类和LeNCED2在番茄20.,54].ZjBG4和ZjBG5而这两个基因在果实成熟过程中对ABA积累表现出正响应,这对调节ABA含量至关重要[11,23].相反,NDGA治疗促进了表达zjcyp707a1.但抑制ZjBG5,从而抑制了3dat ABA含量的增加。这些结果证实了转录平衡的作用数控,CYP707A,BG维持ABA积累[11,19].
我们还发现参与乙烯生物合成和感知的基因,包括ZjACS7,ZjACO3,ZjERS2, ABA上调;在番茄(LeACS2,LeACS4,LeACO1)和葡萄(vvaco1.),提示ABA可能是乙烯途径的上游调控因子[8,25,55].关于乙烯信号通路,ZjERS2ABA上调。表达量的增加是对与乙烯结合引起的受体降解的反应[63,64].信号通路相关的基因很少被治疗诱导,尽管表达ZjEBF2ABA上调基因表达。此外,EBF调节ethylene-insensitive存在(EIL.)在转录后水平上[65,66];因此,该结果也表明ABA间接调控乙烯信号通路。
在我们的研究中,涉及GA、生长素和细胞分裂素的生物合成、代谢和信号转导的几个基因的表达;Ga0ox.,CYP735A,日志,参与GA和细胞分裂素的生物合成;一个德拉参与GA信号转导的蛋白AHP.响应于外源ABA的涉及细胞素素信号传导的基因是下调的。阿巴也上调了表达GA2ox,这调节了GA的降解。此外,NDGA抑制基因的表达(TAA和GH3)参与生长素生物合成。有证据表明,GA,生长素,细胞分裂素和水果中减少草莓,葡萄成熟,和番茄[67,68,69].此外,用这些植物激素治疗的荔枝,草莓和甜樱桃果实抑制或延迟果实成熟过程[15,19,22,70].因此,ABA会与与成熟负相关的激素发生串扰。
在ABA和NDGA诱导的转录因子中,DEGs与AP2 /小块土地,n,WRKY,Bhlh.,Bzip.,乙肝,my,锌指蛋白,Hsf鉴定了TFS。这些TFS广泛参与果实代谢,例如植物激素代谢和信号传导,黄酮类化合物和花青素的积累,以及对压力的反应[6,71].外源ABA抑制了ABA的表达ZjERF34和ZjERF52,而在我们的上一项研究中,这些基因在成熟过程中被下调zjdreb1.被ABA上调,也被发现与成熟呈正相关[72].此外,两个Bzip.s被ABA下调,Zj。jz037039133作为ABA响应因子可能位于ABA信号的末端;该因子被认为参与调控葡萄中ABA和酚的积累[73].我们的研究还确定了由ABA和TF下调的6个MYB TFS,在调制果实着色和质地方面具有广泛的作用[74].大量的锌指蛋白是由外源性治疗所致,而c2hc锌指蛋白可以应对外源ABA诱导的氧化应激的抵抗力[75].我们还发现n基因被ABA上调,并被发现参与调控乙烯信号、果实色素沉着和果实软化[76].总体而言,这些TFS的鉴定为我们提供了广泛的了解ABA参与调节枣果实成熟的复杂调控,并且应在未来优先研究这些TFS的潜在机制。
结论
本研究全面揭示了ABA在枣树果实成熟中的作用,揭示了果实成熟的开始与内源ABA的积累呈正相关关系,内源ABA的积累受内源ABA表达之间的互作调控数控(ZjNCED3),CYP707A(zjcyp707a2.),BGs (ZjBG4,ZjBG5,ZjBG8,ZjBG9).由受体(Zjpyl8.),PP2Cs (ZjPP2C4,ZjPP2C5,ZjPP2C6,ZjPP2C7,ZjPP2C8),SnRK2s (ZjSnRK2-2和ZjSnRK2-5)在调节果实对ABA的敏感性方面起重要作用。此外,ABA在调节枣果实成熟过程中起主导作用,本研究进一步阐明了ABA相关代谢,并预测了枣果实成熟调控网络。这些发现将有助于进一步改进枣果实的贮藏策略,并有助于了解复杂的非更年期果实成熟过程。
方法
植物材料,治疗和储存
大众的水果z jujuba栽培品种‘东枣’,采自我们在中国大理徐庄的实验果园(N34.52, E109.56)的成年树。根据开花期(DAB)和果皮颜色的变化选择采样周期:15 DAB,幼果(YF);30 DAB,放大水果(E1);40轻拍,E2;55轻拍,E3;70轻拍,E4;85 DAB,白色成熟(WM);100 DAB,起始红(BR);110 DAB,半红(HR);115 DAB,全红色水果(FR)。 Three biological replicates of fifteen fruits were collected, and their weights were measured at each sampling period. The fruits were cut into small cubes, immediately frozen in liquid nitrogen, and stored at − 80 °C for subsequent experiments.
在WM期(成熟开始期),用手采收5株冬枣肉质果实。将果实置于15℃保存6 h,转移至实验室,用水清洗,室温(20℃)风干30 min。然后,将果实随机分为三组,浸泡在50 mg L的溶液中−1(±)-ABA (Sigma-Aldrich), 50 mg L−1NDGA (Sigma-Aldrich)或蒸馏水(对照)10分钟。处理后,每组果实均置于10 L无盖塑料容器中,20℃黑暗保存。取处理后第1、3、5、7、9天的果实切片,液氮冷冻,−80℃保存。
提取与内源ABA的判定
内源性ABA在4℃下萃取两次,使12小时从1.0g碎果,4ml 80%含有200mg L的甲醇−1500mg L−1一水柠檬酸[77].离心后上清混合,35℃氮气干燥.残留物溶解在0.8 mL的80%甲醇中,通过0.22 μm滤膜过滤。
ABA水平的定量是在以前发表的方法的基础上修改的[78],并采用高效液相色谱(LC-20AT,岛津,日本京都)和电喷雾串联质谱(QTRAP 5500, AB SCIEX,美国)进行测定。具体来说,采用C18色谱柱(2.1 × 150 mm, 5 μm, Eclipse XDB, Agilent, USA)在40℃分离ABA,溶剂梯度如下(溶剂a,甲醇;溶剂B, 0.05%甲酸):0-8分钟,30% B;8-15 min,线性增加至100% B;15-17分钟,100% B;17-22 min,线性降至30% B,流速为0.50 mL s−1进样量为10.0 μL。对于质谱分析,使用以下条件:IS, Turbo Spray(−),−4000;FP,−400;EP,−10;−4级;坏蛋,10;CAD、5;TEM, 450;GS1, 50;GS2, 55岁; and ihe, ON. The retention time and mass spectrometry information concerning ABA were determined with a standard substance ((±) ABA, Sigma-Aldrich), and the following conditions were ultimately selected: Q1, 263.3; Q3, 153.2; DP, − 24; and CE, − 16. External calibration curves were prepared using different concentrations of standard ABA dilution. Three independent biological replicates were prepared for each sample.
果实贮藏过程中呼吸速率和乙烯生成的测定
采用LI-6400XT光合作用系统(Lincoln, NE, USA),在0.45 L的圆柱形室内,空气流速为700 μmol s,测定每天14:00储存期间的呼吸速率−1.在ΔCO稳定变化2大约100克的水果被用来计算呼吸速率[79.].每个样品测量三个独立的生物学重复。
乙烯生产的萃取和测定是按照我们以前公布的方法进行的[7].乙烯收集方法:在室温下将约100克水果密封在0.5 L玻璃瓶中2小时,并将5ml顶空气体吸入20ml盛满水的青霉素瓶中[7].气体样品在储存期间每天采集,收集后一起测定。从青霉素瓶中取出一毫升气体注入气相色谱仪(Trace GC ULTRA2010, Thermo, USA),该色谱仪装有火焰电离检测器和Porapak 80-100填充柱(200 × 3 mm)。烘箱、进样器和检测器的温度分别为70、70和150℃。载气(N2H2流速分别为35、35和350 ml min−1,分别。每个样品测量三个独立的生物学重复。
ABA生物合成、代谢及信号通路相关基因的鉴定
基于红枣基因组数据集(https://doi.org/10.5061/dryad.83fr7) [80[ABA生物合成,代谢和信号通路基因被BLASTN和SMART分析鉴定并确认[81.].这些基因的序列信息列在附加文件中10.预测的蛋白质用葡萄,番茄的已知蛋白质序列对齐,并且拟南芥,对其序列进行KEGG分析(https://www.genome.jp/kegg/pathway.html).系统发育树数控,CYP707A,BG,PYR /所有/ RCAR,PP2C,SnRK2通过MEGA 7.0进行1000次bootstrap复制,使用邻居连接方法生成基因[82.].
RNA分离、cDNA文库构建及Illumina测序
在1 DAT(两个生物学重复)控制和ABA-和NDGA处理水果进行转录组测序。总RNA,使用植物的RNA提取试剂盒(Takara,大连,中国)分离,并用无RNA酶的DNA酶I其后,RNA的量通过分光光度分析测量消化,且其质量通过琼脂糖凝胶电泳进一步验证。A total of 3 μg of RNA per sample was used for cDNA library preparation with a NEBNext Ultra RNA Library Prep Kit (NEB, USA), and the resulting PCR products were purified and quantified on an Agilent Bioanalyzer 2100 system. Sample labeling was performed on a cBot Cluster Generation System using a TruSeq PE Cluster Kit v3-cBot-HS. Afterwards, the libraries were sequenced on an Illumina HiSeq PE150 platform. The raw sequencing data were subsequently submitted to the Sequence Read Archive (https://www.ncbi.nlm.nih.gov//sra/)(额外的文件11).
转录组测序数据的生物信息学处理
使用内部Perl脚本处理Illumina HiSeq X平台生成的原始测序数据,以去除包含适配器和poly-N高比率(> 10%)的低质量读取。同时计算干净数据的Q20、Q30和GC含量。随后,利用TopHat v2.0.9软件将洁净数据与参考枣树基因组序列进行比对[83.]并用于基因表达水平的定量通过HTSeq V0.6.1进一步处理[84.].相对基因表达丰度由外显子模型每千碱基每百万映射reads (RPKM)值估算,该值来自两个生物重复的平均值[85.].用于鉴定差异表达基因(DEGS),EDGER计划[86.在免费的在线数据分析平台OmicShare工具(http://www.omicshare.com/tools.),变化率(FC)阈值≥2,假发现率(FDR)≤0.05。edgeR的使用允许在两个重复内进行比较分析,它已在之前的几篇论文中使用[12,87.,88.].DEGs的功能富集是通过OmicShare平台上的基因本体(GO)和途径分析工具确定的[89.].我们还使用MapMan 3.6.0RC1软件来丰富deg假定的功能注释[90.,91.].
转录组表达水平的定量实时PCR验证
使用植物RNA提取试剂盒(TaKaRa)提取总RNA,然后使用PrimeScript RT试剂试剂盒和gDNA Eraser (TaKaRa)制备200 ng高质量RNA,合成第一链cDNA。采用总体积为10 μL的SYBR Premix Ex Taq II试剂盒(TaKaRa)进行qPCR,包含1.0 μL cDNA、5.0 μL SYBR Premix溶液、0.4 μL正向/反向引物和3.2 μL dH2O.使用以下条件设定roche LightCycler 96系统中的QPCR的热程序:95°C为30秒;40循环在95℃,58℃下的95℃,30秒和72℃的30秒的扩增循环;和默认的解离阶段。将每个基因的相对表达标准化为参考基因的相对化,Zjubq.(Zhang et al. 2015),最终采用2-△Ct方法(Livak和Schmittgen,2001)。用于定量PCR的引物序列中的其他文件中列出10.
统计分析
采用Duncan多量程检验(MRT)进行统计学分析p< 0.05水平,SPSS 19.0。图中的误差柱代表三个生物重复的标准差。
缩写
- 阳极氧化铝:
-
脱落醛氧化酶
- 阿坝:
-
脱盐酸
- ABA2:
-
黄氧脱氢酶
- ABA3:
-
钼辅因子sulfurtransferase
- 华:
-
1-aminocyclopropane-1-carboxylate氧化酶
- ACS:
-
1-aminocyclopropane-1-carboxylate合酶
- AHP:
-
histidine-containing磷酸转移酶
- AOG:
-
ABA-glucosyltransferase
- AP2 /小块土地:
-
APETALA2 / ethylene-responsive元素
- BG:
-
β-葡萄糖苷酶
- BR:
-
开始红色
- CYP707A:
-
ABA-8”-hydraxylase
- 轻拍:
-
盛开后的一天
- DAT:
-
天治疗后
- DEG:
-
差异表达基因
- 艾凡:
-
放大水果
- EBF:
-
乙烯不敏感的3-结合F-box
- EIN3 /面纱:
-
乙烯不敏感的存在
- 人:
-
乙烯反应
- ETR:
-
乙烯受体
- FC:
-
褶皱变化
- 罗斯福:
-
错误发现率
- FR:
-
全红色
- GA:
-
Gibberenllin
- GA20ox:
-
GA-20-氧化酶
- GA2ox:
-
GA-2-oxidase
- GH3:
-
格雷琴哈根3
- 去:
-
基因本体论
- HB:
-
同源框转录因子
- 人力资源:
-
有的则
- HSF:
-
热休克转录因子的
- 花王:
-
ent-kaurenoic酸羟化酶
- 日志:
-
细胞分裂素核苷5 ' -单磷酸磷酸水解酶
- MRT:
-
多个范围测试
- nc:
-
Nine-cis-epoxycarotenoid加双氧酶
- NDGA:
-
去甲二氢愈创木酸
- PP2C:
-
蛋白磷酸酶2摄氏度
- PYR /所有/ RCAR:
-
Pyrabatin电阻/电阻pyrabatin 1样/调控元件
- SnRK2:
-
蔗糖非发酵相关蛋白激酶2
- TAA:
-
色氨酸转氨酶
- TF:
-
转录因子
- WM:
-
白色的成熟
- YF:
-
幼果
- 齐柏林飞艇:
-
玉米黄质环氧酶
参考文献
- 1.
高庆华,吴春生,王敏Ziziphus Jujuba.轧机)。水果。综述了水果成分和健康益处的现有知识。中国农业科学。2013;61(14):3351-63。
- 2.
姚S.过去,现在和尤文图的福林 - 中国日期在美国。Hortscience。2013; 48(6):672-80。
- 3.
吴华,王胜,朱军,孟X,王东。采后处理对大枣贮藏品质的影响。见:刘丹主编。枣:一种传统的功能食品。第1版:博卡拉顿:CRC出版社;2016.p . 272 - 315。
- 4.
切里安S,菲格罗亚CR,奈尔H.“呼风唤雨”在果实成熟的调控。更年期与非跃变型果实的横清扫。J Exp Bot。2014; 65(17):4705-22。
- 5.
Leng P,Yuan B,Guo Y.脱落酸在果实成熟中的作用和对非生物胁迫的反应。J Exp Bot。2014; 65(16):4577-88。
- 6.
卡尔洛娃R,查普曼N,大卫·K,Angenent介绍GC,西摩GB,德Maagd RA。肉质果实发育和成熟的转录调控。J Exp Bot。2014; 65(16):4527-41。
- 7.
张Z,黄杰,李氏血管基因乙烯途径基因的转录分析。J植物理性。2018; 224-225:1-10。
- 8。
孙兰,张敏,任军,齐建新,张光军,冷鹏。果实成熟初期和收获后脱落酸与乙烯的相互作用。植物学报。2010;10(1):257。
- 9。
罗华,盛杰路,张超,丁勇,李智,孙勇,纪凯,王勇,李强,等。ABA在非更年期甜樱桃果实成熟和采后生命中的作用。植物生长规律。2014;33(2):373-83。
- 10.
王Y,吴y,段c,陈p,李q,戴S,sun l,ji k,sun y,xu w等。表达剖析cspyl.,CsPP2C和CSSNRK2黄瓜果实发育和干旱胁迫中的基因家族。acta botanica sinica(植物学报),2012;
- 11.
王永强,郭胜,田胜,张军,任勇,孙辉,龚刚,张辉,徐永华。西瓜果实成熟和品质性状进化的调控途径。《公共科学图书馆•综合》。2017;12 (6):e0179944。
- 12.
陈建军,毛玲,卢伟,应涛,罗志强。草莓果实采后对外源生长素和脱落酸的转录组分析。足底。2016;243(1):183 - 97。
- 13.
Mou W,Li D,Luo Z,Mao L,Ying T.转录组分析揭示了ABA在成熟过程中番茄果实中颜料,黄酮和抗氧化剂的次生代谢的可能影响。Plos一个。2015; 10(6):E0129598。
- 14.
Pilati S,Bagagli G,Sonego P,Moretto M,Brazzale D,Castorina G,Simoni L,Tonelli C,Guella G,Engelen K,等。脱落酸是葡萄浆果成熟发作的主要调节因子:对ABA信令网络的新见解。前植物SCI。2017; 8(1):1093。
- 15.
胡斌,李军,王德华,王华,秦勇,胡刚,赵建军荔枝果皮响应外源性细胞蛋白和脱落酸。植物生长调节。2017; 84(3):437-50。
- 16.
李丹,李丽,罗智,牟伟,毛玲,应涛。转录组比较分析揭示了脱落酸对草莓果实成熟过程中色素、抗坏血酸和叶酸代谢的影响。《公共科学图书馆•综合》。2015;10 (6):e0130037。
- 17.
孙丽,孙云飞,张敏,王丽,任军,崔明敏,王艳萍,季凯,李鹏,李强,等。9-顺式环氧类胡萝卜素双加氧酶编码脱落酸生物合成的关键酶,抑制该酶可改变转基因番茄的果实质地。植物杂志。2012;158(1):283 - 98。
- 18。
王y,陶x,唐xm,小l,sun jl,yan xf,li d,邓hy,ma xr。番茄的比较转录组分析(茄属植物lycopersicum)对外源脱落酸的反应。BMC基因组学。2013;14(1):841。
- 19。
麦地那-Puche L,兰科-波塔莱斯R,莫利纳-Hidalgo的FJ,Cumplido-拉索G,加西亚 - 卡帕罗斯N,Moyano的-Canete的E,Caballero的-Repullo JL,Munoz的-Blanco的Ĵ,罗德里格斯佛朗哥A.广泛转录的研究角色在发展脱落酸和生长素发挥和草莓果实成熟。Funct综合基因组学。2016; 16(6):671-92。
- 20.
牟伟,李丹,卜杰,姜勇,汗祖,罗智,毛玲,应涛。ABA对番茄果实成熟过程中乙烯生物合成及信号转导的影响。《公共科学图书馆•综合》。2016;11 (4):e0154072。
- 21.
Murcia G,Pontin M,Piccoli P.ABA和Gibberellin A3在糖转运蛋白基因表达模式中的作用和vitis Vinifera cv中的转化酶。马尔贝克在浆果成熟期间。植物生长调节。2017; 84(2):275-83。
- 22.
Estrada-Johnson E, Csukasi F, Pizarro CM, Vallarino JG, Kiryakova Y, Vioque A, Brumos J, Medina-Escobar N, Botella MA, Alonso JM,等。草莓果实的转录组分析揭示了成熟花托中生长素的活性生物合成和信号转导。植物学报。2017;8(1):889。
- 23.
王勇,王勇,纪凯,戴胜,胡勇,孙丽,李强,陈鹏,孙勇,段超,等。脱落酸在黄瓜果实发育成熟中的作用及其转录调控。植物生理生化学报。2013;64(5):70-9。
- 24.
库恩N,关L,戴ZW,吴BH,Lauvergeat V,戈麦斯E,李SH,戈多伊楼阿尔塞 - 约翰逊P,Delrot S.浆果成熟:最近小道消息听到。J Exp Bot。2014; 65(16):4543-59。
- 25.
张敏,冷鹏,张刚,李昕9-cis-epoxycarotenoid加双氧酶(数控在桃和葡萄果实中编码脱落酸生物合成期间编码关键酶的基因。J植物理性。2009; 166(12):1241-52。
- 26。
赵少林,齐建新,段春荣,孙丽,孙玉峰,王艳萍,季凯,陈鹏,戴淑娟,冷鹏DkNCED1,DkNCED2和DkCYP707A1在柿子果实成熟期间调节淤积酸性稳态的基因。j hortic sci biotechnol。2012; 87(2):165-71。
- 27。
季凯,陈鹏,孙丽,王艳萍,戴淑娟,李强,李鹏,孙艳飞,吴勇,段春荣,等。草莓的非更年期成熟与阿巴,FaNCED2和FACY7A1..植物生态学报。2012;39(4):351。
- 28。
姬K,开W,赵B,孙勇,原B,戴S,李Q,陈平,王Y,裴Y,等人。SlNCED1和SlCYP707A2:番茄果实成熟过程中ABA代谢的关键基因。J Exp Bot. 2014;65(18): 5243-55。
- 29。
贾HF,柴YM,李CL,陆d,罗JJ,秦升,沉YY。脱落酸起着草莓果实成熟的调节具有重要作用。植物理性。2011; 157(1):188-99。
- 30.
杨志强,王志强。脱落酸的生物合成与代谢。植物学报。2005;56(1):156-85。
- 31.
罗德里戈MJ, Alquezar B, Zacarias L.克隆和鉴定两个9-cis-epoxycarotenoid加双氧酶基因,在果实成熟期间和uhange utory(素类l .等)。中国农业科学。2006;57(3):633-43。
- 32.
侯永林,孟K,韩勇,班奇勇,王斌,索金堂,吕建勇,饶建平。柿子9脂加氧酶基因DkLOX3在促进衰老和增强对非生物压力的耐受性方面发挥阳性作用。前植物SCI。2015; 6(1):360-438。
- 33.
Saito S, Hirai N, Matsumoto C, Ohigashi H, Ohta D, Sakata K, Mizutani M。拟南芥CYP707AS编码(+)-脱落酸8 ' -羟化酶,是脱落酸氧化分解代谢的关键酶。植物杂志。2004;134(4):1439 - 49。
- 34.
关键词:桑椹果实,脱落酸,8 ' -羟基化酶,cdna,表达acta botanica sinica(云南植物研究),2016;43(1):1 - 5。
- 35.
徐志勇,李国宏,董涛,郑成杰,Jin JB, Kanno Y, Kim DH, Kim SY, Seo M, Bressan RA,等。具有葡萄糖共轭脱落酸水解活性的空泡-葡萄糖苷酶同源物在渗透胁迫反应中起重要作用拟南芥.植物细胞,2012;24(5):2184 - 99。
- 36.
李Q,ji k,sun y,罗h,王h,leng p.的作用FaBG3对草莓果实成熟和灰霉病的影响。植物j . 2013; 76(1):巢族。
- 37.
Karppinen K,Hirvela E,Nevala T,Sipari N,Suokas M,Jaakola L.在果实发育过程中脱离酸水平和相关基因表达的变化,越橘成熟(varcinium myrtillus.l .)。植物化学。2013;95(6):127 - 34。
- 38.
林PC,Hwang SG,Endo A,Okamoto M,Koshiba T,Cheng Wh。异位表达脱落酸2/葡萄糖不敏感1在拟南芥促进种子休眠和抗逆性。植物杂志。2007;143(2):745 - 58。
- 39.
脱落醛氧化酶3基因的两个新等位基因揭示了其在种子脱落酸合成中的作用。植物杂志。2004;135(1):325 - 33所示。
- 40.
徐M,青木H,小井H,神谷Y,南原E,越叶t拟南芥醛氧化酶(AAO)基因家族揭示了其主要作用AAO3ABA在种子生物合成中的作用。植物生理学报。2004;45(11):1694-703。
- 41.
熊亮,石谷明,李华,朱家杰。这拟南芥LOS5 / ABA3该位点编码一个钼辅助因子硫酶并调节冷胁迫和渗透胁迫响应基因的表达。植物细胞。2001;13(9):2063 - 83。
- 42.
Romero P,Lafuente Mt,Rodrigo MJ。柑橘ABA信号组:甜橙果实成熟和叶片脱水期间的鉴定和转录调节。J Exp Bot。2012; 63(13):4931-45。
- 43.
孙丽,王艳萍,陈鹏,任杰,季凯,李强,李鹏,戴淑娟,冷鹏SlPYL,SlPP2C,SlSnRK2番茄果实发育和干旱胁迫过程中ABA信号核心成分的基因家族acta photonica sinica . 2011;62(15): 5659-69。
- 44.
柴玉梅,贾海峰,李春林,董庆华,申媛媛。FaPYR1与草莓果实成熟有关。acta photonica sinica . 2011;62(14): 5079-89。
- 45.
梅洛S,Gosti女,Guerrier d,Vavasseur A,Giraudat J的Abi1.和Abi2.蛋白磷酸酶2C作用于脱落酸信号通路的负反馈调节回路。植物j . 2001; 25(3): 295 - 303。
- 46.
Santiago J, Rodrigues A, Saez A, Rubio S, Antoni R, Dupeux F, Park SY, Marquez JA, Cutler SR, Rodriguez PL.脱落酸受体对抗旱性的调节Pyl5.通过抑制进化枝aPP2Cacta botanica yunnanica(云南植物研究);2009;60(4):575-88。
- 47.
陈鹏,孙宇飞,凯文斌,梁波,张玉生,翟晓伟,姜玲,杜耀文,冷鹏。ABA信号核心组分的相互作用(英文)SlPYL年代,SlPP2C年代,SlSnRK2收费)番茄(茄属植物lycopersicon).J植物理性。2016; 205(1):67-74。
- 48.
Gambetta GA, Matthews MA, Shaghasi TH, McElrone AJ, Castellarin SD。糖和脱落酸信号在葡萄成熟开始时被激活。足底。2010;232(1):219 - 34。
- 49.
维拉德女,Rubio的S,Rodrigues的A,Sirichandra C,贝林C,罗伯特N,梁Ĵ,Rodriguez的PL,洛里埃C,梅洛S.蛋白磷酸酶2C调节的Snf1相关激酶的活化OST1脱落酸在拟南芥.植物细胞。2009;21(10):3170 - 84。
- 50。
苹果乙烯产生的信号转导机制马吕斯×释放有)果实发育和成熟。北京:中国农业大学;2014年。
- 51。
韩勇,党瑞,李建新,姜建柱,张宁,贾金荣,魏立正,李志强,李宝宝,贾文生。蔗糖NONFERMENTING1-RELATED PROTEIN KINASE2.6,与OPEN STOMATA1同源,是草莓果实发育和成熟的负调控因子。植物杂志。2015;167(3):915 - 30。
- 52.
壳聚糖/纳米二氧化硅/海藻酸钠复合膜对冬枣采后色泽及品质的影响Zizyphus jujuba轧机。简历。冬枣)。食品化学。2019;270:385 - 94。
- 53.
Creelman RA, Bell E, Mullet JE。脂氧合酶类酶在脱落酸生物合成中的参与。植物杂志。1992;99(3):1258 - 60。
- 54.
关键词:柑橘,果实成熟,外源脱落酸,基因表达,果实成熟Sci Hortic-Amsterdam。2016, 201(1): 175 - 83。
- 55.
张敏,袁波,冷鹏。ABA在番茄果实乙烯合成和成熟中的作用。中国农业科学。2009;60(6):1579-88。
- 56.
Palumbo的MC,泽诺尼S,FASOLI男,Massonnet男,里纳L,郎世宁楼Pezzotti男,太平洋P.集成网络分析识别打俱乐部节点作为一类集线器包围键推定开关基因葡萄发育过程中诱发的主要转录重编程.植物细胞。2014; 26(12):4617-35。
- 57.
拉玛昌德拉雷迪A,切塔尼亚KV,Vivekanandan M.干旱诱导在高等植物的光合作用和抗氧化代谢的响应。J植物理性。2004; 161(11):1189-202。
- 58.
脱落酸的施用时间和浓度对红地球葡萄品质的影响。中国科学:地球科学(英文版)。
- 59.
脱落酸刺激赤霞珠葡萄果实的成熟和基因表达。功能基因组学。2010;10(3):367-81。
- 60.
韩旭,卢文伟,魏晓霞,李丽,毛玲,赵艳艳。外源ABA对猕猴桃伤部分化的影响。J蛋白质组。2018;173(1):42-51。
- 61.
果胶甲基酯酶和聚半乳糖醛酸酶在葡萄果皮发育中的作用。植物生理学与生物化学。2008;46(7):638-46。
- 62.
黄海辉,谢士德,肖庆林,魏斌,郑丽娟,王玉波,曹勇,张晓刚,龙道道,胡玉峰等。蔗糖和ABA通过一种新的转录因子调控玉米淀粉的生物合成,ZmEREB156.中国科学(d辑):地球科学(英文版)
- 63.
Klee HJ, Giovannoni JJ。番茄果实成熟和品质性状的遗传与控制。acta photonica sinica . 2011;45(1): 41-59。
- 64.
Seymour GB, Ostergaard L, Chapman NH, Knapp S, Martin C.果实发育与成熟。植物学报。2013;64(1):219-41。
- 65.
郭HW,埃克JR。到乙烯气体植物响应由介导的自洽场(EBF1/EBF2)依赖的蛋白水解EIN3转录因子。细胞。2003;115(6):667 - 77。
- 66.
杨勇,吴勇,pirello J, Regad F, Bouzayen M,邓伟,李铮Sl-EBF1和Sl-EBF2表达导致组成型乙烯反应的表型,加速植物衰老,和水果西红柿催熟。J Exp Bot。2010; 61(3):697-708。
- 67.
植物激素之间的动态相互作用对果实发育、成熟和成熟是必需的。植物科学学报,2013;4(79):79。
- 68.
srivastava a,handa ak。番茄果实发展的激素调节。分子视角。J工厂增长调节。2005; 24(2):67-82。
- 69.
西蒙总经理,蔡永杰,罗斯JJ, Quittenden LJ,戴维斯NW,里德JB。草莓非更年期成熟过程中的激素变化。中国生物医学工程学报。2012;63(13):4741-50。
- 70.
Kappel F, MacDonald RA。赤霉酸可以增加果实的硬度,增大果实的大小,延迟甜樱桃的成熟。中国科学(d辑:地球科学)2002;56(4):210-22。
- 71.
wu jx,ll f,yi hl。宽的基因组鉴定参与的转录因子柑橘类一个晚熟甜橙突变体及其野生型转录组的果实成熟。《公共科学图书馆•综合》。2016;11 (4):e0154330。
- 72.
张泽,李XG。基因组识别AP2 /小块土地大枣超家族基因及其在果实成熟过程中的表达。Sci Rep-Uk。2018(8): 15162。
- 73。
基础亮氨酸拉链转录因子脱落酸反应元件-结合因子2是脱落酸依赖的葡萄果实成熟过程中重要的转录调控因子。植物杂志。2014;164(1):365 - 83。
- 74。
谢XB,李S,张RF,赵Ĵ,陈YC,赵Q,姚YX,你CX,张XS,郝YJ。这Bhlh.转录因子MdbHLH3促进花青素积累和果实颜色响应低温苹果。植物学报。2012;35(11):1884-97。
- 75。
张浩,刘亚平,文芳,姚德明,王磊,郭杰,倪磊,张安,谭明民,姜美明。ZFP36是一种新型的水稻c2h2型锌指蛋白,在水稻脱落酸诱导的抗氧化防御和抗氧化应激中起关键作用。[J] .机器人。2014;65(20):5795-809。
- 76.
Ma N,Feng H,Meng X,Li D,杨D,吴C,萌Q.番茄SLNAC1Transcription因子的过度表达改变了果实色素沉着和软化。BMC植物BIOL。2014; 14(1):351。
- 77.
施卫国,李辉,刘天祥,Polle A,彭超,罗志斌。外源脱落酸减轻锌的吸收和积累Populus x canescens.接触过量的锌植物学报。2015;38(1):207-23。
- 78.
PAN X,WELTI R,王X.高效液相色谱 - 质谱法测定原油植物提取物的主要植物激素的定量分析。NAT PROTOC。2010; 5(6):986-92。
- 79.
Fugate KK, Suttle JC, Campbell LG。乙烯的产生和乙烯对采后甜菜根呼吸速率的影响。中国农业科学(英文版);2010;56(1):71-6。
- 80.
黄杰,张春明,赵旭,费志军,万克坤,张智,庞晓明,尹旭,白勇,孙晓强,等。枣树基因组提供了基因组进化和驯化果树的甜味/酸味的见解。公共科学图书馆麝猫。2016;12 (12):e1006433。
- 81.
Letunic I, Doerks T, Bork P. SMART。2015年最新情况、新发展和现状。核酸Res. 2015;43(数据库版):D257-60。
- 82.
MEGA7:用于更大数据集的分子进化遗传学分析7.0版本。生物化学学报。2016;33(7):1870-4。
- 83.
Trapnell C, Pachter L, Salzberg SL. TopHat:用RNA-Seq发现剪接连接。生物信息学,2009,25(9):1105 - 11所示。
- 84.
Anders S, Pyl PT, Huber W. HTSeq—一个用于处理高通量测序数据的Python框架。生物信息学,2015,31(2):166 - 9。
- 85.
Mortazavi A,威廉姆斯BA,麦丘K,谢弗L,沃尔德B.映射和由RNA-SEQ定量哺乳动物转录。纳特方法。2008; 5(7):621-8。
- 86.
罗宾逊医学博士,麦卡锡DJ,史密斯GK。edgeR: Bioconductor包,用于数字基因表达数据的差异表达分析。生物信息学,2010,26(1):139 - 40。
- 87.
西瓜的转录组分析Citrullus lanatus)水果回应黄瓜绿斑驳花叶病毒(CGMMV)感染。Sci Rep-UK。2017; 7(1): 16747。
- 88.
翟锐,冯勇,王华,詹晓霞,沈鑫,吴伟,张勇,陈东,戴刚,杨振等。水稻根系杂种优势的RNA-Seq转录组分析。BMC基因组学。2013;十四19。
- 89.
李胜,朱胜,贾强,袁东,任超,李凯,刘胜,崔勇,赵辉,曹勇,等。美洲蟑螂发育可塑性的基因组和功能景观。Nat Commun。2018;9(1):1008。
- 90。
Thimm O,Blasing O,Gibon Y,Nagel A,Meyer S,Kruger P,Selbig J,Muller La,Rhee Sy,STITT M. Mapman:一个用户驱动的工具,用于显示基因组学数据集到代谢途径和其他生物学图流程。工厂J. 2004; 37(6):914-39。
- 91。
Usadel B, Poree F, Nagel A, Lohse M, Czedik-Eysenberg A, Stitt M.使用MapMan可视化和比较植物组学数据的指南:作物物种玉米的一个案例研究。植物学报。2009;32(9):1211-29。
致谢
不适用。
资金
科技部国家重点研发计划项目(no . 2018YFD1000607)。关键词:岩石力学,蠕变,蠕变特性,蠕变特性支持者在设计、收集、分析、解释相关数据或撰写手稿中没有发挥任何作用。
数据和材料的可用性
本研究中产生或分析的所有数据均包含在本文及其附加文件中。
作者信息
从属关系
贡献
ZZ和XL构思和设计了实验。ZZ进行了样品准备并进行了所有实验,数据分析并写了稿件。CK和SZ参与了采后储存期间的水果呼吸和乙烯生产的测定。ZZ和XL促成了讨论。所有作者均认批准了最终手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
额外的文件1:
RNA-seq数据统计信息。(XLSX 11 kb)
额外的文件2:
映射数据的统计信息。(XLSX 11 kb)
额外的文件3:
在DAT1对deg进行GO浓缩。(XLSX 17 kb)
附加文件4:
在DAT1位点富集DEGs (Level3)的KEGG通路。(XLSX 27 kb)
额外的文件5:
MapMan检测到与代谢途径相关的DEGs。(XLSX 68 kb)
额外的文件6:
与激素代谢和信号转导相关的基因。(XLSX 21 kb)
附加文件7:
与熟练调节中涉及的转录因子相关的DEG。(XLSX 27 kb)
额外的文件8:
RT-qPCR验证RNA测序显示的数字表达模式。选取17个基因,通过qPCR验证其转录组表达。RNA-seq数据与相对表达量的相关系数为0.838-1.0,验证了RNA数据的可靠性。多克斯(241 kb)
额外的文件9:
NCED、CYP707A、BG、PYR/PYL/RCAR、PP2C和SnRK2基因的系统发育分析。利用MEGA 7.0软件将拟南芥、葡萄和番茄的推测蛋白进行多重比对,生成树。Bootstrap值设置为1000 (Kumar et al. 2016)。多克斯(983 kb)
额外的文件10:
ABA途径基因序列。(XLSX 124 kb)
额外的文件11:
加入提交到NCBI序列读档案(SRA)的干净读。(XLSX 10 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
张,Z.,康,C.,章,S.et al。转录本分析揭示了脱落酸在调节枣果实成熟中的综合作用。BMC植物杂志19,189(2019)。https://doi.org/10.1186/s12870-019-1802-2
收到了:
接受:
发表:
关键字
- 枣树(Ziziphus Jujuba.)
- 脱盐酸
- 水果成熟
- Non-climacteric
- 转录组测序