- 研究文章
- 开放访问
- 发表:
的分子细胞遗传学特征Elytrigia×mucronata的自然杂交e .媒介物和大肠被(Triticeae,Poaceae)
BMC植物生物学体积19.文章编号:230.(2019年)
摘要
背景
种间杂交产生的多倍体是植物进化的主要驱动力之一。在这里,我们提供了三种细胞类型的分子细胞遗传学分析数据Elytrigia×mucronata使用序列荧光(5S rDNA、18S rDNA和pSc119.2探针)和基因组原位杂交(四种二倍体类群基因组探针,即山羊草属那Dasypyrum那部落和伪纪念碑).
结果
同时存在部落(下降大肠被),Dasypyrum+山羊草属(下降e .媒介物)所有细胞类型的染色体集合E.×mucronata确认了分析的植物的假定杂交起源。观察到以下不同的基因组结构E.×mucronata.六倍瓣植物展示了三种染色体伪纪念碑和一个染色体设置Aegilops,Hordeum和Dasypyrum.七倍体植物患有六个染色体组六倍体植物和另外的染色体伪纪念碑染色体集。非平面细胞型在其基因组构成中不同,反映了通过减少和未更新的配子的融合来反映不同的起源。重复序列的杂交模式(5S rdNA,18s rdNA和PSC119.2)E.×Mucronata.在细胞类型之间和细胞类型内部都不同。在七倍体和一些非倍体植物中都发现了未在亲本种中发现的染色体变异。
结论
结果证实,同性恋杂交和异质杂交杂交,导致单个杂种基因组内的四种不同的单格的共存存在ElytrigiaAllopolyploids。在七倍体和一些非平面植物中观察到的染色体改变表明,在杂交种植的过程中和/或之后发生基因组重组。此外,在一个非二倍体中检测到一个特殊的染色体易位,表明它不是一个初级杂种。因此,至少一些杂种是肥沃的。杂交中Triticeae异源多倍体对基因组多样性的贡献明显而显著。不同的亲本单倍体结合染色体改变,可以形成独特的谱系,从而为选择提供原料。
背景
杂交和多倍化是植物演进的主要驱动力[1那2那3.那4.].虽然基因组合并的杂交可能导致新的杂交物种的形成,但多倍体化可以稳定杂交育种行为[5.].
同一倍性水平的物种之间可以发生杂交(同倍体杂交),不同倍性水平的物种之间可以发生杂交(异倍体杂交)。无论哪种情况,新杂交种的形成都需要杂种与亲本之间存在繁殖障碍。在没有生殖障碍的情况下,新形成的杂交种可以与一个或两个亲本种回交,形成杂交种群[6.].
新形成的杂种具有新的基因组组合,可以表现出某些特性(杂种活力或杂种优势)的改善或增强。然而,由于杂合子比例的降低,杂种的活力在后代的每一代中都有所下降。
AllopolyProidation,即染色体组在杂种中的乘法,是可以避免混合动力活力的衰减的机制。在所有多聚染色体的强制配对和有限的联合组重组的强制配对,杂种优势的优点在很大程度上保留了[1].
在交配过程中未减数配子的参与被认为是多倍体起源的主要机制[7.].其他多倍体形成机制包括多精子(更多雄性配子受精;[8.)和(体细胞)基因组加倍[9.].因此,已建立的海量倍数可以在多倍体复合物中产生高倍的倍性水平细胞型。
多倍体杂交形成后发生的变化包括在分子、染色体和有机体水平上的各种过程[10.].以前分离的基因组共存后通常会发生染色体重组,这不仅会导致基因组合并,还会导致基因组变异[11.].
部落Triticeae是一个广泛研究的禾草群,其中杂交和多倍体化对当今的多样性有重要贡献。根据分类的不同,Triticeae由27-37属约350-500种分类群组成[12.那13.那14.].总共有23个基本基因组,Löve占据了他们作为Haplomes [13.].
基本染色体数量Triticeae是X= 7。大多数物种是异源多倍体,倍性水平从四倍体(2n = 4x)到十二倍体(2n = 12x)不等。当某些单胞体参与了多于一个异源多倍体物种的形成时,该部落的结构是网状的[13.].
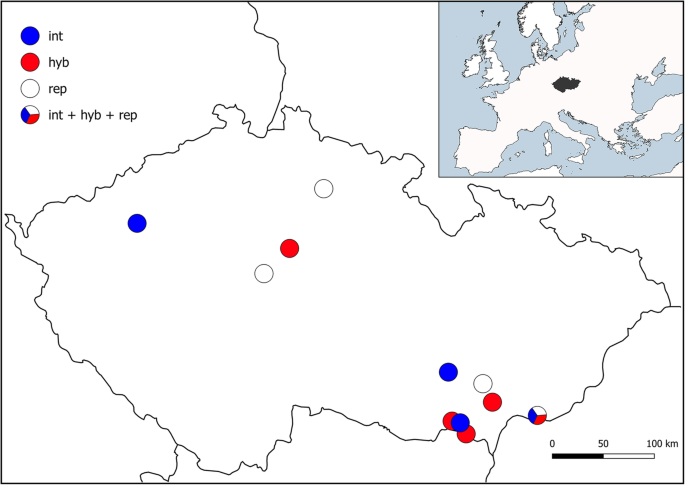
Elytrigia×mucronata(opiz)prokudin [syn。Agropyron mucronatumopiz,大肠apiculata(Tscherning)jirásek]这项研究的主题,是一种自然的杂交e .媒介物(主机)nevski [syn。Elymus hispidus.(opiz)melderis,薄孔中间(主机)Barkworth&D.r.杜威]和大肠被(l)(syn·涅夫斯基。elymus repens.(l)古尔德]。在研究区(捷克共和国),两个亲本物种主要以六倍体(2n = 6x = 42)出现,但少数非单倍体细胞型(2n = 9x = 63)记录大肠被[15.那16.].六倍体之间的自然杂交e .媒介物和大肠被似乎是常见的并且是双向的,并且已经找到了回复的证据[16.].因此,该物种复合物中没有明显的生殖障碍。除了普遍的六倍倍增物E.×mucronata在美国,具有较高倍性的杂交种很少出现,一个居群有七倍体(2n = 7x = 49),三个居群有非二倍体。非单倍体杂交种的起源被认为涉及未减少配子和减少配子的融合,其中未减少配子由亲本物种或其杂种提供[16.].庚醇的起源是未知的。
父母种类都是常年的所有聚氯倍过多倍数,复杂的进化历史[17.那18.那19.那20.].六倍体的组成Elytrigia被假设基因组包括两个亚基因组起源于伪纪念碑(单倍体符号St)和一个亚基因组起源于部落(H)(基因组公式StStStStHH)。除了基因组的主要组成部分大肠被基因组包含了来自内部和外部的其他血统的线索Triticeae,证明该物种必须从遥远的来源获得额外的遗传物质[17.那18.那21].发现的一部分异物遗传物质大肠被从亲代物种遗传而来[22].
六倍体中间麦草的基因组构成e .媒介物尚未令人满意地解决(有关讨论,请参阅[20.那23])。已经达到了一种共识,这些物种由三种不同的亚因子组成,其中一个是源自的伪纪念碑(圣)。另外两个亚基因组的身份仍然存在争议,特别是由于假设来自薄胆汁Bessarabicum(E.B.),Th。elongatum(E.E.),Dasypyrum(V),秘书长(R)和山羊草属(d)[19.那20.那23那24].在这方面,不能完全排除潜在的局部品种的存在。然而,来自捷克共和国本土中央欧洲标本的分析(来自学习的杂种症起源的相同区域)明确建议贡献Dasypyrum(v)和山羊草属(d)[19.那23].因此,我们得出结论,这些属代表该类多元倍数素中的另外两种亚因素的供体,因此我们假设基因组公式e .媒介物是ststddvv。
分子细胞遗传学技术为杂种植物的基因组构成研究提供了新的可能性。特别是,基因组原位杂交(GISH)适合于研究异源多倍体物种的起源(例如,18.那25])。此外,可以在AlloPropyproids中检测数值和结构染色体改变(特别是骨髓组型易位)[26那27].此外,使用已知的重复序列作为染色体标记的原位杂交(鱼类)的荧光提供了关于它们在基因组内的物理定位的信息,并允许我们在多倍化事件发生后研究基因组重组[28那29].
在本研究中,我们对异源多倍体杂种的三种细胞类型进行了分子细胞遗传学分析E.×mucronata为了在杂合形成后阐明其基因组结构并阐明它们的基因组动力学。特别地,使用序贯的GISH和鱼类揭示(1)六倍倍增,庚醇和非平面细胞型的基因组结构E.×mucronata;(2)所研究基因型的染色体改变;(3)核糖体5S和18S rDNA单位的变化规律Triticeae-特异性重复pSc119.2,主要与它们被分配到特定的haplomes有关。
结果
本研究的植物材料可在以前的研究中找到[15.那16.].实验对象为2个六倍体(2n = 6x = 42)、2个七倍体(2n = 7x = 49)和3个非二倍体(2n = 9x = 63)。elytrigia×mucronata.来自五个中欧地方的植物(表1, 图。1).而六倍体和非倍体植物在以前的研究集中在基因组大小变异和自然杂交([15.那16.];详细资料见《方法植物材料》),首次对其进行了研究。根据形态学、流式细胞仪和ITS诊断标记对这些植物进行了鉴定[15.那16.].
六倍体Elytrigia×mucronata
基因组组成
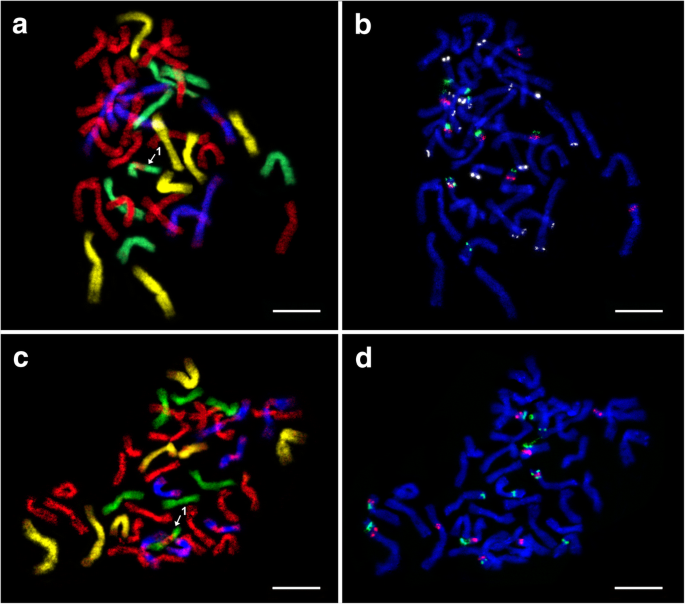
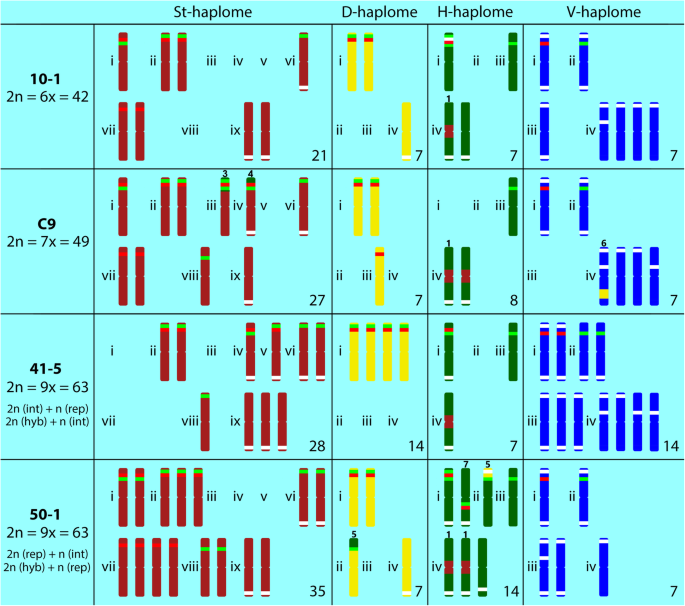
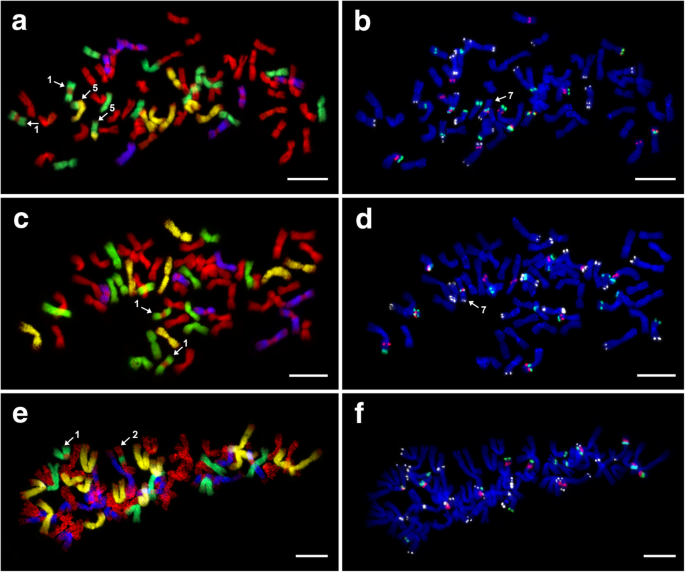
我们分析了两个六倍倍增(2n = 6x = 42)E..×mucronata植物。植物10-1和17-4源自地方“PavíVRCH”和“Vrbčany”(表1).经过GISH后,我们观察到两种被分析植物的杂交模式相同,其中21 St (伪纪念碑) + 7h (部落) + 7 d (山羊草属)+ 7 v(Dasypyrum)染色体(图。2a和c;桌子2).焦化区域中缺少一个信号Dasypyrum标记染色体。我们目前不相信这种模式是染色体易位的迹象。相比之下,只有一个部落-标记的染色体表现出a伪纪念碑探针信号在着丝粒区,提示存在基因组间易位(图。2a,c和3.).
六倍体的有丝分裂中期染色体E.×Mucronata.经过连续FISH和GISH实验.一种和C植物GISH 10-1和17-4:Aegilops Tauschii.(地高辛,抗dig - fitc,黄色假色),杜鹃花绒毛索姆(生物素,链霉抗生物素蛋白-CY3,蓝色伪焦型)、大麦bogdanii(生物素,链霉抗生物素蛋白-Cy3,绿色伪焦型),和Pseudoroegneria spicata(Cy5,红色)。B.和D.植物中的FISH 10-1和17-4:5S rDNA (Cy5,红色),18S rDNA(地高黄素,anti-DIG-FITC,绿色),和pSc119.2 (Cy3,白色假色;FISH后,用DAPI对染色体进行反染色。结构染色体改变用数字(1)表示。比例尺= 10 μm
染色体结构变异
在植物10-1中,其中施加完整的鱼探针,5s rDNA,18s RDNA和PSC119.2信号位于所有染色体组(HAPLOMES;图。2乐队3.;桌子2),在该植物中分别观察到9个、10个和18个探针杂交位点。伪纪念碑- 标记的染色体(ST haplome)携带五个5s和四个18s rdNA位点。5S RDNA在三种染色体上与18秒的RDNA共定;在这些染色体中的两种中,5S rdNA基因座位于近端至18s rdNA,并且在其中一个rDNA轨迹位于与18s rdna的远端。另外,携带两种染色体携带孤立亚细胞体5s rdNA基因座和携带子调节18s rdna基因座的单个染色体。在这内山羊草属-标记的染色体(D单倍体),我们检测到两条染色体具有共同定位的5S和18S rDNA位点,后者位于前者的远端。这部落- 标识的染色体(H haplome)携带一个5s rdNA位点和三个18s的RDNA位点。在其中一种染色体上,存在含有双18S rDNA位点的共定位的RDNA基因座,其中介入5S rDNA位点(18℃-5S-18s)。V haplome,对应Dasypyrum,位于单独的染色体上的单次5S和18S rdNA位点。
与检测到的位点数量相比,pSc119.2的FISH显示出不比例(图)。2b;桌子2).这伪纪念碑- 标记的染色体载有三个PSC119.2位点,其中一个位于染色体上,染色体上携带在相对的臂上的单个18s RDNA基因座。在终端区域中检测到终端区域中的单个PSC119.2杂交位点山羊草属标记染色体。H单倍体来自部落携带三个psc119.2基因座。这些基因座中的两个仍居住在缺乏RDNA位点的染色体上,而第三位位于共局部化的RDNA基因座内。七Dasypyrum-标记的染色体共携带11个pSc119.2杂交位点。其中3条染色体两端均有pSc119.2位点,1条染色体在同一染色体臂上有2个位点;其他染色体在染色体的一端只有一个位点。
另一株六倍体植物(17-4)在rDNA探针FISH分析中观察到稍有不同的模式。还有另外三个18S rDNA位点伪纪念碑- 标记的染色体和另外的5S rdNA位点山羊草属- 标记的染色体(图。2c和d;桌子2).获得的结果令人信服地表明,六倍瓣植物在六倍体之间是杂种的e .媒介物和大肠被.
七倍体Elytrigia×Mucronata
基因组组成
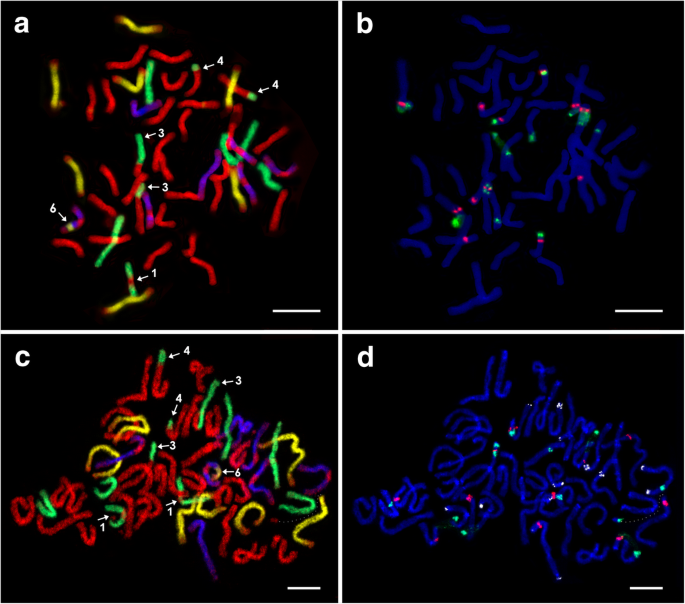
两个七倍体(2n = 7x = 49)E..×mucronata植物C9和C25B,都来自于本地的Čertoryje(表1),进行分析。两个七倍体在GISH后的探针杂交模式略有不同。此外,在C25B植物中发现了28条St + 7h + 7d + 7v染色体。4.a),而植物C9显示27st + 8h + 7d + 7v染色体(图。4.C)。类似于六倍倍细性,其中五个Dasypyrum-标记的染色体在着丝点区域缺乏探针信号。在这两种被检测的植物中都检测到涉及所有四个蛋白单体的数个易位。易位在单独的一章中描述(见下文)。
七倍体的有丝分裂中期染色体E.×Mucronata.经过连续FISH和GISH实验.一种和CGISH在植物C25B和C9:Aegilops Tauschii.(地高辛,抗dig - fitc,黄色假色),杜鹃花绒毛索姆(生物素,链霉抗生物素蛋白-CY3,蓝色伪焦型)、大麦bogdanii(生物素,链霉抗生物素蛋白-Cy3,绿色伪焦型),和Pseudoroegneria spicata(Cy5,红色)。B.和D.植物中的鱼C25B和C9:5S RDNA(CY5,红色),18S rDNA(Digoxigenin,抗-Pitc,Green)和PSC119.2(Cy3,白色假型 - 仅在C9-D中施用)。鱼后,染色体用DAPI染色。不同类型的结构染色体改变用数字表示(1,3,4,6)。染色体段破碎了山羊草属染色体由虚线(c、d)连接,比例尺= 10 μm
染色体结构变异
与六倍体相比,额外的染色体的贡献反映在重复探针标记的染色体数量的增加和模式的改变。两组七倍体在基因型上存在差异伪纪念碑和部落染色体组。在两种植物中,其他两个单链酶的模式是相同的(尽管pSc119.2在C25B中没有应用)。
七倍体C25B每个单倍体携带整倍体染色体组,分别显示12和13个5S和18S rDNA位点(图。4.b;桌子2).庚三醇C9表现出115s和12个18s RDNA位点(图。4.d;桌子2).两种检查的七倍体之间的差异是由于收购了一个额外的部落- 染色体和一个腐蚀性伪少数 -比如C9的染色体。因此,在C25B植物中伪纪念碑染色体上有8个5S位点和9个18S rDNA位点,而在C9植物中分别有7个和8个相应的位点。上的pSc119.2站点数伪纪念碑C9的染色体与六倍体相同(3条染色体上有3个位点)。两对染色体表现出与六倍体相同的pSc119.2模式。第三条染色体,在一条染色体臂上显示了一个pSc119.2位点,在邻近易位的末端片段上也显示了一个共定位的rDNA位点部落染色体在相对的染色体臂上(图。3.和4.c和d;桌子2).
D单倍体来自山羊草属显示两条5S和18S rDNA位点共定位的染色体(5S位于近端);此外,在一条染色体的末端区域还存在一个额外的5S位点。在D单粒体(C9)中未检测到pSc119.2位点。共定位18S-5S-18S位点部落六倍体中的单组倍增到a伪纪念碑如染色体。就这样部落庚三倍体的单组仅携带单个18s的RDNA位点。然而,PSC119.2基因座驻留在原始18S-5S-18S-18S RDNA基因座内部落在易位的轨迹中不再检测到伪纪念碑.这QueSypyrum-如染色体套装(在植物C9中),在六倍体(单独的染色体上的一个5S和18s RDNA基因座中)存在相同数量的RDNA基因座,但在六条染色体上仅显示九个PSC119.2位点(图。3.和4.d,表2).
Nonaploid Elytrigia×mucronata
基因组组成
3个非二倍体(2n = 9x = 63)E..×mucronata对来自两个地区的植物进行了分析(表1).我们为分析选择了两种不同假设的原始方案的植物。虽然来自地方的植物50-1和50-7来自2N的地方(Dolnídunajovice')可能会从2N(大肠被) + n (e .媒介物)或2n (6xE..×mucronata) + n (大肠被)组合,来自局部性'Hovorany'的非平面41-5可以通过2N(e .媒介物) + n (大肠被)或2n (6xE..×mucronata) + n (e .媒介物)配子组成[16.].
分析的非平面图中有两种清除的Gish模式,这可能反映了它们独特的起源(另见讨论)。来自一种人群(50-1和50-7)的两种植物表现出35 st + 14h + 7d + 7v构造(图。5.a和c)。我们再次遇到缺乏信号Dasypyrum在中心点区域的探针Dasypyrum标记染色体。在这两种植物中都检测到了染色体易位(详情见下文)。
非平面图的有丝分裂中期染色体E.×Mucronata.经过连续FISH和GISH实验。一种那C.和E.植物50 - 1,50 - 7和41-5的GISH(中期只有62条染色体):Aegilops Tauschii.(地高辛,抗dig - fitc,黄色假色),杜鹃花绒毛索姆(生物素,链霉抗生物素蛋白-CY3,蓝色伪焦型)、大麦bogdanii(生物素-链霉亲和素- cy3,绿色假色)Pseudoroegneria spicata(Cy5,红色)。B.那D.和F植物50-1,50-7和41-5的鱼(仅用62染色体中的中期):5s rdna(Cy5,红色),18s rdna(Digoxigenin,抗Dig-Fitc,Green)和psc119.2(cy3,白色pseudocolour)。鱼后,染色体用DAPI染色。用数字表示不同类型的结构染色体改变(1,2,5,7)。秤条=10μm
41-5植物的基因组结构与上述植物的基因组结构不同(图。5.e).基于GISH分析,41-5为28 St + 7 H + 14 D + 14 V染色体。与其他被分析的植物相似Dasypyrum-标记的染色体在着丝点区域缺乏信号。
染色体结构变异
检查的非平面植物在鱼类分析中显示了可变模式,反映了它们不同的起源和基因组添加性(50-1和50-7 vs.41-5)。此外,在两种植物之间观察到鱼类图案的差异,具有相同的基因组结构(50-1和50-7)。在这种情况下,差异主要是由于染色体组内的多态性伪纪念碑.与六倍倍增物相比,所有检查的非平面值中的所有鱼探针的总数增加了(表2).
50-1厂共有14个5S位点和18个18S rDNA位点。pSc119.2探针与16条染色体上的21个位点杂交。五个染色体组伪纪念碑St Haplome表现出九个5岁和918秒的RDNA位点。这些RDNA位点在五条染色体上共定,而四种染色体患有孤立的5s rdNA位点,以及四个其他染色体患有孤立的18s rdNA位点(两个间质和两个子调节位点)。ST Haplome在末端染色体区域中携带四个PSC119.2基因座,其中两个载体载体在相对的染色体臂上载有18秒的rDNA染色体。这山羊草属类D单胞体携带2个5S rDNA位点、3个18S rDNA位点和1个pSc119.2位点。其中2个5S位点和5个18S rDNA位点被检测到部落染色体组。5S和18S rDNA位点在两条染色体上共定位。除了在六倍体和七倍体中都观察到的18S-5S-18S rDNA位点外,还有一个与pSc119.2位点共同定位的5S-18S rDNA位点位于同一染色体臂上。总共有6个pSc119.2位点位于6个位点上部落染色体。其中一个遗址源自源自染色体染色体段山羊草属如染色体。与六倍体相似,V单倍体来自Dasypyrum在单独的染色体上有单独的5S和18S rDNA位点。七分之五QueSypyrum-类似染色体携带10个pSc119.2位点。3.和5.b;桌子2).
50-7号工厂有11个5S和16个18S rDNA位点。pSc119.2探针在15条染色体的20个位点进行杂交。FISH模式与植物50-1相似,主要差异存在于植物内部伪纪念碑如染色体。这些染色体带有5个5S位点和8个18S rDNA位点。此外,山羊草属类染色体有三个5S位点而不是两个;18S rDNA位点由原来的3个改为2个;2个pSc119.2杂交位点。rDNA-FISH的模式部落和Dasypyrum这两种植物在其他方面是相同的。5个位点上发现5个pSc119.2位点大麦,标记染色体.PSC119.2基因座的数量和模式相同Dasypyrum染色体组(图。5.d;桌子2).
41-5号,28号伪纪念碑- 标记的染色体携带四个5s和718s rdNA位点。所有5S rDNA位点与18秒的rDNA位点共同定位,其中三个位于18s rDNA的近端。另一个18s RDNA位点在终端区域的三个染色体上。有七个PSC119.2基因座位于终端区域,其中四个位于携带rDNA的染色体上。
非平面图41-5的Hordeum Haplome用近端18s部位和远端5S rdNA部位携带一个共局的基因座,驻留在相对的染色体臂上至PSC119.2位点。此外,单独的染色体上有一个18件轨迹。D和V HAPLOM中的RDNA基因座表现出六倍体中这些HAPLOMES中发现的位点数的两倍。D haplome携带两对具有共定位5s和18s rdNA位点的染色体,并且来自v HaplomeDasypyrum携带两种5s和两个18s的位点,所有这些位点都居住在单独的染色体上。虽然在11条染色体上留下了7个PSC119.2位点,但在D happlome内没有检测到PSC119.2位点(图。3.和5.F;桌子2).
染色体改变-概述
三种构造蚀变有7种,数值蚀变有1种E.×mucronatacytotypes。发现以下结构变化(表)3.).(1) H/St易位伪纪念碑达到的浓铬染色体段部落在C9、50-1和50-7中出现了2次。2一个,c,4.a,c和5.A, c和e),是七种中唯一在亲本物种中检测到的类型E.×mucronata(在一对染色体上检测到易位大肠被[18.])。因此,该易位应该是从父级继承(参见讨论)。旋转染色体在一个染色体臂的末端区域中携带PSC119.2位点(当使用该探针时)。(2)H / St易位,其中一个伪少数 -标记染色体携带部落探针信号在它的着丝粒区,这种易位只发生在非单倍体41-5(图。5.e). (3) H/St易位发生在末端之间部落和伪纪念碑染色体。由于易位引起了通过A获取了共同定位的18S-5S-18S RDNA站点伪纪念碑染色体(无花果。3.和4.)和该网站的消失部落在美国,我们将这种易位归类为相互易位,并且它发生在两个七倍体中(图。4.(4) H/St终端移位发生在a伪纪念碑- 状染色体携带垂直于a的末端段部落如染色体。这种类型的易位仅在两条染色体上的庚三倍体中发生(图。4.a和c)。其中一种染色体携带与断裂点相邻的共定位的5S-18S rDNA位点,并且在相对染色体臂的末端区域中的PSC119.2位点(仅在C9中仅施用PSC119.2)。(5)D / H往复易刻染色体段之间发生大麦,和山羊草属如染色体。两种染色体上的断裂点都靠近18S rDNA位点,并且易位片段山羊草属染色体包含一个pSc119.2位点,且对50-1非单倍体具有特异性(图1)。3.和5.a). (6) D/V间质易位是一种染色体片段的非互反易位山羊草属类染色体Dasypyrum如染色体。该易位染色体携带两个pSc119.2位点(位于间质位置和亚端粒位置),在两种七倍体植物中都发现了该位点(图。4.(7) a和c的倒置部落- 标记的染色体,其中共定位的5s-18s rdna轨迹在非平面图50-1,50-7中在相互倒置的位置,与41-5(分别在相同和相反的染色体臂上发生rdna轨迹);无花果。3.和5.B d和f)。
在一株七倍体植物(C9)中观察到数值染色体改变。虽然该植物的染色体总数是整倍体,但并不是所有的染色体组都是7条染色体的倍数。一个缺失的染色体伪纪念碑染色体组由一个额外的染色体补偿部落.额外染色体的身份基于与第二次渗透点的比较可追溯;额外的东西部落染色体是来自于有易位着丝点区域的两条染色体之一伪纪念碑,虽然一伪纪念碑带有5S和18S rDNA共定位位点的类染色体缺失(图。4.c和d;桌子3.).
讨论
高倍性水平的天然杂种的发生很少有文献记载Triticeae部落.例如,有报道称在Thinopyrum junceum和Elytrigia被从瑞典30.]和一个非平面的杂交Elytrigia pycnantha.和大肠被从法国31].对后者的GISH分析表明,在这个非单倍体中存在4个单倍体,由4个染色体组组成伪纪念碑两个染色体组Agropyron两个染色体组Thinopyrum和一条染色体套部落.这些结果表明,在较高的多倍体中的常规减数分子可能在杂交复合物中发生Triticeae.然而,据我们所知,六倍倍醇和七倍体天然杂交物中尚未显示四种单体的存在。
在这项研究中,我们展示了这一点elytrigia×mucronata.是一种高复杂性的全多倍,其中所有三种学习的杂交细胞型均包含在家长物种中存在的所有四个单体(D,H,St,V)大肠被和e .媒介物.在所有的情况下(见下文),所有的染色体组在杂交种是整倍体,由7条染色体组成。而基因组的构成(即,特定的haploes /基本基因组的类型和数量)E.×Mucronata.杂交种反映了特定细胞型的倍率水平,它还取决于参与特定植物的发起的配子的类型。
如果我们假设常规分裂在家长物种中发生,那么E.×mucronata六倍体会含有三种染色体伪纪念碑和一个染色体设置Hordeum,Aegilops.和Dasypyrum(基因组StStStHDV公式)。除了这些染色体组,七倍体细胞型还含有来自伪纪念碑(StStStStHDV)。不同植物的非倍体细胞型的基因组构成不同。其中2株为35 St + 14h + 7d + 7v染色体,另1株为28 St + 7h + 14d + 14v染色体。我们假设这种差异反映了非倍体细胞类型的不同起源[16.)(见下文)。
不同细胞型的起源
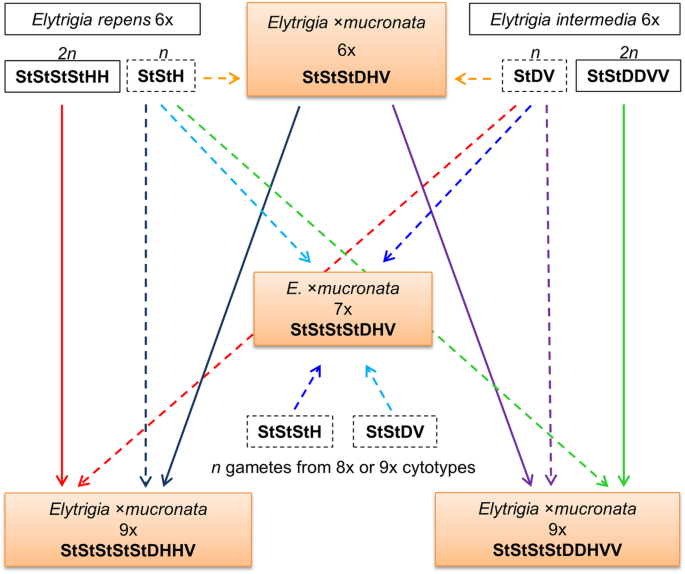
这些被分析的植物的基因组结构使我们能够部分推断出导致它们起源的配子类型(图。6.).的六倍体细胞型E.×mucronata最有可能是来自两个亲本物种的两个减少的配子的合并。
如上所述,非平面植物最有可能通过减少和未更新的配子融合来源[15.那16.].Mahelka等[16.]对杂交非二倍体50-1、50-7和41-5的起源提出了不同的设想(原文中为植物N7、N6和N8)。而植物50-1和50-7可能是由2n (大肠被) + n (e .媒介物)或2n (6xE..×mucronata) + n (大肠被)组合,非单倍体41-5可能代表2n (e .媒介物) + n (大肠被)或2n (6xE.×mucronata) + n (e .媒介物)配子组成。由于替代配子组合产生了相同的基因组组合物,因此我们无法通过使用GISH来辨别哪种情况真正导致形成分析的非平面值。六倍体的参与E.×mucronata在非二倍体的形成中杂交似乎更有可能,因为杂交可能更容易产生未减数分裂的配子,而不是纯物种[9.].七倍体细胞型可能由异质杂交引起;但是,其起源的确切模式难以确定。一种可能性是在六倍倍增醇和八倍体(2n = 8x = 56)之间的交叉后起源于庚脂。如果六倍体父母要么大肠被要么e .媒介物(配子N= 3x = 21 = StStH或StDV),则来自八倍体的配子必须是N= 4x = 28 = StStDV或StStStH6.).然而,没有从这种地方记录八倍体植物。或者,在六倍体和非平面值之间的交叉之后,庚脂肽可以起源于其中后者是包含四种染色体组的配子的供体。已经观察到这种情况Elytrigia在田间收集的非单倍体杂种50-1的后代中发现了一株七倍体植物[16.].花粉的供体很可能是大肠被要么e .媒介物.不幸的是,没有分析这种特定七倍体的基因组结构。
染色体改变E.×mucronata
所有三种细胞类型都发生了染色体改变,并涉及所有四种单质。大多数易位涉及St和H染色体,而V染色体来自Dasypyrum涉及一个易位。问题是这种差异是否只发生了,因为st和h染色体从其他单体中偏离染色体,或者如果它源于核型稳定性的不同水平,这可能对染色体重组和非倍增性具有很强的效果Triticeae[32].
涉及H和/或St Haplome的其他多年生常数物种中报道了结构染色体改变。Dou等。[33]在h和st haplomes之间发现两种类型的非互惠易位和h和y Haplomes之间的两种类型的互易转换Elymus nutans.(2n = 6x = 42, StStHHYY)。观察到不同单质间的染色体改变频率不同Kengyilia thoroldiana(2n = 6x = 42, StStPPYY)。P/Y易位频率高于P/St易位,而St和Y单胞体染色体间未见易位[34].
问题是,在杂交形成的哪个阶段,易位发生的频率有多高?如果不了解亲本物种,就很难推断出特定的结构重排是遗传自亲本物种,还是在杂交后代中从头开始的。亲本本地种质的细胞遗传学分析e .媒介物和大肠被表明了大肠被,一对部落染色体携带着着丝点H/St '易位' [18.],对应于我们在此所谓的1型易位。相比之下,没有类似于观察到的易位E.×mucronata这里分析的植物是在其他亲本种中观察到的e .媒介物[19.那23].因此,我们得出结论,除了三种细胞型中的所有(1型)染色体改变E.×mucronata在杂种的形成过程中出现。
在任何情况下,只有一个这样的易位存在于六倍体杂种,表明有规则的减数分裂发生大肠被父母。因此,似乎没有脱象旋转性出现在E.×Mucronata.六倍体。在两个非平面值(50-1和50-7)中存在两种这样的易位和其他非平面值(41-5)中的一个易位与这些非平面值的替代起源一致。
此外,非平面图50-1中的D / H倒数易位(型5)的存在表明该植物不是主要非平面值杂交e .媒介物和大肠被,由于Hybrid植物必须发生H和D Haplomes之间的重组(在任何父母中不存在)之间。因此,涉及2N的原点(6倍E..×mucronata) + n (大肠被)组合似乎更有可能在这种植物。
在庚脂植物中观察到的染色体改变的显着较高频率与另一种分析的细胞型的结果对比。在其他细胞型中未发现四种类型的易位(类型3,4和6)中的三种,表明在形成配子期间必须发生同源染色体之间的几种多元素,从而产生七倍体植物。
两种染色体的同时存在具有往复式易流的段,表明替代的偏析(即,漂移的染色体不隔离并且存在于单个配子中)。这种状态不太可能起源于两个不平衡配子的融合。非往复式易位可以是非互互互易的本身或可能由相邻的偏析引起,其中正常和漂移的染色体分离成一个配子[35].
此外,在一株七倍体植物中观察到的数字染色体改变是隐性非整倍体的一个例子[27那32,即从另一组染色体中获得一条额外的染色体来补偿一条染色体的缺失。
染色体在着丝粒区也被观察到携带着不同的信号Dasypyrum如染色体。这个特性之前已经被报道过e .媒介物物种(19.那23].需要进一步的研究来揭示这些GISH模式的真实性质,并确定它们是由染色体重组还是序列同源造成的。
重复DNA的映射E..×mucronata混合动力车
核糖体DNA基因与AllopolyPLOIDY相关的演变是一种深入研究的问题(例如,[36那37])。rDNA位点是一种有价值的染色体标记,利用原位杂交定位rDNA位点有助于评估异源多倍体基因组核糖体位点的祖先-衍生模式和位置动态。异源多倍体物种的rDNA基因可能会经历截然不同和难以预测的进化模式,从与祖先相关的某些位点的丢失(Zingeria- - - - - - (38)超过几乎完全的可加性(例如,Thinopyrum ponticum- - - - - - (39];尼古利亚娜- - - - - - (40])以增加rDNA位点的数量(小麦属植物- - - - - - (41])。Triticeae草的特点是能够改变rDNA位点的位置[42那43那44,这可能是通过次要位点的分散而发生的,随后是rDNA阵列的放大和原始位点的缺失。rDNA位点的丢失是加速协同进化过程的一种潜在机制[45].
在所有研究的杂交细胞型中,5S和18S rDNA位点均位于代表不同单质的所有染色体组上。因此,rdnaE..×mucronata杂交在一定程度上反映了基因组可加性的原理。然而,由于E..×mucronata是两个所有多个多倍数物种之间的杂交,该杂种的RDNA基因座的动态是可追溯的,只要父母物种中的图案被理解。因此,我们表征了两者的标本大肠被和e .媒介物来自杂交种起源的相同分布区域([18.那23Mahelka, Kopecký, unpubl。数据)。在两个亲本物种中,我们都遇到了一些与它们的二倍体祖先相关的rDNA位点的重组,这很可能发生在异源多倍体起源之后(用于讨论,见[18.那23])。rDNA位点的模式大肠被和e .媒介物显示在附加文件中1S1:表。值得注意的是,除一个较小的45S rDNA位点外,其余位点都可能发生严重的消除部落亚底群大肠被(基因组StStStStHH公式)。类似地,45S rDNA位点的消除发生在伪纪念碑- 和Dasypyrum- 状亚因素e .媒介物(基因组StStDDVV公式)。在两个物种中,5S rDNA受位点丢失的影响小于45S rDNA。
在这项研究中,我们预测了杂种中RDNA基因座的理论数量E..×mucronatacytotypes(附加文件1表S1),假设亲本rDNA位点完全可加性。通过对观测数据的比较,我们可以推断杂交种rDNA位点的位置动态。出于这个目的,我们认为18S和45S探测器提供的信息是一样的。
5S rdna loci的总数良好地进入所有杂交植物的预期数字。在非平面41-5中,如果[2n(6x]如果[2N(6倍)只落在预期范围内的5S rDNA基因座的数量下降。E..×mucronata) + n (e .媒介物对其起源的设想得到了考虑。在相反的情况下[2n (e .媒介物) + n (大肠被),较低(11 vs. 13-15预期)。这种缺失主要是由于上的5S rDNA位点较少所致伪纪念碑染色体比预期的多(观察到4个位点,比预期的6-7个位点)。然而,我们必须注意到,由于在分析的中期缺失了一条染色体,该植物中位点的实际数量可能比观察到的要高。这种观察结果与亲本物种中发现的5S rDNA位点的模式是一致的,在亲本物种中没有记录到5S rDNA位点的重大变化([23],unpubl。数据)。
相反,在所有分析的细胞类型的杂种中,18S rDNA位点的总数总是高于预期。如果我们考虑到45S rDNA位点的严重损失已经在两个亲本物种中发生的话,这个观察结果就特别有趣了[18.那23].一些基因座的恢复清楚地发生在内部落并且,到较小程度,伪纪念碑杂交后的单倍体(见六倍体10-1)。特别是,在检查部落Haplome,我们在所有细胞型中观察到共定位的5s-18s和/或18秒-5s-18s rdna基因座(尽管在七倍体中,共同局部的基因座已被易于转移到a伪纪念碑染色体);然而,该位点在大肠被[18.].这一模式在所有三种细胞类型中都是一致的,但没有研究位点重现的机制和原因。
我们没有用PSC119.2探针探测任何父母种类。在其他研究中,已经发现了最多5个具有一个或两个PSC119.2基因座(位于终端或间隙位置)的染色体e .媒介物[46].在e .被pSc119.2位点的总数在5至10个之间(一个间质位点和终端区域的其他位点)[47].虽然这些植物来自不同的地理区域,但它看起来类似于18秒的RDNA,所检测到的PSC119.2位点的总数E.×Mucronata.高于家长物种。
结论
杂交和多倍体化是草类物种形成的主要机制Triticeae.这些机制不仅产生了新的异源多倍体谱系,而且通过广泛杂交和渐渗进行的遗传物质转移也可能显著丰富了新建立的谱系的基因库,从而为选择提供了原材料。许多Triticeae小麦草地,包括e .媒介物,代表对遗传物质的遗传物质来源非常宝,可能对小麦改善有用。因此,新建立的杂交谱系对一般科学均感兴趣,并且由于其潜在的实际影响而对小麦育种者特别关注。我们使用基因组和荧光在异聚倍数的三种细胞型杂交中进行分子细胞遗传学分析E.×mucronata是两种异源多倍体麦草的杂交产物,e .媒介物和大肠被.在所有三种细胞类型(即六倍体、七倍体和非二倍体)中,我们观察到在亲本物种中存在四种不同的单倍体,从而证实了假设的杂交起源。这些被分析的植物的基因组结构使我们能够部分推断出导致它们起源的配子类型。而六倍体细胞型E.×mucronata七倍体细胞型可能是异倍体杂交的结果,是由两个亲本的减数配子合并而成。非单倍体植物极有可能是由减少的(n)配子和未减少的(2n)配子融合产生的。非二倍体的不同基因组构成表明,与亲本物种同时存在的是六倍体E.×mucronata应该被认为是未减数配子的供体。在杂交种形成期间和/或之后,在七倍体和一些非单倍体植物中都观察到一些染色体改变。此外,在一个非二倍体中检测到一个特殊的染色体易位,表明它不是一个初级杂种。因此,至少有一些混血儿是可育的,并产生可存活的后代。
方法
植物材料
本研究中使用的植物材料可作为上一项研究的生活材料提供[15.那16.].作者(VM)收集所有调查的植物,在不需要允许的地方收集样品。在表中给出了样本位置的详细信息1和无花果。1.选用2个六倍体(2n = 6x = 42)、2个七倍体(2n = 7x = 49)和3个非二倍体(2n = 9x = 63)的杂交植株进行试验。E.×Mucronata.植物(表格1).在过去的基因组大小变异和自然杂交的研究中使用了六倍体和非倍体植物[15.那16.].因此,六倍体植株10-1和17-4对应Mahelka et al. [16.],非二倍体植株41-5、50-1和50-7分别对应同一研究的非二倍体植株N8、N7和N6。本研究首次对七倍体进行了研究。二倍体的种子Triticeae用于探针准备的品种由美国农业部(USDA)国家小谷物收集所提供。
收集材料和载玻片制剂
在温室中的塑料盆中栽培植物。在冰冷的水中预处理根尖24-33小时,固定在新鲜的乙醇 - 乙酸固定剂(3:1,v / v)中固定。
固定根尖用蒸馏水(2次)和柠檬酸缓冲液(0.01 M柠檬酸和0.01 M柠檬酸钠缓冲液,pH 4.8)分别冲洗5分钟。随后,在37°C下用酶混合物[1% (w/v)果胶酶,1% (w/v)果胶酶和20% (v/v)果胶酶(Sigma, St. Louis, MO, USA)柠檬酸缓冲液]处理根尖3-4小时。处理后,用蒸馏水清洗消化后的组织。
切片是用涂片法制作的[48]根据上一份报告[49]有几种修改。将消化的组织小心地转移到显微镜载玻片上,用针产生悬浮液。然后将冷的75%乙酸立即加入到悬浮液中,之后将载玻片放置在热板上并用针搅拌以扩散细胞。最后,加入150μl冷乙醇 - 乙酸固定剂,用乙醇洗涤载玻片并风干。
探针制备和原位杂交
以下三种探针代表重复的染色体标记用于FISH分析:(1)5S rDNA探针,(2)18S rDNA探针,(3)pSc119.2探针。利用引物5SprobeF (5 ' -GATCCCATCAGAACTCCGAAG-3 ')、5SprobeR (5 ' -CGGTGCTTTAGTGCTGGTATG-3 ') [50, 18S-F (5 ' -CGAACTGTGAAACTGCGAATGGC-3 ')和18S-R (5 ' -TAGGAGCGACGGGCGGTGTGTG-3 ') [51].pSc119.2探针,一个120 bp的片段,最初从黑麦分离[52],被扩增Triticum Aestivum.简历。根据报道的协议,中国春季DNA。
用于获得基因组探针的二倍体物种的选择是基于父母物种的基因组结构的分析[18.那19.那23].来自二倍体物种的基因组dnaAegilops Tauschii.肋骨。(USDA登录标识符PI542278;代表D Haplome),杜鹃花绒毛索姆(L.)P. Candargy(PI639751; V Haplome),大麦bogdanii(pi269406; h haplome),和Pseudoroegneria spicata(pursh)á。利用DNeasy植物迷你套件(Qiagen,Hilden,德国)提取了Löve(pi563869; st haplome)。根据制造商的协议或通过随机底漆标签或通过随机底漆标记53]用直接荧光染料(Cy3,Cy5; Amersham,Piscataway,NJ,美国)。
在有丝分裂中期染色体上进行以下三个顺序实验E.×Mucronata.:(i)用5S rDNA (Cy5)、18S rDNA(地高黄素,抗dig - fitc偶联物)和pSc119.2 (Cy3,该探针未应用于植物17-4和C25B)探针进行FISH;(ii) GISH与三个基因组探针,来自Aegilops Tauschii.(digoxigenin anti-DIG-FITC共轭),大麦bogdanii(生物素,streptavidin-Cy3),Pseudoroegneria spicata(Cy5);(iii) GISH与来自杜鹃花绒毛索姆(生物素,链霉抗生物素蛋白-CY3)。杂交模式总是在每株植物3-6个中源性中证实。
染色体和探针同时在93°C的热板上变性3分钟(ThermoBrite™载玻片处理系统,StatSpin, Norwood, MA, USA)。根据相关文献,在63℃下杂交3 h [54那55].采用抗dig - fitc偶联物(Roche,印第安纳波利斯,IN, USA)或链霉亲和素- cy3偶联物(Sigma,圣路易斯,MO, USA)(37℃下1小时)完成检测。载玻片用vectasshield抗褪色支架(Vector Laboratories, Burlingame, CA, USA)安装,在蔡司Axio成像仪上检查和拍照。Z2显微镜系统配备apotome。使用Zen (Zeiss, Jena,德国)和Adobe Photoshop软件(Adobe Systems, San Jose, CA, USA)合并和处理图像。
缩写
- 18 s rDNA:
-
18 s核糖体DNA
- 45 s rDNA:
-
45 s核糖体DNA
- 5s rdna:
-
5 s核糖体DNA
- 防挖菲特:
-
Anti-digoxigenin-fluorescein异硫氰酸酯
- Cy3:
-
Cy3-dUTP,青蓝3-dUTP
- Cy5:
-
Cy5-dUTP,青蓝5-dUTP
- DAPI:
-
4',6-二氨基-2-苯基吲哚
- 脱氧核糖核酸:
-
脱氧核糖核酸
- 鱼:
-
荧光原位杂交
- GISH:
-
基因组原位杂交
- 其:
-
内部转录间隔区
- rDNA:
-
核糖体DNA
- streptavidin-Cy3:
-
链霉抗生物素蛋白 - 花青3
参考
- 1。
Comai L.多倍体的优点和缺点。NAT Rev Genet。2005; 6(11):836-46。
- 2。
洛杉矶迈尔斯,莱文地检官。论开花植物多倍体的丰度。进化。2006;60(6):1198 - 206。
- 3.
soltis ps,soltis de。杂交在植物形态的作用。Annu Rev植物Biol。2009; 60:561-88。
- 4.
Goulet是,Roda F,Hopkins R.植物中的杂交:旧的想法,新技术。植物理性。2017; 173(1):65-78。
- 5.
授予V.工厂形态。第二次。纽约:哥伦比亚大学出版社;1981年。
- 6.
亚洲野生稻是一种具有广泛基因流动和野生化的杂交群体。基因组研究》2017;27(6):1029 - 38。
- 7.
Harlan JR, DeWet J.登录Ö。畏缩和祈祷:多倍体的起源。机器人启41 1975;(4):361 - 90。
- 8.
Suarez Ey,Lopez Ag,Naranjo Ca.多糖与未更新的男性配子作为非平面图(9x)常见的小麦植物的起源。鹅圈炎。1992年; 45(1):21-8。
- 9.
Ramsey J,SchemeSke D.开花植物中多倍体形成的途径,机制和速率。Annu Rev Ecol Syst。1998年; 29:467-501。
- 10。
Doyle Jj,鞭毛勒,帕特森啊,拉普雷,索尔蒂斯德,Soltis Ps等。基因组合并的进化遗传和植物加倍。Annu Rev Genet。2008; 42:443-61。
- 11.
陈建平,王志强,王志强,等。多倍体小麦基因组可塑性的研究进展。在:Soltis PS, Soltis DE,编辑。多倍性和基因组进化。柏林:施普林格柏林海德堡;2012.109 - 35页。
- 12.
杜威博士:古斯塔夫森,编辑。植物改良中的基因操作,第16届Stadler遗传研讨会纽约:Plenum出版社;1984.p . 209 - 79。
- 13.
爱一个。麦科概论。Fedd众议员95:425 1984;521年。
- 14.
Soreng RJ, Peterson PM, Romaschenko K, Davidse G, Teisher JK, Clark LG等。全球禾本科(Gramineae)系统发育分类II:更新和比较2015年的两个分类。地球科学进展。2017;55(4):259-90。
- 15.
Mahelka v,Suda J,Jarolímováv,TrávníčekP.基因组大小在密切相关的分类群之间辨别Elytrigia被和E..介质(Poaceae:Triticeae)及其杂种。folia geobot。2005; 40:367-84。
- 16.
Mahelka v,Fehrer J,Krahulec F,JarolímováV.最近的两个Allopolyproid小麦草系之间的自然杂交(Elytrigia(禾本科):生态学和进化意义。安机器人。2007;100(2):249 - 60。
- 17.
Mason-Gamer RJ。allohexaproidy,血栓增生和复杂的系统发育史elymus repens.(Poaceae)。mol phylocyet evol。2008; 47(2):598-611。
- 18.
Mahelka v,Kopeckýd。从allohexaploid的草地上捕获基因elymus repens.(L.)由其GBSSI和分子细胞遗传学证明的古尔(Poaceae,Triticea)。mol Biol Evol。2010; 27(6):1370-90。
- 19.
Mahelka v,Kopeckýd,PaštováL.在基因组体构成和中级小麦草的演变(薄孔中间:禾本科,Triticeae)。BMC Evol Biol. 2011;11:127。
- 20.
王RRC,Lu B.基因组分析揭示的多年生束物种的生物系统和进化关系。J Syst Evol。2014; 52:697-705。
- 21.
Mason-Gamer RJ。一种四倍六倍体草的网状进化、渐渗和部落间基因捕获。系统医学杂志。2004;(1):53 25-37。
- 22。
王志强,王志强,王志强,等。核糖体基因在系统发育不同的草谱系间的多重水平转移。《美国国家科学院学报》上。2017年,114(7):1726 - 31所示。
- 23。
Mahelka V, Kopecký D, Baum BR。对比45S和5S rDNA家族的进化模式,揭示了农学上重要牧草基因组构成的新方面薄孔中间(Triticeae)。生物医学进展。2013;30(9):2065-86。
- 24。
Kishii M,Wang R-C,Tsujimoto H. Gish分析显示了基因组构成的新方面薄孔中间.中华植物育种杂志。2005;41:92-5。
- 25。
六倍体的trigenomics起源Psammopyrum athericum原位杂交揭示的(麦科:禾本科)。Chromosom杂志2001;9(3):243 - 9。
- 26.
作者综述了现代细胞遗传学方法(FISH/GISH)在网状结构(多倍体/杂交)研究中的应用。基因。2010;1(2):166 - 92。
- 27.
Chester M, Gallagher JP, Symonds VV, Veruska A, Mavrodiev EV, Leitch AR等。最近形成的天然异源多倍体物种的广泛染色体变异,tragopogon miscellus.(菊科)。《美国国家科学院学报》上。2012; 109(4):1176-81。
- 28.
Weiss-Schneeweiss H, Tremetsberger K, Schneeweiss GM, Parker JS, Stuessy TF。南美二倍体和多倍体的核型多样化和进化Hypochaeris从rDNA定位和遗传指纹数据推断。安机器人。2008;101(7):909 - 18。
- 29.
Brasileiro-Vidal AC, Cuadrado A, Brammer SP, Zanatta ACA, Prestes AM, Moraes-Fernandes MIB, et al。染色体特征Thinopyrum ponticum(小麦科,禾本科)利用原位杂交不同的DNA序列。中国生物医学工程学报。2003;26(4):505-10。
- 30。
Östergreng.细胞学Agropyron Junceum.那一种.被和他们的自发杂种。秘密人。1940; 26:305-16。
- 31。
refoufi a,jahier j,eSnault ma。基因组分析天然杂交的2N = 63染色体ElytrigiaDESV。(Poaceae)使用GISH技术。植物BIOL。2001; 3(4):386-90。
- 32。
张H,BIAN Y,GOU X,ZHU B,XU C,QI B等。持续的全染色体非整倍性通常与新生的allohexaploid小麦有关。《美国国家科学院学报》上。2013; 110(9):3447-52。
- 33。
窦Q-W,陈Z-G,刘Y-A,Tsujimoto H.高次型曲调变异的高频率,持续的鱼类常年草饲料中的顺序鱼和GISHElymus nutans..Sci繁殖。2009;59(5):651 - 6。
- 34。
王Q,刘H,高A,杨X,刘W,李X等。多倍化后的依赖性重排Kengyilia thoroldiana(禾本科:麦科)受环境因素影响。《公共科学图书馆•综合》。2012;7 (2):e31033。
- 35。
《植物育种词典》,第571卷。博卡拉顿:CRC出版社;2009.
- 36。
Volkov R,Komarova N,Hemleben V.植物杂交种中的核糖体DNA:遗传,重排,表达。SYST BIODIVERS。2007; 5(3):261-76。
- 37.
Sochorová J, Coriton O, Kuderová A, Lunerová J, Chèvre A- m, Kovařík A芸苔属植物显著.Ann Bot。2017; 119(1):13-26。
- 38.
Kotseruba v,Gernard D,Meister A,Houben A.在同种异体电脂草地中的核糖体DNA发单人失去Zingeria trichopoda(2n = 8).基因组。2003;46:156-63。
- 39.
LI D,张X. 18S-5·8S-26S RDNA的物理定位及其地区的序列分析Thinopyrum ponticum(禾本科:麦科):协同进化的意义。安机器人。2002;90:445-52。
- 40.
Kovařík A, Matyášek R, Lim KY, Skalická K, Koukalová B, Knapp S, et al.;18-5.8-26S rDNA重复序列的协调进化烟草异源四倍体.中国科学(d辑:地球科学)2004;
- 41.
姜j,吉尔bs。新的18S·26s核糖体RNA基因基因座:染色体地标,用于多倍体麦的演变。染色体瘤。1994年; 103(3):179-85。
- 42.
Dubcovsky J,DVOřákJ.核糖体RNA多烯烯基因座:Triticeae基因组的游牧民族。遗传学。1995年; 140(4):1367-77。
- 43.
罗斯纳奥,博伊耶夫A,内华州E.量子形态山羊草属:来自RDNA集群在天然群体中的分子细胞遗传学证据。《美国国家科学院学报》上。2004; 101(41):14818-23。
- 44.
重复DNA和染色体重排:植物基因组中的物种形成相关事件。细胞基因组Res. 2008;120(3-4): 351-7。
- 45.
Eickbush Th,Eickbush DG。精心策划的运动:核糖体RNA基因的演变。遗传学。2007; 175(2):477-85。
- 46。
黄志强,王志强,王志强,等Triticum Aestivum.和薄孔中间使用FISH技术。中国科学院院刊。2011;64(12):1713-8。
- 47。
Ørgaard M, Anamthawat-Jónsson K.冰岛种的基因组原位杂交鉴别Elymus.和Elytrigia(Poaceae:Triticeae)。基因组。2001; 44(2):275-83。
- 48。
Lysák MA, Fransz PF, Ali HB, Schubert I.染色体绘画拟南芥蒂利亚纳.植物j . 2001; 28(6): 689 - 97。
- 49。
Pijnacker LP,Ferwerda Ma。Giemsa C-染色染色体。可以j Genet cytol。1984; 26(4):415-9。
- 50。
核糖体dna:水稻基因组中基因顺序保守的一个例外。中国科学(d辑:地球科学)2000;
- 51。
张国德,方思安,张福忠,钟明忠。两个遥远的核糖体RNA基因的染色体保守性和序列多样性oryza.物种。基因组学。2010; 96(3):181-90。
- 52。
Bedbrook Jr,Jones J,O'Dell M,Thompson Rd,Flavell RB。端粒异铬胺的分子描述秘书长物种。细胞。1980; 19(2):545-60。
- 53。
实用的原位杂交。牛津:Bios科学出版有限公司;2000.
- 54。
5S rDNA单元的非转录间隔被分成单元类分配到haplomes -对栽培小麦和小麦祖先的试验。47基因组。2004;(3):590 - 9。
- 55。
acta physica sinica, 2017, 36 (3): 495 - 498 . acta physica sinica, 2017, 36 (3): 495 - 498Aegilops Spottoides.Tausch。染色体res。2004; 12(2):153-61。
确认
我们感谢František Krahulec对手稿的有益讨论和评论。我们感谢Andreas Houben提供pSc119.2和Michaela Jandová帮助我们准备地图。用于探针准备的植物种子由美国农业部国家小谷物收集处慷慨提供。
资金
该研究由捷克科学院的长期研究开发项目RVO 67985939提供资金,从捷克科学基金会(VM)项目17-06548,并从查尔斯大学项目SVV 260439。
资金机构在研究和收集,分析和解释的设计中没有作用,以及编写手稿。
数据和材料的可用性
本研究产生的所有数据均包含在本文(及其补充信息文件)中。
作者信息
从属关系
贡献
AB和VM设计了这项研究。LP执行了实验并分析了数据。LP,AB和VM写了稿件。所有作者阅读并认可的终稿。
通讯作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
附加文件
附加文件1:
表S1。六倍体(2N = 6x),七倍体(2n = 7x)和非平面图(2n = 9x)细胞型的理论图E.×mucronata混合动力车。亲本的rDNA位点观察值和调查的期望值E.×mucronatacytotypes。(XLSX 12 kb)
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
Paštová,L.,Belyayev,A.&Mahelka,V.分子细胞遗传学表征Elytrigia×mucronata的自然杂交e .媒介物和大肠被(Triticeae禾本科)。BMC植物杂志19,230(2019)。https://doi.org/10.1186/s12870-019-1806-y
已收到:
公认:
发表:
关键词
- 异源多倍性
- 染色体改变
- elymus repens.
- 更高的多倍体
- 杂交
- 鱼
- 吉什
- 薄孔中间