摘要
背景
香蕉(穆萨是世界上最重要的水果之一,其产量很大程度上受各种胁迫条件的限制。SROs(类似于RCD-ONE)在植物的非生物逆境抗性和发育中具有重要作用。它们包含一个聚(adp -核糖)聚合酶(PARP)结构域的催化核心和一个c端RST (RCD-SRO-TAF4)结构域。此外,部分SROs还包含n端WWE结构域。尽管在一些模式植物中已经发现了一些SROs的特征,但人们对它们在香蕉中的作用知之甚少,尤其是在应对生物胁迫方面。
结果
六个m利用PARP和RST模型对香蕉基因组进行了基因鉴定。系统发育分析表明,来自15个种的77个SROs可分为两个结构不同的类群。I组的SROs具有WWE、PARP和RST三个中心区域。在II组SROs中缺乏WWE结构域。在选择的单子叶植物中,II组中仅存在香蕉的MaSROs。大部分的MaSROs在多个香蕉组织中表达。应激和激素相关的顺式调控元件(CREs)在启动子区域MaSROs支持的差异转录本MaSROs在非生物和生物胁迫下处理香蕉根。此外,表达概况MaSROs在群组中,我显然与激素治疗后II组观察到的那些。值得注意的是,表达了MaSRO4被多种应激和激素显著上调。MaSRO4蛋白可直接与MaNAC6和MaMYB4相互作用,蛋白-蛋白相互作用需要PARP结构域。
结论
根据保守结构域的特点,将香蕉基因组中的6个MaSROs分为两个主要类群。综合表达分析表明MaSROs通过具有激素的复杂的相互作用网络对生物和非生物胁迫进行正反应。Masro4可以通过PARP域直接与MANAC6和MAMYB4进行互动,以调节下游信号通路。
背景
植物不断受到各种生物和非生物环境压力的挑战。多种压力因素导致全球农业生产的广泛损失[1].在进化过程中,植物已经发展出复杂的机制来保护自己免受多重压力。一些分子,如转录因子(TFs)、活性氧(ROS)、胞质Ca2+激酶参与了不同的应激信号通路[2,3.].此外,由水杨酸(SA),茉莉酸(JA),脱落酸(ABA)和乙烯调节的激素信号传导途径也在生物和非生物胁迫之间的串扰中发挥关键作用[4,5,6].
类似于RCD ONE (SRO)家族是一组植物特异性蛋白,参与非生物胁迫和发育过程[7].在拟南芥,一种自由基诱导的细胞死亡1 (AtRCD1)最初是根据酵母突变体氧化应激反应缺陷的恢复而发现的[8].随后,我们还鉴定了AtRCD1的同源物(AtSRO1-5),并将其分为两种结构类型[7].atrcd1.和AtSRO1I型中含有一个n端WWE结构域(PS50918)、一个聚(adp -核糖)聚合酶(PARP)结构域(PS51059)和一个c端RCD1-SRO-TAF4 (RST)结构域(PF12174) [9].II型包括缺少WWE域的ATSRO2,3,4和5 [7].以往的研究表明,RST结构域专门参与植物的SRO和TAF4蛋白,而WWE-PARP结构域广泛存在于各种生物中[10,11].WWE结构域通过形成球状结构可能是蛋白质相互作用所必需的[12].RST域对于SRO与不同tf的相互作用至关重要[7,9].
到目前为止,对SROs的了解有限拟南芥和米饭。失去功能的突变atrcd1.导致对非生物胁迫反应的敏感性增加,叶片和莲座形态异常,激素反应改变[13,14,15,16].通过与SOS1相互作用,ATRCD1也参与盐应激,等离子体膜NA+/小时+逆向转运(17].然而,几乎没有做什么工作AtSRO2,3.,4和5.AtSRO2在光处理下上调。AtSRO3在光胁迫下显著下调,但受到盐胁迫和臭氧的诱导[7].变异的AtSRO5植物对H更敏感2O2-介导的氧化应激和盐胁迫[18].此外,一种水稻SRO蛋白OsSRO1c通过与NAC1和锌指TFs的相互作用,在改善干旱和氧化胁迫耐受性方面具有双重作用[19,20.].小麦SRO可以通过调节氧化还原稳态来缓解盐处理下的氧化应激[212]。同样,苹果的过度表达RCD1在转基因苹果愈伤组织中拟南芥植物增强了植物抗盐胁迫[22].然而,是否成员s基因家族是否参与调控生物应激仍是一个悬而未决的问题。
虽然已经在模式植物中进行了一些功能研究,但在非模式植物中所知甚少。香蕉对许多热带和亚热带国家的粮食安全至关重要。香蕉商业品种的营养繁殖由于遗传背景狭窄而导致对病虫害的敏感性[23].例如,镰刀菌枯萎,由此引起Fusarium oxysporumF。sp。号(船),是最具破坏性的疾病之一,它能导致叶子枯萎和整个植物死亡。特别是一种船称为热带第4种族(船TR4已经征服了全球80%以上的香蕉和大蕉。24].此外,干旱、低温等不利环境因素也制约了全球香蕉产业的发展[25,26].理解m功能响应情调和生物应激,我们首先鉴定并表征s香蕉基因组的基因家族。的表达模式MaSROs对六种非生物胁迫(冷、渗透、盐、紫外线、热和伤害),一种生物胁迫(船TR4接种)和四种激素处理(ABA,SA,GA和乙烯)。相比之下,MaSRO4通过PARP结构域与MaNAC6和MaMYB4互作。
结果
MaSROs的识别和分类
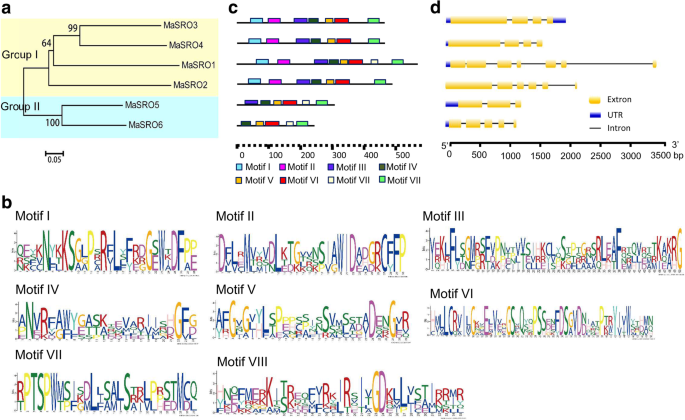
利用PARP和RST模型对香蕉全基因组进行了搜索MaSROs从MaSRO1来MaSRO6根据jasper et al.(2010)的描述[7].利用MaSROs全长蛋白序列构建最大似然(ML)系统发育树。六个MaSROs聚集成两个不同的组(图。1a).组I从MaSRO1到MaSRO4共4个成员,具有WWE、PARP和RST域,而没有WWE域的MaSRO5和MaSRO6属于组II。为了进一步识别其他保守结构域,我们使用MEME工具分析了MaSROs的所有氨基酸(AA)序列[22].总共列出了七个保守的主题1.Masro5和Masro6显然缺乏内部主题和图案VI,而Motif VI仅在Masro2中发现(图。1b, c)。MaSROs c端两个高度保守的motif V和VII分别含有典型的PARP和RST结构域。WWE结构域内的Motif I主要位于n端。母题的结构分布支持了分组结果(图。1一个)。
香蕉的进化关系、蛋白质结构域和基因结构分析s基因家庭。一个在MEGA7.0构建的无根ML树中,6个MaSROs聚为两组。我的小组包括MaSRO1, 2, 3和4。MaSRO5和MaSRO6组成第二组。b通过在线MEME工具生成了7个MaSROs的保守主题。堆栈的总体高度代表了序列守恒的级别。堆栈内残差的高度表示在指定位置上每个残差的频率。c鉴定的七个基序的位置在Masros中示意性地呈现。使用不同的彩色盒子显示不同的图案。使用底部的刻度估计蛋白质和基序的长度。d的内含子/外显子结构MaSROs通过比较基因组和cDNA序列来分析。黄色和黑色盒子分别代表外显子和内部区域。蓝色框表示未转换的地区(UTRS)。使用底部的刻度测量外显子和内含子的尺寸
确定…的基因组结构MaSROs,每个DNA序列被用来搜索香蕉基因组数据库。分布的MaSROs香蕉上的12条染色体似乎是不均匀的(附加文件2).染色体4和5包含两个MaSROs, 分别。MaSRO2和MaSRO4分别位于7号和9号染色体上。外显子/内含子的结构MaSROs(如之间MaSRO3和MaSRO4之间,MaSRO1和MaSRO2)被保守在同一亚科内,除了MaSRO6和m7(无花果。1d)。
我们还预测了每个MaSRO蛋白的化学和物理特性。MaSROs的长度范围为240 ~ 490 AAs, GRAVY值范围为−0.202 ~−0.435。基于不稳定性指标,大多数MaSROs属于不稳定蛋白。MaSROs的等电点从6.33变化到9.69,分子量从27.023 kDa变化到66.147 kDa。MaSRO1、2、3和5的亚细胞定位在叶绿体或细胞核中,而MaSRO4和masro6位于细胞核中2.
系统发育分析s基因家族
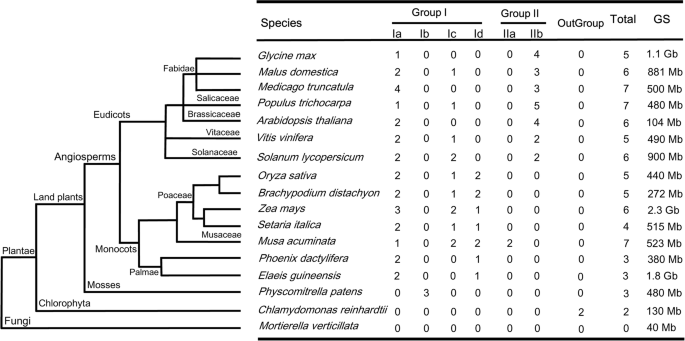
为了探讨植物SrO蛋白之间的进化关系,我们在16种基因组测序物种中鉴定了80个SRO,包括答:芥(6),玉米(6),杨树trichocarpa(7),穆萨acuminata(6),茄属植物lycopersicum(6),葡萄(5),Physcomitrella金属盘(3),o .漂白亚麻纤维卷(5),Medicago truncatula(7),马吕斯有明显(6),Broachypodium distachyon.(5),Setaria italica(4),衣藻reinhardtii(2),甘氨酸最大(5),Elaeis guineensis(3)Phoenix Dactylifera(3)附加文件3..所选植物代表被子植物科和苔藓植物科的物种。2).从藻类到开花植物,随着生物复杂性的增加,不同植物中SROs的数量逐渐增加[27].大多数植物的基因组中有5-7个SRO成员。大肠guineensis,p .金属盘和p . dactylifera含有3个SRO,而在c . reinhardtii基因组。在真核微藻中没有观察到SRO同源物Coccomyxa subellipsoidea和一个单细胞绿色藻类Ostreococcus lucimarinus.同样,我们在光合作用和/或真核微生物中也没有发现SRO同源物。失去了祖先自律监管在特定的世系中,在植物进化过程中通过广泛的扩展来支持进化多样化。
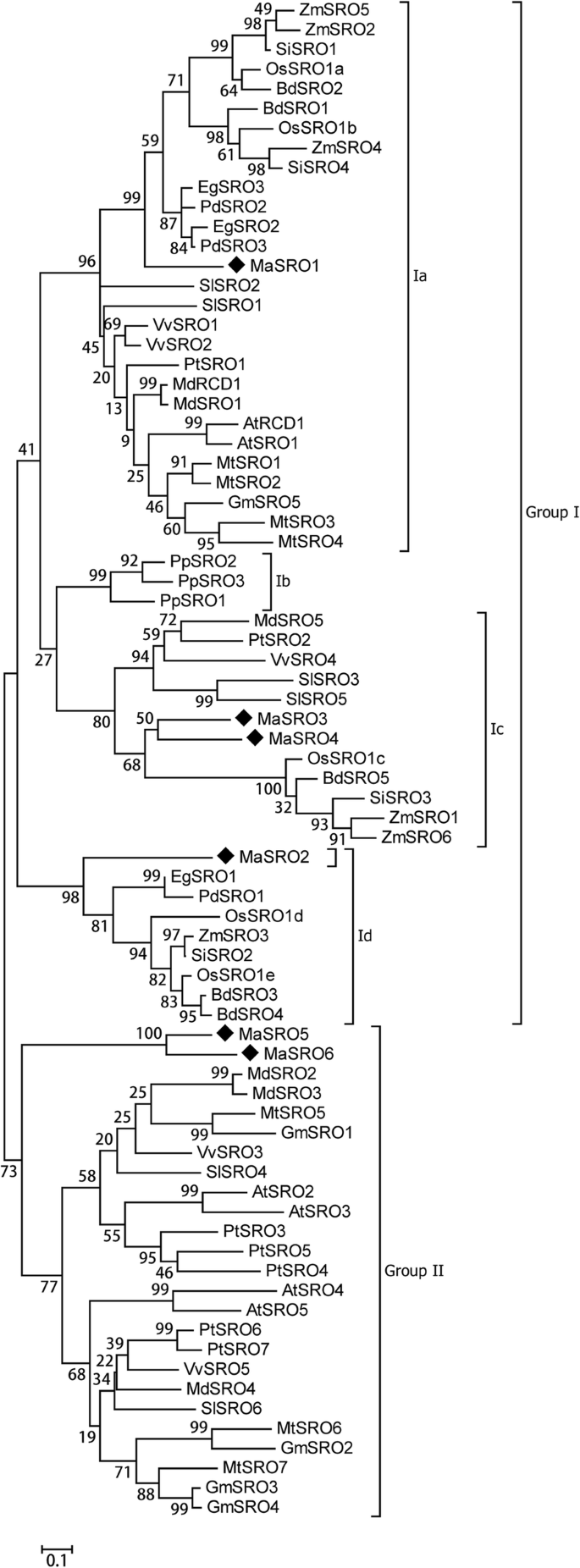
基于SROs的全长蛋白序列(附加文件4),使用引导分析产生m1系统发育树(1000 repicate)(附加文件5).偏离似乎是从c . reinhardtii与一个单独的单系分支,从而混淆了树状结构。因此,我们从最终的系统发育树中删除了两个CrSROs。15个物种共77个SRO成员聚为I组和II组(图2)。3.).基于分支值(> 75)[28],我进一步分为四个子组(IA,IB,IC和ID)[7]。AtRCD1和AtSRO1与所有被选物种的SRO同源物形成Ia亚群p .金属盘,在单子叶和双子叶之间产生了明显的分化分支(图。2).三PpSROsp .金属盘在我们选择的物种中,只有单子叶植物参与了Id亚群。第二组可以分为一组。除香蕉的MaSRO5和MaSRO6外,其他单子叶植物的SRO同源物均不属于II亚群。
植物SROs保守结构域的特征
基于领域架构,我小组中的那些sro拥有WWE、PARP和RST域的中心区域。在II组的SRO成员中未发现WWE结构域。与三种域原子吸收光谱的组成相比,WWE域的原子吸收光谱有明显的变化6).第一个领域在单像中最受保守。在N-末端的脂族AAS中避免了脂族AAS,在第一结构域中中间的严格保守的酪氨酸(Y),以及C-末端的两种甘氨酸(G)和天冬氨酸(D)残基。此外,七个保守的主题用于展示来自15种的植物SRO的域架构(附加文件7).在所有SROs中均发现含有基序I和基序VII的基本PARP结构域,表明该结构域对SROs的基本功能起重要作用。使用保守的PARP结构域和全长蛋白序列构建的系统发育树相似,但在亚群的定义上存在差异(附加文件)8).变量WWE区域内的motif II除来自于PpSRO1外,均出现在组I中p .金属盘.特别是,同一子组中的大多数成员共享PARP和RST域之外的一个或多个主题,进一步支持子组定义(附加文件7).
表达谱的MaSROs在不同香蕉组织中
采用实时荧光定量PCR (qRT-PCR)研究其表达模式MaSROs在香蕉(穆萨AAA,简历。威廉斯)根,叶,茎,和果实(另外锉9).每个PCR产物m经测序证实。成绩单的MaSROs在所有选择的组织中均能检测到,但在果实中表达量较低。值得注意的是,MaSRO2在根中表达量较高,而在香蕉茎和叶中表达量较低。MaSRO1,3.和4聚为同一类群在茎中表现出优先表达。MaSRO5在不同的器官中有一个组成型表达。我们的结果表明MaSROs在香蕉植物的生长期间,可能在多种生物过程中发挥关键作用。
表达特征MaSROs在不同的非生物胁迫下
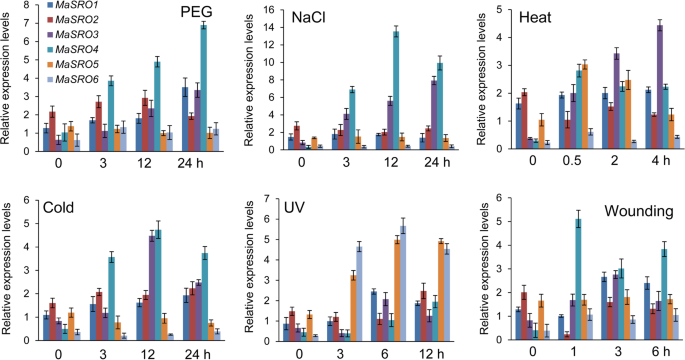
确定…的势函数MaSROs响应于不同的非生物应激,在聚乙二醇(PEG),盐,冷,热,紫外(UV)和伤口处理下测定它们的转录物谱(图。4).采用PEG处理模拟渗透胁迫。在初始阶段,表达水平MaSROs都明显上调了,除了MaSRO5.尤其是转录水平MaSRO1 3和4在PEG处理下逐渐增加,直至24小时。在转录积累中没有发现显着差异MaSRO5在指定的时间点中.盐处理下,MaSRO3和MaSRO4分别在24h和12h达到表达高峰,其他成员表达下调或无明显变化。相比之下,表达Masro1,3,4和5可能由热处理引起。的增加MaSRO3和MaSRO4范围从5.41至11.76倍和增强MaSRO1和MaSRO5为1.18 ~ 3.01倍。在冷胁迫下,表达水平明显上调MaSRO1,2,3.和4,但都MaSRO5和MaSRO6被抑制。值得注意的是MaSRO5和MaSRO6在紫外线胁迫下诱发早期阶段,而其他成员的转录物被压抑。伤口治疗迅速达到上调MaSRO3和MaSRO4.在表达模式中检测到相反的结果MaSRO2.因此,这些文字记录MaSROs对大多数施加的应力处理都有反应。特别是,MaSRO4在多种应激处理下表现出显著的变化,表明它可能在应激反应中具有独特的作用。
qRT-PCR表达分析MaSROs在不同的非生物胁迫下香蕉根。处理后的香蕉根在指定的时间点收获。数据显示了三个独立的生物副本(三个RNA提取;n= 3)。专用底漆MaSROs被列入额外的文件10
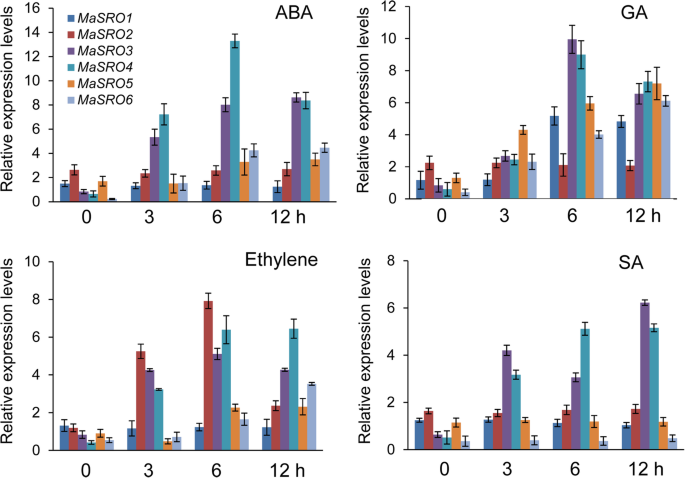
表达谱的MaSROs对各种激素治疗的反应
已有证据表明,不同激素在应激信号转导和细胞反应中发挥重要作用[4,5,6].在这里,我们调查了表达谱MaSROs对ABA、GA、乙烯和SA处理的响应5).最多的MaSROs分别由ABA处理、GA或乙烯处理诱导。有趣的是,SA处理并不能显著上调表达水平ms,除了MaSRO3和MaSRO4。MaSRO5和MaSRO6对ABA或GA处理更敏感。与非生物应力相比,MaSROs同一亚组对外源性激素也有类似反应。例如,MaSRO2在GA或乙烯处理后,亚组Id的表达模式相似。我们还发现,诱导转录谱MaSROsⅱ组与ⅰ组有明显差异。MaSRO2,3.和4在GA或乙烯处理后,I组在指定时间点出现表达高峰。MaSRO5和MaSRO6在本组中,II在整个检测到的时间点显示不断的转录物增加。
表达谱的MaSROs通过qRT-PCR检测。处理后的香蕉根在指定的时间点收获。数据显示了三个独立的生物副本(三个RNA提取;n = 3)。专用底漆MaSROs被列入额外的文件10
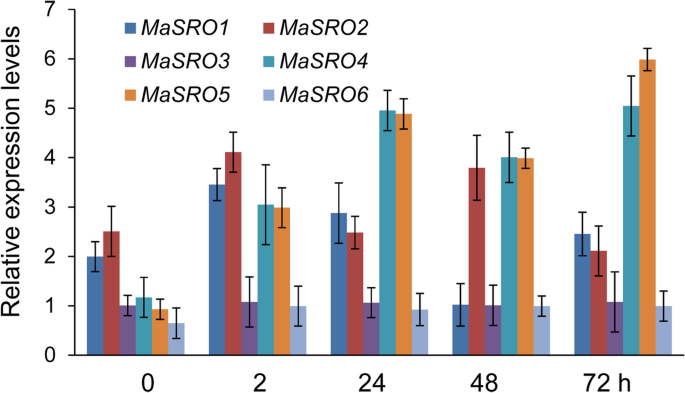
表达谱的MaSROs在香蕉根部接种船TR4
调查是否MaSROs是生物胁迫所必需的,在香蕉根接种船TR4(图。6).除了MaSRO3和MaSRO6,大多数MaSROs与初始阶段相比,2小时后2小时增加超过2倍。中船TR4感染,表达MaSRO2显示出急剧增加,达到2个HPI和48 HPI的两个峰,然后在以下时间点下降。MaSRO4和MaSRO524 hpi表达上调,48 hpi表达下调。的表情高峰MaSRO4和MaSRO5为72 hpi。这两个MaSRO3和MaSRO6连续表达窗口显示低或中等水平。
中存在的分析MaSROs在香蕉根部接种船TR4。分别于0、2、24、48和72 h收获样品船TR4接种。数据显示了三个独立的生物副本(三个RNA提取;n = 3)。专用底漆MaSROs被列入额外的文件10
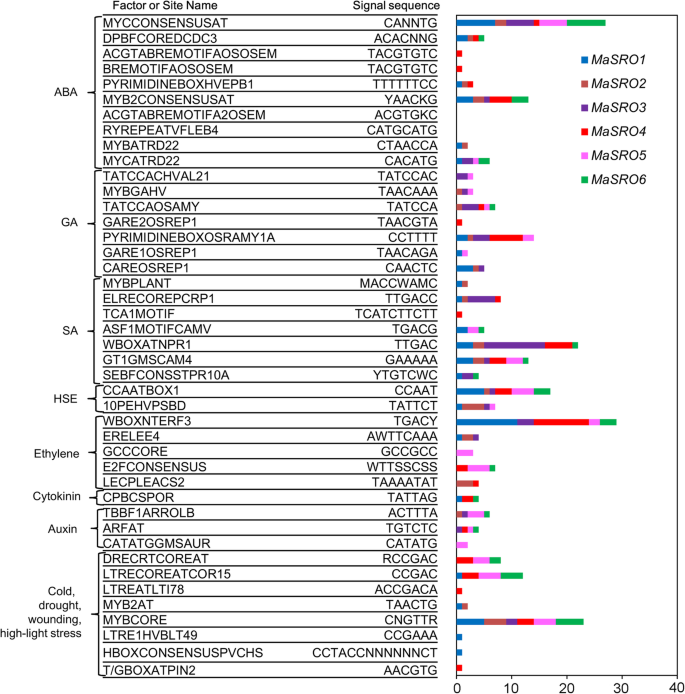
应激和激素诱导的顺式调节元件(CRE)分析
基因表达的转录控制取决于启动子区的CrES。在我们的研究中,翻译起始网站的1.5 kB上游地区MaSROs用于鉴别。根据其潜在的反应功能,发现了一些应激和激素相关的CREs(图。7).每个基因的启动子区均检测到一个以上的CREm.相比之下,鉴定大多数常见的CRE,例如mycconsensat(Canntg,ABA响应因子结合位点),GT1GMSCAM4(GaAAAA,乙烯响应因子结合位点),WboxNTERF3(Tgacy,负责病原体和盐诱导的表达),W-ELRECOREPCRP1中的框(TTGAC,由SA诱导的WRKY DNA结合蛋白识别),ASF1 MOTIFCAMV结合位点(TGACG,通过养蛋白和SA治疗参与转录激活),低温响应元件(CCGAAA,ACCGACA和CCGAC),和养素响应因子绑定站点(TGTCTC)。六分之一的CRE的类型和丰度有明显的差异MaSROs启动子分析(无花果。7).HSE、W-box和CBF/DREB1元件均分散在启动子区域MaSROs.启动子的MaSRO4包含了最多样化的假定CREs集合(总共25个CREs,如CBF/DREB1、LTR、HSE、GARE、SEBF、ABRE、W-box和ERF3等)。特异性检测到TACGTGTC (ABA)、TAACGTA (GA)、TCATCTTCTT (SA)、AACGTG (JA)等激素反应元件MaSRO4启动子。在MaSRO1启动子、GA反应元件如TATCCAC、TAACAAA、TATCCA等相对缺失MaSRO3和MaSRO4.在启动子中只发现了少量的潜在CREsMaSRO1,MaSRO2和MaSRO6.GA和SA反应元件在MaSRO6启动子。通过组合的表达模式MaSROs通过CER分析,我们发现MaSROsCREs的种类和数量与多刺激的反应有正相关。
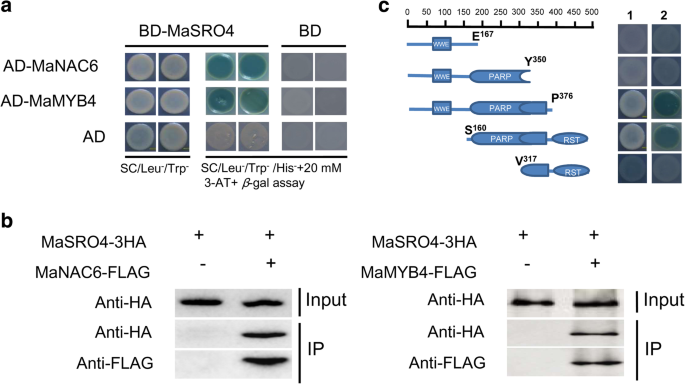
与MaSRO4相互作用蛋白的鉴定
早期的研究表明,AtRCD1和OsSRO1c可以与许多转录因子(DREB2B、AP2/ERF、MYB、bZIP和NAC家族)相互作用,激活应激信号通路[7,9,19,20.].因为表达MaSRO4并进一步分析其相互作用蛋白,预测胁迫相关的调控机制。结构域分析发现MaSRO4中存在完整的WWE-PARP-RST结构,提示该蛋白可能还与水稻或水稻的同源转录因子相互作用拟南芥.这里,进行酵母双杂化测定和免疫沉淀(共同IP)以鉴定Masro4的相互作用蛋白。使用Masro4-BD构建体作为诱饵蛋白质,并且将选定的香蕉TFS构建为捕食载体。通过酵母的生长选择培养基(缺乏Leu,TRP,他和Ade)和α.-半乳糖苷酶检测,全长MaSRO4蛋白可直接与MaNAC6和MaMYB4相互作用(图。8a).此外,我们共同表达MaSRO4-3公顷和TF-FLAG在拟南芥原生质体。Co-IPs使用Anti-FLAG树脂(图。8b).抗3ha抗体的Western blot分析显示沉淀部分含有MaSRO4-3HA。因此,MaSRO4-3HA可被MaNAC6−/MaMYB4-FLAG免疫沉淀。
通过酵母双杂交和Co-IP检测鉴定出masro4相互作用蛋白。一个MaSRO4与MaMYB4或MaNAC6相互作用的酵母双杂交试验。以BD空载体共转化AD-MaMYB4或-MaNAC6为阴性对照。相邻的两个无性系在每个互作试验中都有不同的菌落。bMaMYB4或MaNAC6与MaSRO4相互作用的Co-IP检测。编码3HA的MaSRO4基因(MaSRO5-3HA)和标记FLAG的MaMYB4或MaNAC6基因(MaMYB4-或MaNAC6-FLAG)共表达拟南芥原生质体。蛋白提取物(Input)用抗flag树脂免疫沉淀。用抗ha抗体检测MaSRO4,用抗flag抗体检测MaMYB4和MaNAC6。c利用酵母双杂交系统研究MaMYB4与MaSRO4截短片段的相互作用。为结构域-结构域相互作用制备了多种MaSRO4缺失结构。左图为MaSRO4和缺失衍生物的结构域示意图。每个截断点上面的数字表示MaSRO4的AA坐标。右图显示了酵母生长(No. 1)和β-半乳糖苷酶测定(第2位)
为了了解MaSRO4的不同结构域是否对其与MaMYB4的相互作用是必要的,通过减少MaSRO4的长度产生了不同的N-和c端截尾。在酵母双杂交系统中,缺乏WWE结构域的MaSRO4对与MaMYB4的互作没有显著影响(图)。8c),表明WWE结构域在蛋白质相互作用中不是必需的。然而,在该系统中不可能单独检测RST结构域,因为同时缺乏WWE和PARP结构域的c末端结构体强烈地自动激活了报告基因在酵母中的表达。PARP结构域的缺失导致与MaMYB4失去相互作用,表明该结构域是MaSRO4功能所必需的。
讨论
虽然SRO同源基因在植物界广泛存在,但在水稻和植物界中仅有少量同源基因拟南芥已经表征了调节植物发育,提高植物对非生物胁迫的抵抗力[13,14,15,16,17,18,19,20.].在我们的研究中,有六个MaSROs在香蕉基因组中被鉴定。系统发育分析显示,基于全长蛋白序列,两大主要类群中聚集的15个物种的SRO同源性(图。3.)和PARP域(附加文件8)[7,21].第II组以前被认为是开花植物的双子体组[7],而香蕉的MaSRO5和MaSRO6也聚在这一组。由于分析方法和标准不同,亚组(I和II)与以前的分类不同[7].在Ia亚群中,除香蕉外,选择的单子叶植物至少有两个SROs,提示该谱系中的重复事件可能发生在香蕉之后。实际上,扩张事件发生在p .金属盘.Ib亚群中有3个预测的SROs,香蕉4号和5号染色体中有2个m基因,分别。假设重复基因的维持在胁迫反应和植物发育中提供了冗余功能,如AtRCD1和AtSRO1 [9].
组织特异性转录分析表明MaSRO1,3.,4和6更丰富的茎和叶,而MaSRO2在根中高度表达,就像在水稻中一样[20.].丰富的m茎和叶中的表达可能参与植物生长和发育的调节。根系中具有高转录物的候选者对于感知各种环境刺激可能是重要的。我们也发现了大部分MaSROs在PEG处理下,I组表达上调(图。4).同样的,突变的水稻OsSRO1c和拟南芥rcd1-3/sro1-1展示了气孔孔径的增加和对干旱的敏感性[15,20.].看起来自律监管可能参与维持细胞Turgor压力和渗透胁迫下膜损伤的降低。此外,QRT-PCR分析显示每个MaSROs对热、紫外线、冷、盐和伤害处理至少有一种反应(图。4).因此,不同的SROs可能导致不同的非生物反应。有人支持rcd1-1突变体比野生型植物更耐受紫外线[14].与SROs在非生物胁迫下的功能相比,目前对SROs在生物胁迫下的反应知之甚少。先前的研究表明atrcd1.参与了植物生长的调节,但不参与防御反应的激活[29].我们发现超过一半的MaSROs在香蕉根中表现出差异表达船TR4。PARP蛋白的药理抑制阻断了由微生物相关分子模式诱导的植物对生物胁迫的响应[30.].在拟南芥,PARG1(聚(adp -核糖)糖水解酶)的丢失导致对坏死营养病原体更敏感葡萄孢菌[31,32].因此,MaSROs在生物和非生物胁迫处理下有不同的调控机制。
越来越多的证据表明,不同的植物激素在植物对非生物和生物胁迫的抗性反应中起着重要的作用[4,5,6,13].在目前的研究中,大多数MaSROsABA、乙烯和GA处理上调表达。但只有MaSRO3和MaSRO4在SA处理下表现出诱导表达(图。5).前一项研究表明,非洲生物应激反应大大受到ABA控制,初步SA可能主要诱导防御不同的生物攻击者[3.].它促使我们推测MaSRO3和MaSRO4多种胁迫诱导的应激不仅可能涉及非生物胁迫,也可能涉及生物胁迫。事实上,基因表达依赖于多个CREs的存在,这些CREs整合来自不同tf的信号,控制细胞的感知和对环境因素的反应[33].ABA响应元件(ABREs)是最常见的CREs之一m启动子。这很可能与转录本积累MaSROs通常是由ABA处理引起的(图。5).大多数被识别的CREsMaSRO4启动子可以解释其表达水平在多种胁迫和激素作用下上调的原因。同样的,MaSRO2对乙烯和非生物胁迫更敏感,这可能与CREs的数量和类型有关。相比之下,相对较少的CREs在MaSRO1启动子,对应于不同处理后低表达或无明显表达(图。4和5).CREs的重叠表明基因调控网络对不同环境刺激的反应是复杂的。在冷响应基因的启动子中也检测到ABRE和C-repeat motif/drought-responsive element (CRT/DRE) [34,35].ABRE作为耦合因子,与CRT/DRE协同响应干旱和高盐度[33].所以,MaSROs可能通过调节复杂的激素网络来控制生物和非生物压力之间的优先切换。
基于的转录特征MaSRO4我们分析了MaSRO4与MaMYB4和MaNAC6直接互作的互作伴侣(图2)。8).过度的MaMYB4同族体,osmyb4.,有效上调防御基因的转录水平,提高抗逆性[36].NAC也被认为是生物和非生物信号通路相互作用的中心,被JA、乙烯、ABA和SA激活[37,38].同样,AtRCD1或OsSRO1c可与多种转录因子相互作用,以响应不同的胁迫处理[7,9].有趣的是,AP2可以与ATRCD1,ATSRO1和OSSRO1C互动[7,9],但在酵母双杂交体系中未检测到与同源物MaSRO4的相互作用。这表明SRO家族的功能多样性可能是由与特定TFs的选择性相互作用引起的。
为了进一步识别MaSRO4与tf的相互作用域,我们生成了不同的N-和c端截尾。对保守原子吸收光谱的分析支持WWE结构域可以与带正电的par结合袋形成-barrel的一半[39].然而,WWE结构域的缺失并不影响MaSRO5与MaMYB4的相互作用(图4)。8C),表明该域对植物的生存是不可缺少的。虽然保守的PARP,如AtRCD1,在植物中不具有adp -核糖转移酶活性[7[是否需要与MAMYB4相互作用需要MasRO5的PARP结构域(图。8c). AtRCD1和AtSRO1中PARP结构域的部分或完全丢失导致表达的变化和耐受性的丧失[9,15].支持小麦PARP功能域的研究TaSRO1可以补充阻力拟南芥植物受盐胁迫[21].然而,PARP是否对植物SROs的功能进行变构调控还有待研究。与RST结构域相比,单子叶SROs的c端氨基酸更加保守(附加文件)6).单子叶植物似乎存在着保守的抗逆性机制。双子叶和单子叶的RST域可能在参与激活基因表达的蛋白招募中具有不同的功能。例如,AtRCD1和AtSRO1的RST域对与tf的相互作用很重要[7,15,16].然而,在我们的研究中,MaSRO4与MaMYB4的相互作用并不需要RST域(图)。8c).同样,没有RST域的OsSRO1c仍然与OsDREB2B交互[20.].因此,SRO的这些域对功能多样性和多个信号通路的激活是至关重要的。如何不同的SRO专门识别关键TFS并调节下游基因的表达仍然未知。需要分析TF复合物的蛋白质相互作用分析。
结论
在我们现在的研究中,六MaSROs在香蕉基因组中进行了鉴定和特征分析。总共77个s从15种的成员聚集成两个主要组,具有明显的结构差异。单子台自律监管首先在第二组中发现。QRT-PCR测定显示一半MaSROs在香蕉茎和根中表达量高。根据不同应激和激素处理引起的转录水平,MaSROs可能参与复杂应激信号通路的串扰。CREs的数量和类型进一步支持的表达概要MaSROs.特别是,MaSRO4在启动子区域中有许多CRES表现出对多重应激处理的阳性反应,这表明它可能是培育耐受胁迫品种的好来源。酵母双杂化和共同IP测定表明,Masro4可以通过PARP结构域直接与MANAC6和MAMYB4相互作用。因此,我们的结果为Masros的与压力相关的生理功能提供了一些新颖的信息,但它们的详细角色仍需要许多实验验证。
方法
植物材料和生长条件
“Williams (Cavendish亚群,AAA)”和“船TR4来源于中国热带农业科学院,海口。植株在Murashige-Skoog培养基上培养[40].在进行生物和非生物胁迫处理实验之前,将微繁殖植物驯化在安全的荫蔽环境中,如Wang et al. (2012) [41].
鉴定SRO和系统发育树施工
要从16种不同的物种中识别SRO,请从各个项目数据库下载序列文件,包括香蕉[42,43:香蕉基因组中心(http://banana-genome-hub.southgreen.fr/, DH彭航版2),拟南芥[44):拟南芥信息资源(http://www.arabidopsis.org),Broachypodium distachyon.[45:慕尼黑蛋白质序列信息中心(http://mips.helmholtz-muenchen.de/plant/brachypodium1.2版),Medicago truncatula[46: HapMap项目(http://www.medicagohapmap.org),奥雅萨苜蓿[47:水稻基因组注释计划(http://rice.plantbiology.msu.edu7.0版),Physcomitrella金属盘[48):Physcomitrella金属盘资源(http://cosmoss.org/,3.3版),玉米[49]:玉米遗传基因组数据库(https://www.maizegdb.org/,3.0版),和马吕斯有明显[50]:蔷薇科基因组数据库(http://www.rosaceae.org/).两个网站(http://www.phytozome.net.和https://www.ncbi.nlm.nih.gov/)用于搜索sro甘氨酸最大(2.0版)(51],茄属植物lycopersicum[52],Setaria斜体(2.2版)(53],杨树trichocarpa(3.0版)(54],葡萄[55],Phoenix Dactylifera[56],Elaeis guineensis[57),而衣藻reinhardtii[58].此外,Pfam数据库中的PARP (PF00644)和RST (PF12174)域http://pfam.xfam.org/, 2018年9月访问的Pfam 32.0)用作查询,以确定各自项目数据库中的所有SRO序列(p-value = 0.001) [7].冗余序列通过减少冗余工具(http://web.expasy.org/decrease_redundancy).最后使用Scanperite(https://prosite.expasy.org/scanprosite/)[59]及SMART (http://smart.embl-heidelberg.de/,修订于2018年1月4日)[60].
使用默认参数的ClustalW程序(MEGA版本7.0.1)对全长SRO蛋白序列进行比对[61].为了比较SRO进化的结构域保守性,我们还利用SRO的PARP结构域序列进行同源性比对。采用MEGA 7.0.1的最大似然(ML)方法构建了两棵系统发育树,参数如下:WAG蛋白替代模型、gamma分布和bootstrap(1000个重复)。每个MaSRO的分子量、等电点和大平均疏水性(GRAVY)通过ExPASy网站(http://www.expasy.org/tools/)[62].
预测染色体位置,基因结构和抗裂缝m年代
所有的起始和结束位置MaSROs从香蕉基因组数据库中获得每条染色体。它们的外显子-内含子结构m将全长cDNA序列与基因组DNA序列比对确定。每个的结构示意图m由基因结构显示服务器(http://gsds.cbi.pku.edu.cn/index.php,版本2.0)[63].从每个基因的起始密码子上游1500 bp序列中鉴定出推测的crem使用PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html /) [64].
保守基序的预测和MaSROs的亚细胞定位
使用模因工具(http://meme-suite.org/tools/meme,版本5.0.4),遵循最佳主题宽度(≧10,≦150)和七个主题。Plant-mPLoc服务器(http://www.csbio.sjtu.edu.cn/ BioInf / Plant-Multi /,2.0版本用于预测Masros的亚细胞本地化[65].
香蕉苗经不同胁迫处理后接种船TR4
在渗透和盐胁迫下,用15%的PEG6000和200 mM的NaCl溶液处理六叶香蕉幼苗的根[66], 分别。在渗透和盐胁迫处理后在0,3,12和24小时收集样品。对于冷和热休克应力,将幼苗在4℃(在0,3,12和24小时)和42℃(在0,0,0.5,2和4h上取样)转移到生长室中。对于紫外线处理,未过滤的杀菌灯(λ.= 254 nm) (TUV 15 W/G15 T8,菲利普斯,荷兰)在光照区域上方15 cm处放置0,3,6,12 h。用手术刀划伤香蕉根尖,在室温下加水0、1、3、6 h。外源激素处理下,香蕉根分别在添加100 μM ABA、SA、GA3和乙烯的营养液中培养。分别于0、3、6和12 h后取样。为船TR4接种,将该菌株在半强度马铃薯葡萄糖琼脂上培养25℃培养两周。然后将孢子以5000rpm离心5分钟,将沉淀重新悬浮在双蒸馏水中。真菌悬浮液的光学密度调节至106孢子每毫升用无菌水。将根浸泡在直径9 cm的培养皿中15 ml真菌悬液中,分别于0、2、24、48和72 h取样。所有样品在液氮中快速冷冻,用于RNA分离。每个实验重复三次。
RNA分离和qRT-PCR
用RNeasy Plant Mini Kit (Qiagen, Valencia, California, USA)分离不同香蕉组织的总rna。根据制造商的说明,使用RevertAid™first strand cDNA Synthesis Kit (Thermo Scientific, USA),从2 μg dnase处理的总RNA合成了第一条cDNA链。根据标准协议,LightCycler®480 SYBR Green I Master Mix用于LightCycler®480系统(罗氏诊断公司,曼海姆,德国)的qRT-PCR分析。10 μl的反应液中包含0.1 μl的反向和正向引物(100 pmol)、1 μl的cDNA、5 μl的FastStart SYBR Green I Master Mix和3.5 μl的核酸酶无水。PCR反应如下:95℃3 min, 40个循环(95℃10 s, 57℃20 s, 72℃20 s)。香蕉18 s rRNA基因(GenBank ID: U42083)作为内部对照。所有反应均采用三次生物重复。这些引物序列列在附加文件中10.
二者混合酵母筛选
全长或截短的MaSRO5与pGBKT7中的Gal4 DNA结合域(BD)融合,转化酵母株AH109。转化子生长在SD/−Trp板上。lacZ分析被执行以检查全长或截短的自我激活MaSRO5.所鉴定的酵母菌AH109含有Gal4-BD -MaSRO5融合与pGADT7中含有GAL4 -AD- tf的Y187 (MATα)在96孔板上配对(GAL4 AD融合)。配对产物被镀在添加3-氨基-1,4,5-三唑(3-AT)的SD/−Trp/−Leu和SD/−Trp/−Leu/−His/−Ade上。酵母生长持续7 d,对阳性菌落进行处理α.-半乳糖苷酶测定:SD/−Trp/−Leu/−His/−Ade/X-α-Gal。培养皿在30°C下培养,生长5 d后拍照。
Co-immunoprecipitation化验
拟南芥原生质体是根据Yoo et al.(2007)描述的方案从4周大的植物中制备的[67].MaSRO5-HA与TF-FLAG在拟南芥原生质体中共同表达。蛋白表达采用原生质体(1 ml, 2 × 106细胞)转染100 μg质粒DNA。转染后的原生质体在室温黑暗下培养16 h。蛋白用商业亲和树脂纯化(Sigma的抗flag m2树脂和罗氏的抗ha 3F10树脂)。免疫沉淀用10% SDS-PAGE分离,免疫印迹蛋白用抗flag和抗ha抗体检测[68].
统计分析
采用SPSS统计软件包(SPSS Inc., Cary, NC, USA, v.22)进行数据处理和统计分析。采用学生t检验对两种处理方法的差异进行统计分析。
缩写
- 阿巴:
-
脱落酸
- 上:
-
ABA反应元素
- CO-IP:
-
免疫沉淀反应
- CRT / DRE:
-
C重复主题或干旱响应元件
- 船TR4:
-
Fusarium oxysporumF。sp。号热带比赛4
- HPI:
-
小时后接种
- 是:
-
茉莉酸
- PARP:
-
保利(ADP-ribose)聚合酶
- PEG:
-
聚乙二醇
- 存在:
-
实时定量聚合酶链反应
- ROS:
-
活性氧
- RST:
-
RCD1-SRO-TAF4
- SA:
-
水杨酸
- 地面读数:
-
类似于RCD一个
- TF:
-
转录因子
- 紫外线:
-
紫外线
参考
- 1.
1980年以来的气候变化趋势与全球作物产量。科学。2011;333:616-20。
- 2.
Fujita M, Fujita Y, Noutoshi Y, Takahashi F, Narusaka Y, Yamaguchi-Shinozaki K,等。非生物和生物应激反应之间的串扰:当前从应激信号网络收敛的观点。植物学报2006;9:436-42。
- 3.
活性氧:代谢、氧化应激和信号转导。植物学报2004;55:73 - 99。
- 4.
2 .杨志强,王志强,王志强,等。脱落酸在植物-病原互作中的作用。植物学报。2005;8:409-14。
- 5.
调控茉莉酸信号网络的分子分子。植物学报。2005;8:532-40。
- 6.
陈志强,陈志强,陈志强,等。后基因组时代植物非生物胁迫反应的研究进展。植物j . 2010; 61:1041-52。
- 7.
Jaspers P, Overmyer K, Wrzaczek M, Vainonen JP, Blomster T, Salojärvi J,等。含有SRO蛋白家族的RST和parp样结构域:陆地植物中蛋白质结构、功能和保护分析。BMC基因组学。2010;11:170。
- 8.
Belles-Boix E,Babiychuk E,Van Montagu M,inzéd,kushnir s. ceo1,来自的新蛋白拟南芥,保护酵母免受氧化损伤。2月。2000;482:19-24。
- 9.
Jaspers P, Blomster T, Brosche M, Salojärvi J, Ahlfors R, Vainonen JP,等。不相等冗余的RCD1和SRO1介导应激和发育反应,并与转录因子相互作用。植物j . 2009; 60:268 - 79。
- 10.
OTTO H,RECHE PA,Bazan F,DITTMAR K,HAAG F,KOCH-NOLTE F.在硅类别的PARP样聚(ADP-核糖基)转移酶(零件)中的硅表征中。BMC基因组学。2005; 6:139。
- 11.
哺乳动物细胞中的核adp -核糖基化反应:我们今天在哪里,我们将走向哪里?Microbiol Mol Biol Rev. 2006; 70:789-829。
- 12.
WWE结构域:蛋白质泛素化和ADP核糖基化的共同相互作用模块。生物化学学报2001;26:273-5。
- 13.
王志强,王志强,王志强,等。拟南芥自由基诱导的细胞DEATH1属于WWE蛋白-蛋白相互作用域蛋白家族,可调节脱落酸、乙烯和茉莉酸甲酯反应。植物细胞。2004;16:1925-37。
- 14.
Fujibe T, Saji H, Arakawa K, Yabe N, Takeuchi Y, Yamamoto KT。拟南芥的一种甲基抗紫罗兰素突变体,对臭氧敏感rcd1,耐补充紫外线b照射。植物杂志。2004;134:275 - 85。
- 15.
Teotia S, Lamb RS.副同源基因RADICAL-INDUCED细胞DEATH1和类似于RCD one1有部分冗余功能期间拟南芥发展。植物杂志。2009;151:180 - 98。
- 16.
Teotia S, Lamb RS。RCD1和SRO1是否有必要维持分生组织的命运拟南芥.J Exp Bot. 2010; 62:1271-84。
- 17.
朱建军,黄安华,傅旭东,等。质膜钠+/小时+反转运体SOS1与RCD1相互作用,并在抗氧化应激中发挥作用拟南芥.美国国家科学研究院2006;103:18816-21。
- 18.
Borsani O,朱茹,Verslues Pe,Sunkar R,Zhu JK。来自一对天然顺式反义转录物的内源性siRNA调节耐盐性拟南芥.细胞。2005;123:1279 - 91。
- 19.
你j,zong w,li x,ning j,hu h,li x等。Snac1靶向基因OsSRO1c通过调节植物的过氧化氢来调节气孔关闭和抗氧化应激冰.J Exp Bot. 2012; 64:569-83。
- 20。
尤建,宗伟,杜洪,胡洪,熊磊s的家庭,OsSRO1c,通过与多种转录因子的相互作用介导对多种非生物胁迫的反应。中国农业科学(英文版)。
- 21。
刘爽,刘爽,王敏,魏涛,王敏,等。小麦类似于RCD-ONE基因通过调节氧化还原稳态和维持基因组完整性来增强幼苗生长和非生物胁迫性。植物细胞。2014; 26:164-80。
- 22。
李华,李锐,曲芳,姚军,郝颖,王旭,等。识别的s苹果中的基因家庭(马鲁斯×有明显)具有功能性的特征MDRCD1.Tree Genet Genom. 2017;13:94。
- 23.
Dale J,James A,Paul Jy,Khanna H,Smith M,Paraza-Echeverria S,等。转基因卡腔香蕉具有抗镰刀枯萎性的热带比赛4. NAT Communce。2017; 8:1496。
- 24.
PérezVicenteL,Dita M,Martinez de La Parte E. Banana造成的香蕉枯萎病(巴拿马病)的技术手册预防和诊断Fusarium oxysporumF。sp。号热带第4种(TR4)。W Diag Fus Wilt. 2014; 4:1-74。
- 25.
干旱是旱作喂养的东非高原香蕉的主要减产因素。水资源管理。2011;98:541-52。
- 26.
张强,张建忠,周文伟,孙丽丽,陈建伟,陈玉军,等。低温对敏感香蕉和耐性大蕉光合作用和抗氧化酶的影响(穆萨sp)品种。Photosynthetica。2011;49:201-8。
- 27.
Popper ZA, Michel G, Hervé C, Domozych DS, Willats WG, Tuohy MG, et al.;植物细胞壁的进化和多样性:从藻类到开花植物。植物学报。2011;62(62):567。
- 28.
(1)海洋原绿球藻基因组多样性的全球生物地理学研究。ISME j . 2016; 10:1856 - 65。
- 29.
朱勇,杜波,钱军,邹波,华军rcd1独立于防御激活拟南芥.植物杂志。2013;161:2005-13。
- 30.
Briggs AG, Adams-Phillips LC, Keppler BD,等。一种转录组学方法揭示了聚(adp -核糖基)在基础防御反应中的新作用拟南芥.《公共科学图书馆•综合》。2017;12:e0190268。
- 31.
Adams-Phillips L,Briggs AG,Bent Af。聚(ADP-核糖基)的破坏机制改变了反应拟南芥生物压力。植物杂志。2009;152:267 - 80。
- 32.
PARP2是主要的多聚(adp -核糖)聚合酶拟南芥DNA损伤和免疫反应。公共科学图书馆麝猫。2015;11:e1005200。
- 33.
陈WJ,朱T.环境压力反应作用的转录因子网络。趋势植物SCI。2004; 9:591-6。
- 34.
朱涛,新泽西普罗沃特。低温的转录反应及其调控拟南芥.J Bot. 2003; 81:1168-74。
- 35.
徐志刚,陈志刚,陈志刚,等。拟南芥aba依赖表达中两个顺式作用元件abre和dre的相互作用RD29A.基因对脱水和高盐度胁迫的反应。植物j . 2010; 34:137-48。
- 36.
陈志强,陈志强,陈志强,等。水稻的异位表达Osmyb4拟南芥基因增加了对非生物,环境和生物应激的耐受性。physiol mol植物疗法。2006; 69:26-42。
- 37.
Ohnishi T,Sugahara S,Yamada T,Kikuchi K,Yoshiba Y,Hirano Hy等。奥纳克6.的成员南汽基因家族,是由水稻的各种胁迫诱导的。基因学报。2005;80:135-9。
- 38.
基于功能基因组学的干旱信号及其与植物激素信号通路的交互作用。咕咕叫基因。2017;18:469 - 82。
- 39.
罗X,克劳斯WL。PAR与PARP:通过poly (adp -核糖)和PARP-1传递细胞应激信号。基因Dev。2012;26:417-32。
- 40.
陈志强,陈志强,陈志强,等。一种烟草组织培养快速生长和生物测定的新方法。杂志杆菌。1962;15:473 - 97。
- 41.
香蕉枯萎病抗性(4小种)两个诊断标记的鉴定与评价穆萨spp)。Mol Biol rep 2012; 39:451-9。
- 42。
Droc G,Lariviere D,Guignon V,Yahiaoui N,This D,Garsmeur O,等。香蕉基因组枢纽。数据库。2013:BAT035。https://doi.org/10.1093/database/bat035.
- 43。
陈志强,陈志强,陈志强,等。香蕉的改良穆萨acuminata“使用NGS数据和半自动生物信息学方法的参考序列。BMC基因组学。2016; 17(1):243。
- 44。
拟南芥基因组计划。开花植物基因组序列分析拟南芥.大自然。2000;408:796 - 815。
- 45。
国际刷印倡议。模型草的基因组测序和分析Broachypodium distachyon..大自然。2010;463:763-8。
- 46。
Young Nd,Debelléf,oldroyd Ge,Geurts r,Cannon Sb,Udvardi Mk等。这Medicago基因组提供了深入了解根瘤菌共生的进化。大自然。2011;480:520-4。
- 47.
王志强,王志强,王志强,等。改进的奥雅萨苜蓿Nipponbare参考基因组使用下一代序列和光学地图数据。大米。2013;4。
- 48.
郎志强,乌尔里希,穆拉特,富克斯,詹金斯,哈斯等。这Physcomitrella金属盘染色体规模的组件揭示了苔藓基因组结构和演化。植物J. 2018; 93:515-33。
- 49.
王志强,王志强,王志强,等。B73玉米基因组:复杂性、多样性和动态。科学。2009;326:1112-5。
- 50.
郑平,李涛,郑春华,等。中国蔷薇科植物基因组数据库的新数据和功能。核酸Res. 2018;47: D1137-45。
- 51.
徐志强,王志强,王志强,等。古多倍体大豆的基因组序列。大自然。2010;463:178 - 83。
- 52.
番茄基因组财团。番茄基因组序列提供了深入了解肉质水果的进化。大自然。2012;485:635-41。
- 53.
Bennetzen JL,Schmutz J,Wang H,Percifield R,Hawkins J,Pontaroli Ac,等。参考模型植物濑鹿的基因组序列。自然生物技术。2012; 13(30):555-61。
- 54.
张志强,张志强,张志强,等。黑杨的基因组杨树trichocarpa(托尔。&灰色)。科学。2006; 313:1596-604。
- 55.
jillon O, Aury JM, Noel B, Policriti A, Clepet C, Casagrande A, et al.;葡萄基因组序列表明主要被子植物门的祖先六倍体化。大自然。2007;449:463-7。
- 56.
Al-Dous Ek,George B,Al-Mahmoud Me,Al-Jaber My,Wang H,Salameh Ym,等。de nogo基因组测序和枣棕榈的比较基因组学(Phoenix Dactylifera).自然生物技术。2011;29:521-7。
- 57.
Singh R, Ong-Abdullah M, Low ETL, Manaf MAA, Rosli R, Nookiah R,等。油棕基因组序列揭示了新旧世界的干涉性物种的差异。大自然。2013;500:335-9。
- 58.
Merchant SS, Prochnik SE, Vallon O, Harris EH, Karpowicz SJ, Witman GB,等。这衣藻基因组揭示了动植物关键功能的进化。科学。2007;318:245-50。
- 59.
Sigrist CJ, De Castro E, Cerutti L, Cuche BA, Hulo N, Bridge A, et al.;新的和持续的发展在PROSITE。核酸学报2012;41:D344-7。
- 60.
Letunic I, Bork P. 20年SMART蛋白域注释资源。核酸Res. 2017;D1(43): D493-6。
- 61.
MEGA7:用于更大数据集的分子进化遗传学分析7.0版本。Mol Biol Evol. 2016; 33:1870-4。
- 62.
Gasteiger E,Gattiker A,Hoogland C,Ivanyi I,Appel Rd,Bairoch A. Expasy:用于深入蛋白质的蛋白质组织的知识和分析。核酸RES。2003; 31:3784-8。
- 63.
胡斌,金军,郭爱华,张华,罗军,高国刚。gss2.0:一种改进的基因特征可视化服务器。生物信息学。2014;31:1296-7。
- 64.
王志强,王志强,王志强,等。植物顺式调控元件数据库,启动子序列硅分析工具的门户网站。核酸学报2002;30:325-7。
- 65.
Chou KC,沉HB。Plant-MPLOC:自上而下的策略,以增加预测植物蛋白亚细胞定位的力量。Plos一个。2010; 5:E11335。
- 66。
香蕉谷胱甘肽S-转移酶(GST)基因的克隆与表达穆萨acuminataL. AAA组,cv。卡文迪什)。2013; 32:1373-80。
- 67。
yoo sd,cho yh,sheen J.拟南芥叶肉原生质体:用于瞬时基因表达分析的多功能细胞系统。Nat Protoc。2007;2:1565 - 72。
- 68。
在拟南芥中,激酶LYK5是主要的几丁质受体,并与rel形成几丁质诱导的复合物几种激酶CERK1。Elife。2014;3:e03766。
确认
不适用。
资金
国家自然科学基金项目(no . 31770476, no . 314704651)资助。出版费用由中国农业研究系统(CARS-32)资助。中国热带农业科学院中央公益性科研院所基础科研基金资助(1630052019020)。资助机构不参与研究的设计,也不参与数据的收集、分析和解释或手稿的撰写。
数据和材料的可用性
本研究过程中产生或分析的所有数据均包含在本发表的文章及其补充信息文件中。
作者信息
隶属关系
贡献
LZ、上海、JX、WW策划设计研究;LZ, DZ, HH, WL, YH进行实验;LZ、DZ、HH、WL、YH、JX、SH和WW对数据进行分析;LZ、DZ、HH、WL、YH、JX、SH、WW撰写手稿。所有的作者阅读并批准了手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。既没有人或动物的对象,人或动物的材料或人或动物的数据使用在这个手稿。作者声明,本文中描述的植物的实验研究工作符合机构、国家和国际指南。
同意出版
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
额外的文件1:
氨基酸在保守基序中的组成。(XLSX 10 KB)
额外的文件2:
香蕉马斯罗斯的染色体位置,亚细胞定位和借调物理化学特性。(XLSX 10 KB)
额外的文件3:
具有代表性的16种植物的SRO同源性信息。(XLSX 14 kb)
额外的文件4:
用于构建系统发育树的蛋白质序列。(TXT 39 kb)
额外的文件5:
系统发生树的纽维克档案。(TXT 2 kb)
额外的文件6:
双子叶和单子叶中WWE、PARP和RST域的序列标志。堆栈的总体高度代表了序列守恒的级别。堆栈内残差的高度表示在指定位置上每个残差的频率。(TIF 7444 kb)
额外的文件7:
SROs中守恒基序的分布。通过MEME工具识别保守的图案。不同颜色的盒子代表了七种图案。底部的量表用来估计蛋白质的长度和每个基序的位置。(TIF 2906 kb)
额外的文件8:
15种植物SROs PARP结构域的非根系统发育树利用Clustal W对PARP结构域的氨基酸序列进行比对,利用MEGA 7.0构建系统发育树。(TIF 947 kb)
额外的文件9:
六的表达分析MaSROs在香蕉不同组织中进行qRT-PCR检测。分别从六叶香蕉幼苗和果实的根、茎和叶中分离得到总rna。数据显示了三个独立的生物副本(三个RNA提取;n= 3)。使用的引物MaSROs被列入额外的文件10.(TIF 1464 kb)
额外的文件10:
引物序列用于本研究。(XLSX 11 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
张磊,周东,胡海涛。et al。全基因组特征s香蕉对生物和非生物胁迫反应的基因家族(穆萨spp)。BMC植物杂志19,211(2019)。https://doi.org/10.1186/s12870-019-1807-x
收到了:
接受:
发表:
关键字
- s家庭
- 香蕉
- 诱导表达
- 非生物胁迫
- 生物应激,激素治疗
- 蛋白质相互作用