摘要
背景
ZF-HD是一个在植物生长发育中起重要作用的基因家族,一些研究发现经过过表达后ATZHD1.在拟南芥蒂利亚纳,繁荣进展,种子变得更大,种子的寿命是延长的,而且,ZF-HD.基因也参与回应逆境压力。整个基因组的ZF-HD.基因家族已经在几种模型植物中进行过研究,例如拟南芥蒂利亚纳和米饭。然而,关于这方面的研究还很少ZF-HD.鞑靼荞麦的基因(Fagopyrum tataricum.),这是一个重要的食用和药物作物。最近公开的季后赛荞麦全基因组序列使我们能够研究组织和表达谱ZF-HD.苦荞基因家族的全基因组研究。
结果
在本研究中,对全基因组和表达谱进行了分析ZF-HD.首次对苦荞基因家族进行了分析。我们确定了20个FTZF-HD.基因并根据系统发生,将它们分成MIF和ZHD亚壳。ZHD基因分为5个亚壳。二十FTZF-HD.基因分布在7染色体上,几乎所有基因没有内含子。我们检测到具有片段重复的七对染色体,但没有检测到串联重复。在不同的组织和不同的水果开发阶段,FTZF-HD.通过实时定量PCR分析获得的基因显示出明显的表达模式。
结论
在这项研究中,20FTZF-HD.基因在Tartary荞麦中鉴定,研究了蛋白质的结构,演化和表达模式。我们的研究结果为进一步分析了生物学功能提供了有价值的基础ZF-HD.基因家庭。我们的研究还为改善鞑靼荞麦作物而奠定了基础。
背景
专门的遗传网络通过编码各种蛋白质来调节植物的生长。含有与特定核苷酸序列结合的转录因子的蛋白质在植物生长、开花、结果和抗胁迫的不同阶段发挥着重要作用[1那2].作为NDA结构域(BD)的同型肿瘤(HD)具有60个保守的氨基酸序列,并在所有真核转录因子中编码Homeobox(Hb)基因[3.].同源结构域的60个氨基酸折叠成一个特征的三螺旋结构,称为识别螺旋,它附着在DNA的主沟形成一个与DNA的特殊连接[4.那5.].HD蛋白通过调控靶基因的表达模式参与动植物的发育[3.].大多数HD蛋白质与蛋白质 - 蛋白质相互作用和具有监管职能的其他域/基序有关[6.].具有同源结构域的蛋白按主题不同分为六个不同的家族:亮氨酸拉链相关的HD (HD- zip)、锌指基序相关的HD (ZF-HD)、wuschell相关的同源盒(WOX)、bell型HD、与HD相关的手指结构域(PHD finger)和结相关的同源盒(KNOX)蛋白[7.].
锌指结构是重要的结构,由锌离子和半胱氨酸或组织组成(在大多数情况下)[8.].作为一个重要的主题,锌手指广泛存在于各种调节蛋白中,可以特异性结合DNA / RNA序列,并参与蛋白质相互作用[9.那10].锌指单位根据Cys和残基的差异分为许多类,如C3hC2H2和C2C2 [8.].锌指同源结构域(zinc finger homeodomain, ZF-HD)蛋白是第一个在C4植物中发现的含HD蛋白和与同源结构域相关的锌指蛋白Flaveria.[11].
目前,ZF-HD.基因家族已被识别拟南芥蒂利亚纳、大米(奥雅萨苜蓿)和番茄(茄属植物lycopersicum)[12那13那14].拟南芥蒂利亚纳有17名ZF-HD成员,他们充当转录因素,具有独特的生理特征,并在鲜花的发展中发挥非常重要的作用[11].干旱,盐度和脱落酸(ABA)可以诱导ATZHD1与ERD1启动子区域结合[15发现了三种基因ZF-HD.基因家族的拟南芥蒂利亚纳,它的迷你锌手指(MIF.由同型器编码的基因和蛋白质序列与ZF-HD蛋白的ZF结构域高度相似,但没有HD结构域[12那16].系统发生与序列分析MIF.和席基因分析表明席基因具有植物特异性,几乎所有的基因都没有内含子[11].直到现在,起源和演变席和MIF.基因人口仍然尚不清楚[12].在大豆,GmZF-HD1和GmZF-HD2与编码钙调蛋白亚型4的基因的启动子区域结合(GmCaM4)和表达GmZF-HD1和GmZF-HD2接种致病菌后增加[17].在番茄中,ZF-HD.基因家族被发现与果实发育和胁迫有关[14].这ZF-HD.基因家族可能在鞑靼荞麦中发挥类似的作用。
常见的荞麦(Fagopyrum esculentum)产于中国西南部,已传播到世界各大洲。苦荞麦(Fagopyrum tataricum.)生长于中国西南部、印度北部、不丹及尼泊尔的山区[18].Tarrary Buckwheat目前是唯一广泛种植的单性唯一的食物作物,在其种子蛋白中具有平衡的必需氨基酸组成,并且具有高于许多粮食作物的总蛋白质含量[8.那19].这ZF-HD.基因家族在许多植物中得到了广泛的研究,一些研究发现过表达后ATZHD1.在拟南芥蒂利亚纳,繁荣进展,种子变大,种子的寿命延长了[12那20.此外,)ZF-HD.基因也参与回应逆境压力[21].然而,ZF-HD.目前对苦荞基因家族的研究还不多Arf, ap2, nac, mad基因家族已经深入研究了鞑靼荞麦[22那23那24那25].因为它的重要作用ZF-HD.因此,系统研究苦荞的各种生理过程具有重要意义ZF-HD.家庭。最近完成的苦荞基因组序列为揭示苦荞的组织、表达和进化特征提供了一个机会ZF-HD.苦荞全基因组水平上的基因家族。本文对20种苦荞的外显子-内含子结构、基序组成、基因组结构、染色体位置、序列同源性及表达模式进行了研究ZF-HD.详细介绍了基因。此外,系统发育关系ZF-HD.基因家族在拟南芥蒂利亚纳而鞑靼荞麦比较了。通过全球表达分析,参与度ZF-HD.测定了苦荞不同生物学过程中的基因家族成员。这个角色FTZF-HD.详细研究了荞麦果实的发展中的基因,为荞麦功能表征提供了有价值的线索ZF-HD.苦荞生长发育的基因家族成员。
结果
识别的FTZF-HD.苦荞基因
识别FTZF-HD.鞑靼荞麦中的基因,一切可能FTZF-HD.使用两种爆炸方法进行季后赛荞麦基因组的成员,多次FTZF-HD.通过这两种方法分离了季后荞麦基因组的基因,并且由于使用基因组霰弹枪策略测序荞麦基因组,其中一些方法FTZF-HD.即使它们在不同的支架上,基因也可能是多余的。在这项研究中,我们共识别了20ZF-HD.基因,我们给它们命名FtZHD1〜FtZHD17和FtMIF1 ~ FtMIF3基于它们在染色体上的物理位置(附加文件2:表S1)。
对于鞑靼荞麦FTZF-HD.其中,FtZHD14蛋白最小,为83aa,最大FTZF-HD.5(330AA)(附加文件2:表S1)。蛋白质分子量为9.33 kda ~ 34.95 kda;初级陪审员由4.94起(FtMIF1)至10.15 (FtZHD10).预测的亚细胞定位结果表明,所有蛋白质都位于核区域中。
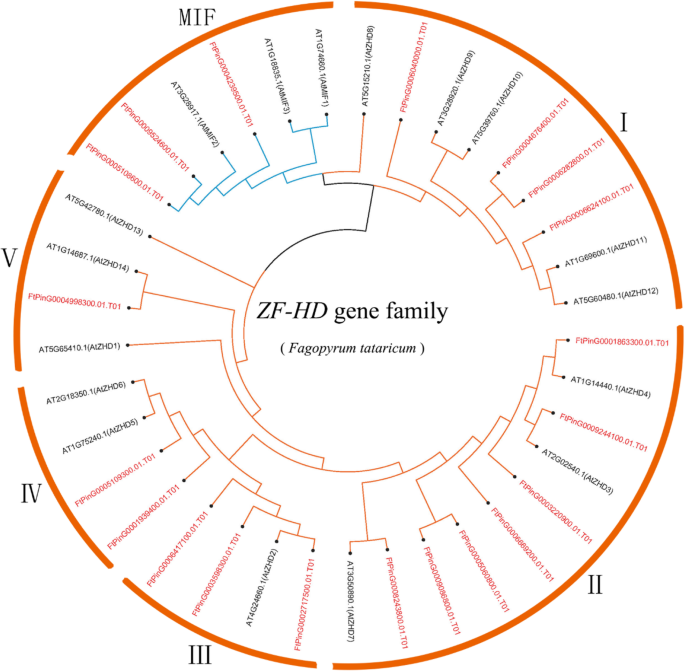
季后荞麦ZF-HD基因家族的系统发育分析
为了探讨ZF-HD蛋白的系统发育关系,抗荞麦中的ZF-HD蛋白质,使用佐剂R11的邻近(NJ)方法来构建由其组成的系统发育树拟南芥蒂利亚纳(17基因)和苦荞(20基因)。系统发育分布表明FTZF-HD.基因家族可分为两个亚属:MIF.和ZHD。席进一步分为五个部分(Zhdi,Zhdii,Zhdiii,Zhdiv和ZHDV)(无花果。1).的数量Zhd IV.基因最少(5%),在ZHD II.基因家族最高(35%)。除了FtZHD17和FtZHD12, 这ZF-HD.Tarrary Buckwheat的基因家族类似于ZF-HD.的家庭拟南芥蒂利亚纳;最高程度的相似性为78.85%(FtZHD14),最低为38.06%(FtZHD9).FtZHD17和FtZHD12和大米更相似吗oszhd1.,44.71和49.27%(附加文件2:表S1)。此外,结果表明ZF-HD.该基因在苦荞中扩增。
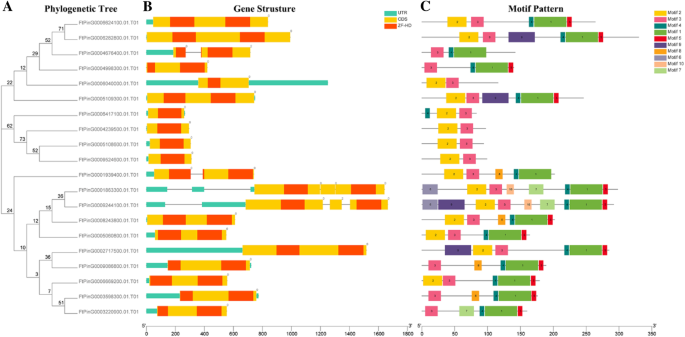
苦荞ZF-HD基因家族结构分析及基序组成
为了进一步理解结构组件FTZF-HD.基因,我们比较了相应的基因组DNA序列,我们获得了外显子和内含子结构FTZF-HD.基因(图。2 b).有趣的是,大部分FTZF-HD.基因(20分中的16个)没有内含子,但其他四种基因中的两个具有内含子。剩下的两个基因每种内含子。此外,两个基因的内含子的位置非常接近,并且两个内含子之间可能存在复制关系。具有类似进化关系的大多数基因具有类似的外显子内部结构。当基因没有内含子时,它意味着它们不容易连接并具有相对节省的功能。该结果与先前报告的情况一致的结果一致ZF-HD.基因几乎没有内含子[11].鞑靼荞麦的内含子ZF-HD.基因是通过进化继承的还是在进化过程中突变获得的,内含子的出现是否对这些基因的原始功能有影响是需要进一步研究的问题。
保守蛋白质基序的系统发育关系,基因结构和架构ZF-HD.苦荞基因。(一种)基于使用毒性R11软件的Tartary荞麦ZF-HD蛋白的全长序列构建了系统发育树。(B.)苦荞的外显子-内含子结构ZF-HD.基因。绿色框表示未经翻译的5'-和3'-地区;黄色框表示外显子;黑线表示内含子。ZF-HD域通过红色框突出显示。该数字表示相应内含子的阶段。(C)Tartary荞麦ZF-HD蛋白的基序组成。图1-10的图案显示在不同的彩色框中。每个主题的序列信息在附加文件中提供3.S2:表。蛋白质的长度可以用底部的刻度来估计
进一步研究特征区域FTZF-HD.蛋白质,结构为20FTZF-HD.采用在线模因分析对蛋白质进行分析。根据模因分析的结果,构造了模型的结构示意图FTZF-HD.蛋白质。我们确定了10个保守的母题,命名为母题1至10(图。2摄氏度).值得注意的是FTZF-HD.基因具有MOTIF3结构域,大多数(60%)具有MOTIF2结构域。有趣的是,MOTIF4是一个特定于ZHD家族的领域,而MOTIF1和MOTIF5几乎被检测到席基因。母题6和母题10是在FtPinG0001863300.01和ftping0009244100.01基因。MOTIF8和MOTIF9在四个基因中存在。MOTIF7,MOTIF8和MOTIF9仅存在于一些基因中。与之相比MIF.基因家族,席基因家族表现出明显的差异,以及功能差异席Tartary Buckwheat的基因可能是由于保守基板的亚家谱的分布。三个三个图案MIF.几个群体中的基因和同一主题席表明,群体中存在保守的主题,但这些保守的主题的功能仍有待澄清。
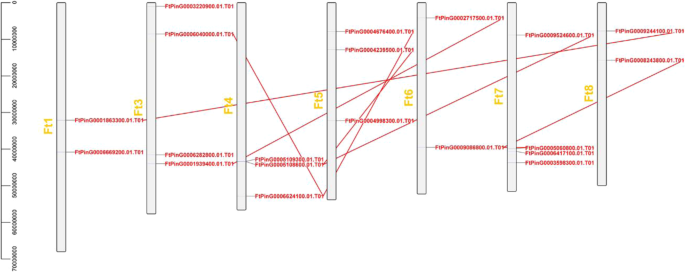
染色体分布与同步分析FTZF-HD.基因
有一个不均匀的分布FTZF-HD.7荞麦染色体(FT2除外)。染色体3和染色体7,其两种染色体最多ZF-HD.基因,每个都有四个ZF-HD.基因和三种染色体具有最低数量的ZF-HD.基因(2ZF-HD.基因)(图。3.).基因复制在发生新功能和基因扩增的情况下起着重要作用。要确定基因之间的片段复制事件,我们采用了标准[26].当查询覆盖和候选基因的一致性≥80时,它们被认为是重复基因。200 kB范围内的两种或更多基因范围内的染色体区域定义为串联复制事件。因此,Tarrary Buckwheat基因重复的分析表明,在Tartary荞麦染色体上没有发现串联重复基因;然而,12个基因参与片段重复事件,以及ZF-HD.染色体4上的基因参与最多的片段重复事件(图。3.).这些结果表明了一些FTZF-HD.基因可能是由基因的重复片段产生的,而这些复制事件是进化的主要驱动力FTZF-HD..
为了进一步推断苦荞与双子叶植物的系统发育关系,我们分析了7种植物与苦荞的共线性关系(图1)。4.).结果表明23FTZF-HD.基因与大豆基因相结合,其次是葡萄(15),番茄(13),甜菜(9),向日葵(6),拟南芥(5)和水稻(4)。一些FTZF-HD.特别是苦荞麦和大豆的ZF-HD基因,如FtPinG0006040000.01、ftping00066241000.01和FtPinG0002717500.01,可能在ZF-HD基因家族的进化中起重要作用(附加文件4.:表S3)。苦荞与大豆、番茄、甜菜和葡萄的关系相似。苦荞与其他植物的ZF-HD基因分析比较对于建立种间亲缘关系和预测基因功能具有重要意义。
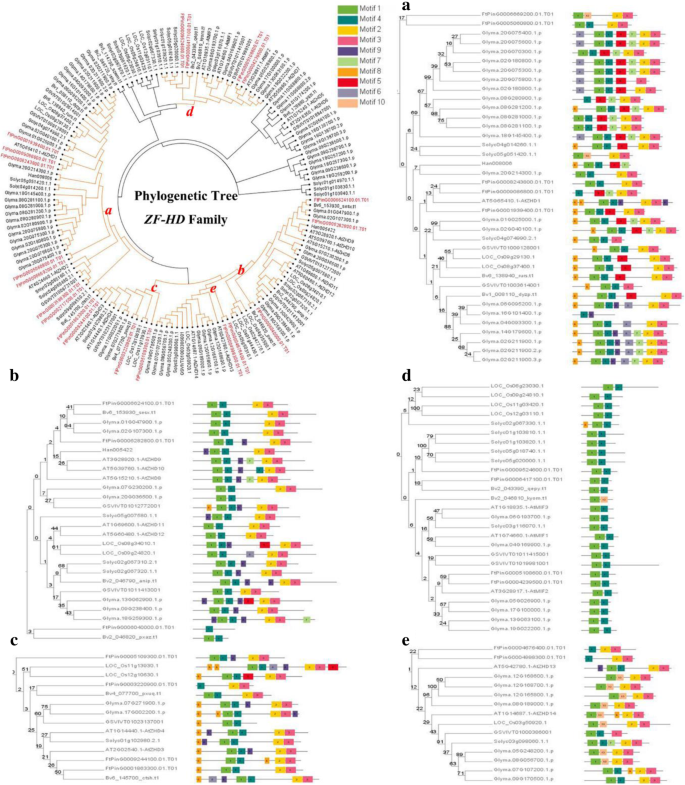
进化分析FTZF-HD.几种不同物种内的基因家庭
的数量FTZF-HD.确定的基因类似于拟南芥蒂利亚纳(17),大米(15,14]和其他植物ZF-HD.基因家庭。但三种种类的基因组大小非常不同(鞑靼荞麦,516 MB;拟南芥意大利,125 Mb;米饭,466 Mb). This result indicated that theZF-HD.在长期演变期间,基因家族在不同物种中保持稳定。基于鞑靼荞麦的现有ZF-HD基因,复制和多样性ZF-HD.进一步研究了进化中的基因。我们构建了一个系统发育树ZF-HD.酒精荞麦,单圈植物(水稻)和六分离型植物的蛋白质序列(拟南芥蒂利亚纳,豆豆,番茄,甜菜,葡萄和向日葵)使用良好的R11的邻近加入方法。根据系统发育树将ZF-HD蛋白分成五组(图。5.).A组含有最多ZF-HD.C组和D组各包含4个基因,E组最少(2个基因)。
我们还使用MEME Web服务器来搜索ZF-HD蛋白共享的保守主题。结果显示(图。5.)确定了10个不同的保守基序。同一基团的基因具有类似的基序,例如D组中的基因,这表明ZF-HD蛋白之间的潜在功能相似性。MOTIF 1和MOTIF 4由几乎所有ZF-HD蛋白共享的保守基序,表明ZF-HD.有一些高度保守的域名。MOTIF2和MOTIF3是由几乎所有ZF-HD蛋白共享的保守结构域,除了D组;因此,在获取MOTIF2和MOTIF3之后的MOTIF2和MOTIF3或MOTIF3或其他基因丧失之后,D组D可能从其他基因中演变。
表达模式FTZF-HD.不同植物组织中的基因
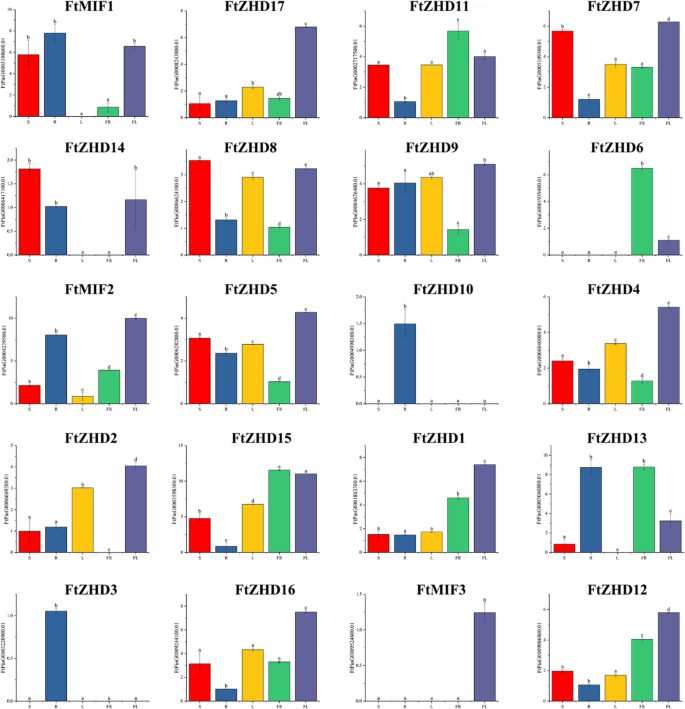
目的:研究中药的生理功能FTZF-HD.基因,使用实时PCR技术来检测基因家族各个成员的表达时间。积累FTZF-HD.研究了苦荞根、茎、叶、花、果实等组织的转录产物。6.).结果表明,该菌株的转录丰度较高FTZF-HD.不同组织和器官的基因差异很大,这表明FTZF-HD.基因家族在Tartary Buckwheat的生长和发展中具有许多功能。一些FTZF-HD.在Tartary荞麦茎中表达的基因具有组织特异性基因FtMIF3只在花中表达,FtZHD10和FtZHD3只在根中表达,FtZHD2只是没有表达在果实上,还有呢FtZHD13和FtMIF1未在叶片中表达。四个FTZF-HD.基因(FTZHD11 / FTZHD6 / FTZHD15 / FTZHD13)在Tartary Buckwheat水果中具有高水平的表达。11的表达FTZF-HD.基因(FTZHD1 / 2/4 / 5/7 / 9/12 / 16/17和FTMIF2 / 3.)高于其他器官。这项研究发现只有5个FTZF-HD.基因在生殖器官中的表达多于在其他组织中的表达(FtZHD1/6/11/12/15)(无花果。6.).
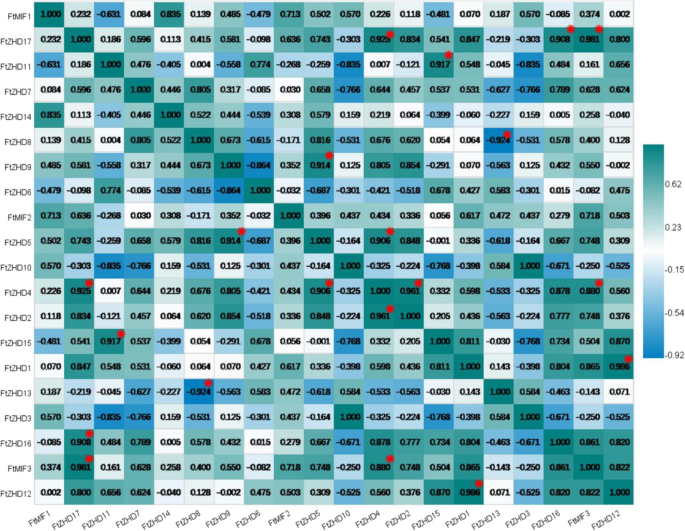
我们还研究了这些因素之间的相关性FTZF-HD.基因表达模式在根,茎,花,叶片和季鳞叶片的叶子和水果中。多对基因具有很强的相关性(0.880-0.986):FtZHD 17和FtMIF3那FtZHD 17和FtZHD 16、FtZHD 17和FTZHD4,FTZHD 11和FtZHD15,FTZHD 9.和FTZHD 5,FTZHD 5和FtZHD 4、FtZHD 4和FtMIF3那FTZHD 4.和FtZHD 2,和FTZHD 1和FtZHD 12(无花果。7.).
差异表达FTZF-HD.鞑靼荞麦果实开发期间的基因
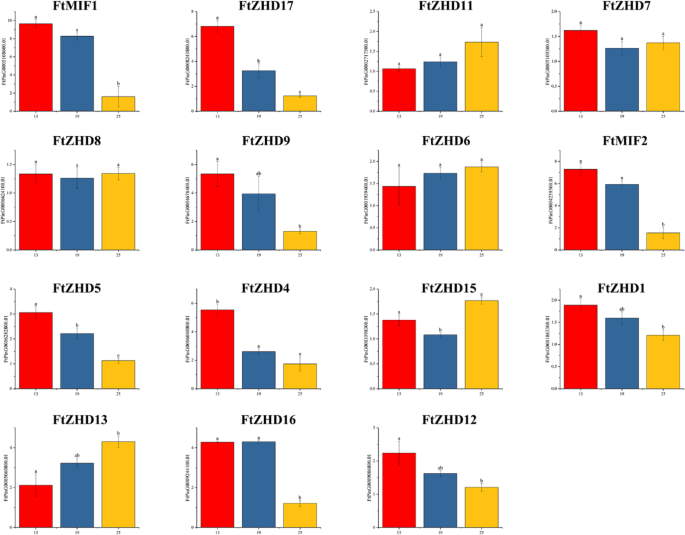
进一步研究表达FTZF-HD.荞麦果实中的基因,使用实时PCR检测基因家族成员在果实发育的三个时期的表达(授粉后13天(DAP),19 dap和25 dap)[27]评估积累FTZF-HD.荞麦水果中的转录产品(图。8.).结果表明大部分FTZF-HD.基因在水果开发的第一期(13个DAP)高度表达,暗示了他们在水果发育早期阶段的贡献。表达5FTZF-HD.水果开发的第三期(25个DAP)的基因高于其他时期的基因,这意味着它们对果实成熟的贡献。所有人的表达FTZF-HD.在第二个时期(19 dap)期间水果中的基因不高于其他两个时期的基因,尽管有些人FTZF-HD.在第二个时期高度表达基因。在这项研究中,只有一个FTZF-HD.在果实发育的所有三个时期,基因(FTPing0006624100.01)高表达,表达水平稳定(图。8.).
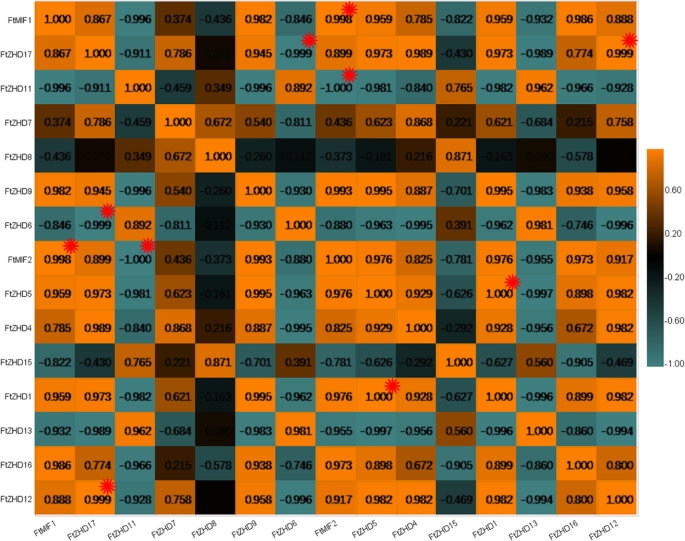
与此同时,我们还研究了表达模式的相关性FTZF-HD.三个阶段的果实发展基因。三对基因具有强烈的相关性(0.998-1.000):FtMIF1和FtMIF2, FtZHD17和FtZHD12,和FtZHD12和FtZHD1(无花果。9.).
讨论
系统发育分析和序列分析席和MIF.这两种基因均为陆生植物特有基因,属于同一蛋白质家族(ZF-HD)的两个不同类群。广泛的研究表明席在许多陆生植物中发现,但在藻类中没有[12].我们确定了20个ZF-HD.含17个基因席基因和3.MIF.基因略高于拟南芥(17)中的数量。基因的复制可以扩增基因的数量。例如,拟南芥基因组中发生了四种大型复制事件,超过一半ZF-HD.基因可能由基因组复制产生[12那28那29].基因复制机制包括片段复制,串联复制和易位(逆转录和复制易位),这是生物进化中的一个重要因素[30.].在这些机制中,片段复制是许多基因家族扩增的主要贡献者之一[31].染色体分布分析ZF-HD.苦荞基因中存在片段复制,但没有串联复制,说明基因片段复制事件极大地促进了苦荞基因扩增ZF-HD.基因家族在植物中具有较小基因组。此外,具有拟南芥的系统发育树也表明这两个物种之间的进化关系。存在的外显子和内含子结构的三种主要机制(基因内含子结构(增益或损失,出血或伪发出和插入或缺失外显子或内含子),并且每个机制导致基因结构差异[15那32那33那34].在苦荞中存在一些内含子ZF-HD.基因的变异可能是由于这三种机制的参与。为了研究苦荞与双子叶植物的系统发育关系,我们构建了苦荞与7种植物的共线亲缘关系图。4.).最后,23日共线的ZF-HD.鉴定了Tarrary Buckwheat和大豆的基因对。正交事件的数量远远大于鞑靼荞麦和水稻之间的数量,这与鞑靼荞麦和大豆之间的更近的进化距离一致[35].
这ZF-HD.转录因子涉及各种生物学过程,例如植物对非生物应激的反应以及植物植物的发育[34那36].大部分以前的报告ZF-HD.基因是关于的调节ZF-HD.基因对非生物胁迫的响应,但有关植物发育的报道较少。的成员ZF-HD.基因家族在植物的花组织中表达(例如拟南芥)[36].据透露ZF-HD.基因家庭调节花卉发展。我们的研究表明了20ZF-HD.从苦荞中鉴定出的基因确实在植物生长发育过程中表达,因此不存在假基因。然而,在对果实发育的研究中,我们发现有5个基因没有参与果实发育的调控。值得注意的是FtMIF3,属于同一亚家族FtMIF1和FtMIF2,在水果中没有表达,并且当比较三个的图案时(图。2),我们发现他们有相同的图案。这一结果使我们有很大的兴趣去探索基因之间差异的原因,因为比较他们的蛋白质序列(附加文件1:图S1),我们发现虽然三个基序是相同的,但氨基酸残基在第126至第139位的氨基酸序列编码FtMIF3基因与那些有意义的差异FtMIF1和FtMIF2.我们推测很有可能是FtMIF3基因导致蛋白质编码,以失去其在水果中表达自己的能力。为了FtMIF1和FtMIF2,它们对氨基酸序列的差异几乎没有效果,表达不大FtMIF1和FtMIF2与果实发育相关系数为0.998。虽然不是所有的基因都与果实发育有关,但发现15个基因在果实中表达同样令人兴奋。在本研究之前,ZF-HD蛋白家族在果实中的表达仅在葡萄(葡萄)和番茄,葡萄果实发展中只有一个潜在的作用[14那15].
我们发现四种葡萄基因在含有多种植物的系统发育树中的果实中表达(图。5.) (GSVIVT01003614001,GSVIVT01009128001,GSVIVT01012772001和GSVIVT 01011413001,分别在a组和b组)[15].这些基因类似于各组中急性荞麦的基序。例如,A组中的基因具有MOTIF1和MOTIF3,以及除外ftping006040000.01,B组具有MOTIF1,MOTIF2,MOTIF3和MOTIF4。可以看出,B组葡萄基因与葡萄牙荞麦基因之间的关系比A组在A组中更接近。
在分析组织中基因的表达(图。6.),我们注意到有5个基因在生殖器官(花和果实)中表达量高于其他组织(FTZHD1,FTZHD6,FTZHD12,FTZHD15,和FtZHD11).另外,表达了FtZHD1和FtZHD12在鲜花中高于水果的表达和表达FTZHD6,FTZHD15和FtZHD11果实的含糖量比花朵的含糖量高。比较他们的主题(图。2),我们发现FtZHD12和FtZHD15完全相同的主题。因此,我们推测两种基因之间可能存在功能重叠。随着果实发育期间表达的研究(图。8.),我们发现表达FtZHD12和FtZHD1在较早的阶段高于中期阶段,表达的表达FTZHD6,FTZHD11和FtZHD15在晚期的阶段高于中期和早期阶段,并且通过对基因的同步分析来发现(图。3.)之间存在片段重复FtZHD6和FtZHD11.所以,FtZHD6和FtZHD11在生殖器官和果实的发育中具有相似的功能。我们还发现FtZHD11和FtZHD15与植物组织发育相关系数为0.917,那么我们推测FtZHD11和FtZHD15也可能具有功能重叠。
单子叶果实的大小与胚乳发育有关[37那38]在双子叶植物中,果实的最终尺寸与子叶细胞的数量和大小有关[39].研究表明,通常胚乳的初始生长而不是胚胎的晚期生长主要与水果的大小有关[40那41那42].苦荞果实发育的报道表明,苦荞果实的大小主要与胚胎发育过程中的细胞分裂有关,多数苦荞果实在授粉后的第13 ~ 25天达到最大状态。[43].因此,在本研究中,水果发育的早期阶段是确定水果大小的关键时期。在我们对水果发展的研究中,我们发现存在8个基因,这些基因在早期的阶段比其他两个阶段更高。水果开发由各种转录监管网络控制。这些网络涉及转录因子,例如ARF系列的成员,其可以调节辅助和ABA等激素[43].Ftarf.2可以具有整合信号的能力,从而延长胚胎发育的循环,增加细胞分裂的循环并增加果组织中储存材料的积累[43].之间的关系FTMIF1,FTMIF2和FtZHD17和Ftarf.基因家庭需要进一步研究;然而,FTMIF1,FTMIF2和FtZHD17可能与苦荞果实大小有关。此外,FtZHD12,它与0.999的相关性FtZHD17,也可能与果实尺寸有关。总之,分析FTZF-HD.基因在组织和果实中的表达为苦荞新品种的选育奠定了基础。
结论
20.FTZF-HD.基因在Tartary荞麦中鉴定,研究了蛋白质的结构,演化和表达模式。我们的研究结果为进一步分析了生物学功能提供了有价值的基础ZF-HD.基因家庭。我们的研究还为改善鞑靼荞麦作物而奠定了基础。
方法
的识别ZF-HD.苦荞基因
我们从季后赛荞麦基因组项目(TBGP;)下载了Tarrary Buckwheat基因组(TBGP;http://www.mbkbase.org/pinku1//)[22].这ZF-HD.通过两种BLASTP方法搜索季后赛荞麦的基因家族。从PFAM蛋白质数据库下载了与ZF-HD_Dimer域(PF04770)对应的隐马尔可夫模型(HMM)文件(http://pfam.xfam.org/).通过PFAM和智能程序验证了ZF-HD_Dimer核心序列的存在。最后,含有20个基因ZF-HD.从苦荞基因组中筛选到结构域。使用ExPASy网站(https://web.expasy.org/compute_pi/等电点和亚细胞定位ZF-HD.蛋白质。
序列分析
使用zf-hd_dimer域序列FTZF-HD.蛋白质,我们使用默认参数Clustalw来比较几种蛋白质序列。确定外显子内部结构FTZF-HD.基因,将预测的编码序列与基因结构显示服务器(GSDS:)与相应的全长序列进行比较(GSDS:http://gsds.cbi.pku.edu.cn.在线计划。使用MEME在线计划(http:/meme.nbcr.net/meme/intro.html)分析以下参数下的蛋白质序列:最佳的主题宽度为6〜200;最大主题数量为10。
染色体分布和基因重复FTZF-HD.基因
的方法FTZF-HD.将基因绘制到Tartary Buckwheat的染色体是指Liu等人。[22].分析FTZF-HD.使用多个共线扫描工具包(McScanx)的基因复制事件。之间的同步关系FTZF-HD.基因和ZF-HD.来自所选植物的基因是通过使用双系统绘图器软件来确定的(https://github.com/cj-chen/tbools.).
FtZF-HD基因家族的系统发育分析与分类
使用ZF-HD蛋白序列(拟南芥蒂利亚纳,玉米,米和大豆)从Uniprot数据库下载(https://www.uniprot.org/)构建系统发生树。我们采用genious R11的NJ方法进行系统发育树的建立。参数是Jukes-Cantor模型,以及自由端间隙的全局对齐。
植物的生长
本研究使用了西昌大学王安胡教授提供的季后荞麦(西樵)种质。我们在四川农业大学生命科学学院的实验领域种植了材料(拉特。29°97'n,102°97'e,Alt。580米),四川省雅安[22].将3个不同果实发育阶段(DAP, 13、19、25)的花、果实和成熟苦荞茎、根、叶分别采集,快速放入液氮中,−80℃保存备用。
的表达式分析FTZF-HD.实时荧光定量PCR
使用Primer3软件(http://bioinfo.ut.ee/primer3/)设计了RT-QPCR引物(附加文件5.:表S4)。定量实时PCR分析用于分析所鉴定的基因。使用FtH3基因作为内部对照,在CFX96实时系统(BiORAD)上至少进行三次SyBR预混物(Takara)的标准RT-QPCR。数据分析了2−(∆∆Ct)方法,获得相对mRNA表达数据[44].
统计分析
我们使用Origin Pro 2018B(OriginLab Corporation。,Northampton,Massachusetts,USA)统计程序来分析所有数据,并且通过最小差异测试(LSD)的差异差异为0.05和0.01的方法进行比较22].
可用性数据和材料
苦荞的基因组序列用于鉴定苦荞ZF-HD.本研究的基因定位于苦荞基因组计划(TBGP;http://www.mbkbase.org/pinku1//).鞑靼荞麦面(西樵;登录号:川2008013)实验中使用的材料由西昌大学王安野教授提供。支持本文结论的数据集包含在文章及其补充文件中。
缩写
- 在:
-
拟南芥蒂利亚纳
- 衣冠楚楚的:
-
几天后授粉
- FT:
-
Fagopyrum tataricum.
- 通用汽车:
-
甘氨酸最大
- HB:
-
Homeobox.
- 高清:
-
homodomain
- HD-Zip:
-
亮氨酸zipper-associated高清
- 诺克斯:
-
与之相关的homeobox
- MIF:
-
迷你锌手指
- PHD手指:
-
与同源结构域相关的指状结构域
- WOX:
-
Wuschel相关的Homeobox
- ZF-HD:
-
锌手指图案相关的同性恋
参考文献
- 1.
掌上魅力j.基因控制拟南芥 - 2001年状态的防御反应表达。CurrOp植物BIOL。2001; 4(4):301-8。
- 2.
Singh K,Foley Rc,Oñate-sánchezL.植物防御和压力反应中的转录因子。CurrOp植物BIOL。2002; 5(5):430-6。
- 3.
Bürglintr。Caenorhabditise elegans prospero同源物定义了一种新型域名。趋势Biochem SCI。1994; 19(2):70-1。
- 4.
关键词:同源结构域蛋白;生物化学,1994;63(63):487。
- 5.
Wolberger C. Homeodomain互动。CurrOgin struct Biol。1996年; 6(1):62-8。
- 6.
Ariel FD,Manavella Pa,Dezar Ca,Chan RL。HD-ZIP系列的真实故事。趋势植物SCI。2007; 12(9):419-26。
- 7.
Kawagashira N,Ohtomo Y,Murakami K,Matsubara K,Kawai J,Carninci P,Hayashizaki Y,Kikuchi S,Higo K:多种锌手指图案,与植物和昆虫2001(12):368-369比较。
- 8.
Krishna Ss,Majumdar I,Grishin NV。锌手指的结构分类:调查与摘要。核酸RES。2003; 31(2):532-50。
- 9.
锌指蛋白:经典的锌指蛋白出现在当代植物科学中。植物生理学杂志。1999;39(6):1053 - 1058。
- 10.
Mackay JP,Crossley M.锌手指粘在一起。趋势Biochem SCI。1998年; 23(1):1-4。
- 11.
Windhövel A, Hein I, Dabrowa R, Stockhaus J. Characterization of A new type of plant homeodomain proteins that binding the C4 phosphoenolpyruate carboxylase gene of Flaveria trinervia.植物同源结构域蛋白的研究进展中国生物防治学报,2001;
- 12.
[10]胡伟,马辉。植物锌指基因家族的系统发育分析。植物分类学报,2011,30(3):457 - 464。植物生物学杂志。2008;50(8):1031-45。
- 13.
关键词:苹果,ABCG基因,全基因组鉴定,表达分析,家蝇园艺学报。2018;4(2):45-54。
- 14.
Khatun K,Nath英国,Robin Ahk,Park Ji,Lee Dj,Kim MB,Chang Kk,Lim KB,努是,钟我。锌手指Homeodomain(Zhd)家族基因的基因组分析和表达谱揭示了在番茄器官发展和压力反应中的可能作用。BMC基因组学。2017; 18(1):695。
- 15.
4 .郝伟,李伟,李伟,张玉成。葡萄锌指同源结构域基因家族的全基因组鉴定、进化及表达分析。中国生物医学工程学报,2014;
- 16.
拟南芥锌指基因MIF1的研究进展植物j . 2010; 45(3): 399 - 422。
- 17.
HC P,ML K,SM L,JD B,DJ Y,CO L,JC H,SY L,MJ C,WS C.病原体诱导的大豆锌手指Homeodomain蛋白GmZF-HD1和GmZF-HD2至2在钙调素同种型4(Gmcam4)启动子中的ATTA Homodomain结合位点的重复。核酸RES。2007; 35(11):3612-23。
- 18.
Nina F,Zhano R,Iztok Joze K,Zuzua W,Zheng Z,Ivan K. Tartary Buckwheat(Fagopyrum Tataricum Gaertn。)作为饮食芦丁和槲皮素的来源。农业与食品化学杂志。2003; 51(22):6452。
- 19。
荞麦植物科学:北京:科学出版社;2012.
- 20。
Bueso E, Muñoz-Bertomeu J, Campos F, Brunaud V, Martinez L, Sayas E, Ballester P, Yenush L, Serrano R. ARABIDOPSIS THALIANA HOMEOBOX25揭示了赤霉素在种子寿命中的作用。植物杂志。2014;164(2):999 - 1010。
- 21。
7个锌指转录因子是胁迫应答基因OsDREB1B的新调控因子。实验机器人,2012;63(10):3643-56。
- 22。
刘敏,马铮,王安,郑涛,黄磊,孙伟,张勇,金伟,詹杰,蔡勇,等。苦荞(Fagopyrum tataricum)生长素响应因子基因家族的全基因组研究。国际分子科学杂志。2018;19(11):3526。
- 23。
刘M,傅Q,Ma Z,Sun W,Huang L,Wu Q,Tang Z,Bu T,Li C,Chen H:Genope-of Gene-ince of Tarrary Butheat在Tarrary Buckfeat中的脱落基因(Fagopyrum tataricum.).2019年。
- 24。
刘M,MA Z,Sun W,Huang L,Wu Q,Tang Z,Bu T,Li C,Chen H:NAC转录因子家庭在Tartary Buckwheat中的基因组分析(Fagopyrum tataricum.).2019,20。
- 25。
刘米,太阳W,MA Z,Zheng T,Huang L,Wu Q,Zhao G,Tang Z,Bu T,Li C等。全基因组调查Tarrary Buckwheat(Fagopyum Tataricum)的AP2 / ERF基因家族;2019. p。19。
- 26。
孔X,Wei L,江口,Dan Z,Cai G,Pan J,Li D:玉米钙依赖性蛋白激酶的基因组鉴定及表达分析。BMC基因组学2013,14(1):433-433。
- 27。
Liu M, Ma Z, Zheng T, Sun W, Zhang Y, Jin W, Zhan J, Cai Y, Tang Y, Wu Q:苦荞生理变化与种子发育的关系Fagopyrum tataricum.Gaertn)BMC基因组学2018,19(1):648。
- 28。
TJ V,DG B,SD T.拟南芥中基因组重复的起源。科学。2000; 290(5499):2114-7。
- 29。
Blanc G,Hokamp K,Wolfe Kh。最近的一个多倍体叠加在拟南芥基因组中的较旧的大规模重复上。Genome Res。2003; 13(2):137。
- 30.
Hongzhi K,Landerherr Ll,Frohlich MW,Jim Lm,Hong M,Depamphilis CW。植物SKP1基因家族中的基因重复模式在Angiosperms中:用于快速基因出生的多种机制的证据。工厂J.2010; 50(5):873-85。
- 31。
Cannon Sb,Mitra A,Baumgarten A,Young Nd,May G.分段和串联基因复制在拟南芥中大型基因家族演变中的作用。BMC植物BIOL。2004; 4(1):10。
- 32.
Guixia X,Chunce G,Hongyan S,Hongzhi K.外显子系统结构中重复基因的分歧。Proc Natl Acad SCI U S A. 2012; 109(4):1187-92。
- 33.
关键词:高粱,超氧化物歧化酶(SOD),基因家族,全基因组分布中国生物医学工程学报。2015;39(1):49-59。
- 34.
王文,彭啊,ying l,hou xl。大白菜不同发育组织和非生物胁迫下ZF-HD转录因子的基因组分析及表达模式。Mol Genet基因组学。2016; 291(3):1451-64。
- 35.
张立,李奇,马b,高q,杜,韩y,李y,cay,qi m,zhu y等。Tarrary Buckwheat基因组在芦丁生物合成和非生物胁迫耐受性,V体提供了深入的洞察力。10;2017. p。1224-37。
- 36.
Tan Q,Irish V. rabidopsis zinc finger-homeodomain基因编码蛋白质,具有在花卉发育过程中协调的独特生化特性。植物理性。2006; 140(3):1095。
- 37.
Chojecki AJS,Bayliss MW,Gale MD。小麦胚乳中的细胞生产和DNA积累,及其与粒重的关系。Ann Bot。1986; 58(6):809-17。
- 38.
Chojecki AJS,Gale Md,Bayliss MW。小麦胚乳中淀粉颗粒的数量和尺寸,及其与粒重的关系。Ann Bot。1986; 58(6):819-31。
- 39.
Munier-Jolain NG,Ney B.谷物豆类的种子生长速率II。种子生长速率取决于子叶细胞数。J Exp Bot。1998年; 49(329):1971-6。
- 40.
Sundaresan V.植物中种子大小的控制。Proc Natl Acad SCI U S A. 2005; 102(50):17887-8。
- 41.
Mizutani M,Naganuma T,Tsutsumi K,Saitoh Y. orysa的合胞特异性特异性表达; KRP3 CDK抑制剂:其参与水稻细胞周期控制的含义(Oryza sativa L.)合胞增生率。J Exp Bot。2010; 61(3):791。
- 42.
黄永平,黄永平。豆科植物种子发育的分子生理学研究。植物生物学杂志,2004;
- 43.
刘敏,马铮,郑涛,王杰,黄磊,孙伟,张勇,金伟,詹杰,蔡勇,等。生长素、脱落酸平衡和FtARF2在苦荞果实最终大小测定中的潜在作用。国际分子科学杂志。2018;19(9):2755。
- 44。
Guilfoyle T,Hagen G,Ulmasov T,Murfett J.营养素如何转向基因?植物理性。1998; 118(2):341-7。
致谢
我们感谢实验室所有同事提供有用的讨论和技术援助。我们非常感谢编辑和审稿人对稿件的批判性评价,并为其改进提供了建设性意见。
资金
该研究得到了中国天然科学基金(31500289)的支持,以及中国国家重点研发计划(2018YFD1000706)。资金用于设计和收集,分析和解释数据以及撰写手稿,以及在公开接入付款中。
作者信息
隶属关系
贡献
m.-y.l.计划和设计研究,分析数据。x.-x.w.写了原稿。x.-x.w.和z.-t.m.通过QRT-PCR确定基因的表达。t.-r.z.和L.H.确定FTZF-HD.家庭基因和可视化他们的结构。Q.W.和z.-z.t.进行了进化分析FTZF-HD.基因和几个不同的物种。t - l - b和c - l - lFTZF-HD.基因染色体分布,基因复制和同步分析。W.-J.S.种植和收集的植物材料。H.C.,M.-Y.L.和w.-j.s.审核并编辑了稿件。H.C.监督研究。m.-y.l.和x.-x.w. contributed equally. All authors read and approved the final manuscript.
相应的作者
道德声明
伦理批准和同意参与
本试验所用苦荞麦材料由西昌大学王安虎教授提供。这些植物材料在世界各地被广泛使用。采集植物样本不需要许可证。植物材料按照中国四川农业大学生命科学学院的制度指导方针进行维护。本文没有涉及任何人类或动物的研究,也没有涉及任何濒危或受保护的物种。
同意出版物
不适用。
利益争夺
作者们宣称他们没有相互竞争的利益。
额外的信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介中不受限制地使用、分发和复制,只要您给予原作者和来源适当的信任,提供知识共享许可的链接,并说明是否有更改。“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
刘敏,王晓,孙伟。et al。全基因组研究ZF-HD.苦荞基因家族(Fagopyrum tataricum.).BMC植物杂志19,248(2019)。https://doi.org/10.1186/s12870-019-1834-7
收到了:
公认:
发表:
关键字
- 鞑靼荞麦
- ZF-HDS.
- 基因组 -
- 水果发展
- 表达模式