摘要
背景
甘蔗是一种热带作物,可以在茎中积聚高浓度的蔗糖作为储存碳水化合物。因此,甘蔗占世界所有糖的约75%,已成为在巴西生产第一代生物乙醇的主要糖源。每日节奏导致植物适应并协调他们的新陈代谢,以实现全天的最大光合作用和碳水化合物生产。昼夜节律来自内部振荡器和外部刺激的相互作用,而Diel节奏响应着光暗循环而发生。二极管信令有助于将昼夜节律与光周期同步,以及以DIEL方式振荡的碳水化合物水平。在常规光周期下,它们在白天合成,整个夜晚消耗作为能量储备。然而,短日可以在白天期间诱导较高的合成率,并在黑暗中降低消费率。细胞壁碳水化合物也被昼夜调节,并且已经显示出纤维素,半纤维素和果胶在一天的不同时间沉积/降解。为了评估幼甘油植物中的Diel碳水化合物型材,我们沿着常规日期或短日期的植物中测量可溶性糖和细胞壁组分。
结果
短日照影响蔗糖合成和细胞壁成分。在短时间内,在黑暗条件下,蔗糖浓度增加了44%,但在白天则保持稳定。纤维素、半纤维素和果胶在短时间内也会在24小时内波动。从白天中午到夜间1小时,叶鞘纤维素含量增加了38%。叶鞘中果胶和半纤维素含量也随日升高而增加,而叶片中果胶和半纤维素含量则随日升高而减少。
结论
这些数据显示了短时间内可溶性糖代谢的日模式和细胞壁代谢的时间调节,表明diel信号在甘蔗管理糖的积累和分配中发挥了作用。了解甘蔗细胞壁的合成/降解动态有助于提高甘蔗产量。
背景
甘蔗是一种C4热带作物,成熟茎秆中蔗糖浓度可高达540毫克/克[1].这一特性使甘蔗成为世界上大约75%的糖生产的基础[2]巴西收获约占世界甘蔗的38%[3.].此外,甘蔗是原料用于生物燃料生产在巴西[4].2017年,甘蔗的估计产量约为646万吨,对应于生产〜4000万/吨糖和约260亿/升乙醇[5].除此之外,甘蔗还吸引了第二代(2G)乙醇产业的兴趣,因为生物质产量高,而且甘蔗渣有转化为生物能源的潜力[4].
蔗糖、葡萄糖和果糖是甘蔗叶和茎中主要的可溶性碳水化合物[6,7].控制蔗糖合成的两个关键反应。首先,蔗糖-磷酸合酶将udp -葡萄糖和果糖浓缩成蔗糖-6-磷酸(S6P),然后蔗糖-磷酸-磷酸酶将S6P去磷酸化,生成蔗糖[8].在甘蔗中,蔗糖通过源-库机制从叶片迅速运输到茎中储存[8,9,10].
地球的旋转是24小时循环,从而强制工厂以协调其新陈代谢以进行光合作用,使得碳水化合物代谢在光时期期间处于最大功率[11].昼夜节律来自控制振荡器,即使在没有外部刺激的情况下也可以运行,例如光和温度[11].然而,昼夜节律数据是由连续的条件测量的,这些条件并不反映植物面临的真实条件[12].另一方面,昼夜节律是对昼夜节律或昼夜周期的响应。昼夜节律也是控制对环境刺激的反应的主要因素,使内源性昼夜节律与外部刺激同步,如光周期[12].
蔗糖和还原性糖是昼夜调节和过程中不同的光条件下[白天和夜晚显著不同13].这些碳水化合物在白天作为光合作用产物被合成,在夜间作为能量来源被吸入。在高粱(高粱双色),淀粉的合成途径是由二元醇控制的[14而拟南芥则根据一天的长短来协调淀粉的合成和消耗。白天越短,淀粉的合成就越快,夜间的分解就越慢,所以这种碳水化合物在每晚结束时都能维持在一个最低水平[15,16].
最近报道了常规光照条件下甘蔗可溶性糖的日谱图,其中蔗糖白天在叶和茎中积累,夜间被消耗[17].在甘蔗浓度的蔗糖浓度下,通过广泛的研究报告了蔗糖和还原糖,并且这些碳水化合物的浓度可以在很大程度上根据品种,生长条件和/或组织和组织而变化1,6,18,19,20.,21,22,23,24,25,26,27].然而,甘蔗品种中可溶性碳水化合物对不同光周期(如短日)的响应如何波动,目前还没有报道。
尽管它的复杂性,所述植物细胞壁主要是纤维素,半纤维素,果胶,木质素和蛋白质组成的动态结构,并且它包括主要的陆地碳储[28,29].细胞壁保护植物细胞免受病原体侵害,并通过松弛和收缩使细胞扩张[30.].甘蔗的叶子和秆的细胞壁,像其他草一样,是由复杂的半纤维素、果胶和果胶阿拉伯半乳糖结合在纤维素上[31].纤维素,由β-1,4葡萄糖链形成的结晶、无弹性和耐机械的材料[28,30.],是主要的细胞壁部件。它嵌入了半纤维素和果胶中。半纤维素主要由木瓜葡聚糖和阿拉伯氧基叶中的甘蔗叶和秆形成[31如预期的草[28].果胶是由半纤维素涉及葡糖醛富酸馏分的矩阵以形成在纤维素的柔性层[28,30.].甘蔗果胶馏分含量包含约10%的细胞壁[31].
在植物细胞生长过程中,细胞壁的组成发生变化,变得更加复杂。在不同的情况下,例如水果软化[32,33,34]、花朵发育及花粉形成[29,35[细胞壁的组成动态变化。然而,关于较小的时间窗口中的壁部件波动很少,例如在一天内[36,37,38,39,以及对各种环境刺激的反应。
在这里,我们首次研究了甘蔗中可溶性糖和细胞壁组分在正常日(RD, 12 h/12 h光照/黑暗)和短日(SD, 08 h/16 h光照/黑暗)下的日动态。在RD条件下,蔗糖在白天以线性速率合成,在夜间分解。然而,在SD中,白天的合成速率要低得多,而令人惊讶的是,夜间的降解速率更高。我们还证明了纤维素、半纤维素和果胶在RD植物的diel循环中相对稳定。然而,我们发现,短日诱导这些细胞壁成分在一天内的显著波动在甘蔗。
结果
短日照对幼植株的形态发育没有影响
在每个Diel方案下,我们测量+ 1叶的植物高度和+ 1叶的长度和宽度。此外,在那些日也测量根部,叶子和叶护套的干块。第0天没有显着差异(p-Value <0.05)检测到RD和SD之间的所有比较中,表明在DIEL时期的开始时植物群相似。令人惊讶的是,在第30天,再次观察到从RD和SD工厂的数据观察到数据(表1和额外的文件2:表S1-S4)。这说明不同光照条件对甘蔗幼苗的形态测量没有影响。
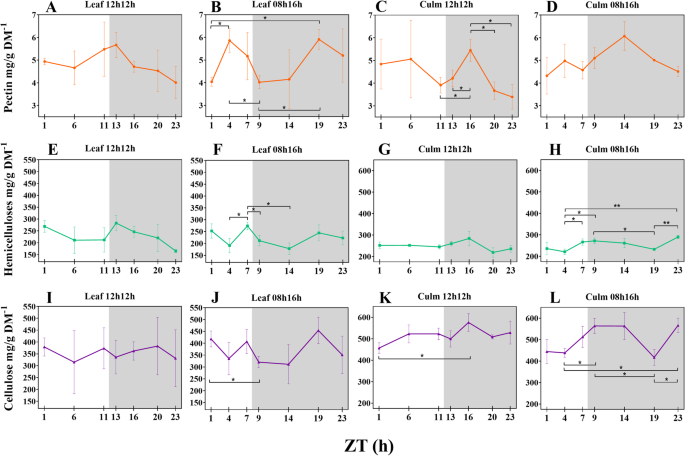
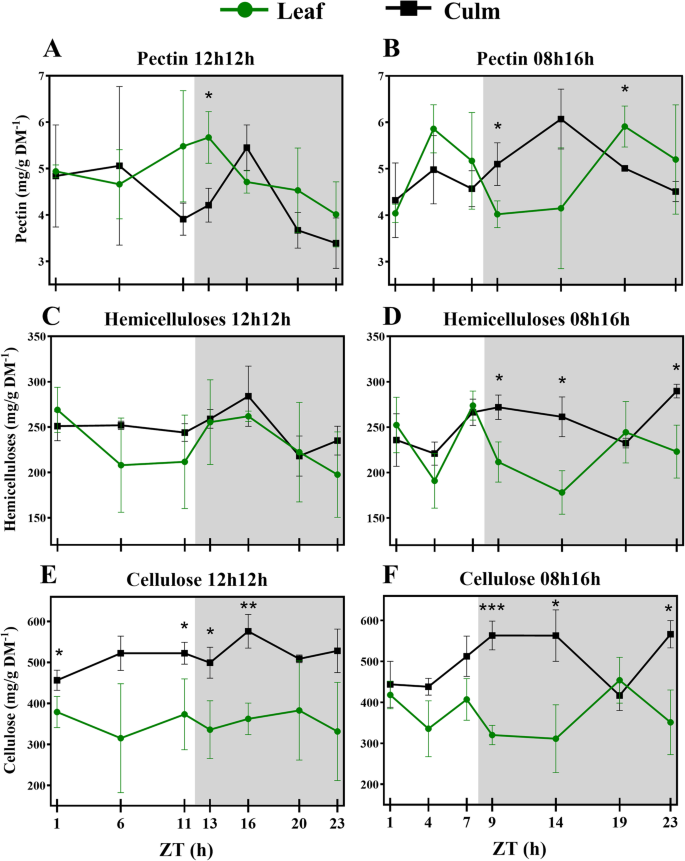
细胞壁组分的浓度在经受短日照制度波动
我们对RD和SD植物叶片和叶鞘的细胞壁组分进行了定量分析2:表S5)。Hemicellulose comprised ~ 24% of cell wall dry mass in both tissues and photoperiods, and pectin corresponded to ~ 5%. Cellulose comprised ~ 50% of leaf sheath cell wall dry mass and ~ 37% in the leaf. There was a tendency for variation in concentrations during the day, such that the proportions of each component relative to the dry mass and in response to photoperiod varied (Fig.1).在SD植物中观察到这些变化中的大部分。然而,来自RD植物的叶子果胶和叶子鞘纤维素在24小时内也经过了变化,主要是在夜间。在SD植物中,叶片中振荡的所有组分以及半纤维素和纤维素也在叶子护套中振荡。作为例证,来自SD植物的叶子丝纤维素从438.15mg / g dm增加−1正午(授时因子时间4 - ZT4)至563.54 mg/g DM−1在夜晚开始(ZT9;p- 0.0194)和566.40 mg / g dm−1在夜晚结束时(ZT23;p- 0.0151)。叶半纤维素从191.01 mg / g dm上升−1在ZT4至273.86 mg / g dm−1在一天(ZT7的结束;p- 0.0404);从ZT7到ZT9,它减少了62毫克/克DM−1(p- 0.0368)。附加文件2:表S6显示显著性(p-值< 0.05)。
在经过RD的植物中,组分的分布在白天稳定。有趣的是,在SD植物的叶子中,与白天期间,与纤维素和半纤维素相比,平均果胶浓度显示出相反的模式,从一天中间达到峰值。在SD植物中,果胶从ZT1到ZT4迅速增加了45%(p- 0.0263),而纤维素从ZT1到ZT9下降23%(p值(图0.0331)。1b, f, j)。
来自Zt16峰值的RD植物的叶子茎果胶和纤维素(图。1c, k),果胶含量从一天结束时急剧增加至ZT16 (+ 39%,p值0.0267)。从ZT1到ZT16,纤维素含量增加了26% (p值为0.0341)。1k).在SD植物中,与RD植物相比,每个叶鞘成分的平均分布不同,在叶片中也观察到不同的分布。果胶在RD中达到峰值的时间相同,而纤维素在昼夜过渡时达到峰值,在ZT14中也是如此(图2)。1l)。除ZT19外,叶片纤维素在夜间保持稳定的浓度,并在夜间叶片相比显示了一种逆模式(图。1j,l)。在ZT19,叶子鞘中的平均果胶和纤维素浓度下降,而这是叶子中的峰值时间。半纤维素在白天增加并在叶子中观察到的夜晚减少。然而,半纤维素在ZT23中达到峰值,与纤维素一样,大多数显着差异在ZT4和夜间的时间点之间(图。1h)。
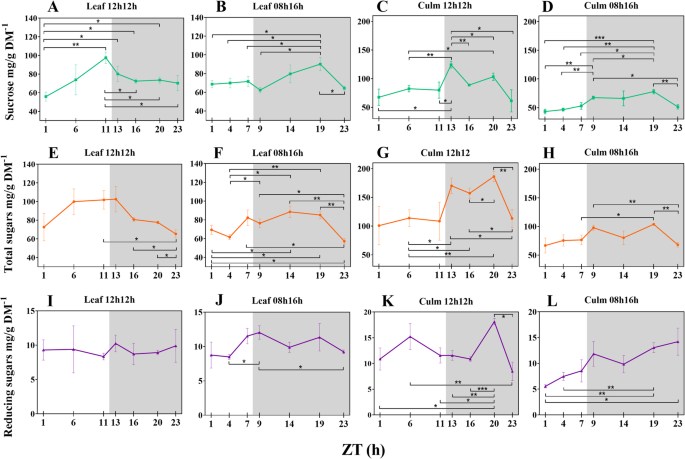
短日期稳定白天蔗糖合成,并在甘蔗叶中夜间诱导合成
我们定量测定了整个过程中叶片和叶鞘中总可溶性糖、蔗糖和还原糖的组成(另附文件2:表S7)。我们的数据显示蔗糖并在叶中总糖和所有的级分的储存的该合成均RD植物更高(图2).附加文件2:表S8在整个24小时内显示出可溶性糖的显着波动。叶蔗糖在白天线性积累,从一天结束时浓度增加〜75%(p值0.0020;无花果。2一个),而在叶鞘,它正好在夜间(ZT13的第一个小时达到峰值的图。2C)。蔗糖从叶片运输到叶子护套,从〜80到124 mg / g dm波动−1(55 +%)在包括日夜过渡的两小时间隔(ZTS 11-13;p- 值0.0338)。In contrast, leaf sheaths from SD plants did not significantly alter their sucrose content during the same transition (ZTs 7–9; ~ 53 to ~ 67 mg/g DM−1;无花果。2d).在RD条件下,ZT1与ZT11 (p值0.0020)和ZT1与ZT13 (p值0.0355)叶片蔗糖浓度差异最大。它们在白天积累的蔗糖比RD植物少得多(图。2在夜间,ZT19之前,叶片中蔗糖积累显著,叶片和叶鞘中蔗糖浓度相近(图2)。2b)。由于这些动态,在ZTS 9和19之间的比较中检测到蔗糖浓度〜44%(p值0.0186),在SD植物中观察到的最大差异。
白天总糖分数也增加,并因为蔗糖是在高得多的浓度比其它的糖(图合成在所有组织和光周期在夜间下降类似于蔗糖。2然而,在RD植株的叶片中,只有ZT11的蔗糖浓度发生了显著变化(Fig. 2, f, g, h)。2一种)。另外,在叶鞘,总糖和蔗糖的分布图案非常相似。浓度白天相当稳定,然后在晚上的第一个小时,从白天和黑夜之间的过渡上升到一个高峰。然后,他们往往在浓度降低,达到在倒数第二个时间点(图另一个高峰。2c、g)。
SD植株叶片中还原糖含量波动较大。尽管它们在RD叶片中是稳定的(图。2i),从ZT4到ZT9有增加(+ 42%),p-值0.0248)。2j).夜间,ZT9 - ZT23浓度下降23%。在每个光周期的响应下,叶鞘中观察到不同的分布。在规则光照下,ZT6和ZT20处分别出现一个峰值(图2)。2k),最后一次占叶浓度的核算。SD植物在白天的叶子中累积较少的还原糖而不是叶片。然而,这些糖从ZT1增加到ZT23(+ 156%,p值0.0416)(图。2l),当它们也高于叶片含量时(p值0.0312)。
讨论
结果表明,RD和SD处理下的甘蔗形态无明显差异。这与31日龄拟南芥在08 h/16 h L/D下生长的观察结果不一致,其生长速率低于12 h/12 h L/D [40].然而,光周期长度(以小时计)并不一定起到增长的一个独占的角色;在光照治疗的天数也可以考虑。A 21 days short-day treatment had no effect in leaf area, petiole length or yield, whereas 35 days of treatment resulted in lower rates in strawberry [41.].此外,幼苗的甘蔗比其他作物增长慢,直到它到达茎伸长级[42.].说明光照时间的缩短对甘蔗幼苗的干质量、株高和+ 1叶长、叶宽没有影响。
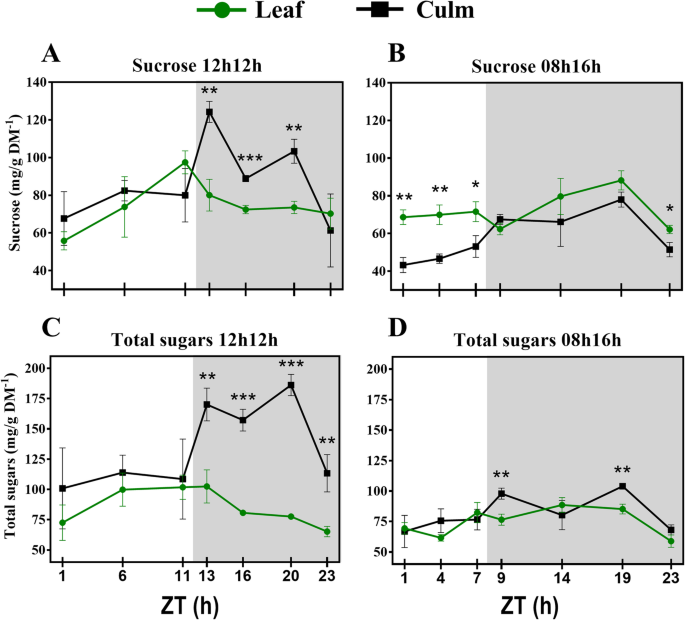
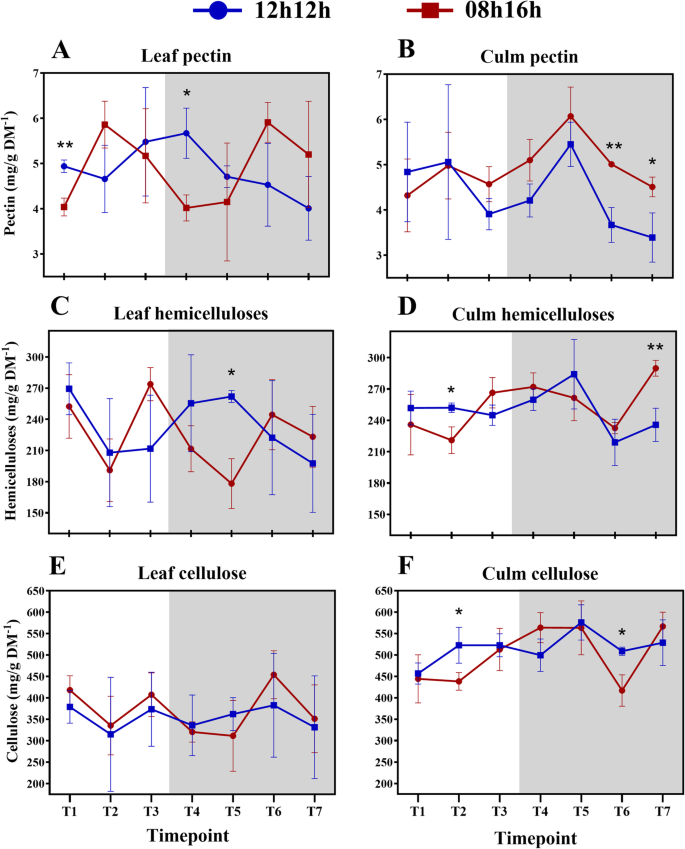
我们还测量来自甘蔗的可溶性糖。数据同意几种报告可溶性糖测量的其他研究(附加文件2:表S9)。本文报道了植物在正常光周期下的源汇调节机制。RD植物在白天通过光合作用合成蔗糖,在夜间将蔗糖从叶片转移到叶鞘。在白天,叶片和叶鞘中蔗糖的含量相近,而在夜间,叶鞘中蔗糖的含量要高得多。3.a).这些数据在一定程度上与最近一份关于田间种植甘蔗中可溶性糖日波动的报告一致[17], 3个月龄植株的叶片从白天中期到结束都在积累蔗糖,但在夜间没有显著差异[17].在本研究中,缩短光期为仅8小时导致该动态的调整。叶片中的蔗糖浓度在当天非常稳定,仍然高于叶护套(图。3.b).夜间,叶片和叶鞘积累蔗糖的模式与RD植物相似。在转录水平上也支持源-汇机制。如前所述,与蔗糖代谢相关的酶的叶相转录谱(阶段是一天中特定基因表达达到峰值的时间)与这些动态一致。与蔗糖合成相关的基因在清晨被高度诱导,而与蔗糖分解相关的基因在夜间被高度诱导[43.].
叶鞘中总糖浓度较高,RD中总糖浓度从zt13降至23,叶片中总糖浓度从ZT11降至23(图1)。3.c),类似于蔗糖在晚上。白天期间,叶子护套和叶子中总糖的量相同。在SD中,叶护套和叶片之间仅ZTS 9和19显着差异。RD植物的模式与先前在稻草中的研究一致[44.].这种反应可能是由水稻光合作用引发的,因为基因的表达大多在一天的开始阶段(ZT1),以确保糖的合成。此外,它们的峰值与在恒定光照条件下甘蔗中报道的光收获复合物转录本的阶段性相关[43.].在拟南芥中,光合作用受昼夜节律控制[45.],然而,昼夜调节基因也表现出一种昼夜表达模式[46.].在水稻下,在自然条件下,还报道了与昼夜控制一起的DIEL影响[44.].作者还报道了生理光合器官也受到diel循环和许多光收获复合体基因的调控,这一阶段在一天的第一个小时或在一天的第一个小时和中间结束。
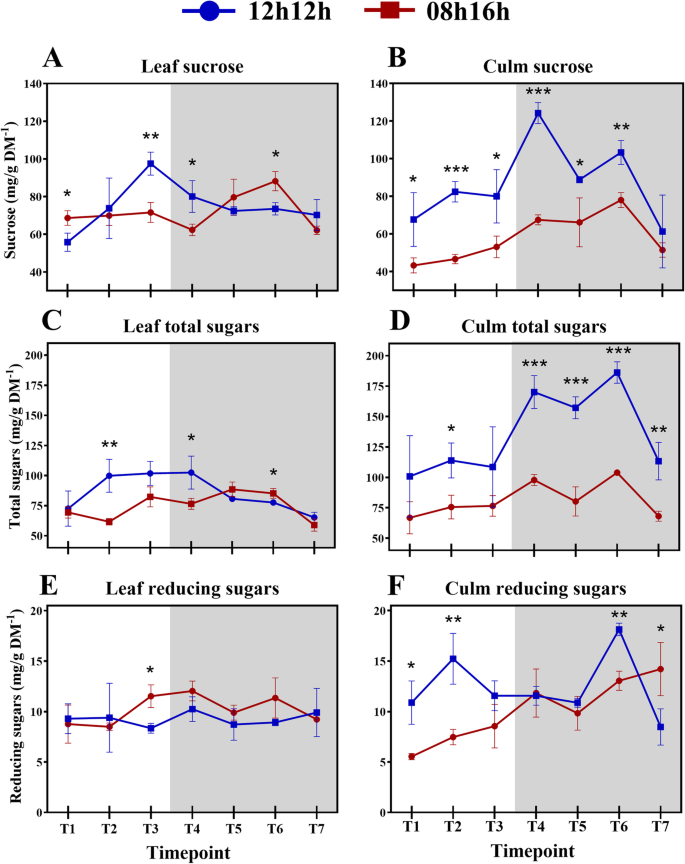
当处于较高浓度时,蔗糖将蔗糖运输到水槽中,这意味着源中的蔗糖较少可能导致蔗糖减去可用于出口[47.].实际上,SD植物中的蔗糖积累显着低于RD植物(图。4一个),其可以是用于在源和宿之间的差异的原因。Consistent with this interpretation, in Arabidopsis a 08 h/16 h photoperiod results in a lower amount of total starch accumulation than a 12 h/12 h photoperiod [15,40].在拟南芥中,已经表明,在白天诱导淀粉合成的短期,随后在夜间较低的消费[15在一个可以数学建模的机制中[16来维持这种储存碳水化合物的必要量。这在SD甘蔗的叶子中没有发生。在甘蔗中,蔗糖是贮藏碳水化合物,在白天,蔗糖浓度没有振荡。令人惊讶的是,在夜间,即使没有光合作用,ZT9到ZT19的叶片中蔗糖含量也增加了。从ZT19到23,积累下降到接近ZT1的水平。有趣的是,叶片中细胞壁组分的浓度趋于在ZT19处达到峰值(图2)。1b)并且只有在SD下只有关于细胞壁组件的那天VS夜间的时间点之间存在显着差异(附加文件2:表S6)。
总之,这些数据表明,甘蔗在正常光照周期下通常发生的变化被转移到夜间,以缓解SD植物的光照不足。然而,这一机制仍然不足以合成和储存相同数量的蔗糖和总糖在RD植物中检测到的,因为更短的白天(图。4b, d).糖信号通路可能在这种代谢重组中发挥作用,并影响糖的积累能力。事实上,碳响应基因在拟南芥中表现出了强烈的昼夜变化,以及许多昼夜调节基因[46.].在无淀粉拟南芥突变体中PGM.夜晚结束时的低水平葡萄糖诱导了许多葡萄糖反应基因,表明糖在日常代谢的调节中起着重要作用[46.].在甘蔗中,发现一组与蔗糖含量相关并与信号转导相关的基因是早期糖响应[48.].最近,信号转导基因和snrk相互作用蛋白在高糖度甘蔗品种中富集[49.,强化了这一假设。
一般来说,SD植株的叶鞘和叶片在24 h内积累的蔗糖和总糖量要少得多(图2)。4广告)。这些观察结果表明,在SD植物中突出蔗糖击穿和转运,以优先于该组织中的蔗糖积累。这是有道理的,因为甘蔗的生长模式被优化以增加蔗糖含量[42.].
除了已经可用的葡萄糖和果糖之外,还可以将其他糖重新分配给夜间蔗糖合成。实际上,根据葡萄糖和果糖的最近报告,RD叶中还原糖的浓度没有差异[17].另一方面,SD叶子从一天中的中间(ZT4)积累了还原糖,直到夜间开始(ZT9)(p-Value = 0.0242;无花果。4此外,SD植物叶片和叶鞘夜间总糖浓度的差异要比RD植物小得多(图2)。3.C,D),表明这些糖可以作为蔗糖合成的基质分配给叶片,因为当时没有发生光合作用。麦芽糖(还原糖),三糖磷酸盐和甘油醛3-磷酸盐是淀粉降解产物,可用作拟南芥蔗糖合成的衬底和调节剂[50.,51.].另一方面,已经证明淀粉浓度太低,小于1.6 mg/g DM−1,在本研究报告的甘蔗品种中(SP83-2847)[52.].由于蔗糖对甘蔗的重要性,短日条件会影响夜间蔗糖的合成,直到ZT19维持这种碳水化合物的合理储存。在ZT23条件下,蔗糖恢复到与ZT1相似的浓度。
对基因表达的进一步研究可以揭示与这些反应有关的基因和途径。研究表明,糖转运体在韧皮部装载蔗糖的过程中起作用[53.和协作来控制源接收机制[47.在拟南芥中[54.]和甘蔗[49.,53.].组合大规模转录组织,蛋白质测量和动力学建模的力量可以合作构建更多地解决扰动的现实模型[55.,例如不同的光周期。由于大多数研究都是在生理水平上进行的,所以对应激时糖转运体的调节知之甚少[47.],因此理解是机构可导致更高的产率,响应于不同的环境条件。
细胞壁碳水化合物的波动也引起了我们的注意。因为(我)细胞壁成分有助于维护墙的力学性能与(2)细胞壁取决于碳水化合物生物合成,我们试图测量墙组件的浓度在每一个时间点来生成知识墙代谢的光周期控制在24小时内。
电池壁组件/拆卸动力学使细胞放松和伸展而不会在发育过程中破坏墙壁。根据植物的需要沉积和改性多糖,以适应环境[29,56.].在小麦种子中,负责细胞壁组分的合成/降解的基因在不同的显影阶段表达,展示这些碳水化合物不断合成[57.].由谷粒、叶鞘和草叶组成的细胞壁Brachypodium distachyon甘蔗细胞悬浮培养物含有大量的葡萄糖水解酶(GH)、氧化还原酶(OR)和转化酶(INV) [58.,59.,60.].GH和ORs(主要是过氧化物酶)在维持多糖网络中发挥作用,允许半纤维素和果胶组分的组装[59.[通过时间的时间改变半纤维素组合物[56.].INV分解这些成分,以确保存在合成其他细胞壁成分的前体[58.].通常,细胞壁的组装/拆卸似乎在正常情况下发育过程中具有常规行为。
一些研究表明了树木细胞壁代谢的二极管效应[36,37,38,39].然而,无论是嫩草还是光周期效应都不是这些研究的重点。[36,37].的日转录组桉树Sp. xylem shed light on wall diel dynamics [39].差异表达基因在ZT16的阶段最多,我们在本研究中发现RD壁组分的主要峰在ZT16。5一些细胞壁形成基因如蔗糖合酶和udp -葡萄糖醛酸脱羧酶被报道为Diel对照。同时,报告了木材形成的日变化模式杨树通过追踪放射性一氧化碳2结合到所有墙壁组件中[38].研究人员报告的数据最高13C在夜间进入细胞壁。半纤维素糖与夜间的负相关也有报道,这表明半纤维素沉积在黑暗中不能完全发生。
纤维素,半纤维素和果胶组成约95%的甘蔗细胞壁[31,61.],它鼓励我们衡量这些分数。After 30 days of being subjected to an SD light regime, the concentrations of cell wall components from the sugarcane cultivar were about the same as RD, indicating no effect from the photoperiod that may have resulted in differential thickness of cell walls during the 24 h period (Fig.6A-F)。事实上,每个细胞壁组分率分别为类似于以前的报告[31,62.,表明这些浓度在不同品种间具有一定的稳定性。在RD植物中,没有显著的波动(p-value < 0.05),叶鞘果胶和纤维素含量仅出现时点性差异(图。1C,K;附加文件2:表S6)。另外,光周期治疗后观察到在测得的形态特征没有差异,如上面所讨论。总之,这些观察结果表明,年轻的甘蔗品种SP83-2847弱细胞壁代谢的光周期在承受普通的一天影响。在显影甘蔗细胞壁代谢趋向在这样的条件下昼夜循环期间以线性方式表现,除了果胶。短的一天,但是,影响了墙体成分的浓度波动。All but leaf sheath pectin significantly fluctuated (p-value < 0.05) during the 24 h period (Fig.1B, d, f, h, j, l;附加文件2:表S6)。
叶和叶鞘的细胞壁在组成上非常相似,但在果胶和半纤维素的精细结构上有差异[31].目前研究的重点不是分析墙壁的精细结构,而是调查一般成分的波动,它们的比例与以前的报告相符[31,62.].在RD植物的白天,叶护套和叶子组分类似地波动。果胶在叶子鞘中的夜间显着增加和下降,并倾向于降低叶子。在纤维素级分中检测到这些组织之间的唯一差异。早期的甘蔗发育阶段发生在适当的干伸长级之前[63.],叶鞘结构已经存在,并且在RD和SD中积累的纤维素明显多于叶片(图。5e、f)。
细胞壁被有时称为静态结构,即使它们是由大量的糖,其可以是能量的用于生长的植物[源的29].此外,植物能够回收初级细胞壁成分[29在开发过程中,甚至在一天之内。与可溶性糖一样,SD也引起细胞壁成分的波动。甘蔗在一天内组装/分解细胞壁的原因依赖于两个假设:(1)它可能是蔗糖合成前体的来源和/或(2)它可能与细胞和组织生长有关。
第二种假设似乎没有得到现有数据的明确支持,因为植物的生长不受光周期的影响。即使如此,差异波动大多检测到在SD植物(附加文件2:表S8)。因此,果胶和半纤维素的波动可能是蔗糖合成前体的一个来源。因此,随着夜间叶片蔗糖含量的增加,果胶和半纤维素含量降低(图。6a,c)。在叶片和叶子鞘中看到果胶的不同趋势。在叶片中,白天和夜晚尖顶,而在叶子护套中,它们往往会在半夜积累。甘蔗果胶的主要部分是水溶性,没有与其他壁部件连接的水溶性[31,因此更容易重新分配,这可以解释快速增长/下降。在一个高生物量甘蔗基因型中,一些果胶分解基因被上调,这加强了果胶被快速降解以循环利用的观点[64.].
在RD和SD下的叶片和叶片鞘级分中,半纤维素和纤维素分布的图案相似(图。1先前转录组数据显示,半纤维素合成的关键酶udp -葡萄糖醛酸脱羧酶与蔗糖合酶具有非常相似的表达模式[39,与纤维素生物合成有关[64.].半纤维素和纤维素的配位可能是有利的,因为木聚糖作为含有纤维素微纤维的交联基质[39].
在本研究中,纤维素级分有趣地波动。在Rd下,在叶护套中看到ZT16中的峰值;然而,DIEL内的唯一显着差异在ZTS 1和16之间(图。5e;附加文件2:表S6)。另一方面,在SD植物中发现了另一种纤维素沉积模式。叶片中纤维素浓度由ZT1降至ZT9。同时,叶鞘中纤维素含量从白天中午到夜间第1小时呈上升趋势,然后达到一个高原,直到ZT19时下降,并在夜间其余时间恢复到相同的水平(图2)。5f).奇怪的是,在ZT19时,叶片和叶鞘纤维素的浓度相同。半纤维素也是如此(图。5d).大多数关于diel纤维素沉积的文献数据来自树木的茎干[36,37,38如上所述。我们来自SD植物的结果与先前的结果类似:纤维素主要从下午到夜间沉积。ZT19的纤维素含量的降低可能意味着在叶子鞘中发生糖转换,以有助于叶片中的蔗糖合成。支持这个假设是DIEL期间叶鞘中纤维素浓度的大多数差异在一天之间(附加文件2:表S6)。
结论
甘蔗是如何积累蔗糖和细胞壁响应短日照政权一天的给定时间间隔墙动力学的知识能合作的理解。在这项研究中,我们调查了昼夜控制下发展甘蔗可溶性糖和细胞壁成分的量。我们的结论是,甘蔗植株适应短天,代谢细胞壁以不同的方式,同时保持通过夜间合成蔗糖的合理费用。
方法
植物材料和光/周周性条件
本研究旨在当受到经常和短日报道在甘蔗品种的昼夜碳水化合物谱;并评价这种制度的在沿着在那些植物的时间过程的可溶性糖和细胞壁成分的影响。
从商业的甘蔗品种SP83-2847一百二十四家工厂(Saccharum sp.)恳求捐赠卡纳维埃拉技术中心(CTC),皮拉西卡巴,巴西。Plants were propagated by stem cuttings and grown in small pots (5 cm × 5 cm × 6.5 cm; 160 cm3.)在四氯化碳在温室条件下。After 60 days, when the plants were ~ 40 cm high, plants were divided into two groups and entrained to different photoperiods for 30 days in a controlled chamber. Light was supplied by light-emitting diodes under a 12 h light (100 μmol m−2年代−1光子磁通密度[43.])/12 h暗(正常日,RD)或8 h/16 h明/暗(短日,SD),温度维持在27±2℃,CO2室内浓度为405 ppm。光和有限公司2使用红外线气体分析仪LCPRO +(ADC Bioscietic)测量浓度。植物每周一次浇水两次,它们的位置每周在腔室内随机重新组织。30天(90天龄植物)后,叶护套(由多叶累积蔗糖制成的结构)和+ 1叶中的中间部分(具有可见露珠的最上面的叶子[63.,65.])删除中间的维管组织收获从6 (RD)和4 (SD)植物在以下时间点期间24小时(ZT0意味着时刻-在几小时后的灯被打开):ZT1, ZT6, ZT11, ZT13, ZT16, ZT20和ZT23 12 h / 12 h光/暗周期;ZT1、ZT4、ZT7、ZT9、ZT14、ZT19、ZT23为8 h/16 h的光/暗循环。因此,12 h/12 h (RD)中的ZT1, 6和11,8 h/16 h (SD)中的ZT1, 4和7分别对应于光照开始后1 h、光照周期中期和光照周期末期。其余的ZT周期分别对应于天黑后的第一个小时(RD中的ZT13和SD中的ZT9),以及天黑期间的两个点和天黑期间的最后一个小时(附加文件)1:图S1)。所有材料均在液氮下冷冻,保存在−80°C,待进一步分析。
在不同光周期照射后0天和30 d,测定了27株植株的株高(根-枝过渡到最幼叶顶端)、+ 1叶长和叶宽(从最宽处开始)。此外,我们按株高间隔组织植株,并在此间隔中选择3个具有代表性的植株,从每一个diel条件下获取0天的根、叶和叶鞘干团;在第30天对另外3个植物进行同样的测量。
细胞壁成分的分离和定量
从叶片和叶鞘中提取300毫克生物重复,采用上述方法测定每个组织和每个收获的ZT中的果胶、半纤维素和纤维素。66.].
For the pectin fraction, samples were washed and centrifuged at 13,000 RPM for 10 min with 1 mL chilled water, 1 mL acetone and 1 mL of a 1:1 (v/v) methanol-chloroform solution. Pellets were dried at room temperature and then incubated for 3 h at 37 °C in 1 mL of a α-amylase solution (2 U/mL) in 0.1 M sodium acetate buffer (pH 6.5). Samples were centrifuged at 13,000 RPM for 10 min, and the pellets were incubated three times in 600 μL of 20 mM ammonium oxalate (pH 4) for 1 h at 70 °C. The supernatants were collected after centrifugation and combined in the same microtube. The pellets resulting from this extraction were used to extract the hemicellulose fraction. They were incubated with 600 μL of 0.1 M NaOH for 24 h under vacuum at room temperature in the dark. Samples were centrifuged at 13,000 RPM for 10 min, and supernatants were collected. Pellets were then incubated three times with 400 μL of 17.5% (w/v) NaOH for 8 h in the same conditions. The four supernatants obtained by centrifugation were combined in the same microtube. Finally, the cellulosic fraction was extracted. Pellets were washed with the following solutions (1 mL): water; 1 mM acetic acid; 1 mL ethanol. After drying at room temperature, the pellets were resuspended in 1 mL 72% (v/v) H2所以4for 1 h, with vortexing every 10 min. The sugar content from each fraction was quantified in triplicate following the phenol-sulfuric method [67.],使用葡萄糖作为标准。
可溶性糖的提取和定量
在与前一部分中所述的相同条件下,叶子和叶子鞘在液氮中呈液氮磨碎。各种可溶性糖,蔗糖和还原糖各自从20mg的20mg冷冻干燥材料中提取。将样品用1.5ml 70%(v / v)乙醇在70℃下萃取1小时,以13,000rpm离心10分钟。将该程序重复四次,并将溶液合并在相同的微管中[49.].采用苯酚-硫酸法测定蔗糖和总糖含量[67.],使用纯蔗糖和葡萄糖来构建标准曲线。对于蔗糖含量,在测量前将溶液在30%KOH存在下煮沸10分钟。减少糖量定量根据Somogyi-Nelson议定书进行[68.,以葡萄糖为参照。
统计分析
学生的双侧未配对t检验使用“t检验”函数R。P-Values <0.05被认为是显着的。ANOVA用于访问大小和干肿大的差异。
可用性数据和材料
在本研究期间生成或分析的数据集包含在本发布的文章中及其附加文件中,并从相应的作者提供合理的请求。
缩写
- 2g乙醇:
-
第二代乙醇
- “大酒店”:
-
Glucosyl水解酶
- inv:
-
转化酶
- L / d:
-
光明/黑暗
- 要么:
-
氧化氧化还原剂
- 理查德·道金斯:
-
普通的一天
- S6P:
-
Sucrose-6-phosphate
- SD:
-
短时间
- SNRK:
-
蔗糖非发酵相关激酶
- ZT型:
-
授时因子时间
参考文献
- 1.
两个FC,黑千克。蔗糖磷酸磷酸盐合成酶和蔗糖合成酶活性在甘蔗中的专体组织成熟期间。AUST J植物理体。2000; 27:81-5。
- 2.
分子标记在提高甘蔗含糖量中的应用。纽约:施普林格;2012.https://doi.org/10.1007/978-1-4614-2257-0.
- 3.
粮农组织。FAOSTAT。:统计数据库;2014.http://www.fao.org/faostat/en.
- 4.
botcher A, Cesarino I, brobini dos Santos A, Vicentini R, Mayer JLS, Vanholme R等。甘蔗的木质素化:生化特性、基因发现和木质素含量对比的两种基因型表达分析。植物杂志。2013;163:1539-57。https://doi.org/10.1104/pp.113.225250.
- 5。
CONAB。Acompanhamento da safra Brasileira: cana-de-açúcar(巴西收获的后续:甘蔗)。Monitoramento agrícola: cana-de-açucar(农业监测:甘蔗)。2017.https://www.conab.gov.br/info-agro/safras/cana/boletim-da-safra-de-cana-de-acucar/item/download/1209_3473288df6b6414380e1d3ad68a39246.
- 6。
在不同气候条件下生长的甘蔗的蔗糖代谢:蔗糖的合成和储存与蔗糖合酶、蔗糖-磷酸合酶和转化酶活性的关系。植物化学。1986;25:2431-7。
- 7。
Lingle Se,Virs Rp,Johnson Rm,ToW TL,Boykin DL。对蔗糖含量的复发选择具有甘蔗的生长和糖积累改变。f crop res。2009; 113:306-11。
- 8。
Patrick JW,BIRCH RG。植物中糖和简单糖衍生物的代谢工程。植物Biotechnol J. 2013; 11:142-56。
- 9。
Rae AL, Grof CPL, Casu RE, Bonnett GD。蔗糖在甘蔗茎中的积累:运输和分隔的途径和控制点。F Crop Res. 2005; 92:159-68。
- 10.
叶蜂JM,博塔FC。分析甘蔗茎秆糖分积累的体外动力学数据基础上的。生物化学杂志2001; 358:437-45。https://doi.org/10.1042/0264-6021:3580437.
- 11.
Dodd AN, Webb AAR。在植物自己甜蜜的时候。生物化学学报。2014;36:8-11。
- 12.
引用本文:王志强,王志强,王志强,等。基因表达日常节律的自然多样性促成了表型变异。《美国国家科学院学报》上。2015; 112:905-10。https://doi.org/10.1073/pnas.1422242112.
- 13.
Hoffman de,Jonsson P,Bylesjöm,Trygg J,Antti H,Eriksson Me等。杨树转录组和代谢物中的昼夜模式的变化响应于光周期变化。植物细胞环境。2010; 33:1298-313。
- 14.
陈志强,陈志强,陈志强,等。高粱胚乳中淀粉分枝酶基因表达的生理振荡。植物信号行为。2009;4:871-2。
- 15.
Gibon Y, Bläsing OE, Palacios-Rojas N, Pankovic D, Hendriks JHM, Fisahn J,等。白天淀粉周转对短日的调节:夜间糖的消耗导致糖类利用的暂时抑制,糖的积累和adp -葡萄糖焦磷酸化酶的翻译后激活。植物j . 2004; 39:847 - 62。
- 16。
scialdone a,mugford st,feike d,skeffngton a,borrill p,graf a等。拟南芥植物进行算术划分以防止夜间饥饿。Elife。2013; 2013:1-24。
- 17。
甘蔗发育过程中气体交换和非结构性碳水化合物的日变化。acta botanica yunnanica(云南植物研究). 2018;45:865-76。
- 18。
吴l,桦树rg。甘蔗植物中的糖含量加倍,以产生蔗糖异构体。植物Biotechnol J. 2007; 5:109-17。
- 19。
甘蔗茎中蔗糖的积累受可溶性酸性转化酶和蔗糖磷酸合酶活性差异的调控。植物杂志。1997;115:609-16。https://doi.org/10.1104/PP.115.2.609.
- 20.
陈志强,王志强,王志强,等。不同成熟期甘蔗品种蔗糖合成及其代谢酶活性的关系。植物生物化学学报。1995;4:17-22。
- 21.
Batta Sk,Pant NC,Thind Ks,Uppal Sk。早期和中期成熟甘蔗基因型蔗糖积累与酶活性的表达。糖科技。2008; 10:319-26。
- 22.
Cunha CP, Roberto GG, Vicentini R, Lembke CG, Souza GM, Ribeiro RV,等。甘蔗成熟初期乙烯诱导的转录和激素反应。Sci众议员2017;7:43364。https://doi.org/10.1038/srep43364.
- 23.
在低于或高于最适温度条件下,甘蔗的生长和糖的贮藏。acta botanica sinica(云南植物学报)1998;https://doi.org/10.1016/S0176-1617(98)80209-5.
- 24.
英曼-Bamber的NG,Bonnett GD,的Spillman MF,休伊特MH,Glassop D.蔗糖积累在甘蔗是通过温度和基因型通过碳sourcesink平衡的影响。农作物牧场sci。2010; 61:111-21。
- 25.
Mattiello L, Riaño-Pachón DM, Martins MCM, da Cruz LP, Bassi D, Marchiori PER, et al.;甘蔗叶片发育阶段的生理和转录分析。BMC Plant Biol. 2015;15:300。https://doi.org/10.1186/s12870-015-0694-z.
- 26.
McCormick AJ,Cramer MD,WATT DA。强度调节甘蔗。新植物。2006; 171:759-70。
- 27。
Sachdeva M,Mann APS,Batta Sk。蔗糖新陈代谢和低蔗糖储存甘蔗基因型中的关键酶活性的表达。糖科技。2003; 5:265-71。
- 28。
•DJ。植物细胞壁的生长。《细胞生物学》2005;6:850-61。https://doi.org/10.1038/nrm1746.
- 29。
Barnes WJ, Anderson CT。释放,回收,重建:植物发育过程中细胞壁的重塑,自我降解,和糖的回收以进行新的细胞壁生物合成。摩尔。2017;8:1-16。https://doi.org/10.1016/j.molp.2017.08.011.
- 30.
Vorwerk S,Somerville S,Somerville C.植物细胞壁多糖组合物在抗病性中的作用。趋势植物SCI。2004; 9:203-9。
- 31.
甘蔗细胞壁多糖的组成和结构:对第二代生物乙醇生产的影响。生物能源研究》2013;6:564 - 79。
- 32.
Paniagua C,Santiago-Doménechn,克拉比AR,Gunning Ap,Morris vj,Quesada Ma,等。草莓果实开发期间细胞壁果胶的结构变化。植物理性生物化学。2017; 118:55-63。
- 33.
张建军,王旭,余欧,唐建军,顾旭,万兴,等。草莓果实发育成熟过程中代谢谱的研究J Exp Bot. 2011; 62:1103-18。
- 34.
引用本文:纪勇,张志强,张志强,等。番茄果皮果胶和半纤维素在果实生长过程中的重塑。植物科学。2017;257:48 - 62。
- 35.
Chebli Y,金田男,Zerzour R,Geitmann A.拟南芥花粉管的细胞壁 - 空间分布,回收,和多糖的网络形成。植物理性。2012; 160:1940至55年。https://doi.org/10.1104/pp.112.199729.
- 36.
Bobák男,NečesanýV.变化在二十四小时的时间内形成木质化细胞壁的。BIOL植物。1967; 9:195-201。https://doi.org/10.1007/BF02929737.
- 37.
Hosoo Y, Yoshida M, Imai T, Okuyama T.应用场发射扫描电镜检测针叶树分化管胞发育次级壁最内壁免疫金标记葡萄糖甘醇含量的日差异。足底。2002;215:1006-12。
- 38.
Mahboubi A, Linden P, Hedenström M, Moritz T, Niittylä T. 13C跟踪13CO2供应后揭示了阿斯彭木材形成的日模式。植物杂志。2015;168:478 - 89。https://doi.org/10.1104/pp.15.00292.
- 39。
Solomon OL, Berger DK, Myburg AA。桉树木质部发育过程中基因表达的昼夜变化规律南非J Bot. 2010; 76:425-39。https://doi.org/10.1016/j.sajb.2010.02.087.
- 40。
张志强,张志强,张志强,等。拟南芥在极短光周期下生长、淀粉周转、蛋白质含量和中枢代谢对碳供应减少的调节。植物学报2009;32:859-74。
- 41。
光周期和短日照处理对草莓营养生长和开花的影响。农业科学与技术。2001;76:77-82。
- 42.
Allison JCS, Pammenter NW, Haslam RJ。为什么甘蔗(Saccharum sp. hybrid)生长缓慢?acta botanica yunnanica(云南植物研究). 2007;73:546-51。
- 43.
高多倍体作物甘蔗义和反义转录的昼夜节律。《公共科学图书馆•综合》。2013;8:e71847。
- 44.
李H,梁Z,丁G,施L,徐楼蔡H.自然光/碳 - 氮代谢的黑暗周期调控和水稻芽基因表达。前植物SCI。2016年8月7日:1318。https://doi.org/10.3389/fpls.2016.01318.
- 45.
Dodd An,Salathia N,Hall A,Kevei E,Toth R,Nagy F等人。植物昼夜节目增加光合作用,生长,生存和竞争优势。科学。2005; 309:630-3。https://doi.org/10.1126/science.1115581.
- 46.
Bläsing OE, Gibon Y, Gunther M, Hohne M, Morcuende R, Osuna D,等。糖和昼夜调节对拟南芥昼夜基因表达的整体调控有重要贡献。植物学报。2005;17:3257-81。https://doi.org/10.1105/TPC.105.035261.
- 47.
Lemoine R, La Camera S, Atanassova R, Dédaldéchamp F, Allario T, Pourtau N,等。糖的源库运输及环境因子的调节。植物科学学报2013;4(4):272。https://doi.org/10.3389/fpls.2013.00272.
- 48.
帕皮尼-Terzi FS,罗沙FR,VêncioRZN费利克斯JM,Branco的DS,Waclawovsky AJ,等人。与蔗糖含量相关的基因甘蔗。BMC基因组学。2009; 10:120。
- 49.
Ferreira SS, Hotta CT, Poelking VG de C, Leite DCC, Buckeridge MS, Loureiro ME,等。共表达网络分析揭示了与甘蔗细胞壁生物合成相关的转录因子。植物学报。2016;91:15-35。
- 50。
麦考密克AJ,克鲁格NJ。缺乏果糖-2,6-二磷酸妥协光合作用和生长在拟南芥中波动的环境。植物杂志2015; 81:670-83。
- 51。
在转基因拟南芥中,蔗糖生物合成途径中两种关键酶,胞质果糖-1,6-二磷酸酶和蔗糖磷酸合酶的表达降低对光合碳代谢具有显著不同的影响。植物j . 2000; 23:759 - 70。
- 52。
Figueira JDA,Carvalho ph,Sato HH。甘蔗淀粉:定量测定和表征。ciênciae tecnol alm。2011; 31:806-15。
- 53。
Casu Re,Grof Cpl,Rae Al,McIntyre Cl,Dimmock Cm,Lander JM。用表达序列标签和微阵列分析鉴定在甘蔗的成熟酸性血管组织中强烈表达的新型糖转运蛋白同源物。植物mol biol。2003; 52:371-86。
- 54.
陈立强,曲晓强,侯炳辉,soso D, Osorio S, Fernie AR,等。SWEET蛋白介导的蔗糖外排是韧皮部运输的关键步骤。科学。2012;335(80):207 - 11所示。
- 55.
系统生物学与代谢建模。在:摩尔PH,博塔FC,编辑。甘蔗:生理学、生物化学和功能生物学。牛津:Jhon Wiley & Sons;2014. p。60.1–22.https://doi.org/10.1002/9781118771280.ch22。
- 56.
东投遗址,leall g,colquhoun ij,nemeth c,saulnier l,lovegrove a等。小麦CV晶粒细胞壁组合物中的时间和空间变化。在这里。Planta。2010; 232:677-89。
- 57.
Pellny TK, Lovegrove A, Freeman J, Tosi P, Love CG, Knox JP,等。发育中的小麦淀粉胚乳细胞壁:组成和RNA-Seq转录组的比较。植物杂志。2012;158:612-27。
- 58.
Calderan-Rodrigues MJ, Jamet E, Bonassi MBCR, Guidetti-Gonzalez S, Begossi AC, Setem LV, et al.;甘蔗细胞悬浮培养细胞壁蛋白质组学。蛋白质组学。2014;14:738-49。
- 59.
Douchét,clemente hs,burlat v,roujol d,valot b,zivy m等。BroChypodium distachyon作为一种改进生物燃料作物的模型工厂:搜索分泌的蛋白质,参与生物发生和拆卸细胞壁聚合物。蛋白质组学。2013; 13:2438-54。
- 60。
Francin-allami M,Merah K,Albenne C,Rogniaux H,Pavlovic M,Lollier V等。Broachymium distachyon谷物的细胞壁蛋白质组器:对细胞壁重塑蛋白质的关注。蛋白质组学。2015; 15:2296-306。
- 61。
博塔FC,摩尔PH。生物质和生物能源。在:摩尔PH,博塔FC,编辑。甘蔗:生理学、生物化学和功能生物学。牛津:Jhon Wiley & Sons;2014. p。521-40。
- 62。
关键词:甘蔗,甘蔗品种,残馀生物量,生物量潜力Sci阿格利司。2013;70:299 - 304。https://doi.org/10.1590/S0103-90162013000500003.
- 63。
Bonnett G.发展阶段(酚类学)。在:摩尔PH,博塔FC,编辑。甘蔗:生理学、生物化学和功能生物学。牛津:John Wiley&Sons,Ltd;2014. p。35-53。https://doi.org/10.1002/9781118771280.
- 64。
魏昌明,张建军,张建军,等。细胞壁代谢和己糖分配对高产量极分离蔗F2群体生物量积累的影响。BMC基因组学。2017;18:773。https://doi.org/10.1186/s12864-017-4158-8.
- 65。
Kuijper J. DeGroei van Bladschijf, Bladscheede em Stengel van het suikerriet。Arch Suikerind Ned 1915; 23:528-56。
- 66.
陈龙,陈飞,程晓峰,等。不同发育阶段高羊茅茎中木质素的沉积及其解剖学、酶活性、基因表达和瘤胃降解率的变化。中国农业科学(英文版)2002;
- 67.
Dubois M,Gilles Ka,Hamilton JK,雷伯斯PA,史密斯F.测定糖和相关物质的比色方法。肛门化学。1956; 28:350-6。https://doi.org/10.1021/ac60111a017.
- 68.
索莫吉。糖的测定。J Biol Chem. 1952; 195:19-23。
致谢
作者感谢卡纳维埃拉技术中心捐献了本研究中使用的植物
资金
洛杉矶获得科技发展委员会(CNPQ)的研究奖学金(进程140976/2-2)。RV从CNPQ获得了研究奖学金。这项工作是由fapesp(FundaçãodeAmparoàPesquisa做Estado deSãoPaulo)(授予08 / 58031-0至RV)设计和谴责该研究。本研究部分由CoordenaçãodeApherfeçoamentodepessoaldednível高级 - 巴西(Capes) - 金融代码001供交。
作者信息
从属关系
贡献
LA和RV设计了实验。LA和JL做了所有的实验并分析了数据。LA撰写了手稿,PM帮助手稿的编辑和写作的关键问题。RV合作撰写手稿和数据评估,并分析结果与关键问题。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者宣称,他们有没有竞争经济利益。
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
附加信息
手稿是LCA未发表的论文的一部分。
附加文件
额外的文件1:
图S1.每个光周期相应地的时间点的示意性概述。(PDF 59 KB)
附加文件2:
表S1.在12小时/12小时和08小时/16小时光照/暗条件下测定植物的生理特性。表S2.ANOVA表格从比较+ 1叶长度,宽度和植物高度在第0天和30时。表S3。0和30天的干质量测量。表S4。ANOVA表,用于在第0天和第30天进行的干块测量的数据。表S5。细胞壁组分相应地测量每个ZT和光周期。表S6。显著差异(p-value < 0.05) between time points for each measured cell wall components in the leaf and leaf sheath in plants under 12 h/12 h and 08 h/16 h photoperiods.表S7。对每个ZT和PhotoCeriod的可溶性糖测量。表S8。在12 h/12 h和08 h/16 h光周期下,植物叶片和叶鞘可溶性糖各测定值的时间点差异显著(p-值< 0.05)(*学生t检验)。表S9。甘蔗叶片和叶鞘的糖定量数据为mg/g*。(PDF 315 kb)
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Alves,L.C.,Llerena,J.P.P.,Mazzafera,P。等等。在细胞壁成分和可溶性糖如蔗短天的响应昼夜振荡(糖sp。)。BMC植物BIOL.19,215(2019)。https://doi.org/10.1186/s12870-019-1837-4
收到了:
接受:
发表:
关键词
- 甘蔗
- 一昼夜的
- 可溶性糖
- 细胞壁
- 光周期
- 短时间