摘要
背景
羟基氨基酰基 - 精氨酰胺缀合物(HCSPM)是一类羟基氨基酸酰胺(HCAAs),其不仅有用于植物开发和应力反应,而且还有利于人类健康。然而,HCSPM通常在植物中产生,并且它们的生物合成机制仍不清楚。在先前对酚类的调查中茄属植物有关茄子果实(茄属植物melongena我们发现茄属植物richardii是茄子在非洲的野生亲缘种,果实中富含HCSpms。
结果
推测的精胺羟肉桂酰转移酶(HT)SpmHT是独立于S. richardii和茄子。SrSpmHT鲜花和果实中的表达高,并与HCSPM积累有关S. richardii;然而,SpmHT在茄子品种和其他野生亲属中难以检测到。重组SPMHT专门选择精霉菌作为酰基受体底物,同时以下列顺序显示供体基质偏好:咖啡酰基CoA,Feruloyl-CoA和p-coumaroyl-CoA。分子对接显示SpmHT的底物结合囊能很好地容纳精胺,但不能容纳更短、更常见的亚精胺。
结论
SrSpmHT是一种新型的精胺羟基肉桂酰转移酶,专门利用精胺作为酰基受体底物产生HCSpms。我们的发现阐明了HCSpm生物合成途径,可能允许增加健康有益的代谢物茄属植物通过基因渗入或工程HCAA代谢等方法进行作物研究。
背景
羟基氨基酸酰胺(HCAAs)是一组植物次生代谢物,在各种植物物种中发现[1,2,3.].许多研究已确定的关键角色HCAAs在植物生长和发育过程,包括细胞分裂,cytomorphogenesis,开花,细胞壁交联,块茎,和应激反应[玩2,4,5].这些化合物是抗氧化剂和有效的自由基清除剂,具有抗癌、抗高血压、抗菌和其他潜在的治疗活性,对人类和动物健康有显著的好处[6,7,8].由于碳骨架的多样性,HCAAs可分为许多类别,例如多胺缀合物羟基肉桂亚精胺(HCSpd),-spermine(HCSpm),和-putrescine(HCPut)。HCSpd和HCPut是植物王国占主导地位,而只有少数植物中含有丰富的HCSpm化合物[3.,9,10,11].
HCSpm,在自然界很少见,表现出独特的健康益处。例如,N1,n14-双(二氢咖啡基)精胺(苦考胺A)是一种具有降压和抗寄生虫活性的中草药果实的主要化合物枸杞(goji莓)3.,12,13,14].锥虫硫脲还原酶是致病原生动物如利什曼原虫和其他锥虫生存所必需的酶,Kukoamine a的抑制作用是其亚精胺对应物的四倍[N1,n10-国际清算银行(dihydrocaffeoyl)亚精胺)。Kukoamine A还显示出抗癌活性,可减轻胰岛素抵抗和脂肪肝[12,14,15,16,17].此外,N1-香豆素精胺,但不是N1-coumaroylspermidine,发现有效抑制哺乳动物和小龙虾神经受体在体外18,一种对害虫管理和疼痛管理都有极大兴趣的能力。
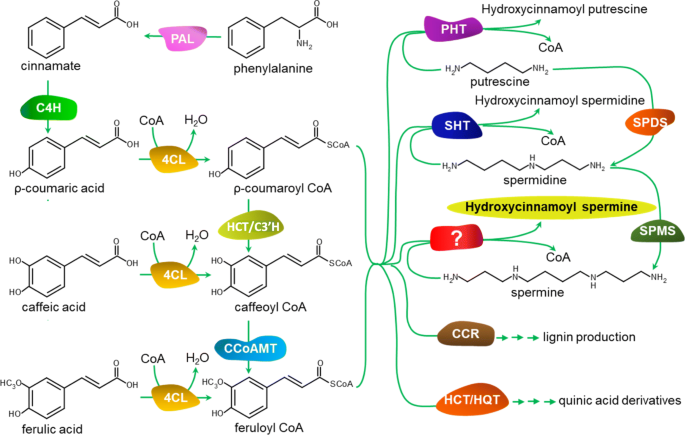
在植物中,HCAA化合物是通过苯丙氨酸途径合成的,这一途径利用大量的酶将苯丙氨酸转化为苯丙氨酸trans- 氨基氨酸,羟基氨基酰辅酶COA硫代锡[19,20.].羟基肉桂酰转移酶(HTs)可与多胺缩合生成羟基肉桂酰辅酶(图。1) [2,21,22,23,24].第一个表征HT的是an拟南芥亚精胺HT (AtSHT)催化形成单、二和三酰基亚精胺[24].后来,两个拟南芥SHT基因(AtSDT和AtSCT)被发现分别调节disinapoyl-亚精胺和dicoumaroyl-亚精胺,积累[2].烟草attenuata则SHT(NADH29)和PUTRESCINE HT(NAAT1)分别能够分别催化HCSPD和HCPPL的合成[25].此前,我们发现了一种茄子SHT (SmSHT),它被预测在花和水果中hcpd的形成中起主要作用[26].然而,专门负责HCSpm生物合成的HT尚未被确定。
HTS属于植物的BAHD超家族,这是酰基COA依赖性酰基转移酶[27,28,29].这个超家族的成员参与合成或修饰各种代谢物,如生物碱、萜类和酚类[28].它们具有一个保守的催化基序(HXXXD)和一个潜在的构象相关基序(DFGWG) [28,30.].迄今为止,几BAHD蛋白的晶体结构已经得到解决,其中包括Coffea canephora莽草酯羟基肉桂酰转移酶[31)和一个高粱双色羟肉桂酰转移酶(sbbhct) [32].这些研究部分阐明了BAHD酶的催化和底物选择机制。
茄科植物(茄科), 包括枸杞和烟草,包括数十种具有多种HCA偶联物的食用水果作物,其中包括HCA [33].一个示例性夜间作物是茄子,全球商业重要作物,具有巨大的药用重要性[34,35,36]超氧化物清除活动中的大多数蔬菜超过[37].前期工作筛选茄子(茄属植物melongenaL.)和来自非洲、亚洲和南美洲的野生亲缘植物已经使用HPLC和LC-MS-TOF鉴定出HCAA化合物[33,38,39,40].几种被证明具有较高水平HCA偶联物的茄子野生近缘种目前正在茄子改良育种项目中使用[41,42].这些与健康有关的品质在很大程度上归因于丰富多样的HCA成分,包括HCA [38,43,44],不幸的是,在驯化过程中,它们的浓度已经降低了[40].
我们以前的调查发现的几个国家加入如PI183357A(龙insanum),MM1506B(龙insanum),W324(茄属植物macrocarpon)和pi500922(茄属植物richardii),通过筛选93个样本产生HCSpms茄属植物家庭(40].其中之一,茄属植物richardii是一种非洲物种,表现出一种惊人不同的HCAA型,表明在特殊HCSPM化合物的非凡水平的果实存在[19,33,39,40].的在其生物合成途径的几个基因的表达,这些植物化学谱的相关性被用于推测HCAA生物合成途径,这表明附加候选HT [45].在本研究中,我们分析了茄子表达序列标签(EST)数据库,并基于酶动力学、结构建模和茄子和茄子基因表达谱鉴定了SpmHT候选基因S. richardii.
结果
假定精胺羟基肉桂转移鉴定
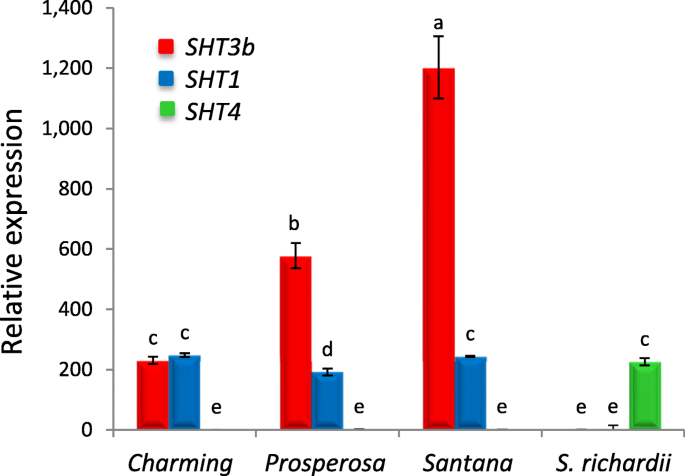
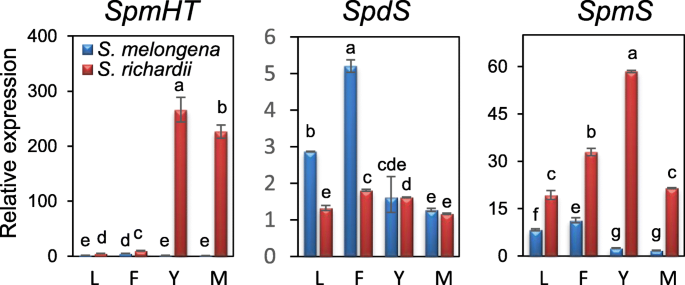
hca -精胺偶联物主要存在于S. richardii表明,一个独特的SpmHT中高度表达S. richardii,但不在茄子和许多野生物种中检查[40].因为茄子和S. richardii在本研究开始时,茄子的基因组尚不清楚,因此我们在茄子EST数据库中搜索SpmHT候选基因AtSHT.获得的ESTs被组装成6个contigs,命名为SHT1(ESTs: FS029005、FS008363、FS012273、FS020813和FS067971);SHT2(FS075455和FS075454),SHT3b(FS088019,FS032510,和FS088020),SHT4(FS076011, FS071986和FS083413),SHT4B.(FS078688),SHT5(FS066003,FS041561,和FS034051)。他们三个人(SHT2,SHT4B.,SHT5)在茄子和茄子的果实中均未检测到S. richardii因此未进一步推行。二 (SHT1和SHT3b)在所有茄子品种成熟果实中均有高表达,但在茄子品种成熟果实中几乎没有表达S. richardii(无花果。2).请注意,SHT1已由本局报告[26].然而,SHT4主要存在于S. richardii,在茄子果实中几乎检测不到,强烈提示它是一种SpmHT候选人。因此我们重新命名SHT4后SpmHT.
三种推测的多胺羟基肉桂酰转移酶基因在紫花楸成熟果实中的表达美国melongena(简历.Charming, Prosperosa, and Santana)和S. richardii.采用qRT-PCR扩增3个重复GAPDH.作为本构控制。请注意,SHT1对应于SHT此前报道26),而SHT4后改名SpmHT之后。相对表达式为fold changes(最低值= 1)。数据代表三次生物学重复的平均值(±SD)。不同的字母表示平均值中显著差异(P < 0.05; Tukey HSD test)
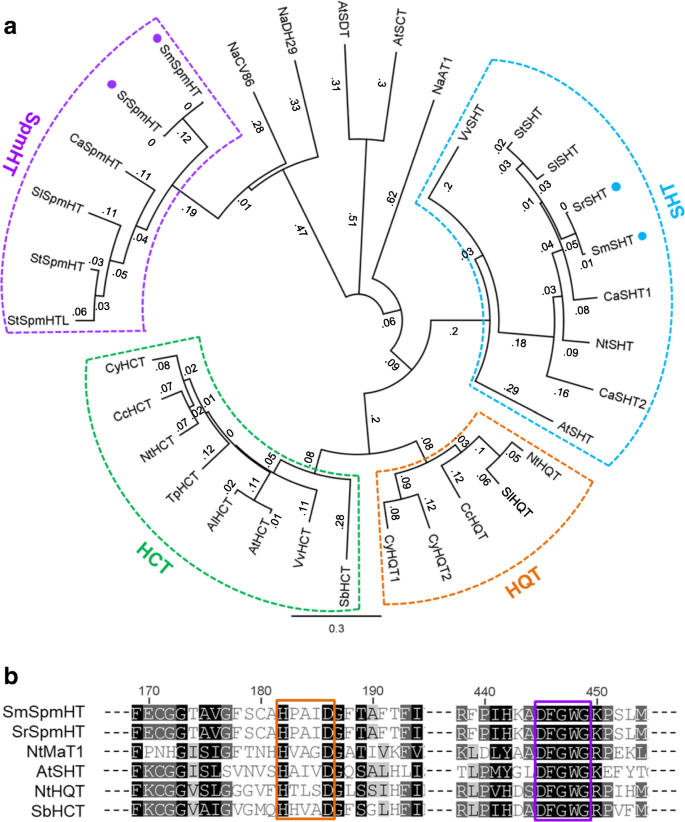
我们克隆并测序了整个编码区域SrSpmHT(KR150683)S. richardii和它的直接同源SmSpmHT(kp233218)来自美国melongena.序列比对显示两者SrSpmHT和SmSpmHT编码447个氨基酸的推定蛋白,只有两个氨基酸取代。在功能性表征的酰基转移酶中拟南芥,Coffea,烟草,茄属植物其中,烟草SHT (NaCV86)对两者的氨基酸同源性最高(53.6%)茄属植物SpmHTs。基因树分析显示SpmHT和其他羟基肉桂酰转移酶主要分布在四个分支(图。3.一种)。所有的功能特点莽草酸羟基肉桂转移酶(HCT)和奎尼酸羟基肉桂转移酶(HQT)落入我们分别指定HCT和HQT,进化枝。含有拟南芥和茄子SHT进化枝命名SHT因为两个成员已被确认来催化亚精胺酰化24,26].二茄属植物假定的SpmHT形成了一个枝。像其他BAHD家族蛋白一样,它们包含典型的HXXXD和DFGWG基元以及一些保守的催化相关位点(图)。3.b和附加文件1:图S1)。然而,与其他进化支的BAHD蛋白相比,其他区域的相似性较低。
SPMHTS和其他BAHD蛋白的氨基酸序列的PHYLAGHOM。一个,以SpmHTs和其他BAHD蛋白构建系统发育树。茄子的sht和spmht分别用实蓝色和紫色的圆点标记。系统图由使用genious软件(版本4.8.5)的ClustalW算法进行比对后,通过邻居连接方法生成。这些值代表了Jukes-Cantor模型下的遗传距离。rabidopsis lyrata.AlHCT (EFH70827),拟南芥AtHCT(AT5G48930),AtSCT(AT2G25150),AtSDT(AT2G23510),AtSHT(AT2G19070),Capsicum Annuum.CaSHT1 (capan00g001430), CaSHT2 (capan05g000927), CaSpmHT (CA09g07820),Coffea canephoraCCHCT(EF137954),CCHQT(EF153931),Cynara cardunculusCyHCT(DQ104740),CyHQT1(EU697935),CyHQT2(EU839580)Lycopersicon esculentumLsHQT (AJ582652),烟草attenuata则NaDH29 (JN390824)、NaCV86 (JN390825)、NaAT1 (JN390826)、烟草NtSHT (unannotated), NtHQT (AJ582651), NtHCT (CAD47830),高粱双色SbHCT(XP_002452435)茄属植物lycopersicumSlSHT (Solyc07g015960.1.1), SlSpmHT (Solyc12g010980.1.1),茄属植物melongenaSmSHT(KP165410),SmSpmHT(KP233218)茄属植物richardiiSrSHT (KP165411)、SrSpmHT (KR150683)、茄属植物tuberosumStSHT (PGSC0003DMP400059459)、StSpmHT (Sotub12g006790.1.1)、StSpmHTL (Sotub12g006750.1.1)、三叶草pratenseTpHCT (EU861218),葡萄VvHCT(XP_002268988)和VvSHT(XP_002269790)。b,茄子SPMHT和其他多胺羟基氨基酰基转移酶的排放区域的对准。保守的主题“HXXXD”和“DFGWG”分别标有橙色和紫色盒子
SPMHT是一种精氨类羟基氨基酰基转移酶
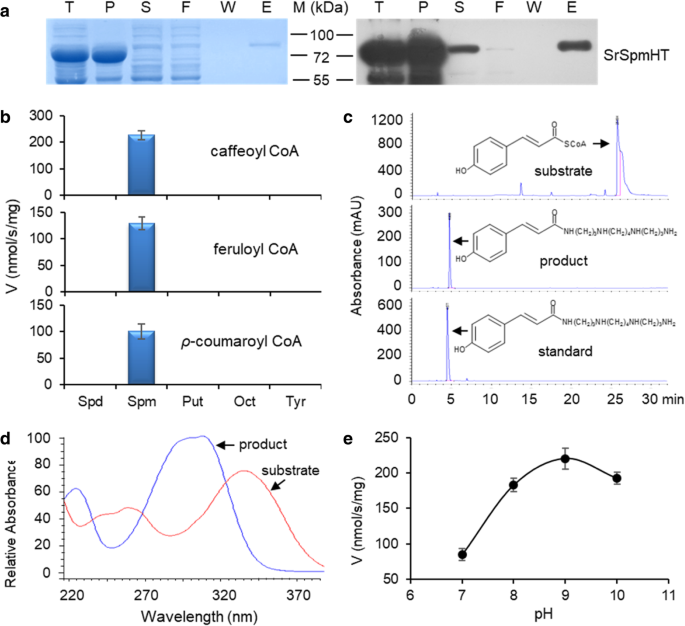
为了研究这种羟基肉桂酰转移酶的催化活性,从其中纯化了his标记的重组SrSpmHT大肠杆菌细胞提取物和通过既考马斯蓝染色证实SDS-PAGE凝胶和蛋白质印迹分析用抗His抗体(图4一种)。SrSpmHT的活性与3个酰基供体底物进行测试(caffeoyl-,feruloyl-和p-香豆蔻酰辅酶a)和五酰基受体底物(Spd, Spm, Put, Oct和Tyr)。分光光度分析表明,SrSpmHT可以有效利用所有测试的HCA-CoA供体底物,而精胺是唯一有效的受体底物(图)。4b)。所有反应产物通过HPLC-DAD进一步检查。如图1所示。5C,在色谱图时只观察到一个峰p-coumaroyl辅酶A和Spm作为底物供给。此峰被确定如N1-p-coumaroylspermine并在322nm处得到了最大特征的紫外光吸收(图。4d).同样,SrSpmHT也可以将咖啡酰辅酶a和铁酰辅酶a作为供体底物,生成相应的单酰化的Spms。在不同pH值下的进一步试验表明,SrSpmHT在pH 9.0时表现出最高的活性(图3)。4e).这些结果表明SpmHT是精胺专属的羟基肉桂酰转移酶。
SrSpmHT的底物特异性和pH最适。一个、重组蛋白的分离S. richardii精胺羟基肉桂酰转移酶(SrSpmHT)他标记的重组蛋白在大肠杆菌并通过镍亲和色谱法从细胞裂解物纯化。蛋白质纯度的评价是通过SDS-PAGE与凝胶(左)的考马斯蓝染色,并使用抗His标签抗体Western印迹进行(右):T,总细胞裂解物;P,细胞沉淀;S,上清液;女,流出液溶液;W,最后一列洗净;E,柱洗出液;b, SrSpmHT的酰基供体底物特异性。测定120 μM羟基肉桂酰辅酶a(咖啡酰辅酶a、阿铁酰辅酶a和ρ-香豆素酰辅酶a)和2.5 mM多胺(亚精胺、Spd;精胺,Spm;putresine, Put, octopamine, Oct;酪胺、酪氨酸);c,SrSpmHT的反应产物与精胺加ρ香豆酰-CoA作为底物(MAU,毫吸收单位)的C18-HPLC-DAD色谱图。N1-ρ香豆-SPM用作标准;d, ρ-香豆蔻酰辅酶a(底物)和N1-ρ-香豆蔻酰spm(产物)的紫外吸收光谱;e, SrSpmHT的ph依赖性活性。用60 μM咖啡酰辅酶a和2.5 mM精胺在不同pH环境下进行反应。条形图显示的是由三次重复计算得出的标准误差
接下来,通过改变酰基供体底物研究稳态动力学。在进行动力学分析之前,我们优化了SrSpmHT的催化条件,包括温度(25、30和37°C)、反应时间(5、8、11、15和20 min)、pH(7.0至10.0)以及DTT、EDTA和Mg的加入2+.初始速度用在几个反应的时间点不同浓度的底物的测定。SrSpmHThad the highest activity at pH 9.0 (Fig.4e)在30°C。在5-15 min内,初始速度为直线。EDTA (10 mM)和Mg2+(2 mM)对酶活性无明显影响,而DTT (1 mM)明显降低了酶活性(附加文件)2:图S2)。因此,我们选择了最佳条件为30°C, pH 9.0, EDTA 10 mM,处理15 min。由此得到的羟基肉桂酰辅酶a曲线完全符合米克利斯-曼登曲线(R2 > 0.99, Additional file3.:图S3)。营业额(K猫SrSpmHT测定咖啡酰辅酶a、阿铁酰辅酶a和p-coumaroyl-CoA were 71.5, 13.9, and 8.5 s−1分别指示SrSpmHT更喜欢使用咖啡酰辅酶A,其次是阿魏酰-CoA和p-coumaroyl-coa(表1).至于催化效率(K猫/K米的计算值p-coumaroyl-CoA(0.173年代−1μM−1)显著高于咖啡酰辅酶a (0.150 s−1μM−1)和feruloyl-CoA (0.132 s−1μM−1).此外,茄子SpmHT(SmSpmHT)也表达并从细菌细胞纯化。重组蛋白显示出相同的底物特异性,pH值优选地,并且作为SrSpmHT催化活性(附加文件4:图S4),这表明在这些直向同源物的两个氨基酸取代是不将酶的生物化学性质的关键。
SpmHT和spm高度水果从表达S. richardii但不是茄子
的表达模式SpmHT对茄子叶片、开放花、幼果和成熟果等不同组织进行了检测。《黑骏马》)和S. richardii.SrSpmHT在年轻和成熟的果实中表现出极高的表达S. richardii.然而,SmSpmHT在所有检查的茄子组织中仅弱表达(图。5).之前我们讲过SHT在幼果和成熟果中均表现出相当低的表达S. richardii茄子[26].这些意见使我们猜测这些基因在两个品种的几乎互相排斥的表达可能会导致精胺是主要的共轭多胺S. richardii,而亚精胺是茄子中主要的共轭多胺。
我们进一步检测了亚精胺合酶基因(SPDS)及精胺合酶基因(spm)在两种物种的组织中,作为植物组织是否包含各自的多胺的指标。如图1所示。6,SPDS在两个物种的所有组织中都有表达,但在茄子的叶子和花中表达水平较高。相比之下,表示spm在S. richardii显著高于栽培茄子(图。5);spm在茄子果实中几乎检测不到转录本。最高级的表达spm在幼果中检测到S. richardii.这些结果表明,两种物种都有亚胺,但是精霉素主要合成S. richardii.总之,这些结果表明,精胺可用于SpmHT到形式HCSpm在足底.
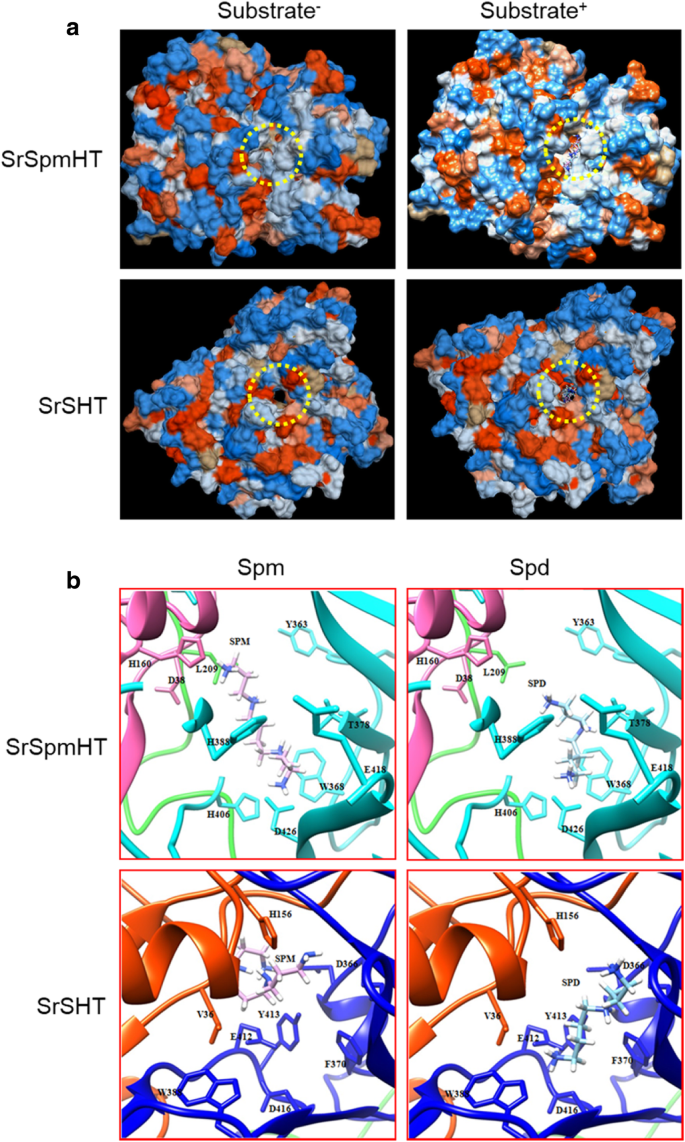
精胺/亚精胺与SrSpmHT/SrSHT的空间相互作用。一个SrSpmHT和SrSHT的三维结构。基材装订袋上标有黄色圆点圈。b在SrSHT或SrSpmHT活性位点亚精胺和精胺的最佳对接结果的比较。在色带表示SrSHT或SrSpmHT结构描述。对于SrSHT,该N端结构域(残基1-191)被着色在橙红色和C端结构域(残基227-449)的蓝色着色。保守和催化残基His156在侧链/碱所示。大交叉循环(氨基酸191-227),用于连接两个域被标记为绿色。对于SrSpmSHT,该N端结构域(残基6-199)被着色在热粉红和C端结构域(残基223-447)为青色。保守和催化残基His160在侧链/碱所示。大交叉循环(氨基酸199-223),用于连接两个域被标记为绿色。该亚精胺表示为蓝色和棍子模型和精胺表示为粉红色和棍子模型。使用UCSF嵌合体进行可视化
从结构上看,SpmHT倾向于以精胺作为酰基受体底物
基于晶体结构,建立了SrSpmHT和SrSHT的相似模型蛇根木血管合成酶(RSV)和咖啡Shikimate HT(CCHCT),因为在七种结构已知的植物BAHD蛋白RSV和CCHCT中,分别显示出最高身份(27.3和37.0%)到SRSPMHT和SRSHT [31,46].SRSPMHT的预测结构叠加在RSV的那个上,如CCHCT的预测结构(附加文件)5:图S5)。与其他BAHD家族成员类似,SrSpmHT和SrSHT的三级结构都是由两个几乎相同大小的结构域组成,这两个结构域由一个巨大的混合β片组成,其两侧有α螺旋(附加文件)6:图S6)。这一观察结果表明,BAHD家族蛋白的结构是高度保守的,虽然它们的序列具有低相似性。已报道的是,假定反应中心是在BAHD家族蛋白的中央溶剂通道[31,46].有趣的是,通过整个srsht运行的频道显然是一个漏洞,而srspmht则不是(图。6一种)。
要检查SRSHT和SRSPMHT与多胺的交互,我们在SRSHT或SRSPMHT活动站点中对SPD或SPM进行了对接分析。对于SRSHT,SPD和SPM通过溶剂通道延伸到由保守的残留物VAL-36,ASP-366,PHE-370,TRP-388,GLU-412,TYR-413和ASP-416形成的口袋中。SPD显示全部适合度 - 2469.339 kcal / mol和Δg,用于最有利的相互作用的7.936 kcal / mol,而SPM具有完全适合度 - 2420.925 kcal / mol,估计Δg为-6.946 kcal / mol。SPD和SPM通过GLU412和ASP366形成氢键相互作用。SPD和SPM的氨基朝向催化位点延伸,但SPD的氨基是更好的,因为SPM形成环时它是直的(图。6b).对于SrSpmHT, Spd和Spm通过溶剂通道延伸到由保守残基Asp-38、Leu-209、tyr363、Trp-368、His-388、His-406、Glu-418和Asp-426形成的口袋。Spm的Full Fitness为−2759.90 kcal/mol, ΔG为−8.888 kcal/mol; Spd的Full Fitness为−2721.611 kcal/mol, ΔG估计为−8.649 kcal/mol。Spd和Spm从背面通过溶剂通道向催化位点H160延伸,并通过高度保守的残基His-406和Asp-426形成氢键相互作用,两者在口袋中都是稳定的。然而,Spm比Spd更接近催化位点His160(图2)。6b)。这些结果表明,结构SPMHT更喜欢SPM而不是SPD,而SHT更喜欢SPD到SPM。
讨论
就像已经phytochemically分析最茄科植物,茄属植物茄子等水果作物含有丰富的HCAAs,含有精胺或普雷氏菌素,但不是精美,因为多胺部分[33,38].然而,HCSpms具有不同于其他更常见的HCAAs的药用特性[14,15,16,17,18].虽然几十年来HCSpms作为具有潜在治疗价值的稀有植物HCAAs已为人所知,但迄今尚未发现催化羟肉桂酰辅酶a与精胺缩合的承诺酶[47].在这项研究中,我们鉴定并表征了SpmHT,一种精胺专用HTS. richardii这是一种在非洲发现的野生茄子亲戚。
结构SPMHT与其他多胺羟基氨基酰基酰基转移酶家族酶共享线性相似性,例如亚精胺HT(SHT)和Putrescine HT(Putht)。然而,与其他HTS相比,SPMHT有两个独特的功能。首先,SPMHT在所有已知的多胺HTS中具有最高的活动,为其Vmax为大于5,7,14,21,并且SbHCT,SrSHT,AtSDT,AtSCT,和CcHCT,84倍分别[2,26,31,32].第二,SpmHT只利用精胺作为酰基受体。通过诱变已经在ht中发现了一些与催化活性相关的残基,如sbbhct中的Thr-36和Ser-38。这两个残基特别参与了羟基肉桂酰部分的结合[31,32].对应于Thr-36和Ser-38的位置由SPMHT中的Leu替换为SPMHT,并在SHT中由Val和Thr(附加文件)取代(附加文件1:图S1)。这两种取代是否对SpmHT的催化活性有影响,值得进一步研究。在多胺基团结合方面,分子对接表明SpmHT更倾向于精胺而不是亚精胺,基于FullFitness和簇形成。三个参与氢键形成的残基(His-406, Asp-426和Glu-428)在所有推测的spmht中都高度保守,而SrSHT中相应的位点被SrSHT中不同的残基取代。SpmHT如何特异性地选择受体底物以及为什么它具有较高的酶活性,还需要进一步的结构研究。
我们之前的分析表明HCSpms在S. richardii果实主要是二或三氢咖啡酰基精胺[19,33,39,40].然而,体外研究表明,SpmHT对精胺有一氢咖啡酰化作用。目前尚不清楚SpmHT是否可以使用二氢或三氢咖啡酰辅酶a作为底物在足底.另一种可能性是,单取代的精锐缀合物可以是由另一种酰基转移酶转移的第二羟基氨基酰基酰基转移的酰基受体[2].在两个天然烟草HTS(NADH29和NACV86)的情况下,NADH29特别介导在SPD上专门介导初始酰化步骤,并且不能进行第二酰化。NaCv86犯下的进一步酰化以作用于单酰化的固体物[48].进一步的解释需要结构或突变研究和体内功能分析。
SpmHT在果中高表达S. richardii但几乎没有任何组织美国melongena或者其他我们分析过的亲戚[49].因此,SPMHT在茄子和许多其他植物中被选择性地沉默,表明SPMHT在茄子果实中的表达降低将代表一种有趣的模型,以研究抗细胞化学演变在驯化过程中的分子机制。高表达spm确保HCSPM合成的SPM充足S. richardii水果。相比之下,几乎没有表达spm在美国melongena水果。因此HCAA的组成S. richardii可能通过HCAA结构基因协同表达来实现SpmHT和spm.它们的协同表达可能受到某些主调控因子的调控。MYBs在其他物种中也有调节作用HCT.表达。例如,在烟草attenuata则, MYB8通过直接激活三种多胺羟基肉桂酸转移酶(HTs)的转录控制酚胺(例如HCAA)水平[25].从那时起,它们在单子叶植物和双子叶植物(如草莓)中也有类似的牵连[49].最近的一项研究表明,正调控因子ORA59可以结合拟南芥的agmatine香豆素转移酶(AtACT)的启动子,使其表达和HCAAs生物合成响应JA/ET信号通路的同时激活[50].确定SpmHT生物合成的主要调控因子,以激活SpmHT通路,研究SpmHT的功能将是一项有趣的研究。
高水平spm表达表明大量的Spm在S. richardii水果。这是不寻常的,因为在大多数植物中,SPM在较低的水平下被合成了[51,52].一般认为,在过表达的转基因植株中,Spd可以促进番茄果实的营养生长,减少枯萎,延长寿命SPDS[52,53],而升高的Spm促进生物(渗透和/或盐)和生物(黄瓜花叶病毒和假单胞菌viridiflava通过诱导植物防御基因的表达[)抗逆性54,55,56,57,58,59,60.].因此,似乎是亚精胺在发育过程很大程度上牵连,而精胺是更可能参与应激反应[53,61.,62.,63.,64.,65.].然而,过量的SPM可能导致异常发育[66.因此,必须对植物正常生长的多胺稳态必须严格调节[67.].
结论
SrSpmHT是一种新型、高效的精胺羟基肉桂酰转移酶,专门利用精胺作为酰基受体底物产生HCSpms。这个基因在茄子和许多其他植物中几乎是沉默的。这是一项基础性工作茄属植物要树立SpmHT更广泛的表征整个植物王国,以及促进在苯丙素途径的其他基因,这将促进我们对HCAA生物合成途径在植物的调节和机制的理解的功能分析。独特的底物特异性和SrSpmHT的高活性将促进HT的催化机制的结构 - 功能研究。此外,SrSpmHT可以用来产生在HCSpm生物反应器系统,并且SrSpmHT用于工程师HCAA代谢基因,以提高胁迫耐受性和/或农产品的营养品质。也许这可以最容易茄子,这是已经配备了功能基因来实现SmSpmHT.
方法
植物材料
茄子野生近缘种的种子S. richardii(收集号:PI500922)来自美国农业部种质资源信息网。四的种子美国melongena从网上商店ECRATER购买品种(黑色美,迷人,桑塔纳和PROSPEROSA)购买(https://www.ecrater.com/c/70/home-garden).正如之前的一份报告所描述的那样,植物是在医学博士贝尔茨维尔种植的[26].Roots, leaves, flowers, young fruits at 10 days post anthesis (DPA), and market harvest fruits (20-25 DPA) were collected and frozen in liquid nitrogen and stored at − 80 °C for future use. Three biological replicates of tissues were collected per accession.
植物化学分析
样品制备和HPLC分析如前所述[40,使用甲醇:水溶剂。主要成分的初步鉴定是基于HPLC洗脱时间和吸收光谱(200-650 nm)与来自加拿大布鲁克大学Jeffrey Atkinson博士的团队获得的可信标准的比较[18].使用HR-ESI-MS和HCAA缀合物的进一步鉴定HCAA缀合物1H-NMR如前所述[40].
在硅分析和分子对接中
拟南芥亚精胺羟基肉桂酰转移酶的编码序列(CDS中)(AtSHT)对NCBI中茄子EST数据库进行爆破,组装成contigs。此外,从GenBank或基因组数据库(如Sol Genomics Network;https://solgenomics.net)通过经BLASTp特定的植物。使用ClustalW比进行多重序列比对和基因树,使用构建邻接法(NJ)与Geneious 1000个引导重复临(4.8.5)。为了获得茄子亚精胺合成酶(SMSPDS.)和精胺合酶(SmSPMS),拟南芥编码序列(CDSs)AtSPDS和精胺合成酶AtSPMS被用来对茄子基因组进行BLAST [68.].
对于三维结构分析,模型S. richardiiSHT(SrSHT)和SrSpmHT使用瑞士模型(构建http://swissmodel.expasy.org),基于咖啡HT (CcHCT, pdb代码:4G0B)的晶体结构[31),蛇根木HT (RsVS, pdb代码:2BGH)。使用Swiss PDB查看器比较模型和模板(http://spdbv.vital-it.ch.) [69.].
对于分子对接,计算相互作用S. richardiiSrSHT和SrSpmHT与多胺(亚精胺和精胺)使用SwissDock [70].评估对接每次(300次)的完全体能和吉布斯自由能量(ΔG)。基于完全适应度和聚类形成对有利的绑定模式进行评分。使用Full Fitness值对集群进行排序。从SwissDock获得的结果由UCSF Chimera (https://www.cgl.ucsf.edu/chimera/).
基因表达分析
如先前出版物中所述进行RNA分离,cDNA合成和定量PCR [26].使用Primer3设计用于定量实时PCR(QPCR)的基因特异性引物[71.)充分SpmHT等推定的HT,以及精胺合成(spm),亚精亚胺合成(SPDS), 和SmGAPDH(JX448343;一个内部控制)。基因特异性引物列于附加文件7S1:表。CFX96 Touch™Real-Time PCR检测系统(Bio-Rad., Hercules, CA, USA): 95°C for 2 min, 95°C for 5 s, 60°C for 15 s, 45个循环,然后进行熔化曲线分析。使用周期阈值(Ct) 2分析特定mRNA水平的相对定量−ΔΔCt方法。相对表达水平用的表达进行标准化GAPDH.并在折叠变化(最低值= 1)中显示。Tukey HSD试验用于确定不同组织中个体基因相对表达的显着差异。实验重复三次(三种生物重复)。
克隆SpmHT基因
全长ORFSmSpmHT从成熟果实cDNA中扩增出S. Melogena.(简历。Black Beauty),使用高保真Pfx DNA聚合酶(Invitrogen, Frederick, MD, USA)和基因特异性引物对(ATGAAAGATTCGATGCAAGTAAA/CTAAAATTTAGCAAAATCCATGATA)。用简并引物对(ATGAAAGATTCGATGCAAGTDAADAT/AAATTTAGCAAAATCSATGATATCYTG)扩增全长SrSpmHT成熟果实的cDNAS. richardii.PCR产物连接到pCR®4-TOPO?(Invitrogen公司,弗雷德里克,MD,USA)和桑格测序(爱荷华州立大学,爱荷华州埃姆斯,USA)验证。
重组SpmHT蛋白的表达和纯化
这两个美国melongena和S. richardiiSpmHT的CDS分别插入pRham™的N-他SUMO阚载体(Lucigen,Middleton的,WI,USA)在帧具有N端His标签按照制造商的说明进行操作。Briefly, a single colony carrying different constructs was cultured in LB medium containing 50 μg/mL kanamycin in an incubator shaking at 230 rpm at 37 °C. When the OD600当浓度达到0.5时,加入鼠李糖诱导剂,最终浓度为0.2%。培养物在37℃连续摇匀5 h。在自然条件下纯化his标记蛋白,并使用SUMO Express蛋白酶去除SUMO标记。用Bradford试验测定收集的蛋白质的浓度[72.通过SDS-PAGE和使用抗his抗体(Millipore, Gibbstown, NJ, USA)进行Western Blot分析,确定重组蛋白的纯度。纯化蛋白的等量储存在−80°C。
酶活性测定
Hydroxycinnamoyl-CoAs的p-香豆酸、咖啡酸和阿ferulic酸用茄子重组4CL酶合成,如所述[26].如先前所描述,检查重组SpmHT的酶活性[26].The standard reaction was run with 120 μM acyl donor (hydroxycinnamoyl-CoA) and 2.5 mM acyl acceptor (polyamine) in 0.1 M Tris-HCl buffer containing 10 mM EDTA at pH 9.0. The reaction was stopped by adding one volume of 0.4% phosphoric acid after incubating at 30 °C for 15 min. The microplates were read at 358 nm, 354 nm and 342 nm for monitoring caffeoyl-CoA, feruloyl-CoA, and ρ-coumaroyl-CoA, respectively, with EON microplate reader (BioTek, Winooski, VT, USA). Blank controls contained all components except for polyamine. The kinetic constants for SrSpmHT were determined using 0 to 240 μM different hydroxycinnamoyl-CoAs at 2.5 mM of acyl acceptor substrate (spermine). pH optima were determined by performing the assay in 0.1 M Tris-HCl buffered to different pHs in the range 7.0 to 10.0. All the reactions were run in duplicate, and each experiment was repeated at least twice.
酶动力学分析
动力学数据拟合到米氏方程。转换数K猫=V马克斯/ [E],其中[E]是酶的浓度(摩尔)。K猫/K米用于描述的酶的催化效率。所有数据均契合KaleidoGraph 4.5版的协同软件。动力学参数,从至少三次测定的。动力学参数的平均值的多重比较是单向ANOVA统计分析后杜克HSD检验。
数据和材料的可用性
SrSpmHT和SmSpmHT的GenBank登录号是KR150683和KP233218分别.支持我们的调查结果中的所有数据都包含在稿件中。构建和种子都可以从合理要求TY。
缩写
- HCAA:
-
Hydroxycinnamic酸酰胺
- HCSPD:
-
Hydroxycinnamoyl亚精胺
- HCSpm:
-
Hydroxycinnamoyl精胺
- HT:
-
Hydroxycinnamoyl转移酶
- SpdHT:
-
亚精胺羟基肉桂转移
- SpmHT:
-
精胺hydroxycinnamoyl转移酶
参考文献
- 1.
Martintanguy J.共轭多胺和繁殖发育:生化,分子和生理方法。physiol植物。1997年; 100(3):675-88。
- 2.
Luo J, Fuell C, Parr A, Hill L, Bailey P, Elliott K, Fairhurst SA, Martin C, Michael AJ。拟南芥种子中负责亚精胺偶联物积累的一种新的多胺酰基转移酶。植物细胞。2009;21(1):318 - 33所示。
- 3.
李志强,王志强,王志强,等。枸杞根皮降压机理的研究进展。四面体。1980;21(14):1355 - 6。
- 4.
多胺与环境挑战:最新进展。植物科学。1999;140(2):103 - 25所示。
- 5.
Bassard Je,Ullmann P,Bernier F,Werck-Reichhart D.Phabolamides:将多胺桥接到酚类代谢。植物化学。2010; 71(16):1808-24。
- 6。
Kwon YI, Apostolidis E, Shetty K。体外茄子的研究(茄属植物melongena)酚类化合物作为2型糖尿病和高血压相关关键酶的抑制剂。Bioresour抛光工艺。2008;99(8):2981 - 8。
- 7。
肉桂酸酯及其衍生物体外和体内抗氧化活性。植物化学修订版2010; 9(1):147-70。
- 8。
Ma CH, Dastmalchi K, Whitaker BD, Kennelly EJ。野生茄子果实中两种新的抗氧化剂丙二酸-咖啡基奎宁酸异构体。农业食品化学。2011;59(17):9645-51。
- 9。
Parr AJ, Mellon FA, Colquhoun IJ, Davies HV。马铃薯中的二氢咖啡酰多胺(库考胺及其同族)(茄属植物tuberosum代谢物图谱中检测到)的块茎。JAgric Food Chem。2005; 53(13):5461-6。
- 10.
东XK,高悉,陈W,王WS,龚L,刘XQ,罗J.苯酚的时尚分布及水稻羟基氨基酰锭的自然变化遗传学。莫尔植物。2015; 8(1):111-21。
- 11.
桂皮酸-酰胺类化合物在植物中的作用。植物生长规律1985;3:381-99。
- 12.
Ponasik Ja,Strickland C,Faiman C,Savvides S,Karplus Pa,Ganem B. kukoamine-A和其他疏水性酰基聚胺 - 有效和选择性抑制剂的临床 - FasciCulata Trypanothione还原酶。Biochem J. 1995; 311:371-5。
- 13.
缺乏锥虫硫脲还原酶的锥虫是无毒的,并且对氧化应激的敏感性增加。摩尔Microbiol。2000;35(3):542 - 52。
- 14.
锥虫酮在运动质体中的代谢和功能。微生物学报1992;46:695-729。
- 15.
Tovar J, Wilkinson S, Mottram JC, Fairlamb AH。通过tryA基因位点的定点替换,证明锥虫酮还原酶是利什曼原虫的必需酶。摩尔Microbiol。1998;29(2):653 - 60。
- 16。
王庆平,李海英,孙忠,董丽玲,高玲,刘春林,王新军。Kukoamine a通过诱导凋亡和上皮-间充质转化抑制人胶质母细胞瘤细胞的生长和迁移。Sci众议员2016;6:36543。
- 17。
李国英,周飞,陈勇,张卫国,王宁。Kukoamine a通过下调Srebp-1c降低胰岛素抵抗和脂肪肝。生物医学Pharmacother。2017;89:536-43。
- 18。
固-欧乌乌,李伟民,李伟民,李伟民。多胺羟基肉桂酸酰胺的合成与生物活性研究。植物化学。2003;63(3):315 - 34。
- 19。
苯丙素生物合成。摩尔。2010;3(1):2 - 20。
- 20。
胡勇,盖勇,尹丽,王旭,冯超,冯丽,李东,蒋晓宁,王大才。毛白杨4-香豆酸:辅酶a连接酶的晶体结构揭示其酶学机制。植物细胞。2010;22(9):3093 - 104。
- 21。
研究表明,亚精胺和亚精胺羟基肉桂酰转移酶的活性与亚精胺羟基肉桂酰转移酶活性密切相关Aphelandra tetragona.植物SCI。1996年; 113(2):149-56。
- 22。
陈志强,陈志强。花粉细胞壁与花粉素的关系。Int Rev Cytol. 1992; 140:35-72。
- 23.
王志强,王志强,王志强,等。植物花粉中苯基丙氨酸的分布及其系统发育关系。植物化学。1988;27(3):823 - 8。
- 24.
Grienenberger E,Besseau S,弗鲁瓦P,Debayle d,海因茨d,拉皮埃尔C,波兰特B,海茨T,罗格朗M.甲BAHD酰基转移酶在拟南芥花药绒毡层中表达,并参与羟基肉桂spermidines的合成。植物杂志2009; 58(2):246-59。
- 25.
MYB8通过激活三种新的羟基肉桂酰辅酶a控制诱导酚酰胺水平:多胺转移酶烟草attenuata则.植物杂志。2012;158(1):389 - 407。
- 26.
彭H,杨T,惠特克BD,Trouth楼上官L,董W,Jurick WM。从茄子亚精胺羟基肉桂转移的表征(茄属植物melongena)及其野生亲缘种茄属植物richardiiDunal。Hortic杂志2016;3:16062。
- 27.
酰基转移酶基因的进化:参与次级代谢的BAHD超家族酰基转移酶的起源和多样性。植物化学进展。2000;34:285-315。
- 28.
D'Auria JC。植物中的酰基转移酶:成为BAHD的好时机。CurrOp植物BIOL。2006; 9(3):331-40。
- 29.
Carqueijeiro I, Duge de Bernonville T, Lanoue A, Dang TT, Teijaro CN, Paetz C, Billet K, Mosquera A, Oudin A, Besseau S, et al.;BAHD酰基转移酶催化Catharanthus roseus根中tabersonine衍生物的19- o -乙酰化,使单萜吲哚生物碱组合合成成为可能。植物j . 2018; 94(3): 469 - 84。
- 30.
俞Xh,陈mh,刘cj。核细胞质局部酰基转移酶催化7-O-糖苷(ISO)黄酮的丙酰基化Medicago truncatula.植物j . 2008; 55(3): 382 - 96。
- 31.
拉勒曼德LA,苏维塔C,李神光,王YC,Acajjaoui S,蒂明斯Ĵ,麦克斯威尼S,Jez的JM,麦卡锡JG,麦卡锡AA。对于主要的绿原酸的生物合成的结构基础,发现咖啡。植物理性。2012; 160(1):249-60。
- 32.
高梁羟基肉桂酰转移酶的结构、反应机理及其与其他辅酶a依赖性转移酶和合成酶的结构关系。植物杂志。2013;162(2):640 - 51。
- 33.
吴淑珍,梅耶尔,韦德克。一种基于液相色谱-质谱的整合茄子化学、形态学和进化的新策略(茄属植物)的物种。中国有色金属学报(英文版);
- 34.
茄子的起源:走出非洲,进入东方。分类单元。2010;59(1):49-56。
- 35.
Wu SJ,NG LT,LIN CC。中药一些常见成分的抗氧化活性,当归,枸杞子和茯苓.Phytother杂志2004;18(12):1008 - 12所示。
- 36.
中国、印度和菲律宾对茄子及其相关茄科植物药用价值的比较表明,茄子的药用价值的独立发展、栽培扩散和最近的物种替换。经济学机器人。2014;68(2):137 - 52。
- 37.
韩德森总理,杨荣荣,祖SCS, Ledesma D, Engle L, Lee TC。茄子的多样性(茄属植物melongena)的超氧化物清除活性,总酚和抗坏血酸。食品学报2006;19(6-7):594-600。
- 38.
惠特克BD,Stommel JR。在商业茄子果实羟基酸结合物的分布(茄属植物melongenaL.)品种。JAgric Food Chem。2003; 51(11):3448-54。
- 39.
茄子种质核心亚群果实酚酸含量及组成。地球物理学报。2003;128(5):704-10。
- 40。
Meyer Rs,Whitaker BD,Little DP,Wu Sb,Kennelly EJ,Long Cl,Litt A.茄子驯化引起的酚类成分的平行减少。植物化学。2015; 115:13。
- 41。
考希克PGP,比拉诺瓦S,RaigónMD,ProhensĴ,广场M.酚含量,果肉颜色和栽培茄子,野生近缘种间杂交种和水果品质育种的影响褐变。食品RES诠释。2017; 102:10。
- 42。
周永明,张志强,吴涛。世界蔬菜中心茄子收藏:起源、组成、种子传播及育种利用。植物学报,2017;
- 43。
土耳其茄子的总抗氧化活性和总酚含量茄属植物melongenaL.)品种。诠释J食品支柱2009; 12(3):616-24。
- 44。
黄酮类化合物的降血脂作用茄属植物melongena.植物食物嗡嗡声Nutr。1997年; 51(4):321-30。
- 45。
李志刚,李志刚,李志刚。茄子营养性状的遗传学研究。In: Chapman M,编辑。茄子基因组:施普林格Verlag;2019.
- 46。
马晓东,王志强,王志强,等。bhd超家族的第一个代表分子vinorine合成酶的晶体结构。中国生物化学杂志。2005;28(14):13576-83。
- 47.
Luo J, Nishiyama Y, Fuell C, Taguchi G, Elliott K, Hill L, Tanaka Y, Kitayama M, Yamazaki M, Bailey P, et al. .酰基转移酶BAHD家族的趋同进化:花青素酰基转移酶的鉴定和表征拟南芥.植物j . 2007;(4): 678 - 95。
- 48.
迈耶RS,卡罗尔KG,小DP,倪MH,亚洲和茄子茄子驯化新的视角之间利特A.关系系统地理。mol phylocyet evol。2012; 63(3):685-701。
- 49.
刘建勇,Osbourn A, Ma PD。MYB转录因子作为植物苯丙类代谢的调控因子。摩尔。2015;8(5):689 - 708。
- 50.
李军,张科,孟Y,胡军,丁敏,边俊,严敏,韩军,周敏。茉莉酸/乙烯信号转导协同ORA59转录因子合成羟基肉桂酸酰胺。植物j . 2018; 95(3): 444 - 57。
- 51.
高等植物多胺的生物合成与调控。植物生长规律1985;3:205-26。
- 52.
Eisenberg的T,的Knauer H,绍尔A,布特内尔S,Ruckenstuhl C,莫纳-Gutierrez的d,环J,施罗德S,马格尼斯C,Antonacci L,等人。由亚精胺自噬的感应促进长寿。纳特细胞生物学。2009; 11(11):1305至1314年。
- 53.
Nambeesan S, Datsenka T, Ferruzzi MG, Malladi A, Mattoo AK, Handa AK。酵母亚精胺合酶过表达影响番茄成熟、衰老和腐烂症状。植物j . 2010; 63(5): 836 - 47岁。
- 54.
谷子耐盐和耐盐幼苗抗氧化物质对盐胁迫的响应差异(英文)Setaria italica).杂志。2000;109(4):435 - 42。
- 55.
作者简介:王志强,男,博士。外源施用亚精胺或精胺对耐盐性不同的3个籼稻品种的盐胁迫改善作用。植物生理学杂志。2011;168(4):317-28。
- 56.
多酚和多胺可能与杏仁砧木耐盐性有关。植物生理生化学报。2011;49(11):1313-22。
- 57.
Radhakrishnan R,Lee IJ。精华抗渗透胁迫通过抗氧化剂和脱落酸在大豆荚和种子中的改善效果。acta physiol植物。2013; 35(1):263-9。
- 58.
段俊杰,李军,郭世荣,康媛媛。外源亚精胺影响盐胁迫下黄瓜根的多胺代谢,短期内提高了黄瓜的耐盐性。acta botanica sinica(云南植物学报),2008;
- 59.
三矢Y,高桥Y,Berberich T,宫崎A,松村H,高桥H,寺内R,草野T.精胺信号传导在防御应答的显著作用拟南芥黄瓜花叶病毒植物生理学报。2009;166(6):626-43。
- 60.
冈萨雷斯ME,马科楼Minguet EG,Carrasco的-Sorli P,MA的Blazquez,Carbonell的Ĵ,Ruiz的OA,Pieckenstain FL。精胺合成酶基因的表达和转录谱的扰动提供四胺精胺在拟南芥防御中的作用对新的见解假单胞菌viridiflava.植物杂志。2011;156(4):2266 - 77。
- 61。
斯洛克姆RD,Kaursawhney R,高尔斯顿AW。多胺在植物生理学和生物化学。拱生物学生生物糖。1984; 235(2):283-303。
- 62。
Kaursawhney R, Tiburcio AF, Galston AW。烟草薄层外植体亚精胺与花芽分化。足底。1988;173(2):282 - 4。
- 63。
Imai A, Matsuyama T, Hanzawa Y, Akiyama T, Tamaoki M, Saji H, Shirano Y, Kato T, Hayashi H, Shibata D,等。亚精胺合酶基因对拟南芥的生存至关重要。植物杂志。2004;135(3):1565 - 73。
- 64。
Yamaguchi K,Takahashi Y,Berberich T,Imai A,Takahashi T,Michael AJ,Kusano T.多胺精氨酸盐对拟南芥的干旱胁迫进行保护作用。Biochem Biophys Res Communce。2007; 352(2):486-90。
- 65。
Yamaguchi K, Takahashi Y, Berberich T, Imai A, Miyazaki A, Takahashi T, Michael A, Kusano T拟南芥.2月。2006;580(30):6783 - 8。
- 66。
烟草中精胺的信号转导:通过线粒体功能障碍介导精胺激活丝裂原活化蛋白激酶。植物j . 2003; 36(6): 820 - 9。
- 67。
蒂武西奥AF,Altabella T,Bitrian男,城堡R.多胺植物的生命周期中的角色:从开发到压力。Planta。2014; 240(1):1-18。
- 68。
平川H,白泽K,宫武K,布目T,根来S,大山A,山口H,佐藤S,矶部S,田端S,等人。茄子草案基因组序列(茄子L.):代表龙种乡土旧世界。DNA Res。2014; 21(6):649-60。
- 69。
Kiefer F, Arnold K, Kunzli M, Bordoli L, Schwede T. SWISS-MODEL库和相关资源。核酸学报2009;37:D387-92。
- 70。
Grosdidier A,Zoete V,Michielin O. Swissdock,基于EADOCK DSS的蛋白质小分子对接Web服务。核酸RES。2011; 39(Web服务器问题):W270-7。
- 71。
Untergasser A, cutcuttache I, Koressaar T, Ye J, Faircloth BC, Remm M, Rozen SG。primer3 -新的功能和界面。核酸学报2012;40(15):e115。
- 72.
布拉德福德mm。用于利用蛋白质 - 染料的原理结合蛋白的微克量的定量的快速和灵敏的方法。肛门生物化学。1976; 72:248-54。
确认
作者感谢纽约植物园辉瑞实验室和基因组计划,以及诺伦温室,感谢它们支持实验室研究和植物种植。美国农业部使用公司或产品名称并不意味着批准或推荐该产品,而排除其他可能适用的名称。
资金
这项研究是由USDA-ARS NP306号项目8042-43000-015-00D资助。出资者在研究和收集,分析和解释数据的设计,并以书面的稿子没有直接的作用。
作者信息
隶属关系
贡献
HP进行了基因克隆、酶活性分析和基因表达研究,并撰写了手稿。RSM, AL和DPL协助监督基因表达工作和编辑稿件。LS和FT参与酶的纯化和活性测定。JH在HK的监督下进行对接和结构分析。AL, RSM, JH, LS和WMJ对文章有贡献。BDW共同监督实验,纯化HCA-CoA底物;并对部分手稿进行了编辑和重写。TY构思了这个项目,监督了实验,并在所有作者的帮助下编辑了手稿。所有作者均已阅读并批准本稿件。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
额外的文件1:
图S1。类bha蛋白的氨基酸序列比对。(PDF 994 kb)
额外的文件2:
图S2。重组SrSpmHT的酶学分析。(PDF 409 kb)
额外的文件3:
图S3。SrSpmHT对羟基肉桂酰辅酶a的催化动力学。(PDF 261 kb)
额外的文件4:
图S4。重组蛋白的分离与鉴定美国melongenaSpmHT。(PDF 214 kb)
额外的文件5:
图S5。预测SrSpmHT、SrSHT及其建模模板的结构对齐。(PDF 464 kb)
额外的文件6:
图S6。SrSpmHT和SrSHT的空间结构。(PDF 306 KB)
额外的文件7:
表S1。用于定量PCR分析的引物清单(PDF 287 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
彭,H.,迈耶,R.S.,杨,T.et al。一种新的用于合成植物中羟肉桂酰精胺缀合物的羟肉桂酰转移酶。BMC植物杂志19,261(2019)。https://doi.org/10.1186/s12870-019-1846-3
收到了:
接受:
发表:
关键字
- 茄子
- 羟基肉桂酸酰胺
- 精胺hydroxycinnamoyl转移酶
- 底物特异性
- 作物改良
- 茄属植物richardii
- 植物化学品