摘要
背景
的烟是辣椒的主要食叶害虫(甜椒),严重损害辣椒生长和产量。因此,研究辣椒抗病性的机理尤为重要烟粉虱,并培育和推广抗病辣椒品种烟粉虱.然而,关于植物如何感知和保护自己免受破坏性害虫的分子机制非常有限。蛋白质组技术为研究植物对胁迫的生理过程提供了一种新的方法烟粉虱.
结果
在这里,一个高抗性基因型和一个高易感基因型暴露于烟粉虱饲养48 h,探讨辣椒对烟粉虱.用等压标记相对定量和绝对定量(iTRAQ)比较两种基因型之间的蛋白质组学差异。采用平行反应监测(PRM)对定量数据进行了验证。结果表明,48 h后,RG(抗性基因型)中鉴定出37个差异丰度蛋白(DAPs), SG(敏感基因型)中鉴定出17个差异丰度蛋白烟粉虱喂食。RG和SG不加饲料时共鉴定出77个dap。通过测定DAP的功能,对其途径进行分类,主要涉及氧化还原调节、应激反应、蛋白质代谢、脂质代谢和碳代谢。一些候选dap与烟粉虱抗性如膜联蛋白d4样(ANN4)、钙网蛋白3 (CRT3)、血红素结合蛋白2样(HBP1)、酸性几丁质酶pcht28样(PR3)和脂氧合酶2 (LOX2)。
结论
综上所述,这项研究表明了复杂的耐药相关事件烟粉虱相互作用,提供了新的分子机制的基础上,植物的反应烟粉虱,并鉴定了一些候选蛋白烟粉虱攻击。
背景
烟(Gennadius)是分布最广泛的农业害虫之一,可能对许多耕地和园艺作物有害,如茄科,葫芦科和十字花科.胡椒(甜椒),是中国重要的蔬菜类型,是最严重的宿主之一烟粉虱.烟粉虱复合物包含超过24种形态上无法区分的生物类型[1]。基于线粒体细胞色素氧化酶I (mtCOI)基因的系统发育研究表明烟粉虱至少包含34个假定物种[2]。在过去的二十年里,烟粉虱B型已从其起源的中东小亚细亚地区引入至少54个国家,成为世界性的入侵和破坏性白蝇物种。在中国,烟粉虱第一次记录是在20世纪40年代末,但直到烟粉虱90年代中期的B型生物[3.]。
烟粉虱它不仅通过从韧皮部组织中吸取重要的汁液而损害植物,而且还通过携带多种病毒和促进叶片上腐生真菌的生长而造成间接损害[4,5]。造成的可见的、直接的损害烟粉虱都是叶片变形和蜜露分泌。控制烟粉虱一直严重依赖于合成杀虫剂,但世界上许多地方已经发展出对杀虫剂的抗药性。例如,烟粉虱在以色列、西班牙、克里特岛和中国,发现野外种群对吡虫啉和噻虫嗪高度耐药[3.]。植物与昆虫的相互作用导致了复杂机制的进化,以应对昆虫的攻击[6]。一个很有前途的控制替代方案烟粉虱就是研究寄主植物的抗性机制,探索抗性基因,培育持久的寄主植物抗性[4,7]。因此,研究辣椒抗病性的机理就显得尤为重要烟粉虱,并培育和推广抗病辣椒品种烟粉虱.
与病原体-植物相互作用类似,烟粉虱诱导拟南芥水杨酸(SA)防御和抑制茉莉酸(JA)防御[8]。在番茄,烟粉虱导致JA水平在几天内先升高后下降,而sa调控基因的表达则逐渐升高[9,10]喂养烟粉虱已知能诱导特定基因,如WFI1在番茄和SLW1壁球[11]。番茄发病相关蛋白(PR)基因也表达于此烟粉虱B型饲料[12]。最近,通过RNA-Seq数据集分析,揭示了棉花对虫害的全面抗性响应机制烟粉虱表明MPK-WRKY-JA和乙烯(ET)通路可能调控棉花的防御烟粉虱(13]。
尽管取得了这些进展,但植物抗烟粉虱保持模糊的定义。到目前为止,这些研究大多集中在核酸水平上,而对实际蛋白质的研究较少。蛋白质组技术为研究植物生理过程提供了一种新的方法。最近,蛋白质组发生了变化拟南芥被感染的叶子烟粉虱采用双向电泳和质谱[6]。易卜拉欣等人[14],采用液相色谱-串联质谱法(LC-MS /MS)进行一维电泳,在感染条件下表达了MAP激酶、cobra样蛋白家族和NBS抗病蛋白等主要蛋白。调查辣椒烟粉虱相互作用,两种基因型被鉴定出不同的表现烟粉虱敏感性,一种是高抗性基因型(称为RG),另一种是高敏感基因型(称为SG),以及两种基因型之间的蛋白质组学差异烟粉虱采用等压标记相对定量和绝对定量(iTRAQ)对48 h的侵染情况进行比较。这些结果可能有助于我们对蛋白质反应和改变的理解,并提供有关响应的分子机制的见解烟粉虱植物侵扰。
结果
的识别烟粉虱辣椒的抗性
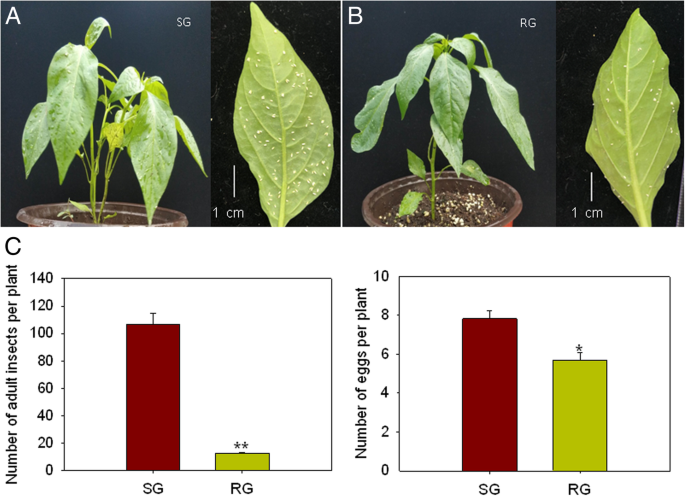
在初步试验中,我们筛选了大量的辣椒材料,鉴定出两个辣椒基因型品种,它们表现出高水平的抗性(RG)或敏感性(SG)烟粉虱侵扰。研究了两种基因型的抗性特征烟粉虱感染(无花果。1和2)。观察到RG的叶片呈深绿色,SG的叶片呈浅绿色(图2)。2a, b).此外,不同的沉降行为烟粉虱在两个品种之间发现了成虫。人口烟粉虱在SG定居的人大约比在RG定居的人高40倍。同样,SG的蛋孵化率较高,而RG的蛋孵化率较低(图2)。2c)因此,这两种基因型是研究辣椒应对气候变化的蛋白质组学机制的理想候选烟粉虱侵扰。
iTRAQ蛋白谱
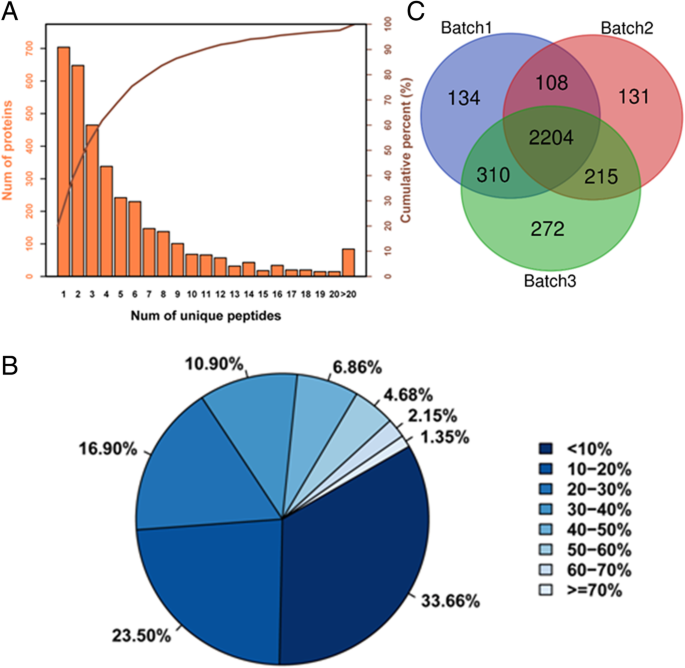
目的:探讨辣椒抗性的机理烟粉虱, 48 h后进行蛋白质组学分析烟粉虱使用iTRAQ对耐药和敏感基因型进行治疗。3次重复生成的二次质谱的平均谱识别率达到34%以上。以复制光谱为例,共获得397,554条光谱,其中13,5885条光谱与已知数据库匹配,光谱识别率为31.2%。根据Uniprot数据库,iTRAQ分析共鉴定出20,102个多肽和2756个蛋白质(至少有两个具有高可信度的独特多肽)甜椒(39,809项)(附加文件4:表S1)。
对所鉴定蛋白质的肽段数进行分析,发现大部分蛋白质的肽段数均小于12(图2)。3.a).本研究三批中含有至少2种独特多肽的蛋白数量分别为2756、2658、3001个,分别占总蛋白的79.80、79.56和80.65%。覆盖[0,10%]的蛋白的百分比为33.66%,覆盖大于或等于20%的蛋白占总蛋白的42.84%,蛋白识别覆盖率平均为21.07%(图1)。3.b).此外,三批实验的维恩图显示,共有蛋白约80%,重复性高(图2)。3.c)。
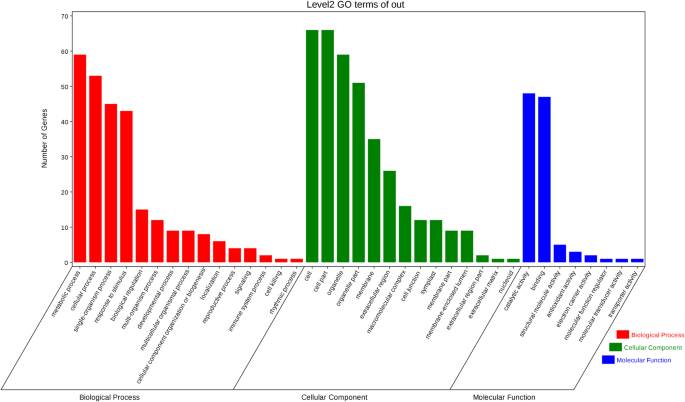
在所有三个重复中,所有蛋白质通过GO分析被注释为52个基因本体(GO)术语(附加文件)5:表S2)。从生物过程分类来看,大部分蛋白质被分为代谢过程(3193,74.6%)、细胞过程(3166,74.0%)和刺激反应(1364,31.9%)。主要细胞成分为细胞(3692,86.2%)和细胞部分(3687,86.1%)。GO分析得到的蛋白质最大的分子功能是催化活性(2118,49.5%)和结合功能(1998,46.7%)。通过通路分析,共对2884个蛋白进行了116条通路的注释,包括代谢途径、次生代谢产物的生物合成、微生物在不同环境下的代谢、核糖体、剪接体、植物-病原体相互作用等。
之后的dap识别烟粉虱侵扰
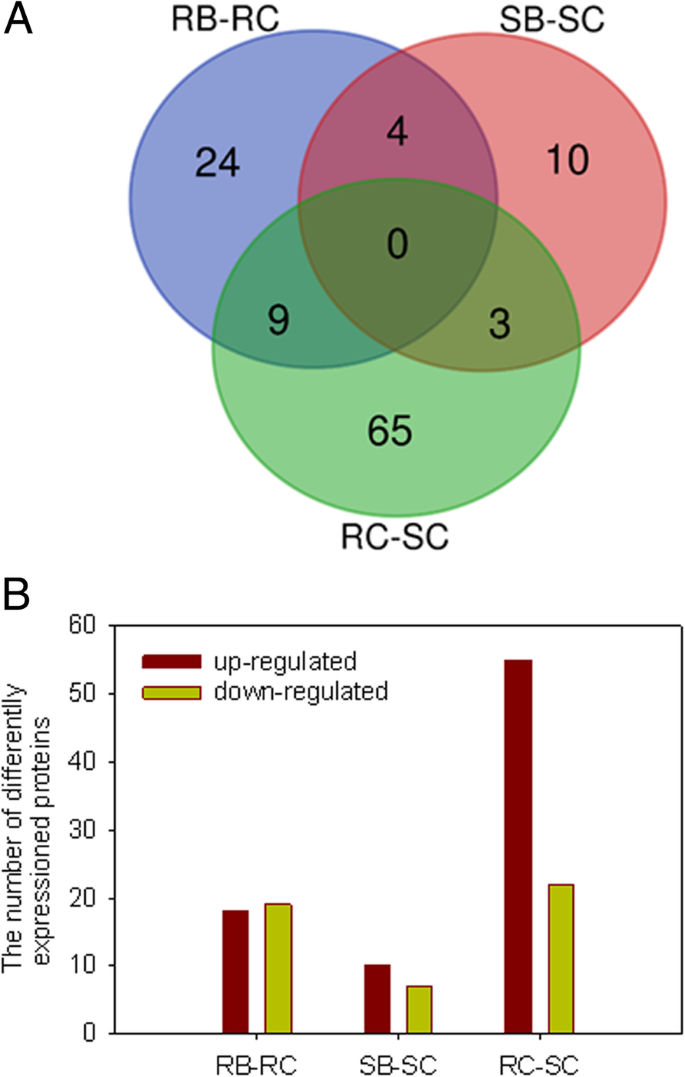
检查响应的DAPs烟粉虱时,蛋白质组在两种基因型之间发生变化烟粉虱在三个独立的iTRAQ实验中研究挑战。与对照组相比,a组改变阈值为1.50倍或0.67倍P在至少两个实验中,蛋白表达的-value < 0.05被归类为生理显著变化。我们分析了接种RG的DAPs烟粉虱(RB)和RG对照(RC), SG之间接种烟粉虱“RB-RC”、“SB-SC”和“RC-SC”共鉴定出115个DAPs。生成了包含115个蛋白质的维恩图(图1)。4)。表中列出了从三个生物重复中获得的所有蛋白质的详细信息1.后烟粉虱侵染、24 DAPs和10 DAPs在RB和SB中分别有差异积累,而在RC-SC中无差异。RB中37个DAPs中,18个蛋白表达上调,19个蛋白表达下调。在SB的17个DAPs中,有10个蛋白表达上调,7个蛋白表达下调。与SC相比,RC的9和3蛋白水平发生了变化(RC-SC)。这些具体烟粉虱反应蛋白可能是产生抗药性的重要因素烟粉虱.在venn图中,两个基因型之间共享了4个DAPs烟粉虱攻击,包括60S核糖体蛋白L4,木葡聚糖内转葡萄糖酶/水解酶,酸性几丁质内切酶pcht28样(PR3)和单脱氢抗坏血酸还原酶5 (MDHAR5)。
DAPs的分类
在基因本体论(GO)注释的基础上,利用Blast2GO将115个差异丰度蛋白(DAPs)分为3个主要富集类别(fisher精确检验,FDR < 0.05)。GO结果显示,101个DAPs(90.99%)被注释为37个功能基团,包括15个生物过程,14个细胞成分和8个分子功能(图。5)。在生物过程中,DAPs主要参与代谢过程、细胞过程、对刺激的反应等。“RB-RC”、“SB-SC”和“RC-SC”均存在“刺激反应(GO:0051716)”,主要包括“氧化应激反应(GO:0006979)”,对应的过程是“过氧化氢代谢过程(GO:0042743)”。此外,在“RB-RC”中存在更高比例的上调“刺激反应”蛋白(response to stimulus)6:表S3)。此外,“RC-SC”中存在更多与光合作用相关的蛋白质变化,如光合作用(GO:0015979)、质体组织(GO:0009657)、光反应(GO:0019684)(附加文件)6:表S3)。在分子功能类别中,DAPs主要参与催化活性和结合(附加文件)7:表S4)。除了这两大类,还鉴定出了结构分子活性(GO:0005198)、抗氧化活性(GO:0016209)、电子载体活性(GO:0009055)等。在“RB-RC”和“SB-SC”中发现了更高比例的“水解酶活性(GO:0004553)”蛋白(补充文件)7:表S4)。在细胞成分类别中,虽然“RB-RC”、“SB-SC”和“RC-SC”均存在“细胞外区域”,但“RB-RC”和“RC-SC”中增加蛋白的比例更高,说明包括细胞壁蛋白在内的相关细胞外蛋白发生了改变,以提高耐受能力烟粉虱感染(无花果。5;额外的文件8:表S5)。此外,三个比例参数中也存在“叶绿体”,但“SB-SC”和“RC-SC”中叶绿体蛋白增加比例较高(附加文件)8:表S5),表明光合作用相关蛋白在辣椒抗性中起重要作用烟粉虱.
为了进一步的功能分类,使用KOBAS3.0数据库进行KEGG通路分析,并将所有dap分配到16个KEGG通路(P< 0.05)。KEGG分类中的所有蛋白质均在附加文件中显示9:表S6。在“RB-RC”中,DAPs被分配到核糖体(ko03010)、过氧化物酶体(ko04146)、内质网蛋白加工(ko04141)等,而在“SB-SC”中,DAPs被分配到抗坏血酸和钙酸盐代谢(ko00053)和碳固定(ko00710)。在“RC-SC”中,发现DAPs参与了抗性相关通路,如光合作用(ko00195)、固碳(ko00710)、RNA降解(ko03018)、糖酵解/糖异生(ko00010)、过氧化物酶体(ko04146)和亚油酸代谢(ko00591)。“RB-RC”、“SB-SC”和“RC-SC”的共同途径包括碳固定和亚麻酸代谢。为进一步了解光合作用相关蛋白的耐受性烟粉虱,“RB-RC”、“SB-SC”和“RC-SC”的DAPs在附加文件中进行分析1:图S1和附加文件2:图S2根据GO功能和KEGG通路分析,多个参与刺激反应、抗氧化防御、光合作用和亚油酸代谢的蛋白质可能对该疾病起防御作用烟粉虱损害。一张主餐桌(餐桌1),总结了所有变化的蛋白质,以获得响应的蛋白质的概述烟粉虱.
通过PRM对所选蛋白质的iTRAQ数据进行验证
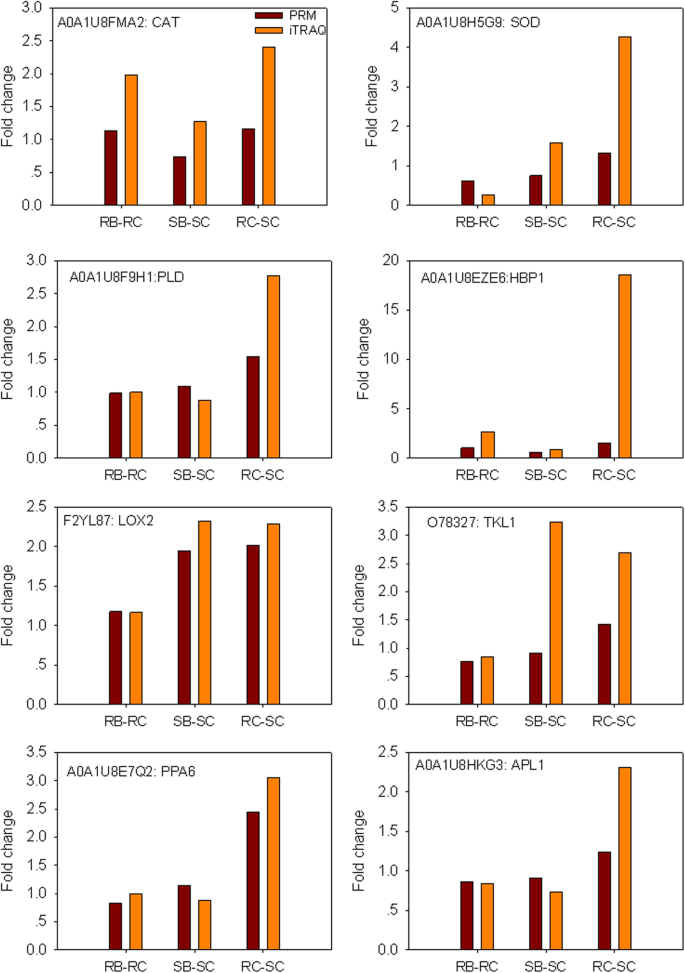
PRM是靶向质谱技术的最新发展,它比选择性反应监测更具特异性和敏感性,已被广泛用于定量和检测靶蛋白[15,16]。在本研究中,通过PRM-MS分析定量部分蛋白的表达水平,证实了iTRAQ得到的蛋白表达水平。十个候选蛋白质与抗药性有关烟粉虱进行PRM分析。在10个靶蛋白中,8个蛋白具有MS/MS谱和独特的肽段。因此,只对8个蛋白(CAT, SOD, PLD, HBP1, LOX2, TKL1, PPA6, APL1)进行PRM检测。总体而言,PRM和iTRAQ测量结果的变化趋势基本一致(图2)。6)。但是,与实际值存在差异。数值之间的差异可能是由于不同的检测方法[16,17]。因此,我们的iTRAQ结果是可靠和可重复的。
通过qRT-PCR确认所选蛋白质的iTRAQ数据
为了进一步证实iTRAQ数据,我们利用qRT-PCR监测了相应基因编码蛋白的表达模式。六种基因的表达模式(猫,草皮,骑士,HBP1,LOX2,PR3)如图所示。7.四个基因的表达趋势与我们的iTRAQ数据基本吻合,除了另外两个基因(猫和HBP1)。蛋白质组和转录组数据相关系数较低,此前已有报道[18,19]。这些差异可能归因于mRNA稳定性、剪接、翻译调节、翻译后处理、蛋白质周转控制、蛋白质降解或这些因素的组合[20.]。
讨论
综合蛋白质组图的生成烟粉虱出没的胡椒
烟粉虱是温室和露天园艺作物的主要害虫。抗性植物的筛选与利用烟粉虱是重要的农业生产资料。到目前为止,我们对植物防御反应的分子机制的了解烟粉虱是有限的,特别是对抗性植物。蛋白质组学已经成为探索细胞水平生理变化的有力工具,但很少有人尝试研究辣椒对烟粉虱在蛋白质组水平上攻击。Yin等。[6的蛋白质组变化答:芥被感染的叶子烟粉虱采用二维电泳。然而,在那份报告中,一个拟南芥品种被用于烟粉虱感染后只产生20个蛋白质。在本研究中,RG和SG基因型不同的遗传背景为鉴定辣椒防御反应中涉及的蛋白质提供了坚实的基础烟粉虱攻击。据我们所知,这是第一次使用先进的蛋白质组学技术(如iTRAQ)进行研究烟粉虱使用两种不同的耐药材料的耐药机制。
两种方法被用来充分评估iTRAQ差异表达数据(附加文件10:表S7)。对于第一个,1.50倍或0.67倍的变化阈值P-value在3个重复的平均值中< 0.05为生理显著变化。在“RB-RC”(130)、“SB-SC”(139)和“RC-SC”(251)3类差异积累蛋白中共鉴定出398个dap。进一步寻找关键的蛋白质成分或途径烟粉虱阻力响应,1.50倍或0.67倍变化阈值与P-value < 0.05的至少2个试验和3个重复的平均值均为显著变化。在“RB-RC”(37)、“SB-SC”(17)和“RC-SC”(77)这三类差异积累蛋白中共鉴定出115个DAPs。RB比SB中存在更多的DAPs。先前的研究报告支持这一结果烟粉虱在强抗性品种中,受虫害影响的差异表达基因(DEGs)多于敏感品种[13此外,差异表达分析显示,在“SB-SC”和“RC-SC”类中,上调蛋白比下调蛋白多。然而,我们的结果与胁迫棉花的观察结果相反烟粉虱,其中下调>上调DEGs。蛋白质和基因的不一致可能解释了辣椒防御中翻译和翻译后调控的差异烟粉虱感染。在本研究中,第二种方法中DAP的作用将在接下来的章节中进一步分析和讨论。GO富集和KEGG通路分析表明,参与氧化应激调节、刺激反应、亚油酸代谢和光合作用等过程的蛋白质可能参与了寄主植物对氧化应激的抗性烟粉虱侵扰。
DAPs参与氧化应激
活性氧(ROS)会在植物组织中产生,以应对不同的压力,包括与食草动物的相互作用[21]。ROS是植物体内重要的信号分子,但也可引起植物毒性。植物已经形成了一套清除高活性氧的酶系统。在本研究中,几种氧化应激相关蛋白如过氧化氢酶(CAT, A0A1U8FMA2),过氧化物酶(POD, A0A1U8FQG1),超氧化物歧化酶(SOD, A0A1U8H5G9),脱氢抗坏血酸还原酶(DHAR, A0A089FZ95),谷胱甘肽还原酶(GR, A0A1U8GBS1)和单脱氢抗坏血酸还原酶5 (MDHAR5, A0A1U8GEC0)被鉴定为响应烟粉虱攻击(表1)。
SOD是第一种以自由基为底物的酶,催化超氧自由基的变性生成O2和H2O2维持足够低的氧自由基水平。它是植物细胞防御系统中重要的保护酶,与植物的抗性密切相关[17]。在本研究中,与SC相比,RC中SOD的表达上调,这表明高抗性材料可能具有较高的清除ROS的能力。CAT催化分解的H2O2对水、氧和CAT的反应以各种有机化合物的氧化为特征,这些化合物已被证明与水稻的昆虫反应有关[20.]。豆荚酶是植物对虫害即时反应的一种必需酶。pod在植物抗虫害中的作用已经在各种植物系统中得到了研究。例如,PODs与酚类化合物结合产生的苯氧和其他氧化自由基直接阻止了昆虫的取食和/或产生降低植物消化率的毒素,这反过来导致昆虫的营养缺乏,对其生长产生严重影响[22]。在本研究中,iTRAQ数据显示,CAT和POD的表达水平在两种辣椒基因型中都被诱导,但仅在RB中被显著诱导。推测这两种蛋白在抗性辣椒中都有降低ROS损伤的能力烟粉虱.MDHAR, DAR和GR是抗坏血酸-谷胱甘肽(AsA-GSH)循环中的关键酶[23]。AsA-GSH循环被认为是植物在胁迫条件下抗性的重要机制[24]。在此循环中,抗坏血酸过氧化物酶(APX)催化H2O2AsA作为电子供体注入水中。DHAR利用谷胱甘肽提供的电子来减少DHA,而DHA以前是由MDHA产生的。同时,GSH被DHAR氧化为谷胱甘肽二硫化物(GSSG), GSSG在GR的催化下还原为GSH。食抗性高粱的绿蝽诱导过氧化物酶和谷胱甘肽- s转移酶基因的表达,但上调和下调的CAT基因不同[25]。
拟南芥MDARP和MDAR3也上调烟粉虱,其功能可能是清除过多的ROS烟粉虱喂养(6]。本实验检测到3种差异表达酶MDAHR、DAR和GR,与SC相比,RC中均表达上调,说明高水平的AsA-GSH循环在辣椒幼苗的抗逆性保护中起着重要作用烟粉虱受伤。汤普森和高金[26]表明韧皮部食性昆虫(pfi)并没有统一地调节整个叶片组织中的氧化应激相关基因。我们的研究结果还表明烟粉虱触发了两种基因型中抗氧化蛋白的差异调节。例如,烟粉虱侵染提高了抗性辣椒中CAT和POD的表达,但降低了SOD和MDAHR的表达。
此外,在氧化应激条件下,细胞的脂质成分会发生氧化,这对生物分子和几种酶活性是有毒的。最近,有报道称CeQORH可以降低与应激相关的氧化脂质γ-酮的双键[27]。在本研究中,A0A1U8FBV9 (CeQORH)是一个叶绿体包膜醌氧化还原酶同源物,是由烟粉虱(表1)。血红素在细胞内铁结合分子中表现突出。细胞质中游离血红素的存在必须保持在低浓度,以防止通过血红素铁的氧化而产生氧化应激[28]。A0A1U8EZE6和A0A1U8EZN6 (HBP)是一种血红素结合蛋白样蛋白烟粉虱在拟南芥RB中有同源基因,而在SB中没有,在RC中比SC有更高的水平。早期研究证实拟南芥同源基因AtHBP5参与抗氧化途径。AtHBP5过表达植株H积累减少2O2.HY1和AtHBP5蛋白之间的相互作用参与了一个抗氧化途径,该途径可能是由血红素分解代谢的反应产物介导的[29]。当昆虫侵入植物时,氧化应激是对昆虫伤害的最初一般反应之一[20.]。结果表明,抗性辣椒具有较强的抗氧化能力烟粉虱-触发的抗氧化蛋白的差异调节可能是由于不同程度的破坏细胞氧化还原稳态。
DAPs参与应激反应
植物被赋予了构成性和可诱导性的生物/非生物防御保护机制,即应激或防御反应[30.,31]。在本研究中,胁迫相关蛋白在两种基因型中均存在差异调控,其中3个蛋白为HSP型(A0A1U8E6Q9, A0A1U8ELM1, A0A1U8FVW2)。A0A1U8E6Q9是一个70 kDa的基质热休克相关蛋白,其同源蛋白拟南芥CPHsp70.2是植物抗氧化应激保护所必需的拟南芥(32]。A0A1U8ELM1是一个热休克蛋白90.5,是拟南芥叶绿体定位的HSP90家族分子伴侣,它与植物的非生物胁迫抗性、光形态建成和核编码蛋白导入叶绿体有关[33]。A0A1U8FVW2是一种热休克70 kDa蛋白(Hsp70-1),胞质hsp70参与拟南芥的耐热性和免疫应答,是烟草植物高产株病毒侵染所必需的[34]。从我们的iTRAQ数据来看,CPHsp70.2和Hsp90.5在RC-SC中表现出显著的积累(约2倍),而Hsp70-1仅在RB中表达上调。表达式配置文件中的变化表明涉及到这些HSPs烟粉虱宽容。
发病相关蛋白(PR蛋白)和防御相关蛋白在应激条件下被特异性诱导[31]。3个生物应激相关蛋白被鉴定为PR蛋白(A0A1U8FME6, A0A1U8HDQ1, B2CZJ6),其中在RB中的表达量高于SB(表2)1)。A0A1U8FME6是一种PR3蛋白,编码乙烯/茉莉酸介导的系统性获得性抗性信号通路中的一种基本几丁质酶。PR3基因是系统诱导的,但不是局部诱导的,它们可能是广谱抗性的候选者,即诱导的系统抗性[35]。A0A1U8HDQ1编码一个小的、分泌的、富含半胱氨酸的蛋白质家族的成员,序列与PCP(花粉外套蛋白)基因家族相似。B2CZJ6编码PYR(抗鼠动蛋白)/RCAR5 (ABA受体调节成分)家族蛋白的一个成员,也被称为PR10 [36]。RCAR5过表达导致拟南芥aba超敏表型,增强植株对aba的抗性两pv。番茄(Pst) DC3000,通过促进气孔关闭导致对这种细菌病原体的抗性[37]。PR蛋白不仅能抑制病原菌的进展,还能促进寄主植物的生长,在受感染的植物和周围组织中局部积累。在未受感染的植物部位产生PR蛋白可防止受感染的植物进一步感染[35]。这些结果表明,这些pr可能与植物对植物的感知和反应有关烟粉虱攻击的信号。
其他胁迫相关蛋白如膜联蛋白d4样(ANN4, A0A1U8E530)和calreticulin-3 (CRT3, A0A1U8H0C7)在叶片中增加烟粉虱ANN4编码Ca2 +-调节的膜结合蛋白,调节细胞质钙特征。哈等人。38提供了实验证据AnnAt4和AnnAt1在Ca中相互作用2 +调节干旱和盐胁迫反应的依赖方式和功能。最近,有报道称ann4介导的胞质钙信号通路参与了拟南芥myb30调节的氧化和热应激反应[39]。在我们的实验中,ANN4在RB中显著表达,达到7.63倍,而在SB中保持不变,这表明ANN4和ANN4介导的钙信号通路可能参与了辣椒抗性烟粉虱损害。CRT已被证明是Ca2 +-结合分子伴侣,促进新合成糖蛋白的折叠和调节钙2 +内质网腔内的稳态[40]。拟南芥CRT3介导植物对病毒和生物营养性病原体的防御[41)拟南芥阴极射线管突变体atcrt3更敏感两pv番茄DC3000 (Pst DC3000)与水分胁迫[40,41]。因此,CRT3在高抗性辣椒中的高表达可能被确定为一种防御烟粉虱入侵。
DAPs参与蛋白质代谢和调节
当植物受到昆虫攻击时,它们会产生许多与防御相关的蛋白质,其中许多会被合成,然后分泌到细胞内的不同目的地[20.]。蛋白质合成方面,60S核糖体蛋白L4/L13/7a-1、30S核糖体蛋白S20、50S核糖体蛋白L2/L15、60S核糖体蛋白L4/L13/7a-1等6种核糖体蛋白在RC中含量高于SC,而这些核糖体蛋白在RB中表达下调,而在SB中保持不变。这说明抗性植物的蛋白质合成过程可以保持较高水平,但具体影响机制尚不清楚。
蛋白质二硫异构酶(PDI)是硫氧还蛋白超家族的一员,参与内质网分泌蛋白的进展和成熟[42,43]。AtPDI6作为D1合成的衰减器,以光调节的方式调节光抑制。PDI是未折叠蛋白反应的一个组成部分,可减轻内质网应激和程序性细胞死亡[44]。最近,有人提出pdi具有专门的和重叠的功能,以适应新的生化需求或环境。彭等人。[43表明转基因烟草过度表达AtPDI6AtPDI6对高浓度的2,4,6-三氯酚(TCP)具有较强的耐受性,表明AtPDI6可以通过在植物中过表达的方式参与TCP的解毒。在我们的实验中,两种pdi (PDIL6 A0A1U8GVQ2)和(PDIL1 A0A1U8GX36)在RC中比在SC中显示出更高的丰度烟粉虱入侵。之后,SB-SC中PDIL1水平增加了2倍以上,而RB-RC中则没有烟粉虱入侵。上述结果表明,抗性辣椒通过调控核糖体蛋白和蛋白二硫异构酶具有较强的基础防御能力。
植物对胁迫的明确反应包括增强热休克蛋白的产生,热休克蛋白在限制由胁迫诱导的蛋白质聚集物的产生和积累方面维持细胞的蛋白质稳态,从而有助于恢复被胁迫条件破坏的细胞蛋白质稳态[45,46,47]。在上一节中,已经讨论了CPHsp70.2, HSP90和Hsp70-1的功能。最近,研究表明这些HSPs中的一些能够在正常或应激条件下控制mRNA的翻译[47,48]。在恢复阶段,小HSPs和HSP101参与了eEF1B和eIF4A等翻译因子的再溶解[46,47]。Merret等人。[47]表明HSP101是从应激颗粒中有效释放核糖体蛋白mrna所必需的,从而通过产生新的核糖体蛋白快速恢复翻译机制。在我们的研究中,与拟南芥HSP101同源的伴侣蛋白clpb1样蛋白A0A1U8G5J6在对HSP101的响应中增加了1.72倍烟粉虱在RB中攻击,但在SB中保持无变化(表1)。这些观察结果表明,耐药基因型可以迅速调整随后的翻译水平烟粉虱压力。
脂质代谢相关蛋白
脂质介导的信号过程对于细胞的生存、生长和分化以及植物对盐度、害虫和病原体等生物和非生物线索的反应至关重要[49]。信号脂类包括多种脂类,如溶血磷脂、脂肪酸和磷脂酸。在本研究中,过氧化物酶体脂肪酸β -氧化多功能蛋白AIMI (A0A1U8E9J9)在RB中表达增加。AIMI是建立幼苗所必需的,也参与JA的生物合成[50]。磷脂酶D (PLD)水解常见的膜磷脂,生成游离的头基和磷脂酸(PA)。pld介导的磷脂水解在植物中非常突出,并在植物对胁迫的反应中发挥重要作用,包括植物与病原体的相互作用[51]。在我们的实验中,PLD α 1 (A0A1U8F9H1)和PLDrp1 (A0A1U8FRJ4)没有被诱导烟粉虱两种基因型均有发病,但在RC中表达量高于SC(约3.0倍)。拟南芥突变体的反义抑制骑士α表达减少了PA和JA的产生。PLD与植物相互作用中JA/oxylipin的形成有关葡萄孢属cinere及剧毒Pst DC3000 [52]。PLDrp1的功能尚不清楚,但其在植物中的大量表达和分布表明其与PA结合,作用于PLDα通路下游。pa结合磷酸化蛋白PLDrp1受PLDα1以应力依赖方式调控[53]。我们的结果表明,pld介导的信号在SB中有助于提高抗性烟粉虱而PLDrp1和PLDα1的表达未被激活烟粉虱.
JAs在促进对广谱昆虫的抗性方面发挥着核心和保守的作用,这是源自叶绿体膜中α-亚麻酸的脂质衍生信号[50]。植物脂氧合酶(LOXs)催化多不饱和脂肪酸的氧化,生成氢过氧脂肪酸。LOX2编码13(S)-脂氧合酶(LOX),该酶控制JAs生物合成的第一个专用步骤,催化α-亚麻酸生成(13S)-氢过氧乙酸三烯酸的初始步骤。在本研究中,拟南芥AtLOX2同源的LOX2 (F2YL87)在SB中显著增加,但在RB中没有。在大米中,过度表达OsLOX植物增加了内源性JA水平,当被韧皮部喂养的棕色植物漏斗感染时,植物死亡率降低[54]。在玉米中,13-LOX ZmLOX10参与了咀嚼抗性Spodoptera exigua幼虫(55]。在大麦,LOX2.2过表达系中其他部分ja调控基因表达上调,蚜虫数量减少,表明LOX2.2参与了ja介导的反应的激活,表明LOX2.2参与了基本的防御反应[56]。最近,有报道称LOX2参与拟南芥绿叶挥发物(GLVs)的生物合成[57]。glv已被证明可诱导防御反应,并参与植物-昆虫相互作用的间接防御[58,59]。另据报道,LOX2参与了单线态氧的生成,作为对食草动物和物理因素诱导的伤害的反应,这为局部防御反应中伤口诱导的信号传导提供了新的见解[60]。虽然LOX2仅由烟粉虱在SB中,正常情况下RC的LOX2水平高于SC。的烟粉虱PRM和RT-qPCR进一步证实了LOX2的表达(图;6和无花果。7)。由此可见,易感辣椒植株可能在胁迫下激活了lox2介导的JA信号的基础防御机制烟粉虱在抗性植物中已经存在并保持较高水平的攻击。
参与光合作用的DAPs
除了食草动物诱导的物理和化学防御外,植物的初级代谢也发生了许多变化,以应对昆虫食草动物[61]。关于与昆虫摄食相关的初级代谢变化的研究主要集中在碳水化合物作为光合作用产物的作用上。在本研究中,通过KEGG富集分析发现有8个蛋白(A0A1U8GUM8、A0A1U8FUM0、A0A1U8FRH4、A0A1U8GVK4、A0A1U8FGM0、A0A1U8FJN4、A0A1U8FZN5和A0A1U8EAE0)参与光合作用系统(附加文件)1:图S1)和7个蛋白质(A0A1U8FNB3, A0A1U8HDS6, A0A1U8E7W8, A0A1U8GDS4, A0A1U8GZ15, A0A1U8HK56, A0A1U8FHQ4)参与光合生物的碳固定(补充文件2:图S2)。此外,A0A1U8FNB3、A0A1U8GZ15、O78327、A0A1U8E7H4、A0A1U8EJC2和A0A1U8HFF2也参与了光合CO2固定的过程。例如,叶绿体TKL(转酮酶,A0A1U8FNB3;O78327)是植物碳代谢的关键酶,因其在Calvin-Benson-Bassham (CBB)循环和磷酸戊糖氧化途径中都有两栖生物作用[62]。有趣的是,大多数蛋白在RC中的表达量明显高于SC,但在RB和SB中没有明显增加(表2)1)。
关于植物应该如何改变光合作用,从而改变碳固定,以优化防御,有两种相互矛盾的观点。食草性可促进或削弱光合作用[61]。例如,Bilgin等人。63]表明生物胁迫在全球范围内下调了光合作用基因。而Halitschke等人[64]显示出野生烟草中的盲蝽唾液分泌物对植食性光合作用的特异性诱导。在这项研究中,增加光合作用的想法是非常反对的烟粉虱通过iTRAQ法进行光合作用相关蛋白表达的验证。此前,小麦和大麦对俄罗斯小麦蚜虫的抗性与光合作用相关基因的表达增加有关烟粉虱攻击(65,66]。光合活性可以促进,因为(1)防御性代谢产物的合成需要碳固定或(2)增加光合活性以弥补昆虫造成的叶面积损失[61]。结果表明,该材料具有较强的光合作用能力,对植物的光合作用有一定的响应能力烟粉虱这表明光合作用和碳代谢可能与辣椒的抗性有关烟粉虱.
其他一些蛋白质也被发现与植物防御有关。例如,SEOR1是一种参与植物防御的韧皮部丝蛋白[67]。蚜虫的一种Myzus persicae在拟南芥AtSEOR1和AtSEOR2与蚜虫相比,突变体在对照植物上的表现更差,表现为繁殖减少和繁殖周期缩短。然而,Anstead等人[68结论是,seo不参与植物对韧皮部昆虫的防御。Pagliari [69]显示,植物原体滴度较低AtSEOR1突变系表明该基因可能参与植物防御机制。此外,atseor1介导的JA和顺-12-氧-植二烯酸代谢可能在植物对植原体的防御中起作用。PGK2是一种核编码的叶绿体磷酸甘油酸激酶,在细胞代谢中起着核心作用。拟南芥高效西瓜花叶病毒(WMV, Pot属病毒)侵毒需要PGK蛋白[70]。
结论
在本研究中,综述了辣椒抗性基因型和敏感基因型的蛋白表达谱烟粉虱首先用iTRAQ技术探讨48 h的发病情况。本文提供的蛋白质组学数据将有助于我们进一步了解植物抗病性的分子机制烟粉虱.提示植物表达更多的氧化还原调控相关蛋白以应对氧化损伤烟粉虱提高植物的耐受性。PR3、Hsp70-1、HSP101和JA通路在耐药基因型中较为活跃,可能与耐药基因型的发生有关烟粉虱辣椒的抗性。同时,我们的研究结果支持光合作用(碳代谢)的增加与辣椒的抗性有关的观点烟粉虱.其中,ANN4、CRT3、CEQORH、AIMI等基因均有特异性参与烟粉虱-辣椒相互作用过程。未来,对本研究中发现的特定蛋白质功能的研究将有助于探索宿主对该病毒的抗性机制烟粉虱攻击。
方法
植物材料和昆虫养护
在这项研究中,辣椒(甜椒)基因型新苏椒15号(抗性基因型RG)和基因型苏椒15号(敏感基因型SG)均来自江苏省农业科学院蔬菜研究所。种子在中国扬州大学的无虫害生长室中生长。按照园艺方法灌溉和施肥,但没有喷洒除草剂。无病毒的菌落烟粉虱在害虫温室中对番茄维持B型侵染。
Non-preference测试
选取2株叶面积相近的7叶期辣椒抗性苗和2株易感苗,置于60目网笼中,防止粉虱逃逸。四盆秧苗围成一圈。200只成虫被收集在一个容器里,挂在圆圈的中心。在释放后24 h、48 h和72 h,分别统计每个品种成虫的数量,根据72 h幼苗上的昆虫数量,确定每个品种的平均落体数。试验分为5个生物重复,重复2次以确认试验结果。
卵孵化率
以第7叶期健康苗(cv。选择RG和SG)。每株植株用60目纱布覆盖,寄生5对刚出苗的成虫烟粉虱.释放后3 d,计数每株苗的卵数(含若虫)。实验进行了5个生物重复,重复两次以确认结果。
烟粉虱感染试验
测试样品(cv。RG和SG)生长到第7叶期。收集50只成虫,放于第5叶上,用一个小通风袋封闭3.:图S3)。以无虫害的植株作为对照。后烟粉虱感染48 h后,将感染的叶片切下,立即在液氮中冷冻,并保存在−70°C冰箱中备用。所有试验均分为3个生物重复。
蛋白质萃取及还原烷基化处理
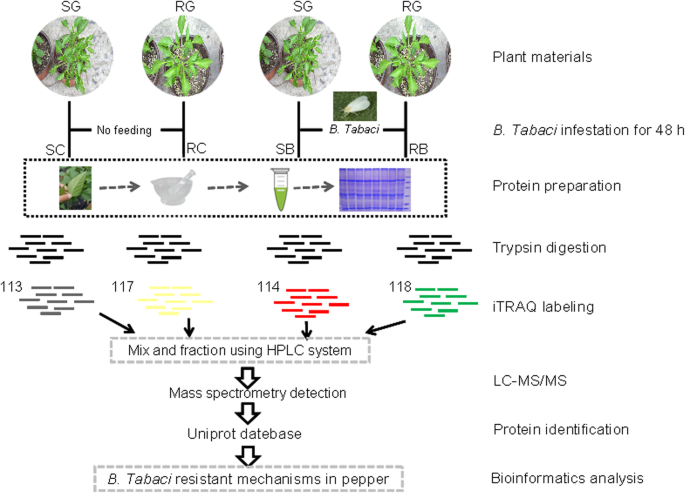
蛋白质组学研究设计如图所示。1.对于蛋白质提取,12个叶片样本(两个基因型的3个生物重复作为对照和烟粉虱侵扰;处理:SB和RB是指SG辣椒和RG辣椒烟粉虱分别侵扰;对照:SC和RC是指SG辣椒和RG辣椒不含烟粉虱分别在液氮中研磨成粉末,并在含有1 mM PMSF和2 mM EDTA(终浓度)的裂解缓冲液(7 M尿素,2 M硫脲,4% SDS, 40 mM Tris-HCl, pH 8.5)中孵育5分钟,然后向样品中加入10 mM DTT(终浓度)。样品超声15分钟,在4°C, 13,000×g离心20分钟。将上清液转移到新管中,与4卷预冷烷基化液在−20°C下混合过夜。离心后,将蛋白颗粒风干并在8 M尿素/100 mM TEAB (pH 8.0)中重悬。蛋白质样品在56°C下用10 mM DTT还原30分钟,然后在黑暗中用50 mM碘乙酰胺(IAM)烷基化30分钟。
胰蛋白酶消化和iTRAQ标记
用100 mM TEAB稀释5倍后,每个样品100 μg蛋白进行胰蛋白酶消化。胰蛋白酶(Promega, Madison, WI, USA)以1:30 (w/w)的酶蛋白比例添加,在37°C下消化过夜。用等体积0.1%甲酸(FA)溶液酸化消化肽,并用Strata-X C18色谱柱脱盐。将酸化的酶解液注入柱中三次,然后用溶剂A (0.1% FA, 5% ACN)洗涤柱两次,用溶剂B (0.1% FA, 80% ACN)洗脱1 ml肽。最后,将多肽冻干并在20 ul 0.5 M TEAB中重组,用于多肽标记,使用iTRAQ 4-plex试剂盒(AB Sciex Inc.,美国),根据制造商的方案:Control和烟粉虱两个辣椒基因型处理分别标记为附加文件11:如表S8所示。将标记后的样品组合并冻干。接下来,使用高效液相色谱(HPLC)系统(Thermo DINOEX Ultimate 3000 BioRS)和Durashell C18 (5 um, 100 Å, 4.6x250mm)对标记样品进行分离,收集12个馏分。
LC-ESI-MS / MS分析
将每个组分溶解于30 μl 2%乙腈中,使用Triple TOF 5600+质谱仪和Eksigent nanoLC系统(SCIEX, USA)分析。将5 ml肽样品装入C18阱柱(5 μm, 100 μm × 20 mm),以300 nL·min洗脱−1在C18分析柱(3 μm, 75 μm × 150 mm)上梯度90 min。流动相为缓冲液A(2%乙腈/0.1%甲酸/98% H)2O)和缓冲液B(98%乙腈/0.1%甲酸/2% H2O).对于IDA(信息依赖获取),每次扫描在250 ms内收集调查扫描,在100 ms内收集30个生产扫描。MS1光谱采集范围为350-1500 m·z−1MS2光谱采集范围为100-1500 m·z−1.前体离子被排除重选15 s。
数据分析
通过搜索UniProt进行蛋白鉴定和定量c .建立蛋白质数据库(39,809个蛋白质,2017年10月更新)。选择生物修饰作为ID焦点。偏差校正和背景校正检查蛋白质定量和归一化。根据软件计算,所有识别出的蛋白质的未使用Protscore为> 1.3(对应于识别出>的蛋白质的95%置信度),通过PSPEP算法在蛋白质水平上确定的全局错误发现率(FDR)≤1%。要被认为是差异表达,蛋白质需要有一个p≤0.05,由软件计算。对于3个生物学重复,病例组和对照组之间的中位数表达比例定义为折叠变化。通过学生t检验(双尾和非配对)来确定被比较样本之间蛋白质表达水平差异的统计意义,以校正多重假设检验。对于使用iTRAQ测量的蛋白质丰度比值,3个重复的平均值变化阈值为1.50倍或0.67倍P-value < 0.05在至少两个实验中被归类为显著变化。
生物信息学
在本研究中,所有差异丰度蛋白(DAPs)的功能注释是通过使用本地化的Blast2go v2.6对抗程序对NCBInr植物数据库(https://github.com/wegnerce/taxomias)。所有鉴定蛋白的生物学和功能特性用基因本体(GO)术语(http://geneontology.org/)。用聚类正交蛋白群系统对蛋白质进行功能分类(http://www.ncbi.nlm.nih.gov/COG/)进行。所有被鉴定的蛋白质都在京都基因和基因组百科全书(KEGG)中被映射到一个途径富集。
平行反应监测(PRM)定量靶蛋白
在Triple TOF 5600+ LC-MS/MS系统(SCIEX)上选择12个蛋白(包括2个参考蛋白)进行PRM验证。蛋白质提取和胰蛋白酶消化的方法与iTRAQ实验相同。首先在DDA模式下进行MS数据采集,在每个周期的每次调查MS1扫描后获得最丰富的40个前驱体离子的MS/MS谱。利用Protein Pilot软件进行蛋白质鉴定,将数据库搜索结果导入Skyline软件进行光谱库构建。将PRM验证的靶蛋白导入Skyline软件,根据谱库中的离子信号选择蛋白定量的肽段。从Skyline导出包含m/z值和保留时间的相关肽列表,并导入MS控制软件Analyst用于PRM获取方法的构建。对感兴趣的生物样品进行PRM方法,进行评估和改进,以开发最高质量的测定。每个样品的数据采集采用最终PRM采集方法在qTOF质谱仪上进行,其中每个前驱体离子由四极杆选择,碎片化,然后所有碎片离子在TOF质谱仪上定量。为了消除蛋白质携带,需要在相邻样品之间运行一个“空白”进行柱清洗。在Skyline中进行数据处理,并对目标蛋白的每个肽进行人工量化结果检查。
实时定量PCR (qRT-PCR)分析
为了研究iTRAQ和PRM数据集中转录物与蛋白水平的相关性,确认反应蛋白,我们选择了6个不同的表达蛋白进行进一步的qRT-PCR分析。肌动蛋白- 97和磷酸烯醇丙酮酸羧化酶2作为内参基因。根据感兴趣的蛋白信息,从NCBI中获得相应基因的全长cDNA序列,引物(附加文件12:表S9)采用NCBI引物工具设计。48小时后烟粉虱饲养后,按照厂家说明书(Invitrogen Trading (Shanghai) Co., Ltd)采用Trizol提取方法从辣椒叶片中提取总RNA,并使用ReverTra Ace qPCR RT Kit (Toyobo生命科学Co.)从等量(1.0 μg)总RNA中逆转录cDNA。反应使用SuperReal PreMix Plus试剂盒(Toyobo生命科学公司)根据协议进行。热循环器执行如下:95°C 1 min循环1次;接着是95°C, 15 s和60°C, 30 s的40个循环。相对基因表达量由2——ΔΔCT方法。实验重复了三次。
数据和材料的可用性
本研究中所使用的材料将免费提供给通讯作者:fczhou@yzu.edu.cn
缩写
- 衣冠楚楚的:
-
差异丰度蛋白质
- iTRAQ:
-
等压标签相对和绝对量化
- 是:
-
茉莉酸
- 人口、难民和移民事务局:
-
平行反应监测
- 存在:
-
定量rt - pcr
- RB:
-
感染的抗性基因型烟粉虱
- RC:
-
RB控制
- 鲁柏:
-
耐药基因型
- 山:
-
水杨酸
- 某人:
-
感染的易感基因型烟粉虱
- SC:
-
某人的控制
- SG:
-
易感基因型
参考文献
- 1.
Barro PJD, Liu SS, Boykin LM, Dinsdale AB。烟:物种状态的声明。昆虫学报。2009;56:1-19。
- 2.
丁斯代尔A,库克L,里吉诺斯C,巴克利YM,巴罗PD。对烟粉虱(半翅目:烟粉虱:烟粉虱总科)线粒体细胞色素氧化酶1进行全局精细化分析,以确定种级遗传边界。中国昆虫学报,2010;23(3):366 - 366。
- 3.
杨宁,文鑫,辛勇,王松,吴强,李锐,潘惠鹏,等。甘薯粉虱的转录组和蛋白质组反应,烟,改为噻虫嗪。科学通报。2013;8:e61820。
- 4.
Elsen OVD, Lucatti AF, Heusden SV, Broekgaarden C, Mumm R, Dicke M,等。定量抵抗烟在茄属植物pennellii:遗传学和代谢组学。中国生物工程学报,2016;
- 5.
李志刚,李志刚,李志刚,李志刚,等。RNA干扰法下调粉虱渗透调节因子(烟):控制白蝇的潜在技术。PLoS One. 2016;11:e0153883。
- 6.
尹华,闫峰,季军,李勇,王蓉,徐成拟南芥这些叶子上有烟草粉虱烟,(属)B型。植物摩尔生物学报告,2012;30:379-90。
- 7.
张文杰,张文杰,张文杰,等。植物抗虫基因的研究进展。中国生物技术学报,2011;9:419 - 424。
- 8.
Zarate SI, Kempema LA, Walling LL。银叶粉虱诱导水杨酸防御和抑制有效茉莉酸防御。植物科学学报。2007;43(3):366 - 366。
- 9.
张培军,何永春,赵春,叶志华,于XP。茉莉酸依赖防御在番茄抗肿瘤中起着关键作用烟是仙女,不是大人。9.前沿植物科学,2018;https://doi.org/10.3389/fpls.2018.01065.
- 10.
张培军,魏金娟,赵超,张玉峰,李春春,刘ss, Dickee M,于XP, Turlingsf TCJ。由粉虱通过诱导植物挥发物混合的空气寄主-植物操纵。美国国家科学研究院2019。https://doi.org/10.1073/pnas.1818599116.
- 11.
Wt VDV, Levesque CS, Perring TM, Walling LL。银叶粉虱取食对南瓜基因表达的影响。植物学报,2000;12:1409-23。
- 12.
Puthoff DP, Holzer FM, Perring TM, Walling LL。番茄发病相关蛋白基因表达对蒸发试虫和番茄枯萎病的反应烟B型饲料。化学学报。2010;36:1271-85。
- 13.
李娟,朱林,胡俊杰,梁松,daniel H,等。转录组分析揭示了棉花对韧皮部食性昆虫侵害的全面抗虫响应机制烟(粉虱)。中国生物技术学报,2016;14(2):366 - 366。
- 14.
易卜拉欣M, Yasmeen S, Zaman G, Li B, al - qurainy F, Athar HUR,等。蛋白谱分析陆地棉,(锦葵属:锦葵科)被棉粉虱侵袭的叶子烟,(同翅目:蝗科)。应用昆虫动物园。2016;51:1-9。
- 15.
彼得森AC,拉塞尔JD,贝利DJ,韦斯特法尔MS,库恩JJ。用于高分辨率和高质量精度定量、靶向蛋白质组学的平行反应监测。Mol Cell Proteomics, 2012; 11:1475-88。
- 16.
王志祥,尚鹏,李庆国,王丽丽,湛巴YZ,张宏,张波,吴彩霞。基于itraq的蛋白质组学分析揭示了影响猪肌肉生长和脂质沉积的关键蛋白质。科学通报2017;7:46717。
- 17.
曾伟,孙智,蔡智,陈辉,赖智,杨松,等。大豆抗病性的iTRAQ-MRM蛋白质组学分析Lamprosema指示.BMC基因组学,2017;18:444。
- 18.
陈启忠,郭文伟,冯丽珍,叶晓珍,谢文峰,黄小鹏,等。感染桉叶的转录组和蛋白质组分析Calonectria pseudoreteaudii.中国生物医学工程学报,2015;
- 19.
苏勇,徐林,王震,彭强,杨勇,陈勇,等。比较蛋白质组学揭示了中心代谢变化与抗性有关Sporisorium scitamineum在甘蔗。BMC Genomics. 2016;17:800。
- 20.
魏震,胡伟,林青,程旭,童明,朱林,等。了解水稻对褐飞虱的抗性(摘要研究选择性):蛋白质组学方法。蛋白质组学。2009;9:2798 - 808。
- 21.
马菲梅,Mithöfer A, Boland W.基因表达前:植物-昆虫相互作用的早期事件。植物科学进展,2007;
- 22.
War AR, Paulraj MG, Ahmad T, Buhroo AA, Hussain B, Ignacimuthu S,等。植物对昆虫食草动物的防御机制。植物学报。2012;7:1306-20。
- 23.
Leterrier M, Corpas FJ, Barroso JB, Sandalio LM, del Río LA。环境胁迫条件下过氧化物酶体单脱氢抗坏血酸还原酶基因组克隆特征及功能分析。植物科学学报。2005;38(2):344 - 344。
- 24.
Foyer CH, Noctor G.抗坏血酸和谷胱甘肽:氧化还原中枢的心脏。植物物理学报,2011;
- 25.
朴淑娟,黄艳,阿尤碧。高粱对青虫韧皮部取食反应基因表达谱的cDNA减法和芯片分析。足底。2006;223:932-47。
- 26.
吴晓明,王晓明,王晓明。植物防御诱导的转录组学和功能基因组学研究。中国科学(d辑),2006;
- 27.
Curien G, Giustini C, Montillet JL, Mas-Y-Mas S, Cobessi D, Ferrer JL,等。叶绿体膜相关的ceQORH假定醌氧化还原酶减少长链,应激相关的氧化脂质。植物化学。2016;122:45-55。
- 28.
可汗AA,奎格利JG。细胞内血红素水平的控制:血红素转运蛋白和血红素加氧酶。生物化学学报。2011;1813:668-82。
- 29.
李海杰,望月N,增田T, Buckhout TJ。在拟南芥中,破坏血红素结合蛋白5 (AtHBP5)与血红素加氧酶1 (HY1)的双分子结合会导致氧化应激。中国科学(d辑),2012;
- 30.
氧化应激,抗氧化剂和应激耐受性。植物科学进展,2002;7:405-10。
- 31.
潘旭,朱斌,朱宏,陈勇,田宏,罗勇,等。番茄青熟突变体iTRAQ蛋白谱分析揭示了果实成熟关键的新方面。《蛋白质组学杂志》2014;13:1979。
- 32.
Pulido P, Llamas E, rodrezconcepcion M. Hsp70伴侣和Clp蛋白酶质体系统都是对抗氧化应激的保护所必需的。植物信号学报。2017;12:e1290039。
- 33.
吴旭东,杨晨,赵蓉。拟南芥叶绿体定位分子伴侣HSP90.5的共抑制对植物发育和叶绿体生物发生的影响。BMC Res Notes. 2014;7:643。
- 34.
Jungkunz I, Link K, Vogel F, Voll LM, Sonnewald S, Sonnewald U. athsp70 -15缺失拟南芥植物的特征是生长减少,构成性细胞质蛋白反应和对TuMV抗性增强。植物J. 2011; 66:983-95。
- 35.
钱德拉谢卡,李志强,李志强,等。拟南芥PR-1、PR-2、PR-3和PR-12样基因的表达模式研究链格孢属brassicae,接种。生物技术。2018;8:230。
- 36.
辛哈M,辛格RP, Kushwaha GS,伊克巴尔N,辛格A, Kaushik S,等。植物致病相关蛋白家族变应原研究进展。科学通报2014;2014:543195。
- 37.
林长青,李世生。拟南芥脱落酸受体在抗病中的重要作用。中国生物医学工程学报,2015;
- 38.
许sm,卢克,金HG,全宝文,裴凯,胡兴华,等。拟南芥联膜蛋白AnnAt1和AnnAt4相互作用,调控干旱和盐胁迫反应。植物生理学报,2010;
- 39.
廖春,郑艳,郭艳。拟南芥MYB30转录因子通过annexin介导的胞浆钙信号通路调控氧化应激和热应激反应。新植物,2017;216:163。
- 40.
邱勇,席杰,杜丽,普瓦雅BW。钙网蛋白在植物免疫中的作用。植物学报。2012;7:907-10。
- 41.
Kim JH, Nguyen NH, Nguyen NT, Hong SW, Lee H.三种钙网蛋白CRT1, CRT2和CRT3的缺失导致拟南芥对水分胁迫的敏感性增强。植物细胞,2013;32:1843-53。
- 42.
维滕贝格G,莱维坦A,克莱因T,丹古尔I,克伦N,达农A拟南芥叶绿体蛋白二硫异构酶6导致光抑制水平降低,在强光下D1合成增加。植物学报(英文版);2014;
- 43.
彭荣荣,邱娟,田玉生,高洁,韩辉,付晓霞,等。二硫异构酶样蛋白AtPdil1-2是一种很好的三氯酚植物解毒候选蛋白。科学代表2017;7:40130。
- 44.
卢dp, Christopher DA。内质网应激激活蛋白二硫异构酶基因亚群的表达,AtbZIP60调节内质网应激的反应拟南芥.Mol Genet Genomics, 2008; 280:199-210。
- 45.
巴沙E, O 'Neill H, Vierling E.小热休克蛋白和α-结晶蛋白:具有柔性功能的动态蛋白。生物化学学报,2012;37:106-17。
- 46.
Mcloughlin F, Basha E, Fowler ME, Kim M, Bordowitz J, Katiyar-Agarwal S,等。I类和II类小热休克蛋白在热应激下保护蛋白质翻译因子。植物物理学报。2016;172:16.00536。
- 47.
Merret R, Carpenier MC, Favory JJ, Picart C, Descombin J, Bousquetantonelli C,等。热休克蛋白HSP101影响核糖体蛋白mrna的释放,以促进热休克后的恢复。植物物理学报。2017;174:1216-25。
- 48.
华德士,李志强,李志强,等。核平衡与蛋白平衡的耦合作用:Hsp70蛋白在mRNA代谢中的作用。生物化学学报,2015;40:552-9。
- 49.
脂质信号。植物学报,2004;7:329-36。
- 50.
杜丽娟,王丽娟,王丽娟。茉莉酸的生物合成拟南芥需要过氧化物酶体β -氧化酶-通过PEX6和AIM1的性质进一步证明。植物化学。2007;68:1642-50。
- 51.
江崎勇,齐藤。脂质在植物胁迫响应中的信号分子和缓解作用。植物学报2014;49:584 - 96。
- 52.
赵J, Devaiah SP,王C,李米,Welti R,王x拟南芥磷脂酶Dbeta1调节细菌和真菌病原体的防御反应。新植物,2013;199:228-40。
- 53.
吴晓明,刘志强,刘志强,Röhrig H,杨晓明。植物PLDα1介导的磷酸结合蛋白PLDrp1的研究进展。植物学报2017;92:276-90。
- 54.
王锐,沈伟,刘玲,姜玲,刘勇,苏楠,等。来自发育中的水稻种子的一种新的脂氧合酶基因赋予了双重位置特异性,并对伤害和昆虫攻击做出反应。植物化学学报,2008;
- 55.
Christensen SA, Nemchenko A, Borrego E, Murray I, Sobhy IS, bo萨克L,等。玉米脂氧合酶ZmLOX10介导绿叶挥发物、茉莉酸盐和食草动物诱导的植物挥发物的产生,以防御昆虫的攻击。植物J. 2013;
- 56.
罗斯维克,李志强,朱丽华,等。大麦脂氧合酶LOX2.2的过表达和下调影响茉莉酸调控基因和蚜虫繁殖力。中国生物化学杂志,2017;
- 57.
Mochizuki S, Sugimoto K, Koeduka T, Matsui K.拟南芥脂氧合酶2对绿叶挥发物和五碳挥发物的形成至关重要。FEBS Lett. 2016; 590:1017-27。
- 58.
Scala A, Allmann S, Mirabella R, Haring MA, Schuurink RC。绿叶挥发物:植物对抗食草动物和病原体的多功能武器。中国生物医学杂志,2013;
- 59.
王志强,王志强,王志强,等。绿叶挥发物的生物合成、生物功能及其在生物技术中的应用。中国生物工程学报,2015;13(4):366 - 366。
- 60.
Prasad A, Sedlářová M, Kale RS, Pospíšil P.脂氧合酶在单线态氧生成中的反应:在体内成像拟南芥.科学通报2017;7:9831。
- 61.
周松,娄玉玲,覃伟。植物初级代谢对昆虫食草性的响应。植物科学进展。2015;
- 62.
罗查AG, Mehlmer N, Stael S, Mair A, Parvin N, Chigri F,等。拟南芥转酮醇酶Ser428位点的磷酸化为叶绿体碳代谢的代谢控制提供了一个潜在的范式。生物化学学报,2014;
- 63.
Bilgin DD, Zavala JA, Zhu J, Clough SJ, Ort DR, Delucia EH。生物胁迫会下调光合作用基因。植物细胞环境。2010;33:1597-613。
- 64.
王志强,王志强,王志强,等。野生烟草中盲蝽唾液分泌物对光合作用的诱导作用烟草减弱.新植物,2011;191:528-35。
- 65.
Botha AM, Lacockvan L, Niekerk C, Matsioloko MT, Preez FB, Loots S,等。光合作用转录调节在吗小麦l .简历。' TugelaDN '是耐受的一个促成因素Diuraphis noxia(同翅目:蚜科)。植物细胞学报2006;25:41-54。
- 66.
张晓东,刘志刚,张志刚,张志刚,等。耐药大麦的基因表达谱Diuraphis noxia(半翅目:蚜虫科)取食。牛昆虫学报2009;99:163-73。
- 67.
Torsten W, Furch ACU, Zimmermann先生。以韧皮部为食的昆虫如何面对韧皮部定位防御的挑战。中国植物科学,2013;4:336。
- 68.
Anstead JA, Froelich DR, knobluch M, Thompson GA。拟南芥p蛋白长丝的形成同时需要AtSEOR1和AtSEOR2。中国生物医学工程学报,2012;
- 69.
韧皮部蛋白在植物-病原菌相互作用中的作用2017.
- 70.
Ouibrahim L, Mazier M, Estevan J, Pagny G, Decroocq V, Desbiez C,等。拟南芥抗西瓜花叶病毒RWM1基因的克隆为天然病毒抗性基因的新功能指明了方向。植物学报(英文版);
致谢
不适用。
资金
本工作得到国家自然科学基金项目(No. 31101092)、中国博士后科学基金项目(2012 T50520)、江苏省科技支撑计划项目(BE2017347)、江苏省现代农业(蔬菜)产业体系创新团队(SXGC[2017]303)、设施果蔬重大病虫害生态防治技术开发与应用(CX[15]1041)资助。创始人在本研究或相关数据的设计、分析和解释中没有扮演任何角色。
作者信息
从属关系
贡献
XX、FC和HD构思并设计了该研究。JX, YH和HB进行实验。SR和XY进行qRT-PCR分析。XX和HD进行数据分析。HD和XX共同撰写稿件。FC监督并补充了写作。所有作者均已阅读并同意此稿件。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
附加文件
附加文件1:
图S1。光合作用KEGG途径(ko00195)。PsBo,A0A1U8FJN4 / A0A1U8FZN5;PsBp,A0A1U8EAE0;PsB27,A0A1U8FGM0;PsaD,A0A1U8GVK4;善待动物组织,A0A1U8FRH4,PetH,A0A1U8FRH4;γ,A0A1U8FUM0,b,A0A1U8GUM8 (TIF 4719 kb)
附加文件2:
图S2。光合生物固碳的KEGG途径(ko00710)。4.1.2.13,A0A1U8FHQ4;2.2.1.1,O78327 / A0A1U8FNB3;3.1.3.11,A0A1U8GDS4;2.7.2.3,A0A1U8HDS6;3.1.3.37,A0A1U8GZ15;1.1.1.40,A0A1U8E7W8 (TIF 1471 kb)
附加文件3:
图S3。受控容器。50烟粉虱收集成虫后,将其释放到第5片叶子上,并用一个小口袋将其闭合。(TIF 7155 kb)
附加文件4:
表S1。总蛋白鉴定信息统计(XLSX 9 kb)
附加文件5:
表S2。注释蛋白的基因本体(GO)分析(XLSX 11 kb)
附加文件6:
表S3。氧化石墨烯生物过程富集DAPs (xlsx9 kb)
附加文件7:
表S4。DAPs的GO分子功能富集(XLSX 114 kb)
附加文件8:
表S5。DAPs的GO细胞成分富集(XLSX 46 kb)
附加文件9:
表S6。RB-RC通路富集(XLSX 17 kb)
附加文件10:
表S7。不同分析方法获得的dap数量(xlsx23 kb)
附加文件11:
表S8。样品与iTRAQ标签之间的相似性(XLSX 12 kb)
附加文件12:
表S9。qRT-PCR引物(XLSX 12 kb)
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
吴,X,严,J,吴,Y。et al。iTRAQ-PRM的蛋白质组学分析为辣椒的抗性机制提供了综合的见解烟(Gennadius)。BMC植物生物学19日,270(2019)。https://doi.org/10.1186/s12870-019-1849-0
收到了:
接受:
发表:
关键字
- 胡椒
- 烟
- 电阻
- 蛋白质组
- iTRAQ
- 人口、难民和移民事务局