摘要
背景
番茄的发育和成熟(茄属植物lycopersicum果实是与工业园艺有关的作物生物学研究的重要过程。番茄果实的多种用途导致其在从早期成熟到红熟的不同发育阶段收获,传统上由大小、重量、颜色和内部成分等参数表示,根据定义的视觉“分级”方案。然而,视觉分级方案是主观的,因此对番茄果实发育和成熟的客观分类是“高科技”园艺所需要的。研究了整个番茄果实的发育和成熟过程。赚钱者),生物光谱学方法使用紧凑便携式ATR-FTIR光谱与化学计量学耦合。
结果
从番茄果实表皮的角质层-细胞壁复合物中获得了番茄果实发育和成熟过程中独特的光谱谱线。角质层的各种成分,包括角质、蜡和酚类化合物等,以及来自底层细胞壁的纤维素、果胶和木质素类化合物等。表皮表面结构包括角质层和细胞壁在未成熟绿色到成熟绿色的发育过程中发生了显著变化,在成熟过程中也发生了显著变化。光谱指纹区(1800-900厘米)的变化−1)均能较准确地识别9个发育阶段和6个成熟阶段。
结论
因此,非破坏性光谱方法可能特别适用于研究在发育和成熟过程中发生在与番茄等级相关的水果表皮中的体内生化变化,用于自主食品生产/供应链应用。
背景
全球粮食安全依赖于有效的作物生产、分配和利用的结合[1].作物生产和分配都正变得越来越具有挑战性,而人口增长和气候变化正导致全球粮食短缺和营养不良[2].传统耕作方式一直难以提高全球主要作物的产量[3.].由于缺乏可用于粮食生产的土地,预计作物产量的大部分增长将通过提高产量、集约化种植和减少气候、虫害、病原体造成的作物损失以及下游消费废物造成的供应链浪费来实现[4,5].因此,最大限度地提高作物产量和减少浪费的创新解决方案对维护粮食安全至关重要。虽然正在开发许多帮助解决这一问题的方法,但基于技术的农业解决方案经常被种植的大量作物物种(和栽培品种)以及作物生产系统中植物与环境相互作用的复杂性所困扰。因此,迫切需要开发新的方法来提高我们对作物生物学的理解,并开发应用农具,以最大限度地提高产量,减少损失,并改善收获前和收获后的生产和利用。
番茄(茄属植物lycopersicum)是全球最重要的作物之一,每年价值1246亿美元[6]在肉质水果市场占据最大份额[6,7].由于其生成时间短,遗传、生化和生理特性研究充分,被广泛用作植物模型[8].番茄果实富含有益的植物化学物质,质地娇嫩,发育和成熟迅速,在其发育的各个阶段都可用作整果,或用于各种加工用途,包括罐头食品、酱料、酱汁、果汁等。[9].每一种产品都要求果实处于不同的发育或成熟阶段,根据开花后的天数(dpa),从早期未成熟到红熟不等[9].番茄果实的发育和成熟是园艺工业的重要参数,影响果实质量和保质期[7,10].因此,准确和无损地监测番茄果实发育和成熟过程中发生的变化的能力是植物生物学家和园艺学家最感兴趣的。
植物表皮层和相关的表面结构提供了维持植物完整性、调节果实生长和确定保质期所必需的植物-环境界面[10,11].番茄果实表皮由一个完整的非均质多层基质组成,包括角质层(角质层固有层和角质层)、细胞壁和表皮细胞[12].这些层在果实发育和成熟过程中发生广泛的变化。然而,迄今为止,所涉及的分子机制以及这些变化如何影响形态、质地、病原体易感性和保质期等特征尚未完全阐明[12].此外,由于角质层和细胞壁的顽固性,很难分别研究这些组织[13].因此,研究植物表面结构的新方法对于确定它们如何促进园艺产品的健康生长和发育或异常情况的出现至关重要。此外,这些方法需要转化为实际的基于实地的应用,以便与基础植物生物学研究和应用作物科学相关。虽然有一些传统上在实验室使用的分析工具可能适用于野外园艺应用[14,15,16],可用于非破坏性研究植物表面结构的工具有限。
基于光-物质相互作用的光学传感器已被认为是基于光谱特征的植物健康无损监测和疾病检测的有效工具[14,17].特别是中红外(MIR)振动光谱与化学计量学相结合已被广泛用作一种生物分析工具,可对大多数类型的样品进行无损分析[18].振动光谱学,也被称为表面技术,通常探测样品的表面层到微米深度,由于数据分析的进步,也可以用于分析复杂的异质生物样品,称为生物光谱学。独特的生物材料光谱在4000 ~ 400厘米之间−1(2.5-25 μm波长),由红外辐射与样品之间的光-物质相互作用产生,包含对生物应用有用的生物化学特定变量[19].许多生物材料优先吸收“指纹区”(1800-900厘米)−1),因此该区域通常是选择进行分析的光谱范围[20.].光谱数据分析可分为探索性分析和诊断性分析[21].探索性数据分析包括数据可视化、模式识别和生物标志物提取[21,22].用于这些目的的分析模型的例子包括无监督学习,如主成分分析(PCA),和监督方法,如线性判别分析(LDA) [21].诊断数据分析旨在评估分类器在自主决策中的性能。常用的分类器包括LDA、支持向量机(SVM)、naïve bayes和人工神经网络(ANN),每种分类器都表现出不同程度的模型复杂性。MIR光谱学与专门的数据分析一起应用于解决重要的园艺问题,包括植物健康监测、植物-环境相互作用、疾病检测、表型和分类学关系[17,23,24].然而,基于生物光谱的作物科学生物分析方法的发展,使植物能够在实验室和野外环境中进行研究,对于其作为园艺工具的广泛采用是至关重要的[18].
目前,可以测量完整样品的便携式拉曼光谱仪比具有这种能力的红外光谱仪更容易获得。因此,迄今为止,基于生物光谱的生物分析方法在完整作物分析方面的进展主要局限于拉曼光谱的使用,尽管该技术最近才用于全样品分析[25,26,27,28].MIR范围之外的其他几种技术,如近红外(NIR)、紫外(UV)和可见光,以及高光谱分析已用于评估番茄的质量参数[29,30.,31].然而,这些研究中很少对发育和成熟过程中在体内发生的变化提供详细的生化洞察,传统上仅关注分类性能或传统质量参数与光谱数据之间的相关性[32].此外,潜在的小测量区域,以及NIR、UV、可见光和拉曼仪器的更高能量,在非常小的区域内增加了光穿透样品的深度,从而可能难以获得可靠的生物信息。相比之下,MIR光谱学提供的采样模式具有非常明确的测量区域和光穿透深度[19],当与被研究植物组织的已知化学成分结合时,便可进行生化研究[33,34,35,36,37].衰减全反射傅里叶变换红外光谱(ATR-FTIR)是一种具有非常明确的光穿透深度的方法,可以在更大的区域进行宏观测量[19].在其他领域,ATR-FTIR光谱已被证明在提供生物样品的生化洞察,以及与分类模型结合提供强大的鉴别能力方面非常出色[20.,34].这表明需要评估在作物科学中使用拉曼互补方法,如反射光谱,包括ATR-FTIR光谱。为了提高基于光谱的方法提供生化信息和分类性能的能力,必须评估旨在开发复杂系统所需的多传感器平台的互补方法。
番茄作为研究果实发育和成熟过程中角质层、细胞壁和表皮的模型系统被广泛应用。因此,在本研究中,我们应用了一种结合多元化学计量学的新方法来提取生物标志物和评估分类性能。生物标志物提取作为两层方法的一部分,旨在研究发育和成熟对番茄果实光谱特征的影响。首先,采用PCA-LDA形式进行探索性多变量分析,提取与番茄果实4 ~ 36 dpa 9个发育阶段差异相关的尝试性波数生物标志物,随后提取与番茄青熟到红熟6个不同成熟阶段差异相关的生物标志物。34-55 dpa)。生物化学实体鉴定为生物标志物进行探索。第二层包括9个发育阶段和6个成熟阶段的SVM分类,以确定基于MIR指纹图谱的番茄果实成熟度和成熟阶段自主分级的潜力。
结果
番茄果实发育的光谱分析
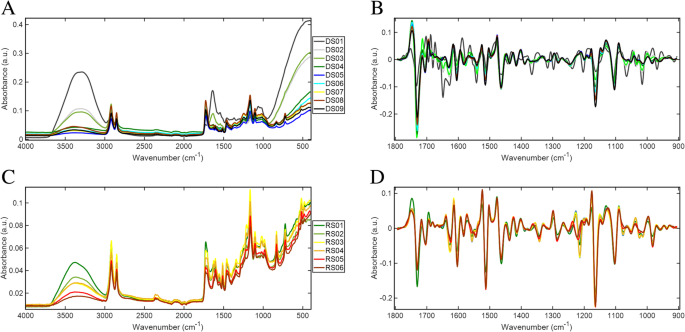
番茄果实的发育和成熟分为两个不同的过程,如图所示。1.从包括成熟在内的每个发育时间点获得光谱。数字2显示了用于开发的类平均原始和预处理指纹光谱(图。2a和b)和成熟(图。2C, d,过程。数字2清楚地表明,最尖锐的吸收峰是明显的指纹区域之间1800和900厘米−1.这个区域保存了与样品有关的大部分生化信息,因此是调查的重点。
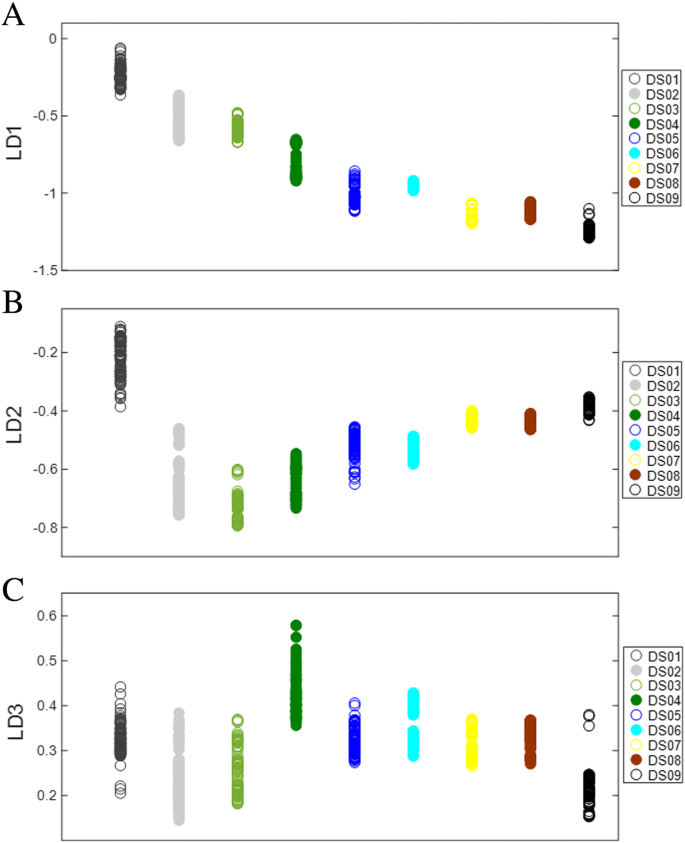
基于PCA因子的线性判别分析对番茄果实发育进行了有效的判别。数字3.根据PCA因子的LDA,分别得到三个线性判别量LD1、LD2和LD3。在属于九个不同发展时期的光谱簇的三个ld上观察到变量分离。判别函数1 (LD1)在区分发育阶段方面是有效的,尽管没有观察到DS02与DS03、DS05与DS06、DS07与DS08的明显分离(图1)。3.a).这表明这些阶段的光谱特征与其他发育阶段(DS01、DS04和DS09)几乎没有差异。虽然DS02/DS03、DS05/DS06和DS07/DS08形成了不同的集群,没有明显的分离,但这些对彼此非常不同,有效地沿着LD1形成了六个可区分的组(图1)。3.a).相比之下,判别LD2显示了DS02和DS03的明确分离,但没有相邻的DS05/DS06或DS07/DS08(图5)。3.b). DS05与DS06的分离是沿着LD3实现的,而DS07与DS08之间没有可观察到的分离(图3)。3.c).从光谱数据来看,图中完整显示的前三个ld的多元PCA-LDA显示,DS07和DS08的相关性最为密切。3..这可能是由于番茄果实成熟的最后几天发生的变化很小,与成熟绿色阶段之前发生的变化相比。
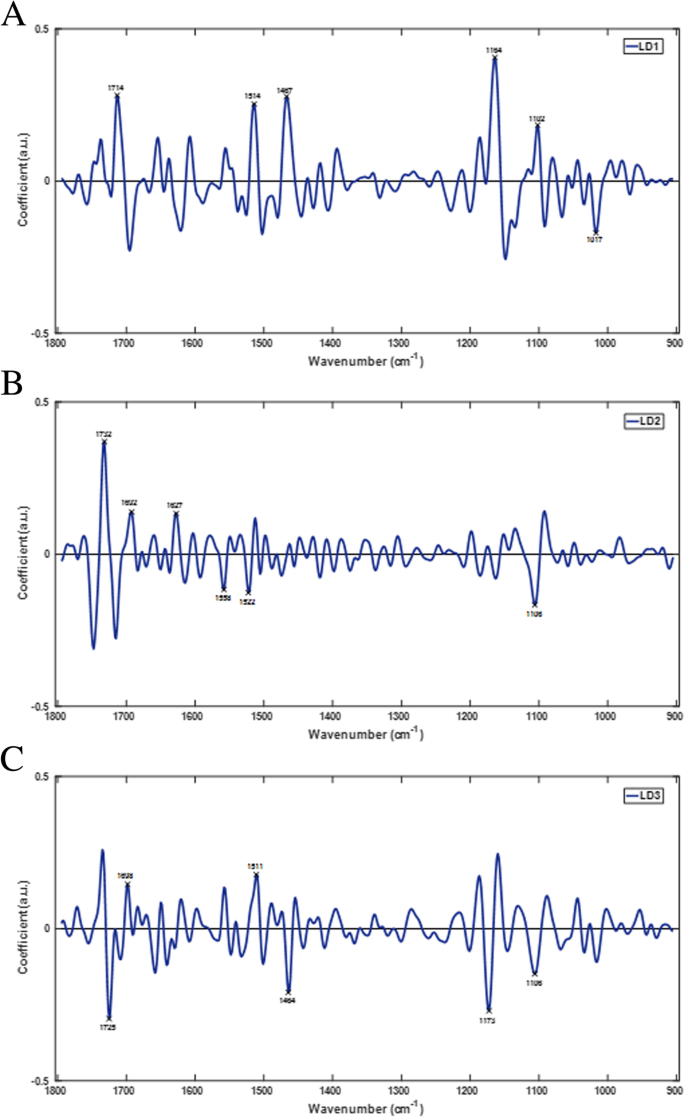
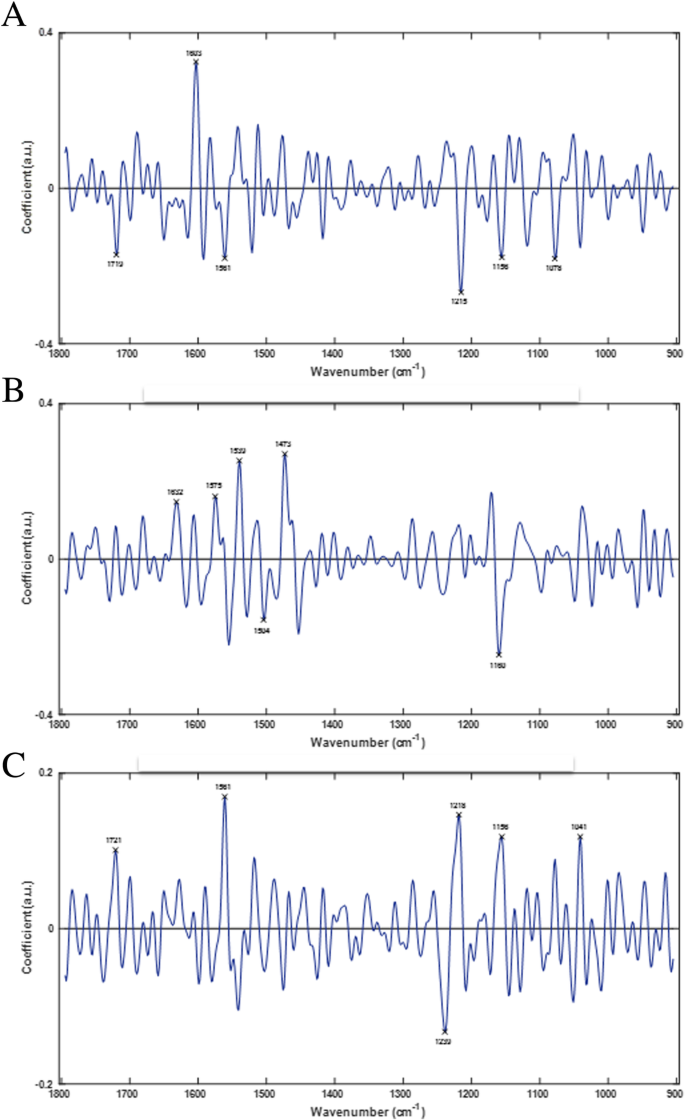
为了进一步探索在三维判别空间中观察到的群体聚类,对三个ld分别提取PCA-LDA负载,以确定与番茄果实发育过程相关的特定光谱变化。本文概述了DS01-DS09在4 - 36 dpa之间番茄果实发育过程中发生的主要生化变化。数字4显示了PCA-LDA负载(LD1-LD3),代表了区分番茄果实发育阶段的主要定性波数。从每个负荷中选取前6个波数生物标志物,定性表征变化最大的生化化合物。通过PCA-LDA负载提取的生物标志物为监测果实发育提供了潜在的生化和分子标记。表格1显示LD1-3的前6个鉴别波数,代表该品种发育过程中的主要生化官能团和相关化合物。在1732-1714、1698-1627、1558-1511、1467-1464、1173-1102和1017 cm的波数区域观察到特定的变化−1.
番茄果实成熟的光谱分析
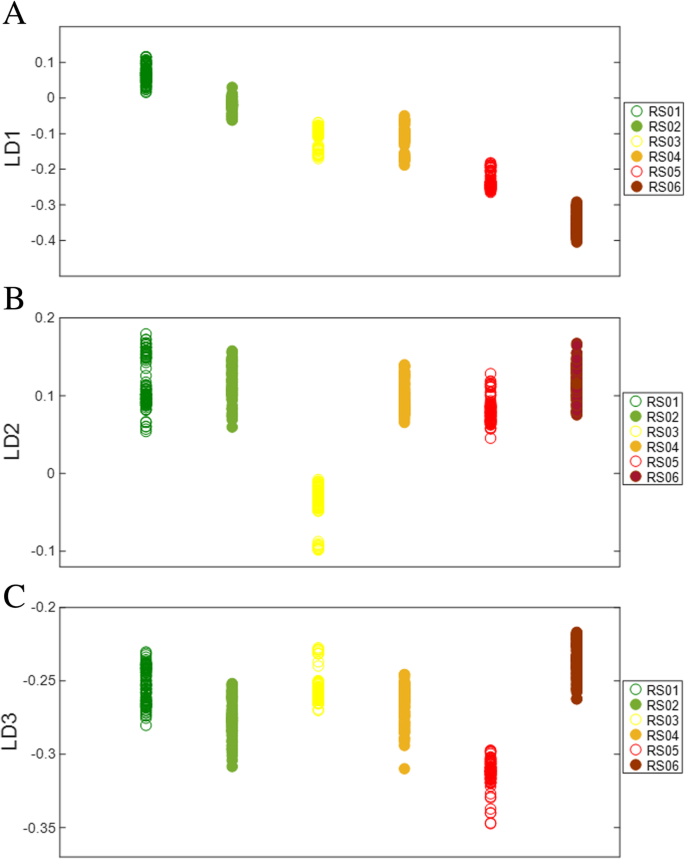
与发育阶段的多变量分析类似,番茄的成熟阶段也可以根据LD1、LD2和LD3进行有效的区分(图2)。5).这些ld在区分六个不同的成熟阶段方面效果各异。最显著的分类分离是在LD1阶段观察到的,六个成熟阶段显示出明显的分离,除了RS03和RS04没有显示出分离,因此在这些组中最相似(图1)。5a).虽然LD1不能区分RS03和RS04,但LD2在区分RS03和RS04以及所有其他成熟阶段方面非常有效(图2)。5b).沿着LD3可以看到可变组聚类,其中RS05与其他组分离最明显(图。5c).与番茄果实发育一样,成熟期沿不同的ld表现出独特的类聚类,表明每个类的光谱特征都是独特的。这提出了一种有趣的可能性,即除了基于这种方法的不同发育阶段外,还可以有针对性地使用不同的ld来识别成熟阶段。
通过PCA-LDA负载提取的成熟光谱生物标志物,鉴定出与发育过程中鉴定出的角质层和细胞壁成分相似的成分(图2)。6);角质、酚类化合物、脂类和蜡类的波数分别为1721、1719、1632、1603、1561、1473、1160和1156厘米−1同时,木质素类化合物、纤维素、果胶和其他多糖的波数为1719、1603、1539、1504、1239、1160、1156、1078和1041 cm−1(表2).此外,还鉴定了与蛋白质相关的几种独特的光谱生物标记物,包括突出的酰胺I、II和III区域。蛋白质是细胞壁的重要组成部分,在较小程度上是植物角质层,这表明这些蛋白质可能是成熟依赖的,基于指纹图谱上看到的多种蛋白质振动。蛋白质振动模式在波数1632、1575、1539、1239和1218 cm处特别可见−1(表2).这些变化可能与果皮软化、果胶和其他天然聚合物在成熟过程中的解聚有关[38从而改变了嵌入在细胞壁角质层复合物中的蛋白质的可及性和丰度。1504 cm处的(C-H)振动−1可能与成熟过程中类胡萝卜素含量的增加有关,特别是番茄红素。成熟特异的生物标记物在1078厘米处−1之前与木葡聚糖有关,也可能与表皮中的木葡聚糖转移酶/内水解酶(XTH)活性有关,后者在番茄的果实软化中起积极作用[39].有趣的是,波数为1041厘米−1与阿拉伯半乳聚糖有关。植物细胞表面的阿拉伯半乳糖糖蛋白与植物生长发育有关,并可能整合成熟过程中发生在细胞壁和角质层的变化[40,41].蛋白质振动的检测,这可能意味着在番茄成熟过程中蛋白质丰度的增加,加强了阿拉伯半乳聚糖作为糖蛋白的一部分的身份,并在成熟过程中提供了木葡聚糖和XTH酶活性之间的联系。
番茄果实发育成熟阶段的自主测定
利用PCA-LDA进行分类对光谱生物标志物的初步分配是令人满意的,但需要支持向量机进行更有效的发育和成熟阶段的分类。基于番茄果实光谱特征的自动分类是一种令人兴奋的可能性。为了测试基于指纹谱的分类性能的可行性,同时应用了PCA-LDA和SVM(附加文件)1:表S1,附加文件2:表S2,附加文件3.:表S3;额外的文件4:图S1和附加文件5:图S2)。而PCA-LDA的分类性能令人满意(附加文件1:表S1),该方法主要用于生物标志物提取。为了提高PCA-LDA的分类性能,应用支持向量机进行分类。虽然支持向量机在纯粹的分类目的上是优越的,但支持向量机是一种非线性方法,因此不提供生化信息。表格3.为基于ATR-FTIR指纹谱的支持向量机发育阶段自主分类结果。在番茄的所有发育等级中都观察到很高的准确性,只有在~ 34-36 dpa之间直接相关的发育后期(DS08和DS09)之间有最小的错误分类,如发育混淆矩阵所示(表2)3.).发展的敏感性和特异性相应较高(附加文件2:表S2和附加文件4:图S1)。这些结果表明,表皮表面的变化足以以极高的灵敏度和特异性,用紧凑的设备无损地确定整个番茄果实的发育阶段。此外,可以区分番茄的发育,在这种情况下,在下一个发育阶段的±4天内。
番茄果实在不同的发育阶段收获,这取决于它们的最终用途,以确保每个发育阶段所期望的独特品质。在4至36dpa (M1-M4)之间收获的番茄至少有4个成熟等级,在成熟时提供不同品质的果实[42,43].目前,园艺业通常依赖于主观的视觉和/或破坏性的成熟度和成熟阶段的番茄分级[44].因此,开发客观、非破坏性的方法来确定果实成熟度和成熟阶段,同时获得有价值的生化信息,将有利于产业发展。在这里,我们提供的证据表明,ATR-FTIR结合化学计量学建模可以对许多不同的发育阶段进行分类,在本例中为9个,无需破坏性测量,但具有高选择性和特异性(表2)3.和附加文件2:表S2)。这些结果超过或至少与目前用于评估水果成熟度和质量参数的其他光谱方法相当[29,30.,32].
六种园艺成熟等级通常根据配色方案进行区分;成熟绿色、碎裂、变绿、粉红色、浅红色、红色[43].光谱数据与化学计量学相结合也能有效地识别番茄的六个不同成熟等级。与发育组一样,六个成熟等级的光谱进行支持向量机分析(附加文件)3.:表S3和附加文件5:图S2)。表格4结果表明,区分六个成熟等级的准确率几乎在99%到100%之间,唯一的例外是相邻的成熟等级“转弯”和“粉红色”之间。
讨论
番茄果实发育的光谱特征
判别分析揭示了光谱组的类依赖聚类,并允许定性生物标志物的提取。ATR-FTIR探测样品的前几微米,这在植物中构成了外表皮层,因此提供了果实发育过程中植物-环境界面生化变化的概述。角质化的细胞壁,形成生物化学上复杂的异质基质,是外表皮的一部分[12],由嵌入在主要聚合物角质层中的各种可溶性蜡组成(~ 40-80%),以及少量的酚类成分(~ 1-5%)[13,45].底层细胞壁主要由纤维素、果胶、各种多糖和蛋白质组成[12].在番茄果实发育过程中,角质层和细胞壁经历了与发育阶段不同的结构和成分变化,包括从细胞分裂到细胞扩张的转变,角质层的生物发生,以及细胞壁厚度的变化[11].因此,在果实发育过程中,细胞壁和角质层对植物表皮表面的相对贡献因快速的细胞分裂(2至35-40 dpa)和随后的细胞扩张而显著变化[46].因此,这些表面层提供了独特的体内分子靶标,用于使用ATR-FTIR光谱区分发育阶段。
指纹光谱(1800-900 cm)多组分分析−1)显示,这些光谱区域的变化与突出的角质层和细胞壁成分(包括其主要成分)密切相关。光谱生物标记物与角质、蜡和酚类化合物密切相关1),并与发育过程中角质层的变化相一致(4-36 dpa) [45,47,48].角质的波数为1732、1725、1714、1698、1692、1467、1464、1173、1164、1106和1102厘米−1.蜡,包括甘油脂类化合物,在1732,1467和1464厘米的波数被鉴定−1.初级酚类化合物在1627、1558、1522、1514和1511厘米的波数上被鉴定出来−1.观察到的其他光谱变化源于细胞壁成分,作为角质化细胞壁结构的一部分。与细胞壁相关的光谱生物标记物鉴定出纤维素、果胶和各种其他碳水化合物部分。纤维素和果胶的波数分别为1725、1714、1106、1102和1017 cm−1分别。其他碳水化合物,包括一些木质素类化合物,在波数1522、1514、1511、1164、1106和1102厘米处与果胶、纤维素和其他部分有重叠−1.这些结果清楚地表明,指纹图谱的多元分析可以提供番茄果实发育过程中角质层和细胞壁发生的生化变化的信息。然而,还需要进一步的工作来破译这些化合物在其红外吸收特性的背景下的确切作用。重要的是,4至36 dpa之间的发展时间框架包含至少四个用作行业标准的园艺等级;成熟度等级M1-M4大致对应DS06-DS09 [42,43,44].因此,这里提出的初步表征和定性分析显示了根据园艺等级区分发育阶段的潜力,例如,通过检测与番茄果实发育相关的多种光谱生物标记物,基于它们的表皮表面特性。然而,还需要进一步的研究来确定不同发育阶段组织的结构-功能关系,以及成熟度分级等园艺应用。
番茄果实成熟的光谱特征
成熟,虽然是番茄果实自然发育的一部分,但由于其独立的基因调控和独特的颜色变化,通常被视为一个独立的发育阶段。基因表达的显著变化和乙烯生物合成的转变导致番茄果实成熟过程中表皮表面的改变,从而影响收获后的品质[46,48,49].因此,番茄果实表皮层的变化在发育阶段和整个成熟期都有显著差异。数字4显示,在成熟过程中,番茄果实表现出独特和共同的光谱特征,与发育过程中观察到的光谱特征不同,这些光谱特征分别对应于六个成熟阶段:成熟绿色、破碎、转向、粉红色、浅红色和红熟(RS01-RS06,见图)。1).
在番茄成熟前后,角质层和细胞壁发生了明显的生物物理和相关的生物化学变化。35-55 dpa [11,50].因此,在表皮层中观察到的光谱变化可能与角质层重排、细胞壁拆卸、类胡萝卜素积累以及遗传和代谢调节的基础变化等事件有关[12,49].因此,这一探索性分析清楚地表明,生物光谱学可以提供丰富的化学信息,有助于了解在发育和成熟过程中发生在表皮层的变化。重要的是,分析完整水果的能力将使健康水果的发育和成熟的基线特征成为可能,提供了使用基线偏差作为异常发育、压力或疾病指标的有趣可能性。对于园艺应用来说,成熟尤其有趣,因为红熟后期是消费者消费的关键阶段,但也是水果越来越容易受到果实开裂和病原体感染等事件的影响的阶段,这些事件与表皮结构和果实完整性直接相关[10,51].
番茄果实发育成熟的常见光谱特征
番茄果实发育和成熟的光谱特征主要与角质层和细胞壁成分有关。果实发育和成熟的鉴别波数包括一般区域:1725-1714、1632-1627、1561-1558、1514-1511和1473-1464厘米−1(表2而且3.).具体来说,这些光谱生物标记物包括1725、1721、1719和1714厘米的波数−1,分别为ν(C=O)酯的强吸光度贡献和角质的ν(C=O··H)酯的中吸光度贡献。波数在1632和1627厘米−1ν(C=C)为中吸光度,ν(C=C)为强吸光度,表明其中含有酚类化合物。酚类化合物在1561和1558 cm处的ν(C-C)吸光度较弱−1而地区包括1514和1511厘米−1与ν(C-C)~(C=C)共轭芳香族酚类化合物有关。在传统的红外光谱中,这些吸光度的名称强、中、弱分别指光谱中彼此相对的最高、中间和最小峰值振幅[52];这些反应了官能团的IR活性和它们在样品中的丰度。在完整的番茄果实中发现的共同发育和成熟光谱生物标志物也在未成熟的绿色和红色成熟番茄果实的孤立角质层中观察到[33].1473、1467和1464厘米处有相似之处−1解释为δ(CH2)成熟及未成熟水果角质层中角质及蜡的修剪[33,53].角质是角质层中最外层和最丰富的化合物之一,因此在完整的果实和孤立的角质层中观察到的光谱变化与角质层化合物,特别是角质在发育和成熟过程中的变化是一致的。ATR-FTIR光谱分析作为一种表面技术,识别了果实表层在~ 4-55 dpa的整个发育过程中常见的生物标志物,这些生物标志物主要与角质层的变化有关。然而,指纹图谱中的新区域可能为研究果实发育和成熟过程中许多角质层功能的确切作用提供了新的见解。10].
确定番茄果实的发育和成熟阶段
自主和无损地区分番茄果实9个不同发育阶段和6个常见园艺成熟等级的能力是一项重要的进步,使专业种植者或工业食品生产/供应链能够更有效地对水果质量进行分级。基于传感器的园艺系统将依赖于来自各种传感器的多重输入。因此,探索和使用不同的传感器并将其视为互补而不是竞争是很重要的。各种研究表明,番茄成熟度分级和质量参数评估可以使用光谱来实现,这些光谱采用不同波长和紫外、可见光和红外线之间的电磁光谱。为了促进MIR传感器的扩展,研究表明,目前的精度水平是使用紧凑型光谱仪实现的,与园艺环境中可用于测试的样本数量相比,数据集相对较小,在园艺环境中,通常分类精度随着数据集的增加而增加。虽然需要外部验证来巩固这些结果,但这项研究清楚地表明了ATR-FTIR的潜力,特别是ATR-FTIR用于包括番茄在内的各种园艺产品的自动分类。
结论
生物光谱学是一种强大的分析工具和潜在的传感器技术,用于连接基础植物生物学和应用作物科学,作为开发精密园艺系统的一部分。表面技术的发展,包括适用于均质和非均质物质的MIR光谱学,为完整组织的分析和体内无损测量打开了大门。然而,迄今为止,MIR光谱学用于研究完整植物的程度有限,对可随时改装用于园艺应用的便携式设备的评估也是如此[25].ATR-FTIR采样模式,探测番茄果实表皮表层的主要生化化合物群,如角质层的角质、蜡和酚组分,以及纤维素、果胶、碳水化合物和木质素类化合物作为主要的细胞壁成分(表1而且2),因此是研究植物表皮的理想选择,因为它与园艺参数有关。基于生物光谱学的多化合物分析,在体内植物器官内,提供了一种替代方法,以研究发育过程中或对工业加工的响应中角质层和细胞壁结构的传统方法[33,36].在这方面,MIR生物光谱学将被证明有助于破译番茄果实发育和成熟过程中表皮结构变化的分子细节。这是至关重要的,因为角质层形成背后的详细机制存在争议,而且对整个番茄果实角质层结构与采后特征之间的关系知之甚少[10,13].
ATR-FTIR光谱作为一种体内分析方法,如本文对细腻的番茄果实所演示的,可以测量整个番茄果实表皮结构中的大群化合物。探索性判别分析(PCA-LDA)将这些化合物组与番茄果实发育和成熟的特定生物标志物相关联,识别出反映番茄果实发育和成熟过程中发生的明显变化的共同和独特的光谱特征。指纹图谱反映的各种化合物可初步归属于包括角质层和细胞壁在内的表皮表层成分。作为完整角质化细胞壁的一部分,存在包括角质、蜡、酚类物质、纤维素、果胶和木质素在内的化合物,这些化合物显示出重大变化,尽管由于我们对果实发育过程中细胞壁角质层复合物如何变化的知识有限,对光谱生物标志物的定性解释仍然具有挑战性[11,13].然而,表皮层在果实的品质中起着重要作用,在番茄果实发育的各个阶段,表皮层在决定园艺等级方面也起着重要作用[10].使用支持向量机分类模型对已定义的番茄果实组进行自动分级,该模型表明发育和成熟至少可以在15个独立阶段进行区分(9个发育阶段和6个成熟阶段)。重要的是,所有分析都是完全无损的,并使用紧凑的便携式ATR-FTIR光谱仪进行,这表明了基于现场分析的潜力。
将这种方法从基于实验室的分析方法转变为用于常规监测的应用传感器技术所需的大多数元素已经可用,包括便携式光谱仪、快速数据分析工具,以及对大多数作物植物所需的最少或不需要样品制备,使其成为现实的可能性。为了实现这一潜力,需要将生物光谱学应用于更多的模型植物系统,同时评估新的便携式设备,类似于最近为拉曼光谱学开发的设备[25].有了这些进步,使用光学传感器(如MIR光谱)进行快速分析将进一步实现对健康水果发育的自动表征,并使与损伤或疾病相关的异常能够可靠地识别。此外,生物光谱学在植物和作物科学中的进一步发展将有助于更好地了解植物表层的生物学和生物化学,以及它们如何影响植物器官(如果实)的性状;因此,有助于分子植物生物学和工业园艺更好的作物生产。
方法
植物生长条件
单独的番茄植株,茄属植物lycopersicum简历。赚钱的种子,从商业种子(汤普森和摩根种子,英国)在10升花盆,含有Levington的M3生长介质(Levington园艺有限公司,伊普斯维奇,英国)到开花(约。60天)。在加热温室(25±5℃)中,昼夜循环18/ 6h,最低光照500 μmol m−2年代−1在植物冠层,从600 W金属卤化物灯)和50±10%的湿度。Tomorite肥料(Levington Horticulture Ltd., Ipswich, UK)根据制造商的说明从花开始每隔一次浇水。发育和成熟阶段的标准是dpa,其中最初的等级以4dpa测量,随后的等级分别以发育和成熟系列的4天生长为间隔。番茄果实选择过程中使用的参数被记录为与图中所示相对应的发育和成熟集。1并在附加文件中找到6:表S4和附加文件7:表S5。
ATR-FTIR光谱学
番茄果实从植物中采摘,用去离子水清洗,干燥,并立即使用ATR-FTIR光谱测量。研究了番茄果实9个发育阶段(DS01-DS09)和6个成熟阶段(RS01-RS06)的振动谱。将整个番茄果实放在样品台上进行分析,施加压力不超过0.1 kg,以确保样品有足够的接触。从每个水果的圆周上测量五个点;在每个接触点取两个光谱,每个水果共测量10次。分析了10个果实,每个发育和成熟阶段共100个光谱,发育数据集共900个光谱(9类),成熟数据集共600个光谱(6类)。光谱采集使用一个紧凑的便携式Bruker Alpha-P红外光谱仪,带有铂ATR附件(Bruker Optics, Coventry, UK),范围为4000-400 cm−1光谱分辨率为8厘米−1, 32个共加法和7 kHz的镜像速度。背景光谱是在样品测量之前采集的,以考虑周围的大气条件。金刚石ATR晶体定义了1毫米的空间分辨率(采样面积)2测量之间使用异丙醇ATR清洁湿巾(布鲁克光学,考文垂,英国)进行清洁。
计算分析
原始光谱截断到光谱指纹区域(1800-900厘米)−1)使用Savitzky-Golay滤波和二阶微分进行预处理,然后进行向量归一化,以解释样品厚度和ATR金刚石接触压力的差异。采用PCA-LDA分析进行探索性数据分析和生物标志物提取。PCA-LDA分析使用开源的IRootlab工具箱(https://github.com/trevisanj/irootlab)专门用于分析红外光谱[54],结合Matlab 2016a (The Maths Works, MA, USA)。主成分分析将数据集减少到解释光谱方差的因素;使用IRootlab优化PCA,以确保在前10个pc中包含主数据集方差。前10台pc分别占开发数据集和成熟数据集方差的97%和95%(附加文件8:表S6)。这些作为LDA的输入变量,形成复合技术PCA-LDA [21].通过沿三个主要线性判别因子(LD1、LD2和LD3)的聚类分离进行探索性分析,以确定是否可以观察到属于发育和成熟阶段的光谱组的特定聚类。PCA-LDA评分交叉验证10 k倍。对于主要光谱变化的定性表征,PCA-LDA加载与峰值拾取算法相结合(20厘米−1使用最小分离)将前六种最显著的振动模式改变及其相应的化学分配制成表格,这些化学分配被用作发育和成熟的初步生物标志物[22].
使用PLS工具箱版本7.9 (Eigenvector Research, Inc., WA, USA)对DS01-DS09阶段和RS01-RS06阶段的分类精度进行支持向量机测试;结合Matlab 2016a。利用支持向量机分类器对葡萄的发育和成熟阶段进行分类。SVM分类器使用90%的数据进行训练,10%的数据进行内部验证。与PCA-LDA相同的数据,即预处理过的指纹光谱,被用作支持向量机的输入。该模型的开发是为了提高PCA-LDA的分类性能(附加文件1:表S1,附加文件2:表S2,附加文件3.:表S3,附加文件4:图S1和附加文件5:图S2)。SVM使用10 k褶交叉验证。
数据和材料的可用性
本研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得.
缩写
- ATR:
-
衰减全反射
- DS:
-
发展阶段
- 红外光谱:
-
傅里叶变换红外
- LDA:
-
线性判别分析
- 米尔:
-
中红外
- 主成分分析:
-
主成分分析
- 拉尔夫-舒马赫:
-
成熟阶段
- 支持向量机:
-
支持向量机
参考文献
- 1.
伯纳斯-李M,肯尼利C,沃森R,休伊特CN。目前的全球粮食产量足以满足2050年人类的营养需求,前提是有彻底的社会适应。电子科学杂志,2018。https://doi.org/10.1525/elementa.310.
- 2.
IFPRI发展倡议。2017年全球营养报告:滋养可持续发展目标。布里斯托尔:发展倡议贫困研究;2017.
- 3.
Ray DK, Mueller ND, West PC, Foley JA。产量趋势不足以到2050年使全球作物产量翻一番。PLoS One, 2013。https://doi.org/10.1371/journal.pone.0066428.
- 4.
粮农组织。高水平专家论坛——如何在2050年养活世界。罗马:联合国粮食及农业组织;2009.
- 5.
高佛雷,贝丁顿,克鲁特,哈达德,劳伦斯,缪尔,等。粮食安全:养活90亿人口的挑战。科学。2010;327:812-8。
- 6.
FAOSTAT统计数据库。联合国粮食及农业组织。2017年罗马。。http://www.fao.org/faostat/en/#home.2018年9月24日访问。
- 7.
巴巴特VA, Trivedi PK,高希A, Sane VA, Ganapathi TR, Nath P.肉质水果的成熟:分子洞察和乙烯的作用。生物技术,2010;28:94-107。
- 8.
Tomas M, Beekwilder J, Hall RD, Sagdic O, Boyacioglu D, Capanoglu E.番茄酱工业加工与家庭加工:对酚类化合物、类黄酮和抗氧化剂体外生物可及性的影响。食品化学,2017;220:51-8。
- 9.
塔库尔BR,辛格RK,纳尔逊PE。番茄加工产品的质量属性综述。食品杂志1996;12:375-401。
- 10.
劳拉I,比利时B,古劳LF。果实角质层作为采后品质的调节剂。生物技术,2014;87:103-12。
- 11.
李志强,李志强,李志强,等。番茄果实发育过程中表皮细胞壁和角质层超微结构的研究。植物学报。2016;17:935 - 46。
- 12.
叶芝TH,罗斯JK。植物角质层的形成与功能。植物学报。2013;163:5-20。
- 13.
Domínguez E, Heredia- guerrero JA, Heredia A.植物角质层成因:未回答的问题。植物科学进展(英文版);
- 14.
Mahlein a - k。通过成像传感器检测植物病害-精确农业和植物表型的平行和特定需求。植物科学进展,2016;21(3):344 - 344。
- 15.
Martinelli F, Scalenghe R, Davino S, Panno S, Scuderi G, Ruisi P,等。先进的植物病害检测方法。复习一下。农业可持续发展,2014;35:1-25。
- 16.
王志强,王志强,王志强,等。植物病害检测技术的研究进展。计算电子农业。2010;72:1-13。
- 17.
王志强,李志强,李志强。振动光谱技术在植物健康发育无损监测中的应用。Anal Methods. 2015; 7:4059-70。
- 18.
史立克,麦安士,马丁。生物光谱学在植物和作物科学中的应用。进:Lopes J, Sousa C,编辑。综合分析化学。阿姆斯特丹:爱思唯尔;2018.15 - 49页。
- 19.
陈建林,陈建林。ATR-FTIR光谱成像技术在生物系统中的应用。分析师。2013;138:1940-51。
- 20.
Martin FL, Kelly JG, Llabjani V, Martin- hirsch PL, Patel II, Trevisan J,等。基于对其红外光谱的计算分析来区分细胞类型或种群。自然科学学报。2010;5:1748-60。
- 21.
崔维森,杨晓明,陈晓明,陈晓明。基于傅里叶变换红外(FTIR)生物光谱数据集的生物信息提取:当前实践与未来展望。分析师。2012;137:3202-15。
- 22.
Kelly JG, Trevisan J, Scott AD, Carmichael PL, Pollock HM, Martin-Hirsch PL,等。生物光谱学代谢轮廓生物分子结构:一个多阶段的方法连接计算分析与生物标志物。中国生物工程学报,2011;
- 23.
陈建平,李建平,陈建平,等。梧桐叶的光谱化学分析及其在环境健康监测中的应用。分析师。2016;141:2896 - 903。
- 24.
Zimmermann B, Bagcioglu M, Sandt C, Kohler A.振动微光谱技术用于单粒花粉的化学表征以及基于花粉超微结构的植物种类比较分析。足底。2015;242:1237-50。
- 25.
张志刚,张志刚。用手持拉曼光谱仪检测和鉴定玉米籽粒上的植物病原体。《肛肠化学》2018;
- 26.
傅霞,何霞,徐红,应莹。基于微型拉曼光谱和比色法的完整番茄新鲜度和番茄红素含量无损快速评价。食品肛管方法,2016;9:2501-8。
- 27.
Trebolazabala J, Maguregui M, Morillas H, de Diego A, Madariaga JM。利用便携式仪器和不同波长的共聚焦拉曼光谱仪,获得番茄(Solanum lycopersicum)果实中主要有机成分的光谱信息。生物化学学报(英文版);2013;
- 28.
Trebolazabala J, Maguregui M, Morillas H, de Diego A, Madariaga JM。便携式拉曼光谱技术在番茄果实成熟过程中的原位监测。中国生物化学学报,2017;30(4):344 - 344。
- 29.
黄烨,吕荣荣,陈凯。番茄采后品质无损检测的多通道高光谱成像探针。ASABE安国际会议。2017。https://doi.org/10.13031/aim.201700195.
- 30.
陆红,王峰,刘霞,吴勇。基于可见光/近红外光谱和机器视觉的番茄成熟度快速评估。食品分析方法。2017;10:1721-6。https://doi.org/10.1007/s12161-016-0734-9.
- 31.
田中,小岛,威廉姆斯。近红外光谱无损估计番茄成熟度和质地性质。中国食品科学,2012;https://doi.org/10.1016/j.jfoodeng.2012.04.007.
- 32.
Bureau S, Reling P, Bogé M, Garcia C, Renard CMGC, Giovinazzo R, Page D.利用中红外光谱快速表征工业型番茄。植物学报,2017;(1159):183-8。https://doi.org/10.17660/ActaHortic.2017.1159.27.
- 33.
赫里迪亚-格雷罗JA,贝尼特斯JJ,多明格斯E,拜耳IS,辛戈拉尼R,阿塔纳苏A,等。植物角质层的红外和拉曼光谱特征研究进展。前沿植物科学2014。https://doi.org/10.3389/fpls.2014.00305.
- 34.
杨晓明,李志强,李志强,等。ATR-FTIR光谱无损检测番茄果实损伤性酸腐病。足底。2018;249:925-39。
- 35.
李志强,李志强,李志强,等。利用同步加速器傅立叶变换红外微光谱技术检测植物营养缺陷。光子学报。2017;39(4):344 - 344。
- 36.
Largo-Gosens A, Hernandez-Altamirano M, Garcia-Calvo L, Alonso-Simon A, Alvarez J, acbees JL。傅里叶变换中红外光谱技术在植物细胞壁结构可塑性监测中的应用。前沿植物科学2014。https://doi.org/10.3389/fpls.2014.00303.
- 37.
Movasaghi Z,拉赫曼S, ur拉赫曼DI。生物组织的傅里叶变换红外光谱。应用光谱Rev. 2008; 43:134-79。
- 38.
陈晓明,王晓明,王晓明。转基因植物细胞壁代谢与果实软化品质的关系。植物分子生物学杂志2001;47:31 - 39。
- 39.
米德斯E,赫伯斯K,索内瓦尔德U,洛伦塞斯EP。一种细胞壁酶的过表达减少了转基因番茄果实的木葡聚糖解聚和软化。农业化学学报。2010;58:5708-13。
- 40.
Ellis M, Egelund J, Schultz CJ, Bacic A.阿拉伯半乳糖蛋白(AGPs):细胞表面的关键调控因子?植物物理,2010。https://doi.org/10.1104/pp.110.156000.
- 41.
周质阿拉伯半乳聚糖糖蛋白是调节植物生长发育的钙电容器。新植物,2013;197:58-64。
- 42.
Maul F, Sargent SA, Balaban MO, Baldwin EA, Huber DJ, Sims CA.成熟番茄的香气挥发谱受收获时生理成熟度的影响:电子鼻技术的应用。地球科学进展,1998;23(2):344 - 344。
- 43.
萨金特SA。佛罗里达番茄生产指南:收获和处理。佛罗里达州:食品和农业科学研究所合作推广服务;1997.
- 44.
卡德尔AA,莫里斯LL。番茄成熟和成熟的主观和客观测量相关联。记录:第二届番茄质量研讨会。戴维斯:加州大学;1976.57 - 62页。
- 45.
番茄果实角质层的酚类成分。植物化学。1980;19:1415-9。
- 46.
李国强,李国强,李国强,等。番茄果实生长相关基因研究。中国机械工程学报,2015;26(3):366 - 366。
- 47.
Holloway PJ。植物角质层的化学组成进:Cutler DF, Alvin KL, Price CE,编辑。植物角质层伦敦:学术;1982.45 - 85页。
- 48.
叶芝TH,豪KJ,马塔斯AJ,布达GJ,坦豪泽TW,罗斯JK。研究了番茄果实表面蛋白质组中与角质层生物发生相关的蛋白质。中国科学(d辑),2010;
- 49.
卡拉B,乔凡诺尼JJ。乙烯在番茄果实发育成熟过程中的分子生物学研究。植物科学与工程学报2008;
- 50.
巴格尔,倪辉。番茄(Lycopersicon esculentum mill.)果实生长成熟与果皮和离体角质层生物力学特性的关系。中国科学(d辑),2005;
- 51.
Isaacson T, Kosma DK, Matas AJ, Buda GJ,何勇,于波,等。番茄果实角质层的角质素缺乏会持续影响其对微生物感染的抵抗力和生物力学性能,但不会影响蒸腾失水。植物J. 2009; 60:363-77。
- 52.
红外光谱:基础和应用。第1版。新泽西州:威利;2004.
- 53.
Espana L, Heredia- guerrero JA, Segado P, Benitez JJ, Heredia A, Dominguez E.番茄(Solanum lycopersicum)果实角质层在发育过程中的生物力学特性受其成分相对量变化的调控。新植物,2014;202:790-802。
- 54.
Trevisan J, Angelov PP, Scott AD, Carmichael PL, Martin FL. IRootLab:用于振动生物光谱数据分析的免费开源MATLAB工具箱。生物信息学。2013;29:1095-7。
确认
感谢之前的实验室同事,他们的基础工作创建了框架,以促进本文的研究。
资金
这项工作得到了农业和园艺发展委员会(AHDB)(资助号CP 119)的支持:基于传感器的害虫和病原体的症状前检测,用于作物保护产品的精确调度(奖学金)。本研究中使用的方法和方法是由生物技术和生物科学研究委员会(批准号BB/D010055/1)和工程和物理科学研究委员会(EPSRC;批准号:GR/S75918/01和EP/K023349/1)。资助机构在研究的设计中没有发挥任何作用;数据的收集、分析和解释;或者在写手稿的时候。
作者信息
从属关系
贡献
PS撰写了草稿,并生成了所有的数字和表格。CLMM辅助SVM数据分析。FLM和MRM构思了研究并给出了手稿反馈。PS最终定稿。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用
发表同意书
不适用
相互竞争的利益
Martin R McAinsh是BMC植物生物学编委会成员。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
附加文件
附加文件1:
表S1。预测性能表现为为PCA-LDA化学计量模型计算的敏感性和特异性,该模型旨在从ATR-FTIR光谱数据中区分番茄果实发育和成熟阶段。(docx13kb)
附加文件2:
表S2。预测性能表现为为支持向量机化学计量模型计算的灵敏度和特异性,该模型旨在从ATR-FTIR光谱数据中区分番茄果实发育阶段。(docx12kb)
附加文件3:
表S3。预测性能表现为为支持向量机化学测量模型计算的灵敏度和特异性,该模型旨在从ATR-FTIR光谱数据中区分番茄果实成熟阶段。(docx12kb)
附加文件4:
图S1。用于开发类的类预测性能支持向量机。(PPTX 68 kb)
附加文件5:
图S2。成熟类的类预测性能支持向量机。(pptx70 kb)
附加文件8:
表S6.PCA-LDA模型随pc数量变化的方差百分比。(docx17 kb)
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
斯科利克,P.,莫莱斯,C.L.M,马丁,F.L.et al。用便携式红外光谱和化学计量学测定整个番茄果实的发育和成熟阶段。BMC植物生物学19日,236(2019)。https://doi.org/10.1186/s12870-019-1852-5
收到了:
接受:
发表:
关键字
- 番茄
- 发展
- 成熟
- 作物生物学
- 米尔光谱学
- 化学计量学