抽象的
背景
miRNA(microRNA)是18-24 nT内源性非致rNA,其调节在转录后水平的基因表达,包括组织特异性,发育正时和进化守护基因表达。
结果
这项研究首次使用高通量测序技术落叶松属olgensis,预测的78 miRNA,包括12,229,003读SRNA,筛选差异表达的miRNA。预测靶基因有助于理解miRNA调控功能,并获得333个相应的靶基因。基因本体(GO)和京都基因组(KEGG)功能注释进行了分析,主要包括核酸结合,植物激素信号转导,泛酸和COA生物合成,以及纤维素合成酶。本研究将为澄清复杂的miRNA介导的生长和发展的监管网络奠定基础。鉴于此,分析了miR396,miR950,miR164,miR166和miR160的时空表达落叶松属olgensis在不氧化的生长阶段,跛行的开始,通过定量实时PCR(QRT-PCR)在不同的组织(根,茎和叶)中完全徘徊。在同一生长期的根部,茎和叶中的miRNA表达存在差异。在60天时,MiR160,MiR166和MiR396-2在叶子中表现出最高的表达。120天,根部和茎中大多数miRNA显着下降。在180天,MiRNA在根和茎中大量表达。同时,随着时间的推移,叶片中miRNA表达的分析显示,随着时间的推移,MiR396-2减少了MiR396-2,而其他MiRNA最初增加然后减少。另一方面,在茎中,miR166-1增加,而其他miRNA,特别是miR160,miR164,miR396和miR950-1,首先降低,然后增加。同样,在根中,MIR950-2首先降低,然后增加,而其他MIRNA表现出连续增加的趋势。
结论
本研究包括麦克纳斯的快速分离和鉴定落叶松属olgensis通过使用SOLEXA的SRNA文库的构建,预测的78个新的miRNA,其显示在不同组织和阶段的差异表达水平。这些结果为进一步揭示了MiRNA在针叶树生长和发育的遗传调节机制和靶基因中功能验证的理论依据。
背景
mirna是一类内源性单链非编码rna,长度约18-24 nt。来源于可以形成发夹结构的单链前体rna [1那2, mirna主要在转录后水平调控基因表达[3.].随着MIRNA在结构上保守的,生物信息学方法可用于预测miRNA及其靶基因。鉴于miRNA序列短且仅在特定组织/细胞或细胞的特定阶段表达,研究人员忽略了miRNA。1993年,Lee发现了第一个miRNA秀丽隐杆线虫(秀丽隐杆线虫),mirna-lin4 * [4.,它暂时调节胚胎的发育。后来,大量的后续研究发现,在高等植物中,miRNA通过沉默或降解mRNA来调控其靶mRNA,在转录后水平发挥重要作用[5.那6.那7.].植物中第一个miRNA是在拟南芥2002年[8.].
裸子植物和被子植物大约在3亿年前分化。裸子植物在很长的进化时间尺度上已经进化和发展了独特的mirna。这些独特的mirna可能在裸子植物的生长发育中发挥重要作用。截至2012年,由曼彻斯特大学和剑桥大学共同建立的miRNA数据库miRBase(18.0)已经公布了168种植物的18226个miRNA前体序列,其中52种为植物。然而,大多数植物种类是被子植物松果体taeda和Picea Asperata.表示数据库中仅有的裸子植物。裸子植物miRNA信息的缺乏,极大地阻碍了miRNA研究的进展。新兴的sRNA文库高通量测序技术的应用可以帮助解决这一问题,特别是对于基因组大而ESTs信息少的针叶树。Solexa测序可以高通量、快速、高效地获取miRNA信息。
miRNA将其mRNA靶或阻断mRNA靶标主要通过互补与mRNA靶标的翻译。当miRNA与其mRNA靶向吻合对时,miRNA的5'末端位于miRNA的5'末端的碱基,首先与mRNA上的靶位点的片段对[9.那10]通过RNA聚合酶II形成初级转录物PRI-miRNA。然后,由核中的Dicer样1(DCL1)酶络合物介导,PRI-miRNA被切割成形成具有发夹结构的预先miRNA。接下来,加工前miRNA以形成成熟miRNA:miRNA * [11那12].最后,miRNA的一条链:miRNA *与Argonaute1(前1)蛋白结合以形成执行其功能的RNA诱导的沉默复合物(RISC);该链被称为miRNA,另一种互补链是miRNA *。许多研究证实miRNA *易于降解,并且可以在真核生物中作为基因表达的负调节剂发挥非常重要的作用,这在一定程度上拓宽了miRNA介导的基因调节的网络[13].在植物中,大部分miRNA和它们的mRNA靶基因具有少于四个不匹配[14];因此,植物mirna主要通过与AGO1蛋白结合形成RISC,从配对区域的中间分裂到mRNA的5 '端来实现其功能[15那16].以往的大量研究已经证实,植物mirna的大多数靶基因是转录因子、应激反应因子和F-box蛋白[17那18那19,强调了mirna在植物发育相关基因的表达和调控中的中心地位。此外,近年来的研究发现,植物mirna还参与信号转导途径、植物激素诱导、有机化合物的合成代谢、离子转运等,表明mirna具有重要的生物学意义。
落叶松属olgensis是我国东北地区重要的经济、生态树种和主要造林树种。遗传增益落叶松属olgensis用传统改进方法得到的数据将随着世代的延续而减少。另一方面,落叶松属olgensis具有非常复杂的遗传背景和大型基因组,以及其生长和发展的分子机制背后的研究。因此,使用SOLEXA高通量测序技术构建了小RNA文库文库文库,其允许快速分离和鉴定miRNA。在去除低质量序列并筛选清洁读取后,靶基因的基因鉴定和功能注释之后,MiRNA预测随后。最后,进行了MiRNA的差异表达分析落叶松属olgensis通过qRT-PCR初步了解miRNA在木质素生长发育中的调控作用落叶松属olgensis.
结果
sRNA文库的质量分析
经检测,RNA的浓度和纯度均符合高通量测序的要求。最终获得S01样本的21095,170个原始reads和S02样本的16395,342个原始reads,构建miRNA文库。总共获得27.21 M的clean reads。S01和S02样品中分别有15294797(72.50%)和11,913,982 (72.67%)clean reads。两份样本中相应的原始reads中clean reads所占比例均超过50%,说明测序数据质量较高。
小RNA序列分析
使用bowtie [20.]软件,将过滤的清洁读取应用于Silva数据库,GTRNADB数据库,RFAM数据库和Repbase数据库,用于序列对齐,并滤除NCRNA,例如RRNA,TRNA,SNRNA,Snorna和Repbase序列,以获得未经发布的读取。样本S01和S02的分类和注释如表所示1.
分析miRNA.
由于不同物种的miRNA的长度百分比存在差异,我们用长度来预测潜在miRNA的分类统计。21 nt产品最高;在S01样本中占25.76%,在S02样本中占26.71%。其次为20 nt (S01 17.34%, S02 21.11%)和22 nt (S01 17.11%, S02 16.58%)。
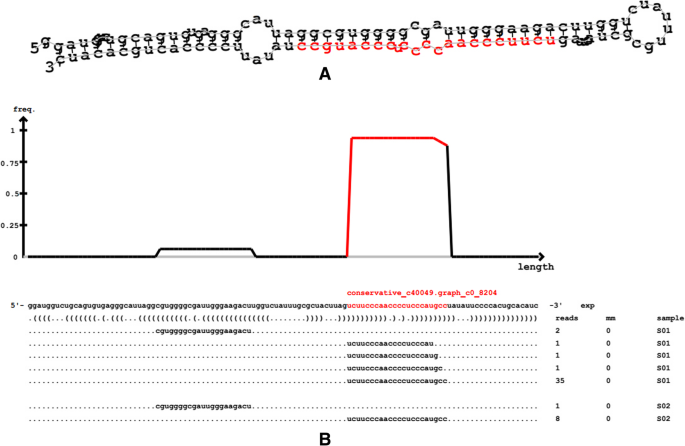
MiRNA前体的预测结构如图1所示。1.所有样品中共预测了78个新的miRNA。鉴于在miRBase库中包含落叶松中的miRNA,所谓的已知miRNA的预测数为零,所有预测的miRNA可以是新的miRNA,包括保守和未经遗忘。由于DICER和DCL酶的特异性,最终成熟MIRNA的长度主要是20至24nt的范围。特别是,植物miRNA主要是21 nt。该结果主要与所选的DCl酶有关[21].
研究了新型miRNA的长度分布。成熟的miRNA长度落叶松属olgensis大多是21 nt,占据所有预测的miRNA中的55.13%,预测的miRNA长度主要集中在21nt至22nt的范围内,这与常规结论一致。此外,研究基础偏好落叶松属olgensis揭示了21 NT产物的第一个基地的U计占53.49%,并且在22 nT中,它为71.43%,比所有比例的位置总和中的其他基座高,与MiDeepe2预测结果相同。
分析差异表达miRNA
差异表达mirna的筛选
通过将样品中的miRNA比较,包括11个保守的miRNA和38个未灌注的miRNA来获得总共49个差异表达的miRNA。上调了三十三个miRNA,下调了16名miRNA。鉴于MiRNA参与各种植物生命活动和过程,并且从增稠生长期的开始和峰值获得了两个样品,两个采样时间点之间的生长和发展可以由各种麦克纳斯策划重要的植物生长和发展的作用。
差异表达mirna的聚类分析
在筛选差异表达的miRNA之前,两种样品中miRNA的表达水平统计量化,然后使用百万(TPM)算法的转录物标准化[22].TPM归一化公式为TPM = Readcount*1000/MappedReads,其中Readcount表示与给定miRNA对齐的读数,MappedReads表示与参考基因组对齐的读数。然后利用表达丰度来筛选差异表达的mirna。
在检测到差异表达的miRNA落叶松属olgensis没有生物复制的物种,使用IDEG6进行差异表达分析[23]和使用| LOG2(FC)| > =1 and FDR < =0.05 as screening criteria, where the fold change (FC) indicates the ratio of the expression level between two samples. Given that the differential expression analysis of miRNAs includes a large number of independent statistical hypothesis tests for miRNA expression levels, a false positive problem exists. To address this problem, the Benjamini-Hochberg correction method [24]用来调整重要性p-值,以错误发现率(FDR)作为筛选差异表达mirna的关键指标。
采用基于完全连锁的层次聚类分析方法分析差异表达的miRNA。将表达相同或相似的miRNA聚类。差异表达mirna的聚类结果如图所示。2.根据表达丰度,所有miRNA预测常规(低表达)和高丰度(高表达)表达。
两个样品中相同miRNA的差异表达表明,差异表达的miRNA(49)占所有miRNA(78)的62.82%,大多数差异表达的miRNA以高丰度表示。大多数差异表达的miRNA被上调。结果表明,样品S01中上调的miRNA的比例较高,而在样品S02中下调的miRNA的比例较高。此外,从图中可以看出,一些差异表达的miRNA稳定表达,并且有些是随着生长和发育而不断变化的。
MiRNA靶基因预测及功能注释
靶基因预测
植物可以通过组合miRNA和mRNA或降解mRNA来锻炼其调节功能。基于植物miRNA的机制,预测的miRNA和相应的基因序列与靶器软件一起使用以预测靶基因(表2).
在S01和S02样本中,分别预测有相应靶基因的mirna 76和73个,靶基因总数分别为325和302个。在两个样本中,78个预测mirna的靶基因总数为333个。差异表达的mirna最终是通过调控mrna来实现其功能的。因此,要了解mirna的功能和调控模式,对其靶基因的初步了解和了解至关重要。结果表明,一个miRNA可能调控多个靶基因。同样,靶基因也可能受到多个mirna的调控。
差异表达mirna的目的基因注释
预测的靶基因序列与NR对齐[25],瑞士人[26), (27],COG [28],kegg [29], KOG [30.]和pfam [31]通过BLAST软件的数据库,获得了目标基因的注释信息。注释信息仅获得333个预测的靶基因的222个,以及所有miRNA靶基因注释号(表3.)计算和差异miRNA靶基因注释数(表4.).
当目标基因序列长度大于1000时,每个数据库中通过比对标注的目标基因数量大于目标基因序列长度在300到1000之间时的数量。序列长度大于1000的靶基因注释总数占数据库中靶基因总数的63.06%。对差异表达mirna目的基因的注释分析表明,NR数据库中注释的目的基因数量最大,包含了差异表达mirna目的基因的所有注释信息。其次是Swiss-Prot和GO,分别占差异表达mirna靶基因注释信息的68.66和67.16%。COG和KEGG数据库包含的注释信息最少。这些结果表明,一个miRNA靶基因具有相同的miRNA,而一个miRNA不一定有一个单一的靶基因,这也说明了miRNA及其靶基因调控网络的复杂性。
差异表达miRNA靶基因的归纳
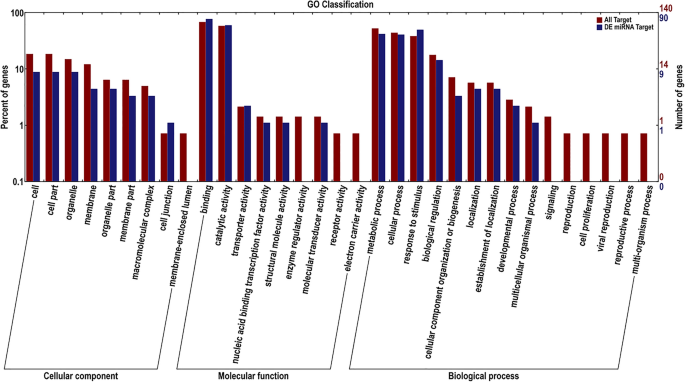
GO数据库是一个适用于所有物种的结构化标准生物注释系统,为基因和蛋白质研究建立了一个标准的信息系统,可以详细描述基因及其产物的属性。GO功能分析包括三个本体:细胞成分、分子功能和生物过程[32].对所有mirna预测的目标基因GO分类注释和差异表达mirna进行分析,将其分为I类和II类,可以反映差异表达基因的生物学特性。结果如图所示。3..
GO分析显示563个靶基因在所有预测的mirna中都被注释。差异miRNA的目的基因注释为315个,占注释的目的基因总数的55.95%。其中靶基因相关的细胞组分有117个,其中差异表达miRNA靶基因39个,占所有靶基因的33.33%。靶基因相关分子功能有191个,其中差异表达miRNA靶基因129个,占全部靶基因的67.54%。催化活性(54)项和结合(70)项所占基因数量最多。靶基因相关生物学过程有255个,其中差异表达miRNA靶基因147个,占所有靶基因的57.65%。最大的三个百分比是代谢过程(38),细胞过程(37)和对刺激的反应(45)。图中显示了所有mirna的GO二级功能富集和靶基因的不同表达,反映了它们的位置。二级功能具有明显的比例差异,提示差异表达miRNA靶基因与所有靶基因的富集趋势不同。根据富集趋势,可以简单地预测mirna调控的生命活动方向,例如,在细胞组分中,靶基因的不同表达,没有膜包腔; among molecular functions, without receptor activity, electron carrier activity, enzyme regulator activity; and among biological processes, without reproduction, viral reproduction, reproductive process, signaling and multi-organism process, suggested that the miRNAs involved in these processes were relatively stably expressed during growth and development in落叶松属olgensis.然而,还存在一些比例的miRNA靶基因多于其他miRNA靶基因,例如催化活性,对刺激,细胞过程和生物调节的结合,响应,这表明多个miRNA调节其靶基因以完成正常生长和发展过程。总之,了解这些GO术语在细胞成分,分子功能或生物过程类别中富含MiRNA的不同表达富集。
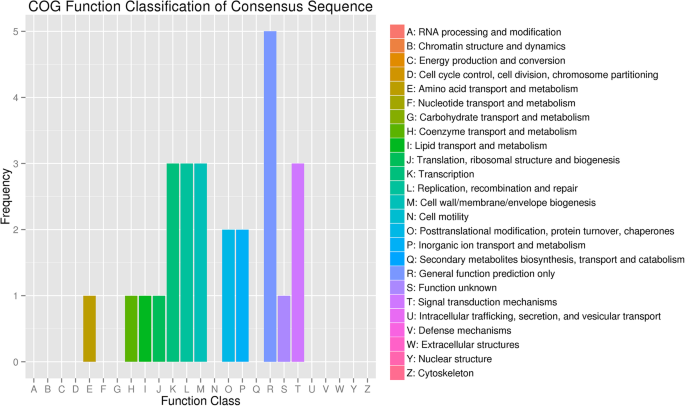
差异miRNA靶基因的COG注释
COG数据库基于细菌、藻类和真核生物的系统发育关系构建。COG数据库可用于蛋白质的同源分类。差异表达miRNA靶基因COG分类注释结果如图所示。4..这些靶基因参与氨基酸运输和代谢、辅酶运输和代谢、脂类、无机离子运输和代谢;翻译、核糖体结构与生物发生、细胞壁/膜包膜生物发生;转录;复制、重组和修复;生命活动过程,如翻译后修饰、蛋白质转换和伴侣;功能预测,如信号转导机制。在不同的功能分类中,注释的差异miRNA靶基因的比例反映了相应时期和环境的生理或代谢偏倚信息。如图所示,与这些过程相关的是转录;复制、重组和修复; cell wall/membrane envelope biogenesis; posttranslational modification, protein turnover, chaperone life activity processes; and coenzyme transport and metabolism. The expression level of these target genes was relatively high, suggesting that the samples were in a vigorous growth and development period. Correspondingly, sample 1 was in the early stages of growth, and sample 2 was in the vigorous growth period. Most miRNAs target genes were in the category of general function prediction and function unknown that the expression level was the highest, suggesting most miRNAs participation in the entire life process and needing further verification.
差异表达miRNA的富集
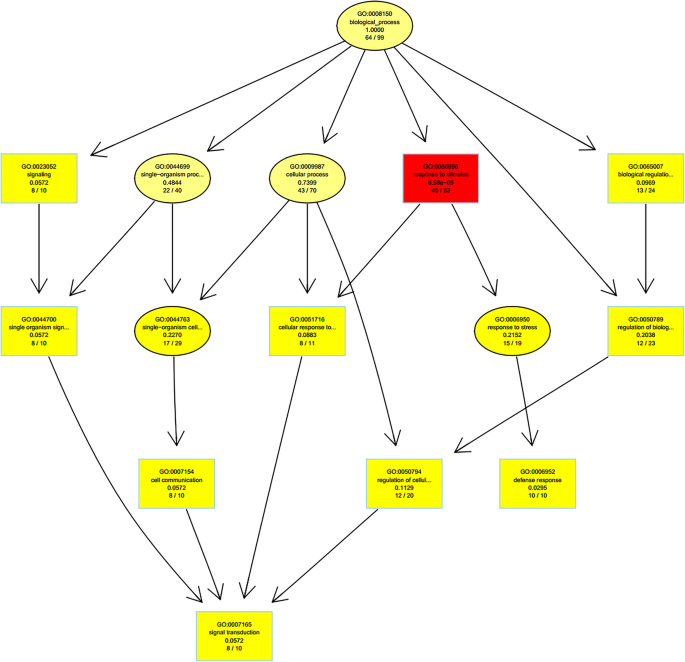
GO富集差异表达mirna的靶基因
利用topGO软件对样本间差异表达基因进行富集分析,以有向无圈图可视化的形式直观显示GO系统中显著富集项的层次关系。图中显示了样品S01和S02对差异miRNAs靶基因氧化石墨烯富集的生物学过程层次分析。5..如图所示。5.,获得了生物过程分类中的总共76项富集术语。最具显着富集的术语是对内源激素和有机物刺激的反应,其次是调节细胞大分子的代谢过程(包括RNA,核酸和有机物质的生物合成)和基因表达的调节。值得注意的是,富含不同类别的术语富集细胞信号转导。细胞通过细胞膜或细胞内受体感测信息分子的刺激;因此,可以影响整个小区的功能。靶基因的转录活性可以改变,从而诱导细胞响应过程。在分子功能的分类中,确定了38条富集的术语。最具显着富集的靶基因包括核苷酸结合,然后是转移酶,DNA,核糖核苷和离子结合的活性。上述共识结果表明了一些落叶松属olgensisMiRNA可能参与转录层面的规定。TopGo富集的前10位是分子功能分类中的靶基因,如表所示5..
如表中所示5.,差异表达的miRNA的靶基因的数量被注释为核苷酸结合,占靶基因总数的84.93%,其具有最高的富集率。转移酶活性,占注释的总靶基因的78.38%,表现出第二次最高浓缩率。对于这两种类型的差异表达miRNA的靶基因的富集是极为显着的,表明这些miRNA在生活中发挥着重要作用。
差异表达miRNA靶点的KEGG注释和通路富集
在体内,不同的基因相互作用,执行生物功能。为进一步了解差异表达mirna及其靶标的功能,我们对所有mirna及其靶标进行GO富集和KEGG通路注释分析。途径显著富集分析可以帮助我们确定差异表达的靶基因参与了主要的生化代谢途径和信号转导途径。将两个样本的miRNA差异靶基因按照代谢途径进行分类,其中两个样本给出了16个代谢途径的信息(表)6.).代谢过程中有8个miRNA靶基因参与,包括缬氨酸、亮氨酸和异亮氨酸生物合成、脂肪酸生物合成、n -聚糖生物合成、泛酸和辅酶a生物合成、丁酸代谢、丙酸代谢、丙酮酸代谢和c5 -支二元酸代谢。它们组成了50%的差异表达的靶基因。此外,参与遗传信息加工的富集靶基因有5个,占31.25%。此外,还存在植物激素信号转导和植物与病原互作基因。这说明在生长发育过程中有多个代谢途径参与结合,这些代谢途径是由多个miRNA协调完成的。然而,mirna如何调控靶基因还需要进一步的研究和验证。
miRNA时空表达模式分析
小RNA测序预测了78个mirna。作为落叶松属olgensis没有基因组数据库,不能准确地定义这些miRNA的目标基因的功能。基于上述研究结果[33那34那35那36那37那38那39那40选择,选择八个miRNA,其可能与生长和显影有关,以进行额外的定量荧光分析,以了解在落叶松的几种生长和发育阶段期间这些miRNA的相对表达。米兰语和靶基因注释呈现在表格中7..此外,选择5.8S rRNA作为对照参考,引物序列5'ACGTCTGTCTGGGGCGTCG 3'。上游底漆是由Transgen Biotech(北京,中国)提供的通用底漆。下游引物显示在表中8..
对于所选参考5.8s rRNA,当样品模板浓度和体积基本相同时,所有样品的5.8s rRNA基因的表达相对稳定;样品之间的CT值差异小于2并符合参考标准。实时定量PCR的溶出曲线均为单峰,表明PCR产物更具体。
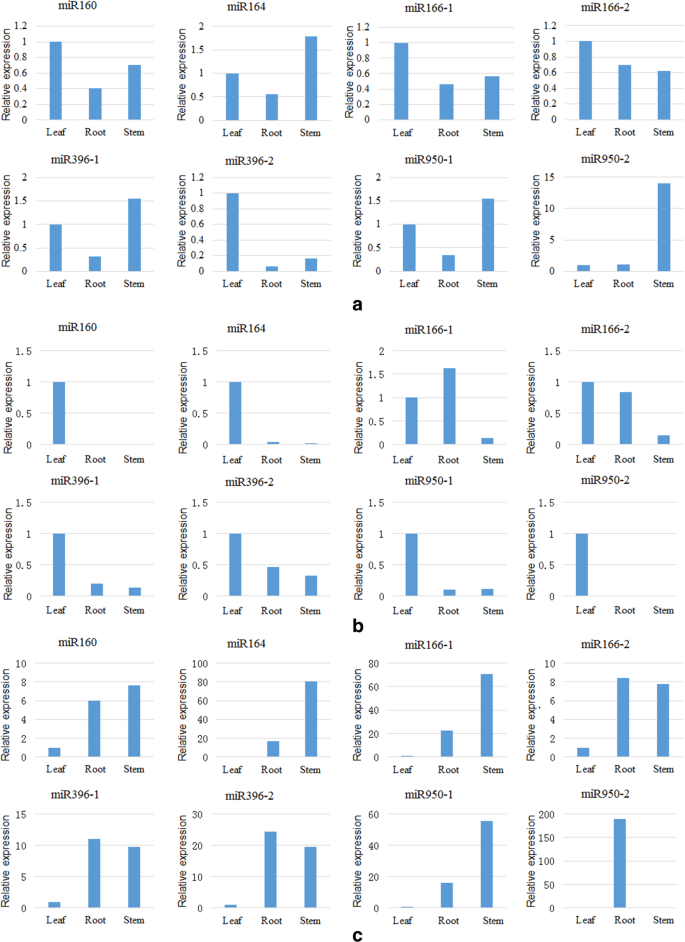
不同组织中miRNA的表达分析
相同的mirna在不同植物组织中的表达存在差异。以叶片组织为参照,图中显示了60天(120天,180天)幼苗根、茎、叶中各miRNA的相对表达量。6.a(b,c)。
如图所示。6.,在同一生长阶段,注意到根,茎和叶中miRNA表达的差异。在60天,MiR160,MiR166和MiR396-2表现出叶子中最高的表达;然而,它们在叶片中的表达与茎中的表达没有显着差异。MiR950-2表现出叶片中最低的表达,与根和叶子相比,其在茎中的表达显着增加,表明MIR950-2可能在干伸长中发挥着重要作用。在120天的时间内,除了根系中的miR166-1表达的轻微增加,其他miRNA在根和茎中的相对表达显着下降。叶子中注意到最高表达。特别地,与叶片相比,茎中miR160,miR164和miR950-2的表达显着降低。这些miRNA可能在叶子中大量表达,因为它们与叶子的生长和发育密切相关。在180天内,MIRNA在根部和茎中大量表达(根系中的miR950表达相比,与叶子相比大大增加),表明这些miRNA与在此阶段形成侧根和不定根的形成紧密连接。
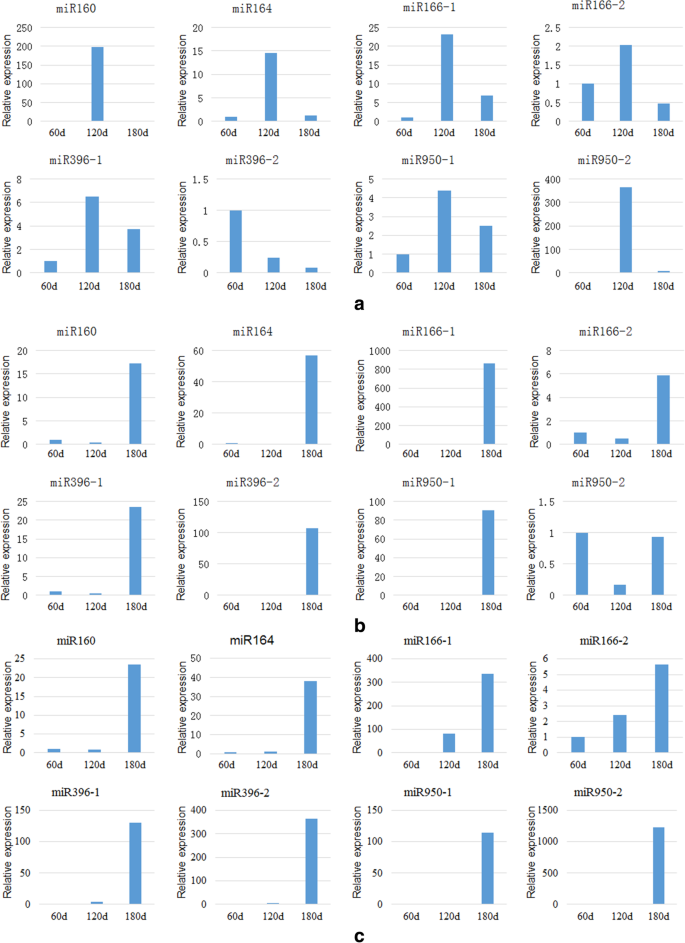
不同生长阶段mirna的表达分析
理解MIRNA及其靶基因在根,茎和叶片中的差异表达和调节关系在不同的生长阶段的探讨探讨MIRNA的调节机制和生物学功能及其靶基因的生长和发展中落叶松属olgensis.图中显示了60-180天根(茎和叶)组织中各miRNA的相对表达量。7.a(b,c)。
如图所示。7.,MiRNA在不同的生长阶段的根,茎和叶中表现出不同的表达水平。miRNA在根,茎和叶中具有不同的变异趋势。对于叶片,在生长期期间,MiR396-2的相对表达减少,而另一个七个miRNA最初增加,然后减少。特别地,miR160,mir164和mir950-2表现出这样的趋势的明显模式。另一方面,MiRNA在茎中的相对表达,MiRNA,MiRN166-1和MiR396-2,而持续增加,而所有其他miRNA,特别是miR160,miR164,miR396-1和miR950-1的表达,首先降低和然后增加。类似地,MiRNA在根中的相对表达,MiR950-2表达首先降低,然后增加,而其他miRNA表现出不断增加的趋势。因此,假设茎和根部的miRNA166-1和miR396-2的表达随着生长和发育而增加,表明它们可能与木髓的形成有关。相比之下,miR160,miR166-1,miR166-2和mir396-2在非跛足生长阶段表现出最高的叶片表达,但全褐化生长阶段的最低表达表明这些miRNA可以参与中学细胞中的新陈代谢。 Additionally, 60 and 120 days were the turning points for miRNA expression changes, indicating that they might be the key stages for miRNA to regulate the growth of落叶松属olgensis.
讨论
sRNA测序的方法
小RNA测序分析是miRNA研究中非常重要的话题。该分析涉及MiRNA的后期预测和鉴定,用于进一步了解特定组织中miRNA的表达以及在染色研究中对相应的miRNA筛选的特定阶段。早期的研究主要通过构建文库,然后是直接克隆和测序来鉴定MiRNA。例如,Lu等人。[9.[,]用此方法研究了mirna的调控松果体taeda用梭形锈病感染后金枪鱼Quercuum.f . sp。fusiforme.Yakovlev等人[41]还使用该方法研究胚胎发生过程中的胚胎胚胎中气候适应中的气候适应的表观遗传机制。Picea amies.图书馆建设方法,然后是直接克隆和测序的方法相对简单,并且代表了获得植物miRNA的有效和可信的方法。该方法还允许识别已知的和新的miRNA。然而,这种方法需要时间,并且检测效率低。此外,通过该方法获得的小RNA不仅包括miRNA,还包括其他SRNA,例如SIRNA,其严重阻碍MiRNA的鉴定。目前,近期采用的分子生物学实验测序技术弥补了上述缺点。自2005年以来,高通量排序技术,例如大规模平行签名测序(MPS)[42454 - flx [],43]和Solexa,用于挖掘和分析小rna。Roussley等人[44使用454-FLX测序技术在野生米上进行高通量测序,并通过与其自身的水稻基因组对齐进行差异表达基因。SOLEXA是一种基于SBS的新型测序方法(合成序列),其利用单分子阵列在小流动细胞中进行PCR。此外,新的可逆终端技术用于一次仅合成一个基地。然后,标记荧光基因,捕获荧光信号,允许读取基本信息。SOLEXA测序在35bp的长度内产生读数,这非常适合于对小RNA的测序分析,例如miRNA。另外,可以在短时间内获得数百万或甚至数十亿读数。对于针叶树,可以通过小RNA文库构建和测序来进行miRNA研究p . taeda和p .冷杉属[9.那10].该方法高效、有效的数据收集特点极大地加快了动植物中miRNA的研究。
mirna及其靶标分析
以往的研究表明,被子植物中已鉴定出多种mirna,并以科的形式分类[45那46]但很少在裸子植物中报道[47那48那49].最近的研究已经确定了与许多方面相关的miRNA靶标,主要包括转录因子,信号转导,植物生长和发展[50],植物激素信号转导[51RNA转运蛋白[52],sRNA生物合成[53]及植物防御[54那55].但是,对于落叶松属olgensis在美国,一项关于miRNAs的研究以前没有报道过。为了获得有关miRNA和目的基因注释的信息,构建sRNA文库并进行测序。从7,715,641个独特序列中获得78个mirna和333个靶基因,揭示了植物的生长发育过程落叶松属olgensis是由许多mirna调控的。此外,大部分sRNA在本研究中没有注释,包括样本S01 12,229,003(79.96%)和样本S02 9,921086(83.27%),这可能是因为在任何数据库中都没有基因组信息落叶松属leptolepis.因此,也有可能存在大量的功能特异性和新颖的mirna,这意味着有很多信息可以挖掘。
在研究miRNA功能时,重要的是直接找到相应的调节靶基因。注释的主要靶基因是该研究中的转录因子,信号转导和细胞壁和细胞膜生物合成。在先前的研究中,miRNA靶基因大多是转录因子,这意味着miRNA可以参与超过生长和发育的调节。本研究还表明miRNA可以调节多于一种靶基因,并且不同的miRNA也可以调节相同的靶基因[56].从miRNA和靶基因注释信息中,可以看出miRNA具有多于一个目标基因落叶松属olgensis,同样的靶基因不仅调控一个miRNA。此外,miR950在针叶树种中仅被注释,而且在某些种中还有未知的功能,这表明miR950可能在针叶树种中具有特殊的功能Larix Olgensis。前期研究发现mirna主要是负调控的靶基因。理论上它们应该是负相关的,但在玉米中miRNA的表达与靶基因的负相关很小。因此,靶基因的调控可能受到多种因素的影响,而不仅仅是miRNA的调控。在通路分析研究中,差异表达的mirna主要参与有机大分子和无机离子的生物合成和信号转导,而靶基因并不总是参与代谢通路,例如,miR164的预测靶基因参与3个代谢通路,miR2592参与4个代谢通路。这也进一步证实了mirna与其靶基因之间的相互作用受到多种因素的影响。
qRT-PCR的mirna表达模式
miRNA的时空表达模式为功能研究提供了思路,也是miRNA研究的重要组成部分之一。不同的mirna在植物中具有时间和组织特异性,表明时间和空间表达可能不仅决定了组织和细胞的功能特异性,还参与了复杂的基因调控,在植物的生长发育中发挥重要作用。大多数的mirna在不同的组织中有不同的调控Prunus Persica[57].在前人的研究中,miR164通过切割CUC1(杯状子叶)和CUC2 mrna调控花器官发育[33].此外,mirna调节mrna翻译机制的机制是可逆的,在此过程中mirna和mrna都被表达[40].NaC1(N-乙酰-1-半胱氨酸)mRNA的切割下调侧根发育的激素信号[34].一些李春万NAC基因在花蕾开放期间下调,部分NAC基因在冬季茎中高表达[58].植物蛋白在植物生长和发展中起着重要作用。ARF17是ARF(营养响应因子)基因家族的成员,是miR160的靶基因之一。miR160负面调节ARF17表达,并在响应早期的助化信号传导中发挥重要作用[35].过表达PTCMIR396C的前体在转基因烟草中的PCAMV35S中,不同的线显示出生长和发育的延迟,从而在增长的三个月内延迟了花卉过渡。因此,MIR396可能在植物的生长和发展中发挥重要作用。[59].在玉米中,MIR166通过抑制NAC1和ATHB-8调节干细胞和MiR166的分化,增强植物适应性对低温应激(拟南芥此外,miR166家族中的miR166c/f可能与植物微管细胞的分化和分生组织和侧根的形成有关;它主要参与生长素信号转导的代谢过程,从而调节植物对逆境的适应性,使植物向有利条件发展[45].miR951切割与植物抗病蛋白质同源的非蛋白质编码序列松果体taeda并产生短肽或次级siRNA。假设miR950也可能表现出这个功能[3.].肽是一类植物信号传导分子,其在生长和发育中起重要作用,不能被毒素或细胞素替换[46那47].在Brassica Rapa.,许多新的miRNA,许多含有少数靶基因和低表达,表明miRNA基因的快速演变[60.].
MiRNA是快速响应环境变化的重要调控基因。本研究采用qRT-PCR方法检测了叶、茎、根三个重要时期的相对表达量落叶松属olgensis增长与发展。发现miR160,mir166和mir396-2在60天的叶中表达最高,但MiR950的表达是最低的,而在茎和叶中,它显着高于根部。前者可能与叶子的生长和发育密切相关,并且miR950可能与侧根和木质素的形成有关。120天,这只是讽刺。除MiR166-1外,其他MiRNA在叶子中具有最高的表达。在研究期间,植物的光合作用吸收相对较强,因此有推测这些miRNA可以促进叶子的生长和发育。当植物完全萎缩超过180天时,叶中所有miRNA的表达是最低的,但它们在茎中大量表达。特别地,MiR950在根中的表达显着高于茎中的表达,表明它在横向根发育中起着非常重要的作用。以前的研究还发现MIR950可以促进侧向根部发育落叶松属leptolepis.发现miRNA在不同生长和发育阶段的根,茎和叶中的相对表达是不同的,并且miRNA具有不同的变异趋势。MiRNA的相对表达首先增加,然后在叶子中减少,除miR396-2外,结果是来自茎和叶的结果不同,在根系中存在增加的趋势,除了miR950。许多miRNA可能参与相同的代谢过程,并在生长过程中发挥非常重要的作用。确定相关的MIRNA将为增长和发展机制奠定基础落叶松属olgensis.
在以前的研究中,提到MIR164家族调节参与生长和发育,信号转导和抗应力反应的R2R3-MYB结构蛋白[61.].这表明MiR164在生长和发展中起重要作用以及压力耐受性。MiR164的靶基因NAc可以转化植物激素信号,从而产生玉米中的侧根,并且MiR164的表达增加可以减少侧根[62.].这与本研究结果一致。当植物增长120天时,侧面根部应该发生最大的发展。此时,结果表明miR164的相对表达非常低,导致大量的侧面根。miR166 / mir165在叶卷曲中起着重要作用,它可以通过增加miRNA表达和改善植物耐受性来抑制叶辊基因RLD的表达。此外,发现miR166参与苜蓿中根形态的调节。前体miR166的表达减少了III类HD-ZIP(Homodomain-亮氨酸ZIPPER)基因的表达,并且在共生关节和侧根侧存在异常[63.].此外,miR160对叶片的形成也有一定的调控作用,说明叶片的调控涉及到多个基因的参与。在本研究中,miR166在根中的表达量随着时间的推移而增加,而在叶片中则先增加后减少。研究也发现miR160和miR167的靶基因可能在调控GH3.6的表达中起相反的作用(Gretchen Hagen3.6) [64.那65.];也就是说,MiR160靶基因的还原可以激活养肝和不定根的增加,而MiR167靶基因是相反的。这也表明miRNA参与了许多水平的增长和发展的调节。该研究预测MiR160靶基因是ARF。MiR160的最低丰度表达在根系中发现,但靶基因ARF的表达在分析成熟miRNA和靶基因的分析中,推测通过调节靶基因ARF来促进miR160植物生长。MIR396的研究表明,靶基因ARF是与干旱有关的转录因子基因。然而,这项研究发现MIR396在监管中发挥着监控作用落叶松属olgensis生长和发展,表明基因具有多种功能。根系中的miR950在180天中高度表达。众所周知,很难制造落叶松属olgensis通过器官发生或体细胞胚胎发生在组织培养中的根。我们可以克隆miR950,然后进行基因转化落叶松属olgensis,因此改善了根率。将来,可以分析差异表达miRNA的途径及其目标以了解其他功能或调节网络落叶松属olgensis.
结论
这项关于78个新的mirnas的研究丰富了落叶松属olgensis基因组。分析了差异表达的miRNA。不同组织和阶段的大多数表达水平不同,这表明miRNA表达水平是时空可变的。简而言之,通过MiRNA和其靶基因之间的相互作用,涉及每个植物生长和发展过程的植物miRNA可以直接调节植物生长和发育,并且还可以通过其相应的靶基因间接调节植物的生长和发育。一些植物miRNA作为多司钓鱼物理地聚集在一起,这表明这些miRNA具有潜在调节基因表达的功能,以协调的方式。植物中的MiRNA在生长和开发过程中具有重要的生物学功能,研究其分子机制对于调节植物生命活动中的靶基因具有非常重要的生物学意义。根据miRNA的表达模式,可以预测其功能。如果需要验证miRNA和目标基因功能,则需要通过MiRNA的遗传转化来实现。这也是紧急要求解决方案的关键问题。
材料和方法
材料
sRNA测序的材料
来自中国东北林大学毛泽东实验森林农场的测序材料,中国黑龙江东北林大学。根据生长苯相磷酶落叶松属olgensis,在增稠生长期(5月5日)开始时获得了Clecbium及其周围的实质组织,分别是增稠生长期(6月15日)的峰值。将样品立即置于液氮中以进行冷冻保存,然后将其取向实验室并置于A-80℃的冷冻机中,直至RNA提取。
QRT-PCR材料
用于种子播种和苗圃成长,落叶松属olgensis在24±1℃下置于恒温幼苗室中的植物,亮度为16小时−1光照强度为35 μmol·m-2·s-1.当植物生长60天(未萎缩)时,120天(跛行开始),并取样180天(完全荨麻籽),三种组织(根,茎和叶子)。将收集的样品用纯水冲洗,用吸收纸干燥,然后在液氮中置于液氮中,用于miRNA提取。
方法
sRNA文库的构建与测序
sRNA图书馆建设的
RNA样品的纯度、浓度和完整性分别使用Nanodrop分光光度计(BioRad, Philadelphia, PA, USA)、Qubit 2荧光仪(Invitrogen, Carlsbad, CA, USA)和安捷伦2100生物分析仪(Agilent Technologies, Santa Clara, CA, USA)进行检测,以确保合格的样品被测序。Illumina测序(Illumina, San Diego, CA, USA),使用small RNA Sample Pre Kit构建sRNA文库,并通过质量检测。简单地说,小RNA (18-30 nt)首先连接到一个3 '适配器;加入逆反应引物;并将一个5 '接头连接到小RNA上。最后进行反转录反应,再进行多个周期的PCR,以获得足够的测序产物,并通过PAGE凝胶电泳筛选目的片段。利用片段中的所有序列构建小RNA库。
图书馆质量控制和测序
sRNA文库构建完成后,分别使用Qubit 2.0荧光仪和Agilent 2100生物分析仪检测sRNA文库浓度和插入尺寸。此外,采用Q-PCR方法对文库有效浓度进行准确定量,确保文库质量。经准确定量后,使用Illumina高通量测序平台HiSeq2500对sRNA进行测序,测序reads为单端50 nt产品。
测序数据的统计分析
清洁读数的生产
通过测序获得的原始读数包含适配器序列或低质量序列。为确保信息分析的准确性,有必要控制原始数据的质量并获得清洁读取。原始序列的质量控制标准如下:
- (1)
过滤掉低质量读(基本质量值小于30,占比大于20%);
- (2)
过滤掉含未知基N的内容大于10%的读;
- (3)
切割3 '端适配器和条形码序列;
- (4)
丢弃小于18 nt和大于30 nt的读取。
预测miRNA和靶基因
miRNA转录起始位点(TSS)位于基因间区、内含子和编码序列的反向互补序列中,形成发夹结构前体。60-70 nt前体被运输到细胞质中,并被Dicer酶切割形成成熟的miRNA [66.那67.].利用miRDeep2程序将干净的reads映射到参考序列(这里的参考基于转录组装配序列),以识别保守的和新的miRNA。然后利用miRDeep2对miRBase数据库中的特定物种进行18-30 nt核苷酸序列比对。序列未映射到经消除适配器过滤的参考序列上,然后扩展miRNA碱基数,预测miRNA结构,得到新的miRNA。最后,利用TargetFinder软件对靶基因进行预测,以测序丰度最高的预测miRNA作为查询序列,转录数据作为靶基因筛选数据库。
miRNA提取和逆转录
使用EasyPure®MiRNA提取试剂盒进行MiRNA提取,该试剂盒购自TransGen Biotech(北京,中国)。miRNA的逆转录反应使用从TransGen Biotech(北京,中国)购买的反转录试剂盒TransScript®miRNA First-Strand cDNA Synthesis SuperMix(含尾酶和逆转录酶)进行。将逆转录得到的cDNA稀释5倍,用于qRT-PCR。
mirna的qRT-PCR分析
分析结果显示,差异表达的mirna在落叶松属olgensis.为了推断这些上调或下调表达的mirna是否具有组织特异性或参与生长发育,我们通过研究不同组织中某些差异表达的mirna的表达水平落叶松属olgensis采用qRT-PCR分析。
mirna的qRT-PCR反应使用TransGen Biotech(北京,中国)的qRT-PCR试剂盒,反应使用SYBR染料。qRT-PCR仪器为ABI7500 (Applied Biosystems, USA, PCR仪用于基因表达分析)。每个反应包括三个技术重复。反应过程如下:94°C, 30 s;94°C for 5 s, 60°C for 15 s, 72°C for 35 s共40个循环;95°C for 15 s;60°C 1分钟;95°C 30 s。扩增反应完成后,进行熔化曲线分析,确保熔化曲线为单峰,以保证PCR扩增产物的统一性,这也说明PCR扩增产物具有较高的特异性。
由于植物细胞含有细胞壁且较难溶解,细胞组织采用液氮研磨制成研磨粉。勺子、研钵和舂杵置于121°C的高压釜中15分钟。然后用0.1% DEPC水对塑料材料进行处理,以防止RNA酶降解RNA。此外,在实验的最后一步,加入RNase free H2O,最好将其置于恒温水浴中以预热至60°C,并尽快将其添加到过滤器的中心,这可以提高miRNA的提取效率。在实时定量PCR之前,必须完全混合添加的混合物,以减少对添加误差的影响。
数据整理和统计分析
本研究的原始数据与Excel 97-2003一起处理。使用2定量分析每种处理中miRNA的相对表达——ΔΔCt方法 [68.].以5.8S rRNA作为成熟mirna的内控基因,对mirna的基因表达水平进行归一化。随后进行miRNA差异表达计算和分析。
可用性数据和材料
在当前的研究中生成的原始序列可在国家生物技术中心小型阅读档案(NCBI SRA,http://www.ncbi.nlm.nih.gov/sra.)和SAMN11843655、SAMN11843656。本研究中生成或分析的数据集包括在本文中。
缩写
- 前1:
-
Argonaute1
- ARF:
-
生长素响应因子
- ATHB-8:
-
拟南芥Homeobox8.
- 齿轮:
-
同源组的蛋白质簇
- CUC1:
-
1杯形状的子叶
- DCL:
-
像偶然的
- 舰队指挥官:
-
褶皱变化
- FDR:
-
假发现率
- GH3.6:
-
(格雷琴Hagen3.6)
- 走:
-
基因本体论
- HD-ZIP:
-
Homeodomain-leucine拉链
- Kegg:
-
京都基因和基因组百科全书
- miRNA:
-
microRNA.
- MPSS:
-
大规模并行签名排序
- 南京:
-
N-acetyl-L-cysteine
- nt:
-
核酸
- 存在:
-
定量实时PCR
- RISC:
-
RNA诱导的沉默复合物
- SBS:
-
综合排序
- SE:
-
体细胞胚胎发生
- SRNA:
-
小核糖核酸
- TPM:
-
记录每百万
- TSS:
-
转录起始点
参考
- 1.
陈XM。小RNA及其在植物开发中的作用。Annu Rev Cell Dev Biol。2009; 25:21-44。
- 2.
Bartel DP。microrna:基因组学、生物起源、机制和功能。细胞。2004;116:281 - 97。
- 3.
Brodersen P, Sakvarelidze-Achard L, Bruun-Rasmussen M, Dunoyer P, Yamamoto YY, Sieburth L, Voinnet O.植物mirna和sirna的广泛翻译抑制。科学。2008;320:1185 - 90。
- 4.
Fire A, Xu S, Montgomery MK, Kostas SA, Driver SE, Mello CC.双链RNA对秀丽隐杆线虫的有效和特异性遗传干扰。大自然。1998;391:806-11。
- 5.
Llave C,Xie Z,Kasschau Kd,Carrington JC。稻草人样mRNA目标的裂解拟南芥microrna。科学。2002;297:2053-6。
- 6.
Aukerman MJ,Sakai H. MicroRNA的开花时间和花器官身份的调节及其Apetala2样靶基因。植物细胞。2003; 15:2730-41。
- 7。
Bari R,Datt PB,Stitt M,Cheible WR。PHO2,MicroRNA399和PHR1在植物中定义磷酸态信号通路。植物理性。2006; 141:988-99。
- 8。
Reinhart Bj,Weinstein,例如Rhoades MW等。植物中的microRNA。基因开发。2002; 16(13):1616。
- 9.
Lu SF Syh,Amerson H,Chiang VL。MicroRNAS在Loblolly Pine(Pinus taeda L.。)及其与梭形锈的携带的关联。工厂J. 2007; 51:1077-98。
- 10。
MicroRNAs,表观遗传记忆和气候适应挪威云杉.新植醇。2010;187:1154 - 69。
- 11.
Carrington JC,Ambros V. MicroRNA在植物和动物发育中的作用。科学。2003; 301(5631):336-228。
- 12.
mr . Jones-Rhoades MW, Bartel DP, Bartel B. MicroRNAS及其在植物中的调控作用。植物学报2006;57:19-53。
- 13.
杨杰,菲利普斯MD,Betel D等人。脊椎动物MicroRNA *物种的广泛监管活动。RNA。2011; 17(2):312-26。
- 14.
Qi Y,Denli Am,Hannon GJ。生物化学专业化内部拟南芥RNA沉默的途径。Mol细胞。2005; 19(3):421-8。
- 15.
yoon wh,meinhardt h,montell dj。miRNA介导的JAK /统计形态学信号传导的反馈抑制建立了细胞命运阈值。NAT细胞BIOL。2011; 13(9):1062-9。
- 16.
Gandikota M,Birkenbihl RP,Hohmann S等人。拟南芥SBP盒基因SPR3的3'UTR中的miRNA156 / 157识别元素可防止在幼苗中的翻译抑制早期开花。工厂J. 2007; 49(4):683-93。
- 17。
Shi T,Wang K,Yang PF。在植物辐射期间优先保留调节转录因子的古老MicroRNA系列。植物信号表现。2016; 11(12):1-3。
- 18。
Jones-Rhoades MW,Bartel DP。植物微小RNA的计算鉴定及其靶标,包括应激诱导的miRNA。Mol细胞。2004; 14(6):787-99。
- 19.
陈米,孟义,顾人,等。基于下一代测序数据的工厂小RNA的功能表征。计算Biol Chem。2010; 34(5-6):308-12。
- 20.
人类基因组短DNA序列的超快和记忆效率比对。基因组医学杂志。2009;10:R25。
- 21.
Starega-Roslan J,Galka-Marciniak P,Krzyzosiak WJ。miRNA前体的核苷酸序列有助于通过加入裂解位点。核酸RES。2015; 43(22):10939-51。
- 22。
Fahlgren N, Howell MD, Kasschau KD, Chapman EJ, Sullivan CM, Cumbie JS, Givan SA, Law TF, Grant SR, Dangl JL, Carrington JC。高通量测序拟南芥microrna: MIRNA基因频繁出生和死亡的证据。《公共科学图书馆•综合》。2007;2 (2):e219。
- 23。
Romualdi C,Bortoluzzi S,D'Alessi F,Danieli Ga。IDEG6:用于检测多个标签采样实验中的差异表达基因的网络工具。physiol基因组学。2003; 12(2):159-62。
- 24.
Benjamini.Hochberg。控制错误发现率:一种实用而强大的多重测试方法。J R Stat Soc Ser B. 1995; 57:289-300。
- 25.
Yu K,张T. NCBI-NR数据库的定制子数据库的构建,采用组合爆破和梅根方法快速注释巨大的偏见数据集。Plos一个。2013; 8(4):E59831。
- 26.
Apweiler R,Bairoch A,Wu Ch,等。UNIPROT:通用蛋白质知识库[EB / OL]。核酸RES。2004; 32(数据库问题):115-9。
- 27.
等。基因本体论:生物学统一的工具。基因本体论联盟。Nat麝猫。2000;得分上以25 - 9胜过25(1):。
- 28.
Tatusov RL, Galperin MY, Natale DA, et al.;COG数据库:用于蛋白质功能和进化的基因组规模分析的工具。核酸学报2000;28(1):133-6。
- 29。
Kanehisa M,Goto S,Kawashima S等人。用于解密基因组的KEGG资源。核酸RES。2004; 32(数据库问题):D277。
- 30.
Koonin EV, Fedorova ND, Jackson JD等。在完整的真核生物基因组中编码的蛋白质的一个全面的进化分类。基因组医学杂志。2004;5 (2):R7。
- 31.
Eddy SR. Profile hidden Markov模型。生物信息学。1998;14(9):755 - 63。
- 32.
Ashburner M,Ball Ca,Blake Ja,Botstein D,Butler H,Cherry JM,Davis AP,Dolinski K,Dwight SS,EPPIG JT,Hill DP,LSSel-Tarver L,Kasarskis A,Lewis S,Matese JC,Richardson JC,Ringwald M,Rubin Gm,Sherlock G.基因本体:生物学统一的工具。Nat麝猫。2000;得分上以25 - 9胜过25(1):。
- 33.
Laufs P, Peaucelle A, Morin H, Traas J. CUC基因的MicroRNA调控是控制边界大小所必需的拟南芥分生成品.发展。2004;131(17):4311 - 22所示。
- 34。
郭HS,谢Q,Fei JF,Chua NH。microRNA将转录因子NaC1的mRNA切割引导到下调植物引线信号拟南芥侧根开发。植物细胞。2005; 17:1376-86。
- 35。
Mallory AC,Baitel DP,Battel B. MicroRNA定向调节Arabidopsis Auxin.响应因子17对于适当的发展至关重要,并调节早期疾病响应基因的表达。植物细胞。2005; 17(5):1360-75。
- 36.
刘D,宋y,chen z等。miR396的异位表达抑制GRF靶基因表达,改变叶片生长拟南芥.physiol植物。2009; 136(2):223-36。
- 37.
王志强,王志强,王志强,等。细胞增殖的控制拟南芥由微rna miR396。发展。2010;137(1):103 - 12所示。
- 38.
关键词:UV-B, microRNA,基因表达,基因工程abstract拟南芥.生物学杂志。2007;3:103。
- 39.
杨H,Matsubayashi Y,Nakamura K,等。Oryza sativa psk基因编码植物霉素-α的前体,植物中发现的硫酸化肽生长因子。Proc Natl Acad Sci U S A. 1999; 96(23):13560-5。
- 40。
Lindsey K,Casson S,Chilley P.肽:植物中的新信号分子。趋势植物SCI。2002; 7(2):78-83。
- 41.
Yakovlev Ia,Asante DK,Fossdal CG等。差异基因表达与影响气候自适应的表观遗传记忆相关挪威云杉.植物SCI。2011; 180(1):132-9。
- 42.
Brennecke J,Aravin AA,Stark A,Dus M,Kellis M,Sachidanandam R,Hannon GJ。离散的小RNA产生基因座作为转座子活性的主调节器果蝇.细胞。2007; 128(6):1089-103。
- 43.
等。微组装高密度皮升反应器中的基因组测序。自然。2005;437(7057):376 - 80。
- 44.
王志强,王志强,王志强,等。植物基因组的新一代测序。大米。2009;2(1):35-43。
- 45.
关键词:aptala2,转录抑制子,微rna拟南芥花卉发展。科学。2004; 303(5666):2022-5。
- 46。
Nils S,Andreas S.翻译后修饰的调节植物肽激素和生长因子。植物BIOL。2019; 21(SOPPL 1):49-63。
- 47。
哦TJ,Wartell RM,Cairney J,Pullman GS。特异性微小RORNAS(miRNA)和小植物胚胎胚胎和雌性PINE的雌性配子体的MIRNA加工组分的阶段特异性调节的证据(松果体taeda).新植醇。2008;179(1):67 - 80。
- 48.
Morin RD, Aksay G, Dolgosheina E, Ebhardt HA, Magrini V, Mardis ER, Sahinalp SC, Unrau PJ。小RNA转录组的比较分析Pinus contorta.和奥雅萨苜蓿.基因组研究》2008;18(4):571 - 84。
- 49.
高通量测序技术揭示茉莉酸甲酯对红豆杉microRNA表达的调控作用Taxus chinensis.).基因。2009;436(1 - 2):37-44。
- 50。
Cakir C,Gillespie Me,Scofield SR。小麦和大麦病毒诱导基因诱导基因函数的快速测定。农作物科学。2010; 50:S77-84。
- 51。
刘强,陈宇强。植物发育机制:mirna途径与植物激素反应的相互作用。生物化学学报。2009;384(1):1 - 5。
- 52。
王志强,王志强,王志强,等。小麦新保守microrna及其靶标的鉴定与注释(Triticum aestivuml。).《公共科学图书馆•综合》。2018;13 (7):e0200033。
- 53.
谢泽,Kasschau KD, Carrington JC。dicer-Like1的负反馈调节拟南芥通过MicroRNA引导的mRNA劣化。Curr Biol。2003; 13(9):784-9。
- 54.
邓艳,王静,董建军,等。植物生长过程中小RNA在调节天然免疫中的作用。公共科学图书馆Pathog。2018;14(1):22页。
- 55.
朱军,朱建军。小rna在植物非生物胁迫反应和营养剥夺中扮演重要角色。植物科学进展。2007;12(7):301-9。
- 56.
Joshi H.在Sesame的Silico识别和MicroRNA的靶预测(芝麻标记L.)表示的序列标签。int j计量microbiol appl sci。2018; 7:1275-84。
- 57.
朱H,夏R,赵某,等等。桃子的独特表达,处理规则和监管网络(Prunus Persicamicrorna。BMC Plant Biol. 2012;12:49。
- 58。
卓晓坤,郑太仓,张志勇,等。NAC转录因子基因家族的全基因组分析揭示了木本植物中不同的表达模式和冷胁迫反应李春万.基因。2018;9(10):494。
- 59。
Baucher M,Moussawi J,VandePutte O M等人。MiR396 / GRF网络在花卉发育期间器官型规范中的作用,\ r的异位表达支持,杨树trichocarpamir396c \ r,在转基因烟草中。植物生物学。2013; 15(5):892-8。
- 60。
叶熙柱,李志强,李志强,等。基于小RNA深度测序的油菜基因组中新microrna的鉴定和分析。BMC Plant Biol. 2012;12:218。
- 61。
lu x,h d,lian c等。PEU-MIR164及其靶心菜基因对非生物压力的作用胡杨.植物理性生物化学。2017; 115:418-38。
- 62。
李吉,郭克,郭爱等。miRNA164 - ZMNAC1的定向切割ZMNAC1在玉米中的侧根发育(玉蜀黍L。).BMC Plant Biol. 2012;12:220。
- 63。
张志强,张志强,张志强,等。McicroRNA166控制根瘤发育Medicago truncatula.工厂J. 2008; 54(5):876-87。
- 64。
Gutierrez L,Mongelard G,FlokováK,等。养宾控件拟南芥通过调节茉莉酸稳态来偶然根起因。植物细胞。2012; 24(6):2515-27。
- 65.
田策,武藤敏,通口等。生长素反应因子8基因的破坏和过表达拟南芥影响休底伸长率和根生长习性,表明其在疾病中可能参与疾病稳态。工厂J. 2004; 40(3):333-43。
- 66.
杨丽琴,李爱杰,姜建明,陈志强,杨丽琴,陈志强。Real-time PCR技术在微rna检测中的应用。方法。2008;(1):44 31-8。
- 67.
秦烨,段志新,夏晓丽,尹伟林。在脱水和高盐度冲击下前体和成熟microrna的表达谱胡杨.植物细胞代表2011; 30(10):1893-907。
- 68.
Livak KJ, Schmittgen TD。使用实时定量PCR和2(−Delta Delta C(T))方法分析相对基因表达数据。方法。2001;25:402-8。
确认
不适用。
资金
全文由国家科技重大专项(2018ZX08020-003)和国家自然科学基金(31700595)资助。实验设计及样品采集由国家高技术研究发展计划(2013AA102704)资助。中央高校基本科研业务费资助项目(2572016CA08)资助
作者信息
从属关系
贡献
构思和设计了实验:HGZ和LZ。执行实验:SFZ,SSY和PQA。分析了数据:SFZ,JLZ,HHX和JHW。写了论文:SFZ。所有作者阅读并认可的终稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。既没有人或动物的对象,人或动物的材料或人或动物的数据使用在这个手稿。植物材料的收集符合机构,国家和国际准则。
同意出版
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
张淑珍,闫淑珍,赵军。等等。mirna及其靶基因的鉴定落叶松属olgensis和差异表达mirna的验证。BMC植物杂志19,247(2019)。https://doi.org/10.1186/s12870-019-1853-4
收到了:
公认:
发表:
关键词
- microrna的
- 落叶松属olgensis
- 靶基因
- 差异表达