摘要
背景
重金属镉(Cd)由于人类活动的影响而在环境中积累。它是不必要的,对所有生命形式都是有害的。植物细胞壁形成了抵御环境胁迫的物理屏障,并且在镉暴露后观察到细胞壁结构的变化。在目前的研究中,细胞壁组成和结构的变化紫花苜蓿对长期接触Cd后的茎进行研究。液相色谱-质谱(LC-MS)定量蛋白质分析辅之以靶向基因表达分析,并结合细胞壁组成分析。
结果
几种决定细胞壁结构的蛋白质发生了大量变化。结构变化主要表现在果胶多糖的组成上,数据表明,在Cd的作用下,木糖醛酸的存在增加。尽管检测到果胶甲基酯酶的丰度和酶活性较高,但果胶总甲基化不受影响。
结论
由于半乳糖醛酸主链甲基化,木乳糖醛酸丰度的增加可能阻碍Cd在细胞壁的结合。可能,Cd从细胞壁和外质体的排斥限制了重金属进入共质体,是获得耐受性的一个重要因素。
背景
人类活动的影响导致上层土壤中镉的积累。在整个欧洲,由于施肥、采矿活动和污水污泥,表土中镉的浓度在< 0.01至14.1 ppm之间。[1].镉具有很高的流动性,可通过根系进入植物,从根系分布到植物的所有部位,并可引起多种中毒症状。在地上部分的积累限制了植物材料的经济稳定,但相反,在植物修复过程中,植物也可以用于去除土壤中的Cd。
植物细胞壁是一种动态结构,它不断地发生变化,以适应植物的生长和环境条件,是抵御Cd等环境威胁的物理屏障。其结构成分提供了机械支撑和刚性,并通过嵌入细胞壁蛋白的活性来维持细胞壁的最佳特性[2,3.].细胞壁主要由纤维素、半纤维素和果胶组成。纤维素是主要的结构成分,由β-1,4-链葡萄糖组成,形成结晶微原纤维。这些微纤维嵌入在复杂的、异质的多糖基质中。半纤维素与纤维素结合,包括木葡聚糖、葡甘露聚糖、木聚糖和混合连锁葡聚糖,因此它们与纤维素的相互作用高度有助于细胞壁的增强[4].果胶可能是多糖中最不均匀的一组,包括均半乳糖醛酸(HG),鼠李糖半乳糖醛酸(RG) I和II,以及木半乳糖醛酸(XGA)。果胶的骨架由未分枝的半乳糖醛酸(GalA)组成,可部分修饰木糖等各种糖基。作为一个例外,RGI的主干不仅含有GalA,而且含有双糖重复序列。半乳糖醛酸可以通过甲基酯化和/或乙酰化来修饰,从而影响果胶的理化性质。因此,果胶多糖均半乳糖醛酸在被构建到细胞壁时是高度甲基化的,然后被细胞壁定位的果胶甲基酯酶(PME)去甲基化。然而,半乳糖醛酸主链上附着的糖基如木糖会干扰酶接近其GalA靶侧[5].XGA含量高的细胞壁结构域具有高甲基化程度[6]因为这些补丁最有可能抵抗PME活动。
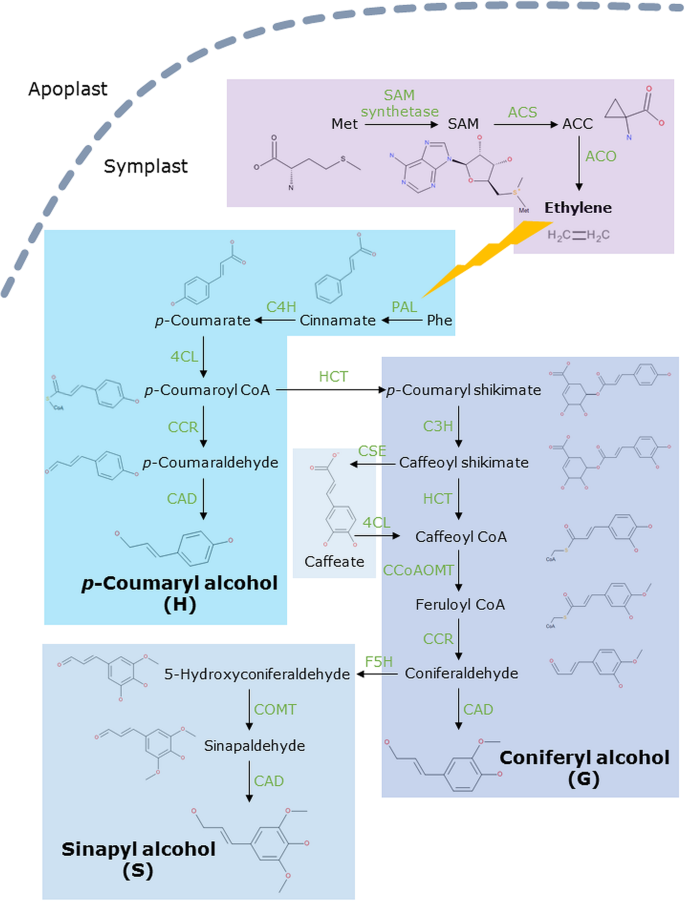
在接触Cd期间,细胞壁结构发生改变,并观察到HG甲基化模式的变化[7,8].PME活性增加,PME积累增强中外职业Cd暴露后的转录本显示在亚麻中[9,10].HG的去甲基酯化过程为Ca创造了结合位点,由于Cd具有更高的亲和力,Ca可以被Cd取代[11].因此,Cd在细胞壁中的可能的隔离阻止了它进一步进入细胞,这是植物抵御Cd胁迫的防御策略的一部分[12].此外,Cd还能诱导过氧化物酶活性,增强细胞壁木质化[9,10,13],在不同种类的植物中均可观察到[14,15].通过诱导活性氧(ROS)的积累,其中过氧化氢(H2O2)作为信号分子,引发过氧化物酶活性等次生反应,Cd有助于细胞壁木质化,然后抑制生长[16,17,18].木质素是由单木质素块组成,即p-香豆醇、辛纳醇、针叶醇和一组不同的酶是它们的生物合成所必需的[19,20.(图。1).在合成单木榄醇等酚类化合物的最初步骤中,苯丙氨酸(Phe)被苯丙氨酸解氨酶(PAL)转化为肉桂酸,其活性因植物气体激素乙烯而增强[21].乙烯在植物生命周期中参与多种分子、生物和生理过程,具有简单的生物合成途径(图2)。1).根据Keunen等人的研究,暴露于重金属中会影响乙烯的生物合成和信号传递。[22].在Cd-exposed拟南芥发现乙烯前体1-氨基环丙烷-1-羧酸(ACC)浓度增加,乙烯反应基因上调[23].此外,抑制乙烯合成会降低黄瓜根中的PAL活性和木质素含量[24].
单酚和乙烯生物合成途径。指出了这些途径的分子和酶。遇到了蛋氨酸;山姆年代腺苷甲硫氨酸;ACC 1-氨基环丙烷-1-羧酸;ACS acc -合成酶;ACO acc -氧化酶;苯丙氨酸解氨酶;C4H cinnamate-4-hydroxylase;C3H香豆酸3-羟化酶;羟肉桂酰转移酶;4CL 4-香豆酸连接酶;CAD肉桂醇脱氢酶;CSE咖啡基莽草酯酶; CCoAOMT caffeoyl-CoA 3-O甲基转移酶;肉桂酰辅酶a还原酶;COMT caffeateO甲基转移酶;F5H阿魏酸5-羟化酶。乙烯影响PAL的活性(用闪电粗体表示),从而影响单木酚的生物合成。CSE酶与4CL一起绕过了第二次HCT反应,在木质素生物合成途径中起重要作用m . truncatula[28]
紫花苜蓿是全球重要的草料豆科植物,其茎组织常被用于研究细胞壁上发生的过程[25,26]因为它占所产生生物量的50%以上,并且含有丰富的细胞壁物质。此外,茎可用于工业应用,如生物乙醇生产,这增加了植物的经济价值。环境条件,如重金属暴露,影响细胞壁的结构和组成,影响其稳定潜力。因此,解决细胞壁结构变化的研究具有很高的经济和社会利益。之前的一项基于凝胶的研究揭示了细胞壁蛋白质组的变化m .漂白亚麻纤维卷当植物暴露于Cd时27].研究表明,参与细胞壁重塑和碳水化合物代谢的几种蛋白质的丰度发生了改变,这支持了Cd影响细胞壁结构的假设,并强调了Cd作为抵御Cd胁迫的防御屏障的功能。
本研究重点研究了木质素的细胞壁单糖组成和木质素含量m .漂白亚麻纤维卷当植物暴露在土壤中实际浓度的Cd中一整个季节时。基于细胞壁作为Cd防御屏障的假设,本研究通过使用无凝胶方法补充了之前基于凝胶的研究,并通过有针对性的分析解决了关于Cd暴露后细胞壁结构变化的不同假设。
结果
无标记定量蛋白质组分析
以LC-MS为基础对三组分提取的细胞壁蛋白和可溶性蛋白进行定量分析。所使用的靶向方法导致细胞壁蛋白富集,其中胞浆蛋白污染低。然而,参与光合作用的蛋白质在三个细胞壁蛋白组分中都有发现。在我们的数据中,镉会干扰光合作用,并对叶绿体蛋白质的丰度产生一致的影响。因此,在结果和讨论中,将包括参与光合作用的蛋白质。
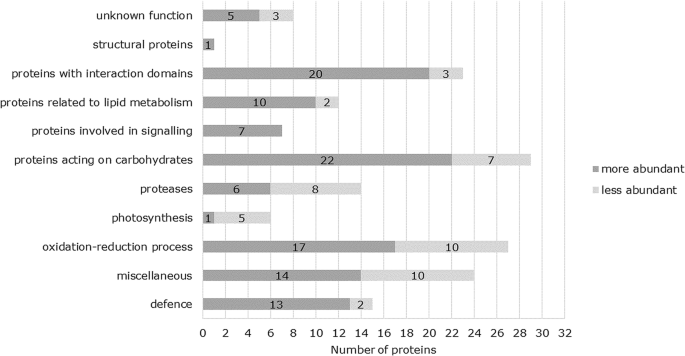
在三个细胞壁组分中鉴定出166个显著变化的蛋白质。这些蛋白质被分类为[29]但将防御蛋白和参与光合作用的蛋白质分开分类(附加文件)1).显然,更多的蛋白质具有更高的丰度,以应对Cd(116个蛋白质相对于50个蛋白质丰度较低)(图。2).
分别观察每个细胞壁蛋白组分(附加文件1)中,EGTA和LiCl组分中发生显著变化的蛋白质数量最多(分别为65和68)。在EGTA部分中,只有5种蛋白质的丰度因Cd暴露而降低,LiCl部分中27种蛋白质的丰度在Cd暴露后下降。在acl中2其中33个蛋白丰度变化显著,其中15个蛋白丰度较高。虽然所使用的提取方法是针对细胞壁蛋白,但所获得的提取物是细胞壁蛋白的富集,其中与其他亚细胞定位蛋白的污染较低。在发生显著变化的蛋白质中,分泌的细胞壁定位蛋白的百分比在所有三个分数中都很高:CaCl2EGTA为81.46%,LiCl为77.94%。
引人注目的是,大量蛋白质在镉暴露后丰度增加,在植物防御中具有指定的功能。这些包括几丁质酶和几丁质结合蛋白(归为碳水化合物结合蛋白),致病相关的thaumatin家族蛋白,过敏原Pru蛋白和Kunitz型胰蛋白酶抑制剂蛋白(归为具有相互作用域的蛋白质)。LiCl部分中只有两种防御相关蛋白的丰度较低(m . truncatula耐药转运体样ABC结构域蛋白与LRR和NB-ARC结构域抗病性蛋白同源)。在分类氧化还原过程中鉴定出不同的过氧化物酶,并且在EGTA和LiCl馏分中确定了较高的丰度对Cd暴露的响应。与此相反,在LiCl部分和CaCl中发现过氧化物酶III类(contig 34,984)丰度较低2分数。聚类鉴定的过氧化物酶(Clustal Omega)和序列比较并没有揭示分离,也没有发现低丰度过氧化物酶的特定功能。在CaCl中还鉴定出铁蛋白、多铜氧化酶样蛋白、碱性蓝样蛋白、l -抗坏血酸氧化酶、质体青素样结构域蛋白和早期结节样蛋白等氧化还原过程中含量较低的蛋白2和LiCl分数。大多数被分类为作用于碳水化合物的蛋白质都与植物细胞壁的结构有关。最常见的是葡聚糖内基-1,3-葡萄糖苷酶,在所有三个组分中都被鉴定出来,并且在Cd暴露后显示出增加的丰度。此外,α -半乳糖苷酶样蛋白和扩张蛋白A10在CaCl2EGTA组分中糖苷水解酶家族18蛋白和果胶乙酰酯酶家族蛋白的丰度均有所增加。已知参与细胞壁组装的其他丰度较高的蛋白质有定向样蛋白(分类为杂蛋白)、聚半乳糖醛酸酶抑制蛋白1、果胶酯酶/果胶酯酶抑制剂、木葡聚糖酶特异性内切葡聚糖酶抑制剂蛋白(均分类为具有相互作用域的蛋白质)、伸展蛋白样蛋白(结构蛋白)和束素林样阿拉伯半乳糖蛋白(分类为参与信号传递)。主要存在于EGTA和LiCl组分中。在后者中,也发现了一些细胞壁组织蛋白的丰度较低,如β -半乳糖苷酶样蛋白和聚半乳糖醛酸酶非催化蛋白,但也发现了一些丰度较高的蛋白质,如α -葡萄糖苷酶、果胶乙酰酯酶家族蛋白、膨胀蛋白和果胶酯酶/果胶酯酶抑制剂。此外,聚半乳糖醛酸酶抑制剂蛋白在CaCl2片段(contig 93293)的丰度也较低。
在可溶性蛋白部分,总共有28种显著变化的蛋白质被鉴定出来,其中25种蛋白质丰度更高,3种蛋白质丰度降低(见附加文件)1对于所有的识别)。其中57.14%的蛋白没有预测靶位点,可以认为是细胞质蛋白。6种蛋白被预测为分泌蛋白,另外6种蛋白为叶绿体蛋白。大多数被鉴定的蛋白质是杂的、参与翻译、核苷酸结合或蛋白质折叠的小蛋白质。此外,还鉴定了一种果粘连素受体、一种谷氨酰胺合酶和一种筛元闭塞蛋白。这些蛋白质由于镉暴露而增加,只有60S核糖体l4样蛋白(contig 101331)的含量较低。更丰富的蛋白质被分类为作用于碳水化合物(果糖-二磷酸醛缩酶、糖苷水解酶家族1蛋白、葡萄糖胺-6-磷酸异构酶/6-磷酸葡萄糖内酯酶)、防御(与致病相关的thaumatin家族蛋白)、氧化还原过程(类结核蛋白、过氧化物酶)、光合作用(类囊体罗丹斯样)和蛋白酶(真核天冬氨酸蛋白酶)。此外,过氧化物酶体nadd -苹果酸脱氢酶2和光系统II亚基Q-2的丰度因Cd暴露而降低。
基因表达分析
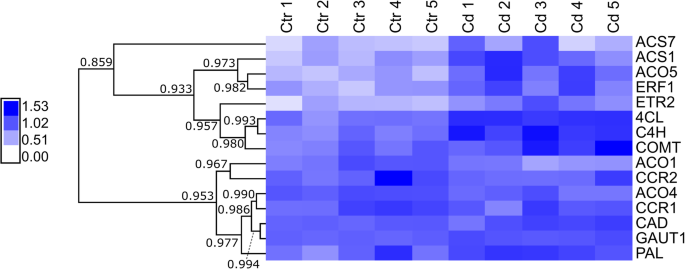
研究了单木酚、果胶和乙烯合成相关基因的表达m .漂白亚麻纤维卷以揭示镉暴露的影响(见图。1用于基因名称的缩写)。本实验使用5个生物重复,相对归一化表达值计算为均数,均数标准误差(SEM)(表2)1).热图分层聚类显示了qPCR评估的所有基因和复制的表达(图2)。3.).观察到两种基因表达模式。在上分支中,由于镉暴露,检测到较高的基因表达ACS7,ACS1,ACO5,ERF1而且ETR2.除了ACS7,这些表达变化显著(表1).此外,4 cl,C4H而且COMT的在上分枝中也有表达,但对照株与cd暴露株之间表达差异较小。而4 cl而且C4H变化明显,表达COMT的不会(表1).在cd暴露的植物中,聚集在较低分支的基因表达较低,但在相同条件下,重复之间的表达值总体上表现出较高的差异(图2)。3.).只有表情的变化ACO1而且ACO4有显著性(表1).在较低分支集群的第二组中计算机辅助设计,朋友而且GAUT1.后者是一种1,4-半乳糖醛基转移酶,可合成汞[30.].而GAUT1在cd暴露的植株中表达显著更高,在重复之间可以看到计算机辅助设计而且朋友.然而,这三个基因的平均表达值表明,在镉暴露的响应下,它们的表达更高(表2)1).
长期接触cd后干细胞壁中的单糖组成
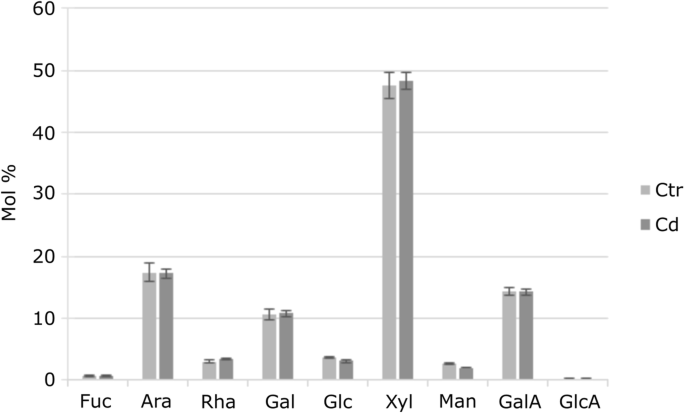
由细胞壁的总糖组成m .漂白亚麻纤维卷经TFA水解后,测定茎的含量(图;4).这个分析排除了结晶纤维素,因为它是抗TFA的。到目前为止,最显著的单糖是木糖(Xyl),在cd暴露的植物和对照植物中占近50%(48.34%)和47.46%。其次为阿拉伯糖(Ara)、半乳糖醛酸(GalA)和半乳糖(Gal)。浓度最低的是焦糖(Fuc)、鼠李糖(Rha)、葡萄糖(Glc)、甘露糖(Man)和葡萄糖醛酸(GlcA)。在cd暴露的植物和对照植物之间,没有观察到整体单糖组成的差异。
制备的总细胞壁由cd曝光和对照m .漂白亚麻纤维卷茎通过顺序提取进行分离(图;5).在顺序提取结束时,最后的细胞壁颗粒(CWP)仍然存在,它也被水解,并分析了单糖组成(表2).
所分析的单糖均存在于H2O部分以Ara为主,其次为Gal、GalA、Glc、Man、Xyl、Rha以及少量GlcA和Fuc。cd处理植株的细胞壁仅Rha和Xyl与对照植株的细胞壁有显著差异。中性单糖以Ara和Gal含量最高。Rha的共提取表明该部位含有阿拉伯聚糖和/或阿拉伯半乳聚糖侧链,Ara在cd暴露的干细胞壁中含量显著降低,而Rha的丰度增加。GalA代表果胶主干,其含量在cd处理茎的细胞壁中显著增加约5.9%。此外,与GalA共提取的xyyl表明,木聚糖存在于细胞壁上m .漂白亚麻纤维卷据报道,由于镉暴露,茎和Xyl丰度显著增加。在KOH馏分中,发现Xyl是最丰富的单糖。1m KOH组分中主要含有Xyl(两种条件下均大于70%),其次是GalA。然而,两者都没有受到cd暴露的影响。除大量的Xyl外,4 M KOH馏分中含有所有其他分析的单糖,Rha和GlcA所占比例最低。单糖(Gal、Glc、Xyl、GalA)在暴露与未暴露植物间存在一定差异,其中只有Gal发生显著变化。此外,Rha检测到轻微的变化,这是显著的。在连续提取结束时剩余的最终颗粒也用TFA水解。这部分仍然含有大量的Xyl, Glc, Gal, Ara和GalA。因此,在cd暴露植株的剩余颗粒中Ara和Rha的比例显著较高。 On the other hand, Man significantly decreased in Cd-exposed plants.
PME活性与果胶甲基化
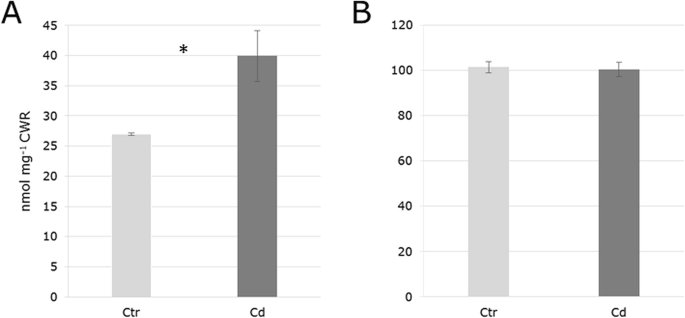
PME活性和果胶甲基化在5个生物重复中进行评估,其中每个重复在2个技术重复中进行测量。在cd暴露的样品中,PME活性显著增加,这是通过产生甲醇(nmol mg)来监测的−1轧(无花果。5a)并反映蛋白质在Cd暴露反应中的积累(附加文件1).然而,对照和Cd暴露的样品在皂化后从细胞壁释放的甲醇量是相同的,尽管确定PME活性增加,但Cd暴露似乎没有改变果胶甲基化程度(图2)。6b)。
长期镉胁迫对茎木化的影响分析
用分光光度法测定了长期暴露在cd环境下的植物茎部与在未污染土壤中生长的植物茎部的总木质素含量。木质素浓度无明显差异。测定了硝基苯氧化后CWR中木质素的组成,并分析了木质素的主要降解产物p-羟基苯甲醛(H),香兰素(V)和丁香醛(S)。单木质素的组成在不同条件下没有变化。事实上,在重复之间观察到单体木质素组成的高度变异性(表3.).
乙烯前体分子对长期镉暴露的响应定量研究
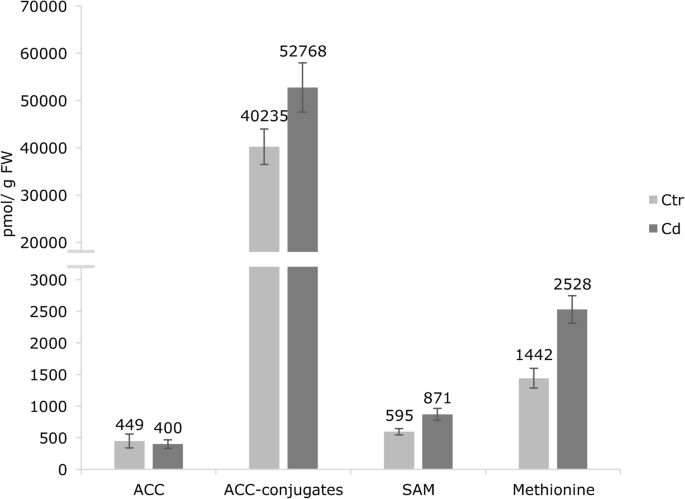
为了评估Cd对乙烯合成的影响,我们在Cd暴露和未暴露的植物中测定了ACC及其缀合物的浓度。7).作为直接前体,ACC的存在决定了乙烯生物合成中的一个速率限制步骤,并最终影响激素的浓度[32].长期接触Cd对ACC含量影响不显著,但偶联ACC含量显著增加(约31.15%),但不显著。此外,年代-腺苷蛋氨酸(SAM)和蛋氨酸含量分别显著增加46.39%和75.31%(图3)。7).
讨论
在目前的研究中,m .漂白亚麻纤维卷植物生长在cd污染的土壤(10 mg kg−1土壤DW)整个季节(5月至9月)。根据农业实践,在重新生长阶段后,植物被切割并进行二次茎取样。虽然在幼苗阶段出现了强烈的生长抑制,但在采样时没有测量到生物量的差异[27].本研究调查了接触Cd如何改变细胞壁的组成和结构。先前基于凝胶方法的数据[27]与使用相同样品的无凝胶方法相补充,并且通过有针对性的分析解决了关于Cd暴露后细胞壁结构变化的不同假设。
针对细胞壁蛋白,依次使用离子强度增加的萃取缓冲液,逐步提取紧密结合的蛋白。几种蛋白质,在CaCl中发现了更高的丰度2和EGTA部分,在LiCl部分中出现较低的丰度(附加文件1).LiCl缓冲液具有最高的离子强度,因此可以提取更紧密结合的细胞壁蛋白质。细胞壁的结构改变可能会影响细胞壁-蛋白质的相互作用,从而导致蛋白质在不同部分之间的转移。这种类型的转移在亲和力由于细胞壁的变化可以影响定量期间的解释。这一观察结果可能是第一个表明细胞壁在Cd胁迫下发生结构变化的迹象。细胞壁多糖的组成和性质的变化可以改变胁迫响应过程中细胞壁的功能,从而保护植物免受严重的Cd诱导的损伤。
然而,正如在凝胶研究中观察到的m .漂白亚麻纤维卷茎(27],长期Cd暴露导致防御相关蛋白,如不同的几丁质酶,致病相关的thaumatin家族蛋白以及葡聚糖endo1,3 - β -葡萄糖苷酶(附加文件1),这反映了植物的一般应激反应,似乎相当不具体。
长期接触镉对小鼠细胞壁组成的影响m .漂白亚麻纤维卷茎
植物细胞壁由纤维素为主要承载物的多糖、半纤维素和果胶组成。它的组成和重塑参与了对非生物胁迫的响应[33,34].因此,嵌入多糖网络的细胞壁蛋白(约占细胞壁的10%)可以作用于细胞壁结构,并在发育和环境压力(如Cd暴露)期间定制细胞壁特性。这里提供细胞壁蛋白数据(附加文件1)显示,长期接触镉后,几种蛋白质的丰度会发生显著变化,并对细胞壁结构起作用,这些发现与先前的研究结果一致[27].
在总提取中从分离的细胞壁材料中提取单糖m .漂白亚麻纤维卷对照和cd暴露植株之间没有显著差异(图2)。4).在这两种生长条件下,主要的单糖是木聚糖。早在1987年,人们就发现Xyl在成熟期最为显著m .漂白亚麻纤维卷茎,通过与木质素交联增强其消化能力[35].
用H2O, EDTA和KOH (1 M,然后用4 M提取),以获得更全面的细胞壁组成。总的来说,结果与以前从M漂白亚麻纤维卷同一发育阶段的茎[36].
用EDTA螯合剂提取果胶多糖。半乳糖醛酸,汞的组成部分,是主要的果胶残渣,而葡萄糖醛酸只存在于微量(表2).HG的GalA可以被木糖残基修饰,形成xylogalacturonan (XGA)的结构域,XGA是一种果胶多糖,被证明存在于各种组织的细胞壁中拟南芥[37].EDTA馏分中Xyl与GalA共提取表明XGA存在于细胞壁上m .漂白亚麻纤维卷(表2).木聚糖是豆科植物细胞壁中常见的一种成分[38],大豆细胞壁由XGA和RG组成,而不是HG [6].结果表明,XGA存在于细胞脱离区域[39].在这里,GalA和Xyl的提取量显著增加,以响应Cd暴露(表2),表明由于施加的压力,细胞壁中XGA的丰度更高。XGA的HG骨架可以部分甲基化。PME对HG的去甲基化是调节果胶网络的关键过程,其活性有助于果胶聚类成凝胶状基质[40].用Xyl修饰HG会抑制凝胶的形成,因为它会阻碍果胶修饰酶到达它们的目标位点[5,41]并稳定果胶的高甲基化程度[42].然而,cd暴露增加了PME的丰度和酶活性m .漂白亚麻纤维卷茎(无花果。6a,附加文件1),降低细胞壁的甲基化程度,促进Cd在果胶网络内的结合。然而,数据并没有显示对照和cd暴露植物之间皂化后从细胞壁部分释放的甲醇的变化。6b).组织内果胶在细胞壁中的甲基酯化程度不同,即使在很小的空间尺度上,也会导致细胞壁力学性质的局部差异[43].XGA与细胞壁结合m .漂白亚麻纤维卷茎肯定会影响壁基质的凝胶性质。可能存在XGA较少的区域,这些区域可用于PME及其较高的丰度和酶活性,以响应Cd(图)。6a,附加文件1)可以补偿富含xga的区域,以维持细胞壁的特定整体去甲基化程度。细胞壁网络中的这些结构域可以用于Cd的复员,而那些含有较高比例XGA的结构域则可以免受PME活性的影响。
研究表明,植物对重金属的耐受性由果胶甲基化程度决定,并与重金属敏感性或抗性有关。重金属耐受性种群的果胶甲基化程度较高[44].因此,这限制了细胞壁结合重金属的能力,并维持低外质体重金属浓度,导致共质体摄取减少。这两个过程都是植物耐受性的重要因素[45].因此,富含xga的细胞壁可以帮助从外质体中排除Cd,这与细胞壁中的局部Cd沉积相结合m .漂白亚麻纤维卷茎。通过这种方式,这里观察到的细胞壁结构改变有助于先前报道的耐受性m .漂白亚麻纤维卷与长期接触镉有关[27].
大部分半纤维素是用不同浓度的KOH提取的。最常见的单糖是木糖,在两个KOH馏分中Fuc的测定表明是木糖葡聚糖。GalA在KOH馏分中的共萃取(表2)可能是果胶与木葡聚糖的交联[46].木葡聚糖广泛分布于植物的细胞壁[47].其与果胶的连接高度有助于细胞壁的结构和组装,并支持木葡聚糖与细胞壁的整合[48].
然而,不同的糖基水解酶家族蛋白具有更高的丰度(附加文件1).已知这些细胞参与细胞壁的解构、松动和生长[49,50].显然,在压力条件下的生长是交联硬化和细胞壁松动之间的冲突。ROS和过氧化物酶支持半纤维素与木质素的交联硬化,膨胀素和糖基水解酶支持松动[34].
长期接触cd会影响乙烯的生物合成,但不会影响木质化和单木质素的组成
乙烯是一种气体激素,参与对多种生物和非生物应激的响应[22,51,52]在不同的植物中接触金属后,其含量有所增加[23,53].在本研究中,长期接触Cd导致蛋氨酸和SAM含量增加。接下来,SAM通过ACC合成酶(ACS)的活性转化为ACC。研究两种基因亚型的转录水平ACS1而且ACS7在cd暴露的茎中表达上调m .漂白亚麻纤维卷这表明ACC的产生增加了,ACC是乙烯生物合成中的限速步骤[32].虽然ACC含量在镉接触后略有下降,但其共轭形式的丰度却增加了,尽管这种变化并不显著(p= 0.086)。已知ACC的三种缀合物是γ-谷氨酰-ACC (GACC)、茉莉酰-ACC (JA-ACC)和丙二酰-ACC (MACC),缀合物可能是影响乙烯水平的有效ACC的生化调控[54].MACC的合成与乙烯产量呈正相关,表明乙烯合成的自我调节反馈控制是活跃的,这将刺激ACC的储存[55].MACC可能会转化回ACC,从而刺激乙烯的产生[56].
在最后一步,ACC被ACC氧化酶(ACO)氧化成乙烯,在当前的研究中,cd暴露植物ACC的降低伴随着ACC的上调ACO5乙烯反应基因的转录水平ETR2而且ERF1.因此,自由ACC被转化为乙烯,增强了乙烯信号,以应对长期的镉暴露。
除其他机制外[22],乙烯正影响PAL的活性[21,24],从而增加木质素含量[57].PAL酶催化苯丙氨酸转化为肉桂酸,使进入单木酚生物合成。这些单木质素是木质素生物合成的基石。Cd对细胞壁木质化和植物生长的影响已得到证实[14,58,59]以及观察在非生物胁迫下木质素组成的变化[60].尽管如此,经过长期的cd曝光m .漂白亚麻纤维卷植物细胞壁木质素含量及转录水平朋友没有明显变化。此外,在长期接触Cd后,单木质素的组成也不受影响(表3.).然而,一个显著变化的积累C4H而且4 cl检测到转录物;都是单木酚生物合成途径的编码酶(表1).镉诱导的PAL活性的刺激表现为剂量和时间依赖性洋甘菊chamomilla,这也适用于可溶性酚类物质的含量及其积累[61].在目前的研究中,应用的Cd浓度保持在较低的水平以模拟真实的土壤浓度,并且可能太低而不能显著影响木质素的生物合成和含量,尽管乙烯的生物合成伴随着的变化朋友转录水平。
木质化是由过氧化物酶活性驱动的。定量LC-MS显示,与之前观察到的一样,由于接触cd,不同过氧化物酶亚型的丰度增加[27].过氧化物酶及其活性随镉暴露而增加[62]从而导致木质化增加[59].对于木质素的形成,过氧化物酶需要H2O2作为底物分子。此外,Cd诱导植物细胞氧化应激,促进H2O2[63].然而,在当前的研究中,对照和cd暴露植物的茎木化没有发现差异。可能这些过氧化物酶更多地参与了H2O2在长期轻度cd暴露中清除,而不是改变木质素含量[34,64].在LC-MS分析中,观察到一些过氧化物酶亚型丰度下降。在系统发育树中聚类所有已识别的异构体后,未出现较低丰度的异构体与较丰度的异构体的分离(数据未显示)。因此,观察到的已识别肽的减少可能是由于降解片段,因为Cd也诱导蛋白水解,这在本研究中监测到的蛋白酶丰度的增加中得到了强调(附加文件)1).
结论
长期接触Cd导致适应m .漂白亚麻纤维卷对施加的应力。在表型上,cd处理与对照植株在成熟生育期无显著差异,表现为生物量相近。在长期镉暴露过程中,果胶多糖在细胞壁的组成m .漂白亚麻纤维卷茎变化。与最初的假设相反,细胞壁经历了支持Cd固定的结构变化,数据表明,Cd暴露后XGA丰度增加。与汞相反,XGA对PME活性具有抗性,因此可以稳定果胶的高甲基化程度。因此,在果胶网络中Cd的结合位点的产生不会发生。可能,Cd从细胞壁和外质体的排斥限制了重金属进入共质体,这是获得耐受性的一个重要因素。作为细胞壁重组的另一个重要方面,尽管过氧化物酶在cd暴露的植物中含量很高,但没有报道木质化的增加。很可能过氧化物酶的积累是对cd诱导的氧化应激的反应,以维持体内的氧化还原平衡m .漂白亚麻纤维卷.然而,长期接触Cd刺激乙烯信号m .漂白亚麻纤维卷茎。植物激素对PAL和酚丙类途径的活性有积极影响。PAL不仅由乙烯诱导,还进一步取决于底物的可用性[65],苯丙氨酸含量是细胞壁木质化和硬化的关键因素。了解这是如何受到长期镉暴露的影响m .漂白亚麻纤维卷茎对于模拟植物对施加的胁迫的反应是有价值的。
方法
植物材料和取样
紫花苜蓿L.种子,品种Giulia,接种Sinorhizobium meliloti播种在cd污染和对照土壤上。土壤由2/3盆栽土和1/3沙子(w/w)混合制成一批。一半的土壤被CdSO污染4最终浓度为每千克土壤干重(DW) 10mg Cd。2015年5月播种,每种条件12乘12盆。这些植物被保存在温室里,直到开花阶段,然后像农业实践一样进行切割。在重新生长期间,植物被放置在室外,直到开花前阶段,然后在温室中再放置一周,然后进行最终采样(2015年9月10日)。在整个试验过程中不施肥,也不控制日周期和温度。从茎中去除第一个和最后两个节间,只对中间部分取样,以获得更均匀的样品。在每种条件下,对茎进行5个生物重复采样,从24个盆中提取一池茎材料,对应一个生物重复。样品在液氮中研磨成细粉末,并在- 80°C保存,直到进一步使用。
无标记定量蛋白质组研究
蛋白质的提取和制备
细胞壁和可溶性蛋白的提取m .漂白亚麻纤维卷茎的处理方法如前所述[66,67].
蛋白质消化使用Amicon Ultra-4 10 K离心过滤装置(Millipore)进行[68].细胞壁和可溶性蛋白各为20 μg,用10 mM DTT在100 mM碳酸氢铵(AmBic)中还原20分钟,然后用100 mM AmBic(30分钟,4700 g, 4°C)洗涤。还原样品留在过滤器顶部,并在黑暗中与溶解在100 mM AmBic中的50 mM碘乙酰胺烷基化30分钟。洗涤两步后,用40 μL trypsin Gold (Promega) 5 ng ml消化样品−1胰蛋白酶在20mm AmBic,在40°C过夜。100 μL H2在过滤器上添加O,设备离心(40分钟,4700 g, 4°C),并从管底部收集肽。多肽真空干燥,用40 μL 5%乙腈(ACN)和0.01%三氟乙酸(TFA)增溶。
LC-MS/MS多肽分离分析
多肽用NanoLC-2D系统(Eksigent)与TripleTOF 5600+ MS (Sciex)耦合分析,先前在Behr等人中详细描述。2018 [69].通过搜索从Samuel Roberts Noble网站下载的紫花苜蓿EST数据库(675,750个序列;304,231,702个残基,2015年11月3日发布)[70]以下参数设置:2个缺失解理,质量精度前驱体:20 ppm,质量精度片段:±0.5 Da,固定修饰:卡脒甲基(C),动态修饰:氧化(M和P),乙酰基(蛋白质n项),双脱氢(F)和色氨酸到kynurenine。为确保蛋白质鉴定,至少需要两个指定的多肽通过mascot计算得分≥25,并且这些多肽应在至少80%的重复中被鉴定出来。吉祥物数据导入PROGENESIS QI蛋白质组学(非线性动力学)软件进行定量分析。定量结果采用单因素方差分析进行统计评价p值(p≤0.05)以及1.5的折叠变化,显示了丰度显著不同的蛋白质。在定量分析中,只考虑独特的多肽。观察到显著变化的蛋白质被人工验证以避免假阳性鉴定。亚细胞位置由TargetP在线工具确定[71]使用标准参数。因此,当根据文献预测到分泌信号肽或发现亚细胞定位时,将蛋白质视为细胞壁靶向蛋白。鉴定出的细胞壁蛋白按照Duruflé等人的方法按功能分类。2017 [29].
实时定量PCR (qPCR)
根据制造商的说明,使用RNAqueouse™Kit (Life Technologies)从五个生物重复中提取RNA。RNA用3m醋酸钠和100%异丙醇纯化,随后用70%乙醇洗涤,然后在无rnase的水中重悬。使用NanoDrop®ND-1000分光光度计(Thermo Fischer Scientific)测定浓度和质量(A260/280和一个260/230比率在1.9和2.5之间)。提取的1 μg RNA经DNase处理(TURBO DNA-free™Kit, Life Technologies)并逆转录(PrimeScript™RT Reagent Kit;Perfect Real Time, TAKARA Bio Inc)。将得到的cDNA在1/10 Tris-EDTA缓冲液(Sigma-Aldrich)中稀释10倍,并在−20°C保存,直到进一步使用。
紫花苜蓿基因索引及表达图谱数据库[70]利用开源工具为感兴趣的基因设计特定的引物对(www.bioinformatics.nl目录/ primer3plus / primer3plus.cgi,https://eu.idtdna.com/calc/analyzer).PAL和CAD引物对均取自文献[31].引物效率在基因表达分析之前进行评估(附加文件)2:表S1)。所有qPCR反应均在96孔板中使用7500快速实时PCR系统(Life Technologies)进行,如其他地方所述[27].所有详细资料均按发表实时荧光定量PCR实验所需最少资料[72]显示在附加文件中2:表S2。基因表达量按2——∆Cq相对于具有最高表达的样本的方法。所得数据用平均值2归一化——∆Cq通过GrayNorm算法选取三个最稳定的内参基因的值[7310个测试者中[31].
所有的值都是相对于对照样本表示的。用a评估显著性t以及与p值≤0.05。归一化相对表达数据聚类(非中心Pearson相关,完全链接)[74],并显示为热图[75].
细胞壁残基的分离
将来自5个生物重复的足量深冷冻植物材料粉末与40 mL 80%甲醇混合,超声10分钟,在室温下摇4小时。随后将匀浆离心(3700 g),用80%乙醇通过漩涡/离心循环将颗粒洗涤5次。将分离得到的细胞壁残基(CWRs)干燥(45°C, 24 h),以分析木质素、细胞壁组成、PME活性测定和果胶甲基化为原料。
从干细胞壁连续提取单糖
分离的CWRs (90 mg)在1.5 mL 0.1 M醋酸缓冲液(pH 5.0)中80℃孵育20 min,然后用10 μL α-淀粉酶和10 μL淀粉葡萄糖苷酶在37℃震动过夜消化,去除样品中的淀粉。加入6 mL 100%冷乙醇停止反应。样品在- 20℃下保存3 h,随后在100%乙醇中洗涤三次,并在室温下干燥。从分离的细胞壁材料中提取15 mg用于顺序提取,在每个提取步骤后保留上清,剩余的颗粒用于下一个提取步骤(图2)。5).
第一步提取3次,1.5 mL水,99°C, 1000 rpm, 2小时,含有水溶性多糖。第二次提取用0.1% EDTA (pH 7.5)在99°C, 1000 rpm下进行3次,以溶解果胶。第三次和第四次提取分别用1 M氢氧化钾(KOH)和4 M KOH进行,并加入10 mM硼氢化钠(NaBH)4).两个提取步骤都在20°C, 1000 rpm下孵育2小时,提取的主要是半纤维素。透析前,分别用75 μL和300 μL乙酸中和1 M和4 M KOH组分的pH值。
使用分子量临界值为0.5-1.0 kD的Float-A-Lyzer®G2设备(Spectrum Laboratories)对提取物进行透析。用10%乙醇和H清洗设备2O透析前按厂家说明书进行。所有透析步骤均在不断搅拌下进行。4 M KOH馏分首先在中和的1 M KOH溶液中透析(2小时),随后与1 M KOH馏分一起转移到中和的0.25 M KOH溶液中(2小时)。最后,所有四个部分都针对H进行透析过夜2O和冻干(阿尔法1-4 LD加,基督)。分离得到的CWR、4个冷冻干燥馏分和顺序提取的最后剩余颗粒在500 μL 2 M TFA中99℃水解2.5 h。样品在冰上冷却,离心(10,000 g, 3分钟),上清液以2倍和100倍稀释进行分析。
定量结果通过离子层析耦合脉冲安培检测(ICS 5000+, thermodionex)获得。金电极的电压保持在0.1 V,持续0.4 s, 0.02 s内降低到−2 V, 0.01 s内增加到0.6 V, 0.07 s内降低到−0.1 V。以氯化银电极为参比。采用两种色谱方法对所有单糖进行分离。洗脱液由超纯水和氢氧化钠(NaOH)制备。第一种方法:在CarboPac PA20色谱柱(3 × 150 mm +保护柱3 × 30 mm, thermodionex)上注入5 μL, 30℃(0.5 mL min)−1).梯度从12 mM NaOH开始,持续10分钟,2分钟内增加到300 mM,并保持在300 mM,持续5分钟。第二种方法:1 μL注入CarboPac SA10-4 μm色谱柱(2 × 250 mm +保护柱2 × 50 mm, thermodionex), 45℃(0.38 mL min)−1).梯度从1mm NaOH开始,持续5分钟,在3分钟内增加到198 mM,并在此条件下保持2分钟。
PME活性测定
PME活性测定如前所述[76].任何由PME活性释放的甲醇被醇氧化酶转化为甲醛。在第二种反应中,甲醛与紫色形成复合物,产生紫色。用不同浓度的甲醇生成标准曲线。将制备好的CWR 10 mg加入200 μL 1 M NaCl中,4℃摇1 h。随后将样品离心(13200 g, 10分钟,4°C),回收上清液用于PME活性测定。PBS中果胶含量为100 μL (0.64 mg mL)−1), 10 μL乙醇氧化酶(0.01 U μL−1)和50 μL PME样品。反应在30°C下孵育10 min后,加入200 μL紫癜(5 mg mL−1加入0.5 N NaOH),在30°C下孵育30分钟。最后,550 μL H2加入O,在550nm处测定吸收。对于这两种条件,在两个技术重复中分析和测量了五个生物重复。
果胶甲基化
甲基化果胶的水解和所得甲醇的测定如前所述[77略作修改。简单地说,在5 mg分离的CWR中加入300 μL的1 M KOH,在室温下孵育30 min。果胶水解物用1 M磷酸中和(7.0 pH),体积调节为1 mL。对于提取物中甲醇的测定,遵循与PME活性测定相同的规程。
干细胞壁木质素的提取与表征
使用HACH LT200系统,用2.6 mL 25%的乙酰溴在冰醋酸中消化5 mg CWR,在50°C下消化2小时。样品在冰上冷却,转入10 mL 2 M NaOH + 12 mL冰醋酸中。用冰醋酸冲洗反应管,加入1.75 mL 0.5 M羟氯化铵。用冰醋酸调整每个体积至30 mL,离心(3000 g, 15 min),分光光度法(280 nm,消光系数ε = 22.9 g)测定木质素含量−1L cm−1).
木质素的表征采用上文所述的硝基苯氧化法[69,78].用双(三甲基硅基)三氟乙酰胺对10mg CWR进行硝基苯氧化后的产物进行衍生化,并用气相色谱-质谱联用(GC-MS)进行分析。色谱柱为HP-5MS (30 m × 0.25 mm, 0.25 μm,安捷伦),色谱柱为7890B-5977A GC-MS(安捷伦)。以水杨酸- d4为内标。
乙烯生物合成途径化合物的测定
从50 mg细粒植物原料中提取80%甲醇,在500 μL低温条件下进行萃取。为了定量,加入D4-ACC (250 pmol, Olchemim Ltd.)和D3-Methionine (1000 pmol, Sigmar-Aldrich)。加入半毫克OASIS HLB 0.3 μm固相块状填料(WATERS)进行粘结。用离心(14000 g, 4°C, 10分钟)去除包装材料和细胞碎片。用ES分析ACC代谢产物和前体+UPLC-MS/MS (ACQUITY TQD, WATERS),采用ACQUITY UPLCr BEH Amide 1.7 μm色谱柱。洗脱液为0.1%甲酸水溶液2ACN (B)中O (A)和0.1%甲酸。梯度为:梯度0 ~ 2 min: 15.0% A, 85.0% B;2-5.8 min:线性梯度为35.0% (A), 65.0% B;5.8-6.4 min:线性梯度至80.0% A, 20.0% B;A为80.0%,B为20.0%,直到7min。流速0.4 mL min−1.注射量为6 μL,采用部分回路注射方式。选择用于多反应监测的特定过渡(停留时间0.034 s。D4-ACC为106.10 > 60.20(锥:14.0,碰撞能量10.0)和106.10 > 88.00(锥:14.0,碰撞能量8.0);蛋氨酸150.00 > 104.00(锥15.0,碰撞15.0);153.00 > 107.00(锥14.0,碰撞10.0)用于d3 -蛋氨酸;189.00 > 130.00(锥16.0,碰撞12.0)丙二醇- acc;232.00 > 148.00(锥16.0,碰撞12.0)谷氨酰胺- acc;jasmonyl-ACC为295.00 > 148.00(锥16.0,碰撞12.0),SAM为399.40 > 250.00(锥16.0,碰撞15.0)。用CI法分析ACC的数量−五氟苯溴衍生化后的GC-MS/MS [79].数据以皮摩尔每克鲜重(pmol g FW)表示−1).
数据和材料的可用性
质谱蛋白质组学数据已通过PRIDE存入ProteomeXchange Consortium [80使用数据集标识符PXD009670和https://doi.org/10.6019/PXD009670
缩写
- 4 cl:
-
4-coumarate连接酶
- ACC 1:
-
Aminocyclopropane-1-carboxylic酸
- 雨:
-
乙腈
- 华:
-
ACC-oxidase
- ACS:
-
ACC合酶
- AmBic:
-
碳酸氢铵
- Ara:
-
阿拉伯糖
- 摘要::
-
Coumarate 3-hydroxylase
- C4H:
-
Cinnamate-4-hydroxylase
- Ca:
-
钙
- 计算机辅助设计:
-
肉桂醇脱氢酶
- CCoAOMT:
-
Caffeoyl-CoA 3-O-methyltransferase
- CCR:
-
肉桂酰辅酶a还原酶
- Cd:
-
镉
- COMT的:
-
Caffeate O-methyltransferase
- CSE:
-
咖啡基莽草酯酶
- Ctr:
-
控制
- CWP:
-
细胞壁颗粒
- 轨:
-
细胞壁残基
- DW:
-
干重
- F5H:
-
Ferulate 5-hydroxylase
- Fuc:
-
植物种子
- 加:
-
半乳糖
- 联欢晚会:
-
半乳糖醛酸
- 气相:
-
气相色谱-质谱联用
- 相关:
-
葡萄糖
- GlcA:
-
葡萄糖醛酸
- HCT:
-
Hydroxycinnamoyl转移酶
- HG:
-
Homogalacturonan
- KOH:
-
氢氧化钾
- LC:
-
液相色谱法。
- 男人:
-
甘露糖
- 满足:
-
甲硫氨酸
- 女士:
-
质谱分析
- 氢氧化钠:
-
氢氧化钠
- 朋友:
-
苯丙氨酸ammonia-lyase
- 法:
-
苯丙氨酸
- 中外职业:
-
果胶methylesterase
- ppm:
-
百万分之一
- 鲁柏:
-
Rhamnogalacturonan
- Rha:
-
鼠李糖
- ROS:
-
活性氧
- 山姆:
-
S-adenosylmethionine
- 扫描电镜:
-
均值的标准误差
- 组织:
-
三氟乙酸
- XGA:
-
Xylogalacturonan
- Xyl:
-
木糖
参考文献
- 1.
潘杰,潘建平,李志强,李志强,等。镉污染对人体健康的影响。环境地球化学卫生,2010;32:1-12。https://doi.org/10.1007/s10653-009-9273-2.
- 2.
副水手长GI。植物细胞壁蛋白。植物化学学报,1998;29(4):389 - 397。https://doi.org/10.1146/annurev.arplant.49.1.281.
- 3.
Albenne C, Canut H, Hoffmann L, Jamet E.植物细胞壁蛋白:大量的数据,但逃逸呢?蛋白质组。2014;2:224-42。https://doi.org/10.3390/proteomes2020224.
- 4.
Scheller HV, Ulvskov P.半纤维素。植物学报,2010;https://doi.org/10.1146/annurev-arplant-042809-112315.
- 5.
于L, Mort AJ。成熟西瓜果实细胞壁木糖醛酸的部分特征:木糖基化对内聚半乳糖醛酸酶活性的抑制。生物工程学报。1996;14:79-88。https://doi.org/10.1016/s0921 - 0423 (96) 80248 - 6.
- 6.
豪氏威马MMH, Fransen CTM, Kamerling JP, Vliegenthart JFG,学校HA, Voragen AGJ。豆粕中cdta可溶性果胶物质由鼠李糖半乳糖醛酸和木半乳糖醛酸组成,不含均半乳糖醛酸。生物聚合物。2001;58:279 - 94。279年https://doi.org/10.1002/1097 - 0282 (200103) 58:3 <:: AID-BIP1005 > 3.0.CO; 2.
- 7.
杜奇切O, Driouich A, Morvan C.细胞壁结构对重金属胁迫响应的空间调控:镉诱导的均半乳糖醛酸甲基酯化模式的改变。张志强,2010;https://doi.org/10.1093/aob/mcp306.
- 8.
杨晓燕,杨晓燕,杨晓燕,Günthardt-Goerg MS。镉在耐镉柳叶片中的定位及其对镉的影响(柳树viminalisl .)。环绕。电子学报2006;58:25-40。https://doi.org/10.1016/j.envexpbot.2005.06.012.
- 9.
Paynel F, Schaumann A, Arkoun M, Douchiche O, Morvan C.镉处理亚麻下胚轴细胞壁果胶甲基酯酶和过氧化物酶异构体的时间调控。安·波特。2009;104:1363-72。https://doi.org/10.1093/aob/mcp254.
- 10.
Douchiche O, sorret -Morvan O, Chaïbi W, Morvan C, Paynel F.“Hermes”亚麻幼苗耐镉特性:细胞壁的贡献。臭氧层。2010;81:1430-6。https://doi.org/10.1016/j.chemosphere.2010.09.011.
- 11.
Dronnet VM, Renard CMGC, Axelos MAV, Thibault JF。果胶结合重金属:选择性、定量和表征。生物工程学报。1996;14:535-40。https://doi.org/10.1016/s0921 - 0423 (96) 80283 - 8.
- 12.
植物细胞壁对微量金属的反应:多糖重塑及其在防御策略中的作用。植物学报。2011;33:35-51。https://doi.org/10.1007/s11738-010-0581-z.
- 13.
麦克杜格尔GJ。亚麻纤维木质化过程中细胞壁相关过氧化物酶的变化。植物化学。1992;31:3385-9。https://doi.org/10.1016/0031 - 9422 (92) 83691 - q.
- 14.
Elobeid M, Göbel C, Feussner I, Polle A.镉对杨树生长素生理和木质化的干扰。中国科学(d辑),2012;https://doi.org/10.1093/jxb/err384.
- 15.
王晓明,王晓明,王晓明,等。镉和铜对豌豆叶片抗氧化能力、木质化和生长素降解的影响(Pisum一l .)幼苗。中华医学杂志,2005;328:23-31。https://doi.org/10.1016/j.crvi.2004.10.001.
- 16.
Rodríguez-Serrano M, Romero-Puertas MC, Zabalza A, Corpas FJ, Gómez M, Del Río L A, Sandalio LM。镉对豌豆氧化代谢的影响(Pisum一l .)的根源。体内活性氧和一氧化氮积累的成像。工厂。细胞环境。2006;29:1532-44。https://doi.org/10.1111/j.1365-3040.2006.01531.x.
- 17.
桑达利奥LM,达卢佐HC, Gómez M,罗梅罗-普尔塔斯MC,德尔Río LA。镉对豌豆生长和氧化代谢的影响。中国机械工程学报,2001;42(2):326 - 326。https://doi.org/10.1093/jexbot/52.364.2115.
- 18.
帕萨迪F, Penel C, Dunand C.执行悖论:植物过氧化物酶如何修饰细胞壁。植物科学进展2004;9:534-40。https://doi.org/10.1016/j.tplants.2004.09.002.
- 19.
范霍梅,李志强,李志强,李志强。木质素的生物合成与结构研究。植物科学进展。2010;https://doi.org/10.1104/pp.110.155119.
- 20.
R. Vanholme, I. Cesarino, K. Rataj, Y. Xiao, L. Sundin, G. Goeminne, H. Kim, J. Cross, K. Morreel, P. Araujo, L. Welsh, J. Haustraete, C. McClellan, B. Vanholme, J. Ralph, G.G. Simpson, C. Halpin, W. Boerjan一个rabidopsis.科学。2013;341:1103-06。https://doi.org/10.1126/science.1241602.
- 21.
Hyodo H,杨顺峰。乙烯增强豌豆幼苗苯丙氨酸解氨酶的合成。植物物理学报,47(1971):765-70。https://doi.org/10.1104/PP.47.6.765.
- 22.
柯宁,谢林根,范格伦斯维尔德,库柏。乙烯与金属应力:小分子,大影响。前沿植物科学,2016;7:23。https://doi.org/10.3389/fpls.2016.00023.
- 23.
Schellingen K, Van Der Straeten D, Vandenbussche F, Prinsen E, Remans T, Vangronsveld J, Cuypers A.镉诱导乙烯生产及其响应拟南芥依靠ACS2而且ACS6基因的表达。BMC植物生物学。2014;14:214。https://doi.org/10.1186/s12870-014-0214-6.
- 24.
酚化感化学物质对黄瓜根苯丙氨酸解氨酶乙烯依赖性活性和木质素形成的影响。环境科学学报,1999;23(2):344 - 344。
- 25.
Printz B, Guerriero G, Sergeant K, Audinot J- n, Guignard C, Renaut J, Lutts S, Hausman J- f。结合组学揭示铜营养对紫花苜蓿的影响(紫花苜蓿)茎代谢。植物细胞物理学报。2016;57:407-22。https://doi.org/10.1093/pcp/pcw001.
- 26.
王志强,李志强,王志强,等。紫花苜蓿茎秆细胞壁蛋白质组学分析。中国植物科学,2012;3:艺术。279.https://doi.org/10.3389/fpls.2012.00279.
- 27.
Gutsch A, Keunen E, Guerriero G, Renaut J, Cuypers A, Hausman J- f, Sergeant K.长期接触镉会影响影响细胞壁结构的蛋白质的丰度紫花苜蓿茎。中国生物医学工程学报,2018;20(3):344 - 344。https://doi.org/10.1111/plb.12865.
- 28.
Ha CM, Escamilla-Trevino L, Yarce JCS, Kim H, Ralph J, Chen F, Dixon RA。咖啡基莽草酯酶在单木酚生物合成中的重要作用Medicago truncatula.植物J. 2016; 86:363-75。https://doi.org/10.1111/tpj.13177.
- 29.
Duruflé H, Clemente HS, Balliau T, Zivy M, Dunand C, Jamet E.细胞壁蛋白质组学分析拟南芥成熟的茎。蛋白质组学。2017;17:1-5。https://doi.org/10.1002/pmic.201600449.
- 30.
Sterling JD, Atmodjo MA, Inwood SE, Kumar Kolli VS, Quigley HF, Hahn MG, Mohnen D.功能识别拟南芥果胶生物合成均半乳糖醛酸半乳糖醛基转移酶。自然科学进展,2006;23(3):344 - 344。https://doi.org/10.1073/pnas.0600120103.
- 31.
格列罗,李盖,豪斯曼JF。非生物胁迫下的苜蓿纤维素合成酶基因表达:RT-qPCR规范化指南。PLoS One. 2014;9:e103808。https://doi.org/10.1371/journal.pone.0103808.
- 32.
杨顺峰,Hoffman NE。乙烯在高等植物中的生物合成及其调控。为基础。植物物理,1984;35:155-89。https://doi.org/10.1146/annurev.pp.35.060184.001103.
- 33.
郭志强,李志强,李志强,李志强。非生物胁迫对细胞壁代谢的影响。植物。2015;4:112 - 66。https://doi.org/10.3390/plants4010112.
- 34.
非生物胁迫下细胞壁重塑。植物科学学报2015;5:第1期。771.https://doi.org/10.3389/fpls.2014.00771.
- 35.
Albrecht KA, Wedin WF, Buxton DR.苜蓿茎叶细胞壁组成和消化率。作物科学1987;27:735-41。https://doi.org/10.2135/cropsci1987.0011183X002700040027x.
- 36.
从成熟度不同的茎段分离的苜蓿细胞壁的碳水化合物组成。农业化学学报。1992;40:424-30。https://doi.org/10.1021/jf00015a012.
- 37.
Zandleven J, Sørensen SO, Harholt J, Beldman G, Schols HA, Scheller HV, Voragen AJ。木糖乳聚糖存在于各种组织的细胞壁中拟南芥.植物化学。2007;68:1219-26。https://doi.org/10.1016/j.phytochem.2007.01.016.
- 38.
志贺TM,拉霍洛FM。蚕豆细胞壁多糖(菜豆L.) -成分和结构。Carbohydr。石油。2006;63:1-12。https://doi.org/10.1016/j.carbpol.2005.06.025.
- 39.
Willats WGT, McCartney L, Steele-King CG, Marcus SE, Mort A, Huisman M, Van Alebeek GJ, Schols HA, Voragen AGJ, Le Goff A, Bonnin E, Thibault JF, Knox JP。一个木乳糖酸表位与植物细胞脱离特异性相关。足底。2004;218:673 - 81。https://doi.org/10.1007/s00425-003-1147-8.
- 40.
王志强,王志强,王志强,等。半乳糖醛酸甲基酯化反应与植物发育。植物学报。2009;2:851-60。https://doi.org/10.1093/mp/ssp066.
- 41.
Willats WGT, Mccartney L, Mackie W, Knox JP。果胶:细胞生物学及功能分析展望。植物分子生物学,2001;47:9-27。https://doi.org/10.1023/A:1010662911148.
- 42.
雷纳德CMGC,巴伦A,盖约S,德里罗JF。苹果细胞壁与天然苍白多酚的相互作用/定量及一些后果。中国生物医学杂志2001;29:15 - 25。https://doi.org/10.1016/s0141 - 8130 (01) 00155 - 6.
- 43.
leveske - tremblay G, Pelloux J, Braybrook SA, Müller K.果胶甲基酯化调控对细胞壁生物力学和发育的影响。足底。2015;242:791 - 811。https://doi.org/10.1007/s00425-015-2358-5.
- 44.
杨晓明,张晓明,张晓明,等。木本植物铝排斥和耐铝性研究进展。植物科学进展(英文版);2013;4:1-12。https://doi.org/10.3389/fpls.2013.00172.
- 45.
Colzi I, Arnetoli M, Gallo A, Doumett S, Del Bubba M, Pignattelli S, Gabbrielli R, Gonnelli c硅宾paradoxa环境科学学报(英文版),2012;https://doi.org/10.1016/j.envexpbot.2011.12.028.
- 46.
在悬浮液培养的被子植物细胞中,木葡聚糖和酸性多糖之间普遍存在共价连接。杨晓明。2005;6:1 - 9。https://doi.org/10.1093/aob/mci153.
- 47.
苔藓植物和叶生植物的原代细胞壁组成。安。波特。2003;91:1-12。https://doi.org/10.1093/aob/mcg013.
- 48.
木葡聚糖-果胶键在原生质内形成,有助于细胞壁组装,并在细胞壁中保持稳定。足底。2008;227:781 - 94。https://doi.org/10.1007/s00425-007-0656-2.
- 49.
植物苷水解酶的生理作用。足底。2008;227:723-40。https://doi.org/10.1007/s00425-007-0668-y.
- 50.
吉尔伯特HJ。植物细胞壁解构的生物化学和结构生物学。植物学报。2010;153:444-55。https://doi.org/10.1104/pp.110.156646.
- 51.
艾克尔,戴维斯。植物防御基因受乙烯调控。中国科学院学报(自然科学版),1987;https://doi.org/10.1073/pnas.84.15.5202.
- 52.
林泽,钟山,格瑞森。乙烯研究进展。中国机械工程学报。2009;30(2):344 - 344。https://doi.org/10.1093/jxb/erp204.
- 53.
王晓明,王晓明,王晓明,等。镉胁迫下向日葵和小麦叶片多胺代谢的研究进展。植物科学通报2003;https://doi.org/10.1016/s0168 - 9452 (02) 00412 - 0.
- 54.
Van de Poel B, Van Der Straeten D.植物中的1-氨基环丙烷-1-羧酸(ACC):不仅仅是乙烯的前体!植物科学进展(英文版);2014;5:1-11。https://doi.org/10.3389/fpls.2014.00640.
- 55.
Martin MN, Saftner RA。番茄果实中1-氨基环丙烷-1-羧酸n -丙二酰转移酶的纯化与鉴定。植物物理学报,1995;https://doi.org/10.1104/pp.108.3.1241.
- 56.
Van de Poel B, Bulens I, Hertog ML, Nicolai BM, Geeraerd AH。基于转录组学的番茄乙烯合成动力学模型(茄属植物lycopersicum结果:新的调控机制的发展、验证和探索。新植物,2014;202:952-63。https://doi.org/10.1111/nph.12685.
- 57.
卡斯CL,佩拉尔迪A,多德PF,莫蒂亚Y,桑托罗N,卡伦SD,布赫曼YV,福斯特CE,投掷者N,布鲁诺LC,莫斯科文OV,约翰逊ET,威尔霍特ME,普坦尼M,拉尔夫J,曼斯菲尔德SD,尼克尔森P,塞德布鲁克JC。敲除苯丙氨酸解氨酶(PAL)对植物细胞壁组成、生物量消化率及生物和非生物胁迫响应的影响Brachypodium.中国机械工程学报,2015;https://doi.org/10.1093/jxb/erv269.
- 58.
A. Finger-Teixeira, M. de L. Lucio Ferrarese, A. Ricardo Soares, D. da Silva, O. Ferrarese- filho Osvaldo,镉诱导木质化抑制大豆根系生长。生态毒理学杂志,2010;73:1959-64。https://doi.org/10.1016/j.ecoenv.2010.08.021.
- 59.
李志刚,李志刚,李志刚,李志刚。镉胁迫下植物根系抗氧化系统和分化的研究进展Medicago truncatula行。原生质。2017;254:473 - 89。https://doi.org/10.1007/s00709-016-0968-9.
- 60.
Moura JC, Bonine CA, de Oliveira Fernandes Viana J, Dornelas MC, Mazzafera P.植物非生物和生物胁迫与木质素含量和组成的变化。中国生物工程学报,2010;https://doi.org/10.1111/j.1744-7909.2010.00892.x.
- 61.
Kováčik杨晓东,杨晓东,杨晓东,等。木质素积累与酚酸的关系洋甘菊chamomilla的根源。植物细胞学报2008;27:6 5 - 15。https://doi.org/10.1007/s00299-007-0490-9.
- 62.
不同浓度镉对云杉针叶过氧化物酶活性和同工酶活性的影响。环境科学学报。2000;44:105-13。https://doi.org/10.1016/s0098 - 8472 (00) 00059 - 9.
- 63.
Cuypers A, Smeets K, Ruytinx J, Opdenakker K, Keunen E, Remans T, Horemans N, Vanhoudt N, Van Sanden S, Van Belleghem F, Guisez Y, Colpaert J, Vangronsveld J.细胞氧化还原状态作为镉和铜响应的调制器拟南芥幼苗。植物科学进展。2011;29(2):349 - 349。https://doi.org/10.1016/j.jplph.2010.07.010.
- 64.
seenji M, Lendvai Á, Miskolczi P, Kocsy G, Gallé Á, Szucs A, Hoffmann B, Sárvári É, Schweizer P, Stein N, Dudits D, Györgyey J.长期干旱适应过程中根系功能的差异:两种基因型小麦活性基因集的比较。植物学报。2010;12:871-82。https://doi.org/10.1111/j.1438-8677.2009.00295.x.
- 65.
Da Cunha A. l-苯丙氨酸解氨酶的测定表明苯丙氨酸的生物合成受l-苯丙氨酸供应和有效性的调节。植物化学。1987;26:2723-7。https://doi.org/10.1016/s0031 - 9422 (00) 83579 - 7.
- 66.
王伟,Scali M, Vignani R, Spadafora A, Sensi E, Mazzuca S, Cresti M.橄榄叶双向电泳蛋白的提取,一种含有高水平干扰化合物的植物组织。电泳。2003;24:2369 - 75。https://doi.org/10.1002/elps.200305500.
- 67.
Printz B, Dos Santos Morais R, Wienkoop S, Sergeant K, Lutts S, Hausman JF, Renaut J.植物细胞壁蛋白质组研究的改进方案。植物科学学报2015;6:第1期。237.https://doi.org/10.3389/fpls.2015.00237.
- 68.
Abdallah C, Sergeant K, Guillier C, Dumas-Gaudot E, Leclercq CC, Renaut J.优化iTRAQ标签耦合到OFFGEL分馏作为蛋白质组学工作流程,用于分析的微粒体蛋白质Medicago truncatula的根源。蛋白质组学学报2012;10:37。https://doi.org/10.1186/1477-5956-10-37.
- 69.
Behr M, Sergeant K, Leclercq CC, Planchon S, Guignard C, Lenouvel A, Renaut J, Hausman JF, Lutts S, Guerriero G.生长大麻下胚轴中单木质素衍生产物生物合成的分子调控。BMC植物生物学2018;18:1。https://doi.org/10.1186/s12870-017-1213-1.
- 70.
O 'Rourke JA, Fu F, Bucciarelli B, Yang SS, Samac DA, Lamb JAFS, Monteros MJ, Graham MA, Gronwald JW, Krom N, Li J, Dai X,赵px, Vance CP紫花苜蓿基因指数1.2:一个网络可访问的基因表达图谱,用于研究之间的表达差异紫花苜蓿亚种。BMC Genomics. 2015; 16:1-17。https://doi.org/10.1186/s12864-015-1718-7.
- 71.
根据蛋白质n端氨基酸序列预测蛋白质的亚细胞定位。分子生物学杂志2000;300:1005-16。https://doi.org/10.1006/jmbi.2000.3903.
- 72.
Bustin SA, Benes V, Garson JA, Hellemans J, Huggett J, Kubista M, Mueller R, Nolan T, Pfaffl MW, Shipley GL, Vandesompele J, Wittwer CT。MIQE指南:定量实时PCR实验发表的最少信息。临床化学。2009;55:611-22。https://doi.org/10.1373/clinchem.2008.112797.
- 73.
Remans T, Keunen E, Bex GJ, Smeets K, Vangronsveld J, Cuypers A.通过逆转录定量PCR分析可靠的基因表达:报告和最小化数据准确性的不确定性。植物学报。2014;26:3829-37。https://doi.org/10.1105/tpc.114.130641.
- 74.
Eisen MB, Spellman PT, Brown PO, Botstein D.全基因组表达模式的聚类分析和显示。自然科学进展,1999;29(3):344 - 344。
- 75.
沙尔丹哈AJ。Java Treeview -可扩展的微阵列数据可视化。生物信息学。2004;20:3246-8。https://doi.org/10.1093/bioinformatics/bth349.
- 76.
朱晓峰,雷国军,姜涛,刘勇,李国祥,郑世杰。细胞壁多糖参与磷缺乏诱导的cd排斥拟南芥.足底。2012;236:989 - 97。https://doi.org/10.1007/s00425-012-1652-8.
- 77.
王志强,王志强,王志强,等。乙醇氧化酶法测定果胶中甲醇的含量及其应用。食品化学学报。1986;34:597-9。
- 78.
Billa E, Tollier MT, Monties B.碱性硝基苯氧化小麦秸秆木质素单体组成的表征:温度和反应时间的影响。中国食品农业科学。1996;72:250-6。
- 79.
smetts R, Claes V, Van Onckelen HA, Prinsen E.植物组织中1-氨基环丙烷-1-羧酸的气相色谱耦合质谱提取与定量分析。中国生物医学工程学报(英文版);2003;https://doi.org/10.1016/s0021 - 9673 (02) 01817 - 4.
- 80.
Perez-Riverol Y, Xu QW, Wang R, Uszkoreit J, Griss J, Sanchez A, Reisinger F, Csordas A, Ternent T, Del-Toro N, Dianes JA, Eisenacher M, Hermjakob H, Vizcaíno JA。PRIDE检查工具套件:向蛋白质组学数据标准格式和蛋白质交换数据集质量评估的通用可视化工具迈进。Mol Cell Proteomics, 2016; 15:305-17。https://doi.org/10.1074/mcp.O115.050229.
确认
我们特别感谢Céline Leclercq执行LC-MS分析和Audrey Lenouvel执行IC和GC-MS分析以及他们的日常技术支持。我们感谢Marc Behr在木质素和单木质素分析期间的协助。我们感谢哈瑟尔特大学Ann Cuypers教授团队对我们进行基因表达分析的大力支持和帮助。
伦理批准和同意参与其中
不适用。
资金
这项工作得到了FNR和FWO的支持,是双边项目CadWALL (FNR/FWO项目INTER/FWO/12/14)的一部分。
作者信息
从属关系
贡献
AG, KS, JFH和AC设计实验。AG完成了所有的实验工作,分析和数据解释。GG和EK参与了RT-qPCR的实验设置。KS有助于蛋白的鉴定和定量。JR提供和管理技术设备。EP执行了ACC判定并起草了ACC判定的技术部分。KS严格地修改了手稿,并对数据的解释和讨论做出了贡献。所有作者修改并批准了最终版本的手稿。
相应的作者
道德声明
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
A.古奇,K.中士,E.柯南。et al。长期接触镉是否影响果胶多糖在细胞壁的组成紫花苜蓿茎吗?。BMC植物生物学19,271(2019)。https://doi.org/10.1186/s12870-019-1859-y
收到了:
接受:
发表:
关键字
- 长期接触镉
- 紫花苜蓿
- 无标记蛋白质定量
- 基因表达
- 细胞壁
- 木质素
- 果胶methylesterase