抽象的
背景
的生长-调节因素(平)家庭编码含有两个保守域,QLQ和WRC的植物特异性转录因子。该家庭成员在植物开发和压力响应过程中发挥重要作用。虽然平已经在各种植物物种中被鉴定出来,我们仍然对其知之甚少平大豆科(甘氨酸最大).
结果
在本研究中,22通用汽车平通过对大豆基因组数据库的检索,鉴定出14条染色体和1个支架,并根据系统发育关系将其聚类为5个亚群。GmGRFs同一亚群具有相似的基序组成和基因结构。同时性分析表明,大规模重复在扩展过程中起着关键作用gmgrf.家庭。组织特异性表达数据表明GmGRFs在生长组织中,包括茎尖分生组织、发育中的种子和花中均有表达,表明GmGRFs在植物生长发育中起关键作用。在表达分析的基础上GmGRFs在荫凉的条件下,我们发现了全部GmGRFs对阴影压力有反应。大多数GmGRFs遮荫处理后大豆叶片的叶绿素含量降低。
结论
一起参加,这项研究系统地分析了该研究的表征gmgrf.家族及其在大豆发育和阴胁迫反应中的主要作用。进一步研究其功能GmGRFs在大豆的生长,发展和胁迫耐受性,特别是在阴凉压力下,将是有价值的。
背景
生长调节因子(growth - regulated factors, GRFs)是调控植物生长、发育和非生物胁迫反应的植物特异性转录因子[1,2,3.,4,5].第一个平,名叫OSGRF1,从深水稻(栽培稻);的表达OSGRF1由赤霉素(gibberellin, GA)诱导,并以GA依赖的方式介导茎伸长[6].大量研究表明,GRF蛋白的n端有两个保守结构域,QLQ和WRC。QLQ (Gln, Leu, Gln)结构域作为蛋白-蛋白互作特征,可与grf互作因子(GIF)互作[7],而植物特异性WRC (Trp, Arg, Cys)结构域由C3.H基序用于DNA结合和核定位信号(NLS) [8].与n端氨基酸残基序列的保守性相比,grf的c端区域是可变的,有研究表明c端区域具有反式激活活性[7,8,9].此外,一些保守度较低的基序,如TQL和FFD,通常存在于grf的C端区域[10].
由于grf是与发育相关的转录因子,所以它通过调节细胞增殖来调节叶片的形状和大小并不奇怪[11,12].过度的AtGRF1,AtGRF2和AtGRF5导致了比野生型更大的叶片拟南芥,而树叶平突变体,如grf3-1,grf5-1,grf1-1 / grf2,grf2 / grf3和grf1/2/3,比WT [1,2,11,12].此外,平也调节根的生长、花的发育和种子的大小[9,13,14,15].除了GRF, gif也参与了叶子大小和结构的控制。与野生型相比gif1更窄更小[7,16].生化分析表明,GRF和GIF在体内结合形成转录复合物,调节细胞增殖,最终控制叶片大小[5,16].此外,已有研究表明,microRNA miR396直接抑制的表达平通过转录后调节[11,14].本构超表达的拟南芥miR396a和miR396b的异种表达PTC-MIR396C.(从杨树trichocarpa),ATH-MIR396A.(从拟南芥) (烟草)显著降低mRNA水平平并导致更窄更小的叶子,模仿拟南芥grf1/2/3[17,18,19,20.].因此,转录水平平被miRNA-GRF-GIF级联严格定量调控。
光是一种重要的环境因子,在植物的生长发育中起着至关重要的作用,并最终决定作物产量[21].然而,在玉米(玉米)大豆(甘氨酸最大),大豆冠层内的光环境因低于玉米冠层而发生变化,使大豆处于遮荫胁迫(由光量和红光:远红光比的降低引起)[22,23].此外,作物的密集种植模式也导致相邻幼苗之间的遮荫胁迫[24].以前的研究表明,大豆形态特性在遮荫条件下显着变化,导致植物高度增加,产量下降,减少根长度[23,25,26].值得注意的是,当大豆对遮荫胁迫作出反应时,叶片扩张也受到抑制[27,28].然而,在遮荫条件下叶片发育的具体调控机制仍然是未知的,特别是在遮荫条件下平family-mediated通路。
在本研究中,22通用汽车平从大豆基因组中分离出来。系统地分析了它们的序列特征、染色体分布、系统发育关系、基因结构、保守基序组成和同位性。基于这些发现,他们的表达谱GmGRFs在各种植物和生殖组织中被记录在一起。此外,我们还分析了表达式模式GmGRFs在阴影压力条件下。这些结果不仅可以帮助我们更好地了解的功能通用汽车平但也将为通过基因改造改良作物,特别是大豆奠定基础。
结果
识别Gmgrfs.
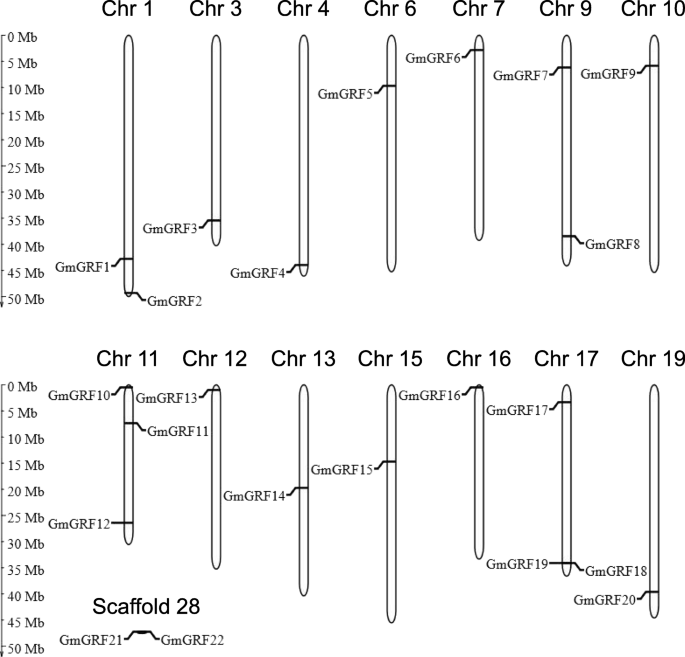
基于WRC域和QLQ域的隐马尔可夫模型(HMM),共有22个域GmGRFs从大豆基因组中鉴定,命名为gmgrf1- - - - - -GmGRF22根据它们在染色体上的位置1).的编码序列(CDS)的长度GmGRFs由927 bp (GmGRF10)至1830 bp (GmGRF19).相应地,GmGRF10是最小的GmGRF,有308个氨基酸残基,而最大的GmGRF是GmGRF19(609个氨基酸残基)。这些假定的GmGRFs的理论分子量(MW)范围为34.58 ~ 66.90 kDa,等电点(pI)范围为6.35 (GmGRF13) ~ 9.10 (GmGRF1)1).
GmGRFs不均匀地分布在染色体上。二十GmGRFs分布在14条染色体和2GmGRFs位于脚手架d_28上(图。1).在14条染色体中,11号染色体和17号染色体所包含的数目最多GmGRFs每一个都有三个基因。1号和9号染色体都携带两个GmGRFs每一个,但只有一个gmgrf.在第3、4、6、7、10、12、13、15、16和19条染色体上均观察到。1).
gmgrf的序列分析和系统发育分析
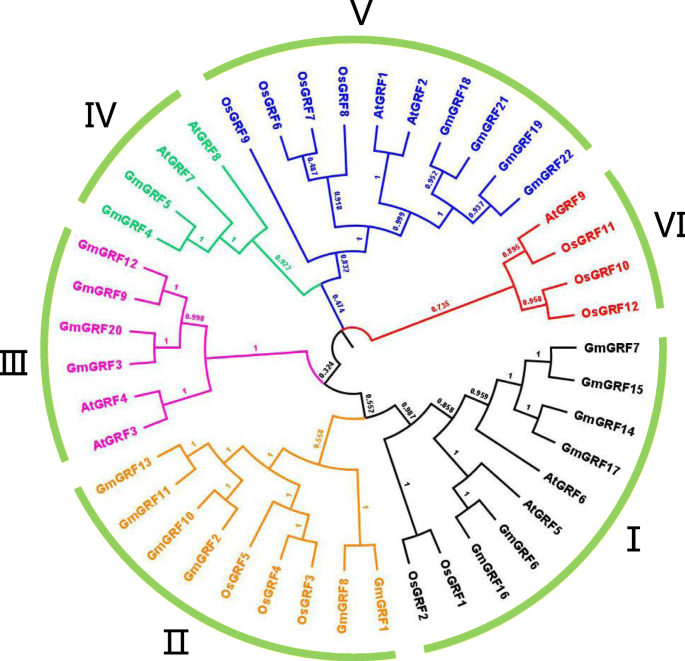
所有gmgrf在其n端区域包含保守的QLQ和WRC域(附加文件1:图S1)。为了深入了解大豆(22)、水稻(12)和水稻(12)中grf之间的进化关系拟南芥(9)、MEGA 7.0软件构建邻居连接系统发生树。如图所示。2,将43个不同种的grf聚类为6个亚群(I-VI)。6个亚组中有5个包含gmgrf,而亚组VI只有AtGRF和OsGRF成员。在6个亚组中,亚组IV和VI相对较小,各只有4个grf。相比之下,子组I和V包含的grf数量最多(各10个),其次是子组II(9个)、III(6个)。系统发育树显示gmgrf与atgrf的亲缘关系比与osgrf的亲缘关系更密切,这可能与大豆和osgrf的亲缘关系有关拟南芥是双子叶植物。
结构分析GmGRFs
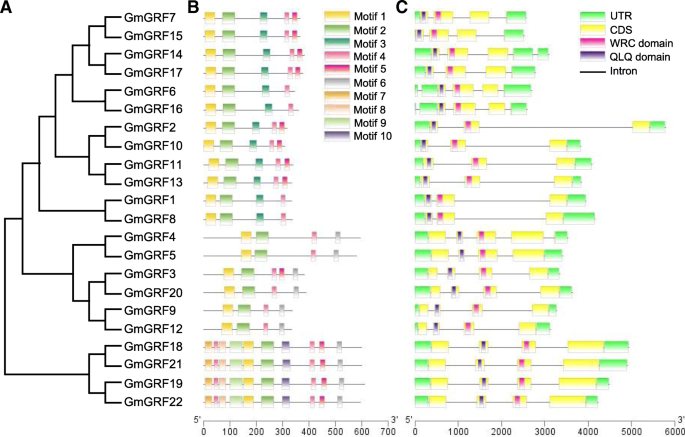
为了进一步探讨GmGRFs之间的进化关系,我们构建了系统发育树,分析了GmGRFs的基因结构和基序特征GmGRFs(无花果。3.).根据图。2在美国,gmgrf可以分成5组。很明显,22GmGRFs包含2到4个内含子(6个基因有2个内含子,12个基因有3个内含子,4个基因有4个内含子)(图2)3.c).的保守结构GmGRFs与来自其他植物物种的那些类似,其中大多数基因包含三个内含子[29,30.,31].个体的长度GmGRFs内含子长度的差异在一定程度上反映了不同基因的长度。比如最长的基因,gmgrf2.,大小为5.7 kb,主要是因为内含子总长度为4.8 kb。
利用多重EM for Motif Elicitation (MEME)网络服务器识别GmGRFs的保守Motif(图。3.b和附加文件2:表S1)。所有gmgrf中都含有motif 1和motif 2,在其n端被注释为GRF特异结构域QLQ和WRC。每个GmGRF都有4 ~ 10个保守基序,其中V子群(GmGRF18、GmGRF19、GmGRF21和GmGRF22)的grf包含的基序数量最多。属于同一亚群的gmgrf具有相似的基序组成(如GmGRF4和GmGRF5, GmGRF18和GmGRF21)。此外,一些主题只出现在某些特定的亚群中。例如,motif 3是I和II亚群特有的,而motif 7、8、9和10是v亚群特有的。总体而言,基因结构和motif特征有力地支持了GmGRFs的系统发育关系。
同线性分析GmGRFs
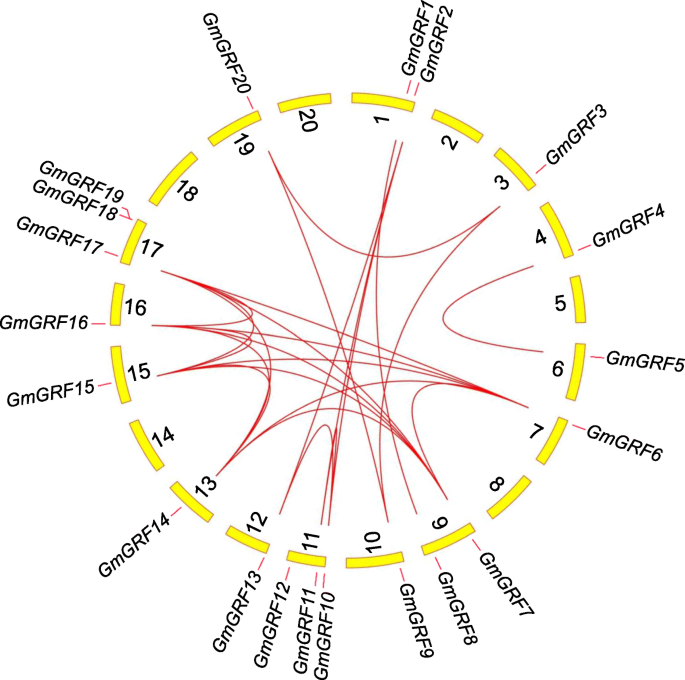
基因复制在增加基因的数量和随后的演化中起着重要作用。例如,超过90%的监管和发育基因拟南芥基因组被复制了[32].为了分析重复事件GmGRFs,采用MCScanX (Multiple collinear Scan toolkit X)软件。最终,我们发现22人中有19人GmGRFs(86.36%)分布在重复区域,表明这些基因是由大规模重复事件、全基因组重复(WGD)或节段重复(Fig. 2)产生的。4和附加文件3.:表S2)。此外,根据以前的方法[33],GmGRF18-GmGRF19和GmGRF21-GmGRF22分别属于染色体17和scaffold 28,被鉴定为串联复制基因。进一步,我们计算了这些重复基因对的非同义替换率(Ka)和同义替换率(Ks)。结果表明,Ka/Ks比值最大gmgrf.对小于1,说明这些GmGRFs经历了净化选择过程。
表达谱的GmGRFs
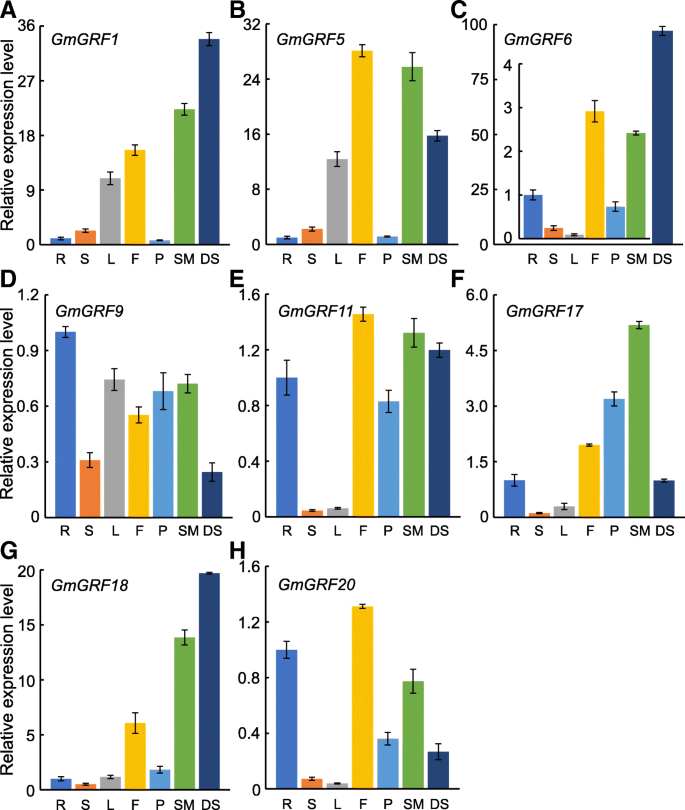
根据Figs的结果分析。2,3.和4,我们选择了8个GmGRFs属于不同亚组的GA响应和组织特异性表达分析。ga3.处理后,选取表达水平均为8GmGRFs被下调(附加文件4:图S2)。然后我们研究了它们的表达模式GmGRFs在七个大豆组织中(根、花、茎、荚、叶、茎顶端分生组织和正在发育的种子)。如图所示。5,尽管所有GmGRFs在7个组织中均有表达,不同基因的转录水平在不同组织间差异很大。一般来说,GmGRFs在生长组织如发育中的种子、花和茎尖分生组织中有高表达。的GmGRFs的表达水平gmgrf1,GMGRF6和GmGRF18在发育的种子中含量最高。5在这三个基因中,GMGRF6在发育中的种子中更优先表达,比在根中表达高100倍。然而,在花中,转录水平gmgrf5,GmGRF11和GmGRF20最高(无花果。5b, e, h)。GMGRF9在根中大量表达,而GmGRF17拍摄顶端商品中的转录水平最高(图。5d和f)GmGRFs在调节不同大豆组织的生长和发展方面。
表达谱的GmGRFs响应遮荫压力
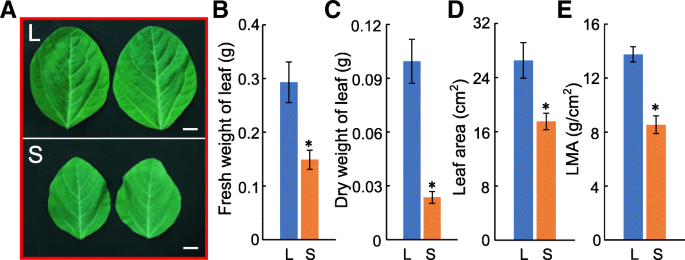
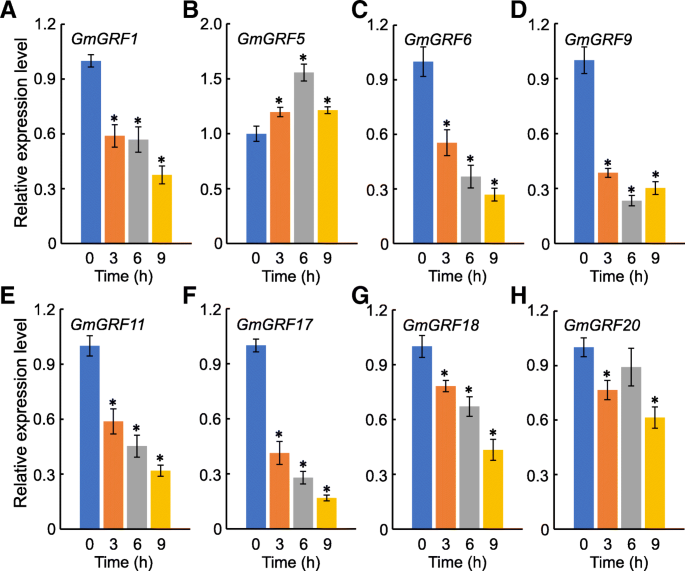
大豆植株形态在遮荫胁迫下发生了很大的变化,这被称为遮荫回避综合征(SAS),包括叶面积和重量的减少,以及茎过度伸长(图2)。6和附加文件5:图S3)。以前的研究已经证明了这一点平在调节叶片大小和植物对非生物胁迫(包括ABA和渗透胁迫)的响应中发挥重要作用[4,34,35,36].因此,为了进一步探讨GmGRFs在遮荫条件下,我们测量了八种植物的转录水平GmGRFs中存在。结果表明,所有的转录GmGRFs受荫蔽的影响。几乎全部的表达gmgrf.s在遮荫胁迫下显著下调,但下调程度不同。7).在这些基因中,转录水平GMGRF9和GmGRF17受到更强烈的压制,而GmGRF20表现出最弱的转录抑制。另一方面,表达水平gmgrf5在阴影胁迫条件下上调(图。7b).基于的表达模式GmGRFs,gmgrf5,GMGRF9和GmGRF17可能在遮荫条件下调节叶片生长的重要作用。
讨论
作为植物特有基因家族的成员,平在植物生长发育中起重要作用,特别是在调节器官大小方面[5,11,15].最近对水稻的研究表明OSGRF4.通过促进细胞分裂和氮素吸收效率可以提高水稻产量[37,38,39].因此,有必要了解grf在植物发育和逆境响应中的调控机制。到目前为止,平家庭已在各种植物中确定(附加文件6:表S3),如拟南芥, 白饭,玉米,芸苔属植物显著,素类,山茶花Sinensis.,杨树trichocarpa和Pyrus×bretschneideri[1,8,40,41,42,43].然而,关于grf在大豆中的作用的信息很少。
为了更好地了解其特点和功能GmGRFs,我们研究了gmgrf.通过生物信息学分析、qRT-PCR分析、植物形态分析等方法鉴定其属。在目前的研究中,共有22个GmGRFs通过搜索大豆基因组数据库来识别,并显示所有推定的Gmgrfs包含QLQ和WRC域(表1和附加文件1:图S1)。系统发育分析显示22GmGRFs可以根据它们的进化关系聚类为5个子群(图。1).外显子-内含子的结构和基序排列与系统发育分析一致GmGRFs属于不同的子群体表现出较低的身份。
许多研究表明,基因复制不仅可以增加数量平,同时也是产生新基因的途径,这种现象有利于使植物适应各种环境[44,45,46,47].的确,扩张平家庭主要发生在基因重复,特别是大规模重复(WGD或节段性重复)[5,30.,43].一直以来,在目前的研究中GmGRFs分布在复制块中,表明WGD或分段重复在扩展方面发挥了重要作用。gmgrf.家庭。此外,大豆含有更多平而不是另一个豆类,Medicago truncatula,一个模型植物(附加文件6:表S3和附加文件7:表S4)。这可能主要是由于在大豆基因组的演变(58和1300万年前)期间发生的两个WGD事件,而且Medicago基因组仅在5800万年前经历过一次WGD事件[48,49].值得注意的是,这一现象在其他大豆基因家族中也存在,如同源结构域-亮氨酸拉链和同源盒基因家族[50,51].总之,这些结果表明,大规模重复是普遍存在的gmgrf.家庭。
之前的研究报道过平是植物生长和发育的关键调节因子[5,34].例如,过度表达AtGRF5导致叶子增大,而叶子的拟南芥grf5突变体比WT的变窄[12].一般来说,表达水平平在积极生长的组织中比在成熟组织中要高[29].事实上,一些研究已经揭示,随着器官的老化,转录水平平减少(19,41].在本研究中,我们发现了GmGRFs在茎尖分生组织、发育中的种子和花中高度表达。5).有趣的是,在所有被选中的8人中GmGRFs,gmgrf1,GMGRF6和GmGRF18在培养的种子中表达高度表达,表明这些基因可能在种子发育中起重要作用。除了发展种子,平对花的发育和根的生长也很重要[9,52,53,54].相应地,我们发现有些GmGRFs,如GMGRF9,GmGRF11和GmGRF20在花和根中大量表达。基因表达分析表明,GmGRFs可能在大豆组织的生长发育中发挥重要作用。
光不仅为植物提供能量,而且调节植物的生长发育[55,56].植物可以通过光敏色素、隐色素和促光蛋白等光感受器系统感知光环境的变化[57,58,59].作为固定的光自养生物,植物需要与邻居竞争光、营养和其他资源。例如,当暴露在邻近植物的阴影胁迫下时,适应开放范围的植物(例如:拟南芥(如大米和大豆)会产生避光反应,导致避光综合症[60,61,62].避荫反应有助植物在荫凉条件下存活[61,63].然而,在农业生产的背景下,避免阴影会导致作物产量下降[63].例如,在玉米-大豆间作系统中,由于邻近较高的玉米植株产生的遮荫胁迫,大豆产量显著下降[23].在目前的调查中,几乎所有的转录gmgrf.被测基因在遮荫处理下下降(图。7),这表明GmGRFs具有关于植物阴响应的隐性功能。
叶片是光合作用的主要组织,其大小直接影响光合效率[64,65].大量研究表明,叶面积是由许多与细胞分裂和扩张相关的基因调控的[36].其中,平可以通过控制细胞增殖来调节叶面积[65].此外,UV-B辐射通过降低叶绿素的表达来抑制叶片生长平年代拟南芥和玉米66,67].形态分析表明,在遮荫胁迫下,大豆叶片大小、叶面积、干重和鲜重均显著下降。6),并与之相一致的是,几乎所有人的表达水平gmgrf.遮荫条件下基因表达下调(图。7).鉴于grf对多种植物细胞增殖的积极调节作用[68,这些结果是一致的(图。6和7).有趣的是,在荫凉条件下,大多数的表达水平GmGRFs被抑制,gmgrf5在这些条件下,转录被上调。因此,进一步研究其功能gmgrf5遮荫胁迫可能有助于间作大豆叶面积的增加,从而有可能提高大豆产量。
结论
在本研究中,我们系统地分析了其基本特征和功能GmGRFs.利用QLQ和WRC这两个与GRF相关的保守结构域HMM,从大豆基因组中共鉴定出22个gmgrf。这些GmGRFs分布在14条染色体和1个支架上,根据系统发育关系可分为5个亚群。通过进一步分析,我们发现GmGRFs同一亚群具有相似的基因结构和基序组成。基因重复分析表明,大规模重复和串联重复都有助于基因的扩增,特别是前者gmgrf.家庭。qRT-PCR研究结果表明GmGRFs参与大豆的生长发育和遮荫反应。重要的是,我们发现了一些可能有用的基因,比如gmgrf1,gmgrf5和GMGRF6通过分析gmgrf.家庭。这些结果将为未来的研究提供基础平在大豆。
方法
植物材料及遮荫处理
本研究以我国西南地区流行的大豆品种南豆12为材料。南豆12的种子来源于四川省南充农业科学研究所。在相对湿度为65%、光周期为12 h(25°C)/12 h(20°C)、光强为380 μmol m的环境中培养大豆植株−2 s−1.为了分析通用汽车平在大豆的不同组织中,我们收集了根源(播种后16 d),茎(播种后16 d),叶(播种后16 d),拍摄顶端商品(播种后16 d),花(播种后36 d),豆荚(播种后44d)和显影种子(播种后60 d)。对于GA处理,用100μmGa喷洒六天的大豆幼苗3.分别在0、3、6和9 h收获大豆幼苗下胚轴。此外,探索转录谱GmGRFs在阴影应力下,采用黑色尼龙网和远红发光二极管(LED)来调节光环境(光强度和质量)[26].将生长10 d的大豆幼苗移栽到113 μmol m的遮荫环境中−2 s−1光合有效辐射(PAR)为0.4,红:远红光比(R/FR)为0.4。分别在遮荫处理后0、3、6和9 h采集大豆幼苗第一批复叶。所有样品立即在液氮中冷冻,然后在−80°C下保存以供进一步分析。
遮阳治疗后七天,来自不同盆的10个大豆幼苗用于分析形态特征。通过imagej软件测量第一复合叶片的叶面积。还测定播种高度,茎直径,叶和根部鲜重。随后,将叶,茎和根部暴露于105℃以进行0.5小时,然后在80℃下干燥直至恒定重量。最后,还计算了每面积(LMA)的干重,根枝比和叶片质量。
鉴定GmGRFs
大豆蛋白序列和基因组注释从Phytozome数据库下载(http://www.phytozome.net/).WRC域(PF08879)和QLQ域(PF08880)的HMM分别从PFAM数据库(http://pfam.xfam.org/),并用HMMER软件预测gmgrf。然后,将这些蛋白序列(e值≤1e−10)用于构建特定于大豆的HMM,用于识别Gmgrfs [69].最后,只有当预测蛋白含有经SMART软件验证的QLQ和WRC保守域时,才被认为是GmGRFs (http://smart.embl-heidelberg.de/)和PFAM数据库。所有公认的gmgrf.使用MapGene2Chrom web v2 (http://mg2c.iask.in/mg2c_v2.0/).
序列和系统发育分析
的外显子-内含子分布模式GmGRFs使用Dual system Plotter软件(https://github.com/CJ-Chen/TBtools)[70,71].为了预测GmGRFs的MW和pI, ExPASy蛋白质组学服务器(https://web.expasy.org/protparam/)被使用[72].利用MEME在线程序预测GmGRFs的保守基序(http://meme-suite.org/tools/meme)[73].通过Clustal W分析GmGRFs的多序列比对[74].使用Mega 7.0软件用于使用泊松模型,成对删除和1000个引导复制的邻接方法构建系统发育方法[75].
基因复制和进化分析
使用默认参数的MCScanX程序分析的复制事件GmGRFs[76].根据McScanx的结果,通过KAKS_CALCULATOR 2.0软件计算重复基因的非同义替代率(KA)和同义替代率(KS)[77].
基因表达分析
总RNA制备、第一链cDNA合成及qRT-PCR检测如前所述[78].根据制造商的方案,用DNA酶I处理总RNA,然后使用莫里狼白血病病毒逆转转录酶(每次反应200单位200单位,将2μg总RNA进行反转转录。QRT-PCR使用Vazyme™ACEQ QPCR Sybr Sybr Green Master Mix在QuantStudio 6 Flex实时PCR系统(Thermo Fisher Scientific,USA)上进行[79].大豆管家GmTubulin作为内参基因,每个反应有3个重复。10 μL反应混合物包括5 μL Vazyme™AceQ qPCR SYBR Green Master混合物、0.2 μL正向引物、0.2 μL反向引物、1 μL cDNA模板和3.6 μL无dnase ddH2O. QRT-PCR反应程序设定如下:30℃,然后40℃,60℃,60℃持续30℃。表达水平GmGRFs采用比较CT方法计算[80].qRT-PCR引物序列列于附加文件8:表S5。
统计分析
在这项研究中,学生的t采用Microsoft Excel软件-test分析不同处理之间的差异。P< 0.05为差异有统计学意义。
数据和材料的可用性
本研究中使用和分析的所有数据均包含在文章及其附加文件中。
缩写
- 阿坝:
-
脱盐酸
- 遗传算法:
-
吉布林素
- GIF格式:
-
GRF-interacting因素
- 平:
-
生长调节因子
- 嗯:
-
隐马尔可夫模型
- 卡:
-
产生的替代率
- ks:
-
同义替代率
- 引领:
-
发光二极管
- LMA:
-
每面积叶质量
- MCScanX:
-
多重共线性扫描工具包
- MEME:
-
多重EM Motif Elicitation
- 兆瓦:
-
分子量
- NLS:
-
核定位信号
- 票面价值:
-
光合有效辐射
- pI:
-
等电点
- R / FR:
-
红色:远红光比
- 情景应用程序:
-
荫蔽躲避综合征
- WGD:
-
全基因组复制
- WT:
-
野生型
参考
- 1.
AtGRF家族在水稻叶片和子叶生长发育中起重要作用拟南芥.工厂J. 2003; 36(1):94-104。
- 2.
Kim JH, Lee BH。增长-调节因子4.的拟南芥叶子,子叶和拍摄顶端单位是所必需的。J植物BIOL。2006; 49(6):463-8。
- 3.
王志强,王志强,王志强,等。miR396/GRF网络在花发育的器官类型规范中的作用,支持的异位表达populus trichocarpa mir396c在转基因烟草。植物医学杂志。2013;15(5):892 - 8。
- 4.
Kim JS,Mizoi J,Kidokoro S,Maruyama K,Nakajima J,Nakashima K,等。拟南芥生长调节因子7用作脱落酸和渗透胁迫响应基因的转录阻遏物,包括DREB2A.植物细胞,2012;24(8):3393 - 405。
- 5.
Omidbakhshfard Ma,Proost S,Fujikura U,Mueller-roeber B.生长调节因子(GRF):一个小型转录因子家庭,具有植物生物学的重要功能。莫尔植物。2015; 8(7):998-1010。
- 6.
水稻赤霉素诱导的一种新基因及其在水稻茎秆生长中的调控作用。植物杂志。2000;122(3):695 - 704。
- 7.
Kim Jh,Kende H.转录共同激活因子ATGIF1,参与调节叶片生长和形态拟南芥.中国科学(d辑:地球科学)2004;101(36):13374-9。
- 8.
崔D,金JH,肯德H.全基因组分析OsGRF在水稻中编码植物特定推定转录活化剂的基因家族(栽培稻l .)。植物生理学报。2004;45(7):897-904。
- 9.
刘华,郭胜,徐勇,李超,张震,张东,等。osmir396d调控的osgrf通过与目标结合在水稻花器官发生中发挥作用osjmj706.和OSCR4..植物杂志。2014;165(1):160 - 74。
- 10.
张东风,柏霖,贾国强,张涛,戴JR,李俊生,等。玉米GRF转录因子和GIF转录辅激活因子编码基因的分离与鉴定(玉米l .)。植物科学。2008;175(6):809 - 17所示。
- 11.
Debernardi JM, Mecchia MA, Vercruyssen L, Smaczniak C, Kaufmann K, Inze D, et al.;转录后的控制平通过microRNA miR396和GIF协同激活的转录因子影响叶片大小和寿命。植物j . 2014; 79(3): 413 - 26所示。
- 12.
Horiguchi G ., Kim G- t ., Tsukaya H.转录因子AtGRF5和转录共激活因子AN3调控叶原基细胞增殖拟南芥thaliana. Plant J. 2005;43(1): 68-78。
- 13.
Hewezi T,Maier Tr,Nettleton D,Baum TJ。的拟南芥microRNA396 -GRF1/GRF3在包囊线虫感染过程中,调控模块在根细胞的重编程中起发育调节器的作用。植物杂志。2012;159(1):321 - 35。
- 14.
梁光国,何华,李勇,王飞,于丹。microRNA396介导植物雌蕊发育的分子机制拟南芥.植物杂志。2014;164(1):249 - 58。
- 15.
李胜,高飞,谢轲,曾旭,曹勇,曾建军,等。OsmiR396c-OsGRF4-OsGIF1调控模块决定水稻的粒级和产量。植物生态学报;2016;14(11):2134-46。
- 16.
Lee Bh,Ko JH,Lee S,Yi L,Pak Jh,Kim JH。的拟南芥GRF相互作用因子基因家族在决定器官大小和多种发育特性方面具有重叠功能。植物杂志。2009;151(2):655 - 68。
- 17.
Liu D, Song Y, Chen Z, Yu D. miR396异位表达的抑制平目的基因表达和改变叶片生长拟南芥.physiol植物。2009; 136(2):223-36。
- 18.
杨飞,梁光国,刘东,于东。拟南芥MiR396介导在转基因烟草中的叶子和花的发展。J植物BIOL。2009; 52(5):475-81。
- 19.
Rodriguez RE, Mecchia MA, Debernardi JM, Schommer C, Weigel D, Palatnik JF。细胞增殖的控制拟南芥由微rna miR396。发展。2010;137(1):103 - 12所示。
- 20。
金正日JH。植物中GRF-GIF转录复合物的生物学作用和进化示意图。BMB众议员52 2019;(4):227 - 38。
- 21。
Valladares F, Niinemets Ü。耐阴性,是植物复杂性质和后果的关键特征。生态学报2008;39:237-57。
- 22。
杨飞,黄胜,高锐,刘伟,杨涛,王旭,等。大豆间作系统幼苗生长与光量和红远红比的关系。中国农业科学(英文版);2014;
- 23。
刘学军,杨飞,杨涛,等。玉米-大豆间作体系中大豆光环境、形态、生长及产量的变化农田作物公约2017;200:38-46。
- 24。
灵活的艺术:如何逃离阴凉处、盐和干旱。植物杂志。2014;166(1):5-22。
- 25.
吴勇,龚伟,杨飞,王旭,杨伟。玉米-大豆套作对大豆遮荫及后续恢复的响应。植物科学进展。2016;19(2):206-14。
- 26.
杨飞,范勇,吴旭,程勇,刘强,冯磊,等。生长素与赤霉素的比值作为光强和品质的信号调节大豆的生长和物质分配。植物学报。2018;9:56。
- 27.
Kozuka T, Horiguchi G, Kim GT, Ohgishi M, Sakai T, Tsukaya H.不同生长响应拟南芥遮荫期叶片和叶柄受光感受器和糖的调节。植物生理学杂志。2005;46(1):213-23。
- 28.
龚伟,齐平,杜建军,孙旭,吴旭东,宋超,等。遮荫对间作大豆叶片大小抑制的转录组分析。《公共科学图书馆•综合》。2014;9 (6):e98465。
- 29.
王飞,邱宁,钱东,李军,张颖,李华,等。大白菜生长调节因子家族的全基因组鉴定与分析(芸苔属植物拉伯l . ssp。pekinensis.).BMC基因组学。2014;15:807。
- 30.
张建军,李志,金军,谢旭东,张辉,陈强,等。烟草生长调节因子家族的全基因组鉴定与分析(烟草).基因。2018; 639:117-27。
- 31.
吴超,黄春华,严毅,丁志强,等。对GRF家族的全基因组分析表明,它们参与了木薯的非生物胁迫反应。基因。2018;9(2):110。
- 32.
引用本文:马晓峰,德博特,雷依斯,卡斯纽夫,范·蒙塔古,柯伊伯,等。真核生物中基因和基因组复制的建模。中国科学院院刊2005;102(15):5454-9。
- 33.
刘C,谢T,陈C,栾A,Long J,Li C等。菠萝中R2R3-MYB转录因子家庭的基因组组织和表达分析(菠萝comosus).BMC基因组学。2017;18(1):503。
- 34.
王志强,王志强,王志强,等。生长调节因子和grf -互作因子对植物生长发育的调控作用。acta photonica sinica . 2015;66(20): 6093-107。
- 35.
林国强,王志强,王志强,等。番茄GRF转录因子家族基因响应非生物胁迫和植物激素的分子特征及表达谱分析中华医学杂志。2017;18(5):1056。
- 36.
张海龙,张海龙,张海龙,等。叶片大小调控:细胞分裂和扩展的复杂协调。植物科学进展,2012;17(6):332-40。
- 37.
李树华,田勇,吴轲,叶永强,于军,张建军,等。为可持续农业调控植物生长-代谢协调。自然。2018;560(7720):595 - 600。
- 38.
孙子,张某,王y,他q,shu f,liu h等。OSGRF4控制水稻中的晶粒形状,穗长和种子。J Intent Plant Biol。2016; 58(10):836-47。
- 39.
胡建军,王颖,方勇,曾丽,徐建军,余辉,等。一个罕见的等位基因GS2可以提高水稻的粒级和产量。摩尔。2015;8(10):1455 - 65。
- 40.
刘旭,郭立新,金立峰,刘玉珍,刘涛,范玉华,等。柑橘叶片和果实发育调控的生长调节因子基因的鉴定和转录谱。中国人民大学学报(自然科学版);2016;43(10):1059-67。
- 41.
吴志军,王伟林,庄杰(山茶花Sinensis.)平和GIF基因家族。功能整合基因组学。2017;17(5):503-12。
- 42.
马杰克,建HJ,杨B,陆克,张斧,刘P等。基因组分析和表达剖析平油菜的基因家族(芸苔属植物显著l .)。基因。2017;620:36-45。
- 43。
曹勇,韩勇,金强,林勇,蔡勇平中国梨(Pyrus bretschneideri Rehd)、杨树(人口众多)、葡萄(葡萄),拟南芥和米饭(栽培稻).植物学报2016;7:1750。
- 44。
大豆乙二醛酶基因家族的全基因组分析和表达谱分析(甘氨酸最大)表明其发育和非生物胁迫特异性反应。BMC Plant Biol. 2016;16:87。
- 45。
陈旭,陈志,赵华,赵艳,程斌,向勇。大豆HD-zip基因家族的全基因组分析及盐和干旱胁迫下的表达谱分析。《公共科学图书馆•综合》。2014;9 (2):e87156。
- 46。
Kim S, Park M, Yeom SI, Kim YM, Lee JM, Lee HA,等。辣椒的基因组序列为辣椒的辛辣性进化提供了深刻的见解辣椒物种。Nat麝猫。2014;46(3):270 - 8。
- 47。
大豆查尔酮合成酶家族的全基因组鉴定与定位甘氨酸最大[L]稳定)。BMC Plant Biol. 2018;18:325。
- 48。
徐志强,王志强,王志强,等。古多倍体大豆的基因组序列。自然。2010;463(7278):178 - 83。
- 49.
Young ND, Debelle F, Oldroyd GE, Geurts R, Cannon SB, Udvardi MK等。的Medicago基因组提供了深入了解根瘤菌共生的进化。大自然。2011;480(7378):520 - 4。
- 50.
Belamkar V,周NT,Bharti Ak,Farmer Ad,Graham Ma,Cannon SB。大豆中HD-ZIP转录因子家庭的综合表征和RNA-SEQ分析(甘氨酸最大)在脱水和盐胁迫下。BMC基因组学。2014;15:950。
- 51.
Annapurna B,Rajesh G,Rohini G,Mukesh J. Genome-ide-Indoomox基因家族在豆类中的综合分析:鉴定,基因重复和表达分析。Plos一个。2015; 10(3):E0119198。
- 52.
刘继华,华W,杨HL,Zhan Gm,Li RJ,Deng LB等。的BnGRF2基因(GRF2-像基因芸苔属植物显著)通过调节细胞数量和植物光合作用来增加籽油产量。中国生物医学工程学报。2012;63(10):3727-40。
- 53.
JérémieB,Ghazanfar Abbas K,Jean-Philippe C,Pilar BS,Juan Manuel D,Ramiro R等人。mir396影响豆类中的菌根化和根业证活动Medicago truncatula.植物j . 2013; 74(6): 920 - 34。
- 54.
王志强,王志强,王志强,等。之间的交互增长-调节因子和KNOTTED1-像同源框转录因子家族。植物杂志。2014;164(4):1952 - 66。
- 55.
袁敏,赵玉强,张志伟,陈烨,丁长邦,袁胜。光对叶绿体生物发生中叶绿素合成基因转录的调控。植物学报。2017;36(1):35-54。
- 56.
陈志强,陈志强,陈志强,等。光信号转导与根系发育的关系。植物杂志。2018;176(2):1049 - 60。
- 57.
Keuskamp DH, Keller MM, Ballaré CL, Ronald P.蓝光调节避光。植物学报。2012;7(4):514-7。
- 58.
弗雷泽DP,海斯S,富兰克林KA。避光的感光器串扰。《植物生物学》2016;33:1-7。
- 59.
徐F,何某,张俊,毛泽东,王W,Li T等。PhotoCtivated Cry1和Phyb直接与Aux / IAA蛋白相互作用以抑制植物素信令拟南芥.摩尔。2018;11(4):523 - 41。
- 60.
Tavingo LG,Maloof Jn,Brady Sm。作物阴影避免的分子控制。CurrOp植物BIOL。2016; 30:151-8。
- 61.
陈志强,陈志强,陈志强,等。植物对动态变化环境的适应:避荫反应。Biotechnol放置2012;30(5):1047 - 58。
- 62.
范勇,陈建军,王铮,谭涛,李胜,李军,等。大豆(甘氨酸最大幼苗对遮荫的响应:叶片结构、光合作用和蛋白质组学分析。BMC Plant Biol. 2019;19:34。
- 63.
减少谷物作物的避荫反应。AoB植物。2017;9 (5):plx039。
- 64.
叶表皮在叶大小和叶肉细胞分裂速率和程度的控制中的作用。植物学报。2010;97(2):224-33。
- 65.
Omidbakhshfard MA, Fujikura U, Olas JJ, Xue GP, Balazadeh S, muller - roeber B. growth - regulation FACTOR 9负调控拟南芥通过控制叶片生长ORG3抑制叶原基细胞增殖。公共科学图书馆麝猫。2018;14 (7):e1007484。
- 66.
Romina C, Rodriguez RE, Debernardi JM, Palatnik JF, Paula C.抑制生长调节因子microRNA396通过UV-B辐射抑制细胞增殖拟南芥叶子。植物细胞。2013;25(9):3570 - 83。
- 67。
Fina J, Casadevall R, Abdelgawad H, Prinsen E, Markakis MN, Beemster GT,等。UV-B通过改变生长调节因子和赤霉素水平来抑制叶片生长。植物杂志。2017;174(2):1110 - 26所示。
- 68。
吴勇,龚伟,杨伟。遮荫通过控制大豆细胞增殖和膨大抑制叶片大小。Sci众议员2017;7(1):9259。
- 69。
Lozano R,Hamblin Mt,Prochnik S,Jannink JL。木薯基因组中NBS-LRR基因家族的鉴定和分布。BMC基因组学。2015; 16:360。
- 70.
TBtools是生物学家的一个工具箱,集成了多种hts数据处理工具和用户友好的界面。bioRxiv。2018.https://doi.org/10.1101/289660.
- 71.
谢涛,陈超,李超,刘建军,刘超,何玉梅。菠萝WRKY基因家族的全基因组研究:发育和胁迫过程中的进化和表达谱。BMC基因组学。2018;19:490。
- 72.
gsteiger E, Hoogland C, Gattiker A, Duvaud S, Wilkins MR, Appel RD, et al.;ExPASy服务器上的蛋白质鉴定和分析工具。出自:Walker JM,编辑。蛋白质组学协议手册:Humana出版社;2005.p . 571 - 607。https://doi.org/10.1385/1-59259-890-0:571.
- 73.
Bailey TL,Boden M,Buske Fa,Frith M,Grant Ce,Clementi L等。MEME SUITE:主题发现和搜索的工具。核酸RES。2009; 37:W202-8。
- 74.
Thompson JD, Higgins DG, Gibson TJ。CLUSTAL W:通过序列加权、特定位置间隙惩罚和权重矩阵选择来提高累进序列比对的灵敏度。核酸学报1994;22(22):4673-80。
- 75.
MEGA7:用于更大数据集的分子进化遗传学分析7.0版本。生物化学学报。2016;33(7):1870-4。
- 76.
王y,唐,debarry jd,tan x,li j,wang x等。McScanx:一种用于检测和进化分析的工具包,对基因同步和共线性分析。核酸RES。2012; 40(7):E49。
- 77.
张Z,李继,赵X-Q,王家,黄阁,yu J.Kaks_Calculator:通过模型选择和模型平均计算KA和KS。Genom Proteom Bioinf。2006; 4(4):259-63。
- 78.
刘锐,张华,王鹏,等。ABI4在转录和蛋白水平上介导了脱落酸和赤霉素的拮抗作用。植物j . 2016; 85(3): 348 - 61。
- 79.
周伟,陈飞,赵胜,杨超,杨春华,帅华,等。DA-6通过介导脂肪酸代谢和糖代谢促进衰老大豆种子的萌发和成苗。acta photonica sinica, 2019; 40(1): 101-14。
- 80.
Schmittgen TD, Livak KJ。采用比较C(T)法分析实时PCR数据。Nat Protoc。2008;3(6):1101 - 8。
致谢
我们要感谢我们实验室的所有成员在本手稿的准备过程中进行了宝贵的讨论。作者非常感谢中国科学院遗传与发育生物学研究所谢琦教授和他的研究小组。
资金
国家自然科学基金项目(no . 31872804, no . 31701064);国家重点研发计划项目(no . 2017YFD0201300);四川省科技计划项目(no . 2018JZ0060);
作者信息
隶属关系
贡献
KS和FC设计了本研究。FC和Y-ZY进行了大部分的数据分析和实验。X-FL、W-GZ、Y-JD、CZ和W-GL进行了部分实验。KS, FC, Y-WY分析数据并撰写手稿。所有作者阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
额外的文件1:
图S1。gmgrf的两个保守结构域QLQ和WRC的序列比对。(PDF 228 kb)
额外的文件2:
表S1。GmGRF序列中10个保守基序的表征。(PDF 23 kb)
额外的文件3:
表S2。重复的事件GmGRFs.(PDF 44 kb)
额外的文件4:
图S2。的转录水平GmGRFs对GA的回应3..家政服务GmTubulin用于内部控制。误差棒表示标准误差。星号(*)表明学生的P <0.05的显着差异t以及分析。(PDF 46 kb)
额外的文件5:
图S3。遮阳胁迫在大豆中引起阴影避免反应。(a)白光和阴影条件下大豆幼苗的代表性照片。酒吧= 100毫米。播种高度(b),茎直径(c),地上组织新鲜和干重(d,f),根新鲜和干重(e,g)和根枝比(h)。在每个条件下测量十种大豆幼苗。误差棒表示标准误差。星号(*)表示显著差异在P <0.05学生的t以及分析。L,阴影;年代,阴凉处。(PDF 134 kb)
额外的文件6:
表S3。基因组大小和平植物的数量。(PDF 32 kb)
额外的文件7:
表S4.公吨平在Medicago.(PDF 20 kb)
额外的文件8:
表S5。引物序列。(PDF 40 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
陈飞,杨勇,罗旭东。et al。大豆GRF转录因子的全基因组鉴定及表达分析gmgrf.家庭在阴影下的压力。BMC植物杂志19,269(2019)。https://doi.org/10.1186/s12870-019-1861-4
收到了:
接受:
发表:
关键字
- 生长调节因子
- 基因家族
- 阴影
- 叶大小
- 大豆
- 种子