摘要
背景
种子萌发是植物生命周期中的关键阶段,是一个复杂的生理形态发生过程。杨树是一种典型木本植物,其种子萌发的生物学变化尚未得到研究。
结果
在本研究中,我们利用新一代测序和代谢组学分析,发现了一系列在种子萌发和萌发后不同阶段存在显著差异的基因和代谢产物。的K-means方法鉴定多种转录因子,包括AP2 / EREBP,景深,淡水螯虾,涉及特定的种子萌发和萌发后阶段。加权基因共表达网络分析显示,在第3和第5阶段,细胞壁、氨基酸代谢和转运相关途径显著富集,而在糖酵解和三羧酸循环等初级代谢过程中未观察到显著富集。代谢组学分析检测到这些初级代谢过程中中间代谢物的显著变化,而有针对性的相关网络分析确定了与这些变化的代谢物最相关的基因家族成员。
结论
综上所述,我们的结果为杨树种子萌发和萌发后过程的分子网络提供了重要的见解。本研究开发的目标相关网络分析方法可用于寻找特定生化反应中的关键候选基因,为联合多组学分析提供了一种新的策略。
背景
植物种子萌发及其直接后果是一个非常复杂的生物学过程,在环境影响下,涉及一系列形态学、生理和生化变化[1,2,3.,4,5].关于拟南芥等草本植物的萌发和萌发后过程,已在生理和形态层面进行了广泛的研究[6,7,8,9],大豆[10,11,12],大米[13,14,15,16,17]和大麦[18,19,20.].近年来,一种“组学”方法已被用于获取整个代谢产物、蛋白质和基因转录物水平变化的信息[21,22,23,24,25,26,27,28].这些研究的结果为种子萌发和萌发后事件的生物学过程提供了一个综合的观点。
杨树是一种模式木本植物,人们对其发芽过程中的生理变化和形态变化等方面进行了长期的研究[29].以往杨树快速无性繁殖和组织培养的研究取得了很大的成功[30.,31].相比之下,关于杨树种子萌发(有性繁殖)的分子机制的研究较少,尽管最近出现了一些关于种子萌发与环境关系的初步报道[28,32,33,34].杨树种子萌发的分子机制及其直接后果的研究可能是阐明木本植物种子萌发过程的关键。
根据定义,种子萌发开始于成熟的干种子吸收水分,终止于胚根通过种子包膜突出。基于种子萌发过程中鲜重的变化,在以往的研究中广泛采用了三相萌发模型。该模型的三个阶段如下:I,快速吸水,只要所有基质和细胞内容物都充分水化就会发生;二、吸水有限;III,吸水增加,胚轴伸长,覆盖层突破,完成萌发(可见萌发)[1,35,36].种子随后进入发芽后阶段,直到第一片真叶扩张。在本研究中,我们以这三个阶段为基础,将杨树种子的萌发过程分为从第2阶段快速吸水到第6阶段第一片真叶膨胀的6个阶段,并将吸水前的种子定义为第1阶段。利用新一代测序和高效液相色谱-质谱(HPLC-MS/MS)技术,我们获得了杨树6个种子萌发阶段的转录组和代谢组数据。然后我们应用K-means聚类和加权基因共表达网络分析(WGCNA)来识别特定阶段的基因簇和网络模块。此外,我们发现细胞和应激反应相关基因在某些阶段富集,而糖酵解和三羧酸循环(TCA)等初级代谢过程没有明显变化。不同阶段富集模块的网络分析揭示了一系列涉及转运、细胞壁和信号的高度连接的枢纽基因。最后,目标相关网络分析(TCNA)使我们能够找到与代谢物变化潜在相关的最相关的基因家族成员。综上所述,我们的结果为进一步分析杨树种子萌发及其后续的生化和功能奠定了基础。
结果
RNA-Seq数据的全球分析
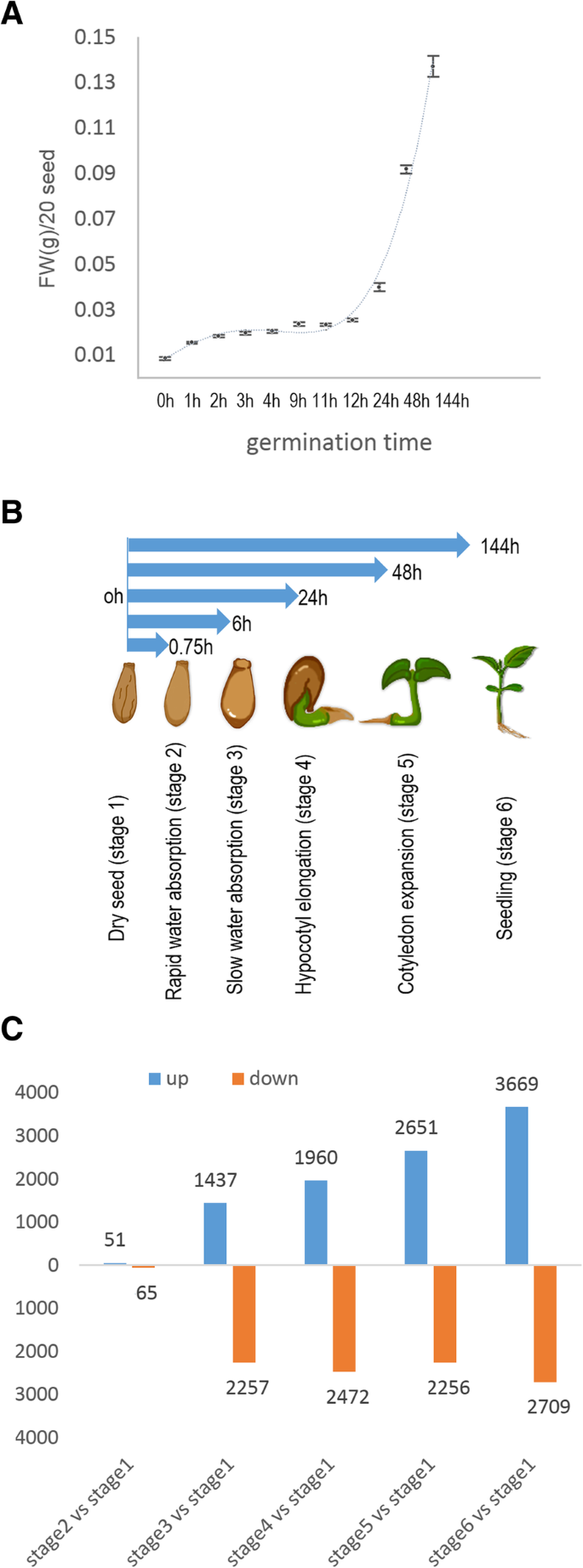
Bewley(1997)将杨树种子萌发过程分为种子萌发阶段的第2至第4阶段[1].根据吸水后种子鲜重的变化进行评估,快速吸水期和缓慢吸水期分别被定义为阶段2和阶段3(图2)。1a和附加文件1:表S1),下胚轴延长期定义为第4期。我们总共在6个阶段收集了样品:阶段2至4,干种子阶段(阶段1),子叶展开(阶段5)和真叶展开(阶段6)的萌发后阶段。实验设置的示意图如图所示。1b。
对于每个阶段的样本,每个库的平均原始读取数约为2700万次(附加文件2:表S2),其中72%的原始reads映射到杨树参考基因组。归一化读计数计算为FPKM值(每百万碱基对序列中每千碱基的期望片段数)。结果表明,共有63498个基因在种子萌发和萌发后表达,约占预测的73000个基因的90%。根据NOISeq差分表达分析结果,按fold change≥2和的标准,每对比较均鉴定出上调和下调的基因p≥0.8。观察到的转录物变化数为:1 ~ 2阶段116个(上升51个,下降65个),1 ~ 3阶段3694个(上升1437个,下降2257个),1 ~ 4阶段4432个(上升1960个,下降2472个),1 ~ 5阶段5207个(上升2651个,下降2256个),1 ~ 6阶段6378个(上升3669个,下降2709个)。与其他阶段相比,第1和第2阶段转录本数量的变化较少。杨树萌发和萌发后各时间点间表达量变化显著的基因数量如图所示。1c。
杨树种子萌发和萌发后转录组的时间表达趋势鉴定
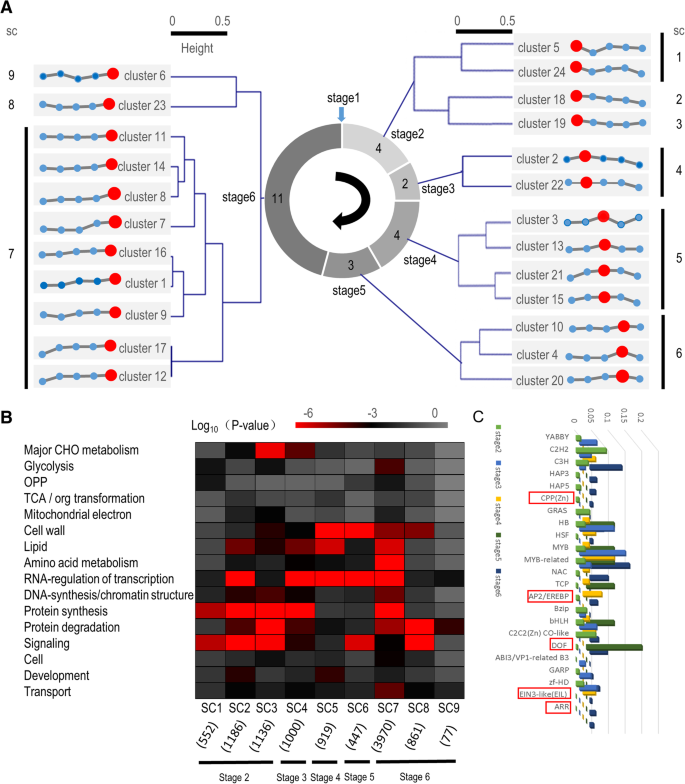
为了揭示差异表达基因(DEGs)的变异,K采用-means聚类方法对种子萌发过程中各时间点差异表达基因的RNA-Seq表达谱进行分组和可视化,共对应10148个基因。24个簇如图所示。2a,他们的基因id列在附加文件中3.:表S3。每个已鉴定的基因簇可以根据其最高表达量划分到特定的萌发阶段:簇5、18、19和24到2阶段;第2及第22组至第3阶段;第3、13、15和21组到第4阶段;第4、10和20组到第5阶段;第1、6 - 9、11、12、14、16、17和23组到第6阶段。
表达趋势相似的聚类进一步合并为9个超聚类(图2)。2a).为了了解这些超集群中的基因分布,使用MapMan工具进行富集分析以识别特定类别[37].在超簇1中,MapMan类别富集最多的是信号,其次是蛋白质合成、糖酵解和氧化磷酸戊糖通路(OPP)。超星系团2中富集最多的类别也是蛋白质合成,其次是信号、RNA转录调节、脂质和蛋白质降解。蛋白质降解在超簇3中占主导地位,其次是蛋白质合成、信号转导、主要的CHO代谢和DNA合成/染色质结构。超簇4中富集最多的类别是蛋白质合成、RNA转录调控、脂质和主要CHO代谢;在超簇5中的是细胞壁、RNA转录调控、脂质和发育。在超簇6中,最富集的类别是RNA转录调控,其次是细胞壁、信号和运输。Superfamily 7具有最多的高富集类别,包括蛋白质合成、RNA转录调控、氨基酸代谢和脂类。在超星系团8中,MapMan类别富集最多的是蛋白质降解,其次是信号、细胞壁和转运。超家族9中大部分类别富集程度较低,只有蛋白质降解和转运蛋白富集程度较高。 Noteworthily, two categories, TCA/org transformation and mitochondrial electron transport/ATP synthesis, were always lowly enriched. These results indicate that the number of active genes associated with energy, TCA, and substance conversion was basically constant (Fig.2b)。
RNA转录调控相关基因富集程度较高,多为转录因子编码基因。有五种转录因子,CPP(锌),AP2 / EREBP,面纱,加勒比海盗,景深,只在一个阶段表达(图;2c和附加文件4:表S4)。淡水螯虾转录因子在萌发早期特异表达EIN3-like(面纱)而且加勒比海盗仅在萌发末期表达(图;2c).这些结果与以往的研究一致。例如,Howell et al.(2009)发现AP2 / EREBP水稻种子萌发早期家族基因增加。该家族被认为与水稻种子萌发早期的水分吸收和ABA信号通路有关[25].这些转录因子的动态和阶段性表达模式可能反映了它们在不同萌发阶段的关键功能。
用WGCNA进行共表达网络分析
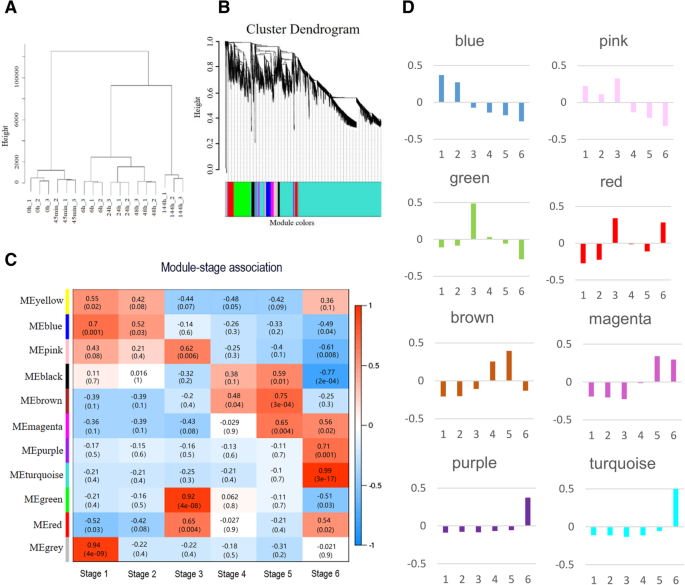
为了从整体网络的角度了解杨树种子萌发的生物学过程及其后续,采用WGCNA共表达网络分析(图2)。3.a).用所有不同阶段的deg构建共表达网络。表达模式相似的基因被归为同一模块,不同模块之间用颜色进行区分(图2)。3.b).如图所示的分层聚类树。3.a, WGCNA鉴定出10种不同的共表达模块。相关分析表明,这些模块对应于发芽或发芽后阶段特定的分布模式(图2)。3.c).与其他模块相比,如绿色模块中的基因与阶段3的相关性最高(p= 4 × 10−8,r= 0.92),而棕色模块中的基因与第5阶段(p= 3 × 10−4,r= 0.75)。粉红色模块中的基因与阶段1、2和3相对高度相关(图2)。3.c)。
模块特征基因(ME)是一个基因模块的第一个主成分,代表了除灰色模块(Miscellaneous)外的各个模块的基因表达谱。8组模块的特征基因表达谱如图所示。3.d.蓝色模块的ME在阶段1和阶段2表达量较高。绿色、粉色和红色模块的MEs在阶段3中表达水平较高,而棕色和品红模块的MEs在阶段4和5中表达水平较高。紫色和蓝绿色模块的MEs在第6阶段表达量最高。
为了了解不同模块中生物过程的变化,应用Fisher精确检验来识别每个模块中丰富的通路类别及其动员趋势。测试结果在附加文件中给出5:表S5。通过比较背景基因数量,得到不同颜色模块中富集类别的动员趋势。黄色模块中的基因与7类显著富集相关:主要CHO代谢、糖酵解、RNA转录调控、蛋白质降解、信号、发育和细胞。蓝色模块与阶段1和2显著相关,确定了12个显著丰富的类别(附加文件5:表S5)。丰富类别的数量因其他模块而异。数量最少的显著富集通路,分别在信号转导和RNA转录调控的品红和紫色模块中发现。
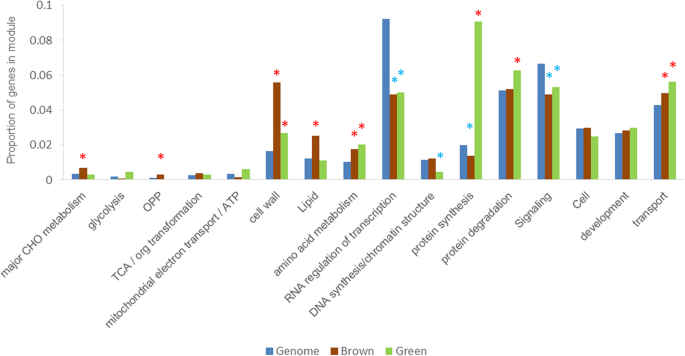
在10个模块中,绿色模块与阶段3的相关性最强,而棕色模块与阶段5的相关性最强(图2)。3.c).因此主要对这两个模块进行分析。在绿色模块中,蛋白质合成和降解途径更活跃,而在棕色模块中,蛋白质合成相关途径被抑制。在绿色模块中,蛋白质降解途径基因数量增加,但增加不显著(图2)。4).因此,蛋白质合成和降解途径的参与随萌发阶段的不同而不同。令人惊讶的是,各模块之间TCA循环通路的活性并无明显差异,这与图中的结果一致。2这意味着该途径的活性在种子萌发和萌发后都是稳定的。
棕色和绿色模块中不同路径类别的富集模式。每个途径类别的转录本频率计算为集群的百分比,并与基因组的百分比进行比较。由Fisher精确检验(p≤0.05),分别用红色和蓝色星号表示。有关所有集群中所有功能组的完整列表,请参见附加文件5表S5
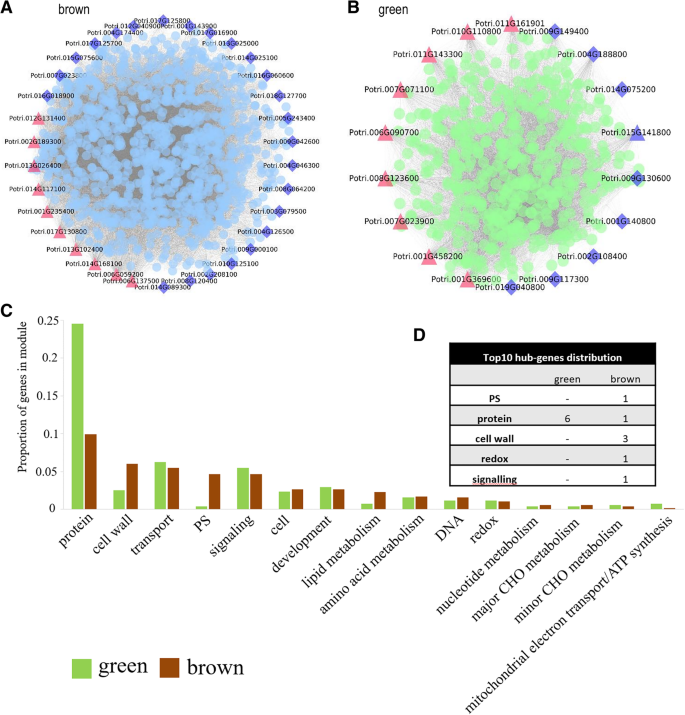
WGCNA还可以用来构建基因网络,其中每个节点代表一个基因,节点之间的连接线(称为边)代表共表达相关的基因。连通性最高的节点基因,即枢纽基因,可能在不同的模块中发挥重要作用。棕色和绿色模块网络如图所示。5分别是A和b。一些相互联系更紧密的节点基因是转录因子的节点基因。例如,potri。绿色模块中连通性最高的转录因子基因015 g141800编码ANL2(ANTHOCYANINLESS 2),属于HD-GLABRA2族的同源结构域蛋白,与拟南芥AT4G00730序列高度相似。在最近的一项研究中,该基因被认为参与了拟南芥根系发育过程的调控[38,39],在挪威云杉体胚胚芽缺陷植株中发现其表达显著降低[40].ANL2因此可能在杨树种子萌发中起发育相关的调节作用。potri。016基因,命名为g060600ZFP8(锌指蛋白8),编码一个核C2H2锌指蛋白,并被发现在棕色模块内具有高连通性。在拟南芥中,由ZFP8是赤霉素诱导种子萌发的负调节因子,在种子萌发和幼苗发育中起关键作用[41].一些相互联系较少的转录因子,如awuscher相关homeobox转录因子(potri.019 g040800)在绿色模块中被发现,被认为与水稻种子的萌发有关[25].此外,a淡水螯虾家族成员(potri.009 g000100)位于棕色模块;该转录因子可能在大豆种子萌发过程中起关键作用[42].以上所有数据都在附加文件中详细列出6:表S6。
在不同的模块中也发现了一些高度连接的功能基因。高连通性节点功能基因在棕色和绿色模块中的分布统计如图所示。5c.绿色模块中,与蛋白质、转运、信号、线粒体电子转运/ATP合成相关的高连接节点基因占主导地位,而棕色模块中与PS、细胞壁、脂质代谢相关的高连接节点基因较多。一个值得注意的问题是,这些高连通性基因不参与关键的初级代谢途径,如糖酵解、TCA和OPP。
为了了解不同模块中高连接基因的类型,我们分析了连接度分布最高的前10个节点基因(图2)。5d).绿色模块中所有高连通性基因都属于蛋白质类,而棕色模块中高连通性基因的功能分布在PS、蛋白质、细胞壁、氧化还原、信号等类别。所有功能基因id和连接都列在附加文件中7:表S7。
初级代谢物分析
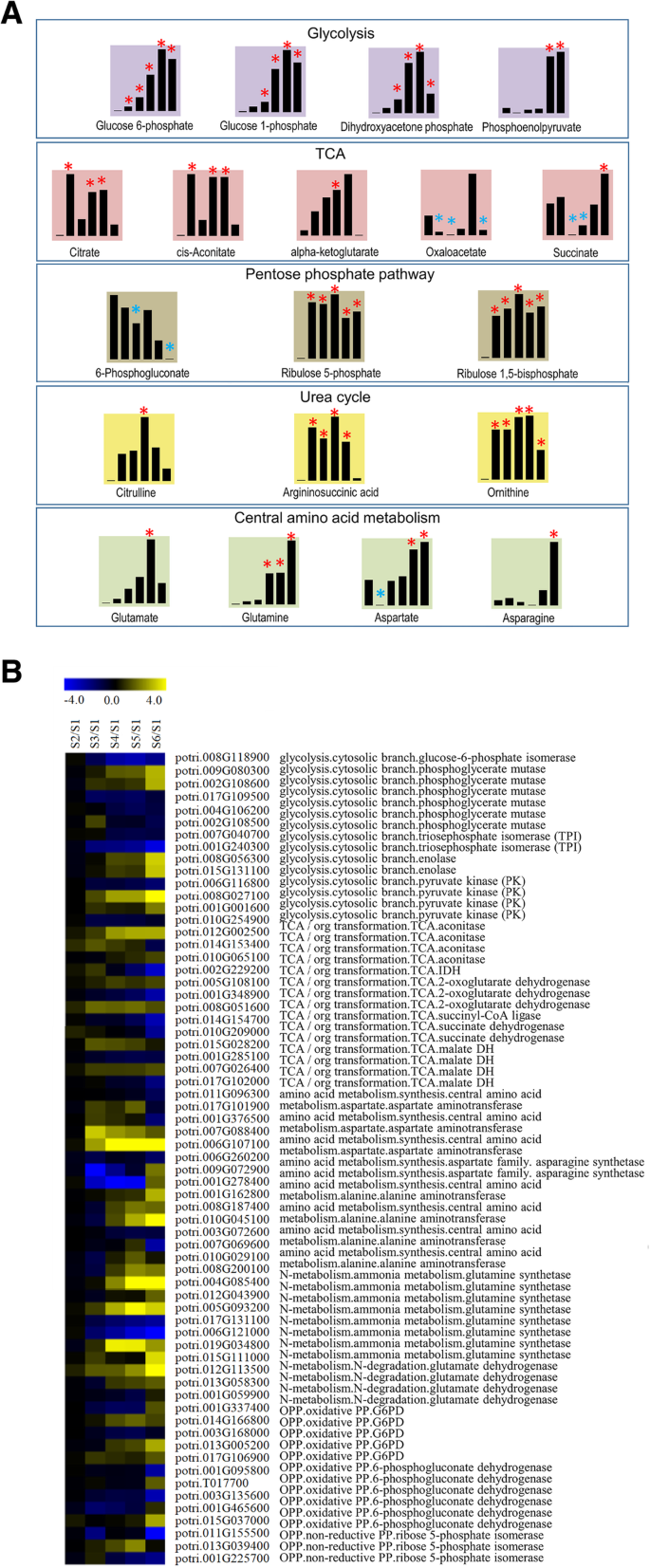
在本研究中,采用非靶向代谢组学方法检测种子萌发和萌发后不同阶段的代谢变化。由于糖酵解、TCA和磷酸戊糖通路在植物初级代谢中起着至关重要的作用,本文采用代谢组学方法研究了杨树种子萌发过程中糖酵解、TCA和磷酸戊糖通路的变化。考虑到尿素循环和中枢氨基酸代谢的重要性,也考虑了这两条途径的代谢产物。共鉴定出与上述5种途径相关的代谢产物19种。这些代谢物在至少一个阶段经历了显著的含量变化。所有代谢物及其变化规律如图所示。6a.在糖酵解途径中鉴定出四种代谢物。其中,葡萄糖1-磷酸和葡萄糖6-磷酸是己糖磷酸池的两个主要成分;前者是淀粉的分解产物,后者与糖酵解和磷酸戊糖途径密切相关。6-磷酸葡萄糖在第2阶段显著升高,而1-磷酸葡萄糖在第3阶段显著升高。两者都在第5阶段含量最高。另外两种物质是磷酸二羟丙酮和磷酸烯醇丙酮酸。磷酸二羟丙酮在第3 ~ 6阶段显著增加,而磷酸烯醇丙酮酸仅在第5和6阶段显著增加。值得注意的是,这四种代谢物的含量变化模式极其相似,在种子萌发后期,它们的含量显著增加(图2)。6a和附加文件8:表S8)。
5种代谢产物与TCA密切相关:柠檬酸,独联体-乌头酸,-酮戊二酸,琥珀酸和草酰乙酸。枸橼酸含量的变化独联体-乌头酸也有相似的趋势,即在第2、4和5阶段显著增加,而-酮戊二酸水平在第1至5阶段增加,但仅在第4阶段显著增加。草酰乙酸在第2、3和6阶段显著降低,而琥珀酸在第3和4阶段显著降低,在第6阶段显著增加。与尿素循环相关的代谢产物中,精氨酸琥珀酸在第2 ~ 5阶段显著增加,鸟氨酸在第2 ~ 6阶段显著增加,瓜氨酸仅在第4阶段显著增加。磷酸戊糖途径中的两种代谢物,5-磷酸核酮糖和1,5-二磷酸核酮糖,表现出一致的变化模式,从阶段2到6显著增加。在中央氨基酸通路中,谷氨酸在第5阶段显著升高,谷氨酰胺在第4 ~ 6阶段显著升高。天冬酰胺在第5和第6阶段显著增加,而天冬酰胺在第6阶段显著增加。
数据集成分析
为了研究种子萌发过程中初级代谢过程的特征,对整个萌发过程的转录组和代谢组数据进行了整合分析。数字6a, b和附加文件8:表S8和附加文件9:表S9显示了原代代谢产物的变化及相关基因的表达模式。我们发现编码同一种酶的许多基因表现出不同的表达模式。例如,两个波谱。015 g131100和potri。006 g116800基因编码烯醇化酶,但表达模式相反,其目标代谢物磷酸烯醇丙酮酸的变化与两种表达模式都不一致。在代谢途径如TCA循环中也观察到类似的现象。这些结果表明,杨树种子萌发过程中初级代谢的调节是非常复杂的;一个可能的原因是,主要代谢途径中酶活性的调节发生在转录后。
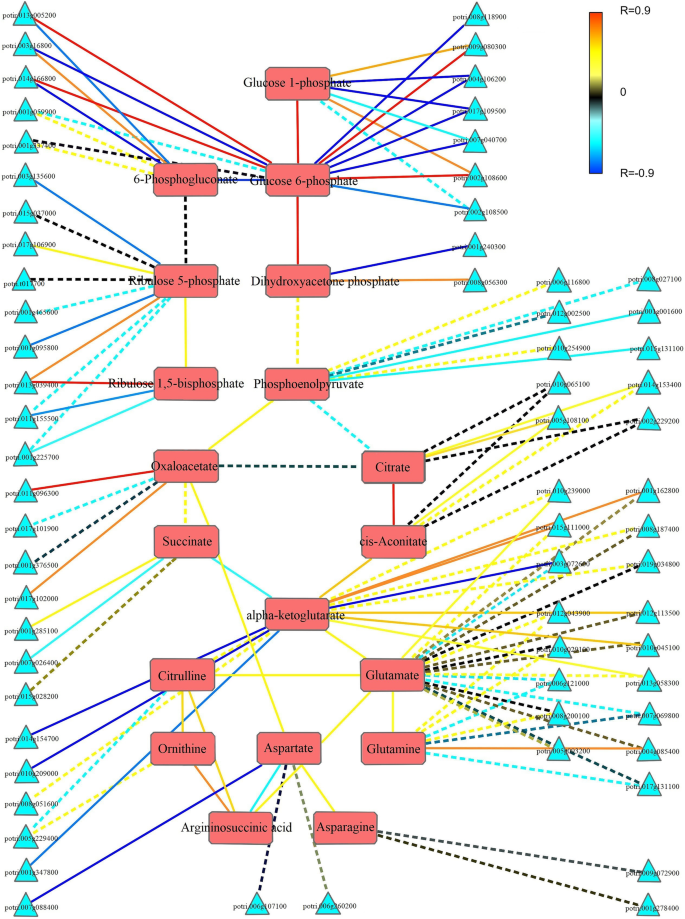
为了揭示基因及其相关代谢物的相互关系,TCNA应用于RNA-Seq和代谢组学数据的内在联系。分析的详细结果如图所示。7和附加文件10:表S10。通过有针对性的相关分析,确定了与代谢物相关性最强的家族成员。例如,磷酸烯醇丙酮酸是糖酵解途径中的中间代谢物,是烯醇化酶的产物,经丙酮酸激酶催化生成丙酮酸。对编码上述酶的基因家族成员的表达模式与磷酸烯醇丙酮酸变化趋势的相关性分析表明,potri。010 g254900和potri。006 g116800与磷酸烯醇丙酮酸高度相关。因为丙酮酸激酶。010 g254900与磷酸烯醇丙酮酸的亲和关系更为密切,该基因可能在磷酸烯醇丙酮酸的变化模式中起关键作用。
三种代谢物的变化模式之间发现了很强的正相关:α -酮戊二酸,谷氨酸和谷氨酰胺。除potri外,控制α -酮戊二酸合成和分解代谢的两个基因家族均与异柠檬酸脱氢酶和α -酮戊二酸脱氢酶基因呈负相关。008 g051600(编码-酮戊二酸脱氢)。在谷氨酸合成途径中,丙氨酸转氨酶和谷氨酸脱氢酶基因与-酮戊二酸和谷氨酸普遍呈强正相关。编码谷氨酰胺合成酶的基因通常具有与谷氨酸和谷氨酰胺高度相关的特征。
代谢途径中相邻代谢物一般具有强相关特征,且这种相关性典型为正相关。如图所示。7,大多数相邻代谢物之间存在正相关趋势,说明同一途径下代谢物的变化基本一致。而6-磷酸葡萄糖与6-磷酸葡萄糖酸、6-磷酸葡萄糖酸与5-磷酸核酮糖、磷酸烯醇丙酮酸与柠檬酸、α -酮戊二酸与琥珀酸之间则存在显著差异,且这些代谢产物含量变化呈显著负相关。
讨论
杨树是一种被广泛用于基础研究的模范木本植物。由于杨树普遍存在无性生殖,其种子萌发的分子机制及其影响尚未得到研究。在这项研究中,收集了从干种子到苗期的样本,并用于RNA-Seq和代谢组学分析。两种不同的生物信息方法,K-means和WGCNA,用于分析RNA-Seq数据。这一分析产生了一些新的见解,包括确定了一系列时间特异性模块、枢纽基因和转录因子,其中一些转录因子与之前的研究结果一致。许多胁迫、细胞壁和蛋白质相关基因与萌发和萌发后阶段有密切关系,而糖酵解、氧化磷酸化和TCA的变化不显著。进一步分析表明,这些途径中的部分代谢物在萌发的不同阶段发生了显著的变化,且在同一代谢途径下,代谢物的变化模式具有相似的特征。与代谢物含量变化相关的酶通常由多个基因家族编码,其中一些基因家族成员与代谢物变化高度相关。本研究鉴定了与杨树种子萌发和萌发后过程相关的重要基因和代谢产物,为今后的生物化学和功能研究奠定了基础。
种子的萌发过程拟南芥,大米和大豆已经被广泛研究。例如,两个转录因子基因,ZFP8而且wuscher相关homeobox,以及淡水螯虾家族成员被认为与种子萌发密切相关[25,41,42].Howell等(2009)发现水稻种子萌发后期糖代谢相关基因的转录丰度显著增加[25].对大麦种子萌发的研究表明,在吸胀后48 h,氨基酸代谢相关基因得到表达[43];这一观察结果与图中所示的结果一致。4,这表明萌发在高等植物中是一个高度保守的过程。然而,相比之下,我们发现转录因子如CPP(锌)而且景深在种子萌发的不同阶段都有特异性表达,这一现象在以前的研究中没有观察到。我们推测,这种差异是由于研究物种之间的差异造成的。
在WGCNA中,绿色模块和棕色模块的基因分别与第3阶段(慢吸水期)和第5阶段(子叶膨大期)最相关。绿色模块中高连通性节点的功能基因与蛋白质的合成和分解有关,而棕色模块中高连通性节点的功能基因与CHO、细胞壁、脂质代谢和PS有关。我们推测变化首先发生在早期蛋白质代谢通路,其中糖代谢的显著变化发生在子叶扩张期。由于WGCNA方法不允许发现与其他时期(如快速吸水或下胚轴伸长)最密切相关的基因模块,我们无法检测在种子萌发的每个阶段转录水平上发生的事件。我们计划在未来的研究中探索这个问题。
在这项研究中,我们使用了两种不同的生物信息学算法,K-means和WGCNA,用于分析转录组数据,该策略与之前草莓和草莓的研究中应用的策略相似芸苔属植物oleracea[44,45].虽然这两种方法对于发现种子萌发和萌发后不同阶段发生的重要生物学事件提供了不同的选择,但都表明糖酵解和TCA循环在转录水平上处于稳定状态。这一观察结果与之前的发现不一致[22,25,43,46,47,48,49,50,51并不能解释这两种途径代谢水平的变化。因此,我们需要确定这些代谢物变化的原因,并确定最有可能密切相关的基因。使用TCNA方法,我们能够识别与特定代谢物含量变化最密切相关的基因家族成员。这些结果为我们后续研究基因的确定提供了可能的方向,这种组合方法也有可能用于未来的多组学联合分析。
萌发过程中代谢产物的相关分析表明,最相关的代谢产物之间存在显著的正相关关系。然而,6-磷酸葡萄糖与6-磷酸葡萄糖酸盐、6-磷酸葡萄糖酸盐与5-磷酸核酮糖、磷酸烯醇丙酮酸与柠檬酸、α -酮戊二酸与琥珀酸之间存在显著差异。这些转化位于与其他代谢途径的交界处,分支代谢物和上游代谢物之间存在很强的相关性。因此,我们推断这些分支点的物质在多个主要方向上流动。这些结果可为进一步研究代谢物流动提供有益的参考。
在转录水平上,许多基因在萌发过程中经历了复杂的变化,即使编码同一酶的基因表达模式不同。然而,在代谢水平上,只观察到代谢物的一些显著变化(图。6a, b).这一结果可能是由于相对于RNA-Seq, HPLC-MS/MS无法检测到大量的低丰度代谢物。另一种可能是转录水平是一个复杂的过程:只有少数基因可能在特定的萌发阶段起关键作用;此外,转录后调控可能作为这一过程的缓冲,导致代谢水平的变化非常小[52].
结论
在本研究中,我们采用转录组合代谢组学方法研究了杨树种子萌发和萌发后的生物学过程。与之前使用的时间顺序方法相比,我们依赖于基于形态差异的策略,这可以更好地解决分子水平和形态的结合。我们将我们的结果与早期研究拟南芥萌发的结果进行了比较。21,53],大米[25]和大麦[20.,43并发现种子萌发在高等植物中是一个高度保守的过程。使用以下组合K-means和WGCNA方法,我们确定了转录因子和代谢途径在种子萌发的特定阶段发挥重要作用。目标网络分析方法的应用使我们能够发现参与特定过程的候选基因。这种方法也代表了未来联合序列多组学分析的一种可能的策略。本研究首次采用综合方法研究杨树种子萌发。因此,我们的研究结果是未来分析的重要起点,并为探索替代策略和可能性提供了新的见解。
方法
植物材料,实验条件,鲜重测量
杨树种子(杨树×黑杨树)取自东北林业大学(哈尔滨)实验林场的同母本杨树半兄弟科。种子萌发试验分为3个重复(每个重复50粒)。种子在25°C有盖的塑料盒中,放在两张吸水纸上,用4.5 mL蒸馏水浸湿。用吸水纸除去多余水分后,在25±1°C的环境温度下,每15分钟称量20颗发芽种子(至±0.0001 g)。根据发芽种子的鲜重,在特定时间点进行转录组和代谢分析。称重后,种子立即用吸水纸吸干,在液氮中快速冷冻,并进行转录组和代谢分析。
转录组分析
使用Trizol试剂(Invitrogen, Carlsbad, CA, USA)从大约200颗种子中提取总RNA,然后用10 U DNase I (Takara,大连,中国)在37℃下孵育30分钟以去除基因组DNA。每个样品3个实验重复构建RNA文库。RNA-Seq文库根据Illumina文库准备试剂盒制造商的协议制备。测序后,对原始数据进行过滤,以去除适配器污染和低质量读取。然后将所有干净的reads映射到杨树基因组中,该基因组从Phytozome网站(https://phytozome.jgi.doe.gov/pz/portal.html),使用带有默认参数的HISAT2对齐算法[54].使用SAMtools提取每个基因的映射reads [55].在NOISeq中使用折叠变化≥2和来识别DEGsp≥0.8阈值[56].基因表达水平采用FPKM法归一化。
基因表达数据的聚类
KMeV4.8中欧几里得距离的均值聚类[57]根据输入的FPKM值产生了24个簇。共表达网络采用R [58].计算每个模块的特征基因值,并用于测试与每个萌发阶段的相关性。随后的分析使用r≥0.75,p≤0.05阈值(学生的t以及)。网络使用Cytoscape v.3.5.1进行可视化[59].
富集分析
MapMan工具用于分配通路类别和筛选转录因子[37].Fisher的精确测试被用于识别显著富集于DEGs的类别(p≤0.05阈值)。
代谢组学分析
使用不同萌发期收集的50 mg杨树种子进行代谢产物分析,LC-MS/MS分析在UHPLC系统(1290,Agilent Technologies, USA)上进行,配备UPLC BEH酰胺柱(1.7 μm, 2.1 × 100 mm, Waters),耦合TripleTOF 6600系统(Q-TOF, AB Sciex),在EI模式下运行。流动相(A)为25mm NH4OAc和25mm NH水溶液4OH (pH = 9.75)。梯度洗脱,流速为0.3 mL min−1使用流动相(A)和乙腈(B): 0 min, 85% B;2 min, 75% B;9 min, 0% B;14 min, 0% B;15 min, 85% B;注射量为2 μL。进行了6次生物重复,所有其他细节均在先前的研究中描述[60].在数据处理过程中,通过两个步骤来确定不同时间代谢物的显著差异。在第一步中,得到了在投影(VIP)值中可变重要性的第一主成分。改变的代谢物被认为是VIP值超过1.0。在第二步中,其余变量由Student 's进行评估t以及(p> 0.05),两组间剔除变量[61].
TCNA
TCNA用于评估每个多基因家族成员对目标代谢物变化的贡献。在这种方法中,考虑了编码直接参与目标代谢物“合成”和“分解”的蛋白质的基因家族成员。根据MapMan工具生成的注释信息获得基因注释和代谢物排名,识别负责目标代谢物合成和分解的基因。进行Spearman相关分析,并使用Cytoscape软件(3.5.1)进行可视化p≥0.05(学生t-test), r≥0.25阈值。
数据和材料的可用性
在本研究中生成或分析的所有数据集均可根据合理要求从通讯作者处获得。
缩写
- AP2 / EREBP:
-
APETALA2/乙烯响应元件结合蛋白
- CPP(锌):
-
富半胱氨酸多梳状蛋白(Zn)
- 度:
-
差异表达基因
- 景深:
-
DNA与一根手指结合
- 面纱:
-
Ethylene-insensitive3式
- HPLC-MS /女士:
-
高效液相色谱-质谱/质谱
- 我:
-
模块eigengene
- 柠檬酸:
-
三羧酸循环
- TCNA:
-
目标相关网络分析
- 贵宾:
-
投影的重要性是可变的
- WGCNA:
-
加权基因共表达网络分析
参考文献
- 1.
布雷JD。种子萌发和休眠。植物学报。1997;9(7):1055-66。
- 2.
Bewley JD, Bradford KJ, Hilborst HWM, Nonogaki H.种子发育、萌发和休眠生理学。第3版,纽约:施普林格;2013.
- 3.
张志刚,张志刚,张志刚。种子休眠与萌发。植物学报,2002;5(1):33-6。
- 4.
Miransari M, Smith DL。植物激素与种子萌发。环境科学学报。2014;29(2):344 - 344。
- 5.
Rajjou L, Duval M, Gallardo K, Catusse J, Bally J, Job C, Job D.种子萌发与活力。植物科学学报,2012;
- 6.
麦格理A, Ralet MC, Kronenberger J, Marion-Poll A, North HM。拟南芥种皮粘液组成的原位、化学和大分子研究。植物与细胞生理学。2007年,48(7):984 - 99。
- 7.
Robert C, Noriega A, Tocino A, Cervantes E.拟南芥种子形态的形态学分析揭示了乙烯信号通路突变体的极性改变。植物营养学报,2008;26(4):531 - 531。
- 8.
温莎JB,西蒙兹VV,门登霍尔J,劳埃德AM。拟南芥种皮发育:外被皮形态分化。植物学报,2000;22(6):483-93。
- 9.
山口勇,孙涛。拟南芥种子萌发过程中早期和晚期赤霉素生物合成基因的细胞特异性表达模式。植物学报,2001;28(4):443-53。
- 10.
黄晓明,张晓明,张晓明,张晓明,等。大豆种子萌发和幼苗生长过程中基因表达的研究进展。足底。1987;170(2):209 - 16。
- 11.
Dierking EC, Bilyeu KD。棉子糖和水苏糖代谢对大豆种子的有效萌发不需要。植物营养学报,2009;26(4):529 - 529。
- 12.
王超,王宏,张娟,陈松。大豆种子特异性ap2结构域转录因子在种子萌发调控中发挥一定作用。中国科学C辑,2008;51(4):336-45。
- 13.
Asakura T, Watanabe H, Abe K, Arai S.水稻天冬氨酸蛋白酶,oryzasin,在种子成熟和萌发过程中表达,具有不同于动物和微生物天冬氨酸蛋白酶的基因组织。中国生物医学工程学报,2001;32(1):457 - 457。
- 14.
阿斯曼SM。G蛋白信号在水稻种子萌发调控中的作用。Sci抽烟可以。2005, 2005 (310): cm12。
- 15.
三永,川上O, Numata T,山口J,福井K, Mitsui T.水稻种子萌发早期淀粉酶多态性。生物科学与技术。2001;65(3):662-5。
- 16.
帕尔米亚诺监制,朱利亚诺监制。水稻种子萌发过程中部分水解酶、过氧化物酶和过氧化氢酶活性的变化。植物学报。1973;52(3):274-7。
- 17.
Taylor NL, Howell KA, Heazlewood JL, Tan TYW, Narsai R, Huang SB, Whelan J, Millar AH。水稻线粒体载体家族的分析表明,在种子萌发过程中,一种参与精氨酸代谢的碱性氨基酸载体无氧积累。植物科学进展。2010;26(2):344 - 344。
- 18.
Abdul-Baki AA。大麦种子萌发初期的代谢。植物学报。1969;44(5):733-8。
- 19.
Martinez M, Cambra I, Carrillo L, Diaz- mendoza M, Diaz I.大麦中整个胱抑素基因家族的特征及其目标组织蛋白酶L样半胱氨酸蛋白酶,种子萌发过程中hordein动员的伙伴。植物科学进展。2009;32(3):344 - 344。
- 20.
杨晓明,李志刚,李志刚,李志刚。大麦种子萌发过程中基因表达差异的研究进展。中国生物医学工程学报。2002;2(1-2):28-39。
- 21.
Dekkers BJW, Pearce S, van Bolderen-Veldkamp RP, Marshall A, Widera P, Gilbert J, Drost HG, Bassel GW, Muller K, King JR,等。拟南芥种子萌发过程中两个相反作用的种子室的转录动态。中国生物医学工程学报,2013;29(1):344 - 344。
- 22.
Fait A, Angelovici R, Less H, Ohad I, Urbanczyk-Wochniak E, Fernie AR, Galili G.拟南芥种子发育和萌发与时间差异代谢开关相关。植物科学进展。2006;42(3):839-54。
- 23.
Gallardo K, Job C, Groot SP, Puype M, Demol H, Vandekerckhove J, Job D.拟南芥种子萌发和启动的蛋白质组学分析。植物科学进展。2001;26(2):339 - 344。
- 24.
张晓东,刘志刚,刘志刚,刘志刚,刘志刚。拟南芥种子发育过程的基因芯片分析。植物科学进展。2000;29(4):344 - 344。
- 25.
Howell KA, Narsai R, Carroll A, Ivanova A, Lohse M, Usadel B, Millar AH, Whelan J.水稻萌发过程中代谢和转录本时间开关的定位突出了特定转录因子和RNA不稳定性在萌发过程中的作用。植物科学进展。2009;29(2):366 - 366。
- 26.
王wq,刘世杰,宋SQ, Moller IM。种子发育、耐干燥性、萌发和活力的蛋白质组学研究。植物化学学报,2015;
- 27.
杨萍,李霞,王霞,陈红,陈峰,沈松。水稻种子萌发过程蛋白质组学分析。蛋白质组学,2007;7(18):3358 - 68。
- 28.
张华,王文杰,刘世杰,Moller IM,宋淑娟。杨树种子活力的蛋白质组分析。公共科学学报。2015;10(7):e0132509。
- 29.
侯爵哒。北方阔叶林种子贮藏与萌发。《中华人民共和国宪法修正案》1975;5(3):478-84。
- 30.
巴贾杰yp。快速繁殖和生物质能生产的树木改良生物技术。树木I.柏林:施普林格;1986.1页。
- 31.
Karnosky DF。组织培养改良林木的潜力。生物科学。1981; 31(2): 114 - 20。
- 32.
Dewan S, Vander Mijnsbrugge K, De Frenne P, Steenackers M, Michiels B, Verheyen K.欧洲黑杨种子成熟期母体温度对种子萌发和花蕾形成时间的影响。《生态管理》2018;410:26 6 - 35。
- 33.
马德洪P,第M章,Jimenez-Ramos MC, Maranon T, Murillo JM。微量元素污染土壤对白杨后代种子萌发和幼苗活力的影响。环境监测与评价。2015;187(11):663。
- 34.
张慧,周kx,王文哲,刘世杰,宋淑琪。蛋白质组分析揭示了杨树种子萌发的能量依赖中枢过程。中国生物医学工程学报,2017;23(4):344 - 344。
- 35.
种子休眠与萌发控制。中国植物学报。2006;26(3):531 - 531。
- 36.
Weitbrecht K, Muller K, Leubner-Metzger G.首先:早期种子萌发。中国机械工程学报,2011;26(10):389 - 389。
- 37.
Thimm O, Bläsing O, Gibon Y, Nagel A, Meyer S, Krüger P, Selbig J, Müller LA, Rhee SY, Stitt M. Mapman:一个用户驱动的工具,将基因组学数据集显示在代谢途径和其他生物过程的图表上。植物学报,2004;37(6):914-39。
- 38.
王晓明,王晓明,王晓明,等。拟南芥anl2突变体根细胞的鉴定。植物科学进展(英文版);2011;
- 39.
Kubo H, Peeters AJ, Aarts MG, Pereira A, Koornneef M.影响拟南芥花青素分布和根系发育的同源盒基因。植物细胞学报。1999;11(7):1217-26。
- 40.
Dobrowolska I, Businge E, Abreu IN, Moritz T, Egertsdotter U.代谢组和转录组分析揭示了挪威云杉(Picea abies)体胚萌发的新见解。树物理学报,2017;37(12):1752-66。
- 41.
Kristof JR, Coppersmith JL, Hong K, Liu PP, Homrichhausen TM, Sun J, Martin RC, Nonogaki H.一种具有萌发潜力的拟南芥胚胎抑制突变体。种子科学,2008;18(2):55-65。
- 42.
黄晓明,张晓明,张晓明,等。大豆幼苗发育过程中NAC和YABBY转录因子结合位点及共调控基因的cdna克隆。BMC Genomics. 2013;14:477。
- 43.
Sreenivasulu N, Usadel B, Winter A, Radchuk V, Scholz U, Stein N, Weschke W, Strickert M, Close TJ, Stitt M.大麦籽粒成熟和发芽:代谢途径和调控网络的共性和差异,由新的MapMan/PageMan分析工具突出。植物科学进展。2008;29(4):344 - 344。
- 44.
Hollender CA, Kang C, Darwish O, Geretz A, Matthews BF, Slovin J, Alkharouf N,刘哲。森林草莓花转录组揭示了发育中的花托和花药基因网络。中国生物医学工程学报,2014;29(3):344 - 344。
- 45.
吴松,雷军,陈刚,陈红,曹斌,陈晨。芥蓝转录组重组及多组织硫代葡萄糖苷代谢相关基因整体表达分析。植物科学进展,2017;
- 46.
Angelovici R, Fait A, Fernie AR, Galili G.种子高赖氨酸性状与TCA循环负相关,并减缓拟南芥种子萌发。新植醇。2011年,189(1):148 - 59。
- 47.
伊斯特蒙德PJ,格雷厄姆IA。重新审视乙醛酸循环在油籽中的作用。植物科学进展,2001;6(2):72-8。
- 48.
何东,韩超,姚军,沈松,杨平。用蛋白质组学方法构建水稻种子萌发代谢和调控途径。蛋白质组学,2011;11(13):2693 - 713。
- 49.
凯利AA,奎蒂尔AL,肖E,伊斯特蒙德PJ。种子贮藏油的调动对拟南芥的萌发或幼苗的建立是重要的,但不是必需的。中国生物医学工程学报。2011;26(2):344 - 344。
- 50.
罗莲子,王晓明,王晓明,等。种子萌发过程中初级代谢的激活与调控。种子科学,2014;24(01):1-15。
- 51.
Soeda Y, Konings MC, Vorst O, van Houwelingen AM, Stoopen GM, Maliepaard CA, Kodde J, Bino RJ, Groot SP, van der Geest AH。甘蓝种子成熟、渗透和萌发过程中的基因表达程序是种子萌发过程进展和胁迫耐受水平的指标。植物科学进展。2005;37(1):354 - 358。
- 52.
Amiour N, Imbaud S, Clement G, Agier N, Zivy M, Valot B, Balliau T, Armengaud P, Quillere I, Canas R,等。利用代谢组学与转录组学和蛋白质组学相结合的研究来确定玉米等作物中氮代谢控制的关键步骤。中国科学(d辑:自然科学),2012;
- 53.
木ura M, Nambara E.拟南芥种子中储存和新合成的mRNA:环己酰亚胺和控制恶化处理对吸收过程中转录恢复的影响。植物分子生物学杂志,2010;43(1):319 - 319。
- 54.
Kim D, Langmead B, Salzberg SL. HISAT:低内存需求的快速拼接对齐器。光子学报。2015;12(4):357-60。
- 55.
Li H, Handsaker B, Wysoker A, Fennell T, Ruan J, Homer N, Marth G, Abecasis G, Durbin R.基因组计划数据处理S:序列比对/图谱格式和SAMtools。生物信息学。2009;25(16):2078 - 9。
- 56.
刘志刚,刘志刚,张志刚,张志刚。RNA-seq差异表达的数据质量敏感分析。核酸研究,2015;43(21):e140。
- 57.
Saeed AI, Sharov V, White J, Li J, Liang W, Bhagabati N, Braisted J, Klapa M, Currier T, Thiagarajan M,等。TM4:免费的、开源的微阵列数据管理和分析系统。生物学技术。2003;34(2):374 - 8。
- 58.
朗菲尔德P,霍瓦特S. WGCNA:加权相关网络分析的R包。BMC生物信息学。2008; 9:559。
- 59.
香农P, Markiel A, Ozier O, Baliga NS, Wang JT, Ramage D, Amin N, Schwikowski B, Ideker T. Cytoscape:生物分子相互作用网络集成模型的软件环境。基因组学报,2003;13(11):2498-504。
- 60.
要EJ,威尔逊ID,吉卡H,西奥多里迪斯G, Plumb RS, Shockcor J,福尔摩斯E,尼克尔森JK。使用UPLC-MS对尿液进行全球代谢分析。物理学报,2010;5(6):1005-18。
- 61.
Smith CA, Want EJ, O'Maille G, Abagyan R, Siuzdak G. XCMS:使用非线性峰比对、匹配和识别处理质谱数据进行代谢物分析。《肛肠化学》2006;78(3):779-87。
确认
不适用。
资金
中央高校基本科研业务费专项资金项目(2572017CA01)、国家自然科学基金项目(31570648)、国家自然科学基金项目(31600534)资助。资助机构没有参与研究设计、数据收集和分析,也没有参与手稿的准备。
作者信息
从属关系
贡献
CQ分析了RNA-Seq和代谢组学数据。CQ, LC, LL撰写并修改了手稿。ZZ进行RNA实验和统计分析。CQ, JH, XS, PZ, CY, ZX和GL设计并组织了这项工作。所有作者都对最终稿做出了贡献并通过了。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
附加文件
附加文件1:
表S1。杨树种子萌发过程中鲜重的变化。(xlsx15kb)
附加文件2:
表S2。每个库的平均原始读取数和匹配结果。(xlsx17 kb)
附加文件3:
表S3。24个聚类的基因id。(xlsx16kb)
附加文件4:
表S4。不同时期转录因子的相对丰度。(xlsx17 kb)
附加文件5:
表S5。每个模块丰富的路径类别和动员趋势。(xlsx22 kb)
附加文件6:
表S6。高连通性转录因子。(xlsx16kb)
附加文件7:
表S7。棕色模块和绿色模块功能基因id及连通性。(xlsx48kb)
附加文件8:
表S8。种子萌发和萌发后初级代谢产物的变化。(xlsx10kb)
附加文件9:
表S9。初级代谢相关基因图谱。(xlsx22 kb)
附加文件10:
表S10。目标相关网络分析(TCNA)中涉及的基因和相关性。(xlsx14kb)
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
曲,C,左,Z,曹,L。et al。杨树种子萌发和萌发后转录本和代谢物转移的综合解剖。BMC植物生物学19日,279(2019)。https://doi.org/10.1186/s12870-019-1862-3
收到了:
接受:
发表:
关键字
- 杨树
- 种子萌发和萌发后阶段
- 转录组
- 代谢组学
- 数据集成
- 候选基因