摘要
背景
芸苔属植物显著L.的初级休眠很少或没有,但次级休眠的变异很大。油菜次生休眠可能导致志愿植物的出现,造成遗传污染,降低质量和生物安全问题。然而,次级休眠的机制尚不清楚。本研究以淮优wsd - h2 (H)和淮优ssd - v1 (V)为材料,分别鉴定出次级休眠率低(约5%)和高(约95%)的品种。收集聚乙二醇(PEG)诱导二次休眠前(Hb和Vb)和后(Ha和Va) 4个样本,通过比较转录组分析确定二次休眠的候选基因。
结果
共检测到998个差异表达基因(DEGs),这些差异表达基因主要参与二级代谢、转录调控、蛋白修饰和信号通路。其中,在休眠种子(Va)中,参与富硫吲哚-硫代葡萄糖苷(GLS)连接生长素生物合成途径的deg表达水平显著上调,这一结果通过qRT-PCR验证,随后通过检测吲哚-3-乙酸(IAA)浓度的变化证实。IAA结合和前体。此外,外源IAA对H品种的二次休眠也有增强作用。
结论
本研究首先(据我们所知)阐明了在PEG诱导的二次休眠过程中,吲哚gls相关生长素的生物合成被增强,这为研究二次休眠提供了有价值的信息,并拓展了目前对生长素在油菜中的作用的认识。
背景
种子休眠是种子植物的重要性状自适应和由两个遗传因素和环境线索的影响,以确保传播及时发芽[1那2].基于发生时间,广泛接受初级和继发性休眠的分类。在模型植物中彻底研究的原发性休眠在母植物的种子发育期间诱导和维持,以及当种子成熟时的峰值,并通过后熟后释放[3.].相反,次级休眠,其主要负责休眠循环被定义为成熟的和非休眠种子不能不利条件(缺氧,高温和/或干旱)下发芽4.那5.].一旦初级休眠被释放,并且不利条件开始生效,分散种子从种子起源于场脱落的次级休眠可能诱发。然后次级休眠种子涉及重复诱导和终止响应于环境条件下,直到用于发芽适当的条件得到满足[6.].
芸苔属植物显著油菜是世界上最重要的油料作物之一。油菜种子很少或不经历初级休眠[7.那8.]但表现出不同的二级休眠潜力[5.那9.].在收获之前和在种子的收获之前,种子损失可以达到每米的10,000种子2因为长角果惊天动地的[10.].在不利条件下,脱落的种子可被诱导进入二次休眠,存活10年甚至更长时间,从而增加土壤中种子库的大小[11.那12.那13.].一旦遇到了有利条件,休眠种子会发芽出现作为杂草(如果除其他作物物种)或作为随后的作物栽培中志愿者植物(油菜作物中)。志愿者植物可能交叉授粉与随后的农作物和降低种子质量[7.那14.].此外,志愿者们可以通过给转基因油菜的持久性土壤种子库异花授粉造成的生物安全问题[15.那16.].在这种情况下,遗传改良导致低或无次生休眠将有助于有效降低土壤种子库,以避免生物安全风险的植物。因此,研究遗传基础和机制次生休眠标的具有重大的理论意义和现实意义。
油菜的二次休眠能力变异较大且显著(冬季品种< 60%,春季品种< 80%),该性状具有较高的遗传性[8.那10.那16.那17.].基因型,种子大小和收获时间二次休眠的贡献已量化和基因型贡献介于44到总变化的82%[7.,提示基因型是决定次生休眠的决定性因素。用PEG6000在黑暗中治疗2周[5.那10.那18.),四个数量性状位点(QTL)定位为二次休眠位于染色体A5, C3, C5和C8发现通过加倍单倍体(DH)群体来自品种之间的交叉表达617(30.4%次生休眠),加入R53次生休眠(61.7%),能够解释表型变异的35% (16.].
以前的研究已经表明,分子机制主休眠底层同时依赖激素(脱落酸(ABA)/赤霉酸(GA)平衡)和基因表达的信号整合(DOG1)阈值19.那20.那21].ABA和GA被认为是主要的拮抗调节种子休眠的激素[22].最近,越来越多的证据表明,另一种植物甾脂植物植物,对原发性休眠也至关重要拟南芥,虽然它的效果有点难题[23那24那25那26].ABA在油菜次生休眠中起重要作用[7.];但是,无论疾病是否扮演关键角色仍然未知。此外,诱导和维持次级休眠的机制是较差的。
RNA测序(RNA-seq)已成为一种非常有用的工具,用于理解发育过程的潜在机制和全基因组水平的基因表达谱之间的关系芸苔属植物显著,包括耐盐基因基础[27],即根长的[28],夜间温度对储存脂质的影响[29].在本研究中,我们利用两个代表性品种(分别约95%和5%的次生休眠)进行rna测序,检测与次生休眠有关的差异表达基因(DEGs)。本研究旨在确定次生休眠和非休眠种子中显著的转录组变化,并揭示吲哚硫代葡萄糖苷(GLS)连接生长素生物合成在次生休眠中的作用。
方法
植物材料
冬油菜型的两个品种(芸苔属植物显著结果表明,两种植物的次生休眠势存在显著差异。低次休眠品种淮优- wsd - h2(简称H)的次休眠率低于PEG诱导的5%,高次休眠品种淮优- ssd - v1(简称V)的次休眠率高于90%(表2)1)。此外,两个选育品种在许多种子品质性状上也存在差异2:表S12)。这两个品种是从这些先进一代的赵医生在淮阴师范学院的研究小组培育出筛选。
诱导次生休眠
在淮阴师范学院生物技术园区试验田种植油菜品种H和V,每个品种形成一块30 m的小区2.每种品种的个体植物分别袋装在开花阶段进行自我授粉。成熟后,收集每种品种的自带种子,干燥并在25℃下在恒定温度下储存,以进行继发性休眠试验。
根据Gruber等人所描述的方案,诱导种子次生休眠。17.]略有修改。将H(4×100)和V(4×100)的干燥种子置于四个培养皿(每培养皿100种子)中,用两片滤纸分层,用于一种生物重复。然后将8毫克PEG6000溶液加入到菜肴中,初始渗透潜力为1.5MPa并放入纸板箱中。然后用黑色布包裹纸板箱,并在20°C的黑暗中置于生长室(MLR-351h,三洋),持续两周。之后,将种子用水在绿色光(500-600nm)下洗涤,以除去任何PEG并立即转移到补充有6ml纯水的新型培养皿中。然后将培养皿用黑色布置回卡盒并转移到腔室进行萌发。八天后,除去发芽的种子,将剩余的种子置于腔室中,在交替的光和温度条件下(在3℃和30℃下为12小时,12小时暗)以释放休眠以测试种子活力。在交替条件下的发芽种子被认为是次级休眠种子,其余的是不可行的。次级休眠率计算为:二次休眠(%)=继发性休眠种子* 100 /(100-不可衰减的种子)。同时,使用污渍H和V在水代替PEG中作为对照。
来自2015年至2017年的连续三年来计算栽培品种H和V的二次休眠率。
样本采集和RNA提取
对于一种生物复制,收集了四种样品,包括品种H和V(HB和VB)和PEG6000诱导的种子(HA和VA)的成熟种子。每重复的细节如下:在二次休眠诱导期间,H和V的种子在PEG6000中被吸收,初始渗透潜力为1.5MPa两周。当时,对HA进行进行采样并提及HA的诱导患者的H种子。在绿灯下用水洗涤V的种子,以除去任何PEG,并立即转移到补充有6毫升纯水的新培养皿中,在黑暗中发芽再次8天。然后,去除发芽种子,取样诱导的剩余种子,并提及VA。同时,除去未进行PEG处理的H和V的成熟种子分别被取样并提及HB和VB。进行三种独立的重复,收获12个样品,用于RNA提取。
使用Aidlab RN38 RNA提取试剂盒(Aidlab,中国),按照厂家说明从每个样本0.1 g成熟种子中提取总RNA,在第二步前加入300 μl氯仿离心,稍加修改。
RNA-seq实验
使用Agilent 2100 Bioanalyzer分析总RNA的质量,具有RNA完整性数(rin)≥7.5的阈值。然后使用Qubit RNA测定试剂盒(Invitrogen,America)精确定量RNA(0.1-0.4μg)。使用具有寡聚(DT)引物的磁珠从总RNA纯化mRNA,然后将其片段为120-210bp。通过上标II试剂盒(Invitrogen,America)合成第一链cDNA,并且通过DNA聚合酶I合成第二链。在末端修复和3'末端腺苷酸后,使用T4 DNA连接酶连接成分衔接件至两端。然后通过Ampure XP珠粒(Beckman Coulter,America)纯化cDNA,以消除冗余适配器并通过PCR扩增。最后,进行凝胶纯化程序以选择范围为300至350bp的片段以产生配对末端文库。碎片大小通过Agilent 2100生物分析仪控制,通过KAPA QPCR试剂盒(Kapa Biosystems,America)评估产量。将10μl文库(2nm)固定在CBOT(Illumina,America)上,并在Illumina X10平台上测序,由CapitalBio Corporation,北京,北京,中国北京市读数150个配对读数。
RNA测序数据处理和基因表达注解
使用NGS-QC工具包处理RNA-seq原始reads [30.],之后丢弃低质量和适配器污染的序列。然后将成对的高质量读数与参考基因组对齐芸苔属植物显著(http://www.genoscope.cns.fr/brassicanapus/data/)经由HISAT [31].为了获得更多的功能注释,所有检测到的基因抨击反对拟南芥基因组(备拟南芥信息资源(TAIR),http://www.arabidopesis.org/blast/index.jsp.)使用BLASTN。Unigenes的功能通过Blastx针对非冗余(NR),Swissprot和Uniprot数据库搜索(E <1E-5)。基因本体(GO)注释使用BLAST2GO使用UNIPROTKB / SWISSPROT数据库确定。进行途径注释以了解通过基因和基因组(Kegg)数据库的kyoto百科全书的Blastx来了解基因功能。对于Go和Kegg浓缩,一个纠正P.设≤0.05值为阈值。MapMan软件(http://mapman.gabipd.org/home, 19.11.2010)提供了代谢和调节途径的图形概述。
基因表达量的定量分析
基因表达水平利用每百万片段(FPKM)方法[每千碱基片段计算32]通过Cuffquant [33]和Cuffnorm软件[33].通过袖口进行差异基因表达分析[34软件基于两个标准:(a)日志的绝对值2fold-change (FC)≥1和(b) a q值(false discovery rate (FDR))≤0.001。
度的视角的实时定量RT-PCR分析
为了验证RNA-seq分析中所鉴定的DEGs,进行了实时定量rt - pcr。总RNA从新处理的样本(不是RNA-seq)中分离。用1 μg无DNA污染的总RNA合成第一链cDNA,由oligo (dT)引物通过Revert Aid第一链cDNA Synthesis Kit (K1622, Thermo)合成。考虑到异源多倍体油菜基因组,我们下载了同一基因的所有位点序列,根据其登录数(http://brassicadb.org/brad/datasets/pub/Genomes/Brassica_napus/).根据1)基因特异性引物根据来自相同基因的所有基因座的相同序列和2)个基因的独特序列(http://bioinfo.ut.ee/primer3/;表格2).从同一基因的所有位点测定表达。熔体曲线分析证实PCR产物具有特异性,凝胶电泳证实为单条带。用SYBR PrimeScript™RT-PCR试剂盒(RR820A, TaKaRa)制备反应混合物,然后装入Bio-Rad CFX Manager仪器。PCR程序为:95℃5 s, 95℃3 s, 60℃30 s,共40个循环。每个样品进行3个生物学重复和3个技术重复,用2-△△CT.方法 [35].作为内部对照,BnaCAT1(BanC07g15270D)来归一化的基因表达(附加文件2:表S3)。
生长素中间体含量分析
IAA的分析,色氨酸,IAA-Asp和IAA-GLU:
IAA、色氨酸、IAA- asp和IAA- glu分析的样品按照Fu等人报道的方法提取和纯化[36将干种子或经PEG6000处理的种子(200 mg, DW)在液氮中研磨成细粉,然后用含80%甲醇的内标液(10 ng13.C11.,10 ng15.N2-trp和2.5 ng2H2-iaa)和 - 20°C 16小时。离心后,收集上清液并蒸发至干。将干燥的残余物重构为5%NH4.OH,并加载到绿洲MAX (Waters)墨盒。按顺序用5%的nhh洗涤墨盒4.然后用5%甲酸(FA)在甲醇中洗脱。洗脱液蒸发并在80%甲醇中重新溶解,进行LC-MS/MS分析。采用UPLC系统(Waters)与6500 Qtrap系统(AB SCIEX)耦合进行LC-MS/MS分析。采用BEH C18色谱柱(1.7 mm, 2.1 × 100 mm;以0.1%的FA (A)和乙腈(ACN) (B)为流动相,梯度初始为2% B,以0.3 mL/min的流速在6 min内增加至50% B。色氨酸、IAA、IAA- asp和IAA- glu在正电离和MRM模式下分别以205/188、176/130、291/130和305/130过渡检测。2H2-IAA作为量化IAA、IAA- asp、IAA- glu的内部标准13.C11.那15.N2-TRP用于量化色氨酸水平。
吲哚-3-丙酮酸分析:
如由Mashiguchi等人的描述进行分析IPyA。[37[微观修饰:将约100mg种子研磨成液氮中的细粉,并在甲醇中均化。离心提取物并将上清液转移到玻璃管中。快速完成三种提取,并合并上清液。向提取物中加入2,4-二硝基苯肼(DNPH)和1N HCl,并在37℃下反应过夜。添加到提取物中的DNPH的量为每1mg新鲜重量样品为1μgdnph。在捕获型衍生后,将蒸馏水加入到相同体积的提取物中,然后加载到OASIS MCX盒(水)上。用50%甲醇洗涤盒并用80%MeOH洗脱,洗脱液蒸发至干。最后,将干燥的DNPH-IPA在室温下用乙醚和重氮甲烷甲基化以获得DM-IPA。将DM-IPA溶解在50%乙腈中,用于UPLC-MS / MS分析。在耦合到6500 QTRAP系统(AB SCIEX)的UPLC系统(水)上进行I分析。LC分离使用A BE1 C18柱(1.7毫米,2.1×100mm;水),具有流动相0.05%乙酸(A)和0.05%乙酸/ ACN(B)。 The gradient was set with initial 5% B and increased to 60% B within 8 min at a flow rate of 0.3 mL/min, then increased to 95% B for 13 min. DM-IPA was detected in negative ionization and MRM mode with transition 396/152. The level of IPyA was quantitatively analyzed by an external standard curve.
外源生长素处理的萌发试验
在20℃黑暗条件下,将油菜籽分别置于装有两层滤纸的培养皿中,分别用10 mg/L、100 mg/L、500 mg/L的IAA溶液或水浸泡,浸泡时间为规定的时间。将IAA (I2886, Sigma)溶液先溶于乙醇,再溶于水,使其达到最终浓度(10 mg/L, 100 mg/L, 500 mg/L)。当种子的根突起穿过种皮时,认为种子已经发芽。记录吸胀8天后未萌发的种子,计算二次休眠率。从三个独立的重复中得到了结果。
结果
在栽培品种H和V次级休眠潜在的表征
为了分离油菜籽次生休眠的候选基因,分别鉴定了两个晚代品种淮优wsd - h2(以下简称H)和淮优ssd - v1(以下简称V)为低代表性基因型和高代表性基因型。为检测种子活力,两种种子均为H(图。1a)和V(图。1b)在20°C黑暗的纯水中完全发芽,表明所有种子都能存活。通过PEG处理进行二次休眠诱导后,几乎所有H品种的种子都在纯水中萌发(图。1c),而品种V的种子只有少量萌发(图。1d)。为了测试非发芽的种子是否是次要休眠(活),仲休眠物在交替的亮/温度条件下断裂。休眠脱模处理后,所有从H(图未发芽的种子。1e)和v(图。1f)发芽,表明非发芽的种子是可行的和次级休眠。2015年至2017年的二次休眠率的统计分析显示,栽培品种H表现出大约5%的继发性休眠潜力和品种v展示了大约95%的继发性休眠潜力(表1).
rna测序质量控制分析
为了探究次生休眠诱导过程中转录组的变化,我们利用次级休眠低(约5%)和高(约95%)的代表性品种H和V进行RNA-seq实验。从成熟种子(命名为Hb和Vb)和peg诱导种子(命名为Ha和Va)中分离的总RNA通过Agilent 2100分析仪进行鉴定,所有RIN值均≥7.9(附加文件)1:图S1)。利用polyA分别从3个独立的生物复制中构建了12个cDNA文库+RNA。RNA-seq实验的质量依赖于油菜参考基因组的阅读覆盖率和生物复制之间的相关性[29].Phred质量评分> 30% (Q > 30%)为> 90%(附加文件)2:表S1),表明测序质量高。此外,使用TOPHAT2成功映射到参考基因组的大约75-82%,66-75%的清洁读数被爆炸到独特的基因组位置(附加文件2:表S1)。如(附加文件1:图S2),平均读取总读取的60%,与参考基因组共享> 80%相似性。此外,每个样本的重复之间的相关性> 0.90(附加文件1:图S3;额外的文件2:表S2)。这些结果共同提出本研究中使用的RNA-SEQ数据非常可靠。
二氢基因在二次休眠诱导中的特性
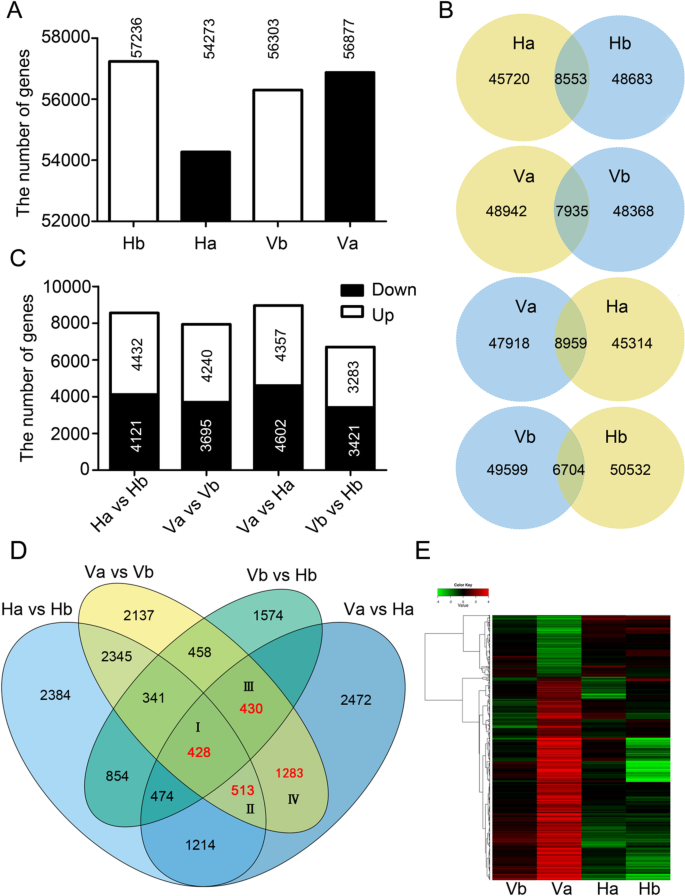
的Hb,哈,Vb和Va时,57236,54273,检测到54501倍53386的基因,分别为(图2一种)。总共66,703个基因占注释基因的66.0%(66,703 / 101040)芸苔属植物显著在四个样本中表达。BLAST查询表明,检测到的66,703个基因的50,589个(75.8%)击中同源物拟南芥, E < 10−5核酸。对检测到的基因进行了详细的分析,包括基因表达水平、功能注释、GO和KEGG分析以及MapMan分析(补充文件)1:图S4;额外的文件2:表S3)。
参与二次休眠的DEGS的鉴定和表达分析。一种单个样品中表达基因数的比较。棒上方的数量表示在相应的样品中检测到的基因数。B.VENN图显示来自四个比较组的表达基因的数量和DEG。交叉点中的数字表示每个组中的次数。C比较四个比较组之间的差异表达基因数量以及个体比较组中上调和下调的差异表达基因数量。开杆和填充杆中的数字分别表示向上和向下调节的deg数字。D.维恩图显示了两个个体之间的差异(Ha vs Hb, Va vs Vb, Vb vs Hb, Va vs Ha)和候选差异(红色部分)在第一轮选择中需要二次休眠。E.使用归一化FPKM值对998个DEGs进行聚类分析。红色表示基因上调,绿色表示基因下调,如上述色条所示。最终的归一化FPKM值范围从−4到+ 4
为了确定参与次级休眠的DEGs,我们对Ha vs Hb、Va vs Vb、Va vs Ha和Hb vs Vb四个比较设置进行了分析,阈值为|log2(FC)|≥1,a FDR≤0.001。在这些条件下,8553年(4432,4121),7935(4240,3695),8959(4357和4602)和6704(3283和3421)基因显著差异表达Ha vs Hb, Va和Vb,弗吉尼亚州和Ha和Hb与Vb比较,分别(无花果。2b和c;额外的文件1:图S5)。在四个比较设置中,在VA VS HA中观察到更多的DEG(图。2b).此外,与下调基因相比,上调基因在Ha vs Hb中更常见,尤其是在Va vs Vb中(图2)。2c)。然而,在VA VS HA和HB VS VB中发现了更多下调的基因(图。2c)。
识别负责二次休眠的候选人
为了识别与次级休眠相关的候选基因,结合四种比较设置构建了包含15个个体亚群的维恩图(图2)。2d).我们主要关注位于Va vs Vb和Va vs Ha交叉点的deg,将其分为4个子组(I-IV),分别包含428、513、430和1283个deg(图4)。2d).考虑到在I和II亚群中,DEGs在Ha vs Hb中也表现出显著变化,显示出非休眠表型,我们主要收集了逆转录基因(即Va vs Vb中上调,Ha vs Hb中下调,反之亦然)。对于III和IV亚组的deg,更严格的标准是|log2式(Va VS Vb)的-log2(Ha vs Hb)|≥1,用于筛选参与次级休眠的关键候选基因。在第二轮筛选的基础上,4个亚组分别分离出25、44、114和815个deg(共998个)2:表S4)。在998℃,960(96.2%)中袭击同源物拟南芥674(67.5%)被命名并在功能上注释拟南芥(附加文件2:表S4)。为了基于其归一化的FPKM值探索998°的表达概况,构建了热图。如图1所示。2e,热图清楚地显示了休眠样本(Va)中DEGs表达模式的两个簇,底部簇(上调的DEGs)的数量是顶部簇(下调的DEGs)的3倍。综上所述,这些结果表明,大多数候选deg在二次休眠诱导中显著上调。
二基因的功能表征
为了获得DEGs的功能信息,我们进行了GO亚类和KEGG通路分析。氧化石墨烯亚类分析显示,“硫化合物代谢”和“硫代葡萄糖苷代谢”在上调的DEGs中高度富集(表)3.;额外的文件2:表S5)。有趣的是,高度相似的代表KEGG途径“硫代谢”,“生物合成的硫代葡萄糖苷”和“色氨酸代谢”也清楚地上调DEGS富集(表3.;额外的文件2:表S6)。此外,在第一轮筛选中发现的DEGs的KEGG通路也表明上述三个术语高度富集(Additional file)1:图S6)。
此外,使用Mapman软件构建了示出VA和HA之间的DEGS概述的代谢图和调节图。关于细胞新陈代谢可视化,大多数Degs涉及包括脂质代谢,次生代谢,氨基生物合成和硫代谢的途径(附加档案1:图S7;额外的文件2:表S7),其验证了GO和KEGG富集分析的结果。在监管可视化,大部分的DEGS被映射为“转录因子”,“蛋白修饰”“蛋白质降解”和“植物激素信号传导”(附加文件1:图S7;额外的文件2:表S7)。示出所有对应于它们MapMan功能类别的DEGS的详细信息列于表S7。的MapMan,KEGG途径和GO子类别的组合分析表明,该用硫代谢,代谢GLS和植物激素信号传导途径相关的DEGS起到次级休眠主导作用。
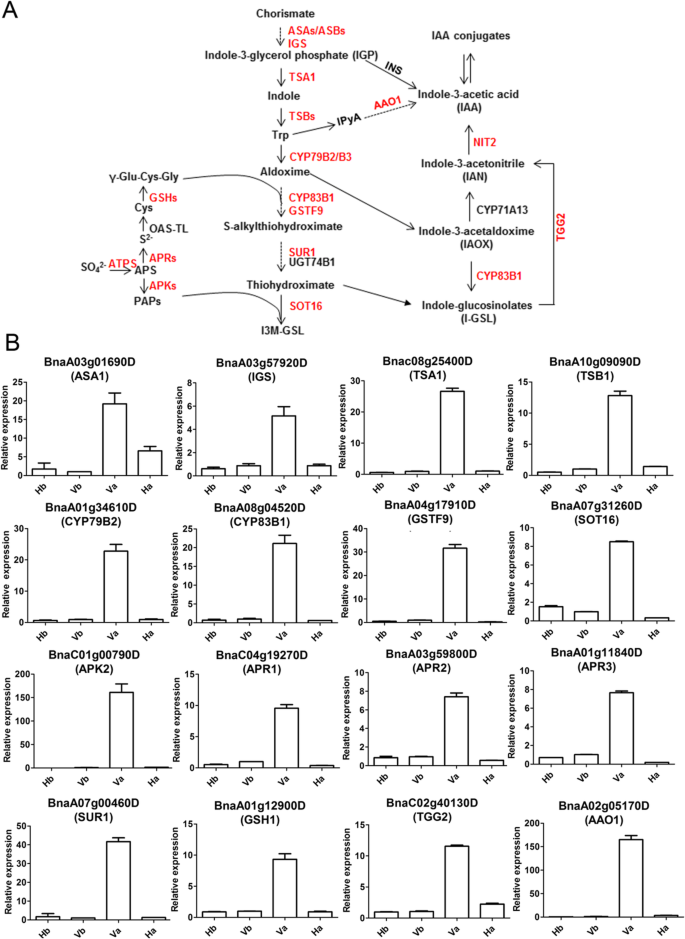
验证吲哚GLS与次级休眠中的吲哚GLS链接的毒素生物合成
“色氨酸代谢”、“硫代谢”、“硫代葡萄糖苷生物合成”和“生长素生物合成”的途径紧密相连。3.a).在本研究中,转录组分析显示,在休眠的Va种子中,参与色氨酸(Trp)生物合成的DEGs表达显著增加(附加文件)2:表S8)。其中度的视角,BnaA03g01690D,编码邻氨基苯甲酸合成酶α-亚基(ASA1) (图。3.a), Va vs Vb和Va vs Ha分别上调约20倍和4倍(图4)。3.b).表示BnaA03g57920D编码吲哚-3-磷酸甘油合酶(IGS.) (图。3.a), Va vs Ha增加6倍(图2)。3.b)。此外,TRP合成酶α(TSA1)和β(TSB1) (图。3.),编码bnac08g25400d和BnaA10g09090D分别被发现被上调在Va的超过10倍VS哈(图3.b)。
在本研究中,Va vs Vb和Va vs Ha中与硫供体生物合成相关的基因表达显著上调(附加文件)2:表S8)。吲哚GLS由色氨酸生物合成(图。3.a).有趣的是,只有大多数吲哚GLS生物合成基因显著上调(附加文件)2:表S8),而没有观察到变化为脂肪族或芳香族GLS基因(附加文件2:表S9)。此外,qRT-PCR验证了表达BnaC01g00790D(APK2)在VA VS VB和VA VS HA中上调超过150倍(图。3.b).另外,表示BnaA01g34610D(CYP79B2),bnaa08g04520d.(CYP83B1),bnaa07g00460d.(SUR1) 和Bna04g17910D(GSTF9在Va)的,编码吲哚GLS的核心结构形成所需的关键酶,被上调20倍至40倍VS哈,如图通过qRT-PCR(图3.b),与RNA-SEQ结果相匹配。发明内容与脂族和芳族GLS生物合成基因的对比,吲哚GLS生物合成基因的表达在次级休眠中唯一地上调。
值得注意的是,吲哚GLS是紧密结合IAA生物合成联[38那39那40].IAA是由色氨酸独立和依赖途径生物合成的[41那42].在本研究中,不依赖色氨酸的IAA生物合成基因INS/TRPA1在休眠种子中的表达没有变化(附加文件2:表S8)。相应地,在色氨酸依赖途径,最显着的变化是DEGBnaA02g05170D(AAO1),在休眠种子(Va)中表达量比非休眠种子(Vb和Ha)高150倍。另外,芥子酶编码基因的表达BNAC02G40130D(TGG2)催化吲哚-GLS为IAA生物合成产生IAN(图。3.a)在Va vs Ha中上调5倍以上(图2)。3.b).除了生物合成基因显著上调外,涉及生长素信号转导的基因包括BnaC02g36370D(AFB2),BnaA10g27350D(SSR1.),BnaA04g26870D(ABCB4.),BnaA07g19210D(ABCB21),BNAC08G19040D.(ARF5) 和bnaa05g01310d.(ARF11)在Va vs Ha中也有显著变化(表)4.),由此表明在次级休眠强烈生长素信号。
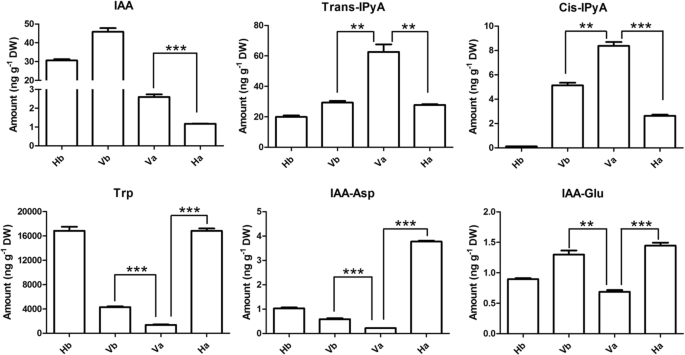
生长素中间体代谢差异的测定
为了研究是否激活吲哚gls连接的生长素生物合成导致代谢差异,测定了生长素代谢产物的浓度。生长素的水平和分布受到其合成(生长素前体)、失活(修饰的生长素形式)和运输的严格调控[43].测定了干种子和休眠种子中的游离IAA、主要生长素前体(IPyA)、生长素底物(Trp)和非活性IAA偶联物(IAA-天冬氨酸(Asp)和IAA-谷氨酸(Glu))。4.).游离IAA的水平在种子休眠(Va)的比在非休眠种子(HA)(图显著更高。4.),与休眠种子中DEGs的上调一致。令人惊讶的是,在Ha vs Hb和Va vs Vb中观察到游离IAA显著下降(图2)。4.),建议改变是响应PEG治疗而不是继发性休眠。IPYA的浓度被认为是IAA Biosynthesis的主要前体[38],在休眠种子中增加(图。4.).Trp生物合成受损时,释放了Trp生物合成的负反馈抑制,导致游离IAA含量增加[44].同样,在休眠种子中也观察到色氨酸浓度的下降(图。4.),导致色氨酸的上调生物合成基因(图3.b).此外,休眠种子(Va)中IAA非活性结合物(IAA- asp和IAA- glu)的浓度远低于非休眠种子(Ha和Vb)(图2)。4.).总之,这些结果表明,吲哚GLS联生长素生物合成在次级种子休眠增强。
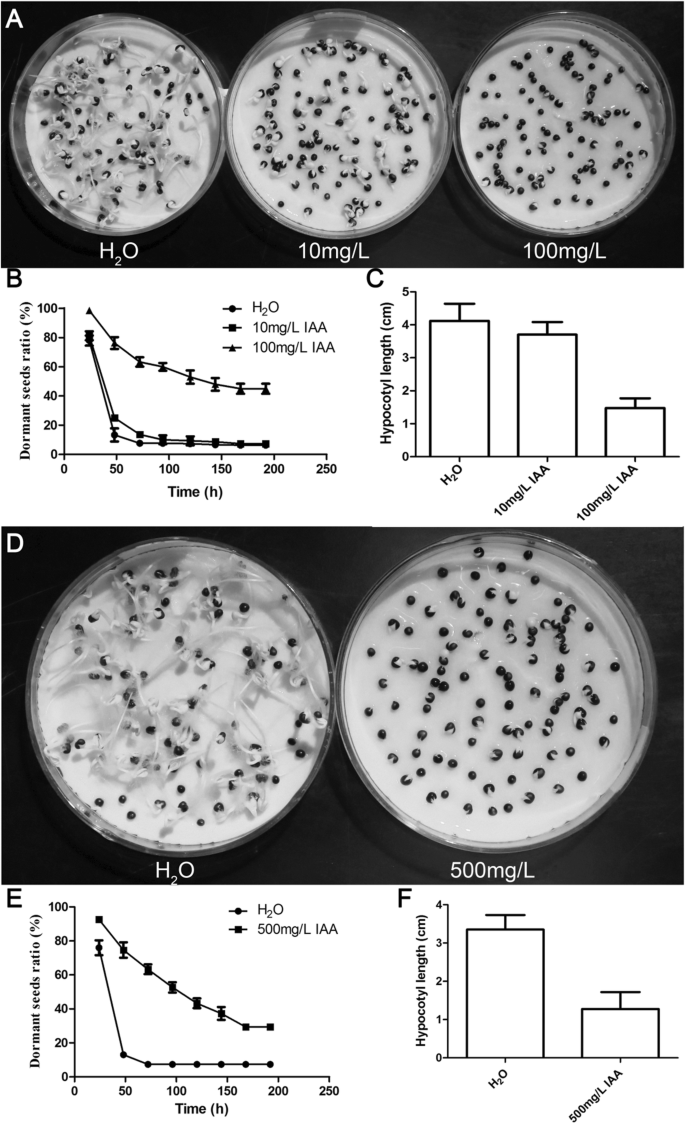
外源性IAA应用促进油菜籽二次休眠
为了确认蟾蜍蛋白对次级休眠的影响,将外源IAA应用于栽培品种H.首先,应用两种策略在黑暗中对低休眠电位Hb进行治疗:恒定的IAA(0mg / L,0.1mg/ L,1 mg / L,10 mg / L和100 mg / l)(附加文件1:图S8a)和高浓度的IAA(0 mg / L,100mg / L,500 mg / L,1000 mg / L和2000 mg / L)的治疗24小时(附加文件1:图S8c)。在恒定处理条件下,随着外源IAA浓度的增加,休眠种子的比例从20增加到40%1:图S8B)。当用500 mg / L IAA处理24小时时,休眠率达到80%(附加文件1:图S8d)。同样的策略在黑暗中处理低休眠样本Ha。在持续施用100 mg/L IAA的条件下,其休眠率比对照高40%。5.一种和B.),和Compared with that in the control, the hypocotyl length in the 10 mg/L and 100 mg/L IAA treatments significantly decreased (Fig.5.c)。Similarly, a 30% increase in the dormancy ratio and a 38% decrease in hypocotyl length were observed in response to the 500 mg/L IAA treatment for 24 h (Fig.5.d-f)。值得注意的是,低浓度的IAA以及ABA和IAA的组合不能模拟次生休眠(附加文件1:图S9),在具有ABA处理协议[12.],但高浓度的IAA增加了次生休眠率,并升高BnaDOG1表达级别(附加文件1:图S9),与次级休眠有关[4.].综上所述,高外源生长素增强了种子次生休眠的主要结论得到了支持。
讨论
一个长期存在的问题是,次级休眠是否在机械和生理上与初级休眠不同[45].虽然对油菜初级休眠进行了广泛的分子和遗传分析,但很少有研究揭示油菜次级休眠的遗传基础[7.那16.那46].在先前的研究中,在AC Excel中(80%)对DH12075(未示出)的次级休眠变化量7.那46]在R53(61.7%)Vs Express 617(30.4%)[16.]比品种V(95%)的以下显著VS在本研究中使用H(5%)(表1).更重要的是,油菜基因组序列并没有在那个时候释放。这样,品种V和H充当了RNA-SEQ理想材料,以探索参与二次休眠候选DEGS。
对所有指标的分析表明,本研究中三个独立生物学重复的RNA-seq数据是高质量和可靠的(补充文件2:表S1)。基于严格的阈值(|日志2(FC)≥1|和FDR≤0.001),在V vs H中鉴定出998个次级休眠候选DEGs,远多于AC Excel vs DH12075拟南芥AR12K cDNA微阵列[7.那46].其中DEGS,那些参与“硫代谢”,“生物合成色氨酸”,“芥子油苷代谢”(表3.)和“植物激素信令”(附加文件1:图S7)显著富集。GLSs是一种富含硫的次生代谢物,由β-D-glucopyranose残基通过硫原子与(Z)-N-hydroximinosulfate酯连接,再加上前体氨基酸衍生的R基团组成,主要存在于十字花科种子中[47那48].基于前体氨基酸和可变R基团,GLS可以分为脂族(例如,丙氨酸)),吲哚(TRP)或芳族(例如,酪氨酸(TYR))-GLS [49].值得注意的是,不同类型的gls是由特定基因的酶合成的[48].在该研究中,在休眠种子中唯一和可染色的TRP衍生的吲哚GLS生物合成的特定基因的表达水平(图。3.;额外的文件2表S8),而脂肪族和芳香型GLS生物合成基因的表达水平未见变化(附加文件2:表S9)。相应地,转录因子的表达水平BnaA09g44500D(MYB51),BNAC02G22630D(MYB122) 和bnaa05g18020d.(MYC2),该正性调节吲哚的生物合成GLS [50,也上调(补充文件1:图S10;额外的文件2表S10),而表达无变化bnacnng43220d.(MYB28)在休眠种子中(附加文件2表S10),调控脂肪族GLS的生物合成。值得注意的是,peg处理的AC Excel种子与DH12075种子之间的苯丙素代谢存在显著差异[7.],它通过醛肟与GLS生物合成相关[23],表明这两个生物合成GLS和相关途径都需要二次休眠。
吲哚GLS与生长素生物合成紧密相连[48].缺乏在类似于生长素积累表型[严重的植物发育缺陷GLS代谢结果51那52那53那54].以前的研究表明,生长素生物合成和信号控制初级休眠拟南芥,虽然有些争议仍有待解决。遗传和分子研究表明,通过募集促进毒素响应因子,养肝蛋白促进了原发性休眠ARF10和ARF16控制表达ABI3在拟南芥[23那24].相比ARF10和ARF16,另一种生长素反应因子,ARF2.,通过抑制ABA信号通路参与种子萌发[55].有趣的是,生长素流入载体AUX1,增加IAA水平,最近有报道对种子萌发有积极影响[26].最近,转录组和翻译组联合分析显示,trp依赖的生长素生物合成受到抑制DOG1在依赖性初级休眠拟南芥[23].与此相反,我们的数据表明,吲哚gls连接的生长素生物合成增加了种子次生休眠(无花果。3.和4.),以及其他外源生长素处理实验证明生长素促进了次生休眠(图。5.),表明在初级VS二次休眠的差异。如图卡德曼等。[56,转录组分析表明,在全基因组范围内,休眠种子的初级和次级基因表达存在显著差异拟南芥.据我们所知,这是第一个提供证据的生长素,作为一个多功能的触发植物发育,有助于提高次生休眠芸苔属植物显著.然而,生长素生物合成基因是如何被激活的仍然是未知的。对不同时间长度的种子处理进行深入研究,可以为这一调控提供理论依据。此外,不同应激条件诱导次生休眠的机制也各不相同拟南芥[56那57那58在大麦中[59那60那61].这将是非常有趣的,以揭示不同条件下的二级休眠基础的具体和一般机制芸苔属植物显著.值得注意的是,使用AC Excel与DH12075杂交获得的QTL的表型变异比例略低,部分原因是表型变异不显著[16.].因此,将使用栽培品种V和H构建群体,以检测我们的下一个工作中的继发性休眠的QTL,并且对分子育种和基因组研究具有重要意义。
是必需的各种激素之间的广泛交互以确定在各种环境种子萌发[最优发育状态62].值得注意的是,由于Testa破裂和激进的伸长率,外源性IAA应用并不完全模仿继发性休眠(图。5.A和d),这表明在诱导休眠过程中需要其他植物激素或因子。MapMan对植物次生休眠调控的综述表明,生长素和其他植物激素都参与了植物次生休眠的调控芸苔属植物显著(桌子5.;额外的文件1:图S7)。AC Excel次生休眠种子ABA水平显著升高[7.[二次休眠的四个QTL置信区间中有两个部分与ABA内容有部分重叠[16.,提示ABA是次生休眠的关键因素。在Va中,ABA代谢相关基因的表达显著上调(表1)5.).与ABA具有拮抗作用的GA在Va中下调(表)5.),进一步说明转录组分析具有较高的可靠性。令人惊讶的是,另一种促进种子萌发的植物激素——乙烯,在休眠的种子中被发现上调5.).值得注意的是,证据证明了生长素增强乙烯生产[63],这反过来又特异性活化的吲哚的生物合成GLS基因[64,提示乙烯的增加可能是次生休眠中对生长素的反应。此外,越来越多的证据表明油菜素内酯(BR)和生长素途径都协同控制几个生长素应答基因[65].在本研究中,BR信号成分在休眠种子中上调。虽然茉莉酸(JA)在种子休眠中的作用是矛盾的,但茉莉酸特异性诱导吲哚GLS生物合成基因的表达[64,提示生长素对次生休眠有协同作用。除了上述的植物激素外,karrikins (KAR),一种来自植物材料燃烧的低分子量有机化学物质,已经被证明可以通过提高GA生物合成基因的表达来促进种子萌发[66].在次生休眠种子中,表达KAI2,卡瑞金受体显著下调(表5.).所有这些结果表明,生长素和其他植物激素之间的串扰复杂地调节了二次种子休眠芸苔属植物显著.
此外,细胞代谢的MapMan概述揭示了DEGS主要涉及细胞壁,脂质代谢,次级代谢(附加文件1:图S7a)和调节表明egs富集转录因子(附加文件1:图S7b)。细胞壁相关基因的表达,包括BnaA10g24090D(PGIP1),BnaA10g24090D(PGIP1)[67] 和BNAC08G06930D(STOP1)[68];脂质代谢基因,包括BnaA06g24040D(ACX2) 和BnaC03g49190D(ACX2)[69];和次生新陈代谢相关的基因,包括BnaA08g21730D(CAT3),BnaC08g19360D(CAT3)[69那70] 和BnaA03g52000D(APX6)[71,所有这些都被证明与休眠有关拟南芥,展示VA VS VB和VA VS HA(附加文件)的显着变化2:表S3)。同样,在AC Excel和DH12075中也发现了参与上述途径的一些deg [7.].几个DEGS,包括转录因子,后生改性剂和次级代谢的基因被随机选择用于通过qRT-PCR验证(附加文件1:图S10),结果与RNA-seq分析大体吻合。
结论
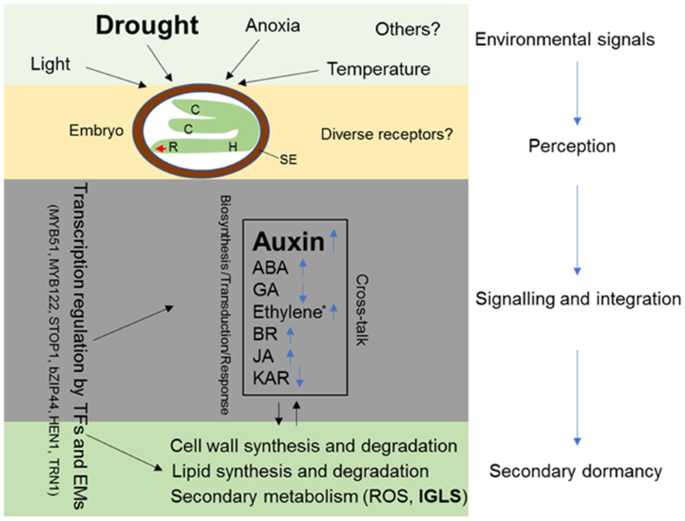
在该研究中,通过使用高级休眠品种V和低级休眠品种H的比较转录组分析探讨了继发性休眠的差异表达基因。我们的结果表明,吲哚GLS连接的毒素生物合成基因在次级休眠种子中富集和上调(VA)与非休眠料(HA)相比,随后通过改变吲哚-3-乙酸(IAA),IAA缀合物和前体的改变浓度证实。基于我们在这项工作中的研究结果,以及先前报告的那些,提出了关于继发性休眠诱导的推定工作模型(图。6.).在这个模型中,胚胎中的受体感知到应激环境信号,然后将信号转导到改变各种植物激素的生物合成和信号转导,特别是生长素生物合成基因高度升高(图)。3.)。植物激素信号之间的串扰最终被整合到转录因子和表观遗传修饰因子调控细胞壁、脂质和次级代谢相关基因(附加文件)1图S10)诱导种子次生休眠。本研究揭示了生长素在油菜次生休眠中的重要作用,为降低土壤种子库提供了有价值的信息。
基于DEGs的油菜种子干旱次生休眠机制示意图非休眠油菜种子可在光照、缺氧、温度和干旱等逆境条件下进入次生休眠,以适应萌发季节。环境信号在胚胎中被受体感知,可能被不同的受体感知。这些信号随后被转导,最终改变植物激素信号,包括生物合成、转导和反应。通过转录因子和表观遗传修饰因子整合植物激素信号,调控细胞壁、脂质和次生代谢相关基因的表达,诱导和维持种子次生休眠。PEG6000在本研究中被用作干旱的代用物。C,子叶;H,下胚轴;R,根;SE、种子信封; ABA, abscisic acid; GA, gibberellic; BR, brassinolide; JA, methyl jasmonate; KAR, karrikin; TFs, transcription factors; Ems, epigenetic modifiers; IGLS, indole GLS
可用性数据和材料
在研究过程中生成和分析的数据集可根据需要从通讯作者处获得。
缩写
- 阿坝:
-
脱落酸
- GA:
-
赤霉
- GLS:
-
葡萄糖酸盐
- IAA:
-
Indole-3-acetic酸
- IAA - 天冬氨酸:
-
IAA天冬氨酸
- IAA-glu:
-
IAA-谷氨酸
- IpyA:
-
Indole-3-pyruvic酸
- PEG:
-
聚乙二醇
- Trp:
-
色氨酸
参考
- 1。
王志强,王志强,王志强,等。水稻种子休眠的分子机制研究。植物生物学学报2008;59:387-415。
- 2.
彭菲尔德S,麦格雷戈DR。环境变化对种子休眠,发芽种子生产过程中。J Exp Bot。2017; 68:819-25。
- 3.
Chahtane H,金W,洛佩兹-Molina的L.初级种子休眠:在时间上多层谜语等待解锁。J Exp Bot。2017; 68:857-69。
- 4.
Née G, Obeng-Hinneh E, Sarvari P, Nakabayashi K, Soppe W.次生休眠芸苔属植物显著与增强的BnaDOG1转录水平。种子科学学报2015;(2):1-9。
- 5.
佩克伦C,Lutman PJW,相对于温度休眠油菜种子的Baeumer K.萌发行为。杂草res。1997; 37:419-31。
- 6.
种子休眠对种子萌发的影响。新植醇。2006;171:501-23。
- 7.
Fei H,Ferhatoglu Y,Tsang E,Huang D,Cutler AJ。与继发性休眠诱导相关的代谢和荷尔蒙过程芸苔属植物显著种子。植物学。2009; 87:585-96。
- 8.
周文杰,周文杰,周文杰。胁迫条件下油菜基因型次生休眠发育的变化。杂草研究》2002;42:446-55。
- 9.
赫夫特JDJ,Lutman PJW。志愿者油菜的文化控制(芸苔属植物显著).ĴAGR科学。1998; 130:155-63。
- 10。
Lutman PJW, Berry K, Payne RW, Simpson E, Sweet JB, Champion GT, May MJ, Wightman P, Walker K, Lainsbury M.常规和耐除草剂油菜(芸苔属植物显著).中国生物医学工程学报2005;272:1909-15。
- 11.
高尔登(Gulden RH), Thomas AG, Shirtliffe SJ。基因型、种子大小和环境对加拿大春油菜种子次生休眠潜力的相对贡献(芸苔属植物显著).杂草研究》2004;44:97 - 106。
- 12.
黄志强,陈志强,陈志强,陈志强,陈志强,陈志强,陈志强,陈志强,陈志强,陈志强,陈志强,陈志强,陈志强,陈志强芸苔属植物显著与继发性休眠的种子。可以j bot。2004; 82:1618-24。
- 13.
耐除草剂转基因油菜的持久性——在德国南部实际相关条件下的首次观察。植物保护。2002;18:255-60。
- 14.
Liu F, Zhao X., Zhang L ., Tang T ., Lu C ., Chen G ., Wang X., Bu C ., Zhao X. RNA-seq analysis of secondary休眠油菜种子转录组(英文)芸苔属植物显著l .)。科学通报。2014:4341-51。
- 15.
SchatzkiĴ,阿拉姆男,KlöppelC,纳格尔男,伯尔纳A,二次种子休眠和种子寿命在一组黑色接种欧洲冬油菜品种MöllersC.遗传变异。植物品种。2013; 132:174-9。
- 16.
SchatzkiĴ,Schoo B,艾克W,Herrfurth C,Feussner I,贝克尔HC,QTL的Mollers C.映射用于在冬季油菜种子休眠双单倍体群体。Al Appl Genet。2013; 126:2405-15。
- 17.
油菜籽种子持久性的研究(芸苔属植物显著):转基因品种和常规育种品种的变异。中国农业科学(英文版);2004;
- 18.
油菜种子次生休眠的诱导研究(芸苔属植物显著L.)水应力或在黑暗中氧缺乏的条件下长期吸入。欧元ĴAGR。1997; 6:245-55。
- 19.
贝塞尔GW。增长或不增长?趋势植物SCI。2016; 21:498-505。
- 20。
Graeber K, Nakabayashi K, Miatton E, Leubner-Metzger G, Soppe WJ。种子休眠的分子机制。Plant Cell Environ. 2012; 35:1769-86。
- 21。
种子休眠萌发机制及新假说。植物科学学报。2014;5:233。
- 22.
舒科,刘旭东,谢强,何振华。一粒种子的两面:休眠和萌发的激素调节。摩尔。2016;9:34-45。
- 23.
白B,诺瓦克O,Ljung的K,汉森Ĵ,Bentsink L.联合转录和translatome分析表明色氨酸依赖性生长素生物合成的控制中起作用DOG1端依赖种子休眠。新植醇。2018;217:1077 - 85。
- 24.
刘PP,蒙哥马利TA,Fahlgren N,Kasschau Kd,Nonogaki H,Carrington JC。镇压助线响应因子10.通过microRNA160是种子发芽和发芽后的阶段的关键。植物杂志2007; 52:133-46。
- 25.
刘X,张辉,赵Y,冯Z,李青,杨HQ,栾S,李江,他ZH。通过脱落酸信令的刺激生长素对照种子休眠通过诱导ARF介导的ABI3激活拟南芥.中国科学(d辑:地球科学)2013;110:15485-90。
- 26.
王震,陈飞,李旭,曹辉,丁敏,张超,左军,徐超,徐军,邓旭,等。拟南芥种子萌发速度由SNL蛋白去乙酰化酶结合的因子介导的调控AUX1.Nat Commun。2016;7:13412。
- 27。
杨海英,邹志强,郭EP,关炳华,周康,那苏S,南zyo M, Kitashiba H, Nishio T.盐胁迫下植物叶片和根系的转录组分析芸苔属植物显著RNA-seq。Biomed Res Int. 2014;19:467395。
- 28。
敦X,道Z,王阶,王X,刘G,初生根的王H.比较转录组分析芸苔属植物显著利用RNA测序技术对主根长度极不相同的幼苗进行测序。植物学报2016;7:1238。
- 29。
周L,Yan T,Chen X,Li Z,Wu D,Hua S,Jiang L.高夜温度对油菜种植种子的储存脂质和转录组变化的影响。J Exp Bot。2018; 69:1721-33。
- 30.
Jain M. NGS QC工具包:用于下一代测序数据质量控制的工具包。《公共科学图书馆•综合》。2012;7:e30619。
- 31。
Kim D,Langmead B,Salzberg SL。Hisat:一种快速拼接对齐器,内存要求低。NAT方法。2015; 12:357-60。
- 32。
Mortazavi A,Williams Ba,McCue K,Schaeffer L,Wold B.用RNA-SEQ进行测绘和量化哺乳动物转录om。NAT方法。2008; 5:621-8。
- 33。
Trapnell C,Roberts A,Goff L,Pertea G,Kim D,Kelley Dr,Pimentel H,Salzberg SL,RINN JL,Pachter L.差分基因和RNA-SEQ实验与Tophat和袖扣的实验分析。NAT PROTOC。2012; 7:562-78。
- 34。
基于RNA-seq的转录解译基因调控的差异分析。生物科技Nat》。2013;31:46-53。
- 35。
Livak KJ,Schmittgen TD。使用实时定量PCR和2分析相对基因表达数据-ΔΔct方法。方法。2001;25:402-8。
- 36。
傅Ĵ,储Ĵ,太阳X,王阶,颜C.简便,快速,和由UPLC-MS含有受伤西红柿植物激素多个羧基的同时分析/使用单SPE纯化和同位素稀释质谱。肛门科学。2012; 28:1081-7。
- 37.
引用本文:masiguchi K, Tanaka K, Sakai T, Sugawara S, Kawaide H, Natsume M, Hanada A, Yaeno T, Shirasu K, Yao H, et al.生长素的主要生物合成途径拟南芥.中国科学(d辑:地球科学)2011;108:18512-7。
- 38.
王志强。植物生长素代谢与植物生长发育的关系。发展。2013;140:943-50。
- 39.
赵玉兰,赵玉兰,赵玉兰,赵玉兰,夏原。植物生长素依赖于吲哚-3-乙醛醇酶的生物合成拟南芥.PROC NATL ACAD SCI。2009; 106:5430-5。
- 40.
Zhao Y, Hull AK, Gupta NR, Goss KA, Alonso J, Ecker JR, Normanly J, Chory J, Celenza JL。依赖色氨酸的生长素生物合成拟南芥:细胞色素p4500s CYP79B2、CYP79B3参与。基因Dev。2002;16:3100-12。
- 41.
王志强。植物生长素生物合成与代谢的分子和细胞分离。《冷泉Harb展望生物学》2010;2:a001594。
- 42。
Woodward AW,Bartel B.植物:调节,行动和互动。Ann Bot。2005; 95:707-35。
- 43。
Korasick DA, Enders TA, Strader LC。生长素的生物合成和贮藏形式。J Exp Bot. 2013; 64:2541-55。
- 44。
Wang B, Chu J, Yu T, Xu Q, Sun X, Yuan J, Xiong G, Wang G, Wang Y, Li J. Tryptophan-independent auxin biosynthesis on early embryonic development . acta botanica yunnanica(云南植物研究拟南芥.中国科学院院刊2015;112:4821-6。
- 45。
Hilhorst HWM。定义和种子休眠的假设。在年度工厂审查。卷27:种子发育,休眠和萌发。DOI:https://doi.org/10.1002/9780470988848.ch3..
- 46.
Fei H,Tsang E,Cutler AJ。种子成熟过程中的基因表达芸苔属植物显著相对于次级休眠的诱导。基因组学。2007; 89:419-28。
- 47.
Agerbirk n,olsen ce。进化中的葡萄糖苷酸盐结构。植物化学。2012; 77:16-45。
- 48.
黄志强,陈志强。吲哚硫代葡萄糖苷与生长素生物合成途径的相互作用。植物学报2017;8:2131。
- 49.
黄志强,王志强,王志强,等。硫代葡萄糖苷和异硫氰酸酯在植物中的分布及化学多样性。植物化学。2001;56:5-51。
- 50.
Frerigmann H,Glawischnig E,Gigolashvili T. MYB34,MYB51和MYB122的camalexin的生物合成的调控中的作用拟南芥蒂利亚纳.前植物SCI。2015; 6:654。
- 51.
Boerjan W,Cervera Mt,Delarue M,Beeckman T,Dewitte W,Bellini C,Caboche M,Van Onckelen H,Van Montagu M,Inze D. Superroot,隐性突变拟南芥,赋予植金病过度生产。植物细胞。1995年; 7:1405-19。
- 52。
Mikkelsen MD, Hansen CH, Wittstock U, Halkier BA。细胞色素P450 CYP79B2来自拟南芥催化色氨酸转化为吲哚-3-乙醛肟,吲哚葡萄糖素酸盐的前体和吲哚-3-乙酸。J Biol Chem。2000; 275:33712-7。
- 53。
Mikkelsen MD,瑙鲁普,Holkier Ba。拟南芥葡萄糖苷生物合成的C-S裂解酶中的突变体对砧鞘稳态吲哚-3-乙醛肟的关键作用。工厂J. 2004; 37:770-7。
- 54。
植物生长素生物合成的四种双功能IAM/ pam - amide水解酶的特性植物(巴塞尔)。2014; 3:324-47。
- 55。
王L,Hua D,He J,Duan Y,Chen Z,Hong X,Gong Z.Auxin响应因子2(ARF2)及其调节的同性恋基因HB33介导脱离酸反应拟南芥.Plos Genet。2011; 7:E1002172。
- 56。
CADMAN CS,TOOROP PE,HILHORST HW,FINCH-SAVAGE我们。基因表达谱拟南芥Cvi种子在休眠周期中表明一个共同的潜在的休眠控制机制。植物j . 2006; 46:805-22。
- 57。
Ibarra SE, Tognacca RS, Dave A, Graham IA, Sanchez RA, Botto JF。植物次生休眠入口的分子机制拟南芥种子。植物学报。2016;39:213-21。
- 58。
Lim S, Park J, Lee N, Jeong J, Toh S, Watanabe A, Kim J, Kang H, Kim DH, Kawakami N,等。ABA-insensitive3, ABA-insensitive5和DELLAs相互作用激活SOMNUS和其他高温诱导基因的表达拟南芥.植物细胞。2013; 25:4863-78。
- 59。
(黄洪辉,谢谢杰,黄洪辉,等。Hordeum Vulgare.L.)通过与氧气和激素调节相关的蓝光谷物。植物细胞环境。2014; 37:1393-403。
- 60.
黄洪辉,王志强,王志强,等。低氧诱导大麦次生休眠及其激素调控。J Exp Bot. 2013; 64:2017-25。
- 61.
Leymarie J,Robayo-Romero Me,Gendreau E,Benech-Arnold RL,Corbineau F. ABA参与诱导大麦中休眠(Hordeum Vulgare.l .)种子。植物生理学杂志。2008;49:1830-8。
- 62.
Toh S,Kamiya Y,Kawakami N,Nambara E,McCourt P,Tsuchiya Y. Thermoinhibition揭示了Strigolactones的作用拟南芥种子发芽。acta botanica yunnanica(云南植物研究). 2012;
- 63.
Arteca RN,Arteca JM。乙烯生产的油菜素内酯,生长素和细胞分裂素的影响。拟南芥蒂利亚纳植物。J Exp Bot。2008; 59:3019-26。
- 64.
Mikkelsen MD, Petersen BL, Glawischnig E, Jensen AB, Andreasson E, Halkier BA。CYP79基因和硫代葡萄糖苷基因的调控拟南芥由防御信号通路。植物理性。2003; 131:298-308。
- 65.
田华,吕波,丁涛,白明,丁志强。生长素- br互作对植物生长发育的调控作用。植物学报。2017;8:2256。
- 66。
Nelson DC, Flematti GR, Riseborough JA, Ghisalberti EL, Dixon KW, Smith SM。Karrikins增强了种子萌发和幼苗发育过程中的光响应拟南芥芥。中国科学院院刊2010;107:7095-100。
- 67。
Kanai M,Nishimura M,Hayashi M.过氧血清ABC转运蛋白通过诱导果胶在控制下诱导果胶降解来促进种子萌发ABI5.植物j . 2010; 62:936-47。
- 68。
Kobayashi Y, Ohyama Y, Ito H, Iuchi S, Fujita M, Zhao CR, Tanveer T, Ganesan M, Kobayashi M, Koyama H。STOP2激活几个基因Al和低pH耐受由调控的转录STOP1在拟南芥.摩尔。2014;7:311-22。
- 69。
刘无效,韩泰,元亨,俞泽,张丽,张巴,翟S,郑平等。Catalase2通过清除H幼苗后幼苗的功能2O.2并刺激ACX2/3的活动拟南芥.植物学报。2017;40:2720-8。
- 70。
c .条件氧化应激反应的研究进展拟南芥photorespiratory突变cat2研究表明,氧化还原状态是基因表达的关键调节因子,并确定光周期是调控H的关键因素2O.2全身的细胞死亡。植物j . 2007; 52:640-57。
- 71。
Chen C, Letnik I, Hacham Y, Dobrev P, Ben-Daniel BH, Vankova R, Amir R, Miller G.抗坏血酸过氧化物酶6保护拟南芥干旱和发芽种子胁迫和调解活性氧物种,脱落酸和生长素之间的交叉。植物杂志。2014;166:370 - 83。
致谢
一个也没有。
资金
国家自然科学基金资助项目(No. 31470572);江苏省青兰项目(2016)。关键词:边坡,边坡稳定性,边坡稳定性资助方不参与研究设计、数据收集、数据分析、数据解释、手稿撰写或决定发表。
作者信息
隶属关系
贡献
XZ构思和设计了实验;JC测定了生长素中间体的含量并进行了数据分析;LL和FL进行了其余的实验并分析了数据;XY、WF、TT、GC、QG协助实验;XZ和LL撰写并修改了手稿。所有作者阅读并批准了最终的手稿。
通讯作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
相互竞争的利益
这些作者声称他们没有利益争夺。
额外的信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
附加文件
附加文件1:
图S1。琼脂糖凝胶电泳(A)和RIN值(B)检测RNA质量。图S2。油菜参考基因组阅读覆盖率的分布。图S3。三次重复中每个样本的相关分析。图S4。概述涉及细胞代谢(A)和调控(B)途径的Va、Vb、Ha和Hb基因表达。图S5。Ha与Hb、Va与Ha、Va与Vb、Vb与Hb之间总表达基因的火山图。图S6。对次生休眠候选DEGs进行KEGG富集分析。图S7。MapMan概述了998 DEGs参与的细胞代谢过程(A)和调控途径(B)。图S8。外源IAA对Hb的发芽试验。图S9。ABA和IAA对二次休眠。图S10。通过定量RT-PCR的12个随机选择DEGS验证。(DOCX 4606 KB)
附加文件2:
表S1。RNA-SEQ的统计结果为12个样品的继发性休眠。表S2。三次重复中每个样本的相关分析。表S3。RNA-SEQ分析的详细信息。表S4。基于阈值的第二轮选择拆分(VA VS VB)-Log2(HA VS HB)| DEGS ≥ 1.表S5。详细的氧化石墨烯富集分析。表S6。在DEGS的详细KEGG富集分析。表S7。与Mapman功能类别相对应的所有DEG的详细列表。表S8。与吲哚gls相关的生长素生物合成相关的DEGs的详细列表。表S9。参与脂肪族和芳香GLS的基因列表。表S10。通过RNA-seq分析鉴定差异表达的转录因子。表S11。差异表达通过RNA-seq的分析确定的表观遗传修饰。表S12。品种H和v的种子品质差异(XLSX 31002 kb)
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
刘林,刘凡,褚建军。et al。转录组分析显示吲哚GLS与油菜中的继发性患者中的吲哚GLS链接的毒素生物合成作用(芸苔属植物显著L..).BMC植物杂志19,264(2019)。https://doi.org/10.1186/s12870-019-1866-z
已收到:
公认:
发表:
关键字
- 芸苔属植物显著
- 二次休眠
- 发芽
- 志愿者厂
- 植物激素
- RNA-seq分析