- 研究文章gydF4y2Ba
- 开放访问gydF4y2Ba
- 发表:gydF4y2Ba
SlBRI1的苏氨酸1050修饰可调控BR信号,提高番茄产量gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba19.gydF4y2Ba, 文章编号:gydF4y2Ba256.gydF4y2Ba(gydF4y2Ba2019年gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
外源施用或内源调控油菜素内酯(brassinosteroids, BR)相关基因引起的适当信号强度可以提高作物产量。然而,BR信号的精确控制是困难的,可能造成不稳定的影响,不能达到充分的潜力。brassino甾体INSENSITIVE1 (BRI1)是BR信号转导的限速受体,最近我们发现修饰BRI1磷酸化位点可以改变拟南芥BR信号强度和植物特性。然而,这些磷酸化位点在作物农艺性状中的作用尚不清楚。gydF4y2Ba
结果gydF4y2Ba
在本研究中,我们研究了番茄SlBRI1苏氨酸-1050 (Thr-1050)的作用。gydF4y2BaSlBRI1gydF4y2Ba突变体gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba以野生型SlBRI1转化体作为对照,研究了具有非磷酸化的Thr-1050 (T1050A)的SlBRI1表达植株。结果表明,自磷酸化的SlBRI1和BR信号强度增强gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba遍布T1050A,通过增加植物膨胀,叶面积,果实重量和果实数,促进产量,但减少营养物质,包括抗坏血酸和可溶性糖水平。此外,转基因植物之间的植物高度,茎直径和髁间距离相似。gydF4y2Ba
结论gydF4y2Ba
本研究结果揭示了Thr-1050在番茄中的生物学作用,并通过磷酸化位点修饰精确控制BR信号强度,为建立高产作物提供了分子基础。gydF4y2Ba
背景gydF4y2Ba
油菜素内酯(Brassinosteroids, BRs)是一种具有纳米摩尔浓度生理活性的内源植物激素,通过参与发芽、叶片形态发生、植物构型、开花、雄性育性和衰老等过程促进植物生长[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba].作为特定BR受体,芸苔类固醇不敏感1(BRI1)在植物的BR信号转导中不可或缺gydF4y2Ba4gydF4y2Ba].BRI1是一种富含亮氨酸重复受体激酶,包括胞外结构域、跨膜结构域和胞浆结构域[gydF4y2Ba5gydF4y2Ba];细胞质结构域含有Juxtamembrane区(JM),丝氨酸/苏氨酸/酪氨酸激酶结构域(KD)和C末端(CT)结构域[gydF4y2Ba6gydF4y2Ba].在BR信号转导途径中,BRs结合到BRI1的胞外结构域,促进BRI1及其辅受体BRI1- associated RECEPTOR KINASE1 (BAK1)之间的异源二聚,进而激活两种蛋白KD结构域的顺序转磷酸化[gydF4y2Ba7gydF4y2Ba].该过程最终导致BRASSINAZOLERESISTANT1(BZR1)和BRI1-EMS SUPPRESSOR1(BES1)的活化gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10.gydF4y2Ba],两者都是转录因子,调节br应答基因的表达[gydF4y2Ba11.gydF4y2Ba,gydF4y2Ba12.gydF4y2Ba,gydF4y2Ba13.gydF4y2Ba].gydF4y2Ba
拟南芥的生化和遗传学研究表明,Bri1在植物生长和发展中起着关键作用。在拟南芥中,大多数突变体gydF4y2BaBRI1gydF4y2Ba等位基因是BR不敏感,并显示矮化表型由卷曲的叶子,延迟生长,雄性不育[gydF4y2Ba14.gydF4y2Ba].过度的gydF4y2BaBri1.gydF4y2Ba导致增加的叶柄长度和敏感性的BR [gydF4y2Ba15.gydF4y2Ba].此外,BRI1磷酸化位点的定点诱变差异地影响植物生长和BR信号传导。BRI1的大多数磷酸化位点位于KD结构域,例如TYR-956,THR-1039,THR-1049,SER-1044和THR-1045,并且在BR信号传导和植物生长中表现出强大功能。实际上,防止这些残留物的磷酸化衰减BR信号传导和扰动植物生长。然而,不磷酸化的Ser-1168和Ser-1172突变体(CT结构域)表现出略微抑制的叶片生长,但大大降低了种子产量。在JM域中,TYR-831参与了叶片生长和开花时间的调节。Ser-891与失活机制有关,因为患有低磷酸化的SER-891的转化体提高了增强的BR信号,并且比遍布野生型BRI1的那些gydF4y2Ba16.gydF4y2Ba,gydF4y2Ba17.gydF4y2Ba,gydF4y2Ba18.gydF4y2Ba].值得注意的是,具有非磷酸化Ser-1042的突变体表现出激酶活性显著下降和半矮化表型,但具有正常的种子产量,因此具有巨大的增产潜力。这些发现证实了一种新的途径,即通过修饰特定的BRI1磷酸化位点来精确调控作物的经济产量。gydF4y2Ba
因此,人们对不同植物的BRI1同源物进行了大量的生物学功能分析。在大米、gydF4y2BaOsBRI1gydF4y2Ba(gydF4y2BaD61gydF4y2Ba)功能缺失突变体株高较矮,叶片直立,对育性影响不大;由于具有较大的光合能力和叶面积指数gydF4y2BaOsBRI1gydF4y2Ba茂密种植条件下的突变体,gydF4y2BaOsBRI1gydF4y2Ba是提高产量的一个有希望的因素[gydF4y2Ba19.gydF4y2Ba].gydF4y2BaZmBRI1gydF4y2Ba-RNAi转基因玉米植株也表现出矮小的身材、缩短的节间和扭曲的叶片,并且BR信号传导受到损害[gydF4y2Ba20.gydF4y2Ba].大麦突变体gydF4y2BaUZUgydF4y2Ba,这是由抑制引起的gydF4y2BaHvBRIgydF4y2Ba,具有半矮秆和抗病能力,有利于高产[gydF4y2Ba21.gydF4y2Ba,gydF4y2Ba22.gydF4y2Ba,gydF4y2Ba23.gydF4y2Ba].另外,异种表达gydF4y2BaTaBRI1gydF4y2Ba能促进植物萌发、开花和种子产量[gydF4y2Ba24.gydF4y2Ba].在草莓,水平gydF4y2BaFaBRI1gydF4y2Ba在成熟期,mRNA的表达迅速增加,而在成熟期则受到抑制gydF4y2BaFaBRI1gydF4y2Ba在去绿过程中,果实明显减缓了红色的形成[gydF4y2Ba25.gydF4y2Ba].总的来说,这些研究突出了gydF4y2BaBri1.gydF4y2Ba在农业生产,并通过控制BR信号强度gydF4y2BaBri1.gydF4y2Ba可能是增加产量的有效方法。gydF4y2Ba
西红柿是一种主要园艺作物和植物分子生物学研究浆果生产厂之间的模式植物。番茄gydF4y2BaSlBRI1gydF4y2Ba首先,其特征在于在gydF4y2Bacurl-3gydF4y2Ba突变体,表现出与拟南芥相似的表型gydF4y2BaBRI1gydF4y2Ba突变体。过度的gydF4y2BaSlBRI1gydF4y2Ba在番茄增强内源性BR信号强度和改善的主要农业性状,如水果产量和质量[gydF4y2Ba26.gydF4y2Ba].蛋白质序列比对显示,KD结构域以及磷酸化位点在SlBRI1和BRI1之间高度保守[gydF4y2Ba27.gydF4y2Ba的异种表达gydF4y2BaSlBRI1gydF4y2Ba在拟南芥gydF4y2BaBRI1gydF4y2Ba突变体并没有完全拯救突变[gydF4y2Ba14.gydF4y2Ba,gydF4y2Ba28.gydF4y2Ba].这些结果表明,不同的调节机制可能存在gydF4y2BaSlBRI1gydF4y2Ba和gydF4y2BaBri1.gydF4y2Ba.的gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba突变体是一个弱点gydF4y2BaSlBRI1gydF4y2Ba在激酶结构域有错义突变的突变体。此外,SlBRI1 Thr-1054位点定向突变在gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba背景未能拯救矮化突变并引起更严重的矮化表型,揭示这种磷酸化位点在番茄中的生物学特征中的关键作用[gydF4y2Ba29.gydF4y2Ba].然而,SLBRI1磷酸化位点的功能分析仅仅限于THR-1054,而不考虑重要的农艺价值,并且其他磷酸化位点在BR信号传导和农艺特征中的作用仍不清楚。gydF4y2Ba
因此,我们研究了在番茄SlBRI1的KD域,其相当于BRI1 THR-1045苏氨酸-1050(THR-1050)的生物学功能。我们生成SlBRI1的T1050A突变体通过苏氨酸1050至丙氨酸取代,发育的转基因gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba以表达T1050A和野生型SlBRI1的植株为对照,比较突变体表型恢复程度。结果表明,与SlBRI1相比,T1050A的表达导致了更强的BR信号强度、更高的自磷酸化水平、更旺盛的营养发育、更高的产量和更低的果实养分含量。这些结果表明,thrl -1050磷酸化在番茄生长发育中具有独特的负调控作用,这对于揭示番茄BR信号传导机制以及通过精确修饰特定磷酸化位点来改善作物性能具有重要意义。gydF4y2Ba
结果gydF4y2Ba
SLBRI1 THR-1050-ALA促进植物营养生长gydF4y2Ba
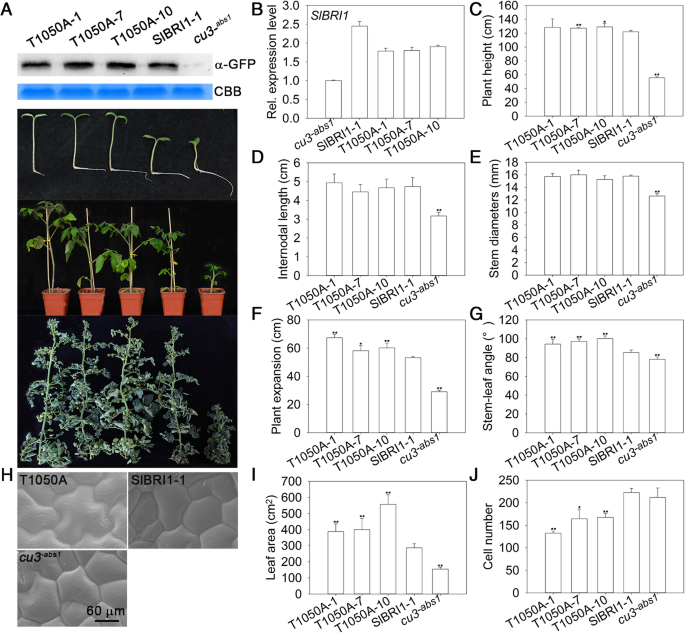
为了确定Thr-1050磷酸化如何广泛影响植物的生长发育,在天然启动子的控制下,产生了表达SlBRI1或T1050A的转基因番茄植株。转基因线PgydF4y2BaSlBRI1gydF4y2Ba::SlBRI1-green fluorescent protein (GFP)-1(以下简称SlBRI1 -1),其SlBRI1表达水平和表型与其他PgydF4y2BaSlBRI1gydF4y2Ba::SlBRI1-GFP线,以及gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba,被选择为控件(附加文件gydF4y2Ba1gydF4y2Ba:图S1)。PgydF4y2BaSlBRI1gydF4y2Ba对T1050A-GFP进行评价,并与gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba和slbri1-1。减少实验误差并确定THR-1050的生理意义,转基因系P.gydF4y2BaSlBRI1gydF4y2Ba:: T1050A-GFP-1, PgydF4y2BaSlBRI1gydF4y2Ba:: T1050A-GFP-7, PgydF4y2BaSlBRI1gydF4y2Ba:: T1050A-GFP-10(T1050A-1,T1050A-7,和T1050A-10),其呈现类似的SlBRI1-1的SlBRI1表达水平,选择;的转录水平gydF4y2BaSlBRI1gydF4y2Ba在这些转基因中比那些更大的转基因素大于2倍gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba(图。gydF4y2Ba1gydF4y2Baa,b)。gydF4y2Ba
THR-1050的去磷酸化提高植株营养生长。gydF4y2Ba一个gydF4y2Ba上图为使用抗绿色荧光蛋白(GFP)抗体对转基因蛋白表达的western blot分析。CBB,考马斯亮蓝色。底部为种子发芽期(播种后8天)、苗期(播种后40天)和成熟期(播种后120天)的植株表型。gydF4y2BabgydF4y2Ba相对转录水平gydF4y2BaSlBRI1gydF4y2Ba通过QRT-PCR。gydF4y2BacgydF4y2Ba在成熟阶段的植物植物高度。gydF4y2BadgydF4y2Ba节间长度及(gydF4y2BaegydF4y2Ba)第二花节茎粗。gydF4y2BafgydF4y2Ba植物在成熟阶段的生长。gydF4y2BaggydF4y2Ba茎叶角度,(gydF4y2BahgydF4y2Ba)通过在1500x放大的视野下扫描电子显微镜来通过扫描电子显微镜(gydF4y2Ba我gydF4y2Ba)第六叶的叶面积。gydF4y2BajgydF4y2Ba在300倍放大的视野下,第六片叶子每单位的细胞数。数据是至少5个独立生物样本的平均值±SDs。gydF4y2Ba星号gydF4y2Ba与p相比表明显着差异gydF4y2BaSlBRI1gydF4y2Ba:: SlBRI1-GFP植物(*gydF4y2BaPgydF4y2Ba < 0.05; **PgydF4y2Ba< 0.01;学生的学习任务)gydF4y2Ba
在营养生长期,PgydF4y2BaSlBRI1gydF4y2Ba:: T1050A-GFP比P更好gydF4y2BaSlBRI1gydF4y2Ba:: SlBRI1-GFP和gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba(图。gydF4y2Ba1gydF4y2Baa).株高、节间长和茎粗在PgydF4y2BaSlBRI1gydF4y2Ba:: T1050A-GFP和PgydF4y2BaSlBRI1gydF4y2Ba:: SlBRI1-GFP;但是,这些数值分别是正常的2.3倍、1.5倍和1.2倍gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba分别(无花果。gydF4y2Ba1gydF4y2BaC,D,E)。总体而言,P.gydF4y2BaSlBRI1gydF4y2Ba:: T1050A-GFP表现出最大程度的植物膨胀和最大的茎叶角度:植物膨胀为P的1.2-折叠gydF4y2BaSlBRI1gydF4y2Ba:: SlBRI1-GFP和gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba,茎叶倾角分别是P . P .的1.1倍和1.2倍gydF4y2BaSlBRI1gydF4y2Ba:: SlBRI1-GFP和gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba分别(无花果。gydF4y2Ba1gydF4y2BaF,G)。为了比较在叶发育,叶面积和CO的差异gydF4y2Ba2gydF4y2Ba同化率进行了分析。P的叶面积gydF4y2BaSlBRI1gydF4y2Ba::T1050A-GFP是P .gydF4y2BaSlBRI1gydF4y2Ba:: SlBRI1-GFP;这种差异主要是由于细胞较大,如PgydF4y2BaSlBRI1gydF4y2Ba::T1050A-GFP为PgydF4y2BaSlBRI1gydF4y2Ba:: SLBRI1-GFP(图。gydF4y2Ba1gydF4y2Bah, i, j)gydF4y2Ba2gydF4y2Ba所有植物的同化率相同(附加文件gydF4y2Ba2gydF4y2Ba:图S2)。综上所述,这些结果表明,thrl -1050的去磷酸化可以挽救SlBRI1的株高和光合功能,甚至在营养生长期促进植株扩张和叶细胞扩张。gydF4y2Ba
THR-1050的去磷酸化提高番茄产量gydF4y2Ba
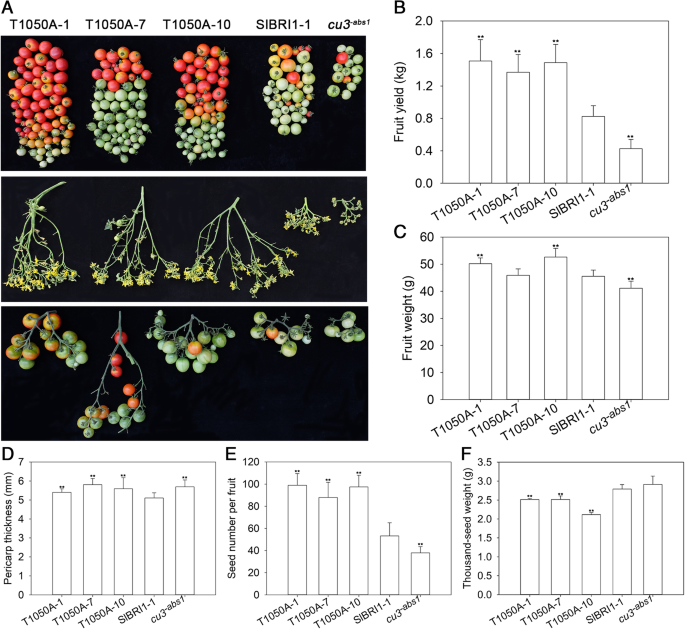
为了评价Thr-1050对果实产量的影响,我们研究了开花时间、单果重、每簇果数、果皮厚度、种子数和千粒重等相关因素。例如,表达T1050A的植株开花时间比P早1周gydF4y2BaSlBRI1gydF4y2Ba::SlBRI1plants and 2 weeks earlier than didCU3.gydF4y2Ba-abs1.gydF4y2Ba植物。磷肥的单株产量gydF4y2BaSlBRI1gydF4y2Ba::T1050A-GFP是P的1.8倍和3.4倍gydF4y2BaSlBRI1gydF4y2Ba:: SlBRI1-GFP和gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba分别,这些差异主要是每簇的不同果实数(图。gydF4y2Ba2gydF4y2Baa,b)。此外,单果重对于PgydF4y2BaSlBRI1gydF4y2Ba:: T1050A-GFP比对于P较重的9%gydF4y2BaSlBRI1gydF4y2Ba::SlBRI1-GFP,因为前者的果皮厚10%(图。gydF4y2Ba2gydF4y2BaC,D)。关于每果种子,那些表达T1050A含有1.8倍以上那些P的gydF4y2BaSlBRI1gydF4y2Ba:: SlBRI1-GFP;而PgydF4y2BaSlBRI1gydF4y2Ba:: T1050A-GFP仅略低于PgydF4y2BaSlBRI1gydF4y2Ba:: SLBRI1-GFP(图。gydF4y2Ba2gydF4y2Bae,f)。因此,苏氨酸1050似乎在番茄产量的作用。gydF4y2Ba
Thr-1050的脱磷酸化促进番茄产量。gydF4y2Ba一个gydF4y2Ba顶部,从第一个果实节点到第四个果实节点。中部,表型为第三花序。下面是第三簇的表型。gydF4y2BabgydF4y2Ba单株果实产量。gydF4y2BacgydF4y2Ba红色成熟(RR)阶段的个体果子重。gydF4y2BadgydF4y2Ba果实黄熟期的果皮厚度。gydF4y2BaegydF4y2Ba单果种子数。gydF4y2BafgydF4y2BaThousand-seed重量。数据为15个独立生物样本的平均值±SDs。gydF4y2Ba星号gydF4y2Ba与p相比表明显着差异gydF4y2BaSlBRI1gydF4y2Ba:: SlBRI1-GFP植物(*gydF4y2BaPgydF4y2Ba < 0.05; **PgydF4y2Ba< 0.01;学生的学习任务)gydF4y2Ba
SlBRI1 thr1050 - ala改变果实品质gydF4y2Ba
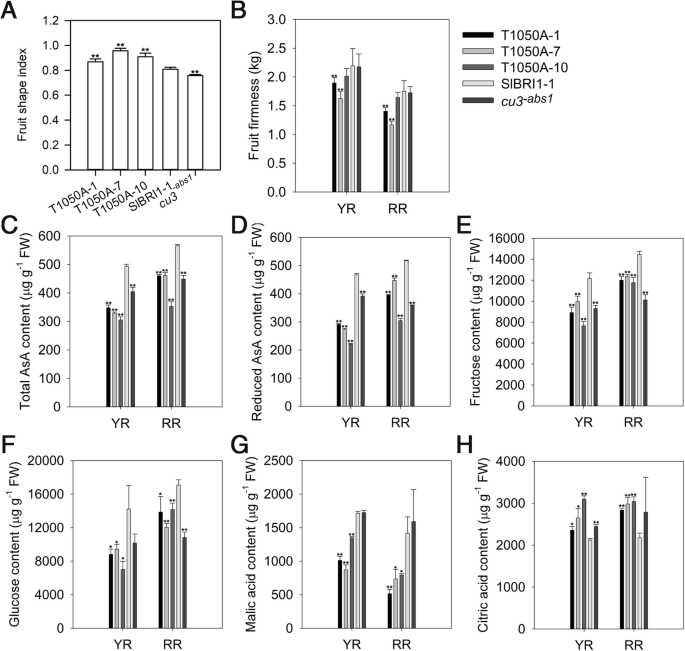
我们还调查了Thr-1050在水果质量方面的作用。SLBRI1和T1050A都能够拯救水果质量gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba.以P相比gydF4y2BaSlBRI1gydF4y2Ba:: SLBRI1-GFP,P的果实gydF4y2BaSlBRI1gydF4y2Ba::T1050A-GFP在成熟期形状指数较大,但硬度较小(图)。gydF4y2Ba3.gydF4y2Ba果实中总抗坏血酸(AsA)含量为磷的66%gydF4y2BaSlBRI1gydF4y2Ba::SlBRI1-GFP果实在黄色成熟期(YR)和红色成熟期(RR)相同果实的75%。AsA含量分别比P低56和74%gydF4y2BaSlBRI1gydF4y2Ba::分别在Yr和RR阶段的SLBRI1-GFP(图。gydF4y2Ba3.gydF4y2BaC,D)。另外,测量诸如果糖和葡萄糖的可溶性糖的含量。p的果实中的果糖含量gydF4y2BaSlBRI1gydF4y2Ba::T1050A-GFP在成熟期和成熟期分别降低了27和17%,葡萄糖含量分别降低了41和22%。gydF4y2Ba3.gydF4y2Ba并对苹果酸、柠檬酸等有机酸的含量进行了分析。结果表明,红豆杉果实中苹果酸含量显著高于红豆杉gydF4y2BaSlBRI1gydF4y2Ba:: T1050A-GFP比P的果实低37和48%gydF4y2BaSlBRI1gydF4y2Ba::在Yr和RR阶段的SLBRI1-GFP;然而,柠檬酸含量为27和36%(图。gydF4y2Ba3.gydF4y2Bag,h)。观察到转基因素中可溶性固体内容物的显着差异(附加文件gydF4y2Ba3.gydF4y2Ba:图S3)。gydF4y2Ba
Thr-1050去磷酸化改变果实品质。gydF4y2Ba一个gydF4y2Ba果子形状指数在断路器阶段。gydF4y2BabgydF4y2Ba果实在黄熟期(YR)和红熟期(RR)的硬度。gydF4y2BacgydF4y2Ba和(gydF4y2BadgydF4y2Ba)总抗坏血酸(ASA)的含量(gydF4y2BacgydF4y2Ba)和降低AsA (gydF4y2BadgydF4y2Ba).gydF4y2BaegydF4y2Ba, (gydF4y2BafgydF4y2Ba),(gydF4y2BaggydF4y2Ba)和(gydF4y2BahgydF4y2Ba)果糖含量(gydF4y2BaegydF4y2Ba),葡萄糖(gydF4y2BafgydF4y2Ba)、苹果酸(gydF4y2BaggydF4y2Ba),和柠檬酸(gydF4y2BahgydF4y2Ba)使用HPLC测量。(gydF4y2Ba一个gydF4y2Ba)和(gydF4y2BabgydF4y2Ba)为15个独立生物样品的平均值±SDs;数据(gydF4y2BacgydF4y2Ba) 到 (gydF4y2BahgydF4y2Ba)是平均值±3个独立的生物样品的SDS。FW = fresh weight.星号gydF4y2Ba与p相比表明显着差异gydF4y2BaSlBRI1gydF4y2Ba:: SlBRI1-GFP植物(*gydF4y2BaPgydF4y2Ba < 0.05; **PgydF4y2Ba< 0.01;学生的学习任务)gydF4y2Ba
SlBRI1 thr1 -1050磷酸化影响BR信号gydF4y2Ba
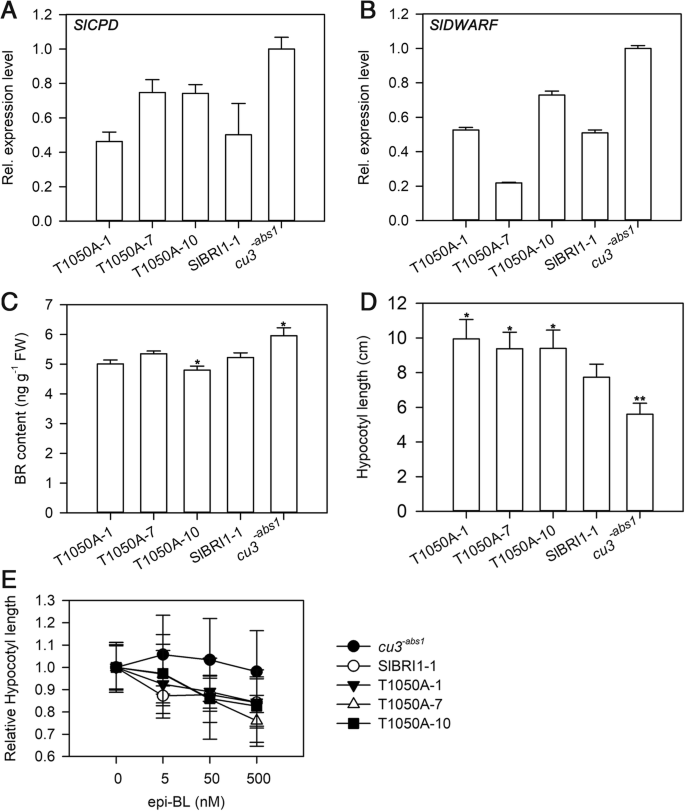
SlBRI1作为BR受体,在BR信号转导中起着关键作用。为了确定Thr-1050磷酸化是否通过影响BR信号、BR生物合成、下胚轴伸长和幼苗BR敏感性来调控番茄的发育,我们测定了幼苗BR信号强度gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2BaPgydF4y2BaSlBRI1gydF4y2Ba:: SlBRI1-GFP, PgydF4y2BaSlBRI1gydF4y2Ba:: T1050A-GFP。番茄BR生物合成基因的表达水平gydF4y2BaSlCPDgydF4y2Ba和gydF4y2BaSLDWARF.gydF4y2Ba通过定量实时PCR(QRT-PCR)进行了评估。虽然表达水平gydF4y2BaSlCPDgydF4y2Ba和gydF4y2BaSLDWARF.gydF4y2Ba处在较高gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba比在转基因素中,P之间没有明显的差异gydF4y2BaSlBRI1gydF4y2Ba:: SlBRI1-GFP和PgydF4y2BaSlBRI1gydF4y2Ba:: T1050A-GFP(图。gydF4y2Ba4gydF4y2Baa、b)。图gydF4y2Ba4gydF4y2Bac表明,转基因品系中BR含量与对照相似,但比对照低18%左右gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba.此外,研究了外源24-表油菜素内酯(epi-BL) 4种浓度对番茄BR敏感性的影响。如图所示。gydF4y2Ba4gydF4y2Bae,gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba是不敏感的epi-BL;与此相反,下胚轴P中长度gydF4y2BaSlBRI1gydF4y2Ba:: SlBRI1-GFP和PgydF4y2BaSlBRI1gydF4y2Ba::T1050A-GFP同样被epi-BL降低。在500nm的epi-BL处理下,PgydF4y2BaSlBRI1gydF4y2Ba:: SlBRI1-GFP和PgydF4y2BaSlBRI1gydF4y2Ba::T1050A-GFP分别下降16和19%。因此,与SlBRI1类似,Thr-1050能够拯救植物中的BR信号。而下胚轴在黑暗条件下伸长的结果表明,PgydF4y2BaSlBRI1gydF4y2Ba:: T1050A-GFP表现出最长的幼杆长度,比其更长的71%和24%gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba和PgydF4y2BaSlBRI1gydF4y2Ba:: SLBRI1-GFP(图。gydF4y2Ba4gydF4y2Bad).这一结果表明,在PgydF4y2BaSlBRI1gydF4y2Ba::T1050A-GFP较P强gydF4y2BaSlBRI1gydF4y2Ba:: SlBRI1-GFP。gydF4y2Ba
thr1050去磷酸化影响BR信号。gydF4y2Ba一个gydF4y2Ba和(gydF4y2BabgydF4y2Ba)BR信号标志物基因的相对转录物水平gydF4y2BaSlCPDgydF4y2Ba和gydF4y2BaSLDWARF.gydF4y2Ba采用qRT-PCR检测。gydF4y2BacgydF4y2Ba用BR酶联免疫吸附测定法测定第三叶BR含量。数据为3个独立生物样本的平均值±SDs。gydF4y2BadgydF4y2Ba幼苗下胚轴长度在培养基表面黑暗生长9天。gydF4y2BaegydF4y2Ba在增加表油菜素内酯(epibrassinolide, epi-BL)浓度的培养基表面,在黑暗条件下生长9天的幼苗相对下胚轴长度的剂量-响应曲线。数据(gydF4y2BadgydF4y2Ba)和(gydF4y2BaegydF4y2Ba)为15个独立生物样品的平均值±SDs。gydF4y2Ba星号gydF4y2Ba与p相比表明显着差异gydF4y2BaSlBRI1gydF4y2Ba:: SlBRI1-GFP植物(*gydF4y2BaPgydF4y2Ba < 0.05; **PgydF4y2Ba< 0.01;学生的学习任务)gydF4y2Ba
SlBRI1的SlBRI1 THR-1050影响自身磷酸化的磷酸化gydF4y2Ba
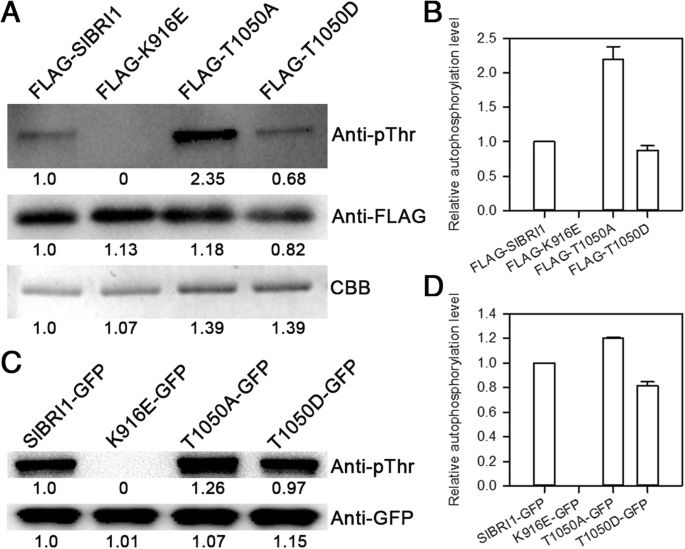
随着类似的受体激酶的功能,自身磷酸化起着BR信号转导和SlBRI1的生物学功能至关重要的作用。为了进一步确定是否THR-1050磷酸化的影响SlBRI1自磷酸化,SlBRI1,T1050A和T1050D(苏氨酸 - 1050 - 天冬氨酸)的自磷酸化水平在体内和体外进行比较。使用含有SlBRI1,T1050A和T1050D的胞质结构域的质粒pFLAG-MAC向量用于体外分析。结果表明,突变THR-1050-d SlBRI1自磷酸化负面影响,如FLAG-T1050A表明磷酸化带,磷酸化水平的强度最强,其中是2.5和2.2分别倍于FLAG-T1050D和FLAG-SlBRI1,的(无花果。gydF4y2Ba5gydF4y2Baa,b)。gydF4y2Ba
Thr-1050的去磷酸化影响SLBRI1自磷酸化。gydF4y2Ba一个gydF4y2Ba体外SlBRI1的自身磷酸化水平。使用抗PTHR抗体检测重组FLAG-SlBRI1的自磷酸化活性,FLAG-T1050A,FLAG-T1050D,和FLAG-K916E蛋白质,以及使用抗FLAG抗体和免疫印迹法检测重组蛋白的等分试样。考马斯亮蓝(CBB)染色显示加载。gydF4y2BabgydF4y2Ba体外检测FLAG-SlBRI1、FLAG-T1050A、FLAG-T1050D和FLAG-K916E蛋白的相对自磷酸化水平。定义FLAG-SlBRI1的自磷酸化水平为“1”。数据是3个独立测量的平均值±SDs。gydF4y2BacgydF4y2Ba体内SlBRI1的自磷酸化水平。SlBRI1绿色荧光蛋白(GFP),使用抗PTHR抗体检测T1050A-GFP,T1050D-GFP,和K916E-GFP蛋白的自磷酸化活性;抗GFP抗体来显示免疫印迹的负荷水平。gydF4y2BadgydF4y2BaSlBRI1-GFP、T1050A-GFP、T1050D-GFP和K916E-GFP蛋白在体内的相对自磷酸化水平。定义SlBRI1-GFP的自磷酸化水平为“1”。数据是3个独立测量的平均值±SDsgydF4y2Ba
为了进一步比较体内的自磷酸化,来自gydF4y2Ba烟草benthamianagydF4y2Ba提取并检查表达SLBRI1-GFP,T1050A-GFP和T1050D-GFP的叶子。如图所示。gydF4y2Ba5gydF4y2Bac和无花果。gydF4y2Ba5gydF4y2Bad,T1050A-GFP和SlBRI1-GFP的磷酸化水平较T1050D-GFP的更强48和23%之间。总的来说,在体外和体内测定法自磷酸化两者建议用于SlBRI1自磷酸化苏氨酸 - 磷酸化1050的负作用。gydF4y2Ba
讨论gydF4y2Ba
许多研究表明BRI1在植物生长中的保守作用。丧失函数gydF4y2BaBRI1gydF4y2Ba突变体表现出一般特征,如矮化表型、深绿色叶片和不育[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba].相反,过度的gydF4y2BaBri1.gydF4y2Ba促进植物萌发、开花及种子产量,并加速成熟[gydF4y2Ba24.gydF4y2Ba].我们的研究旨在研究SLBRI1磷酸化位点对番茄农艺性状的影响。为了探讨SLBRI1中THR-1050的保护,来自六种植物物种的BRI1同源物的蛋白质序列,SLBRI1(登录No.Node NP_001296180.1),StBRI1(gydF4y2Ba茄属植物tuberosumgydF4y2Ba,登记号XP_006357355.1),BRI1(gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba,加入不。NP_195650.1)、OsBRI1 (gydF4y2Ba栽培稻gydF4y2Ba,加入不。NP_001044077.1)、TaBRI1 (gydF4y2BaTriticum aestivum.gydF4y2Ba,加入不。DQ_655711.1)和ZmBRI1 (gydF4y2Ba玉米gydF4y2Ba,加入号XP_008656807.1)被选择进行比较。多个序列对齐显示,在这些植物物种中,Thr-1050高度保守,表明在BR信号传导和植物生长中的重要作用(附加文件gydF4y2Ba4gydF4y2Ba:图S4)。在拟南芥中,Thr-1045相当于番茄蛋白中的Thr-1050。以前的研究表明,BRI1 THR-1045可能积极调节BR信号传导和植物生长,因为不磷酸化的SER-1044或THR-1045导致矮化表型并降低BR信号转导。gydF4y2Ba31.gydF4y2Ba].我们产生了表达SlBRI1或T1050A转基因番茄系,并且该结果显示出Thr1050充当生长在这种作物的负调节物。与之比较gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba和gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba而Thr-1050被去磷酸化的植株植株生长速度更快,叶面积更大,开花和成熟时间更早,产量也更高。gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba).这些发现表明,Thr-1050在番茄和拟南芥中的相反举止。gydF4y2Ba
植物产量在番茄生产中最重要的农艺性状之一,生物圈保护区被认为是生长促进剂,可以增加农业产量。我们的研究结果表明,个人P的产量gydF4y2BaSlBRI1gydF4y2Ba::T1050A-GFP植株是P .gydF4y2BaSlBRI1gydF4y2Ba:: SlBRI1-GFP植物和3.4倍于gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba植物。每个簇的较大的花数和果实重量较大的屈服增加(图。gydF4y2Ba2gydF4y2Ba).然而,由于果实产量的生理限制受到植物光合能力的限制,通常不需要花更多的数量来获得更高的产量[gydF4y2Ba32.gydF4y2Ba].事实上,一个类似的结果也被报道过gydF4y2BaSlBRI1gydF4y2Ba由花数增加促进单株产量,尽管水果重量减少[gydF4y2Ba26.gydF4y2Ba].为了调查这种现象,我们评估了与光合作用有关的特征。PgydF4y2BaSlBRI1gydF4y2Ba::T1050A-GFP植物显示出相似的植物高度和COgydF4y2Ba2gydF4y2Ba但更大的叶面积和更大的植物扩张。由于叶面积增加的程度大于植株扩张的程度,PgydF4y2BaSlBRI1gydF4y2Ba::T1050A-GFP植株叶面积指数更大,开花和结果产生更多的光合产物。此外,在拟南芥上的研究表明,BRI1残基Ser-1042、Ser-1168、Ser-1172、Ser-1179和Thr-1180通过调节分支和有效角粒的数量影响单株产量[gydF4y2Ba33.gydF4y2Ba].因此,我们认为Thr-1050对单株产量的调控作用与SlBRI1不同,因为Thr-1050通过叶面积指数控制花序构型和果实膨大。gydF4y2Ba
作物产量不仅取决于单株产量,也取决于株密度。既往研究报道,部分抑制的表达gydF4y2BaOsBRI1gydF4y2Ba增加30%的产量,因为相对紧凑的植物结构和较高的种植密度[gydF4y2Ba19.gydF4y2Ba].同样,BRI1中的Ser-1042也影响种子产量,因为S1042A突变体具有正常的种子产量,但植株结构相对更紧凑[gydF4y2Ba33.gydF4y2Ba].在我们的研究中,P中的扩张gydF4y2BaSlBRI1gydF4y2Ba::T1050A-GFP是PgydF4y2BaSlBRI1gydF4y2Ba:: SlBRI1-GFP;因此,P的种植密度gydF4y2BaSlBRI1gydF4y2Ba:: T1050A-GFP为P的83%gydF4y2BaSlBRI1gydF4y2Ba:: SlBRI1-GFP。但是,P的个人收益率gydF4y2BaSlBRI1gydF4y2Ba::T1050A-GFP植株是P .gydF4y2BaSlBRI1gydF4y2Ba:: SLBRI1-GFP植物(图。gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba).这两个参数共同作用,提高了磷的产量gydF4y2BaSlBRI1gydF4y2BaT1050A-GFP约为P的150%gydF4y2BaSlBRI1gydF4y2Ba:: SLBRI1-GFP每区域,表明THR-1050在作物育种中的高产潜力。gydF4y2Ba
番茄果实的品质也可以通过BR信号调控。以往的研究表明,过量表达gydF4y2BaSlBRI1gydF4y2Ba加速果实成熟和通过促进乙烯生产[增加类胡萝卜素,可溶性固形物,ASA和可溶性糖的含量gydF4y2Ba26.gydF4y2Ba].此外,研究还发现参与BR反应的转录因子BZR1调控果实品质,从而外源表达gydF4y2BaBZR1gydF4y2Ba导致水果中类胡萝卜素、可溶性固形物、AsA和可溶性糖的含量增加[gydF4y2Ba34.gydF4y2Ba].在我们的研究中,PgydF4y2BaSlBRI1gydF4y2Ba::与P相比,T1050A-GFP果实早些时候成熟gydF4y2BaSlBRI1gydF4y2Ba::SlBRI1-GFP果实的乙烯产量、可溶性固形物含量和类胡萝卜素含量(数据未显示)相近,但AsA、可溶性糖和苹果酸含量较低,硬度较低。相比之下,PgydF4y2BaSlBRI1gydF4y2Ba::T1050A-GFP水果的柠檬酸含量更高,形状指数也更高。gydF4y2Ba3.gydF4y2Ba).因此,我们可以得出结论,苏氨酸-1050的调节作用,果实品质不同于SlBRI1的。推广gydF4y2BaSlBRI1gydF4y2Ba在番茄成熟过程中主要是由于乙烯进化的增加;但由于内源乙烯含量没有变化,Thr1050位点缺乏磷酸化对果实品质的影响与乙烯无关。Thr-1050和SlBRI1在果实品质上的这些功能差异可能是由于它们自身的差异造成的。此外,我们使用了gydF4y2BaSlBRI1gydF4y2Ba而花椰菜花叶病毒35S启动子在前期研究中也被使用,这也可能是造成这些差异的原因。gydF4y2Ba
已有研究表明,BR信号在BR生物合成和BR敏感性中起调节作用,BR信号中的BR突变体表现出BR不敏感性和较高水平的BR生物合成基因表达[gydF4y2Ba27.gydF4y2Ba,gydF4y2Ba35.gydF4y2Ba,gydF4y2Ba36.gydF4y2Ba,gydF4y2Ba37.gydF4y2Ba,gydF4y2Ba38.gydF4y2Ba].作为BR受体,SlBRI1通过调节番茄BR信号转导影响植物生长;转基因植物overexpressinggydF4y2BaSlBRI1gydF4y2Ba表现出增加的BR信号传导,因此具有更长的次杆子并降低Br生物合成基因的转录gydF4y2BaSlCPDgydF4y2Ba和gydF4y2BaSLDWARF.gydF4y2Ba[gydF4y2Ba26.gydF4y2Ba].与之前的发现一致,PgydF4y2BaSlBRI1gydF4y2Ba在我们的研究:: T1050A-GFP植株下列证据的基础上做强BR信号强度。首先,的表达水平gydF4y2BaSlCPDgydF4y2Ba和gydF4y2BaSLDWARF.gydF4y2Ba,应该是BR信号的反馈禁止[gydF4y2Ba37.gydF4y2Ba,gydF4y2Ba38.gydF4y2Ba],分别为P的相似gydF4y2BaSlBRI1gydF4y2Ba:: T1050A-GFP和PgydF4y2BaSlBRI1gydF4y2Ba:: SLBRI1-GFP工厂和低于那些gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba.其次,P的BR内容gydF4y2BaSlBRI1gydF4y2Ba:: T1050A-GFP工厂等于P的植物gydF4y2BaSlBRI1gydF4y2Ba:: SLBRI1-GFP工厂和低于那些gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba.三,P的下胚轴gydF4y2BaSlBRI1gydF4y2Ba::T1050A-GFP较PgydF4y2BaSlBRI1gydF4y2Ba::暗培养条件下SlBRI1-GFP。最后,PgydF4y2BaSlBRI1gydF4y2Ba::T1050A-GFP植物对BR更敏感,因为其相对下胚轴长度比P .gydF4y2BaSlBRI1gydF4y2Ba::SlBRI1-GFP在epi-BL处理的暗培养条件下。由此可见,在BR信号强度方面,T1050A的恢复能力强于SlBRI1,这可能在一定程度上解释了PgydF4y2BaSlBRI1gydF4y2Ba:: T1050A-GFP和PgydF4y2BaSlBRI1gydF4y2Ba:: SLBRI1-GFP(图。gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
BRI1已显示功能作为丝氨酸/苏氨酸/酪氨酸蛋白激酶,其经由磷酸化位点转导BR信号[gydF4y2Ba5gydF4y2Ba].此前在拟南芥上的研究表明,BRI1的Thr-1045(类似于SlBRI1的Thr-1050)可能对BRI1激酶的功能至关重要,因为S1044A或T1045A突变几乎消除了BR信号,并在体外自磷酸化水平方面表现出矮化表型[gydF4y2Ba31.gydF4y2Ba].相比之下,与体内和体外的SlBri1相比,我们的结果显示出更高水平的T1050A自磷酸化(图。gydF4y2Ba5gydF4y2Ba).先前的研究还报告说,与SlBRI1相比,T1050A保留完整的激酶活性在体外gydF4y2Ba29.gydF4y2Ba].因此,我们证明了Thr-1050可能通过积极影响SlBRI1的激酶功能来调节植物的生长,而这一模式与拟南芥中BRI1 Thr-1045的模式相反。gydF4y2Ba
此外,由于Thr-1050被Ala-1050取代而导致的SlBRI1蛋白的结构变化也可能影响激酶的功能。为了研究这一现象,我们对T1050A和SlBRI1进行了蛋白质三维折叠结构预测和亚细胞定位研究。结果表明,Thr-1050的去磷酸化并没有改变SlBRI1的蛋白结构和亚细胞定位,这与SlBRI1对质膜的定位一致(Additional files)gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba: 图。S5,S6)。仍然需要鉴定相关的相互作用蛋白和下游靶基因的额外研究以了解THR-1050的调节机制。gydF4y2Ba
结论gydF4y2Ba
BRs是一组在低浓度下调节各种生物过程的植物激素。然而,BR信号强度难以精确控制,试图对BR信号进行操纵会造成不稳定的影响,导致不能充分发挥BR潜能。gydF4y2BaBri1.gydF4y2Ba与BR信号转导的组分的表达和磷酸化水平相关,以及BRI1中的特定丝氨酸/苏氨酸/酪氨酸残基的功能随拟南芥生长而变化。然而,在番茄中仍然不清楚SLBRI1磷酸化位点的相关农艺性状和分子机制。我们的结果揭示了Thr-1050在番茄中的生物学功能。转基因番茄植物含有T1050A的强大BR信号强度,自磷酸化水平更高,营养发育更高,产量更高,果实营养物质较低。这些结果突出了番茄育种中SLBRI1磷酸化位点的潜力,并提供了通过精确控制BR信号传导来建立高产番茄品种的分子基础。gydF4y2Ba
方法gydF4y2Ba
定点突变和载体构建gydF4y2Ba
构建表达野生型的植物表达载体gydF4y2BaSlBRI1gydF4y2Ba(P.gydF4y2BaSlBRI1gydF4y2Ba:: SlBRI1-GFP-pBI121),全身gydF4y2BaSlBRI1gydF4y2Ba基因(solyc04g051510)没有止码子及其来自番茄的启动子(gydF4y2BaSolanum lycopersicum.gydF4y2Ba简历。很会赚钱的)被放大。天然的促进剂gydF4y2BaSlBRI1gydF4y2Ba(2989 bp)首次克隆到gydF4y2Ba后gydF4y2BaIII和gydF4y2BaXBA.gydF4y2Ba我的二元PBI121向量(Clontech,Palo Alto,CA)的网站以取代35s启动子。放大的gydF4y2BaSlBRI1gydF4y2Ba重组为pBI121,其序列为gfp编码序列,随后为CT区域。为了获得表达SlBRI1突变体T1050A(将Thr-1050替换为丙氨酸)或T1050D(将Thr-1050替换为天冬氨酸)的植物表达载体,PgydF4y2BaSlBRI1gydF4y2Ba::以SlBRI1-GFP-pBI121为模板,通过重叠PCR扩增产生T1050A和T1050D位点突变。测序验证后,将所有结构转化为gydF4y2Ba农杆菌肿瘤术gydF4y2Ba菌株GV3101转化番茄。gydF4y2Ba
全长的野生型SlBRI1,T1050A和T1050D序列从植物表达载体扩增,并克隆到CaM35S-GFP载体用于体内[磷酸化分析gydF4y2Ba39.gydF4y2Ba].从植物表达载体中扩增出SlBRI1、T1050A和T1050D的胞质结构域(815 aa至1196 aa),并克隆到pFLAG-MAC载体(Sigma-Aldrich Saint Louis, MO, USA)中进行体外磷酸化分析。由赖氨酸-916-谷氨酸(K916E)取代不变残基产生的激酶失活突变体如上文所述设计,并在磷酸化分析中用作阴性对照[gydF4y2Ba29.gydF4y2Ba];该突变体的保守Lys残基在体外和体内均缺乏激酶活性。本研究使用的引物均列于附录表S1(补充文件)gydF4y2Ba7gydF4y2Ba).gydF4y2Ba
番茄转型gydF4y2Ba
关于番茄的转化,gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba用作根据子叶的转化方法转基因受体。三个独立的纯合子PgydF4y2BaSlBRI1gydF4y2Ba:: T1050A线条(PgydF4y2BaSlBRI1gydF4y2Ba:: T1050A-1, PgydF4y2BaSlBRI1gydF4y2Ba:: T1050A-7和PgydF4y2BaSlBRI1gydF4y2Ba::T1050A-10)和一个依赖的纯合子PgydF4y2BaSlBRI1gydF4y2Ba:: SLBRI1-1线在本研究中使用。所有转基因素级都提出到TgydF4y2Ba2gydF4y2Ba的一代。gydF4y2Ba
胚轴伸长对外源BL的反应gydF4y2Ba
种子的gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba将转基因株系接种于含有0 nM、5 nM、50 nM和500 nM epi-BL的1/2 MS培养基(1/2浓度的Murashige和Skoog培养基,含0.75%琼脂和2%蔗糖,pH为5.8)的培养瓶中;瓶子在25°C的黑暗中放置9天。下胚轴长度测量到最接近0.1 cm;下胚轴的相对长度是不同浓度epi-BL对下胚轴长度的相对变化。每个处理至少有15株幼苗被随机检查。gydF4y2Ba
农艺性状特征gydF4y2Ba
对于农业性状的调查,所有的番茄植株,包括那些转基因株系和gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba线条在天然日光和温度条件下在玻璃屋中生长。根据以下规则在果实成熟阶段(播种后120天)测量营养开发中涉及的农艺性状:植物高度被认为是从地面到植物顶部的距离;阀杆直径和髁间距离被认为是第二花节点的直径和长度;植物膨胀被认为是植物的最大直径;在第六叶上测量叶面积和茎叶角;通过扫描测量叶面积,然后使用图像J软件计算。并且茎叶角表示叶子和茎之间的角度。每个转基因至少5株植物和gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba线用于每个特征。gydF4y2Ba
生殖发育相关农艺性状的测定按以下原则进行:单果重考虑为RR期单果重;每一簇的果实数视为第三簇的果实数;果实形状指数为破果期纵向直径与横向直径之比;单株产量考虑第1 ~ 4个果节的总重;用游标卡尺测定果实黄熟期果皮厚度;用手持贯入仪(FHM-1,日本)测量水果的硬度;种子的数量被认为是每个果实的种子数量。每个特性至少使用15个独立的生物学重复。gydF4y2Ba
扫描电子显微镜观察gydF4y2Ba
从转基因和gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba分离植物,通过扫描电镜观察细胞大小和数量。如前所述进行样品制备,并使用S-4800扫描电子显微镜(日立,日本)对样品进行显微照相[gydF4y2Ba40gydF4y2Ba].在1500x放大的视野下用扫描电子显微镜比较细胞大小,在300x放大的视野下统计单位叶面积的细胞数。gydF4y2Ba
定量实时PCR分析gydF4y2Ba
从转基因各种组织总RNA,gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba使用RNAiso Plus试剂盒(TaKaRa,大连,中国)提取植物,并根据制造商的协议,用转录子第一链cDNA合成试剂盒(Roche, Mannheim,德国)转录成cDNA。使用SYBR Green Master Mix试剂盒(Vazyme, Nanjing, China)进行qRT-PCR,如前所述[gydF4y2Ba41.gydF4y2Ba].番茄gydF4y2BaUBI3.gydF4y2Ba基因用作内部对照,并且所有的引物列于表S1中列出gydF4y2Ba26.gydF4y2Ba,gydF4y2Ba42.gydF4y2Ba)(附加文件gydF4y2Ba7gydF4y2Ba).通过标准曲线分析验证各引物组合的扩增效率。每个样品由3个生物学重复和技术重复表示。gydF4y2Ba
免疫印迹分析gydF4y2Ba
从表达野生型SlBRI1、Thr1050A、T1050D或K916E的25日龄番茄幼苗(0.2 g)中提取总蛋白,并与2x SDS凝胶加载缓冲液混合。手术过程如前所述[gydF4y2Ba31.gydF4y2Ba].gydF4y2Ba
分析有限公司gydF4y2Ba2gydF4y2Ba同化率gydF4y2Ba
从两种转基因的第六叶片和gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba选择植物来测量COgydF4y2Ba2gydF4y2Ba基于红外气体分析仪的便携式光合作用系统(LI-6800;LI-COR,林肯,东北,美国)。的有限公司gydF4y2Ba2gydF4y2Baconcentration and PPFD used for measurement were 400 μmol mol- 1gydF4y2Ba800 μmol mgydF4y2Ba- 2gydF4y2Ba年代gydF4y2Ba- 1gydF4y2Ba,分别。gydF4y2Ba
BR含量的测定gydF4y2Ba
来自转基因的第三片(0.5g)和gydF4y2BaCU3.gydF4y2Ba-abs1.gydF4y2Ba采用BR酶联免疫吸附测定试剂盒(MyBiosource, San Diego, USA, Cat)。#MBS9364120),根据制造商的说明。用3个独立的生物样品对每个品系的结果进行定量分析。gydF4y2Ba
测定抗坏血酸,可溶性糖,有机酸和可溶性固体含量gydF4y2Ba
收获Yr和RR阶段的果实进行分析。如前所述进行ASA提取和分析[gydF4y2Ba43.gydF4y2Ba].从0.5g水果果皮组织中提取可溶性糖,与15ml蒸馏水混合,随后在沸水浴中加热20分钟。将溶液冷却至室温并以4000×G离心10分钟。之后,将上清液稀释至25mL,然后使用安捷伦ZORBAX色谱柱(4.6×150mm,5μm,安捷伦,帕洛阿尔托,CA,美国,PN。843,300-908)。如前所述进行有机酸萃取[gydF4y2Ba44.gydF4y2Ba],采用高效液相色谱(1260 RID, Agilent, Palo Alto, CA, USA)检测,采用Agilent Zorbax SB-C18色谱柱(4.6 × 150 mm, 5 μm, Agilent, Palo Alto, CA, USA, PN)。883975 - 902)。用手持式折射仪(成都光学仪器厂,中国成都)检测新鲜果汁的可溶性固形物含量。3个独立的生物样品和3个技术重复,通过外部校准对每条线的结果进行定量。gydF4y2Ba
自动磷酸化分析gydF4y2Ba
对于体外自磷酸化分析,将野生型SLBRI1,T1050a,T1050d和K916e的细胞质结构域的构建体亚克隆到Pflag-MAC载体中,然后转化为gydF4y2Ba大肠杆菌gydF4y2BaBL21(DE3)底层(Transcene,北京,中国)。如前所述的蛋白质纯化和自磷酸化测定方法[gydF4y2Ba31.gydF4y2Ba,gydF4y2Ba45.gydF4y2Ba].使用抗PTHR抗体(CST,丹弗斯,MA,USA,目录#93815)检测重组蛋白的磷酸化活性,并使用抗FLAG抗体(转基因,中国北京)检测重组蛋白的等分。实验重复3次,结果一致。使用ImageJ软件不饱和带的强度进行定量并表示为相对值与FLAG-SlBRI1比较。gydF4y2Ba
对于自磷酸化在体内分析中,含有指示的构建菌株GV3101(野生型SlBRI1-GFP,T1050A-GFP,T1050D-GFP,或K916E-GFP)中的溶液在补充有合适的抗生素的液体LB培养基中生长过夜。将培养物离心,并再悬浮于10毫摩尔MgCl细胞gydF4y2Ba2gydF4y2Ba, 10 mM MES-KOH, 200 μM AS至最终外径gydF4y2Ba600gydF4y2Ba = 0.3–0.5. The indicated cultures were infiltrated into 3-week-oldN. Benthamiana.gydF4y2Ba用注射器注射叶子。gydF4y2BaN. Benthamiana.gydF4y2Ba在感染48小时后采收无主静脉的叶片。将叶片在液氮中研磨成细粉,然后加入5 ml 2倍提取缓冲液[50 mM Tris-HCl, pH 7.4;150毫米氯化钠;10%甘油;5 mM EDTA, pH 8.0;20毫米氟化钠;PMSF约1毫米;Triton X-100 (v/v);1% (w / v) PVPP;添加2% (m/v)蛋白酶抑制剂鸡尾酒(罗氏)]。 The samples were clarified by centrifugation at 13000 g for 15 min at 4 °C, after which the protein concentration was adjusted to 2 mg ml- 1gydF4y2Ba带有0.8x提取缓冲液。以1.5 ml总蛋白加入10 μl抗gfp (1 μg μl)进行免疫沉淀gydF4y2Ba- 1gydF4y2Ba) (Transgene,北京,中国),加入40 μl蛋白G磁珠(NEB), 4℃孵育1-2 h。随后用TBS洗涤4次,免疫沉淀,用40 μl的2x SDS负载缓冲液洗脱,煮沸5 min,用抗gfp显示负载水平,用抗pthr检测体内自磷酸化水平。实验重复3次,结果一致。使用ImageJ软件对不饱和带的强度进行量化,并将其作为相对值与SlBRI1-GFP进行比较。gydF4y2Ba
统计分析gydF4y2Ba
本研究的数据采用SPSS 17.0版本和学生t检验进行分析。计算平均值和标准误差值gydF4y2BaPgydF4y2Ba< 0.05或0.01认为与PgydF4y2BaSlBRI1gydF4y2Ba:: SLBRI1-GFP工厂。gydF4y2Ba
可用性数据和材料gydF4y2Ba
本研究中产生或分析的所有数据均包含在本文及其附加文件中。所有植物材料均来自西北农林科技大学,陕西杨凌。gydF4y2Ba
缩写gydF4y2Ba
- 35 s:gydF4y2Ba
-
组成型花椰菜花叶病毒35S启动子gydF4y2Ba
- AsA:gydF4y2Ba
-
抗坏血酸gydF4y2Ba
- BAK1:gydF4y2Ba
-
BRI1-ASSOCIATED受体KINASE1gydF4y2Ba
- BES1:gydF4y2Ba
-
BRI1-EMS抑制器1gydF4y2Ba
- BR:gydF4y2Ba
-
BrassinosteroidgydF4y2Ba
- Bri1:gydF4y2Ba
-
BRASSINOSTEROID INSENSITIVE1gydF4y2Ba
- BZR1:gydF4y2Ba
-
BRASSINAZOLERESISTANT1gydF4y2Ba
- CBB:gydF4y2Ba
-
Coomassie辉煌的蓝色gydF4y2Ba
- CPD:gydF4y2Ba
-
构光形态建成和矮化gydF4y2Ba
- CT:gydF4y2Ba
-
C-末端结构域gydF4y2Ba
- 小矮人:gydF4y2Ba
-
6-DEOXOCASTASTERONE氧化酶gydF4y2Ba
- ELISA:gydF4y2Ba
-
酶联免疫吸附试验gydF4y2Ba
- epi-BL:gydF4y2Ba
-
24-epibrassinolidegydF4y2Ba
- 弗兰克-威廉姆斯:gydF4y2Ba
-
鲜重gydF4y2Ba
- 绿色荧光蛋白:gydF4y2Ba
-
绿色荧光蛋白gydF4y2Ba
- HPLC:gydF4y2Ba
-
高效液相色谱法gydF4y2Ba
- JM:gydF4y2Ba
-
近膜区gydF4y2Ba
- K916E:gydF4y2Ba
-
赖氨酸- 916谷氨酸gydF4y2Ba
- KD:gydF4y2Ba
-
激酶域gydF4y2Ba
- 多发性硬化症:gydF4y2Ba
-
Murashige和Skoog中号gydF4y2Ba
- PMSF:gydF4y2Ba
-
甲苯磺酰氟gydF4y2Ba
- Pn:gydF4y2Ba
-
净光合速率gydF4y2Ba
- PVPP:gydF4y2Ba
-
交联聚乙烯吡咯烷酮gydF4y2Ba
- QRT-PCR:gydF4y2Ba
-
定量实时聚合酶链反应gydF4y2Ba
- RR:gydF4y2Ba
-
红色的成熟gydF4y2Ba
- sds - page:gydF4y2Ba
-
十二烷基硫酸钠 - 聚丙烯酰胺凝胶电泳gydF4y2Ba
- 爵士:gydF4y2Ba
-
丝氨酸gydF4y2Ba
- T1050A:gydF4y2Ba
-
苏氨酸- 1050丙氨酸gydF4y2Ba
- T1050D:gydF4y2Ba
-
苏氨酸- 1050天冬氨酸gydF4y2Ba
- TBS:gydF4y2Ba
-
Tris缓冲盐溶液gydF4y2Ba
- thr:gydF4y2Ba
-
苏氨酸gydF4y2Ba
- 三:gydF4y2Ba
-
三(羟甲基)氨基甲烷gydF4y2Ba
- TYR:gydF4y2Ba
-
酪粉gydF4y2Ba
- UBI3:gydF4y2Ba
-
泛素/核糖体融合蛋白3gydF4y2Ba
- 年:gydF4y2Ba
-
黄色的成熟gydF4y2Ba
参考文献gydF4y2Ba
- 1。gydF4y2Ba
Clouse SD, Sasse JM。油菜素内酯:植物生长发育的重要调节因子。植物生理学报1998;49:427-51。gydF4y2Ba
- 2。gydF4y2Ba
油菜素内酯突变体的分子生理学研究。足底。1999;208(1):1 - 11。gydF4y2Ba
- 3.gydF4y2Ba
Clouse Brassinosteroids。咕咕叫医学杂志。2001;11 (22):R904。gydF4y2Ba
- 4.gydF4y2Ba
Haubrick LL, Assmann SM。油菜素内酯与植物功能:一些线索,更多谜题。植物学报。2006;29(3):446-57。gydF4y2Ba
- 5。gydF4y2Ba
brassino甾体不敏感-1是一个广泛表达的富含亮氨酸重复受体丝氨酸/苏氨酸激酶。植物杂志。2000;123(4):1247 - 56。gydF4y2Ba
- 6。gydF4y2Ba
李建军,李建军。油菜素内酯信号转导中富含亮氨酸重复受体激酶的研究。细胞。1997;90(5):929 - 38。gydF4y2Ba
- 7.gydF4y2Ba
王X,kota u,他k,blackburn k,李j,古山,沃特·科,克莱恩斯SD。BRI1 / BAK1受体激酶复合物的顺序转磷酸化会影响芸苔类固醇信号传导中的早期事件。DEV细胞。2008; 15(2):220-35。gydF4y2Ba
- 8.gydF4y2Ba
陈志强,陈志强,陈志强,等。植物甾体激素信号转导的分子机制。《细胞发展生物学》2005;21:177-201。gydF4y2Ba
- 9.gydF4y2Ba
王Z,Nakano T,Gendron J,He J,Chen M,Vafeados D,Yang Y,Fujioka S,Yoshida S,Asami T,Chory J.核局部化BZR1介导BrassinoStoid诱导的芸芸胸甲类固醇生长和反馈抑制BrassinoStoid Biosynathesis。DEV细胞。2002; 2(4):505-13。gydF4y2Ba
- 10。gydF4y2Ba
拟南芥中油菜素内酯调控基因的微阵列分析。植物杂志。2002;130(3):1319 - 34。gydF4y2Ba
- 11.gydF4y2Ba
Clouse SD。油菜素内酯信号转导:从受体激酶激活到调控植物发育的转录网络。植物细胞。2011;23(4):1219 - 30。gydF4y2Ba
- 12.gydF4y2Ba
孙y,风扇x,cao d,唐w,他k,zhujy,他jx,bai m,zhu s,oh e,patil s,金tw,ji h,wong w,rhee sy,王z.整合用拟南芥植物生长调节转录网络进行芸苔类固醇信号转导。DEV细胞。2010; 19(5):765-77。gydF4y2Ba
- 13。gydF4y2Ba
玉X,李力,左拉Ĵ,Aluru男,冶H,Foudree A,郭H,安德森S,Aluru S,刘P,Rodermel S,尹Y.油菜素类固醇转录网络揭示BESI靶基因的全基因组鉴定在拟南芥中。植物杂志2011; 65(4):634-46。gydF4y2Ba
- 14。gydF4y2Ba
Koka CV, Cerny RE, Gardner RG, Noguchi T, Fujioka S, Takatsuto S, Yoshida S, Clouse SD。番茄基因DUMPY和CURL-3在油菜素内酯生物合成和反应中的作用。植物杂志。2000;122(1):85 - 98。gydF4y2Ba
- 15.gydF4y2Ba
Wang Z, Seto H, Fujioka S, Yoshida S, Chory J. br1是植物激素质膜受体的重要组成部分。大自然。2001;410(6826):380 - 3。gydF4y2Ba
- 16。gydF4y2Ba
哦,MH,王X,克劳斯SD,胡贝尔SC。拟南芥油菜素内酯INSENSITIVE 1的失活(BRI1)受体由富含甘氨酸的环路内自磷酸化的激酶。PROC NATL ACAD SCI。2012; 109(1):327-32。gydF4y2Ba
- 17.gydF4y2Ba
哦,MH,王X,哥打U,Goshe MB,克劳斯SD,胡贝尔SC。所述BRI1受体激酶的酪氨酸磷酸化出现在拟南芥油菜素类固醇信号传导的组成部分。PROC NATL ACAD SCI。2009; 106(2):658-63。gydF4y2Ba
- 18.gydF4y2Ba
关键词:拟南芥,油菜素内酯INSENSITIVE1受体激酶,拟南芥植物杂志。2011;157(1):120 - 31所示。gydF4y2Ba
- 19.gydF4y2Ba
Morinaka Y, Sakamoto T, Inukai Y, Agetsuma M, Kitano H, Ashikari M, Matsuoka M.油菜素内酯不敏感引起的形态改变增加了水稻生物量和产量。植物杂志。2006;141(3):924 - 31所示。gydF4y2Ba
- 20.gydF4y2Ba
Kir G, Ye H, Nelissen H, Neelakandan AK, Kusnandar AS, Luo A, Inze D, Sylvester AW, Yin Y, crafraft PW。油菜素内酯INSENSITIVE1在玉米中的RNA干扰敲除揭示了油菜素内酯信号在控制植物结构中的新功能。植物杂志。2015;169(1):826 - 39。gydF4y2Ba
- 21.gydF4y2Ba
Chono M, Honda I, Zeniya H, Yoneyama K, Saisho D, Takeda K, Takatsuto S, Hoshino T, Watanabe Y.一种半矮型大麦uzu是由编码油菜素内酯受体基因的核苷酸替换导致的。植物杂志。2003;133(3):1209 - 19所示。gydF4y2Ba
- 22.gydF4y2Ba
Honda I, Zeniya H, Yoneyama K, Chono M, Kaneko S, Watanabe Y. Uzu突变大麦(Hordeum vulgare L.)降低了叶展开对油菜素内酯的反应。生物化学学报。2003;67(5):1194-7。gydF4y2Ba
- 23。gydF4y2Ba
Ali SS, Gunupuru LR, Kumar GB, Khan M, Scofield S, Nicholson P, Doohan FM。用油菜素内酯受体BRI1修饰的uzu大麦株系增强了植物抗病能力。BMC Plant Biol. 2014;14:227。gydF4y2Ba
- 24。gydF4y2Ba
Singh A,Bresja P,Khurana JP,Khurana P.小麦gydF4y2Ba油菜素内酯,Insensitive1gydF4y2Ba(gydF4y2BaTaBRI1gydF4y2Ba)与TaSERK基因家族的成员相互作用,引起早花和种子产量的提高gydF4y2Ba拟南芥gydF4y2Ba.Plos一个。2016; 11(6):E0153273。gydF4y2Ba
- 25。gydF4y2Ba
柴勇,张强,田丽,李超,邢勇,秦丽,沈勇。油菜素内酯对草莓果实成熟的影响。植物生长规律。2012;69(1):63-9。gydF4y2Ba
- 26。gydF4y2Ba
NIE S,Huang S,Wang S,Cheng D,Liu J,LV S,Li Q,王X.通过番茄过表达增强芸苔类固结信号(gydF4y2BaSolanum lycopersicum.gydF4y2BaSlBRI1改良主要农艺性状。植物学报2017;8:1386。gydF4y2Ba
- 27。gydF4y2Ba
蒙托亚,野村,法勒,卡内塔,横田,主教GJ。番茄curl3基因的克隆揭示了富含亮氨酸重复受体激酶tBRI1/SR160在植物类固醇激素和肽激素信号转导中的双重作用。植物细胞。2002;14(12):3163 - 76。gydF4y2Ba
- 28.gydF4y2Ba
霍尔顿N,卡诺-Delgado的A,哈里森K,蒙托亚T,乔瑞Ĵ,毕晓普GJ。油菜素类固醇番茄INSENSITIVE1需要在茄醋栗系统素诱导的根伸长,但并不用于伤口信号传导是必需。植物细胞。2007; 19(5):1709至1717年。gydF4y2Ba
- 29.gydF4y2Ba
Bajwa VS,Wang X,Blackburn Rk,Goshe MB,Mitra Sk,Williams El,Bishop GJ,Krasnyanski S,Allen G,Huber SC,Clouse SD。番茄BRI1和BAK1受体激酶磷酸化位点的鉴定与功能分析。植物理性。2013; 163(1):30-42。gydF4y2Ba
- 30.gydF4y2Ba
乔瑞Ĵ,Nagpal P,皮托CA.表型和DET2的遗传分析,一个新的突变影响拟南芥光调节幼苗发育。植物细胞。1991; 3(5):445-59。gydF4y2Ba
- 31。gydF4y2Ba
王X,Goshe MB,Soderblom EJ,Phinney Bs,Kuchar Ja,Li J,Asami T,Yoshida S,Huber Sc,Clouse SD。拟南芥芸苔类药物不敏感1受体激酶体内磷酸化位点的鉴定与功能分析。植物细胞。2005; 17(6):1685-703。gydF4y2Ba
- 32。gydF4y2Ba
克利HJ。花结构的遗传控制:对提高作物产量的见解。细胞。2017;169(6):983 - 4。gydF4y2Ba
- 33。gydF4y2Ba
王强,王胜,王雪梅,王雪梅。拟南芥油菜素激素不敏感1受体激酶特异性磷酸化位点在植物生长发育中的作用。植物生长规律。2016;35(3):755-69。gydF4y2Ba
- 34。gydF4y2Ba
刘L,贾c,张米,陈D,陈某,郭r,guo d,王q.BzR1-D转录因子在芸苔类网状信号中的异位表达增强了番茄的类胡萝卜素积累和果实质量属性。植物Biotechnol J. 2014; 12(1):105-15。gydF4y2Ba
- 35。gydF4y2Ba
他J,Gendron JM,Sun Y,Gampala SS,Gendron N,Sun C,Wang Z.BZR1是一种转录阻遏物,具有双重作用的芸苔类固态性稳态和生长反应。科学。2005; 307(5715):1634-8。gydF4y2Ba
- 36。gydF4y2Ba
Clouse SD, Langford M, McMorris TC。拟南芥中一个油菜素激素不敏感突变体在生长发育中表现出多种缺陷。植物杂志。1996;111(3):671 - 8。gydF4y2Ba
- 37。gydF4y2Ba
Mathur J,Molnar G,Fujioka S,Takatsuto S,Sakurai A,Yokota T,Adam G,Voigt B,Nagy F,Maas C,Schell J,Koncz C,Szekeres M.拟南芥CPD基因的转录,编码类化细胞色素P450,由Brassinosteroids负面控制。工厂J. 1998; 14(5):593-602。gydF4y2Ba
- 38。gydF4y2Ba
Youn JH,Kim Tw,Joo Sh,Son Sh,Roh J,Kim S,Kim TW,Kim Sk。拟拟拟拟合中芸苔类化合物生物合成中的DWARF1作为C-24还原酶的功能和分子调节。J Exp Bot。2018; 69(8):1873-86。gydF4y2Ba
- 39。gydF4y2Ba
王敏,袁芳,郝辉,张勇,赵辉,郭安,胡杰,周旭,谢国成。BolOST1是甘蓝开放气孔1与可变剪接产物的同源物,正调节植物的干旱反应。生物化学学报。2013;442(3-4):214-20。gydF4y2Ba
- 40.gydF4y2Ba
杨超,李华,张军,罗志平,龚鹏,张超,李军,王涛,张颖,卢颖,叶志忠。番茄毛状体形成与胚胎致病性的调控基因。中国科学院院刊。2011;108(29):11836-41。gydF4y2Ba
- 41.gydF4y2Ba
黄珊珊,聂胜,王胜,刘军,张颖,王昕。SlBIR3对番茄PAMP应答和细胞死亡的负调控作用。中华医学杂志。2017;18(9)。gydF4y2Ba
- 42.gydF4y2Ba
彭H,Kaloshian I.番茄亮氨酸的重复受体样激酶SLSERK3A和SLSERK3B具有细菌和线虫先天免疫的重叠功能。Plos一个。2014; 9(3):E93302。gydF4y2Ba
- 43.gydF4y2Ba
HU T,YE J,TAO P,李H,张J,张Y,YE Z.番茄HD-ZIP I转录因子SLHZ24通过D-甘露糖/ L-半乳糖途径的正调节调节抗坏血酸堆积。工厂J. 2016; 85(1):16-29。gydF4y2Ba
- 44.gydF4y2Ba
马斌,陈杰,郑华,方涛,奥古图春,李松,韩艳,吴斌。栽培苹果与野生苹果糖和苹果酸组成的比较评价。食品化学。2015;172:86 - 91。gydF4y2Ba
- 45.gydF4y2Ba
李俊,文俊,Lease KA, Doke JT, Tax FE, Walker JC。BAK1是一种拟南芥LRR受体样蛋白激酶,与BRI1相互作用并调节油菜素内酯信号。细胞。2002;110(2):213 - 22所示。gydF4y2Ba
致谢gydF4y2Ba
不适用。gydF4y2Ba
资金gydF4y2Ba
本研究由国家自然科学基金项目(no . 31672142, no . 31501771),陕西省自然科学基金项目(no . 2017JM3019)和中央高校基本科研业务费专项资金(no . Z109021703)资助。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
WX和WS计划并设计了研究。WS,LJ,ZT,DC,NS和ZY进行了实验。LS和HS分析了数据。WS写了稿件。所有作者阅读并认可的终稿。gydF4y2Ba
通讯作者gydF4y2Ba
伦理宣言gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版物gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
两位作者宣称他们没有相互竞争的利益。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意事项gydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。gydF4y2Ba
附加文件gydF4y2Ba
附加文件1:gydF4y2Ba
图S1。gydF4y2Ba转基因SlBRI1蛋白和P表型的表达gydF4y2BaSlBRI1gydF4y2Ba:: SlBRI1-GFP转基因线。顶部,植株成熟期(播种后120天)的表型。下面,使用抗绿色荧光蛋白(GFP)抗体对转基因SlBRI1表达进行western blot分析。CBB,考马斯亮蓝色。(JPG 604 kb)gydF4y2Ba
附加文件2:gydF4y2Ba
图S2。gydF4y2BaTHR-1050并没有改变光合作用。叶COgydF4y2Ba2gydF4y2Ba成熟期第6片叶片的同化速率(Pn)。数据为3个独立生物样本的平均值±SDs。(PDF 1080 kb)gydF4y2Ba
附加文件3:gydF4y2Ba
图S3。gydF4y2Ba果实中总可溶性固体。(PDF 188 kb)gydF4y2Ba
附加文件4:gydF4y2Ba
图S4。gydF4y2BaSlBRI1,StBRI1,AtBRI1,OsBRI1,TaBRI1和ZmBRI1的部分激酶结构域的序列比对。SlBRI1(gydF4y2BaSolanum lycopersicum.gydF4y2Ba,加入不。NP_001296180.1)、StBRI1 (gydF4y2Ba茄属植物tuberosumgydF4y2Ba,登记号XP_006357355.1),BRI1(gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba,加入不。NP_195650.1)、OsBRI1 (gydF4y2Ba栽培稻gydF4y2Ba,加入不。NP_001044077.1)、TaBRI1 (gydF4y2BaTriticum aestivum.gydF4y2Ba,加入不。DQ_655711.1)、ZmBRI1 (gydF4y2Ba玉米gydF4y2Ba,加入不。XP_008656807.1)。(PDF 1162 kb)gydF4y2Ba
额外的文件5gydF4y2Ba
图S5。gydF4y2BaSLBRI1和T1050A的三维(3D)折叠结构预测。使用瑞士模型预测3D折叠结构。(PDF 1687 KB)gydF4y2Ba
附加文件6:gydF4y2Ba
图S6。gydF4y2BaSlBRI1和T1050A的亚细胞定位。gydF4y2Ba农杆菌属gydF4y2Ba烟草表皮细胞介导的瞬时转化。第一线,GFP的亚细胞定位。下联,SlBRI1-GFP的亚细胞定位。第三行,亚细胞定位T1050A-GFP。左图:亮场图像。中间面板:在蓝光下的绿色荧光信号。右图:合并图像。Scale bars, 50 μm. (JPG 932 kb)
附加文件7:gydF4y2Ba
表S1。gydF4y2Ba本研究使用的引物。(多克斯21 kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放访问gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除非另有说明,否则适用于本文中提供的数据。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
王绍华,刘军,赵涛。gydF4y2Baet al。gydF4y2BaSlBRI1的苏氨酸1050修饰可调控BR信号,提高番茄产量。gydF4y2BaBMC植物BIOL.gydF4y2Ba19,gydF4y2Ba256(2019)。https://doi.org/10.1186/s12870-019-1869-9gydF4y2Ba
已收到gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-019-1869-9gydF4y2Ba
关键字gydF4y2Ba
- 番茄gydF4y2Ba
- SlBRI1gydF4y2Ba
- 磷酸化的网站gydF4y2Ba
- 农艺性质gydF4y2Ba
- BR信号gydF4y2Ba