摘要
背景
亚洲莲(莲属椰子是一种具有较高经济价值的观赏水生植物。花的颜色是一种重要的观赏性状n .椰子以其黄色花朵为重点的育种。探讨黄花的成色机理n .椰子,我们分析了其色素成分和含量,以及黄酮途径的基因表达n .椰子品种。
结果
我们对其中两例进行了代谢组学和基因表达分析n .椰子分别对黄花和白花品种Molinqiuse (MLQS)和Yeguangbei (YGB)进行了5个花色期的研究。通过表型观察和代谢物分析,确定花的着色后期(s3 ~ s5)是MLQS和YGB差异的关键时期,二氢黄酮醇和黄酮醇在不同品种间差异显著。MLQS中二氢槲皮素、二氢山奈酚和异鼠李素显著高于YGB,而山奈酚在YGB中显著高于YGB。在s1 ~ s4阶段,MLQS中类黄酮途径的大部分关键同源结构基因活性显著高于YGB。
结论
在这项研究中,我们进行了第一次分析的初级和二级n .椰子发现异鼠李素和山奈酚的分流导致了MLQS和YGB之间的花瓣颜色差异。基于我们的数据整合分析,在假定的类黄酮途径的关键酶的表达n .椰子品种,NnFLS基因底物特异性和差异表达NnOMT这可能与MLQS和YGB的花瓣颜色差异有关。这些结果将有助于确定黄花的成色机理n .椰子,可促进荷花品种的黄花瓣育种。
背景
莲花是一种具有重要经济价值的水生植物,广泛用于食品、医药和观赏。1,2,3.].作为一种具有许多单子叶特征的基生多子叶植物,莲花在进化和分类学研究中也有特殊的地位[3.,4].莲花在文化和宗教活动中也扮演着重要的角色,广泛分布在亚洲和澳大利亚北部。根据形态特征可辨认出两种莲:亚洲莲(莲属椰子和美洲莲(n lutea珀耳斯。)5,6,7].
花色是决定观赏品质和园林绿化应用价值的重要性状。与其他观赏植物相比,莲花还没有培育出广泛的花色;亚洲莲品种只开红色、粉色和白色的花,而美洲莲品种只开黄色的花[8].有趣的是,这两种莲的品种之间没有繁殖障碍,通过自然和人工杂交培育出了800多个花色不同的品种[9,10].虽然亚洲-美洲荷花杂交品种的后代花是黄色的,但它们的颜色非常浅。新黄品种是莲花育种中罕见的种质资源,是研究类黄酮和类胡萝卜素生物合成的宝贵材料。因此,莲花育种者的首要目标是培育黄色花的莲花新品种。
花的颜色是代谢物(色素)在花表皮细胞的液泡中积累的结果[7,11,12,13].黄色的花朵被认为是由类黄酮或类胡萝卜素的存在、数量或类型的差异造成的。7].据报道,黄色花瓣经常含有类胡萝卜素;黄色叶黄素是大多数植物花瓣中主要的类胡萝卜素。例如,大部分类胡萝卜素在花瓣Sandersonia树蛙β,β胡萝卜素(14];万寿菊花瓣中超过90%的类胡萝卜素万寿菊spp。)15和菊花[16是叶黄素和/或叶黄素衍生物。大量紫黄素和其他类胡萝卜素的积累似乎导致花瓣变黄芸苔属植物显著[17].查尔酮类黄酮和金酮类黄酮是黄酮途径中用于基因工程黄花的两种主要靶色素[18].查尔酮作为所有类黄酮生物合成的中间产物,已在观赏植物如康乃馨(石竹类植物caryophyllus)、仙客来(仙客来persicum)和红花(Carthamus tinctorius)作为黄花色素的主要成分[19,20.].在大丽花的黄花中检测到金酮和亮黄色类黄酮(大丽花摘要)和金鱼(金鱼草majus).查尔酮4 ' - o -葡萄糖基转移酶(4 'cgt),AmAS1基因与6- o -葡萄糖苷的积累相关Torenia矮牵牛花(21].黄酮醇,如山奈酚,槲皮素和异鼠李素也被报道有助于黄色的花着色Lathyrus chrysanthus[22),引种[23),Eustoma羊藿[24,25),莲属椰子[7].
迄今为止,对黄莲花代谢产物组成和基因表达的研究较少,主要集中在类黄酮色素方面。一项研究比较了108个不同颜色的莲花品种的代谢物含量,发现黄酮和黄酮醇与花的颜色有关[7],其中异鼠李素、槲皮素和山奈酚衍生物最为丰富;相比之下,白花品种的山奈酚衍生物含量更高[7].这些结果与黄花和白花莲花品种中花青素含量的缺乏是一致的;然而,黄莲花瓣中是否含有类胡萝卜素还不清楚。利用高效液相色谱法,Katori等人[26]在黄花莲花品种中检测到叶黄素和β-类胡萝卜素;然而,一项使用石油醚显色反应的研究发现,这种花中没有类胡萝卜素色素[27].因此,影响荷花黄花瓣形成的关键代谢物和差异基因表达尚不清楚。一些研究已经在不同颜色的莲花品种中检测了生物合成基因的表达模式。从4个荷花品种中分离到7个类黄酮生物合成基因的cDNA克隆莲属椰子花色不同的品种,类黄酮生物合成受类黄酮生物合成基因表达的不同调控NnCHI,NnF3'H,NnDFR,NnANS受影响的花的颜色[10].对红花和白花两个荷花品种花青素生物合成基因和色素的表达谱分析表明答可能是花青素积累的关键基因;不同甲基化强度的启动子序列答基因可能导致不同的花颜色[12].
以往的研究主要集中在改进红花荷花次生代谢产物的提取和分离方法上。在花的着色过程中,代谢物和基因表达的复杂网络会发生巨大变化[28].然而,对代表性花色阶段的代谢和通路基因表达,尤其是黄色花瓣的代谢和通路基因表达还知之甚少。由于代谢组学能够动态地跟踪代谢变化,它是分析花的着色过程中的代谢的一个很好的工具。因此,我们选择了两个莲花品种作为植物材料:开黄色花的Molinqiuse (MLQS)和开白色花的Yeguangbei (YGB)。系统分析了黄酮途径关键基因在5个决定花色阶段的整体代谢组学变化和表达模式,以阐明黄酮途径的代谢和转录差异。本研究的结果将有助于确定荷花黄色形成的机理,这对观赏荷花育种至关重要。
结果
花朵颜色n .椰子栽培品种MLQS和YGB
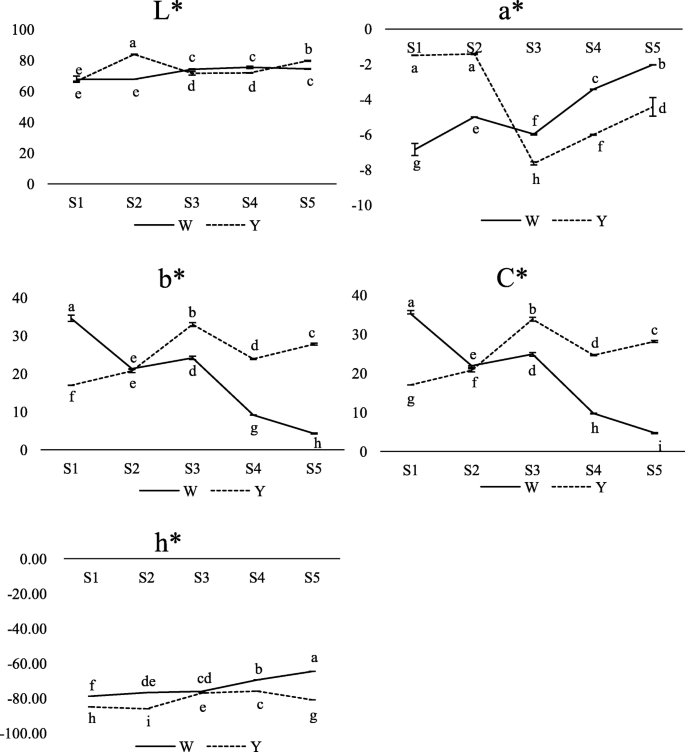
为了识别和表征莲花着色的发育阶段,我们连续3年记录了花芽发育的整个过程。我们确定了5个不同的着色阶段(S1-S5;无花果。1).在MLQS中,黄色在S1-S3期间加深,在S3达到峰值,随后在S4略有下降,在S5有所增加。在YGB中,黄色在S2达到顶峰,在S3-S5期间逐渐消退为白色。S1-S5期间花朵颜色参数的变化如图所示。2,其中C*表示色度,b*表示黄色,正值表示与表型观察结果一致的趋势。C*和b*在YGB中普遍呈下降趋势,而在MLQS中呈上升趋势,在S3达到第一个峰值,在S5达到第二个峰值。L*在YGB S2-S3期间略有上升后保持不变;MLQS在S1-S2阶段迅速增加,然后下降,在S5阶段略有增加。a*在成花前期和后期MLQS和YGB表现出相反的趋势;a*在MLQS中前期大于YGB,后期小于YGB。而在S3-S5期间,MLQS和YGB中a*普遍增加。与YGB相比,MLQS中的h*值更接近90u(黄色)(图1)。2).
花着色过程中MLQS和YGB的初级代谢谱
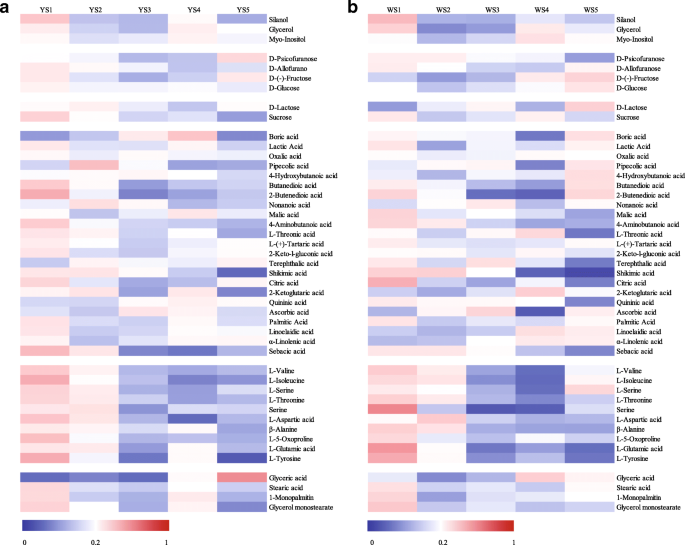
在S1-S5采集两个莲花品种的代表性花瓣,提取代谢物,然后GC-MS分析[29].共有46个代谢物被鉴定使用一个可用的色谱库(附加文件2:表S2)。在每个花着色阶段检测到的每一种代谢物的含量在附加文件中提供3.:表S3。
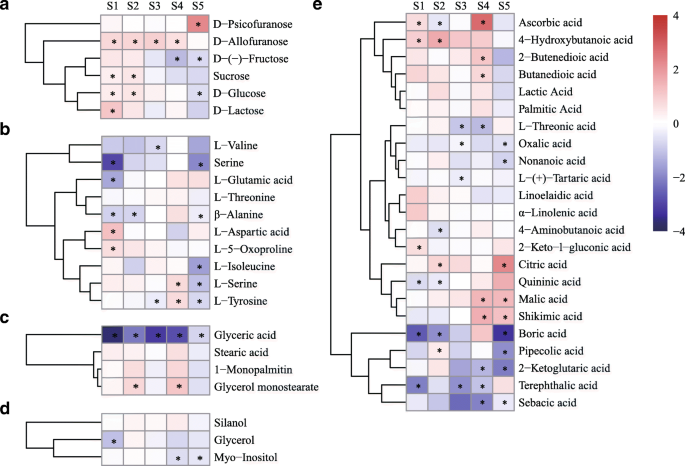
MLQS和YGB之间糖和有机酸代谢的动态差异3.:表S3)。MLQS和YGB花在S1-S2段几乎所有糖都显著减少(P< 0.05)。后期,YGB中S5、d -异氟呋喃糖、d -葡萄糖和d -乳糖含量显著增加,而MLQS中d -异氟呋喃糖和d -葡萄糖含量降低。d - psicofurose含量在MLQS中S5显著升高,而在YGB中显著降低3.:表S3;无花果。3.).有机酸含量模式在MLQS和YGB之间也有差异,特别是在花的着色后期(图。3.).在MLQS中,约有一半有机酸呈下降趋势。我们对方差分析和Duncan 's多区间检验结果的分析显示,YGB中对苯二甲酸、柠檬酸和奎宁酸在S5时显著降低,而MLQS中柠檬酸含量在S5时显著增加3.:表S3)。硼酸、乳酸和棕榈酸含量在MLQS和YGB之间呈现相反的规律(图。3.).MLQS中这些有机酸的含量在S4中显著高于S3,在S5中显著低于S4,而在YGB中则相反3.:表S3)。在花的着色过程中,MLQS和YGB在氨基酸、甘油酸和乙二醇含量方面观察到相似的模式,但一些代谢物在后期有显著差异(图1)。3.;额外的文件3.:表S3)。MLQS和YGB中氨基酸含量的下降趋势相似,在S1和S2处含量最高(图1)。3.).相比之下,YGB中S5的l -缬氨酸、l -丝氨酸和l -异亮氨酸含量显著高于S4,而MLQS中只有S5的l -丝氨酸和l -天冬氨酸含量显著高于S43.:表S3)。
计算Pearson相关系数,比较MLQS (Y)和YGB (W)之间的b*值,以评价Y/W在5个着色阶段的主要代谢物(表2)1).根据相关分析,除部分有机酸和氨基酸外,大部分初级代谢物与Y/W b*值呈负相关。其中d -聚四氟糖、对苯二甲酸、柠檬酸、奎宁酸、甘油酸与Y/W b*值呈显著正相关(P< 0.05),而d -异氟呋喃糖和d -葡萄糖与Y/W b*值呈显著负相关(表21).有趣的是,与Y/W b*值显著相关的初级代谢物在MLQS和YGB之间也表现出不同的动态,如上图所示。3.;额外的文件3.:表S3)。
花着色过程中MLQS和YGB的次生代谢谱
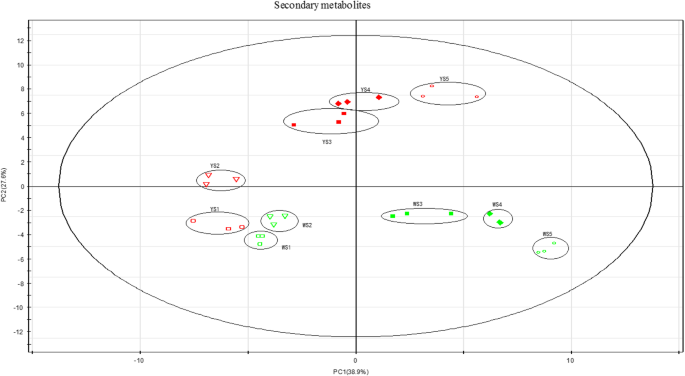
我们利用主成分分析(PCA)对LC-MS结果进行了研究,以检测两个莲花品种间主要次生代谢产物的差异。交叉验证计算两个pc;38.9%的变异是由第一个成分解释的,27.6%是由第二个成分解释的(图。4).在MLQS和YGB中均观察到明显的次生代谢转移,从花着色早期到后期,MLQS的花瓣黄色逐渐加深。两个莲花品种的早期花色阶段被归在一起,但与后期不同(图1)。4).这些PCA分析结果与两个莲藕品种的表型特征和b*值基本一致。1而且2).共检测到78种代谢物,包括苯丙氨酸、香豆酸、二氢黄酮醇、黄酮醇及其衍生物4:表S4)。
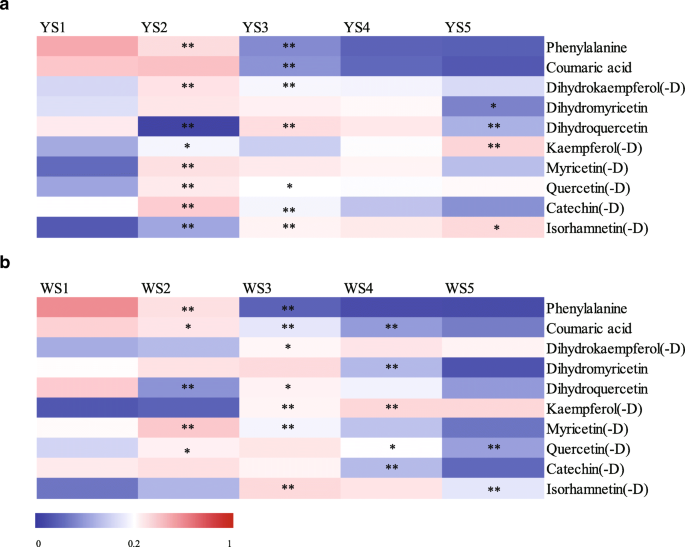
两种荷花品种在成花过程中10种次生代谢产物及其衍生物的积累规律基本相似。然而,从S1到S5,黄酮醇含量存在显著差异(图5)。5).从S1到S5,苯丙氨酸、香豆酸、二氢杨梅素、杨梅素(- D)(代谢物及其衍生物的总含量)、儿茶素(- D)和二氢槲皮素含量的变化相似,MLQS和YGB中苯丙氨酸和香豆酸含量的变化更为一致,从S1到S5,苯丙氨酸和香豆酸含量不断下降(图5)。5).二氢杨梅素、杨梅素(- D)和儿茶素(- D)的含量首先积累,然后消耗(图。5).二氢槲皮素含量随花色变化而波动,MLQS和YGB均在花色后期下降,YGB在s4 ~ s5期间显著下降。二氢山柰酚(−D)含量的变化趋势在不同品种间存在差异,MLQS前期显著增加,S2-S3显著降低,之后略有下降。YGB中二氢山奈酚含量在S1-S4阶段增加,在S4-S5阶段略有下降。
除了杨梅素(- D)含量相似外,黄酮醇(异鼠李素、槲皮素和山柰素)及其衍生物在MLQS和YGB中的含量差异显著。异鼠李素(−D)在黄色品种MLQS中以几乎连续的方式显著积累(图4)。5).然而,在YGB中,它们只在S1-S3期间增加,在S4-S5期间显著下降(图5)。5).MLQS和YGB中槲皮素(−D)含量在成花前期均显著增加,YGB中从S3到S5显著降低;MLQS仅在S2-S3期间显著下降。山奈酚(−D)含量在YGB中保持不变,而在MLQS中从S2-S4显著增加,且呈波动趋势。
78种次生代谢物的含量变化趋势与10种次生代谢物及其衍生物的含量变化趋势相似(图1)。5).黄酮醇含量在MLQS和YGB之间差异很大5:图S1;额外的文件6:表S5)。在MLQS中异鼠李素及其衍生物的浓度在整个5个阶段均显著增加,而在YGB中其浓度在花的后期显色阶段显著下降6:表S5)。槲皮素及其衍生物的含量变化趋势与槲皮素(−D)相似,更多的槲皮素在YGB中含量在后期显著下降(附加文件6:表S5)。部分山奈酚衍生物表现出与山奈酚不同的变化趋势(−D)。例如,山奈酚衍生物4、7、8、11和17在花的后期着色阶段在YGB中呈现下降趋势,这与MLQS中山奈酚(−D)的下降趋势相似6:表S5)。
采用Pearson相关系数评估花的颜色与主要次生代谢物之间的关系1).除香豆酸、二氢山奈酚(−D)和山奈酚(−D)外,大多数代谢物与Y/W b*值正相关。其中,二氢杨梅素和槲皮素(−D)与Y/W b* (P< 0.05),与异鼠李素(−D)高度显著相关(P< 0.01)。
MLQS和YGB之间的代谢物分析有显著差异
MLQS和YGB在5个花色阶段分别有17、13、8、16和19个差异显著的初级代谢物。6).S1、S2、S4期间MLQS中初级代谢物含量显著高于YGB, S3、S5期间MLQS中初级代谢物含量显著低于YGB (P< 0.05)。MLQS和YGB之间的糖、有机酸、氨基酸和脂肪酸含量差异在花的着色阶段是不同的。6),但代谢物含量在MLQS中普遍显著低于YGB。
具体而言,在S1和S2期间,MLQS中的大多数糖含量显著高于YGB (P< 0.05)。而S4和S5则相反,除D-psicofuranose外,MLQS中大多数糖的含量都较低(图5)。6a). S1和S5阶段MLQS和YGB之间有5种氨基酸差异显著,其他3个阶段各品种间氨基酸含量差异较小(图5)。6b). MLQS中硼酸、2-酮戊二酸、对苯二甲酸、癸二酸等有机酸含量在花的大部分显色阶段均显著低于YGB。相反,后期MLQS中苹果酸、莽草酸和柠檬酸含量显著高于YGB(图4)。6e).在检测到的四种脂肪酸中,从S1到S5, MLQS中的甘油酸含量显著低于YGB(图5)。6c),而不同品种间乙二醇含量相似(图。6d)。
在10种次生代谢物及其衍生物中,MLQS中的大部分显著高于YGB,且与花的显色阶段无关(P< 0.05;无花果。7).随着花着色过程的进行,MLQS中次级代谢物浓度增加。在S4和S5, MLQS中大部分次级代谢物(如二氢槲皮素、二氢山柰酚、异鼠李素及其衍生物)的含量显著高于YGB。在开花后期,不同品种间次生代谢物含量差异最大的是二氢槲皮素,其次是异鼠李素(−D)。相比之下,山奈酚及其衍生物在后期MLQS中的浓度明显较低,这是MLQS与YGB颜色分化的关键阶段(图1)。7).黄酮途径上游代谢物苯丙氨酸在MLQS中的浓度在后期显著高于YGB,香豆酸的浓度则显著低于YGB。MLQS中槲皮素(−D)含量仅在S5时显著升高。这些结果与次级代谢物含量与b*显著相关的研究结果一致。
次级代谢物及其衍生物的详细比较在附加文件中提供7:表S6。整个类黄酮代谢途径在MLQS中比在YGB中更活跃,特别是在后期(S3-S5)。在这些阶段,MLQS中含量显著较高的代谢物非常丰富。S1、S2、S3、S4和S5中MLQS和YGB之间分别有43、24、34、42和55个差异显著的代谢物(P< 0.05),其中21、21、16、25和45例MLQS显著高于对照组。这些结果与我们对10种次生代谢物及其衍生物的分析一致。7).
为了进一步确认总黄酮产量或各物质的比例是否对莲花黄色花的颜色有重要影响,我们对Y/W次生代谢物含量和Y/W b*值进行Pearson相关分析。异鼠李素(−D)比例与b* (P= 0.014;R = 0.948);而Y/W总黄酮含量与b*的相关性不显著(P= 0.445;R = 0451)。因此,异鼠李素(- D)的比例似乎对黄色花的颜色比白色花的颜色更重要。
MLQS和YGB类黄酮途径基因表达谱
为了确定黄酮化合物的表达水平是否与mRNA丰度相关,我们进行了qRT-PCR分析。在花着色的5个阶段分析了编码关键类黄酮途径酶的基因。8).
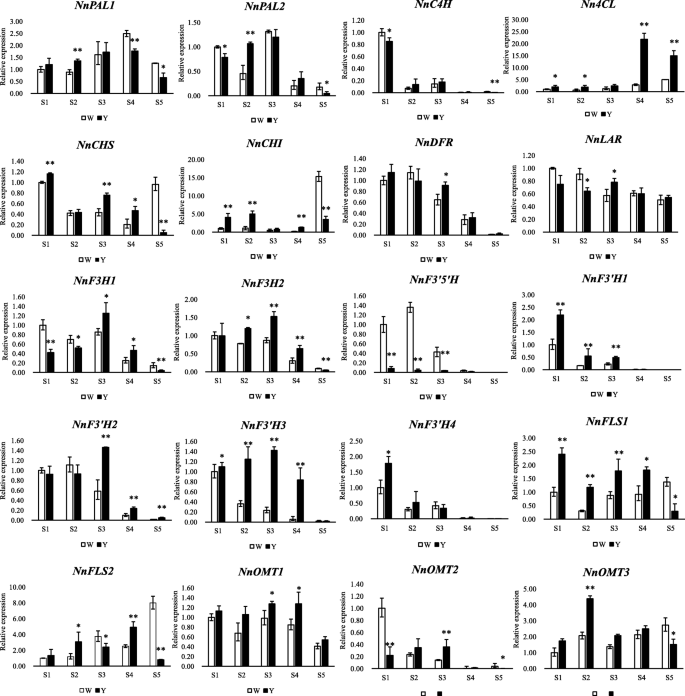
的表达NnPAL,Nn4CL,NnF3H,NnF3'H2,NnF3'H3,NnFLS2,NnOMT1,NnOMT2MLQS从第一阶段开始增加,在S3或S4达到峰值,在S5逐渐下降(图5)。8).这一结果与MLQS中较高的次级代谢物积累是一致的5:图S1)。然而,表达NnC4H,NnDFR,NnF3的5是什么,NnF3'H1,NnF3'H4从S1下降,在S5达到最小值。在YGB中,表示NnC4H,NnLAR,NnOMT2也从S1下降,在S5达到最小值。Nn4CL在花的着色过程中,表达增加。
qRT-PCR结果显示,MLQS类黄酮通路中大部分结构基因在s1 ~ s4时活性高于YGB,而在S5时活性则相反。MLQS中有7个、10个、11个、10个和2个基因在5个阶段的表达量均显著高于YGB (P< 0.05)。表达水平Nn4CL而且NnF3'H几乎在S1-S5期间,MLQS显著高于YGB,分别为14.8倍和6.1倍NnF3'H3在S4和S3分别表达。Nn4CLMLQS中表达量是YGB的7.7倍。NnCHS,NnCHI,NnFLS,NnOMT1,NnOMT3MLQS在S1-S4的表达也显著高于YGB。在这些基因中,NnFLS1在S2时,MLQS基因的表达是YGB基因的3.9倍NnOMT2表达量在S4升高3.2倍;然而,在S5期间,YGB中的表达水平明显高于MLQS(图5)。8).
MLQS和YGB中代谢物和生物合成基因表达的相关性
接下来,我们对花朵颜色形成过程中的Y/W初级和次级代谢物进行相关性分析,以更详细地评估代谢物网络行为。在分析的460对代谢物中,48对具有显著相关性(P< 0.05)。许多糖和有机酸与次生代谢物显著相关,而只有三种氨基酸(l -异亮氨酸、l -5-氧脯氨酸和l -谷氨酸)和一种脂肪酸(甘油)与次生代谢物显著相关(附加文件)8:表S7)。异鼠李素(- D)、杨梅素(- D)和槲皮素(- D)具有最多显著相关的一级-二级代谢物对。异鼠李素(−D)和槲皮素(−D)与D-异氟呋喃糖等糖高度显著相关(R =−0.902;R =−0.897)和d - psicofururose (R = 0.960;R = 0.954),异鼠李素(- D)与D-葡萄糖显著负相关(R = - 0.882)。三种有机酸(对苯二甲酸、柠檬酸和奎宁酸)和一种脂肪酸(甘油酸)与异鼠李素(- D)和槲皮素(- D)显著正相关,而l -异亮氨酸与槲皮素(- D)显著负相关(R = - 0.894)。山奈酚(- D)与D-(-)-果糖、蔗糖、壬酸和2-酮戊二酸显著相关8:表S7)。
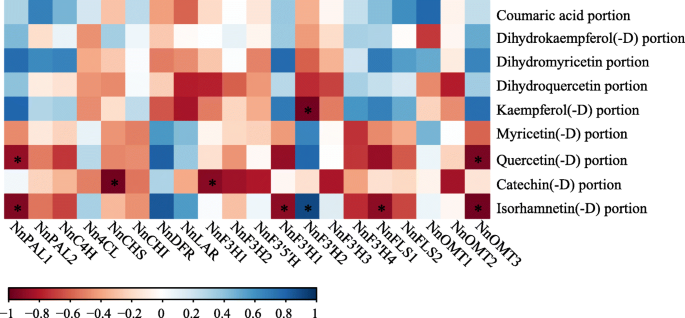
如上所述,Y/W类黄酮比例与b*显著相关。通过Pearson相关分析确定关键生物合成基因与类黄酮之间的相关性(图1)。9结果表明,异鼠李素(- D)、槲皮素(- D)和山奈酚(- D)之间的相关基因几乎相同。我们在10个基因对中检测到基因表达与类黄酮比例的显著相关(P< 0.05)。异鼠李素(−D)与NnPAL1,NnF3'H1,NnF3'H2,NnFLS1,NnOMT3表达,而槲皮素(−D)与NnPAL1而且NnOMT3表达式。山奈酚(−D)与NnF3'H2表达式。
讨论
YGB和MLQS花着色过程中的初级代谢动力学
花色是观赏植物的一个重要特征。尽管代谢物多样性是莲花成花过程中的重要组成部分,但目前对莲花成花过程中代谢物动态的研究较少。与其他观赏植物相比,莲花的花色并不广泛。8].在目前的研究中,我们使用GC-MS平台来量化46种主要代谢物,包括糖、氨基酸、有机酸、甘油酸和醇(附加文件)2:表S2),它们被报道为花的次生代谢的化学前体和能量[30.].
我们的含量动态和差异代谢物含量分析结果表明,在开花着色早期阶段,大多数糖在MLQS中的含量高于YGB,而在开花着色后期的含量较低(图1)。6).在MLQS中d -异戊呋喃糖、d -葡萄糖和d -乳糖的水平降低,而在YGB中显著升高(图。3.;额外的文件3.:表S3)。S5时,MLQS中的d -葡萄糖含量显著低于YGB。d -异戊呋喃糖和d -葡萄糖含量与Y/W b*呈显著负相关(表1).糖在初级代谢组中很重要,因为它们为后续代谢活动提供能量资源和碳骨架,还在转录和翻译后水平上作为信号分子调节色素相关基因[31,32,33,34,35,36].据报道葡萄糖有诱导作用PsCHS1而且PsCHI1通过葡萄糖信号表达牡丹[37].大部分糖在着色早期在MLQS中含量显著较高,这可能与后期MLQS中丰富的次生代谢物有关。糖基化修饰是天然黄酮最常见的修饰[38,葡萄糖、半乳糖、鼠李糖和阿拉伯糖是最常见的糖[38,39,40,41].有趣的是,MLQS在后期检测到较低的糖含量。
不同的内容动态。3.)和代谢物模式(图。6)在MLQS和YGB中检测到的23种有机酸中均可见。在花的大部分着色阶段,MLQS中的硼酸、2-酮戊二酸、对苯二甲酸和癸二酸显著低于YGB (P< 0.05),后期MLQS中苹果酸、莽草酸和柠檬酸含量显著增加。对苯二甲酸、柠檬酸和奎宁酸含量与Y/W b*呈正相关1).到目前为止,很少有研究检验有机酸对花朵颜色形成的影响。据报道,包括柑橘酸和苹果酸在内的有机酸可通过酰化稳定类黄酮[12,42,43,44,45];然而,这些酸是三羧酸(TCA)循环的中间产物,为新陈代谢提供能量[46].MLQS中苹果酸、莽草酸和柠檬酸的含量在后期显著升高,这可能表明MLQS中次生代谢在后期显色阶段更为活跃,这与我们Pearson的相关分析结果一致。
不同品种在花着色过程中次生代谢的差异
已有研究发现黄酮类化合物是黄莲花瓣中的主要色素。许等人。[27]报告说,黄莲品种不含类胡萝卜素;然而,Katori等人[26]采用高效液相色谱法检测莲花中的叶黄素和β-类胡萝卜素。7]检测出黄花莲花品种的类黄酮色素。本研究通过初步实验测定了MLQS和YGB中S5时的类黄酮和类胡萝卜素含量;MLQS中总类胡萝卜素含量为68.25 μg−1干重(DW)和总黄酮含量为401.53 μg−1DW,高出近6倍。
然后我们将重点放在类黄酮途径的代谢物检测上。LC-MS共检测到78种次生代谢物4:表S4)。PCA分析表明,从花的早期阶段到后期阶段有明显的次生代谢转移,两个品种的早期阶段被分组在一起,并与花的后期阶段分开(图1)。4).这一结果表明,S3-S5是这些莲品种之间花的颜色分化的关键阶段。1).
如附加文件所示6表S5),莲花品种的次生代谢物包括苯丙氨酸、香豆酸、二氢黄酮醇、黄酮醇及其衍生物。在我们的分析中没有检测到花青素、金酮和查尔酮,这与之前的研究一致,在黄莲和白莲品种中几乎没有发现花青素、金酮和查尔酮[10].在本研究中,槲皮素、异鼠李素、山奈酚及其衍生物是MLQS中最丰富的次生代谢物,而山奈酚、槲皮素、儿茶素及其衍生物在YGB中最丰富6:表S5)。两个品种之间的次生代谢产物的比较清楚地表明,整个类黄酮代谢途径在MLQS中更活跃,特别是在发育后期(附加文件7:表S6;无花果。7).在几乎所有的花显色阶段,MLQS中的二氢槲皮素、二氢山柰素(- D)和异鼠李素(- D)显著高于YGB,而山柰素(- D)含量在MLQS中的后期显色阶段显著低于YGB(图。7).然而,我们的含量动力学分析结果表明,二氢槲皮素(- D)和二氢山柰酚(- D)的含量在MLQS的后期显著下降6:表S5)。异鼠李素(−D)含量在花的后期显著增加,且与b* (P< 0.05, r = 0.972)。代谢物含量与b*的显著相关性与我们的代谢物分析结果一致;山奈酚衍生物在YGB中最为丰富,与Deng等的结果一致。[12],且在后期显著低于MLQS。由此推测黄酮醇的合成过程在黄色品种MLQS和白色品种YGB中存在差异。异鼠李素的Y/W比例(−D)与Y/W b*高度显著相关;而总黄酮含量与Y/W b*的相关性不显著,表明异鼠李素(−D)的比例对黄花发育更重要。事实上,异鼠李素(−D)据报道是一种黄色色素[47,48].
代谢物与代谢物的相关分析表明,460对总代谢物中有48对呈显著相关(P< 0.05)。许多糖和有机酸与次生代谢物显著相关,而只有三种氨基酸(l -异亮氨酸、l -5-氧脯氨酸和l -谷氨酸)和一种脂肪酸(甘油)与次生代谢物显著相关(附加文件)8:表S7)。由于缺乏足够的代谢物标准,我们对代谢物衍生物的分析结果不明确。对关键代谢物衍生物的后续研究将更好地揭示与花色相关的一级和二级代谢物之间的关系。
差异类黄酮途径代谢基因表达分析
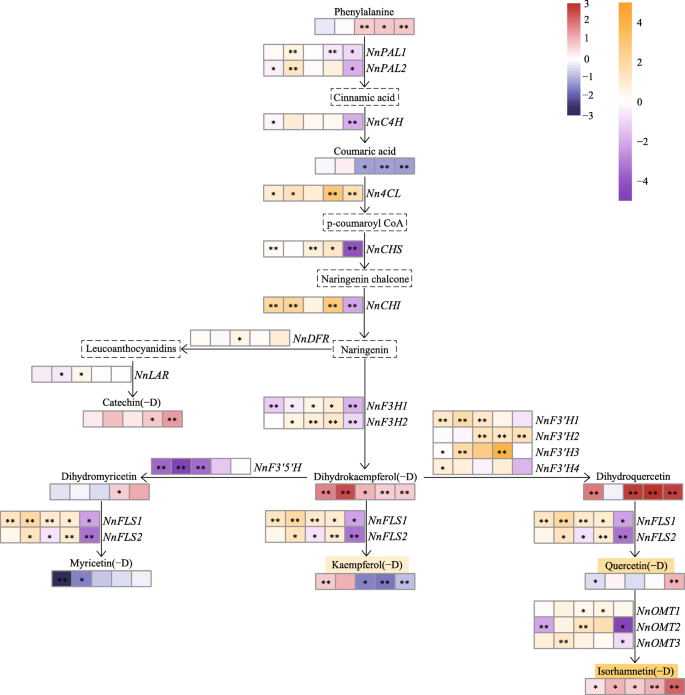
基于在MLQS和YGB中检测到的类黄酮,我们绘制了与莲花颜色相关的类黄酮通路示意图(图1)。10).在严格筛选的条件下,共检测到20个类黄酮通路关键同源基因。类黄酮代谢途径中早期生物合成基因(EBGs)的总体表达水平(NnCHS,NnCHI,NnF3H)[49,50]在S1-S4期间,MLQS中二氢黄酮醇含量高于YGB,导致MLQS与YGB中二氢黄酮醇含量差异显著。特别是MLQS中二氢槲皮素的含量达到YGB的6-8倍(图1)。10).有研究表明,柚皮苷查尔酮可迅速转化为柚皮苷(黄酮)气并在大多数植物中进一步合成各种类黄酮[51].如前所述,在MLQS中没有检测到极光或查尔酮,可能是由于高表达气.
在S1-S4期间,表达水平NnFLS1而且NnFLS2,催化二氢黄酮醇合成黄酮醇[52], MLQS中槲皮素含量显著高于YGB,槲皮素及其衍生物含量无显著差异。而异鼠李素及其衍生物在MLQS中的含量显著高于YGB。AtOMT1被鉴定为参与黄酮醇甲基化形成异鼠李素,在体内支持[53的体外证据拟南芥[54].在本研究中,有可能是MLQS中的槲皮素被快速转化为异鼠李素NnOMT.另外,表达三种NnOMTsMLQS高于YGB,这在一定程度上证实了我们的假设。到目前为止,数量有限的OMT由于缺乏足够的底物范围和高效的遗传转化系统,基因在特定生物体中已被功能特征化[55];这些差距极大地限制了核查NnOMT.两个假设的表达式NnFLSS1-S4期间MLQS基因显著高于YGB基因。山奈酚(−D)含量从S2-S3开始显著增加,在花的后期着色阶段5:图S1),但在S3-S5期间MLQS远低于YGB。之前的研究已经表明fls的显示可变的底物偏好和松散的催化活性,这可能导致它们不同的异构体[56,57,58,59].FtFLS1在Fagopyrum tataricum据报道,二氢槲皮素转化为槲皮素比二氢山奈酚转化为山奈酚更活跃[60].AtFLS1二氢山奈酚转化为山奈酚是否比二氢槲皮素转化为槲皮素更有效答:芥[61].的研究柑橘unshi发现FLS对二氢山奈酚的亲和力高于对二氢槲皮素的亲和力。因此,我们建议FLS的本研究检测的两个荷花品种的基因可能具有不同的底物偏好NnFLS基因在白色品种YGB中更倾向于催化二氢山奈酚(- D)生成山奈酚(- D),而不是催化二氢槲皮素(- D)生成槲皮素,而在黄色品种MLQS中则相反。这一假设与我们的代谢数据一致,我们发现在S3-S5阶段,当MLQS和YGB之间的花颜色差异变得明显时,二氢槲皮素、异鼠李素(- D)和山柰酚(- D)之间存在显著差异(图5)。7).然而,还需要进一步的实验验证。类黄酮含量与基因表达的Pearson相关分析表明,异鼠李素(−D)与基因表达显著相关NnPAL1,NnF3'H1,NnF3'H2,NnFLS1,NnOMT3表达,而槲皮素(−D)与NnPAL1而且NnOMT3表达式。NnPAL1是上游基因决定整个通路的活性,和NnF3'H1,NnF3'H2,NnFLS1,NnOMT3表达式在一定程度上与我们之前的分析一致。花色的形成与代谢途径中关键生物合成基因的表达水平有关。然而,生物合成基因的上游转录因子和转录后蛋白修饰也会影响代谢途径基因的表达和功能[62,63].因此,生物合成基因的表达与代谢物水平不一定是线性相关的。
结论
本研究首次分析了莲花着色过程中初级和次级代谢物的动态。我们发现,异鼠李素和山药酚的分流可能导致MLQS和YGB品种之间的花瓣颜色不同,因为在几乎所有的花色阶段,决定黄色的异鼠李素(- D)含量在MLQS中显著高于YGB。异鼠李素(- D)含量与黄花颜色参数b*显著相关。异鼠李素(−D)可能是导致莲花黄色和白色花朵颜色差异的类黄酮途径中的一种关键色素。这一结果证实了先前对黄花和白花莲花品种色素的研究结果[12],但与另一项研究的结果不一致,该研究报告了金酮和查尔酮类黄酮对其他植物的亮黄色花朵颜色的贡献[21].因此,我们得出结论,荷花的黄色可能具有与其他植物不同的机理。我们绘制了与莲花颜色相关的类黄酮途径的流程图,并进一步分析了该途径中关键酶的表达情况。综上所述,我们的结果表明NnFLS基因与差异表达NnOMTs与MLQS和YGB的花瓣颜色差异有关。未来的研究应该进一步证实NnFLSs而且NnOMTs这可能揭示了荷花黄色形成的机理。本研究为进一步研究莲花黄花瓣颜色育种奠定了基础。
方法
植物材料
选用中国莲花研究中心(武汉)提供的两个花色不同的荷花品种作为实验材料。这两个品种的详细资料可查阅《中国莲花品种》[9].在外部形态上,花瓣颜色是区分两个品种最明显的差异。MLQS是一个花瓣呈亮黄色的品种(RHS 5版yellow GROUP 10B,图S5)。1YGB的颜色为白色(RHS第5版white GROUP NN155D,图中S5)。1).各品种在中国武汉(30.51667°N, 114.31667°E)华中农业大学实验基地相同栽培条件下池中种植。通过对2015-2017年整个生长季花蕾颜色的连续观察,在5个不同着色阶段采集花蕾样品。黄色品种MLQS, S1花蕾呈浅黄绿色(WHITE GROUP 155C),花蕾纵向长度达1-2 cm;S2期芽变淡黄色(黄-绿组150D),芽纵长2 ~ 3 cm;S3花蕾纵长5 ~ 8 cm,花瓣淡黄色(yellow - green组150C);S4期芽纵长8- 10cm,黄色花瓣颜色较暗(yellow GROUP 2D);S5是开花的第一天,花瓣呈亮黄色(黄色组10B)。1).将白色品种YGB的花的着色过程分为5个阶段。S1期芽为白色(黄绿组154D),芽纵长1 ~ 2 cm;S2期芽变淡黄色(黄-绿组150D),芽纵长2 ~ 3 cm;S3花蕾纵长5-8 cm,花瓣淡黄色(yellow GREEN GROUP 149B);S4花蕾纵长8- 10cm,花瓣白色(white GROUP NN155C);S5是开花的第一天,花瓣颜色为白色(white GROUP NN155D)。将新鲜花瓣与皇家园艺学会颜色表(RHSCC)进行比较,以描述各阶段的颜色。在上述5个不同发育阶段,分离出两个品种的全芽(S1-S2)和中层花瓣中心部分(S3-S4)(图4)。1),然后采样进行一级和二级代谢分析以及RNA提取。所有样品采集后立即在液氮中冷冻,在- 80°C保存备用。
用CM-5分光光度计(Konica Minolta, Japan)测定中间层花瓣中心部分的颜色指数,采用三个参数(CIE 1976)进行颜色分析。L*表示亮度,a*表示红绿轴,b*表示黄蓝轴[10,64].色度[C* = (a*2 + b*2) 1/2]和色相角度值(h*) [h* = Arctan (b*/a*)]通过a*和b*的值计算,表示饱和度和色相[64,65].h*是一个连续褪色的色相圈,用来描述不同的颜色,有四个特殊的度数,分别是红色(0°/360°)、绿色(180°)、蓝色(270°)和黄色(90°)[65,66,67].每个样品的颜色指数用三个生物重复进行测量。
GC-MS初步代谢谱分析
使用Yun等人描述的改进方法,通过GC-MS进行非靶向代谢物谱分析。[29和Tan等人。[68].在2,700 μl甲醇和利比醇溶液(300 μl, 0.2 mg ml)中提取200 mg花样品−1)作为定量内标。混合物先孵育,然后搅拌、干燥和衍生。根据Yun等人的建议,使用Thermo Trace GC Ultra和Thermo Fisher TSQ 8000 Evo三重四极杆质谱仪(Thermo Fisher Scientific, Waltham, MA, USA)进行GC- ms分析。[29和Tan等人。[68].在NIST文库中检索代谢物。如Tan等人所述,基于定量离子和内标利比醇的峰面积比进行定量。[68].
LC-MS二级代谢谱分析
根据Yun等人的说法,采用LC-Q-TOF-MS进行二次代谢谱分析,并采用一种改进的方法。[29].将100 mg冻干粉在4°C条件下用80%甲醇浸泡过夜提取。然后将混合物离心并过滤。代谢谱分析使用Q-TOF 6520质谱计(安捷伦科技公司,帕洛阿尔托,美国加利福尼亚州)与Page等人描述的1200系列快速分辨高效液相色谱系统耦合进行。[69].原始数据由安捷伦质量猎人定性分析(版本B. 04)处理。00, Aglient Technologies)和基于Tan等人的Mass Profiler软件(版本B. 02.02, Aglient Technologies)。[70].代谢产物鉴定采用质量片段分析(MS/MS),将准确的m/z值、保留时间和碎片模式与现有标准进行比较,或与文献和数据库(如METLIN、MassBank、HMDB)中报道的代谢产物进行比较。根据Sumner等人的代谢物鉴定内容。[71].标准品槲皮素3-O-hexoside和槲皮素购自Sigma-Aldrich(美国)。采用Simca-P (Ver 11, Umetrics, Umea, Sweden)软件进行PCA分析。
qRT-PCR表达谱分析
根据lotus注释数据筛选出20个类黄酮通路关键同源物[2]在QuantStudio™7 Flex实时PCR系统(Applied Biosystems, Inc., Foster City, CA, usa)上使用基因特异性引物(Primer Premier软件5.0版本)进行qRT-PCR验证(附加文件)1:表S1)。使用EASYspin植物RNA试剂盒(Aidlab,北京,中国)提取MLQS和YGB花着色5个代表性阶段的总RNA。RNA的质量和数量采用1% (w/v)琼脂糖凝胶电泳和NanoDrop 2000分光光度计(Thermo Fisher Scientific, Wilmington, DE, usa)进行检测。使用5X All-in-One Mastermix (AccuRT Genomic DNA removal Kit, Canada)反转录总体积为20 μL的2微克总RNA。qRT-PCR反应体系为10 μL,包含5 μL SYBR Premix Ex Taq II (Tli RNaseH Plus)(2倍),0.2 μL ROX参比染料II(50倍)(Takara, Dalian, China),每个引物400 nM和1 μL 10倍稀释的cDNA模板。反应程序如下:95°C 10 s;然后在95°C, 10秒,40个循环,然后在55°C, 20秒,72°C, 20秒退火。随后,在PCR的最后一轮循环后,使用55°C到95°C的热解离协议检查单个PCR扩增的特异性。基于之前对lotus的研究,我们选择actin作为内控[3.,10].为保证qRT-PCR结果的可重复性和可靠性,每个样本设置3个独立的生物重复和3个技术重复。基因的相对表达量的定量使用2-⊿⊿CT方法,如Livak和Schmittgen所描述的[72].
统计分析
我们进行了方差分析和邓肯多距离检验(P< 0.05和PMLQS和YGB在花着色过程中的一级和二级代谢谱均< 0.01)。根据邓肯多区间检验结果,显著水平以小写字母表示。对MLQS和YGB之间的差异代谢物分析进行了学生t检验P-值设置为0.05或0.01。qRT-PCR分析结果采用Student 's t检验(P < 0.05)或(P < 0.01)。所有数据分析均使用SAS软件(Version 8.0;SAS研究所,卡里,NC)与三个生物重复。采用R软件(Version × 64 3.5.0)进行Pearson相关分析。
数据和材料的可用性
本研究期间产生或分析的所有数据均包含在本文及其补充信息文件中。
缩写
- 4 'cgt:
-
4 ' -O-glucosyltransferase
- 4 cl:
-
4-coumarate-CoA连接酶
- 方差分析:
-
方差分析
- 答:
-
花青素合成酶
- 为:
-
金鱼草素合酶
- C4H:
-
肉桂酸4-hydroxylase
- 互补脱氧核糖核酸:
-
互补脱氧核糖核酸
- 气:
-
查耳酮异构酶
- CHS:
-
查耳酮合酶
- DFR:
-
Dihydroflavonol-4-reductase
- EBGs:
-
早期的生物合成的基因
- F3’5是什么:
-
类黄酮3 ',5 ' -羟化酶
- F3'H:
-
类黄酮3 ' -羟化酶
- F3H:
-
黄烷酮3-hydroxylase
- 读者:
-
黄酮醇合成酶
- 气相:
-
气相色谱分析-质谱法
- 高效液相色谱法:
-
高效液相色谱法
- 政治:
-
Leucoanthocyanidin还原酶
- 质:
-
液相色谱-光谱法
- LC-Q-TOF-MS:
-
液相色谱四极杆飞行时间质谱
- 代谢物(−D):
-
代谢物及其衍生物总含量
- OMT:
-
O-methyltransferase
- 朋友:
-
苯丙氨酸ammonia-lyase
- 主成分分析:
-
主成分分析
- 存在:
-
定量逆转录聚合酶链反应
- 柠檬酸:
-
三羧酸
参考文献
被子植物系统发育学G.开花植物目和科被子植物系统发育学类群分类的更新:APG III。中国生物医学工程学报,2009;29(2):369 - 369。
Ming R, Vanburen R,刘勇,杨梅,韩勇,李莱特,等。长寿圣莲(Nelumbo nucifera Gaertn.)的基因组。基因组医学杂志。2013;14 (5):R41。
引用本文赵敏,杨建新,毛天宇,朱红华,向玲,张杰,陈丽琴。荷花(Nelumbo nucifera Gaertn.)之间高度分化的基因组区域与植物结构的对比及其与植物结构的功能相关性的检测。植物学报,2018;9(1219)。
薛建红,董卫平,程涛,周曙林。莲科植物叶绿体全基因组揭示的系统位置和物种多样性。系统进化学报,2012;50(6):477-87。
久保N,平井M,金子A,田中D,嘉纯k。水莲(Nelumbo nucifera) SSR分子标记的建立与鉴定。Aquat机器人。2009;90(2):191 - 4。
杨荣忠,魏小林,高凤凤,王丽生,张宏杰,徐永杰,等。高效液相色谱-光电二极管阵列检测/电喷雾电离质谱法同时分析莲花品种花瓣中的花青素和黄酮醇。中国有色金属学报。2009;29(1):61 - 62。
邓娟,陈松,尹旭军,王凯,刘永利,李树生,杨鹏飞。108个荷花品种花瓣中花青素、黄酮和黄酮醇的系统定性和定量评价。食品化学。2013;139(1 - 4):307 - 12所示。
王QC。中国莲花品种。北京:中国林业出版社;2005.
张XY。标题中国莲花新品种。北京:中国林业出版社;2011.
王YJ陈YQ元M,雪ZY, Jin QJ徐YC。圣莲类黄酮生物合成基因表达差异揭示了花的颜色多样性。中国科学(d辑:自然科学版)2016;
Mol J, Grotewold E, Koes R.基因如何描绘花朵和种子。植物科学进展1998;3:212-7。
邓军,傅铮,陈松,Damaris RN,王凯,李涛,杨萍。红白两种莲品种花瓣的蛋白质组学和表观遗传分析。植物细胞物理学报2015;56(8):1546。
王安,李锐,任玲,高旭,张艳,马铮,马东,罗艳。不同果肉颜色红薯中黄酮类化合物的比较代谢组学研究(番薯甘薯(l) lam)。食品化学;2018.S0308814618305673页。
尼尔森KM,刘易斯DH,摩根ER。桔梗黄花系类胡萝卜素色素的特征及其生物合成。Euphytica。2003;130(1):25 - 34。
莫志平,田玲,王晓燕,王晓燕。金盏花花瓣发育过程中类胡萝卜素合成基因表达的分析。植物分子生物学,2001;45(3):281-93。
菊(Dendranthema grandflorum, Ramat.)花瓣中类胡萝卜素的组成Kitamura)。植物化学。2004;65(20):2781 - 7。
包铮,晁玲,亚勤,宣勇,方伟,江生,王广杰,柯德。芸属植物类胡萝卜素裂解双加氧酶4基因的突变使花色由白变黄。新植醇。2015;206(4):1513 - 26所示。
田中勇,张志刚,王晓燕。遗传工程在植物育种中的应用。植物细胞组织器官学报2005;80(1):1 - 24。
矮牵牛属植物中黄酮类化合物生物合成的定向。植物j . 1998; 13(2): 259 - 66。
黄酮与花色;1988.p . 565 - 88。
O荣一郎,FM雅子,Noriko N, Yuko F, Keiko YS, Masaatsu Y,等。黄花由金酮生物合成途径的表达产生。中国科学(d辑:自然科学版),2006;29(4):576 - 576。
Markham KR, Hammett KRW, Ofman DJ。两种黄花鸦属植物及其杂种的花色素沉着。植物化学,1992,31(2):549 - 54。
黄玉杰,吉川佳,宫岛1,大久保H.与金花山茶杂交的花色与色素。51 Sci Hortic。1992;(3):251 - 9。
戴维斯KM, Marie Bradley J, Schwinn KE, Markham KR, Podivinsky E.五系莲属植物花瓣中类黄酮的生物合成。植物科学。1993;95(1):67 - 77。
Markham KR, Ofman DJ。莲花黄酮类色素及其在花色中表达的影响因素。植物化学,1993;34(3):679 - 85。
张丽娟,张丽娟,张丽娟,张丽娟。莲藕花瓣花青素和类胡萝卜素的品种差异,植物学报(自然科学版),vol. 32;2002.
徐军,李旭,蒋军,李建辉,蒋宏伟。不同花色莲的色素组成及稳定性分析。江苏农业科学。2016年,44(2):331 - 334335。
Lombardo VA, Sonia O, Julia B, Lauxmann MA, Bustamante CA, Budde CO,等。桃子果实发育和成熟过程中的代谢图谱揭示了支撑每个发育阶段的代谢网络。植物杂志。2011;157(4):1696 - 710。
云志,高宏,刘鹏,刘珊,罗涛,金松,等。采后热处理增强柑橘果实抗病能力的比较蛋白质组学和代谢组学分析。植物生物学杂志,2013;13(1):44。
Mühlemann J, Klempien A, Dudareva N:花挥发物:从生物合成到功能,卷37;2014.
王晓燕,王晓燕,王晓燕,等。植物对糖的敏感和信号传导机制的研究进展。植物学报,2006;57(1):675-709。
吕伟,阮丽丽。糖和生长素信号通路对细胞分裂和膨胀的调节作用。植物学报,2013;4(4):163。
王磊,Nägele T, Doerfler H, Fragner L, Chaturvedi P, Nukarinen E,等。可可种子成熟的系统水平分析揭示了初级和次级代谢的顺序相互作用,导致多酚的积累和抗逆性的准备。植物j . 2016; 87(3): 318 - 32。
刘永杰,王国林,马军,徐志生,王峰,熊爱生。在4个胡萝卜品种中,蔗糖合成酶基因的转录谱显示出不同的模式。植物生物学杂志,2018;18(1):8。
科赫柯。碳水化合物调节基因在植物中的表达。植物生理学报1996;47(1):509-40。
钱永明,张士祥,姚树斌,夏建新,李永忠,戴晓丽,等。基于转录组学和代谢分析的体外蔗糖对茶树品质成分的影响。植物生物学杂志,2018;18(1):121。
张超,付娟,王艳,高升,杜东,吴芳,郭娟,董磊。葡萄糖供应对牡丹“洛阳红”切花着色和花青素生物合成的影响。生物技术,2015;101:73-81。
黄志明,张志强,张志明,等。一种具有广泛底物特异性和区域选择性的柑橘黄酮o -甲基转移酶的分子克隆与鉴定。植物生物学杂志,2016;16(1):180。
Abad-García B, Berrueta LA, Garmón-Lobato S, Gallo B, Vicente F.高效液相色谱-二极管阵列检测耦合电喷雾电离和三重四极杆质谱法表征果汁中酚类化合物的一般分析策略。中国有色金属学报。2009;29(5):593 - 593。
Saito K, Yonekura-Sakakibara K, Nakabayashi R, Higashi Y, Yamazaki M, Tohge T, Fernie AR.拟南芥类黄酮生物合成途径:结构和遗传多样性。植物生理与生物化学,2013;72:21-34。
张春平,刘刚,胡福林。蜂胶β -糖苷酶水解黄酮苷的研究。科学通报,2012;26(3):270-3。
西南郊约20李。北京大学出版社。:生态生物化学;2001.
邓建辉,谭晓辉,王芳,潘晓辉,龚明明。金属离子和颜色佐剂对葡萄果皮色素稳定性的影响。粮食资源发展2009;30(11):48-53。
赵春林,郭卫民,陈建勇。植物颜色的形成及其调节机制。植物学通报。2005; 22(1): 70 - 81。
李伟伟,刘伟,欧悠悠,徐伟勇。有机酸和糖对野生樱桃李花青素的补充作用。江苏农业科学2018;46(13):183-6。
《有机酸:旧代谢物,新主题》,第81卷;2006.
Harborne简森-巴顿。植物多酚- xv:黄酮醇作为黄色花色素。植物化学,1965;4(5):647 - 57。
Silva TMS, Camara CA, Lins ACDS, Barbosa-Filho JM, Silva EMSD, Freitas BM。无刺蜂花粉的化学成分及其清除自由基的活性。食品成分分析。2006;19(6):507-11。
张丽娟,赵敏,李晓燕,等。拟南芥幼苗中TTG1/bHLH/Myb转录复合体对花青素生物合成途径的调控。植物j . 2010; 53(5): 814 - 27所示。
Wei S, Li X, Gruber MY, Feyissa BA, Amyot L, Hannoufa a . COP9信号体亚基5A影响拟南芥调控三蛋白复合体苯丙类代谢、毛状体形成和关键基因的转录。植物生物学杂志,2018;18(1):134。
王泽波,于秋波,沈文祥,El Mohtar CA,赵晓春,Gmitter FG。对柑橘CHS基因家族成员的功能研究发现了一个影响类黄酮产生的新CHS基因。植物生物学杂志,2018;18(1):189。
周兴伟,范志强,陈燕,朱艳丽,李建勇,尹鸿飞。黄酮醇合成酶样基因的功能分析揭示了其在花色素形成过程中类黄酮代谢中的作用。38 J Biosci。2013;(3):593 - 604。
Tohge T, Yonekura-Sakakibara K, Niida R, Watanabe-Takahashi A, Saito K.拟南芥植物化学基因组学:类黄酮生物合成基因的功能鉴定。化学学报,2007;39(4):811-23。
穆扎克一世,王杰,安泽洛蒂,张宏,易卜拉欣。拟南芥黄酮醇3 ' - o -甲基转移酶cDNA克隆的功能表达及其产物的表征。生物化学,2000;37(2):385-8。
金秉国,金德华,许鸿华,林杰,林勇,安志华。O-methyltransferases从拟南芥48卷;2005.
Pelletier MK, Burbulis IE, Winkel-Shirley B.破坏特定的类黄酮基因增强了拟南芥幼苗中类黄酮酶和最终产物的积累。植物分子生物学1999;40(1):45-54。
María Lorena FF, Sebastian R, Julia E, Lucille P, Antje F, Kengo M, Paula C, Erich G. uv - b诱导玉米黄酮醇合成酶的克隆与鉴定。植物学报(英文版);2010;29(1):369 - 369。
金BG,乔EJ,安JH。杨树黄酮醇合成酶的分子表征及其在合成3- o -甲基山奈酚中的应用。Biotechnol。2010;32(4):579 - 84。
杨文华,李文华,李文华,等:柑橘黄酮醇合成酶的功能表达及突变分析。2月J 2002; 269(16): 4134 - 4142。
李超,白艳,李松,陈红,韩旭,赵红,邵杰,朴苏,吴强。苦荞黄酮醇合成酶基因FtFLS1的克隆、表征、活性分析及其与黄酮含量的关系。农业食品化学学报,2012;60(20):5161-8。
欧文斯DK, Alerding AB,克劳斯比KC,班达拉AB,韦斯特伍德JH,温克尔BSJ。拟南芥黄酮醇合成酶基因家族的功能分析。植物杂志。2008;147(3):1046 - 61。
strke R, Jahns O, Keck M, Tohge T, Niehaus K, Fernie AR, Weisshaar B.拟南芥植物黄酮醇苷生成依赖的黄酮醇苷积累分析揭示了MYB11-、MYB12-和myb111独立的黄酮醇苷积累。新植醇。2010;188(4):985 - 1000。
拟南芥转录因子MYB12是一种黄酮醇特异性苯丙类生物合成调控因子。植物杂志。2005;138(2):1083 - 96。
沃斯DH。将植物颜色的色度计测量与皇家园艺学会色度表联系起来。HortScience。1992; 27:1256-60。
引用本文朱明民,郑晓春,舒启勇,李辉,钟碧萍,张海军,徐玉军,王丽娟,王丽娟。热带睡莲品种黄酮类成分与花色变异的关系。《公共科学图书馆•综合》。2012;7 (4):e34335。
Gonnet摩根富林明。花青素共色素作用的显色效应。使用CIELAB比例尺的比色定义。食品化学。1998;63(3):409 - 15所示。
彩色外观型号:CIECAM02及以上。IS&T/SID第十二届彩色成像会议教程幻灯片;2011.
谭福强,涂红,王锐,吴晓明,谢克德,陈建军,张海燕,徐军,郭伟伟。非靶向代谢组学揭示了柑橘双二倍体基因组加倍后的代谢适应。代谢组学。2017;13(11):143。
抗坏血酸对拟南芥高光驯化过程中花青素积累的影响:氧化还原控制花青素合成的进一步证据。植物细胞环境学报,2012;35(2):388-404。
谭凤强,涂红,梁文杰,龙建明,吴晓明,张海燕,郭伟伟。柑桔二倍体及其二倍体砧木的比较代谢和转录分析。紫阳向城)表明了其潜在的抗应力改良价值。植物生物学杂志,2015;15(1):89。
Sumner LW, Amberg A, Barrett D, Beale MH, Beger R, Daykin CA,等。拟议的化学分析最低报告标准。代谢组学。2007;3(3):211 - 21所示。
Livak KJ, Schmittgen TD。相关基因表达数据的实时定量PCR和2−ΔΔCT方法。方法。2001;25(4):402 - 8。
确认
不适用。
资金
本研究由国家自然科学基金项目31700619和中央高校基本科研业务费专项资金(No:2662016QD022)资助。资助机构没有参与研究的设计、数据的收集、分析和解释,也没有参与撰写稿件。
作者信息
从属关系
贡献
JZ构思并设计了这个实验。CHX, JXY进行实验。JZ, HHZ和TYM分析了数据。JZ和HYZ提供试剂/材料/分析工具。JZ和HHZ撰写了这篇论文。作者顺序由合著者共同决定。所有作者阅读并批准了最终稿件。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们没有竞争利益。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
附加文件
额外的文件1:
表S1。类黄酮途径结构基因qRT-PCR引物序列。(医生14 kb)
额外的文件2:
表S2。气相色谱-质谱联用法测定荷花着色阶段中鉴定的化合物。(XLS 11 kb)
额外的文件3:
表S3。莲花着色五个阶段主要代谢物的GC-MS数据。数据归一化为利比醇,计算为μg / g花瓣干重。在ANOVA和Duncan’s多范围检验结果(项目A vs项目B)中,红色和蓝色表示与项目A相比,项目B显著增加或减少(p< 0.05), a、b、c、d经Duncan多区间检验为显著水平(p < 0.05)。(XLS 50 kb)
额外的文件4:
表S4。在MLQS和YGB的五个着色阶段检测到次生代谢物。代谢物鉴定采用质片段分析(MS/MS),将其保留时间和质谱与已知标准相匹配,或与文献和数据库中报道的代谢物进行比较。根据Sumner等人的代谢产物鉴定水平。代谢组学(2007)3:211 - 221。(XLS 43 kb)
额外的文件5:
图S1。花卉着色过程中次生代谢物及其衍生物动态的热图一个MLQS和b部门。各次生代谢物及其衍生物在各个时期从最小到最大的比例由蓝色到红色表示。(PDF 1058 kb)
额外的文件6:
表S5。莲花着色五个阶段次生代谢物的LC-MS数据。数据归一化为利多卡因,计算为μg / g花瓣干重。方差分析和邓肯检验结果(A项与B项)中,红色和蓝色表示与A项相比,B项显著增加或减少(p < 0.05), A、B、c、d表示邓肯多极差检验显著(p < 0.05)。(XLS 83 kb)
额外的文件7:
表S6。花着色过程中MLQS和YGB次生代谢物的差异。Student 's t检验使用的数据为次级代谢物的含量(表S5)。在学生的t检验结果(项目A vs项目B)中,红色或蓝色表示与项目A相比,项目B增加或减少显著(p < 0.05)或非常显著(p< 0.01)。(XLS 24 kb)
额外的文件8:
表S7。Y/W初级代谢物与次级代谢物之间的Pearson相关分析。*表示显著相关P< 0.05水平,**表示在P< 0.01的水平。红色和蓝色分别代表正相关和负相关。(XLS 13 kb)
权利和权限
开放获取本文根据创作共用署名4.0国际许可协议发布(http://creativecommons.org/licenses/by/4.0/),该协议允许在任何媒体上不受限制地使用、分发和复制,前提是您适当地注明原作者和来源,提供创作共用许可的链接,并说明是否有更改。创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
朱,Hh。,Yang, Jx., Xiao, Ch.et al。类黄酮途径代谢产物和转录物的差异影响水生植物黄色花瓣的颜色莲属椰子.BMC植物杂志19日,277(2019)。https://doi.org/10.1186/s12870-019-1886-8
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-019-1886-8