摘要
背景
大部分杏子(Prunus Armeniaca L.)品种显示橙色或黄色的背景皮肤,而一些品种特别受消费者的青睐,因为他们的红色皮肤在背景上脸红。
结果
本研究以红颜杏为材料,研究了红颜杏和红颜杏的表皮形成机制。高效液相色谱分析表明,发红品种果实成熟过程中积累的花青素-3- o -葡萄糖苷、花青素-3- o -芦丁苷和芍药苷水平均高于未发红品种。基于共表达网络分析(WGCNA),一种假定的花青素相关R2R3-MYB,PaMYB10并且从转录组数据中鉴定出七种结构基因。系统发育分析表明PaMYB10聚在花青素相关的MYB分支中。序列比对显示PaMYB10包含一个bhhh相互作用基序([DE]Lx2[RK]x3Lx6Lx3R)和一个ANDV基序。亚细胞定位分析表明PaMYB10是一个核蛋白。Real-time qRT-PCR分析结果显示PaMYB10发红杏花青素合成的7个基因显著高于未发红杏,这与花青素的积累是一致的。此外,套袋显著抑制了转录水平PaMYB10和'jianali'的结构基因并阻断红色和花青素积累。瞬态PaMYB10'Luntaixiaobaixing'水果中的过度表达导致成熟阶段的红色腮红皮肤。
结论
占据了这些数据,揭示了三种花青素对杏子的腮红,鉴定PaMYB10作为杏子花青素生物合成的正调控因子,并证明脸红的形成依赖于光。
背景
杏色(李属armeniacaL.)是一种广泛栽培的温带果树[1这种水果含有多种类胡萝卜素,表皮呈橙色或黄色。新疆是世界杏栽培的主要中心之一,也是我国杏栽培的主要地区之一;这个地区种植了近200个品种[2].在这些品种中,一些橙色或黄色背景皮上有红色腮红的品种,因其颜色漂亮和营养价值高而受到消费者的特别青睐[3.,4].然而,这些品种脸红形成的机制尚不清楚。
花青素是一种水溶性类黄酮色素,在许多花、水果、种子和蔬菜的液泡中积累,形成红色、紫色和蓝色[5].作为主要的颜色决定因素和抗氧化成分,花青素色素在果实中的积累是促进健康的重要指标[6,7].因此,了解果实中花青素生物合成的调节对于我们饮食的富含花青素的食物来说是重要的。
花青素是由类黄酮途径的一个分支合成的,这在许多植物中得到了广泛的研究[8,9,10.].一般来说,转录水平上的花青素生物合成是由dna结合R2R3 MYB转录因子复合物、myc样碱性螺旋-环-螺旋(bHLH)蛋白和WD40蛋白控制的[11.,12.,13.].该复合物MYB成员可单独在花青素生物合成中发挥调节作用[14.,15.,并在各种水果作物中被发现,包括葡萄[16.)、苹果(17.)、梨(18.]和桃子[19.].
据报道,MYB TFS在控制植物途径中具有不同的功能,例如次生新陈代谢,发育,信号转导和抗病性[20.].这些TFS的特征在于由单一或多个不完全重复组成的结构保守的DNA结合结构域。在这些MYB TFS中,两次重复类(R2R3)是最大的,其中133 r2R3 MYB TFS报告拟南芥[21.,22.在葡萄中报道了108 [23.].已经明确指出,R2R3 MYB转录因子是决定大多数植物花青素生产时空模式的关键[7,15.,24.].因此,与花青素生物合成相关的MYB转录因子的分离和表征是了解和操纵果实着色的重要一步[25.].
近年来,对花青素途径的分子控制在许多园艺作物中的研究取得了很大进展[14.].阳光能增强苹果、梨和桃子的花青素生物合成[26.].在杏子中,虽然在某些品种中观察到腮红皮肤,但目前没有关于其发展机制的信息。在本研究中,我们确定了果实腮红的主要颜料,并确定了基于共表达网络分析(WGCNA)的花青素生物合成途径的一个R2R3 MyB转录因子和七种结构基因。通过袋装和瞬时过度表达研究了MYB在杏子中的花青素积累中的潜在作用。我们的结果表明PaMYB10负责控制花青素生物合成,并参与杏子中腮红的皮肤的发育,并且该过程受光线调节。
结果
果实发育和成熟过程中基本品质参数的变化
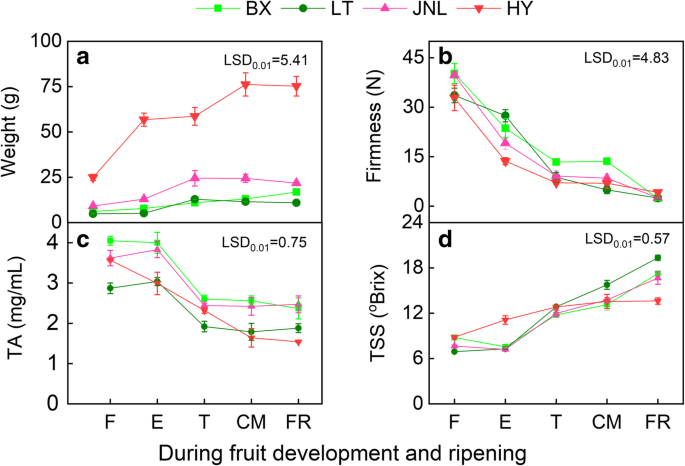
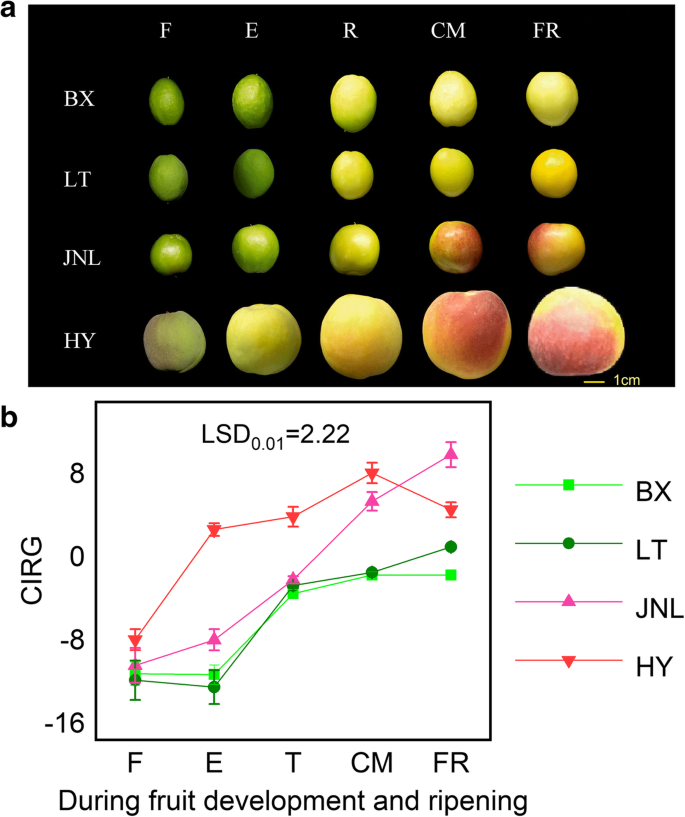
从小果期(F)到成熟期(FR),所有试验品种的果实重均迅速增加,呈典型的s型曲线(图2)。1a),而果实硬度在整个发育期急剧下降(图。1b).所有果实的TSS浓度随果实发育而显著增加(图2)。1c), TA浓度显著降低(图。1D)显示五个发展阶段完全涵盖了水果开发和成熟的全部过程。四个杏品种表现出从转弯(t)阶段的逐渐变化。的一个* value increased during ripening and was positive at the enlargement (E), commercial maturation (CM) and FR stages in ‘HY’ and ‘JNL’, indicating that the fruit was turning red, whereas the value was negative during the whole ripening process in ‘LT’ and ‘BX’ (Additional file1:表S1)。在CM阶段,腮红出现在'JNL'和'HY'的果皮上,而“LT”和“BX”的皮肤没有显示腮红(图。2a).一般用红葡萄颜色指数(CIRG)来评价果实的红色程度。各果皮的CIRG值随发育而增加,但‘HY’和‘JNL’果皮的CIRG值显著高于‘BX’和‘LT’果皮(图2)。2b)。
果实开发期间的花青素含量的变化
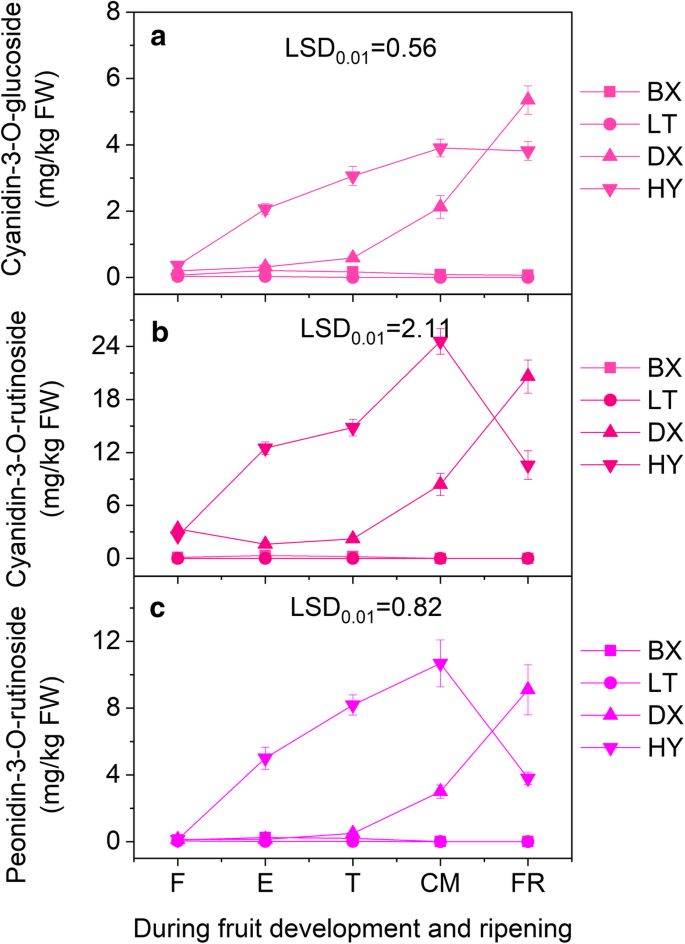
从杏皮中鉴定了三种花青素(Cyanidin-3-O-葡糖苷,Cyanidin-3-O-Rutinoside和PeoNidin-3-O-Rutinoside)(图。3.).在开发和成熟过程中,“BX”和'LT'的花青素含量仍然很低,而“JNL”和“HY”的含量显着增加。For ripe fruit, the total anthocyanin concentrations in ‘JNL’ and ‘HY’ were 35.05 mg/kg·FW and 39.17 mg/kg·FW, respectively, which were significantly higher than those in ‘BX’ (0.09 mg/kg·FW) and ‘LT’ (0.07 mg/kg·FW). Interestingly, we detected cyanidin-3-O-rutinoside in the red cultivars; it accounted for 58.8% and 62.7% of the total anthocyanins in ‘JNL’ and ‘HY’, respectively, but was not detected in the ‘BX’ and ‘LT’ fruit peels.
WGCNA筛选候选基因
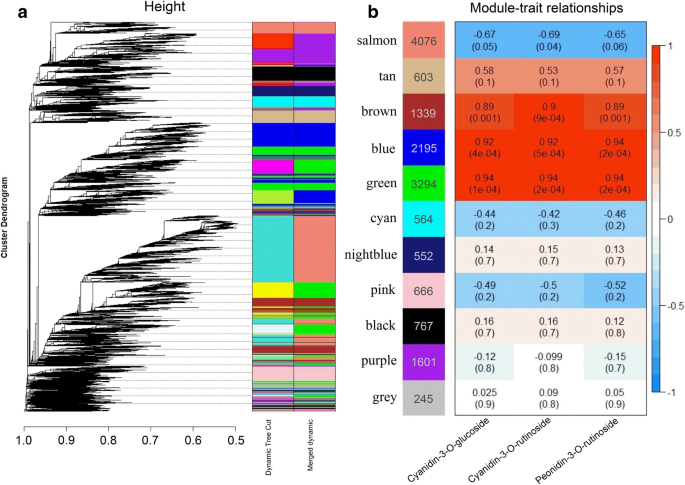
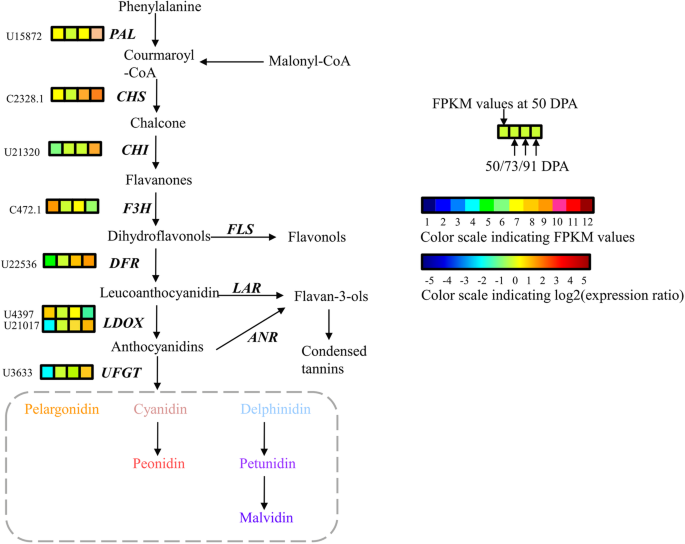
我们利用WGCNA研究了负责花青素生物合成的转录因子和结构基因。我们发现蓝色和绿色模块与cyanidin-3-O-glucoside呈显著正相关,相关系数为0.92 (e-value = 4 × 10)- 4.)和0.94(e-value = 1×10- 4.), 分别。在两种模块和Cyanidin-3-O- rutinoside和PeoNidin-3-O-Rutinoside之间发现了类似的显着相关性(图。4).根据蓝色和绿色模块中基因与花青素化合物的相关系数及变化每千碱基片段记录每百万这些基因在果实成熟过程中的FPKM值(图2)。5),编码MyB的一个U1373基因位于蓝色模块中,并且七种结构基因被鉴定为杏子中的花青素生物合成的推定候选基因,包括一种氨基酮异构酶(Chi:U21320)和一种UDP-葡萄糖:黄酮类化合物3-O-葡萄糖转移酶(UFGT:U3633)位于蓝色模块和一个苯丙氨酸氨裂解酶(PAL:U15872)中,一种Chalcone合酶(CHS:Cl2328.1),一种类黄酮3-羟化酶(F3H:Cl472.1),一种二氢烷醇4-还原酶(DFR:U22536)和位于绿色模块中的一种白藻藻啶二氧化酶(LDOX:U21017)(附加文件2:表S2)。
系统发育和保守的基序分析及亚细胞定位PaMYB10
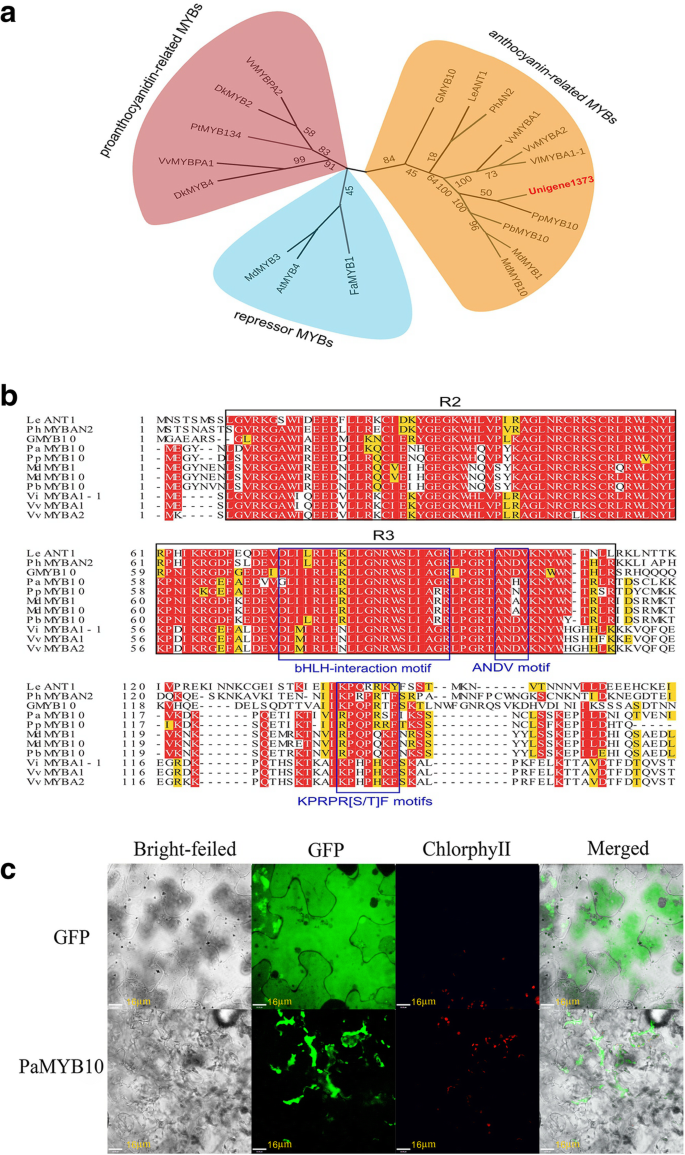
基于杏转录组中的148个MYB基因和其他物种MYB转录因子构建了自启动循环系统发育树。树显示,148个MYB tf分布在5个分支(附加文件3.包括类黄酮相关的MYB、水分胁迫相关的MYB、酚类相关的MYB、细胞壁组成相关的MYB,以及一些功能未知的MYB分支。U1373明显与参与类黄酮合成的其他MYB转录因子聚类。为了进一步验证结果,我们基于U1373和来自其他物种的18个类黄酮相关MYB转录因子生成了另一棵系统发育树。第二种系统进化树显示U1373属于花青素相关的MYB分支,与PpMYB10明显聚类,与梨(Pyrus bretschneideri),以及苹果MdMYB1和MdMYB10 (马吕斯有明显) (图。6一种) [27.,28.].因此,命名为U1373PaMYB10.
用RACE法从‘JNL’果皮中分离得到全长U1373。该序列全长675 bp,包含一个完整的开放阅读框,编码225个氨基酸。随后,比较推导出的氨基酸序列PaMYB10与其他植物花青素相关的MYB转录因子在R2和R3 dna结合域上具有高度的序列相似性。如图所示。6b, PaMYB10 c端R2R3区域也存在一个保守的KPRPR [S/T] F motif。进一步分析发现,R3 dna结合区域包含一个R/ b样bHLH相互作用motif ([DE]Lx2[RK]x3Lx6Lx3R)和一个ANDV motif。
确定亚细胞定位PaMYB10烟草(烟草在共聚焦激光扫描显微镜下观察重组载体pC1301-GFP- myb10与对照载体pC1301-GFP侵染后的叶片。我们发现,使用对照载体pC1301-GFP的烟草叶片在整个细胞中都表现出荧光,而使用重组载体p163-GFP-MYB10的烟草叶片在细胞核中表现出强烈的荧光。这些结果表明该基因的表达位点在细胞核(图。6c)。
转录水平的PaMYB10与花青素合成有关的结构基因
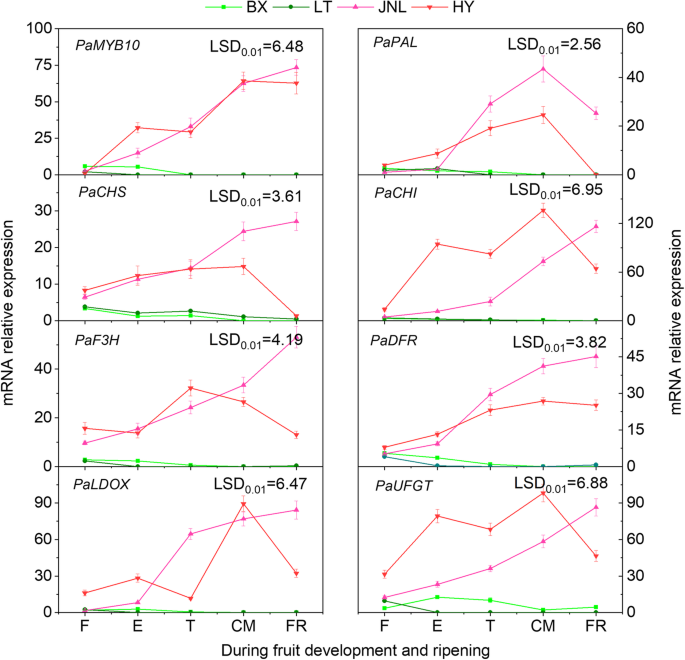
结果表明,腮红品种('JNL'和'HY')的剥离中所有基因的转录物水平显着高于非团体栽培品种('BX'和'LT')中的那些(P< 0.05)(图7).的转录水平PaMYB10,教皇,PaCHS,PaCHI,PAF3H.,PaDFR,帕尔德斯和PaUFGT在“Bx”和'LT'中低,只有在F和T阶段观察到轻微上调。但是,表达水平PaMYB10而‘JNL’和‘HY’中的7个结构基因在整个发育过程中表达量均显著增加,而‘JNL’和‘HY’中的7个结构基因在整个发育过程中表达量均显著增加PaMYB10在'hy'中的大多数结构基因显示了双峰模式,并在CM阶段达到了它们的最高值。
袋装对“JNL”果实基因表达和花青素积累的影响
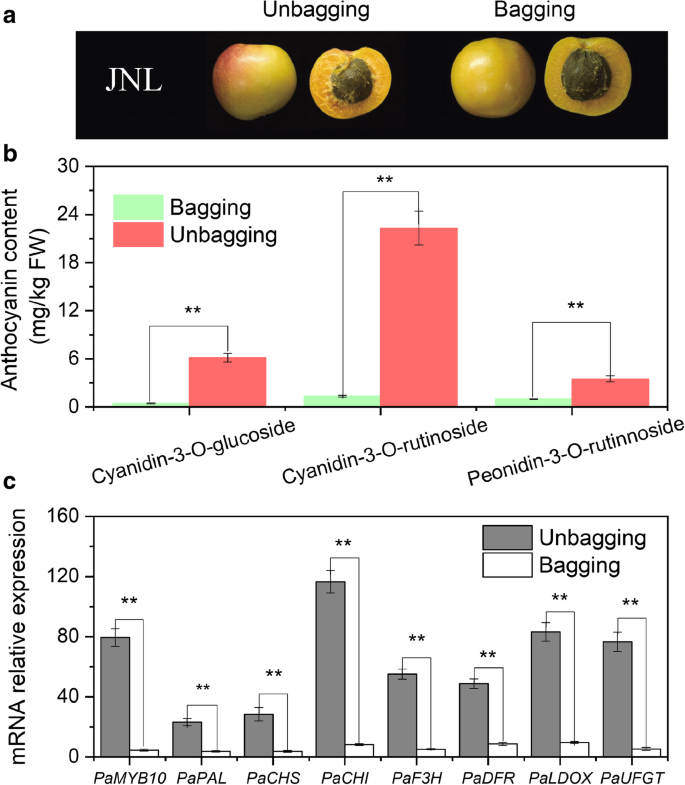
袋装果实(5.87)中的a *值显着低于非刚刚果实(20.84)(附加文件1:表S1), CIRG值也从1.20下降到0.90。在袋装的“JNL”果皮中没有观察到腮红。8a).“JNL”果皮套袋果实中的花青素-3- o -葡萄糖苷、花青素-3- o -芦丁苷和牡丹素-3- o -芦丁苷含量从35.05 mg/kg FW极显著降低至2.17 mg/kg FW。8b),PaMYB10,教皇,PaCHS,PaCHI,PAF3H.,PaDFR,帕尔德斯和PaUFGT表达水平也明显低于非刚刚果实中的水平(P< 0.05)(图8c)。
瞬态PaMYB10过表达增加了' LT '果皮的花青素产量
PaMYB10在CM期‘LT’果皮中短暂过表达。果皮呈现红色的腮红,而对照果皮没有腮红。9a).与对照相比,花青素-3- o -葡萄糖苷、花青素-3- o -芦丁苷和芍药苷的含量分别显著增加了2.2倍、3倍和2.4倍PaMYB10过表达水果(图。9b)。
讨论
橙色或黄色外皮的红杏子因其色彩斑斓的外观和极好的营养价值而在市场上越来越受欢迎。29.];然而,这些品种发展的机制仍然难以捉摸。在这项研究中,我们将花青素组合物和含量与杏子品种之间的含量进行比较,而没有腮红。基于WGCNA,基因表达和基因结构分析和转基因实验,我们将R2R3-MYB TF PAMYB10鉴定为在杏果成熟期间控制整个花青素生物合成过程的母稳压器。
我们的化学分析表明,红皮杏的总花青素含量以及单体花青素-3- o -葡萄糖苷、花青素-3- o -芦丁苷和芍药苷-3- o -芦丁苷含量均显著高于未红皮杏。3.).特别是,在果实成熟过程中,红色品种的花青素-3- o -芦丁苷水平显著升高,而不红色品种的整个成熟过程中均未检测到花青素-3- o -芦丁苷水平。这些结果表明,三种花色苷的高水平决定了杏子果皮的腮红颜色,花青素-3- o -芦丁苷在腮红的形成中起主导作用。如图所示。2a,‘JNL’和‘HY’果皮在T期后变红,说明脸红取决于果实成熟。因此,为了了解脸红形成的分子机制,我们利用代表成熟过程的‘JNL’果实的T、CM和FR阶段进行转录组测序。利用WGCNA,我们在蓝色和绿色模块中鉴定了1个MYB基因和7个与花青素生物合成相关的结构基因,这些基因与花青素-3- o -葡萄糖苷、花青素-3- o -芦丁苷和芍药苷-3- o -芦丁苷显著正相关(图)。4).MYB被认为是花青素代谢网络中的枢纽基因,表明MYB与杏果实花青素的生物合成有直接联系。
功能研究,全长PaMYB10从JNL中克隆了cDNA。在随后的系统发育分析中,PaMYB10被发现群集PpMYB10、PbMYB10 MdMYB1和mdmyb10(无花果。6A),已知与花青素生产呈正相关[27.,28.,30.,31.].序列比对发现杏子PaMYB10包含典型的R2和R3结构域,类似于同一簇中的其他MYB成员(图。6a).序列分析也表明PaMYB10含有R3结构域的ANDV基序,其是与花青素相关的MYBS的标识符[27.].除了R2R3结构域外,KPRPR [S/T] F motif是R2R3- myb特异性结构[22.,被发现在PaMYB10.最后,亚细胞定位分析显示PaMYB10-GFP分布于细胞核内(图。6c)。这些结果表明PaMYB10可能对杏果实花青素的合成有重要的调节作用。
我们也比较了表达水平PaMYB10通过对红杏和不红杏花青素生物合成相关结构基因的研究,发现在果实成熟过程中,所有基因的转录水平在红杏中均显著高于不红杏。这些发现与花青素的积累相一致,证明了这些基因与花青素的生物合成有关(图。7).与此同时,我们证明袋装导致在“JNL”中的花青素积累并防止果皮中的腮红形成(图。8b),它恰逢转录水平的显着减少PaMYB10和结构基因(图。8这些结果进一步证实了这一点PaMYB10是涉及对花青素生物合成的控制的关键基因,同时表明光线可能会影响杏子上的腮红形成。这些调查结果与先前的报道中的其他结果一致,其其他果实与熟化相关的花青素积累中的花青素生物合成调节中涉及的亮介机制[14.].
在植物中,转录因子对结构基因的转录调控似乎是控制花青素生物合成的主要机制[14.,32.,33.].大多数参与花青素生物合成调控的myb是增强花青素结构途径基因表达的正调控因子。然而,阻遏因子也有其特征,如VVMYB4.在葡萄的浆果和FaMYB1在草莓中(Fragaria x ananasasa杜赫)(23.,34.].在本研究中,单一的瞬时过度表达PaMYB10基因促进脸红的形成,显著增加了‘LT’杏的转录丰度PaMYB10和负责花青素生物合成的结构基因。这些结果表明了核心积极作用PaMYB10调控花青素合成。
R2R3 MYB TF调节可以在花青素生物合成途径的不同步骤中进行。例如,普拉拉的R2R3 MYB TFS(Perilla frutescens.)对涉及的Anthocyanin生物合成中涉及的所有结构基因的转录[35.].过度的ATPAP1和ATPAP2.强烈诱导花青素积累拟南芥由于花青素生物合成途径中所有基因的上调[36.,37.].同样,我们的研究结果表明,几乎所有负责花青素合成的基因都在过表达的杏子果实中上调PaMYB10,这提出了全球监管的作用PaMYB10但MYB TF靶向哪些基因尚需进一步研究。
一般来说,花青素生物合成途径的调控是由MYB-bHLH-WD40 (MBW)复合物控制的[7,23.].但是一些花青素生物合成相关的MYB转录因子在没有bHLH伴侣的情况下被激活,已经在葡萄和葡萄中被鉴定出来拟南芥[24.,38.].在本研究中,R3结构域的氨基酸特征([DE] LX2 [RK] X3LX6RX6R×3R)用于连接MYB和BHLH蛋白[21.],在PAMYB10蛋白中发现,表明BHLH蛋白和乳蛋白酶之间的潜在相互作用(图。6b),所以应提供更多的证据,但其他TFS是否可以协调在该过程中。
结论
在该研究中,我们发现杏子的红色腮红皮肤归因于Cyanidin-3-O-葡萄糖苷,Cyanidin-3-O-Rutinoside和果霉素-3-O-芦丁苷的累积。R2R3 MYB TFPaMYB10被鉴定为与花青素生物合成和腮红形成的调节有关的中央基因,并且该方法通过光调节。
方法
植物材料
以新疆轮台市新疆农业科学院国家果树种质资源库栽培的4个杏品种(janali (JNL)、红玉(HY)、白杏(BX)、轮台小白杏(LT))为试验材料。每六个人树被视为一个复制,和水果收获的小果实(F, 30轻拍),扩大(E, 45轻拍“软”,“LT”、“JNL”和“衔接”),把(60 T,用“软”和“LT”和54轻拍“JNL”和“衔接”),商业成熟(75厘米,用“软”和“LT”和72轻拍“JNL”和“衔接”)和完全成熟(FR,‘BX’和‘LT’阶段90 DAB,‘JNL’和‘HY’阶段82 DAB。另外,50个‘JNL’果实在T期前套袋,在FR期收获。对50个果实中的20个进行了果实大小、色差、总可溶性固形物(TSS)和可滴定酸度(TA)等基本生理指标的测定。每个样品采用三个生物重复。将剩下的30个水果样品中的果皮和果肉分离,立即用液氮冷冻,使用前置于−80℃保存。
花青素的提取与鉴定
从果皮中提取总花青素的方法根据我们之前的研究,略有修改[39.].冰冻果皮(1 g)用IKA A11分析研磨机(IKA, Staufen, Baden-Württemberg, Germany)研磨成细粉,用3 mL 2%甲酸在4°C黑暗中提取24小时。萃取物用旋转蒸发器蒸发,进行下一步。将渗滤液残渣溶于pH = 2.3的甲醇盐酸溶液中,调整至最终体积1.5 mL。随后收集清上清,过滤细胞碎片。使用Waters HPLC系统和二极管阵列检测器(Waters, Milford, MA, USA)在40°C下分析样品中的花青素。每个样品(20 μL)上载于反相C上18.一个nalytical column (4.6 mm i.d. × 250 mm i.d., 5 μm) (Nacalai Tesque, Kyoto, Japan) and eluted using a mobile phase consisting of solvent A (2% formic acid in water) and solvent B (2% formic acid and 98% acetonitrile) for 40 min at a flow rate of 1 mL per min. The effluent absorbance was monitored at 525 nm using the Genesys 10 UV spectrophotometer (Thermo Spectronic, Rochester, NY, USA). The concentration was calculated by the standard curve method and expressed as mg/kg·FW. Three biological replicates for each sample were used.
RNA提取和cDNA合成
使用总RNA试剂盒(RNEasy Plant Mini Kit,Qiagen,Hilden,Germany)从水果中提取总剥离RNA。具有OD260:OD280的RNA样品在1.80和2.0之间,OD260:OD230> 1.5和没有可辨别的降解用于cDNA逆转录。在制造商的指示之后,用涡轮DNA-FALE™试剂盒(Ambion,Austin,TX,USA)用涡轮DNA-FALE™套件(Ambion,Austin,TX,USA)治疗。随后,根据制造商的协议,使用Revertaid第一链CDNA合成试剂盒(Invitrogen,Tokyo,Japan)从1μg的总RNA合成第一链cDNA。
转录组测序和加权基因共表达网络分析(WGCNA)
‘JNL’皮转录组测序在Illumina HiSeq2000 (Illumina, USA)平台上进行。序列组装和注释是根据我们之前的工作进行的[2].利用R中的WGCNA (v1.29)包构建共表达网络,并检测其与花青素的关联。3个重复的平均NRPKM > 1序列用于WGCNA。除了软实力为16,最小模块大小为30,合并切割高度为0.25之外,其余模块均采用自动网络构建功能按默认设置逐块获取。
系统发育分析
从我们的转录组数据中共提取了148个MYB序列片段,并与来自其他物种的MYB转录因子构建了系统发育树。同源性比对后,利用邻接(neighbor-joining, NJ)准则构建另一棵无根系统发育树,并利用最大似然(maximum likelihood, ML)方法进行验证。基于JNL中氨基酸(AA)序列U1373与其他高等植物中18个类黄酮相关MYB转录因子的多重比对,共进行1000个bootstrap重复(附加文件)4:表S3)。用ClustalW进行多序列比对,用MEGA 7.0构建系统发育树。
定量实时PCR分析
八对引物(附加文件5表S5)采用Primer Premier 5.0设计,qRT-PCR采用LightCycler System (Roche LightCycler®480;罗氏诊断)。根据制造商描述的程序,所有反应均使用LightCycler®480 SYBR Green I Master Mix(罗氏诊断)进行。qRT-PCR程序为95℃30 s, 95℃5 s, 60℃30 s,共40个循环。反应体积为25 μL,含SYBR Premix Ex Taq (TaKaRa, Dalian, China) 12.5 μL,去离子水8.5 μL,每条引物1 μL,稀释cDNA 2 μL。每个样品采用三个生物重复。每个样本以核糖体RNA和肌动蛋白作为内控基因归一化[39.,40].利用2-△△Ct方法。
全长克隆PaMYB10基因
的PaMYB10利用RACE试剂盒(Takara, Dalian, China)从“JNL”的cDNA中分离到该基因(附加文件)6表S5)。的长篇PaMYB10通过使用BigDye Terminator Version 3.1 Cycle Sequencing Kit (Applied Biosystems)和ABI PRISM 3100 Genetic Analyzer (Applied Biosystems)组装3 ' RACE和5 ' RACE序列获得。将扩增产物克隆到pMD18-T载体中,转化成pMD18-T载体大肠杆菌DH5α(BioTeke,中国)。随后,阳性菌落由Sangon生物工程公司(中国上海)进行测序。
亚细胞定位
的PaMYB10用特殊引物(正向引物:5 ' - gagaacacgggggactggtacccggggatccagggctataacttgga -3 '和反向引物:5 ' -ACAGCTCCTCGCCCTTGCTC ACCATGTCGACCCTAGCTTCTTCTGAAACAT-3 ')扩增无终止子的开放阅读框(ORF),并连接到pC1301-GFP载体上,生成CAMV 35S:PaMYB10gfp融合结构。重组载体(PaMYB10-GFP)和控制载体pC1301-GFP均通过粒子轰击转化烟草。16至18 h后,用共聚焦激光扫描显微镜(Zeiss LSM 510 META, Jana, Germany)检测荧光。
杏果实过表达载体的构建及瞬时转化
过表达PMDC32二进制载体49构造如前所述[41.,42].的PaMYB10利用引物5 ' - atggagggttattcggtgtgag -3 '(正向)和5 ' -TACGTAGGAGATGTTGACTAGATCATTGC-3 '(反向)PCR扩增‘JNL’cDNA序列,并利用PCR™8/GW/TOPO TA克隆试剂盒(Invitrogen公司)克隆。测序确认后,用Gateway LR Clonase II Enzyme mix (Invitrogen)将CDS重组到pMDC32二元载体49中,生成过表达载体。向量被转换成根癌土壤杆菌GV3101,最终od值为0.8重悬于MS液体培养基中。将1毫升悬浮液均匀注射到处于商业成熟期的LT果实中。30个水果被重复注射,这些水果被注射农杆菌属携带空载体作为对照治疗。注射后7-12天,收集围绕注射部位的果皮并立即在液氮中冷冻并在80℃下储存,以根据上述方法确定花青素。
统计分析
所有实验均进行3次生物重复。最低显著差异(LSD)或1%水平的Duncan检验采用DPS(版本2.00;浙江大学,浙江杭州)。数据用三个生物重复的平均值±标准差(SD)表示。
数据和材料的可用性
支持本文结果的数据集包含在本文及其附加文件中。所有从杏中获得的序列都保存在NCBI序列读取档案(SRA)库中,登录号为PRJNA506502,并于2018年11月27日发布。
缩写
- ANR:
-
花青素还原酶
- 软:
-
Baixing
- 气:
-
Chalcone异构酶
- CHS:
-
查耳酮合酶
- DFR:
-
Dihydroflavonol-4-reductase
- F3H:
-
黄烷酮3-hydroxylase
- 读者:
-
Llavonol合酶
- :为什么
-
鸿宇
- 真
-
jianali.
- 政治:
-
Leucoanthocyanidin还原酶
- LDOX:
-
Leucoanthocyanidin Dioxygenase.
- 迷幻药:
-
最小显著性差异
- LT:
-
Luntaixiaobaing
- PAL:
-
苯丙氨酸ammonia-lyase
- TF:
-
转录因子
- UFGT:
-
UDP-黄酮类葡萄糖基转移酶
参考
- 1。
王铮,曹家宽,姜文斌。外源草酸引起的糖代谢变化与杏果实耐冷性有关。采后生物技术。2016;11:10 - 6。
- 2。
张qy,feng c,李夫,qu z,zeng m,xi wp。转录监管网络控制杏的味道和芳香质量(李属armeniacaL.)果实在成熟期间。BMC基因组学。2019; 20:45。
- 3.
消费者对新型猕猴桃的评价:支付意愿。阿格利司食物。2010;85:2519-26。
- 4.
King MC, Cliff MA从苹果新品种和成熟品种的视觉属性建立消费者喜好预测模型。台湾大学学报(社会科学版)2002;4:223-9。
- 5.
MYB转录因子调控山竹中花青素的生物合成藤黄属植物mangostanal.)果实成熟时。足底。2009;229:1323-34。
- 6.
Harborne JB,Williams Ca.自1992年以来黄酮研究进展。植物化学。2000; 55:481-504。
- 7.
Allan Ac,Hellens Rp,Laing Wa。MYB转录因子颜色的果实。趋势植物SCI。2008; 13:99-102。
- 8。
徐泽,黄益,王文,宋X,王文,熊。紫色和非紫色胡萝卜之间参与Cyanidin的花青素生物合成的结构基因的转录物分析(胡萝卜胡萝卜品种揭示不同的模式。BMC Plant Biol. 2014;14:262。
- 9。
葡萄果皮颜色的反转录转座子诱导突变。科学。2004;304:982。
- 10.
Matsui K,Umemura Y,Ohme-Takagi M. AtmyBl2,一种具有单个MyB结构域的蛋白质,作为花青素生物合成的负调节剂拟南芥.工厂J.2010; 55:954-67。
- 11.
徐文军,王志强,王志强,等。MYB-bHLH-WDR复合物对黄酮类化合物合成的转录调控。植物生态学报。2015;20:176-85。
- 12.
Ramsay NA, Glover BJ。MYB-bHLH-WD40蛋白复合物与细胞多样性的进化。植物科学进展。2005;10:63-70。
- 13。
黄酮类化合物在生物化学途径调控和进化中的作用。植物科学进展。2005;10:236-42。
- 14。
JAAKOLA L.新见解果实中的花青素生物合成调节。趋势植物SCI。2013; 18:477-83。
- 15.
许文强,张志强,张志强,等。myb调控基因的一个小家族控制花色素的强度和图案金鱼草属.植物细胞。2006; 18:831-51。
- 16.
Walker Ar,Lee E,Bogs J,McDavid Daj,Thomas Mr,Robinson SP。白葡萄通过两个类似和相邻的调控基因的突变产生。工厂J.2010; 49:772-85。
- 17.
Espley RV, Brendolise C, Chagne D, kutti - amma S, Green S, Volz R,等。在红苹果中,启动子片段的多次重复引起转录因子的自动调节。植物细胞。2009;21:168 - 83。
- 18。
王ZG,孟德,王广告,李TL,江脚,康吉,等。甲基化的PcMYB10启动子与Max Red Bartlett Pear中的绿皮肤运动有关。植物理性。2013; 162:885-96。
- 19。
Uematsu C, Katayama H, Makino I, Inagaki A, Arakawa O, Martin C. Peace,一种myb样转录因子,调节开花桃“Genpei”的花瓣色素沉淀。J Exp Bot. 2014; 65:1081-94。
- 20.
金海林,王志强,王志强。植物myb基因家族的多功能性和多样性。植物学报1999;41:577-85。
- 21.
Zimmermann Im,Heim Ma,Weisshaar B,Uhrig JF。全面识别拟南芥与R / B样BHLH蛋白相互作用的MYB转录因子。植物J.2010; 40:22-34。
- 22.
R2R3-MYB基因家族拟南芥.《植物学报》2001;4:447-56。
- 23。
Matus JT,Aquea F,Arce-Johnson P.葡萄MYB R2R3亚家族的分析揭示了扩大的葡萄酒质量相关的碎片和保守的基因结构组织葡萄属和拟南芥基因组。BMC Plant Biol. 2008;8:83。
- 24。
蔡美玲,张志强,张志强,等。葡萄R2R3-MYB转录因子VvMYBF1调控发育中的葡萄浆果中的黄酮醇合成。植物杂志。2009;151:1513-30。
- 25。
Vimolmangkang S, Han YP, Wei GC, Korban SS.一个苹果MYB转录因子MdMYB3参与花色苷生物合成和花发育的调控。BMC Plant Biol. 2013;13:176。
- 26。
冯树青,王玉玲,杨松,徐永涛,陈新世。梨花青素的生物合成是由R2R3-MYB转录因子PyMYB10调控的。足底。2010;232:245-55。
- 27.
Kui LW,Bolitho K,Grafton K,Kortsee A,Karunairetnam S,Mcghie TK等。R 2R3 MYB转录因子与蔷薇科中的花青素生物合成途径调节相关。BMC植物BIOL。2010; 10:50。
- 28.
Zhai R,王祖,张SW,Meng G,Song Ly,Wang Zg等。两种MYB转录因子调节梨果中的黄酮类生物合成(Pyrus bretschneideriRehd)。J Exp Bot. 2016;67:1275。
- 29.
袁H,张茱萸,Nageswaran D,Li L.类胡萝卜素代谢与园艺作物的调节。Hortic Res。2015; 2:15036。
- 30.
Chagne D,Kui LW,Espley RV,Volz RK,NM如何,Rouse S等人。古代复制的苹果MYB转录因子负责新的红果肉表型。植物理性。2013; 161:225-39。
- 31.
Rahim Ma,Busatto N,Trainotti L.在桃子果实中的花青素生物合成的调节。Planta。2014; 240:913-29。
- 32.
Gonzalez A, Zhao M, Leavitt JM, Lloyd AM。TTG1/bHLH/Myb转录复合物对花青素生物合成途径的调控拟南芥幼苗。植物j . 2010; 53:814-27。
- 33.
BRAVOUONOID生物合成的转录控制:涉及分化的多个方面的保守调节因素网络拟南芥.植物学报。2005;8:272-9。
- 34.
Aharoni A,De Vos Chr,Wein M,Sun ZK,Greco R,Kroon A等。草莓FamyB1转录因子抑制转基因烟草中的花青素和黄酮醇积累。工厂J.2010; 28:319-32。
- 35。
花青素生物合成后期的生物化学与分子生物学研究Perilla frutescens.作为模型植物。新植物。2002; 155:9-23。
- 36。
王志强,王志强,王志强,等。功能基因组学通过代谢组和转录组的综合分析拟南芥植物过表达MYB转录因子。植物j . 2005; 42:218-35。
- 37。
通过激活标记鉴定了一个保守的MYB苯丙类生物合成调控因子。植物细胞。2000;12:2383 - 93。
- 38。
Stracke R,Ishihara H,Huep G,Barsch Gha,Mehrtens F,Niehaus K,等。密切相关的R2R3-MYB转录因子的差异调节控制不同部位的黄酮醇积累拟南芥幼苗。植物j . 2010; 50:660 - 77。
- 39.
乙烯对彩色杏类胡萝卜素积累和胡萝卜素基因表达的调控(李属armeniaca).J Exp Bot。2005; 56:1877-86。
- 40。
张X,张立志,张QP,徐杰,刘德,东方。比较转录组分析和形态学提供了杏酱的洞察力的见解(李属armeniacaL.)。BMC植物BIOL。2017; 17:72。
- 41.
刘志春。野生草莓黄果色SNP基因变异分析及功能验证Sci众议员2016;6:29017。
- 42.
农杆菌介导的成熟肉质果实瞬时基因表达的一种简单方法。[实验机器人。2001;52:845-50 .]
确认
我们感谢Julie Caruana(马里兰大学细胞生物学和分子遗传学系)对这篇手稿早期版本的评论。
资金
国家自然科学基金项目(no . 31872046)。还有关于资助机构在设计研究、收集、分析和解释数据以及撰写手稿方面的作用。
作者信息
从属关系
贡献
GHZ构思了这项研究。WPX设计并完成了实验。WPX和JF撰写了这篇论文。SKZ和YL分析了数据。所有作者都对结果进行了讨论,并对手稿进行了评论。所有作者阅读并批准了最终的手稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
附加信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
席伟,冯军,刘永强。et al。R2R3-MYB转录因子PaMYB10参与杏子花青素的生物合成,并决定了红脸皮肤。BMC植物杂志19,287(2019)。https://doi.org/10.1186/s12870-019-1898-4
收到了:
接受:
发表:
关键字
- 李属armeniaca
- 花青素
- MYB转录因子
- WGCNA
- 克隆
- 中存在