抽象的
背景
自噬是一种保守,高度监管的分解代谢过程,其在植物中发挥着重要作用,发展和先天免疫力。在这项研究中,我们比较了自噬诱导率烟草benthamiana用烟草花叶病毒或TMV 24A + UPD突变体感染植株,其复制速度更快,引起的症状更严重。利用BirA*标记和邻近依赖生物素鉴定(BioID)分析,我们在TMV 24A + UPD感染植物中鉴定了与核心自噬蛋白ATG8相互作用的宿主蛋白。通过结合使用快速复制的TMV突变体和体内蛋白-蛋白筛选技术,我们能够从功能上了解自噬在兼容病毒-宿主相互作用中的作用。
结果
我们的研究表明,与TMV相比,TMV 24A + UPD引起的自噬磁通量增加N. Benthamiana..与ATG8相关的功能蛋白质组的分析显示,总共67个蛋白质,其中16个已知在哺乳动物和酵母体系中与ATG8或其直晶体相互作用。将相互作用的蛋白质分为四个官能团:免疫系统过程,对ROS,硫氨基酸代谢和钙信号传导的反应。由于存在泛素相关的(UBA)结构域,其被证明与ATG8相互作用,选择亨廷顿相互作用蛋白K样(HUPK)以验证物理相互作用和功能。我们使用了酵母两种杂交(Y2H),双分子荧光互补(BIFC)和亚细胞定位以验证ATG8-HYPK相互作用。随后通过病毒诱导的基因沉默(Vigs)对ATG8的下调显示出增强的TMV症状,表明在TMV 24A + UPC感染期间对自噬的保护作用。
结论
本研究提出使用BioID作为筛选ATG8相互作用蛋白的合适方法在Planta..在TMV 24A + UPD感染过程中,我们发现了许多ATG8可能的结合伙伴N. Benthamiana.植物。此外,我们已验证NBHYPK是ATG8的互动伙伴。我们推断自噬在TMV 24A + UPD感染植物中发挥着保护作用。
背景
已有报道在植物和动物细胞中感染几种病毒诱导自噬囊泡[1,2,3.,4].除非受损,自噬途径努力积极消除细胞内入侵者,以促进细胞生存[2].研究揭示了自噬在植物固有免疫、程序细胞死亡、植物抗性和病毒RNA沉默等方面的重要作用[4,5,6].近年来的研究进一步阐明了病毒侵染过程中自噬的作用、基本机制及其与宿主其他组分的相互作用。ATG8直接相互作用,促进消除棉花卷曲卷曲杂种病毒(clcumuv)毒力因子[5] 和花椰菜马赛克病毒(Camv)衣壳蛋白P4 [6].钙调蛋白样蛋白Nbcam,与之相互作用N. Benthamiana.基因沉默抑制因子3 (NbSGS3)在双生病毒感染过程中促进自噬降解[7].中萝卜马赛克病毒(tumv)感染,选择性自噬载体受体NBR1靶向RNA沉默抑制剂HCPRO,从而抑制病毒积累[8].ATG6与Tumv RNA依赖性RNA聚合酶(RDRP)相互作用,并限制其感染[9].
RNA病毒利用细胞机制,通过蛋白质-RNA、蛋白质-脂质和蛋白质-蛋白质成分的不同组成,形成病毒组装复合物[10.].他们与植物自噬的互动在很大程度上是未分发的。因此,需要识别在兼容的RNA病毒 - 宿主相互作用期间涉及自噬涉及自噬的主要宿主蛋白。自噬诱导自噬体的形成,其是双膜囊泡,其吞噬货物,如蛋白质,受损的细胞器和病原体,并将其运送到用于降解的液泡[11.].ATG8是一种与自噬体成熟相关的核心蛋白[12.].因此,筛选ATG8相互作用蛋白对于了解病毒感染过程中自噬小体形成和加工的基本机制至关重要。
烟草马赛克病毒(TMV)是一种阳性意义RNA病毒,其与烟草植物的某些基因型相容。它在3'末端具有上游伪结域(UPD),在病毒翻译和表达期间发挥着至关重要的作用[13.].TMV 24A + UPD是一种通过在TMV UPD上游引入一个内部聚(a)通道(24个核苷酸)而设计的突变体,它诱导了更早和更严重的坏死症状[14.].使用这种突变体,我们研究了感染的自噬和助感N. Benthamiana.植物。我们筛选宿主蛋白质,其在突变病毒感染期间与ATG8相互作用在Planta..在这份报告中,我们发现,与TMV相比,TMV 24A + UPD是一种复制速度更快的突变体,自噬诱导和通量增强。我们采用BioID技术,将生物素连接酶BirA*与ATG8融合。这项技术最初用于哺乳动物细胞[15.[最近用于水稻原生质体[16.脱离叶组织[17.].Bira *释放生物素-5'-AMP,其将生物素与位于其接近10nm内的蛋白质内。随后,与靶蛋白ATG8接近或相互作用的蛋白质是生物素化的。可以使用链霉抗生物素蛋白纯化并通过串联质谱(MS / MS)分析。
鉴定了总共67个蛋白质,其中大多数先前未知,以与植物中的自噬蛋白相互作用。先前已经显示了十六种蛋白质,直接或间接地与动物和/或酵母系统中的自噬途径联系起来。由于已知与ATG8相互作用的UBA结构域的存在,选择亨廷顿相互作用蛋白K样(HYPK)进行进一步验证。使用酵母 - 双杂交(Y2H),生物分子荧光互补(BIFC)和亚细胞共同定位,我们展示了Hypk和ATG8互动N. Benthamiana.植物。与自噬敲除后观察到的症状减轻相比,NbHYPK的敲除没有增强病毒症状,这表明在试验植物中,NbHYPK单独不影响病毒症状。哺乳动物HYPK蛋白和NbHYPK-like蛋白的全长一级序列在保守氨基酸和相似氨基酸上有57%的相似性。这两种蛋白在C端都有一个保守的UBA结构域。这种共同的相似性表明NbHYPK可能发挥着类似于哺乳动物同源基因的作用。哺乳动物的HYPK是一种本质上的非结构伴侣,与Huntingtin (HTT)相互作用,它增强自噬通量,并增加ATG8到脂化/活性ATG8- pe (LC3I到LC3II)的转换[18.].
结果
TMV 24A + UPH诱导自噬生物生物发生和自噬助焊剂
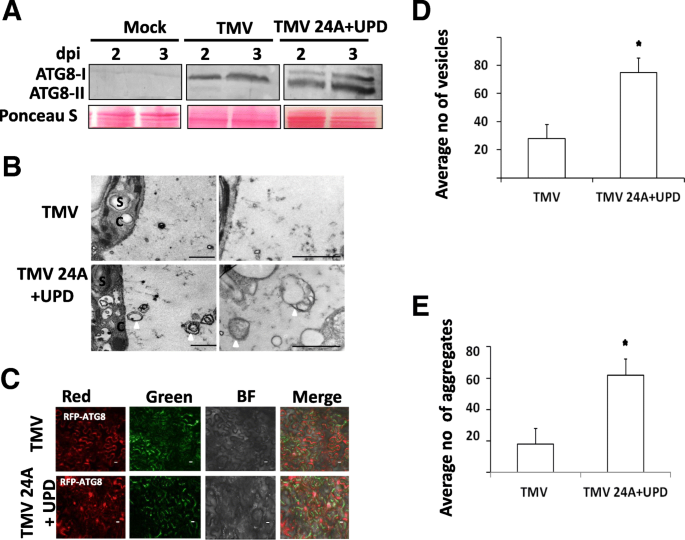
与TMV相比,TMV 24A + UPD复制更快,引起更严重的症状[14.].我们假设快速病毒复制可以增加自噬和/或自噬助焊剂。为了确定是否在感染TMV和TMV 24A + UPD时触发自噬,我们通过确认在2和3DPI时确认存在ATG8-II的自噬助焊剂(图。1一种;额外的文件1:图S1)。接下来,我们通过透射电子显微镜(TEM)调查了感染叶片的超微结构变化。在TMV 24A + UPD感染叶片的超薄部分中观察到类似自噬体样结构的膜质囊泡(图。1b)。为了验证自噬诱导,我们渗透RFP-ATG8进入病毒感染N. Benthamiana.荧光斑的数量(图。1c)。
自噬激活应答TMV和TMV24A + UPD感染N. Benthamiana..一个使用ATG8抗体的免疫印迹分析。在〜16kDa检测到的带的分子量。PONCEA S染色作为装载控制(下面的小组,庞卡S)。b表示在3 dpi(接种后的天数)的感染植物的代表性电子显微照片。箭头显示膜状自噬体样结构。缩写;s,淀粉,c,细胞质。cRFP-ATG8标记的自噬体3 dpi的代表性图像。d从〜100μm获得自噬体状样结构的数量2每个实验的部分。感染TMV 24A + UPD后,自噬小体样结构明显增强(*p< 0.05)。e对于每个实验,从具有大约相等的细胞(〜100)的段中获得平均荧光斑块/聚集体。通过TMV24A + UPD进行感染显着增强RFP-ATG8A自噬体(*p< 0.05)。星号表示未配对样本的显著差异t测试。秤条表示1μm
TMV 24A + UPD感染植物中的自噬体状结构的数量显着高于TMV感染植物中的结构(图。1d)。与TMV相比,在TMV 24A + UPD中观察到显着较高的RFP-ATG8标记的聚集结构(图。1e)。
生物素化蛋白的鉴定
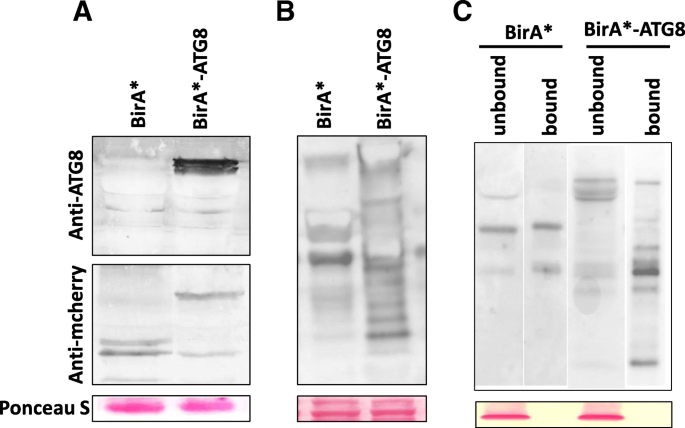
在确定TMV 24A + UPD引起的自噬助剂后,我们试图在感染期间识别ATG8相互作用蛋白。构建了用作控制和PXY01-RFP-HA-BIRA * -ATG8(Bira * -ATG8)的两种质粒,PXY01-RFP-HA-BIRA *(Bira *)被构造为诱饵(附加文件1:图S2a)。BirA*和BirA*-ATG8在两个结构体中均表达成功(图1)。2一种;额外的文件1:图S2B,2C,2D,2E)。N. Benthamiana.叶子用Bira *或Bira * -ATG8载体进行冻结,用AgroinFiltration缓冲液补充有2mM生物素。通过蛋白质印迹检测生物素化蛋白,并使用涂覆链霉抗生物素蛋白的磁性DynaBeads TM纯化(图。2B,C;额外的文件1:图S3A,B)。Bira * -Atg8结合的级分显示多个生物素化的蛋白质带(图。2C;额外的文件1:图S3c)。这表明,与对照相比,BirA*-ATG8样品中有更多的生物素化蛋白。
ATG8可能与参与植物防御的蛋白质网络相互作用
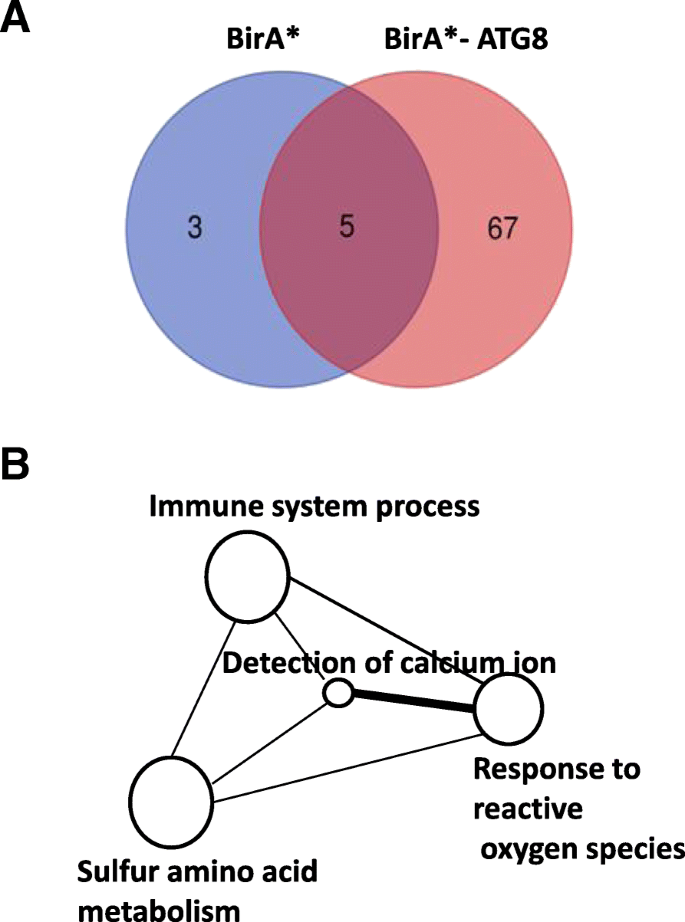
随后的MS / MS结果的生物信息学分析显示了5种蛋白质,其在Bira *和Bira * -ATG8提取物之间共用,67个蛋白质是Bira * -Atg8的独特(图。3.一种)。基因本体分析将Bira * -ATG8鉴定的蛋白质分类为4个官能团:免疫系统过程,对ROS,硫氨基酸代谢和钙离子信号传导的反应(图。3.b).在这些蛋白中,14个未被鉴定,23个未被报道参与自噬或植物防御(附加文件)2:表S1)。因此,他们没有被选为进一步验证的候选人。根据已发表的文献,鉴定出的其他蛋白质被认为是有意义的1).这些蛋白可直接或间接与ATG8相互作用N. Benthamiana.植物。前述前16个蛋白质已显示与自噬途径相互作用(表1).蛋白质17至30尚未显示与自噬过程相互作用,但植物防御中具有生物学作用,可能与核心自噬组件相互作用。我们选择了用于验证ATG8互动的Hypk蛋白,因为它包含了已经证明与ATG8相互作用的UBA域。
对独特的BirA*-ATG8蛋白进行蛋白鉴定和基因本体论(GO)富集分析。一个维恩图显示了BirA*和BirA*-ATG8之间独特和共享的蛋白质。bTMV 24A + UPD感染期间与BirA*-ATG8鉴定的蛋白交互图。圆的大小与特定术语相关的蛋白质的数量成正比。根据公布的REVIGO协议(http://revigo.irb.hr///)
NBHYPK与ATG8互动
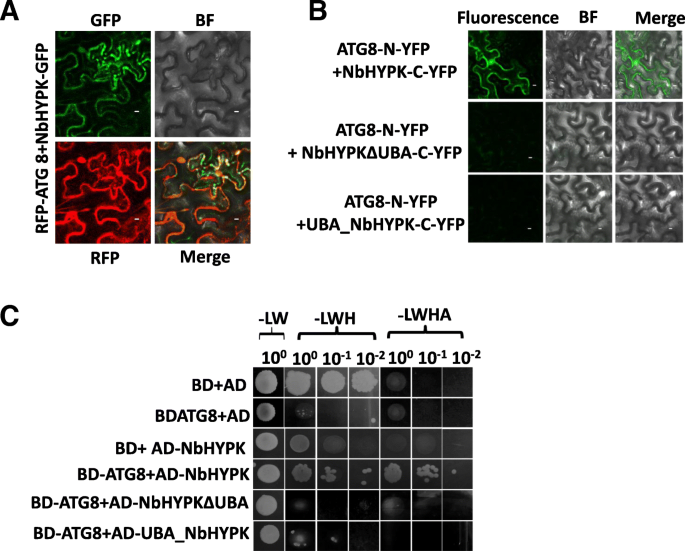
从BioID筛选中鉴定NbHypk并通过cDNA克隆和测序验证。NbHypk是跨越109个氨基酸的小蛋白质。它在氨基酸68-109之间具有UBA结构域,并表示为UBA_NBHYPK。为了测试其与ATG8的相互作用需要UBA域,从NBHYPK基因中删除并称为NbHypkΔuba(1-67AA)。我们通过Western Blotting确认了Hypk-GFP和RFP-ATG8的全长和截断融合蛋白的表达(附加文件1:图S4a)。然后,在NbHypk-GFP /NbHhypkΔuba-GFP / UBA_NBHYPK-GFP和MCHerry-ATG8共渗透到中,我们进行了共定位测定N. Benthamiana.仅在共表达NbHYPK-GFP和mCherry-ATG8的叶片中观察到聚集(图2)。4a),但在表达NBHYPKΔUBA或UBA_NBHYPK-GFP和MCHERRY-ATG8中没有观察到聚集体(附加文件1:图S4B)。为了进一步确认NBHYPK和ATG8之间的相互作用,我们执行了一位BIFC测定。用NbHypk融合到黄色荧光蛋白(NbHypk-yc)的C-末端和与YFP(ATG8-YN)的N-末端融合的ATG8的构建物联合于N. Benthamiana.叶并导致重构YFP(图。4b).用UBA_NbHYPK -Yc、NbHYPKΔUBA -Yc或其他空载体控件表达ATG8-Yn的叶子无法生成epifluorescent信号(附加文件1:图S4C)。
ATG8直接与NbHYPK相互作用.一个GFP标记NbHYPK, NbHYPKΔUBA和UBA-NbHYPK与rfp标记的ATG8共浸润,共聚焦显微镜定位。b双分子荧光互补(BiFC)分析,ATG8-Yn或x-Yn(空载体)与NbHYPK-Yc、NbHYPKΔUBA-Yc和UBA-NbHYPK-Yc或x-Yc(空载体)共表达。共聚焦显微镜下观察3 dpi后的荧光信号。Bar = 1 μm。c用酵母双杂交法分析ATG8与NbHYPK的相互作用。将表达全长NbHYPK或UBA结构域或NbHYPKΔUBA或空载体的质粒转化到AH109酵母中,与含ATG8或空载体的酵母表达质粒交配,在氨基酸滴出YPDA培养基中培养
此外,我们使用Y2H确定NbHYPK与ATG8之间的相互作用。将ATG8融合到结合域(BD),并测试其与融合到激活域(AD)的NbHYPK的相互作用。Y2H测定验证了NbHYPK和ATG8之间的物理相互作用(图。4c).我们还将另外两个质粒NbHYPKΔUBA和UBA_NbHYPK构建到AD中,并检测它们与BD-ATG8的相互作用。没有明显的相互作用(图。4c)。我们得出结论,新发现的宿主蛋白NbHypk在体外和体内物理地与ATG8相互作用。此外,我们证明NBHYPK中的UBA结构域对于与ATG8的这种物理相互作用至关重要。
自噬保护N. Benthamiana.植物抗TMV 24A + UPD诱导的细胞快速死亡
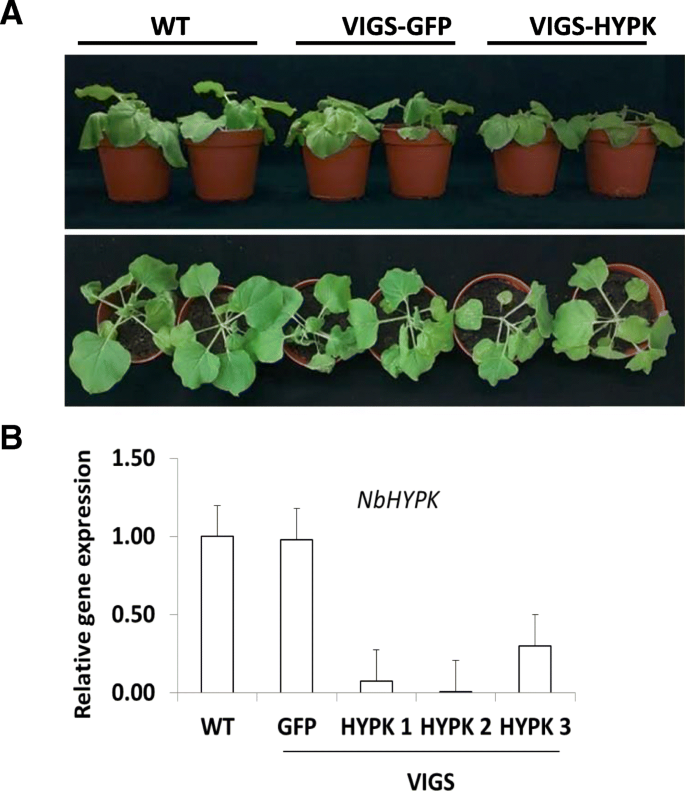
为了测试TMV 24A + UPD诱导细胞死亡是否需要自噬,我们致密ATG5,ATG7和ATG8,这是自噬的核心组件。这种感染TMV的自噬沉默植物表现出增加的萎黄,但没有显示出严重的细胞死亡症状(图。5a).在ATG5和ATG7沉默的植物中,TMV 24A + UPD引发的细胞死亡显著增加(图2)。5b).尽管针对ATG8亚型的保守区域,但在TMV和TMV 24A + UPD感染植物中,与ATG5和ATG7相比,ATG8沉默的效率较低(附加文件)1:图S5A,B)。可能瞬态ATG8沉默效率低,因为ATG8有8个同种型N. Benthamiana.[41.].沉默的TMV 24A + UPD感染植株在新生叶片中表现出增强的细胞死亡症状(图2)。5b).我们推断自噬在TMV 24A + UPD感染的植物中起保护作用。与正常表达NbHYPK的植物相比,NbHYPK沉默的植物在病毒症状上表现出轻微但不明显的差异(图)。6a). nbhypk沉默株与对照株的外壳蛋白基因表达无显著差异(附加文件)1:图S6a),由imagej量化[42.])。
讨论
一些研究已经定义了酵母和哺乳动物系统中的自噬[25.,29.].然而,植物中的自噬途径尚未得到广泛阐明。在这项研究中,我们通过TMV与TMV和快速复制突变体TMV 24A + UPD进行了比较了自噬诱导和助熔剂N. Benthamiana.植物。在2和3 dpi中检测到自噬助焊剂的增加(图。1a).在感染了复制速度较快的TMV 24A + UPD变种的植物中,检测到大量的自噬小体样结构(图2)。1b - e)。这表明,由于TMV病毒复制速度加快,病毒载量增加可能会加速自噬的诱导。
在通过生物筛选鉴定的67个推定的ATG8相互作用蛋白质中,16个蛋白质与自噬途径直接相关(表1).其中,ATG3和calmodulin已被证明与ATG8和自噬体直接相互作用N. Benthamiana.植物 [7,23.].将枯草杆菌蛋白酶样蛋白酶涉及在植物中进行编程的细胞死亡和防御信号,在动物自噬中起作用[25.,41.,42.].酰基辅酶a结合结构域蛋白3-like已被证明可以破坏自噬体的形成并增加植物中ATG8的降解[33.].在这一组中发现的大多数其他蛋白都与哺乳动物系统中的自噬有关,但在植物中未见报道。另一方面,蛋白质17到30(表1)参与自噬相关功能,例如病原体防御,应力信令和过敏反应(HR)[4,42.,43.].蛋白质1到24(附加文件2:表S1)具有与自噬无关的生物功能。最近的研究揭示了ATG8的自噬作用在维持酵母中的脂质液滴完整性和疟疾中的疟疾形成[44.,45.,46.].也许ATG8亚型在植物中也起着自噬无关的作用。一些与ATG8相互作用的蛋白,如ATG4和ATG7,无法通过MS/MS鉴定。一些自噬蛋白可能难以纯化,因为它们不稳定[47.].此外,由于它们在细胞中的偶然的邻近偶联,一些未与ATG8相互作用的蛋白质也是生物素化的,其在细胞中的偶联蛋白质,生物技术的固有限制。因此,进一步考虑了诸如Y2H,BIFC和共定位的相互作用研究以确认物理相互作用。
高通量蛋白质 - 蛋白质相互作用研究对于缩小候选者来研究自噬是至关重要的。ATG8相互作用蛋白通常具有AIM / LIR主题。虽然该主题用于选择候选者,但它并不总是表示图案的功能[48.].因此,采用额外的标准,如蛋白质的结构和生物学方面。自噬受体Joka2, P62和NBR1具有uba样结构域(s),这在它们与ATG8的相互作用中至关重要[49.].对ATG8相互作用子NbHYPK(本研究)的分析表明,其一级序列不包含传统的AIM基序。然而,它在c端包含一个UBA域。因此,我们选择使用上述分析进一步验证NbHYPK与ATG8的相互作用。
我们的结果表明,NBHYPK和NBATG8物理上的互动。NBHYPK和ATG8的相互作用需要UBA域。NbHypk的UBA结构域与另一种细胞溶质伴侣,新型多肽相关复杂蛋白(NAC)具有高相似性,其与从核糖体中出现的新生蛋白质的后翻透过程相关[50.].我们还鉴定了新生多肽相关复杂蛋白的α链(表1).哺乳动物Plic-2蛋白具有一个UBA结构域,参与自噬[51.].Plic-2在饥饿过程中起保护作用,需要ATG5和ATG7蛋白。它直接与ATG8 (LC3)相互作用,并在自噬体与溶酶体融合中发挥作用[51.].
虽然NBHypk对NbHypk的NBHypk对NbHypk-沉默的植物中的病毒症状和细胞死亡产生了显着差异,但沉默的NbHypk可能不会产生表型,但可能对其他细胞过程产生影响,如哺乳动物Hypk Ortholog所证明的。哺乳动物亨廷顿相互作用蛋白K(斜坡)具有伴侣样特性,并且参与细胞死亡,展开蛋白质反应,细胞周期和细胞生长[52.].过表达的Hypk分别增加了ATG8和ATG8-PE,LC3I至LC3II的哺乳动物同源物的转化[18.].有趣的是,亨廷顿蛋白本身(HTT)已被证明与ATG8相互作用,对果蝇的自噬是重要的[32.].我们不排除伴随ATG8的伴侣函数中的冗余。
另一方面,ATG5,ATG7和ATG8的敲低揭示了自噬对抗TMV 24A + UPD诱导的细胞死亡的保护作用。尽管自噬似乎是针对TMV的抗病毒机制,但与TMV 24A + UPB相比,没有显着的自噬助焊剂仍然有趣。已显示自噬在发挥抗病毒角色[8,因此,TMV有可能通过一种尚不清楚的机制来破坏自噬。最近的一项研究表明大麦条纹马赛克病毒(BSMV)通过中断ATG8和ATG7之间的交互来中断自噬[47.].通过TMV 24A + UPB的自噬通量诱导也是合理的,这是宿主 - 病原体交互改变的结果。反应性氧物种(ROS)可以在哺乳动物和植物细胞中诱导自噬[53.,54.].自噬通过减少ROS在减轻氧化损伤中发挥重要作用[53.,54.].未来的研究旨在鉴定TMV 24A + UPB的早期感染是否引发了增加的RO,这可能导致加速的细胞死亡。
结论
使用BioID技术,我们已经确定了67个蛋白质,其与ATG8相互作用N. Benthamiana.植物感染TMV及其快速复制的突变体TMV 24A + UPD。鉴定了一个新的ATG8相互作用蛋白NbHYPK,并验证了其与ATG8的相互作用。这种交互需要在NbHYPK中存在UBA域。最近的一项研究描述了一类新的ATG8适配器和受体,利用泛素相互作用基序序列进行高亲和力结合[55.].
总之,NbHypk参与其中,并且可以在病毒/ TMV感染期间通过ATG8调节自噬过程。未来的研究将致力于阐明NbHypk伴侣活动的生物学意义及其与与ATG8相关的功能蛋白质组中鉴定的其他新型互动伴侣的关系N. Benthamiana.植物。
方法
植物材料、质粒构建与农杆菌渗透
烟草benthamiana种子是从中国农业大学的大北李教授获得的,中国北京。在16-H光/ 8-H-黑暗循环下,幼苗和植物生长在25℃下的生长室。使用额外文件中的引物放大NBATG8A(称为ATG8)3.S2:表。利用cDNA克隆构建载体PXY01 -35S-mCherry-ATG8a。将构建物转化为农杆菌。在VIGS实验中,使用附加文件中列出的引物对ATG5、ATG7、ATG8靶标进行扩增3.S2:表。得到的片段被插入到pTRV2中。如前所述,pTRV1和pTRV2一起被引入农杆菌[56.].通过QRT-PCR / RT-PCR证实了NbHypk,ATG5,ATG7和ATG8的基因表达的下调(图。6b;额外的文件1:图S5, S6b)。克隆是通过连接限制性内切酶产生的粘性末端(酶位点下划线)或来自NEB试剂盒的Gibson Assembly®克隆试剂盒完成的,参见附加文件中的引物(前缀GA使用)3.S2:表。
大肠杆菌使用合适的引物从pcDNA 3.1 myc BioID质粒中扩增出生物素连接酶BirA*(附加文件)3.:表S2)。XBA1 RE位点和HA标签序列包含在正向引物中,而SMA1包含在反向引物中。用适当的酶消化所得片段并插入载体pXY0 -35S-MCHERRY-ATG8中。通过DNA测序确认所得载体PXY01-MCHERRY-HABIRA * -ATG8(BIRA * -ATG8)。对于对照质粒,将片段插入PXY01-MCHERRY-X中并导致PXY01-MCHERRY-HABIRA *(Bira *)。将生物克隆转化到土壤杆菌中,并将2.5mm生物素掺入农毒滤液缓冲液中。将克隆融合成完全膨胀的叶片,2.5μg体外转录的TMV 24A + UPD病毒RNA机械接种到植物中。在3DPI中收集叶子,并提取总蛋白质。使用MCHERRY和ATG8抗体通过免疫印刷验证蛋白质表达。对于BIFC和亚细胞定位,PCR片段与附加文件中所示的引物扩增3.:表S2并克隆到相应的载体中。将BIFC载体转化为土壤杆菌。两种培养物,NYFP-ATG8和CYFP -NBHYPK以1:1的比例混合,并接种到N. Benthamiana.植物如前所述[28.].对于亚细胞共定位,NbHYPK-GFP和RFP-ATG8载体也进行了上述共培养。
西方墨点法
从中提取总蛋白质N. Benthamiana.叶子并通过SDS-PAGE分离,用于使用适当的抗体分析免疫印迹分析。在将蛋白质转移到硝化纤维素膜中,庞塞氏S根据制造商的方案用于染色蛋白质以进行加载控制,然后进行封闭和抗体孵化。捕获蛋白质凝胶频带图像并将其转换为JPEG格式并使用imagej软件版本1.52a进行数字图像分析[42.].
共焦显微镜
对于自噬磁体可视化,用RFP-ATG8将完全扩展的叶子冻结。在24小时后,渗透叶在GKP缓冲液中用2.5μg转录的RNA机械地接种(50mM甘氨酸; 30 mm K.2HPO4, pH值9.2;膨润土1%;1% c盐)。3天后,用5 uM的自噬抑制剂E64d注射器浸润叶片12 h,然后立即用共聚焦显微镜观察。对于亚细胞定位和BiFC,在农业渗透后3天观察叶片荧光。
使用Zeiss LSM510显微镜从附加叶片表皮细胞中获得活细胞图像。GFP和RFP探针分别在488和561nm处激发,分别在495-550和570-610nm处检测到它们的荧光发射。YFP在514nm剧中兴奋,排放527 nm。使用Zen(版本2011)和578 Image J(1.48V)软件进行了共聚焦图像。
Tem
病毒感染和/或自噬抑制剂处理的叶样品在固定介质中固定在磷酸盐缓冲液(0.1M,pH 7.0)中的固定介质中(2%多聚甲醛(W / V),2.5%戊二醛(V / V)过夜,并用1%oso4在磷酸盐缓冲液中2小时。在一系列乙醇脱水后,将叶样品转移到丙酮20分钟后,然后嵌入孢子®树脂中。修剪树脂块和超薄切片。在用2%铀酰染色和1%碱性柠檬酸盐染色后,在TEM(模型JEOL JEM-1230)下观察超薄部分。
酵母双杂交(Y2H)测定
感兴趣的基因(附加文件3.:将表S2)克隆到PGADT7(AD)或PGBKT7(BD)酵母质粒中。如匹配制造商酵母2杂交方案所述,使用氯化锂转化到AH109酵母中的重组载体。转化的酵母菌菌落在液体培养基中生长并稀释成10-,100-和1,000倍并在SD / -TRP / -LEU,SD / -HIS / -TRP / -LEU和SD / -HIS / -TRP上涂布。/ -leu / lead板。将板在30℃温育直至在3天后出现菌落。使用SD / -HIS / -TRP / -LEU和SD / -HIS / -TRP / -LEU /型板形成更严格选择的殖民地表明诱饵和猎物蛋白之间的物理相互作用。
BioID样品制备和MS / MS分析
对蛋白质裂解物进行苯酚萃取。将所得颗粒溶解在裂解缓冲液(0.4%SDS,500mM NaCl,5mM EDTA,1mM DTT,50mM Tris-HCl,pH7.4)中。使用Bradford测定法测定蛋白质浓度。将链霉蛋白涂覆的Dynabeads(200μl)轻轻加入100μg的总蛋白质中。将混合物在4℃下温和,温和地振荡温育。使用磁台与未结合的生物素化蛋白质分离含有结合的生物素化蛋白质的珠子。为蛋白质印迹保存了未结合蛋白质的等分试剂。
将小球洗涤数次(每次洗涤1 ml 1 X PBS,在室温下轻轻摇晃5分钟),1次在2% SDS中,1次在1% SDS中,2次在1% NP-40中,2次在1 X PBS中。珠子在最后的洗涤中被留下了。用streptavidin抗体(1:2000)进行Western blot分析。然后对颗粒进行MS分析。简单地,用200 μl三乙基碳酸氢铵重悬微珠。
(茶叶)(0.5米,pH8.5),通过在65℃下轻轻混合1小时,用4μL三(2-羧乙基)膦(TCEP)(TCEP)(100mm股票)。将四μl甲基甲基磺酸磺酸盐(MMTS)(200mm股票)加入上述混合物中,并在室温下温育15分钟。将研磨蛋白加入12.5ng /μl的珠子中,并在37℃下温育16小时,温和摇动。将珠粒沉淀并对MS分析进行上清液。对MS / MS数据进行搜索以防止数据库烟草蛋白质使用蛋白质pilot™。进行数据清洁以去除无关头口的命中。与对照Bira *蛋白质重叠的Bira * -ATG8蛋白也被除去。冗余和低质量的蛋白质被排除在最终分析之外。蛋白质在功能分类。基因本体互动网络被概述并绘制了已发布的Revigo协议(http://revigo.irb.hr///使用UGen Venn软件生成图表(http://bioinformatics.psb.ugent.be/webtools/venn/).
可用性数据和材料
本研究期间生成或分析的所有数据都包含在本发表的文章[及其补充信息文件]中。
缩写
- ATG8:
-
自噬8.
- Bioid:
-
邻近依赖性生物素识别
- Bira *:
-
生物素蛋白连接酶
- G / Y / RFP:
-
绿色/黄色/红色荧光蛋白
- 百k:
-
亨廷顿相互作用蛋白k样
- mmt:
-
甲基methanethiosulfonate
- 多发性硬化症:
-
质谱分析
- ROS:
-
活性氧
- TCEP:
-
三羟甲基氨基甲烷(2-carboxyethyl)磷化氢液
- TEAB:
-
Triethylammonium碳酸氢
- 透射电镜:
-
透射电子显微镜
- UBA:
-
泛素相关的领域
- 伟大的人:
-
病毒诱导基因沉默
参考文献
- 1。
中岛A,田中N, Tamai K, Kyuuma M, Ishikawa Y, Sato H,等。细小病毒b19感染细胞的自噬存活病毒学。2006;349(2):254 - 63。
- 2。
Hofius D,Munch D,Bressendorff S,Mundy J,Petersen M.自噬在疾病性和过敏反应相关的细胞死亡中的作用。细胞死亡有所不同。2011; 18(8):1257-62。
- 3.
刘y,schiff m,czymmek k,塔罗茄布z,Levine b. dinesh-Kumar的自湿度在植物先天免疫反应过程中调节程序性细胞死亡。细胞。2005; 121(4):567-77。
- 4.
王斌斌。植物的RNA沉默与抗病毒防御。方法:中华医学杂志。2012;894(1):17-38。
- 5。
陈涛,王永强,郑旭,等。自噬是植物对抗双生病毒的一种抗病毒机制。eLife。2017; 6 (10): e23897。
- 6。
Hafren A,Macia JL,Love AJ,Milner JJ,Drucker M,Hofius D.选择性自噬极限花椰菜马赛克病毒nbr1介导的针对病毒衣壳蛋白和颗粒的感染。中国科学(d辑:地球科学)2017;
- 7。
李飞,赵宁,李志,徐旭,王勇,杨旭,等。本氏烟草中一种钙调素样蛋白通过自噬途径降解SGS3,抑制RNA沉默并促进双生病毒感染。公共科学图书馆Pathog。2017;13 (2):e1006213。
- 8。
Hafréna,üstüns,hochmuth a,哀叹的s,约翰逊t,hofius d。萝卜马赛克病毒对抗病毒沉默抑制剂HCpro的选择性自噬。植物杂志。2017;176(1):649 - 62。
- 9。
李飞,张超,李勇,吴刚,侯旭,周旭,等。Beclin1通过抑制和降解病毒聚合酶来限制植物中RNA病毒的感染。自然通讯。2018;9(1):1268。
- 10。
王荣瑞,李凯。正链RNA病毒复制的宿主因子。中华医学杂志;2012;35(2):111-24。
- 11.
Lieberthal W.Macroautophagy:一种介导细胞死亡或促进细胞存活的机制?肾脏int。2008; 74(5):555-7。
- 12.
【关键词】自噬;靶向性;靶向性;自噬。2017;13(5):978 - 9。
- 13。
Zeenko VV, Ryabova LA, Spirin AS, Rothnie HM, Hess D, Browning KS, et al.;真核生物延伸因子1A与上游假结区域的3 '非翻译区相互作用烟草马赛克病毒RNA。J病毒。2002; 76(11):5678-91。
- 14。
郭某,凯尔泽克e,陈g,周yj,黄sm。TMV突变体具有不同长度的聚(a)串的突变体展示了3'UTR影响病毒RNA积累和症状表达的结构变化。SCI REP。2015; 5:18412。
- 15.
Roux Kj,Kim Di,Raida M,Burke B.一种混杂的生物素连接酶融合蛋白鉴定哺乳动物细胞中的近端和相互作用蛋白。J细胞BIOL。2012; 196(6):801。
- 16。
林强,周志,罗伟,方敏,李敏,李辉。水稻原生质体近端和相互作用蛋白的近端依赖生物素化筛选。植物学报。2017;8(10):749。
- 17。
Khan M, Youn J-Y, Gingras A-C, Subramaniam R, Desveaux D。在Planta.邻近依赖性生物素鉴定(BioID)。SCI批准。2018; 8(1):9212。
- 18。
Choudhury Kr,Bucha S,Baksi S,Mukhopadhyay D. Bhattacharyya。伴侣样蛋白百分比及其互动合作伙伴增强自噬。EUR JBelt Biol。2016; 95(6-7):182-94。
- 19。
皮金娜,墨菲。Murphy, ARF肿瘤抑制因子与胞浆HSP70的相互作用有助于其自噬功能。中国癌症杂志。2011;12(6):503-9。
- 20。
郭斌,黄建军,吴伟,冯东,王旭,陈勇,等。新生的多肽相关复合物对自噬通量至关重要。自噬。2014;10(10):1738 - 48。
- 21。
Ramírez-Valle F, Braunstein S, Zavadil J, Formenti SC, Schneider RJ。eIF4GI将mTOR的营养感知与细胞增殖和自噬抑制联系起来。中华医学会细胞生物学分会。
- 22。
Tumbarello DA, Waxse BJ, Arden SD, Bright NA, Kendrick-Jones J, Buss F.自噬受体连接肌凝蛋白VI到自噬体,介导tom1依赖的自噬体成熟并与溶酶体融合。细胞生物学杂志。2012;14(10):1024-35。
- 23。
Yamaguchi M,Noda NN,Nakatogawa H,Kumeta H,Ohsumi Y,Inagaki F. upophagy相关的蛋白8(ATG8)在ATG3中的族族相互作用基序介导ATG3-ATG8相互作用,对细胞质 - 芳啉靶向途径至关重要。J Biol Chem。2010; 285(38):29599-607。
- 24。
韩S,王Y,Zheng X,Jia Q,Zhao J,Bai F等人。胞质甘油糖醛-3-磷酸脱氢酶与ATG3相互作用,以负面调节自噬和免疫力烟草benthamiana.植物细胞。2015; 27(4):1316。
- 25。
FKBP5/FKBP51增强自噬,协同抗抑郁作用。自噬。2015;11(3):578 - 80。
- 26。
TakeShige K,Baba M,Tsuboi S,Noda T,Ohsumi Y.酵母中的自噬证明了蛋白酶缺陷型突变体和其诱导条件。J细胞BIOL。1992年; 119(2):301-11。
- 27。
杜安,黄胜,赵旭,冯轲,张胜,黄建军,等。碳酸酐酶CAR3抑制CHRN内吞在重症肌无力发病中的作用。自噬。2017;13(11):1981 - 94。
- 28。
徐G,王某,韩S,Xie K,王Y,Li J等。植物BAX抑制剂-1与ATG6相互作用以调节自噬和编程的细胞死亡。自噬。2017; 13(7):1161-75。
- 29。
徐敏,张敏,徐敏,等。SHMT2和BRCC36/BRISC去泛素酶通过自噬调节HIV-1 tat k63泛素化和破坏。公共科学图书馆Pathog。2018;14 (5):-e1007071。
- 30.
王Z-H,Ren W-Y,Zhu L,Hu L-J。纤溶酶原激活剂抑制剂-1通过自噬激活调节大鼠巨噬细胞中的LPS诱导炎症。SCI世界J. 2014; 2014年(189168年):1-12。
- 31.
Ramesh N,Pandey UB。Als中的自噬失调:当蛋白质聚集体失控时。前摩尔科斯。2017; 10(33):263。
- 32。
Ochaba J,Lukacsovich T,Csikos G,Zheng S,Margulis J,Salazar L等人。亨廷顿蛋白的潜在功能作为选择性自噬的支架。Proc Natl Acad Sci U S A. 2014; 111(47):16889-94。
- 33。
萧S,高W,陈Q-F,陈S-W,Zheng S-X,MA J等。拟南芥酰基-CoA结合蛋白ACBP3的过度表达促进饥饿诱导和依赖年龄依赖性叶片衰老。植物细胞。2010; 22(5):1463-82。
- 34。
林明辉,刘永春,刘少英,陈富春,杨培军,李光华,等。网格蛋白介导的内吞作用是ANE 30- 100k诱导的自噬所必需的。口腔病理杂志。2018;47(1):25-31。
- 35。
林P,Mobasher Me,Hakakian Y,Kakarla V,Naseem Af,Ziai H等。H / ACA核糖核糖蛋白组分在细胞增殖中的差异要求和DNA损伤的反应。组织中细胞Biol。2015; 144(6):543-58。
- 36。
Lenk Se,Susan PP,Hickson I,Jasionowski T,Dunn Wa Jr.泛染醛糖酶B在饥饿诱导的溶酶体蛋白水溶液中累积。J Cell Physiol。1999年; 178(1):17-27。
- 37。
Ishida H,Yoshimoto K.叶绿体通过自噬部分地移动到液泡中。自噬。2008; 4(7):961-2。
- 38。
Izumi M,Wada S,Makino A,Ishida H.通过含摩尔科的体的叶绿体的自噬降解与叶碳状况有关,但不是拟南芥的氮地位。植物理性。2010; 154(3):1196-209。
- 39。
Blommaart EF, Luiken JJ, Blommaart PJ, van Woerkom GM, Meijer AJ。核糖体蛋白S6磷酸化可抑制离体大鼠肝细胞的自噬。中国生物化学杂志。1995;27(5):2320-6。
- 40.
Monastyrska I, He C, Geng J, Hoppe AD, Li Z, Klionsky DJ。Arp2连接自噬机制与肌动蛋白细胞骨架。中国生物医学工程学报。2008;19(5):1962-75。
- 41.
Kellner R,De La Concepcion JC,Maqbool A,Kamouns,Dagdas YF。ATG8扩展:选择性自噬多样化的司机?趋势植物SCI。2017; 22(3):204-14。
- 42.
Schneider CA, Rasband WS, Eliceiri KW. NIH图像到ImageJ: 25年的图像分析。Nat方法。2012;9(7):671。
- 43.
何志强,李志强,李志强,等。自噬成分有助于过敏细胞死亡拟南芥.细胞。2009;137(4):773 - 83。
- 44。
Maeda Y,Oku M,Sakai Y. ATG8在酵母脂质液滴动力学中的自噬作用。j生物学习。2017; 161(4):339-48。
- 45。
田志刚,田志刚,石原,等。泛素类系统介导蛋白质脂化。自然。2000;408(6811):488 - 92。
- 46。
Ketelaar T, Voss C, Dimmock SA, Thumm M, Hussey PJ。拟南芥自噬蛋白Atg8同源物是一类新的微管结合蛋白。2月。2004;567(2):302 - 6。
- 47。
杨米,张y,谢x,yue n,li j,wang xb等。大麦条纹马赛克病毒γ蛋白颠覆自噬以通过破坏ATG7-ATG8相互作用来促进病毒感染。植物细胞。2018; 30(7):1582-95。
- 48。
Popelka H, Klionsky DJ。Atg8/LC3/ gabarap结合蛋白中LIR/AIM基序的天然构象分析自噬。2015;11(12):2153 - 9。
- 49。
Zientara-Rytter K,Sirko A. PB1和UBA结构域在Joka2的多元化中的重要作用,来自烟草的选择性自噬发生器。前植物SCI。2014; 5(10):13。
- 50.
Arnesen T,Starheim Kk,Van Damme P,Evjenth R,Dinh H,Betts MJ,等。伴侣样蛋白百分比与西氏菌乙酰化和预防亨廷顿聚集在一起。Mol细胞Biol。2010; 30(8):1898-909。
- 51.
n'diaye en,kajihara kk,hsieh i,莫里萨基h,debnath j,棕色ej。PLIC蛋白或泛菌素在营养饥饿期间调节自噬依赖性细胞存活。Embo Rep。2009; 10(2):173-9。
- 52.
Choudhury KR,Raychaudhuri S,Bhattacharyya N.缺血蛋白质的鉴定显示Hypk在调节细胞生长,细胞周期,展开蛋白应答和细胞死亡中的涉及。Plos一个。2012; 7(12):E51415。
- 53.
陈云飞,刘辉,罗晓军,赵智,邹征镒,李军,等。活性氧(ROS)和自噬在白血病细胞存活和死亡中的作用Crit Rev Oncol Hematol. 2017; 12:21 - 30。
- 54.
Xiong Y,Contento Al,Bassham DC。拟南芥中的自噬中断导致组成型氧化应激。自噬。2007; 3(3):257-8。
- 55.
Marshall Rs,Hua Z,Mali S,Mcloughlin F,Vierstra Rd。ATG8结合UIM蛋白质限定了一类新的自噬适配器和受体。细胞。2019年;在新闻。https://doi.org/10.1016/j.cell.2019.02.009.
- 56。
刘y,Schiff M. dinesh-Kumar S病毒诱导的番茄中的基因沉默。工厂J. 2002; 31(6):777-86。
致谢
作者感谢新加坡国立大学生物科学系蛋白质和蛋白质组学中心的Teck Kwang Lim先生,以及新加坡淡马锡生命科学实验室TEM设施的Shaalini D/O Subramaniam女士和欧阳学志先生的技术支持。
资金
本研究得到了新加坡教育部、新加坡国立大学科研基金R-154-000-B23-114、苏州局科技资助项目SNG2018039、国家自然科学基金资助项目31872639和新加坡国立大学Mercy W. Macharia奖学金的资助。N. Naqvi承认来自新加坡淡马锡生命科学实验室的内部资助。所有的资金都在研究的设计、数据的收集、分析和解释以及手稿的撰写中发挥了作用。
作者信息
隶属关系
贡献
MWM进行了实验,分析并撰写了手稿。WZYT进行了BioID实验并对数据进行了分析。PPD协助实验设计和方案优化。NIN和SMW协助研究的设计,讨论结果和编辑手稿。所有作者均已阅读并批准本稿件。
通讯作者
伦理宣言
伦理批准和同意参与
N / A.
同意出版
N / A.
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
附加文件1:
图S1。图4的全免疫斑图像。1a使用ATG8抗体。(a)嘲笑。(b)TMV。(c)TMV 24A + UPD。图S2。BirA*和BirA_ATG8结构的表达。(a)对照Bira *和实验性质粒Bira * -Atg8的图形表示。图4的全凝胶图像。2a使用抗mcherry抗血清进行,(b)和(c)和抗atg8抗血清(*表示弱带)。(d)确定融合蛋白表达。(e)检测农业渗透的RFP信号N.benthamiana叶子确认RFP融合Bira *和Bira * -ATG8的表达。图S3。全凝胶免疫印迹分析Fig.;2b和c。(a)链霉蛋白-HRP粗蛋白裂解物的斑点。(b)DynaBeAdstm纯化后的STREP-HRP污染。缩写:B,珠子;s,上清液。泳道1.只有wt-生物素。Lanes 2-3,-Bira *,Lanes 4-5,Bira * -ATG8,Lane 6-Bira *,Lane 7,Bira * -Atg8,Lane 8,Bira *,Lane 9,Bira * -Atg8。如下不同的治疗方法:样品2-5,生物素在农毒素过滤后3天渗透。样品6-9,与农药渗透缓冲液同时渗透。样品6和7,蛋白质提取3dpi,并收集4 dpi的样品8和9。 Treatments 6 and 7 were used for the final experiment.图S4。ATG8与NbHYPK直接相互作用,而不是NbHYPKΔUBA和UBA-NbHYPK(见图)。4).(a)使用GFP和RFP抗体分别在Western印迹中检测到GFP-NBHYPK,GFP-NBHYPKΔUBA,GFP-UBA-HYPK和RFP-ATG8融合蛋白。(b)RFP-ATG8与GFP-NBHYPK的聚集体,但不是GFP-NBHYPKΔUBA或GFP-UBA-NBHYPK。(c)双分子荧光互补(BIFC)分析表明,ATG8能够与NbHypk相关联,但ATG8-YN与X-Yc不相关(没有插入的质粒)。NbHypk-Yc也没有与X-Yn(没有插入质粒)相关联。图S5。ATG5 / 7/8-Vigs植物基因下调分析(图。5).(a)半定量RT-PCR分析ATG8沉默和非沉默的亚型的表达烟草benthamiana植物。(b)对照和vigs植物ATG5和ATG7基因的qRT-PCR分析。图S6。在VIGS-NbHYPK植株中TMV的积累和NbHYPK的相对表达(图)。6).(a)抗TMV抗体检测TMV外壳蛋白表达。TMV外壳蛋白约为17.5 kDa。统计学显著性由Student 's决定t测试(p = .39). (b) Semi-quantitative qRT-PCR analysis of NbHYPK expression in VIGS silenced and non-silenced烟草benthamiana植物。(邮政编码3798 kb)
额外的文件2:
表S1。通过BioID鉴定的蛋白质(DOCX 16 KB)
额外的文件3:
表S2。本研究中使用的引物列表(DOCX 18 KB)
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
马查里亚,m.w.,谭,W.Y.Z,达斯,P.P.等等。近缘依赖生物素化筛选确定NbHYPK是植物ATG8的一个新的相互作用伙伴。BMC植物BIOL.19,326(2019)。https://doi.org/10.1186/s12870-019-1930-8
收到了:
接受:
发表:
关键字
- BioID
- 自噬
- ATG8
- 烟草花叶病毒
- TMV 24A + UPD
- 蛋白质 - 蛋白质相互作用
- hyp