抽象的
背景
锌指蛋白(ZFPs)仅包含一个锌指结构域,在植物的生长发育调控以及生物和非生物胁迫响应中发挥着重要作用。迄今为止,其进化历史和功能ZFP.基因家族尚未以棉花鉴定。
结果
在本文中,我们鉴定了29ZFP.基因gossypium hirsutum.将该基因家族分为七种亚属,其中22个分布在17个染色体上。生物信息分析显示20GHZFP.起源于全基因组重复的基因,源于分散的重复事件,表明全基因组重复是膨胀中的主要力量GHZFP.基因家族。最多ghzfp8.除了亚家族基因ghzfp8-3,在纤维细胞生长过程中高表达,并在体外被油菜素类固醇诱导。此外,我们发现大量的GHZFP.基因启动子区含有赤霉素敏感元件、生长素敏感元件和E-box元件。外源性应用这些激素显著刺激了这些基因的表达。
结论
我们的研究结果揭示了这一点ghzfp8.基因参与棉纤维发育,广泛诱导,胃蛋白,吉布林蛋白和BR,为植物激素刺激的潜在作用的潜在作用提供了鉴定的基础,以及将来繁殖更好的棉花品种的基础。
背景
棉花是全球最重要的作物之一,适用于工业纤维和油籽生产。棉花纤维,纺织业的主要资源,每年为全球经济贡献超过13亿美元,在农业或工业部门创造了330万件工作[1].gossypium hirsutum(G. Hirsutum),最常见的纤维和石油棉花种类,占全球棉花生产的90%以上[2].棉花由属于代号和四倍体物种组成Gossypium.属。G. Hirsutum是一种Aadd Allotetroploid物种,其从类似于A-基因组二倍体的演变Gossypium Arboreum.d -基因组类似二倍体Gossypium raimondii,大约1-2百万年前(Mya)[2].
以前的研究表明,植物激素在纤维开发过程中发挥着关键作用。例如,据报道,吉布伦酸的内源性水平(GA3.)与中等和短纤维品种相比,长时间的棉花品种较高[3.].GA的外源性应用3.改善纤维伸长率,增加纤维细胞壁厚度并增加各个纤维的重量[3.那4.].体外胚珠培养测定显示,芸苔类固醇(BR)显着促进纤维伸长率,而其生物合成抑制剂铜甲唑(BRZ)废除纤维伸长率[5.].用BR和BRZ治疗分别增加并降低了细胞壁相关基因的表达。此外,在纤维引发和伸长阶段期间,参与Br生物合成途径的基因是上调[6.那7.].外源性吲哚-3-乙酸(IAA)的应用显着增加了总纤维体积[8.],而IAA传输抑制剂,1-萘酞酸(NPA)的应用,显着降低了IAA含量和纤维细胞的数量[9.].IAA生物合成基因的过度表达IAAM.显著提高纤维细胞数、最终产量和综合品质[9.].
锌指蛋白(ZFPs)在多种生物过程中起着关键作用,根据其结构差异可分为23个亚家族,包括A20、AN、Bbox、CDGSH、CHY、DHHC、Dof、FYVE、GATA、LYAR、MSRING、NFX1、PADPP、PHD、RBPO、Ring、TAZ、TDDP、TFIIB、Ubox、UBR、WRKY和ZK[10.那11.那12.].虽然植物丰富了植物丰富,但只有少数含有单锌手指结构域的ZFP,已经表征在植物高度调节中的作用[13.那14.],植物发展[15.]次生细胞壁增厚[16.,花药发展[17.],根籍发展[18.],花开发[19.],种子萌发[20.]和果实成熟[21.].
ZFP.已发现基因参与各种生物过程,包括信号转导,转录调节,RNA结合和形态发生,以及应激反应[22.那23.那24.].在拟南芥,ZFP蛋白已被定向为9组:C2H2,C8,C6,C3HC4,C2HC,C 2 HC5,C4,C3H和C4HC3 [25.].ATZFP1,在萌发后3天,在顶端分生组织、维管系统和幼苗中均有高表达。的ZFP1.突变体具有叶萌发中的显性表型[26.].ZFP6.编码C2H2锌手指蛋白,其参与通过整合甘油酸和细胞蛋白信号传导来调节毛状体发育[27.].ZFP5,下游的基因ZFP6.信令,编码细胞对细胞移动mRNA,用于调节培养体的发展所必需的[27.].ZFP10,发现靶向特定序列的DNA结合转录因子,参与锌离子和核酸结合[28.].过度表达ZFP11导致死亡率和变形表型拟南芥[29.].
在这项研究中,我们确定了29份GHZFP.基因G. Hirsutum并表现了它们的进化关系,染色体分布,基因重复和基因结构,以获得洞察的作用ghzfps.在棉花。基因表达模式表明ghzfp8.除了亚家族基因ghzfp8-3,在纤维细胞发育期间显着表达。BR的外源应用增强了这些基因的转录水平。此外,我们发现大量的GHZFP.基因含有启动子区域中的甘油酸酸响应元件(GARE),助体响应元件(AUXRE)或E-BOX元件。我们的结果表明大多数GHZFP.在其启动子中含有这些元素的基因分别通过外源施用甘油酸,生长素和BR显着上调。
方法
植物材料和生长条件
gossypium hirsutum(徐州142)是在一个气候控制的温室中生长的,光照周期16小时,暗周期8小时,温度30℃。30.].对于植物激素治疗实验,每次治疗中总共使用30个胚珠,对每个实验进行三份生物三份酸盐。
序列检索,多序列对准和系统发育分析
棉花基因组序列是从织特门网站获得的(https://www.ctongen.org.).的拟南芥基因组序列从TAIR 10下载(http://www.arabidopsis.org.).具有默认参数的HMMER软件用于搜索使用保守的ZFP域作为查询的相应蛋白质序列。我们使用BLAST程序进一步识别基于同源性的ZFP序列。使用Clustal X执行所有识别的ZFP的多个序列对准[31.].使用邻近参数的邻接算法构建推导的氨基酸序列的系统发育树,在Mega 6.0中的默认参数和1000个引导程序复制(https://www.megasoftware.net.).
染色体定位、基因结构及保守基序分析
位置信息GHZFP.从烤织根网站下载的解析的一般特征格式(GFF)文件中获取。用于外显子内部结构分析GHZFP.基因,编码序列用于与其基因组DNA序列对准,并且使用在线基因结构显示服务器(GSD)程序(http://gsds.cbi.pku.edu.cn/).使用在线工具包来研究GHzFP蛋白的保守术语,用于主题诱导的多个期望最大化(MEME 3.0.3;http://meme-suite.org/).MEME的优化参数采用如下:重复次数,任何;最大图案数,50;以及每个基序的最佳宽度,6至300个残基之间,并仅保留与之相关的基序E.值
RNA提取和定量RT-PCR(QRT-PCR)分析
将每种指定时间的植物激素治疗后收获的棉胚在液氮中被冷冻,然后使用前述方法用研钵和研杵研磨成细粉末[1].根据制造商的说明,使用purelink™RNA mini试剂盒(Invitrogen,Lot No.1687455)提取总RNA,并且CDNA从1.2μg总RNA逆转录[32.].在QRT-PCR实验中,每个基因在三种生物学复制中运行,并使用反应参数的三种技术复制如下:95℃,10分钟,其次为95℃的40个循环10 s和56°C s. A melting curve was generated from 65 to 95 °C. CottonGhubq7.(Genbank No。Ay189972)被用作内部控制。用于QRT-PCR分析的引物在附加文件中列出1:表S3。SigMastat软件用于单向统计方差分析。
体外胚珠培养
根据先前公布的方法进行体外胚珠培养物[26.].在3天后,在开花后1天收集的棉胚(DPA)在10%次氯酸钠中灭菌,并在30℃下在培养基中培养[33.].五微米1-萘基乙酸(NAA,Sigma),1μmGibberellin酸(GA3.将Sigma)和5μmBr(sigma)分别加入到所示时间的培养基中。处理后,收集样品用于QRT-PCR实验。
的识别CIS.元素在GHZFP.启动子地区
基因启动子序列的预测GHZFP.从烤织根网站下载(https://www.ctongen.org.).的CIS.元素在GHZFP.使用网站植物CIS作用调控DNA元素(Place,https://www.dna.affrc.go.jp/PLACE/?action=newplace)[34.].
结果
范围内识别ZFP.基因家庭Gossypium.
全基因组序列的三种测序棉质(G. Hirsutum那g . arboreum和g . raimondii就)用于鉴定ZFP蛋白质。拟南芥以ZFP蛋白序列作为查询,搜索3个参考基因组,筛选出棉花中的候选ZFP蛋白。利用HMMR软件进一步选择基于保守结构域的ZFP候选基因,我们鉴定了29个ZFPG. Hirsutum,以及23 ing . arboreum和23日g . raimondii就. 在发现的29种GhZFP蛋白中G. Hirsutum基因组,13个成员源自亚基因组和来自DT子基因组的16个(附加文件1:表S1)。GHzFP蛋白的长度范围为170(GHzFP10-9)至295(GHzFP10-1)氨基酸(AA),平均长度为238AA。GAZFP蛋白质从165(GAZFP11-3)到295(GAZFP10-1)氨基酸,平均长度为226AA。GRZFP蛋白质的范围为116(GRZFP4-1)至490(GRZFP10-1)氨基酸,平均长度为272AA。物理化学参数分析表明,GHzFP蛋白的分子量为21.49(GHzFP8-1)至33.23(GHzFP10-2)KDA,平均值为26.42kDa和GHzFP蛋白的等电点(PL)的范围为5.12(GHZFP4-1)至9.34(ghzfp11-1)平均值为6.90(表1).
系统发育分析,染色体位置和基因重复ZFP.基因家族
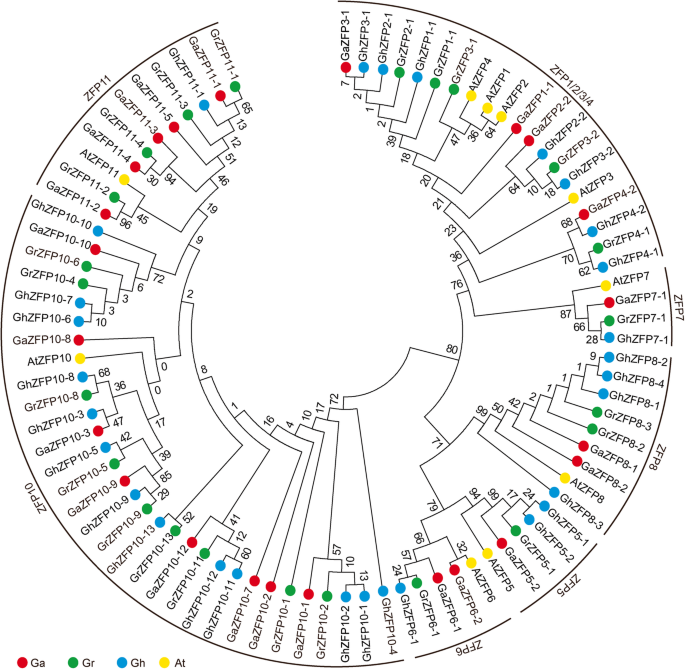
进一步了解进化历史和系统发育关系的洞察力ZFP.基因家族,构建了一个邻近的系统发育树。我们的结果表明ZFP.家族基因聚为7个亚家族,二倍体和相应的异源四倍体之间的大部分同源基因聚为同一个分支(图1)。1).系统发育树如图。1),一个类似的棉花组织拟南芥鉴定了ZFP蛋白和两种物种之间的一些局部关系。基于该分析,棉花ZFP蛋白基于与已知的关系命名拟南芥ZFPs。为了验证邻居连接法(NJ)的结果,我们重建了植物的系统发育树ZFP.基因使用最大似然方法并再次发现ZFP.基因被分为七个亚科(附加文件)2:图S1),类似于使用邻居加入(NJ)方法获得的结果。
相比拟南芥, 二GAZFP8和八个GAZFP10基因被发现g . arboreum,还有两个grzfp8.和九个GRZFP10基因g . raimondii就.此外,四TCZFP8基因和两个TCZFP10基因被发现T. Cacao.(附加文件3.:图S2)。为了验证ZFP的进化关系,我们介绍了ZFP蛋白o.苜蓿和g·马克斯.如附加文件所示4.:图S3,ZFP蛋白也被聚集成七个亚属,与我们之前的结果一致(附加文件4.:图S3)。基因数的比较ZFP8.和ZFP10基因三Gossypium.物种和拟南芥表明这些基因亚家族的扩展可能发生在Gossypium.从共同的祖先分歧后拟南芥和Gossypium..
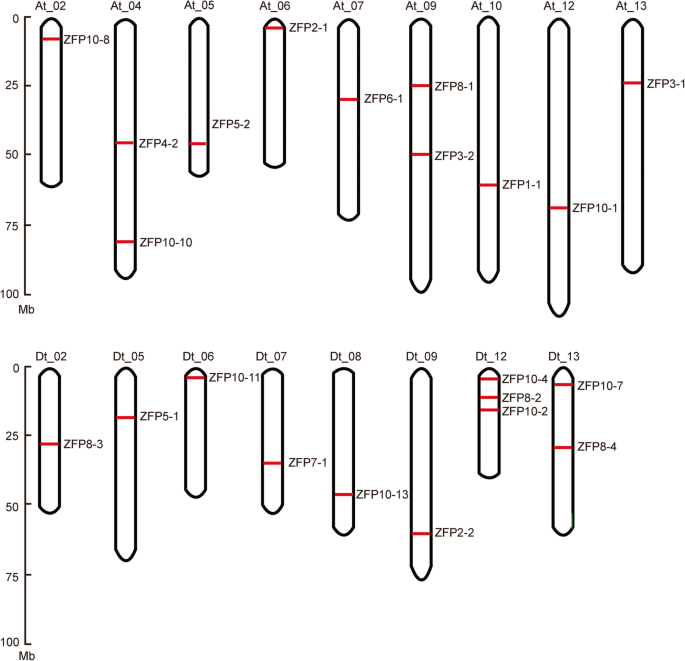
确定染色体位置GHZFP.基因G. Hirsutum,物理分布GHZFP.沿染色体的基因是使用从烤织根网站下载的位置信息文件进行。在29中GHZFP.基因,沉积在17个染色体上的22个基因,包括来自亚基因组的九个染色体和来自DT子组的八个(图。2).大多数染色体只有一个GHZFP.除了AT_04和AT_09染色体外,基因。之间Gazfp.和GRZFP.基因,23名成员g . arboreum分布在10个染色体和17个成员上G. Rainomdii.分布在九条染色体上(附加文件5.:图S4)。
我们进一步调查了可能GHZFP.由全基因组重复(WGD)产生的基因。其中GHZFP.基因,25来自WGD和4来自分散的重复事件(附加文件1:表S2),表明WGD事件在经济扩张中发挥了重要作用GHZFP.基因。另外,为了调查进化史GHZFP.基因,KaKsèu计算器2.0程序被用来计算同义和非同义替代率。Ks比率GHZFP.基因对范围为0.016至0.555。重复事件的近似时间ghzfps.从53万年前(MYA)到18.5万年前(Table2).
GhZFP蛋白的基因结构及保守基序
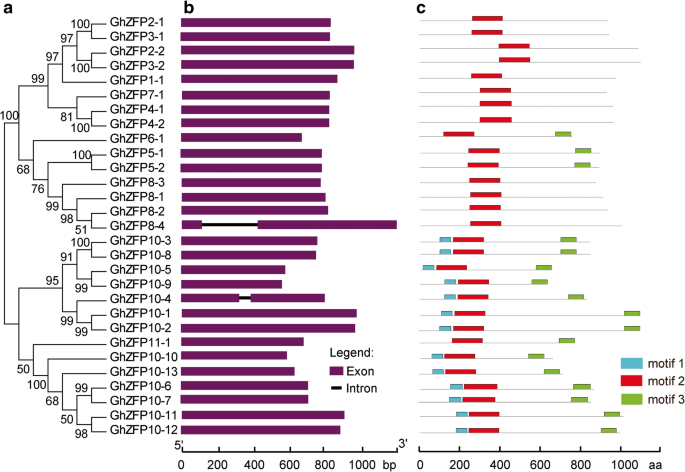
旨在提高GHZFP蛋白不同成员之间的相似性和多样性的目的,我们用推导的GHzFP氨基酸序列产生了一个大型的系统发育树(图。3.a)并对外显子性结构进行比较分析。我们发现基因长度GHZFP.相对节省了ghzfp8-4拥有最长(1.2 kB)和ghzfp10-9具有最短(0.6kb)基因组序列(图。3.b) 是的。29人中有27人GHZFP.基因没有内含子,除了ghzfp8-4和ghzfp10-4,其中包含一个内含子。这些结果与结构非常相似ZFP.基因杨树trichocarpa[35.].最多ghzfps.在相同的亚类中,内含子和外显子的数量和长度表现出相似的基因结构,这与系统发育树中的亚科一致(图。3.一种)。
此外,我们还对GhZFP蛋白的保守基序进行了研究,以了解GhZFP蛋白基序组成的多样性。在GhZFP蛋白中共鉴定出3个保守基序,命名为motif 1 ~ motif 3。每个GhZFP中保守基序的数量从2个到3个不等,同一亚科内的大多数GhZFP具有相似的基序组成(图1)。3.C)。此外,大多数GHZFP蛋白都具有三个保守的主题,除了GHzFP1,GHZFP2,GHZFP3,GHZFP4和GHZFP8亚属植物,其含有两个保守的主题,表明GHZFP蛋白显示出功能性分歧。
ghzfp8.在纤维细胞发育期间亚家族基因高度表达
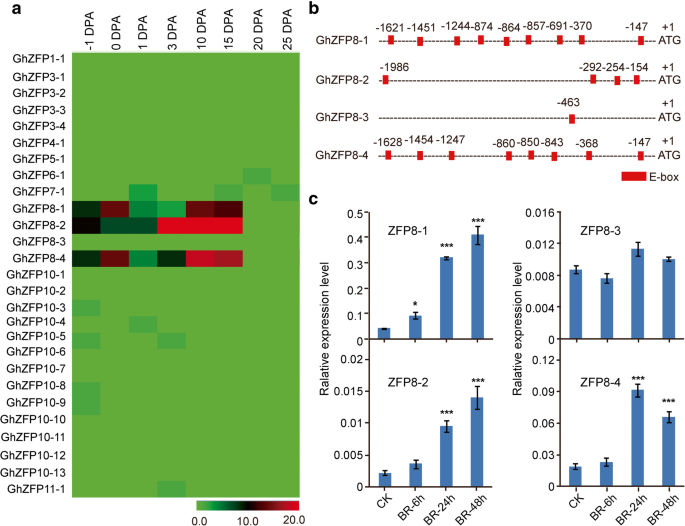
确定哪个GHZFP.基因可能在纤维细胞发育中起作用,使用来自纤维细胞的不同发育阶段的转录组数据研究单个基因的表达谱,包括0,3,10和15dPa的纤维。
我们发现大部分GHZFP.来自同一亚家族共同的基因相似的表达模式。值得注意的是,所有成员ghzfp8.亚家族,除了ghzfp8-3,在纤维细胞起始和伸长发育过程中高表达(图。4.(一)那表明这些基因可参与棉纤维细胞发育。我们在转录起始密码子(ATG)上游的2000bp序列提取为启动子区域。在分析启动子区域时ghzfp8.基因,发现了大量的电子盒元素(Canntg,其中n可以是任何核苷酸)ghzfp8.启动子区域(图4.b)。E-Box元件可以通过BES1识别,BR信号通路中的核心转录因子[36.].
三ghzfp8.基因,ghzfp8.1,ghzfp8.-2和ghzfp8.-4,在其启动子区域中包含至少四个E-Box元素,而ghzfp8-3只有一个电子箱(图。4.b)。这些结果表明表达了ghzfp8.基因可以由Br诱导。为了进一步证实这一点,我们进行了QRT-PCR实验以评估转录水平ghzfp8.在体外有或没有BR处理的基因(图。4.C)。我们的结果表明,成绩单ghzfp8.1,ghzfp8.-2和ghzfp8.在BR施用24小时后显着诱导-4(图。4.C)。但是,BR没有诱导ghzfp8.-3转录物即使用BR处理胚珠48小时。这些结果意味着ghzfp8.可能需要棉纤维细胞发育。
基因表达分析GHZFP.基因响应植物激素治疗
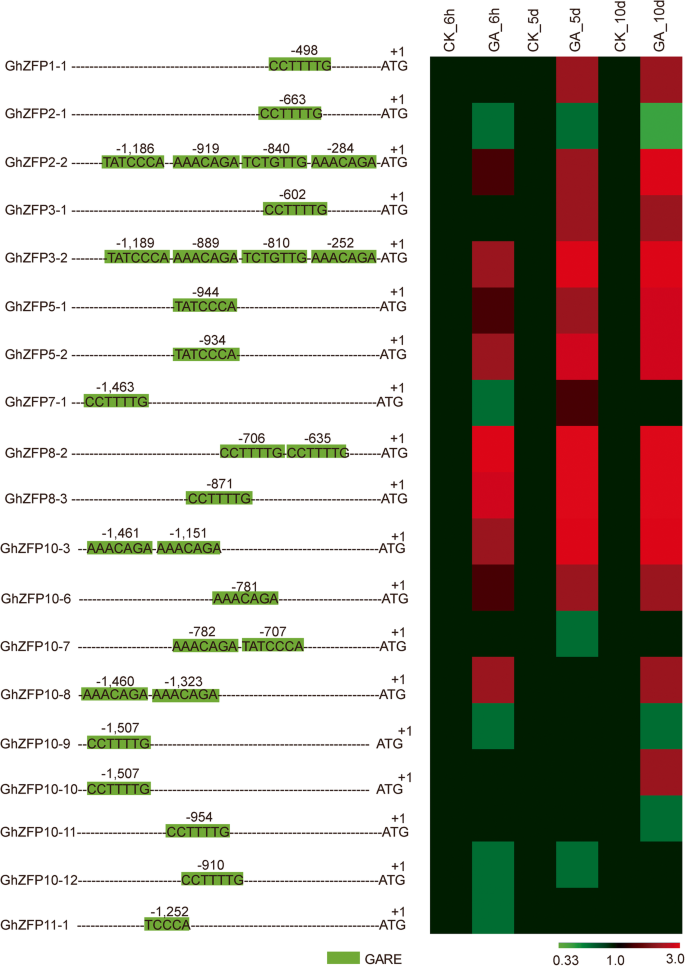
植物激素在植物开发中发挥关键作用。相当大的证据表明棉纤维细胞发育需要甘草酸,养羊酸和BR [34.那37.那38.那39.].为了探索之间的关系GHZFP.基因和赤霉素,我们分析了CIS.元素在GHZFP.推动者区域。在内部发现了大量的GARE元素(CCTTTG或CCTTTG或TATCCCA或AAACAGA或TCTGTTG)GHZFP.启动子区域(图5.).特别是19中的19个GHZFP.基因具有至少一种可达元素。这些结果强烈表明表达了GHZFP.基因可以通过甲虫酸调节。确认此发现,表达分析GHZFP.用吉布林素治疗后进行基因。我们的结果表明,共15岁GHZFP.基因对胃肠杆菌蛋白处理响应(图。5.),除了GhZFP2-1那GHZFP7-1那ghzfp10-7和ghzfp11-1基因。
19的表达配置文件GHZFP.GA下的基因3.治疗.分析19.GHZFP.在其启动子地区(左)存在的Gare元素的基因。使用该地方网站预测Gares(绿色)(http://www.dna.affrc.go.jp/htdocs/place/).折叠改变19GHZFP.GA下的基因3.治疗(右)。所有处理均设3个生物重复和3个技术重复。以棉花为材料,测定相关基因的表达水平Ghubq7.作为一个控制
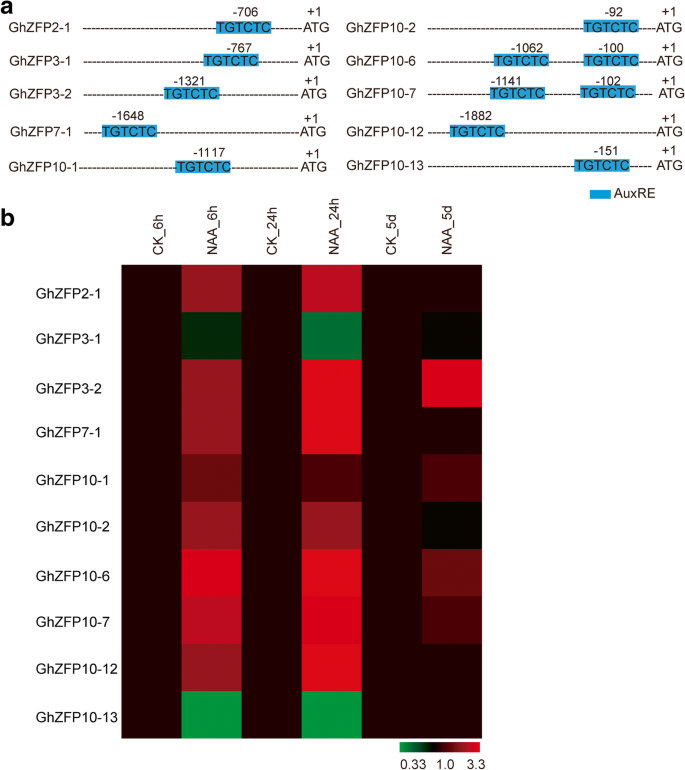
尚已知蟾蜍在促进棉纤维细胞发育方面发挥重要作用。生长素生物合成基因的过度表达IAAM.显着增加的纤维细胞启动[38.].然后我们确定了GHZFP.对生长素敏感的基因。为此,我们使用类似的方法来鉴定对赤霉酸敏感的基因。生长素响应因子(Auxin response factors, ARF)是生长素信号通路中的关键成分,它能特异性识别并结合生长素响应元件(AuxRE, TGTCTC)来调控下游的生长素响应基因[40].我们的数据显示总共有10个GHZFP.发现基因在其启动子区域中含有奥氧元素(图。6.一种)。QRT-PCR分析表明,转录水平为七GHZFP.在施用5μMNAA,助长素类似物,24小时后,基因显着增加(图。6.b).这些结果表明,生长素可能促进GHZFP.基因。
BR还参与BR体外促进纤维细胞伸长率的纤维生长和外源应用[33.那37.].E-box元件被BES1转录因子特异性识别,该转录因子在br调控的基因表达中起关键作用[36.].我们分析了电子箱元素的分布GHZFP.启动子区域并测定转录水平GHZFP.有或没有BR治疗的基因。令人惊讶的是,25分中,29分GHZFP.基因包含在其启动子地区的电子箱元素(附加文件6.:图S5),表示GHZFP.转录物可以由Br诱导。在大多数的大大刺激的转录水平中发现了进一步的证据GHZFP.当它们用5μmCr处理时,在其启动子区域中具有电子箱元件的基因(图。7.).
一起服用,转录GHZFP.基因广泛被甘油酸,生长素和血管诱导,表明这些基因在棉开发的植物激素调节中起重要作用。
讨论
ZFP基因家族是世界上最大的基因家族之一,其成员在植物生长发育中具有广泛的功能[41.那42.].在拟南芥,有211个锌手指蛋白质,其构成植物中最丰富的推定转录调节因素[42.].其中,只有10个成员只包含一个锌指域,它们被命名为ZFP蛋白。ZFP.已经研究过家庭基因拟南芥,米饭和矮牵牛[42.那43.那44.].然而ZFP.基因家族尚未调查G. Hirsutum.在这项研究中,我们确定了29份GHZFP.基因G. Hirsutum,包括来自亚基因组的13个基因和来自DT亚基因组的16个基因(附加文件1:表S1)。特别是,23ZFP.基因被发现g . arboreum和g . raimondii就,每次,表明在此处发生了基因损失事件ZFP.多倍化后的基因家族G. Hirsutum,这也证实了前人的研究,在异源四倍体棉花中发生了大量的基因丢失事件[45.那46.].
基因复制事件涉及基因扩张和基因组重新调整[47.].基因复制有助于基因的功能创新和扩展,特别是植物中的转录因子基因家族[35.].调查起源ZFP.基因G. Hirsutum,我们沿染色体和基因复制事件分析了它们的分布。在29中GHZFP.基因,22个成员位于17染色体上(图。2).外显子内组织或基因的基因组结构在基因家族和基因剪接的演变中起着重要作用[48.].我们的结果表明,所有的GHZFP.基因只有一个外显子,除了ghzfp8-4和ghzfp10-4,其中分别在两个外显子之间有一个内含子(图。3.).这可能是由于CDNA分子与其基因组拷贝和水平转移重组,发现导致基因组内的内含子丧失[49.那50.那51.].在杨树trichocarpa,大多数C 2 H 2-ZF组I基因没有内含子[35.],与外显子系统安排一致G. Hirsutum.
更好地了解的角色GHZFP.基因G. Hirsutum,我们对棉纤维细胞的几种发育阶段进行了基因表达模式进行了系统分析。转录组数据用于分析表达水平GHZFP.基因。有趣的是,最重要的是ghzfp8.在纤维细胞中显着表达亚家族基因(图。4.A,强烈建议参与ghzfp8.纤维发育中的基因。我们也表演了CIS.- 对预测ghzfp8.推动者地区探索的机制ghzfp8.调节纤维的增长。我们在ghzfp8.推动者区域。据报道,由于BES1是BR反应途径的一部分,这一发现表明转录ghzfp8.基因可以由BR激活。植物激素,BR,在调节纤维发展方面发挥着重要作用[33.那52.].我们的研究结果表明BR可以诱导ghzfp8.表达调节纤维发育。
蟾蜍素,赤霉酸和BR在光纤发展中起重要作用[33.那37.那38.那39.].为了探索两者之间的联系GHZFP.详细研究了这些基因和激素的转录表达水平GHZFP.基因治疗前后的个别激素。在分析所有基因的启动子区域时GHZFP.发现基因,其中19个拥有可达元素。GA的外源性应用3.显着诱导最多的转录GHZFP.在其启动子地区的GARE元素的基因(图。5.).NAA,助潮剂类似物的应用导致七种基因的显着转录上调,其含有其启动子中的奥氧元素(图。6.).在29中GHZFP.基因,25个成员含有其启动子区域的E型盒元件,其中大部分在用Br处理5天后对其进行上调(图。7.).我们的研究结果表明GHZFP.生长素、赤霉素和BR基因的诱导作用广泛,为进一步鉴定更多可能参与植物激素刺激的下游基因奠定了基础,为今后选育优质棉花品种奠定了基础。
结论
我们的研究提供了全面的分析GHZFP.基因家族。我们透露了这一点ghzfp8.基因参与棉纤维发育。本研究将扩大我们了解的确切作用GHZFP.棉纤维发育中的基因及其适应植物激素刺激。我们的研究结果还将进一步提供未来培育更好的棉花品种的线索。
数据和材料的可用性
在本文中分析的棉棉基因组数据可从斯托贡根获得(https://www.ctongen.org.)和A. Thaliana.基因组序列可在Tair 10(http://www.arabidopsis.org.).
缩写
- ARF:
-
一种恒生响应因素
- BR:
-
芸苔类固醇
- DPA:
-
花后第二天
- GFF:
-
一般特征格式
- 德牧:
-
基因结构显示服务器
- MARD1:
-
ABA监管休眠1的调解员
- MEME:
-
主题诱惑的多重期望最大化
- mya:
-
百万年前
- RD21A型:
-
对脱水反应21A
- WGD:
-
全基因组重复
参考文献
- 1。
张Y,他p,杨z,黄g,王l,pang c,小h,赵p,yu j,小g。一种基因组规范分析别针基因家族揭示其在棉纤维开发中的功能。前植物SCI。2017; 8:461。
- 2。
Wendel JF,Cronn RC。多倍体和棉花的进化史。advagron。2003; 78:139-86。
- 3.
赤霉素酸在棉纤维发育中的作用。中国农业科学,2002;
- 4.
Ueguchi-Tanaka M,Nakajima M,Katoh E,Ohmiya H,Asano K,Saji S,xing H,Ashikari M,Kitano H,Yamaguchi I,Matsuoka M.可溶性胃肠杆菌素受体,GID1的分子相互作用与水稻Della蛋白,slr1和gibberellin。植物细胞。2007; 19:2140-55。
- 5。
Sun Y,Veerabomma S,Abdel-Mageed Ha,Fokar M,Asami T,Yoshida S,Allen Rd。芸苔类固醇调节培养的棉胚轴上的纤维开发。植物细胞生理。2005; 46:1384-91。
- 6。
萧克,赵鹏,张玉。激素在调节棉纤维开发方面的关键作用。前植物SCI。2019; 10:87。
- 7。
GODA H,Shimada Y,Asami T,Fujioka S,Yoshida S.微阵列的芸苔类固定基因的微阵列分析拟南芥.植物理性。2002; 130:1319-34。
- 8。
Kim HJ,Triplett Ba。植物和棉纤维生长体外.植物细胞伸长和细胞壁生物发生模型。植物理性。2001; 27:1361-6。
- 9。
张M,郑X,歌曲,Zeng q,侯l,李d,zhao j,wei y,li x,罗m,xiao y,罗x,张j,xiang c,pei y。养生生物合成的时尚操纵在棉胚芽表皮细胞中,增强纤维产量和质量。NAT BIOTECHNOL。2011; 29:453-8。
- 10。
罗X,白X,朱D,李y,ji w,cah,吴j,刘b,朱y.gszfp1,新的cys2 / his2型锌 - 手指蛋白,是植物耐性阳性调节器和干旱的压力。Planta。2012; 235:1141-55。
- 11.
孙淑娟,郭树青,杨欣,鲍玉明,唐洪杰,孙辉,黄杰,张浩生。一种与水稻耐盐性有关的新型Cys2/ his2型锌指蛋白的功能分析。实验机器人。2010;61:2807-18。
- 12.
Pradhan S,康德C,verma S,Bhatia S. Ghatia S. Genome-ide-Inte分析CCCH锌指家族的分析识别ChichPea中的组织特异性和应激响应性候选者(阿列蒂努M L.)。Plos一个。2017; 12:E0180469。
- 13。
刘y,xu y,xiao j,ma q,li d,xue z,chong K. oSdog,胃肠杆菌素诱导的A20 / An1锌手指蛋白,负调节水稻中的嗜酸甘油蛋白介导的细胞伸长率。J植物理性。2011; 168:1098-105。
- 14。
Joseph MP、Papdi C、Kozma Bognár L、Nagy I、López Carbonell M、RigóG、Koncz C、Szabados L。这个拟南芥锌指蛋白3干扰种子萌发和植物发育中的脱落酸和光信号。植物理性。2014; 165:1203-20。
- 15.
李W,王继,孙Q,李波,余y,赵米,萌Z.玉米双B箱锌指蛋白的基因表达分析。Funct综合基因组学。2017; 17:653-66。
- 16。
Seok HY, Woo DH, Park HY, Lee SY, Tran HT, Lee EH, Vu Nguyen L, Moon YH。AtC3H17是一种非串联的CCCH锌指蛋白,具有核转录激活因子的作用,对植物的营养发育、开花和种子发育具有多效性影响拟南芥.植物细胞生理学。2016;57:603-15。
- 17。
柴G,kong y,zhu m,yu l,qi g,唐x,王z,cay,yu c,周g。拟南芥C3H14和C3H15在次级壁增厚和花药的调节中具有重叠的作用。J Exp Bot。2015; 66:2595-609。
- 18。
刘XM,Nguyen XC,Kim Ke,Han HJ,Yoo J,Lee K,Kim Mc,Yun DJ,Chung Ws。MPK6调节锌指转录调节器ZAT6的磷酸化拟南芥盐和渗透胁迫下的种子萌发。Biochem Biophys Res Communce。2013; 430:1054-9。
- 19。
杨y,ma c,xu y,wei q,Imtiaz m,lan h,gao s,cheng l,王m,fei z,hong b,gao J.一种锌指蛋白在菊花中调节开花时间和非生物胁迫耐受性调节嗜酸性胃泌素生物合成。植物细胞。2014; 26:2038-54。
- 20。
Baek D,Cha Jy,Kang S,Park B,Lee Hj,Hong H,Kim DH,Kim Mc,Lee Sy,Yun DJ。的拟南芥一种锌指结构域蛋白ARS1是种子萌发和ROS稳态响应ABA和氧化应激的关键。植物科学与技术,2015;
- 21。
翁L,赵F,Li R,Xu C,陈K,Xiao H.锌指转录因子SLZFP2负调节番茄中脱落酸生物合成和果实成熟。植物理性。2015; 167:931-49。
- 22。
柴G,胡河,张D,齐G,Zuo R,Cao,Chen P,Kong Y,周G.杨树CCCH锌手指家庭综合分析(杨树trichocarpa).BMC基因组学。2012; 13:253。
- 23。
彭X,赵y,曹家,张w,姜h,李x,马q,朱氏,程b。Ccch型锌手指家庭在玉米中:基因组 - 范围鉴定,分类和脱盐酸酐下的表达概况治疗。Plos一个。2012; 7:E40120。
- 24。
Gupta sk,rai ak,kanwar ss,sharma tr。植物疾病抗病患者的比较分析。Plos一个。2012; 7:E42578。
- 25。
臧D、李H、徐H、张W、张Y、史X、王Y。一拟南芥锌指蛋白通过调节钠钾稳态、活性氧清除和渗透势提高非生物胁迫耐受性。前植物科学。2016;7:1272.
- 26。
他,奥廷格H,詹维尔N,塔格BW。AtZFP1,编码拟南芥蒂利亚纳C2H2锌指蛋白1,在光形态形成激活下游表达。中国生物医学工程学报,2000;
- 27。
周Z,Sun L,Zhao Y,AN L,Yan A,Meng X,GaN Y.锌指蛋白6(ZFP6)通过整合嗜酸甘油蛋白和细胞蛋白信号传导来调节培养的培养基启动拟南芥蒂利亚纳.新植物。2013; 198:699-708。
- 28。
Riechmann JL,听到J,Martin G,Reuber L,Jiang C,Keddie J,Adam L,Pineda O,Ratcliffe OJ,Samaha Rr等。拟南芥转录因子:真核生物中的基因组对比分析。科学。2000; 290:2105-10。
- 29。
Dinkins RD, Pflipsen C, Collins GB。基因的表达与缺失分析拟南芥超人样锌手指基因。植物SCI。2003; 165:33-8。
- 30.
何平、赵平、王丽、张Y、王X、肖H、俞杰、肖G。这个别针棉花基因家庭(gossypium hirsutum):在根部发育和非生物应激反应期间基因组鉴定和基因表达分析。BMC基因组学。2017; 18:507。
- 31。
汤普森JD,Gibson TJ,Plewniak F,Jeanmougin F,Higgins DG。Clustal_x Windows接口:通过质量分析工具提供多个序列对齐的灵活策略。核酸RES。1997年; 25:4876-82。
- 32。
肖国华,王克,黄国光,朱一新。棉花基因组规模分析KCS.基因家族揭示了吉布林蛋白的纤维生长的二元作用方式。J Intent Plant Biol。2016; 58:577-89。
- 33。
史毅,朱谟,毛谢兹,冯·杰克,秦烨,张立,程俊,魏立会,王泽,朱yx。转录组分析,分子生物学和生理学研究揭示了乙烯在棉纤维细胞伸长中的主要作用。植物细胞。2006; 18:651-64。
- 34。
Higo K,Ugawa Y,Iwamoto M,Higo H.植物CIS.-作用调节DNA元件(PLACE)数据库。核酸研究1999;27:297-300。
- 35。
刘q,王z,徐x,张h,李立肝素锌 - 手指系列转录因子的基因组宽分析及其对杨树中非生物胁迫的反应(杨树trichocarpa).Plos一个。2015; 10:e0134753。
- 36。
Yin Y,Wang ZY,Mora Garcia S,Li J,Yoshida S,Asami T,Chory J。BES1在油菜素甾体激素作用下在细胞核内积累,调节基因表达,促进茎伸长。牢房。2002;109:181–91.
- 37。
Beasley Ca.荷尔蒙调节未受精棉胚轴的生长。科学。1973; 179:1003-5。
- 38。
张米,郑X,歌,曾q,侯l,李d,赵j,魏y,li x,罗m等。棉胚内表皮细胞中蟾蜍蛋白生物合成的动作增强了纤维产量和质量。NAT BIOTECHNOL。2011; 29:453-8。
- 39。
单厘米,上官XX,赵B,张XF,赵林,杨CQ,王立杰,朱海英,曾义德,郭文志,等.同源结构域转录因子GhHOX3对棉纤维伸长的调控。自然公社。2014;5:5519.
- 40。
Guilfoyle TJ,Hagen G.助生响应因素。CurrOp植物BIOL。2007; 10:453-60。
- 41。
Meissner R,Michael AJ。拟南芥两种和三指C2H2锌手指蛋白基因和CDNA多元族家族的分离与表征。植物mol biol。1997年; 33:615-24。
- 42。
Englbrecht cc,schoofh,Böhms.守恒,多样化和扩张C2H2锌手指蛋白拟南芥蒂利亚纳基因组。BMC基因组学。2004;第五章39节。
- 43。
Agarwal P, Arora R, Ray S, Singh AK, Singh副总裁,Takatsuji H, Kapoor S, Tyagi AK。水稻C2H2锌指基因家族的全基因组鉴定及其系统发育和表达分析植物生物学杂志。2007;65:467-85。
- 44。
Kubo K、Sakamoto A、Kobayashi A、Rybka Z、Kanno Y、Nakagawa H、Takatsuji H。矮牵牛属Cys2/His2锌指蛋白家族:进化和目标序列识别的一般机制。核酸研究,1998年;26:608–15.
- 45。
李F,风扇G,Lu C,Xiao G,Zou C,Kohel RJ,MA Z,Shang H,MA X,Wu J等。栽培高地棉花的基因组序列(gossypium hirsutumTM-1)提供对基因组进化的见解。NAT BIOTECHNOL。2015; 33:524-30。
- 46。
张涛,胡勇,蒋伟,方璐,关欣,陈杰,张杰,Saski CA, Scheffler BE, Stelly DM,等。异源四倍体棉花测序(gossypium hirsutumL. ACC。TM-1)提供了一种用于纤维改进的资源。NAT。Biotechnol。2015; 33:531-7。
- 47。
Vision TJ,棕色DG,坦克斯利SD。基因组重复的起源拟南芥.科学。2000; 290:2114-7。
- 48。
徐G,郭成,山H,孔H.外显子系统结构中重复基因的分歧。Proc Natl Acad Sci U S A. 2012; 109:1187-92。
- 49。
Vaughn JC,Mason Mt,Sper-Wharity GL,Kuhlman P,Palmer JD。通过植物线粒体群的水平基因转移I内含子在嵌合的Coxi基因中进行真菌来源佩纳米亚.J Mol Evol。1995年; 41:563-72。
- 50.
Sanchez-Puerta MV,Cho Y,Mower JP,Alverson AJ,Palmer JD。频繁,系统源性局部局部水平转移COX1群Intron在开花植物线粒体中。mol Biol Evol。2008; 25:1762-77。
- 51.
罗伯斯·赫姆。Caenorhabdisnis Nematodes的大型SRH族化学感受器基因揭示了基因组进化过程,涉及大量重复和缺失和内含子收益和损失。Genome Res。2000; 10:192-203。
- 52.
杨z,张c,杨x,刘k,吴z,张x,郑w,xun q,liu c,lu l等。PAG1.棉花油菜素内酯分解代谢基因,调节纤维伸长。新植醇。2014;203:437-48。
致谢
不适用。
资金
国家自然科学基金(批准号31600223)、香港学者计划(批准号XJ2017017)、中国陕西省自然科学基础研究计划(中国陕西青年委托人才计划2018JZ300 6和2019JM491)资助(批准号20190205)。陕西省博士后项目(批准号2018BSHYDZZ76),中央高校基础研究基金(批准号:GK201803041、GK201901004),棉花生物学国家重点实验室开放基金(批准号:CB2018A03、CB2019A09),国家大学生创新创业培养计划(批准号:cx2018143),勤奋研究与创新基金项目(批准号:KY2018YB003)。资助机构为研究项目提供资金支持,但不参与研究设计、数据收集、分析或手稿准备。
作者信息
隶属关系
贡献
GX和PH构思了原始的研究计划,YYANG,ZW和PZ进行了实验,YYUAN,LZ,YM和CP进行了数据分析;GX写了这篇文章,JY和PH修订了手稿。Yyuan将与作者列表中最远的作者对应。所有作者均致力于研究和阅读并批准最终手稿。
通讯作者
伦理宣言
道德认可和参与同意
从中国农业科学院棉花研究所收集和分析的所有棉线,都是公开的,可用于非商业目的。本文不包含任何与人类参与者或任何作者执行的动物的研究。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
附加文件
附加文件1:
表S1。分析G. Hirsutum ZFP.基因家族及其在AA和DD棉基因组中的矫形器。表S2。中国重复事件分析G. HirsutumZFP基因位于染色体中。表S3。本研究中使用的引物列表。(PDF 112 KB)
附加文件2:
图S1。系统发育分析ZFP.基因家族.Mega 6.0软件与最大似然方法和引导一起使用1,000次迭代。在,拟南芥蒂利亚纳;乔,Gossypium Arboreum.; Gr公司,Gossypium raimondii.;GH,gossypium hirsutum.(PDF 165 KB)
附加文件3:
图S2。系统发育分析ZFP.基因家族。Mega 6.0软件与邻居加入方法一起使用,并使用1,000次迭代引导。(PDF 253 KB)
额外的文件4:
图S3。系统发育分析ZFP.基因家族。利用ZFP蛋白全长氨基酸序列构建系统发育树。在,拟南芥蒂利亚纳;乔,Gossypium Arboreum.; Gr公司,Gossypium raimondii.;GH,gossypium hirsutum;Tc,神悟石膏; 比约斯加,水稻;甘菊,甘氨酸最大.(PDF 515 kb)
额外的文件5:
图S4。染色体位置Gazfp.(a) 以及GRZFP.(b)染色体上的基因。染色体的编号显示在每条染色体的顶部。秤条表示兆页面的长度(MB)。(PDF 199 KB)
额外的文件6:
图S5。分析25.GHZFP.随着他们的推动者地区存在的BES1元素。使用在线位置网站预测BES1元素(红色)。(PDF 424 KB)
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
他,P.,Yang,Y.,Wang,Z.等等。综合分析ZFP.棉花植物激素反应期间表达谱的基因族及表征。BMC植物BIOL.19,329(2019)。https://doi.org/10.1186/s12870-019-1932-6
已收到:
公认:
发表:
关键词
- 棉布
- 锌手指蛋白
- 植物激素
- 表达式模式
- 光纤开发