抽象的
背景
植物细胞壁参与植物与环境的所有相互作用。在这些相互作用中保持细胞壁完整性(CWI)是至关重要的。这一认识导致了对CWI的兴趣增加,并导致了关于CWI维护期间活跃的早期感知和信号机制的知识。相比之下,关于CWI损伤时介导细胞壁代谢变化的过程的知识非常有限。
结果
为了鉴定所涉及的基因并研究其对方法的贡献,我们选择的23个基因具有改变的表达,响应CWI损伤,并表征在这些基因中使用傅里叶变换红外光谱(FTIR)在细胞壁组合物上的T-DNA插入的影响拟南芥幼苗。14个基因中的插入导致了FTIR可检测到的细胞壁表型。对四种基因的详细分析发现,其在CWI损伤时的表达改变依赖于CWI维护的关键组分。插入管线的表型表明,CWI维护,细胞壁组合物或抗性的特定方面需要四种基因Plectosphaerella cucumerina成人植物的感染。
结论
在一起,结果涉及对CWI损伤,细胞壁代谢和/或病原体防御的反应中的基因,从而鉴定了对CWI维护相关的新分子组分和方法。
背景
植物细胞壁涉及植物与其环境之间的所有相互作用。实例包括病原体感染或暴露于干旱,其中壁组成和结构改变以防止水损失,病原体易感性或至少限制进一步的病原体展开[1那2].这些细胞壁的变化可以通过在感染期间用胼胝质进行强化或通过修改果胶多糖来防止干旱胁迫下的水分流失来体现[3.那4.].细胞壁极具可塑性,经历动态变化使植物细胞在生长和发育过程中扩展和分化[5.].在细胞扩张过程中,通过纤维素合酶和微管之间的相互作用,纤维素微纤维受控沉积,例证了细胞壁组织的变化,允许严格控制细胞扩张[6.那7.].初生根中柱鞘细胞中卡氏带形成时木质素和木质素的沉积例证了细胞分化过程中细胞壁的变化[8.那9.那10].这些实施例说明了在植物环境相互作用和开发期间活跃的过程,使细胞壁能够满足各自的生物学功能。
细胞壁如何执行这些功能,有时涉及相反的性能要求,同时保持其功能完整性?可用证据支持存在专用机制,该机制正在监测植物细胞壁的功能完整性,并启动细胞和细胞壁代谢的适应性变化,以维持细胞壁完整性(CWI)[11那12那13那14那15].CWI维持机制作用方式的研究往往是考察对细胞壁损伤(CWD)的反应,CWD可由细胞壁降解酶(纤维素酶、果胶酶等)或异沙苯(ISX)等化合物产生[16].ISX抑制在伸长植物细胞中的原发性细胞壁形成期间的纤维素产生[17那18那19].建立对CWD的反应包括涉及细胞周期骤计的生长抑制,茉莉酸(JA),水杨酸(SA)和细胞蛋白(CKS)等植物激素水平的变化以及涉及果糖,木质素和核糖的细胞壁组合物的变化沉积[20.那21那22那23那24].
现有证据表明,受体样激酶(RLK)如MALE DISCOVERER 1- interaction RECEPTOR like KINASE 2 (MIK2)、FEI1、FEI2、THESEUS 1 (THE1)和FERONIA (FER)在CWI维持中起作用[16那25那26那27那28].the1和fer属于Catharanthus Roseus.RLK1-like激酶(CrRLK1L)家族,共有17名成员。这些RLKs由一个胞内丝氨酸/苏氨酸激酶结构域、一个跨膜结构域和一个胞外结构域组成,这些结构域与最初鉴定的麦芽素结构域相似Xenopus laevis.[29.].目前尚不清楚如果统计域域名Crrlk1ls需要与细胞壁表位结合,介导蛋白质 - 蛋白质相互作用或实际兼而有之28那30.那31.那32.那33.那34.那35.].在配子体和根毛的发育、盐胁迫、JA信号以及ABA和JA信号协调过程中,FER是必需的[28那36.那37.那38.那39.那40那41.那42.].Mik2和The1是根部开发,CWD诱导的木质素和植物激素生产以及根病原菌的抵抗力所必需的尖孢镰刀菌[16那25那27那33.].Fei1和Fei2最初是通过它们对含有4.5%蔗糖的培养基上的培养基的影响而识别,随后将涉及盐过度敏感的细胞壁信号传导途径(SOS5)和FEI2 [43.那44.那45.].在并行的,示出了离子通道,如MID1补充活性1(MCA1)和小导电型2(MSL2)和3(MSL3)的机械敏感通道,有助于激活植物中的CWD诱导的反应[16那23].MCA1最初通过其部分识别其部分补充MID1 / CCH1缺陷酿酒酵母拉紧 [46.].在酵母MID1 / CCH1中,形成血浆膜 - 局部拉伸激活的钙通道,需要用于机械 - 感知和CWI维护(Levin,2011)。CWD诱导植物的反应(如在酵母细胞中)似乎对Turgor操纵敏感[11那47.].原因在于拟南芥幼苗,同时暴露于ISX和轻度高骨质条件,大部分CWD诱导的响应以浓度依赖方式抑制[16那48.].产生的早期信号似乎通过反应性氧物质(ROS)和植物激素的产生(Ja / Sa / CKS)的改变来传送到下游响应介质。23那24].CWI损伤时参与ROS产生的酶是nadph氧化酶,如呼吸突发氧化酶同源物(RBOH) D/F (isx处理后)或花粉管发育过程中的RBOH /J [49.].NADPH-氧化酶活性又可以通过钙结合,涉及受钙水平变化控制的激酶的钙结合,鉴于病原体感染的磷酸钙粘合,涉及受磷酸化诱导的激酶1(BIK1)或受控的磷酸化活化的激酶通过Rho GTP酶,ROPGEF和FER [37.那50.那51.].
这种缩写概述了在工厂CWI维护期间的分子组分的概述说明了近年来推定的CWI传感器和早期信号转导元件的知识增加。虽然知道早期的CWD感知和信令过程令人着迷,但我们还需要了解信号如何导致细胞壁组成和结构变化,以将CWI维护机制的作用方式彻底分解。这对靶向改性的生物量质量和食物作物性能提高的背景是特别令人兴趣,因为CWI维护机制似乎是细胞壁塑性的重要组成部分[52.那53.].又讨论了细胞壁可塑性作为根本原因,以便显然有限的成功旨在优化到目前为止实现的生物质质量[52.].
我们想要确定额外的成分和分子过程,它们介导了对CWD的反应和细胞壁代谢的适应性变化。为了达到这些目的,我们利用来自isx处理的拟南芥幼苗的微阵列表达谱数据选择候选基因。然后利用傅立叶红外光谱鉴定候选基因,其中插入导致幼苗水平的细胞壁变化。我们对四个基因进行了深入研究,以验证该方法。这些研究包括确认基因表达对ISX是敏感的,确定表达是否受THE1控制,并研究这些基因功能缺失的等位基因如何影响成年植物的细胞壁组成,以及对坏死营养病原体的抗性Plectosphaerella cucumerina并对ISX诱导的CWD损害CWI的回应。
结果
鉴定候选基因
此前,我们进行了时间过程实验,以描述拟南芥幼苗对isx诱导的CWD的响应[48.].Affymetrix ATH1微阵列用于检测ISX治疗开始后36小时内转录水平的变化。幼苗的表型特征显示,isx处理4-6 h后,根尖木质素沉积和JA产量增加[48.].基于这些结果,我们假设基因在4小时后表现出转录变化可能参与了CWD反应(植物激素和木质素生产)以及细胞壁修饰过程。微阵列衍生的表达数据分析表明,数百个基因的转录水平在暴露于ISX 4 h后发生了变化。我们使用公共表达式数据(www.genevestigator.com.),以鉴定在ISX处理4 h后表现出差异表达和在细胞壁修饰或产生优先发生的组织类型(主根延伸区和扩展的下胚轴)中表达升高的基因。为了确定这些候选基因是否参与细胞壁相关过程,我们决定进行一项初步研究,描述23个候选基因的T-DNA插入系的表型。支持信息表1(附加文件1:表S1)列出了与其数据库注释的23个候选基因,探针组代表了Affymetrix ATH1微阵列和用于表征的插入线上的基因。表S2总结了在原始时间课程表达分析实验中产生的23个候选基因的微阵列衍生的表达数据。附加文件1图S1显示了利用genevinvestigator数据库推测的候选基因在不同组织/器官中的转录水平。基因研究人员提供的表达数据表明,一些候选基因参与了影响或涉及植物细胞壁代谢的细胞和生物学过程。
基于FTIR的分析检测突变幼苗中的细胞壁表型
对23个候选基因的插入系进行详细的细胞壁分析是耗时的,而且可能效率不高。在此之前,FTIR已经成功地作为一种有效的分类方法拟南芥细胞壁建筑改变的突变体[58.].我们利用这一方法作为基础,以便于识别导致拟南芥幼苗细胞壁组成或结构变化的候选基因插入。收集6天龄的总细胞壁材料、液体培养的Col-0幼苗或插入候选基因的T-DNA幼苗的FTIR光谱进行分析。最初仅对Col-0样本进行表征,以确定在对照组中观察到的可变性。随后,使用col0变异的两倍标准差作为截断点,以识别引起FTIR光谱显著变化的候选基因插入。基于这一标准,分析的23个插入行中有17个的FTIR光谱显示出显著差异(附加文件1:图S2)。幼苗的幼苗观察到明显的差异AT5G24140(角鲨烯MONOOXYGENASE2那SQP2.,(59.]) 和AT5G49360(BETA-XYLOSIDASE1, ATBXL1,(60.]),AT1G07260(UGT71C3,(61.]),AT1G74440[62.],AT2G35730[55.那63.],AT3G13650(Dirigent蛋白7那DIR7,(54.])和AT4G33300.(激活抗病类1那ADR1-L1,(64.),在1740-1600厘米- 1和1200-950 cm.- 1区域(附加文件1:图S2A)。这些是纤维素的特征,果冻多糖的元素(包括果胶中的烷基酯以及其他酯,[59.那60.那65.那66.2015年])。插入行AT2G41820(韧皮部与木质部/管状细胞分化抑制因子受体相关3,pxc3,(57.]),AT3G11340(UDP糖基转移酶76B1那UGT76B1,(67.]),At4g33420(过氧化物酶47.那PRX47,(68.]),At4g35630(磷酸丝氨酸AMINO-TRANSFERASE 1那PSAT 1,(69.]),AT5G48460(Fimbrin 2,Atfim2,[70]),AT5G47730(SEC14-同源19那SFH19,(56.那71.]),At5g65390(阿拉伯半乳聚糖蛋白7那AGP7,[72.), At3g16560, At2g02950 (光敏色素激酶底物1,pks1)[73.],AT2G13790(体细胞胚胎发生受体激酶4那SERK4)[74.]在1367-1200厘米上表现出明显的差异- 1C-H振动和CH振动的特征区域2- 在纤维素和半纤维素中进行纤维素和半纤维素的弯曲蛋白环果胶环中的弯曲(附加文件1:图S2b, [66.])。检查的其他线的FTIR光谱没有与COL-0控件的差异表现出差异(附加文件1:图S2C)。插入管线的FTIR的分析结果表明,在检查的23个候选基因中的17个中,细胞壁组合物或结构可能会受到幼苗的幼苗。该插入似乎基于其表观分离为三组细胞壁组合物/结构具有明显的影响。
四个候选基因被选中以进行更详细的描述
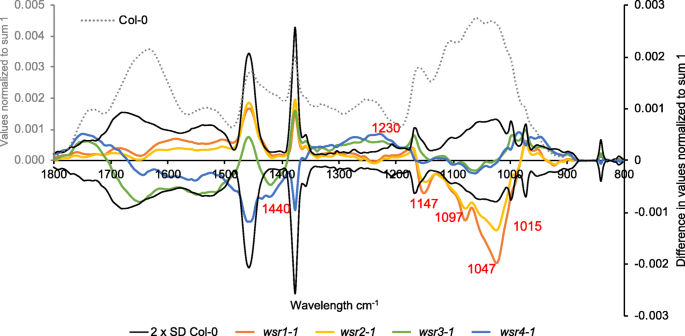
我们选择了四个候选基因进行更详细的分析(AT3G13650那AT2G35730那AT5G47730和AT2G41820、表1),因为对它们的生物学功能和导致两种性质不同的FTIR表型的四种插入的现有知识有限。这也使我们能够确定在幼苗水平上产生相似FTIR细胞壁表型的插入系在成体植株水平上是否也表现出相似的细胞壁表型。而AT3G13650和AT2G35730FTIR-Spectra(橙色,黄色)似乎偏离了Col-0的控制,主要是纤维素的特征和某些类型的果胶,AT5G47730和AT2G41820光谱(绿色,蓝色)主要偏离在纤维素元素的特征,半纤维素和果胶的区域(图。1,数字突出的波数诊断的某些波段的光谱根据[66.])。这四个基因被归为WALL STRESS RESPONSE基因或WSRs。AT3G13650(WSR1,DIR7.)属于抗病应答蛋白家族,在木脂素的生物合成和凯氏带的形成中都有涉及[10那54.].对现有数据的分析表明AT2G35730(WSR2)在雌性配子体中表达并编码重金属运输/排毒超家族蛋白[55.那63.].蛋白质同源性表明AT5G47730(WSR3,SFH19)与SEC14蛋白相关有关酿酒酵母,在极化囊泡运输中有牵连[71.].AT2G41820(WSR4,PXC3.)编码一种推定的富含亮氨酸的重复受体激酶,属于其他成员在次级血管组织组织中涉及的家庭[57.].
Col-0的平均FTIR光谱概述,wsr1-1、wsr2-1 wsr3-1和wsr4-1幼苗。灰度线表示COL-0(灰色Y轴标签)的平均光谱。不同的彩色线条WSR1-1.(橙色的),wsr2-1(黄色),WSR3-1(绿色)和wsr4-1(蓝色)表示从col0平均谱(黑色y轴标签)中减去各自的突变体平均谱得到的差异谱。黑线表示col0衍生材料的2 × SD。红色的数字表示植物细胞壁材料的红外光谱波段作为某些类型的细胞壁多糖的指标。要与完整的突变集进行比较,请参阅附加文件1S2:图
定量基因表达分析证实了转录组学的结果,表明THE1是控制的WSR基因表达
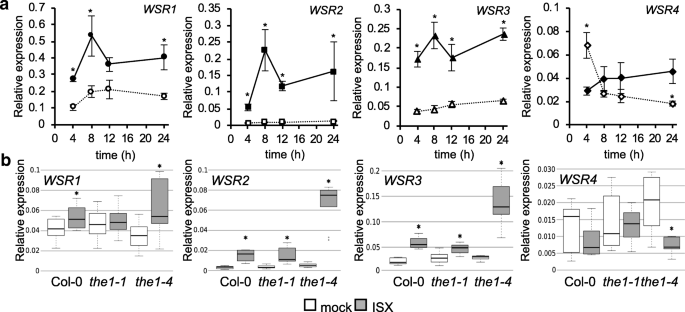
拟南芥幼苗的基于DNA微阵列的表达分析表明转录水平WSR基因响应于ISX治疗而改变(表S2)。为了确认这一点,通过在模拟或isx处理的幼苗中,通过定量逆转录 - 聚合酶链反应(QRT - PCR)来确定四种基因的时间课程实验和转录水平。转录水平WSR1 2和3.在ISX处理4 h后升高,与模拟对照相比仍保持升高(图4)。2a).的转录水平WSR4在初始的瞬态增加后降低。确定是否的表达WSR我们调查了基因由The-1介导的CWI维护机制控制WSR转录水平那场损失(1-1) -或功能增益(1-4)幼苗25那75.].在isx处理的col0幼苗中WSR1那2和3.转录水平增加而增加WSR4在8小时后似乎略有减少(图。2b)。WSR1转录水平没有增加1-1苗期,但增加了1-4.WSR2转录水平在1-1幼苗,如在Col-0中,同时增加增加1-4.增加WSR3表达显然略微减少1-1幼苗与Col-0相比,而增加再次更明显1-4而不是ISX治疗的COL-0幼苗。减少WSR4似乎没有表达1-1与isx处理的Col-0幼苗相比,在isx处理下表现更明显1-4幼苗。总之,DNA微阵列和QRT-PCR表达分析显示,转录水平WSR1 2和3.增加WSR4随着时间的推移,在ISX处理的幼苗中降低。WSR转录水平似乎受THE1活性变化的不同程度影响,而THE1活性的增加影响所有转录水平WSR基因减少了1个活动似乎影响特别强烈WSR1.
受纤维素生物合成抑制的幼苗候选基因表达谱分析。一种基因表达的WSR1那2那3.和4.根据QRT-PCR分析,在模拟(DMSO;空符号,虚线)或ISX(填充符号,实线)处理后的指示时间点的幼苗。值被归一化为ACT2.并且代表了3个独立实验的意思(每次试验重复一次,每个试验汇总每次重复)。误差栏表示SD。星号表示统计上显着的差异(*P. < 0.05) to mock controls according to Student‘s t test.B.转录水平的WSR1那2那3.和4.在Col-0,1-1和1-4DMSO或isx处理8 h。值被归一化为ACT2.,表示3个独立实验的平均值(N= 8 - 9)。根据学生t检验(*),星号表示与模拟对照有统计学显著差异P. < 0.05). The boxes in the boxplot indicate interquartile range (IQR, between 25th and 75th percentile) and the black line in the middle of the box marks the median. The whiskers indicate data points furthest from the median, if they are still within 1.5xIQR from the closest quartile. The data points outside this range are plotted individually
基因敲除和敲除等位基因的鉴定WSR基因
使用通过T-DNA插入产生的敲除(KO)或敲除(KD)等位基因是一种成熟和成功的方法来描述感兴趣的基因[76.].我们使用拟南芥基因定位工具(拟南芥基因定位工具,拟南芥基因定位工具,拟南芥基因定位工具,拟南芥基因定位工具,拟南芥基因定位工具http://signal.salk.edu/cgi-bin/tdnaexpress).利用基于pcr的基因分型技术分离出用于插入的纯合子植物,并确定单个基因的插入位置及其对转录水平的影响。为了WSR1第一个插入位于5'中(wsr1-1,Salk_046217)和第二个(wsr1-2,Salk_092919)在基因的3 '非翻译区(附加文件1:图S3A)。插入WSR2被映射到第一个内含子(WSR2-2,Salk_123509)和第三个外显子(WSR2-1,Salk_058271)(附加文件1:图S3B)。为了WSR3插入部分位于启动子区域(wsr3-2, SALK_079548)或第10个内含子(WSR3-1(附加文件1:图S3C)。在里面wsr4-2(SALK_121365)等位基因的插入位于第1位,而产生wsr4-1(SALK_082484)等位基因位于第二外显子(附加文件1:图S3D)。为了确定插入是否影响基因的转录水平,我们使用从模拟处理的7天幼苗分离的总RNA进行QRT-PCR。这些实验确定了四个真人的ko-(wsr2-1那wsr2-2那WSR3-1那wsr4-2)及4个kd等位基因(WSR1-1.那WSR1-2那wsr3-2和wsr4-1)对于候选基因(附加文件1:图S3a-d)。
对isx诱导的CWD的响应在幼苗中被插入WSR1或4.
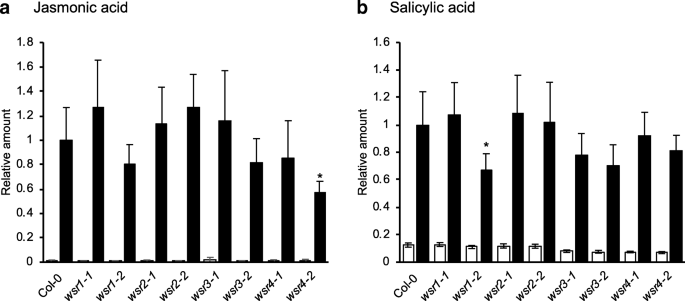
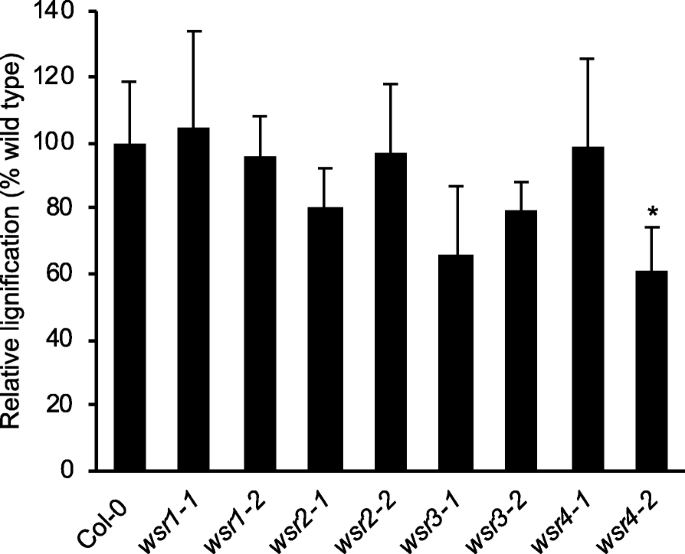
isx诱导的CWD导致幼苗根尖木质素沉积,JA和SA产量增加[20.那21那48.].在这里,我们研究了候选基因分离的KO / KD等位基因,通过在液体培养中使用模拟或isx处理的幼苗进行实验来影响这些反应。在将幼苗治疗7小时后,我们测量了JA和SA水平(图。3.a,b)。在isx治疗wsr4-2幼苗,我们检测到JA的产量减少,而SA的水平较低WSR1-2幼苗。在使用甘油蛋白醇的24小时后检测到木质素,并使用图像分析量化[16].模拟治疗的幼苗根没有显示任何木质素沉积(附加文件1:图S4)。经过isx处理后,我们发现木质素化显著降低wsr4-2幼苗(图。4.额外的文件1:图S4)。这些结果表明WSR1和4.可能参与对ISX引起的CWD的响应。
WSR1那2,3和4.茎生长期间有助于细胞壁形成
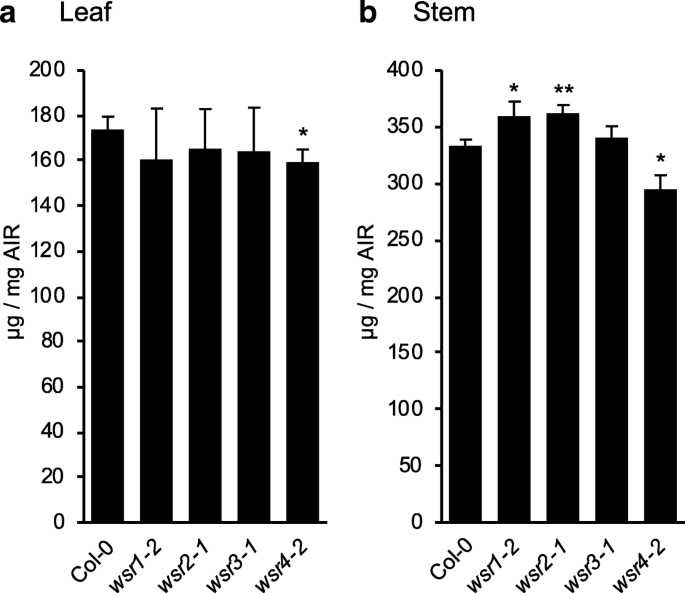
为了确定感兴趣的基因是否影响细胞壁代谢,纤维素,氧膦和中性细胞糖的水平在来自莲甜叶和Col-0的成熟茎的细胞壁制剂中测定WSR.突变植物。与Col-0植物相比,突变植物没有表现出任何明显的生长表型(附加文件1:图S5)。在这里,我们只研究了每个候选基因最强的KO或KD等位基因。我们检测到的纤维素含量减少仅在叶wsr4-2与Col-0相比(图。5.一种)。我们在成熟茎中的纤维素定量检测到增加量WSR1-2和wsr2-1,而纤维素则在wsr4-2茎(图。5.b).对成年植株茎秆中木质素含量的分析未发现Col-0与突变植株之间的任何差异(附加文件)1:图S6)。叶片中性细胞壁糖和糖醛酸分析只检测到葡萄糖醛酸含量低WSR1-2与COL-0对照的显着差异(图。6.一种)。在茎衍生的材料中,我们观察到增强水平的鼠李果和木糖WSR1-2(图。6.b)。在WSR3-1茎、病灶、鼠李糖、阿拉伯糖和半乳糖含量升高。在wsr4-2与Col-0对照组相比,葡萄糖量减少,甘露糖轻微增加。综上所述,我们的细胞壁分析检测到纤维素和不同中性细胞壁糖含量的差异,在茎中检测到的影响最显著。观察到的细胞壁表型的相似性和变异性表明,不同的基因可能参与了不同但也重叠的细胞壁代谢方面的成体植物。
有插入的植物WSR1表现出病原体反应表型
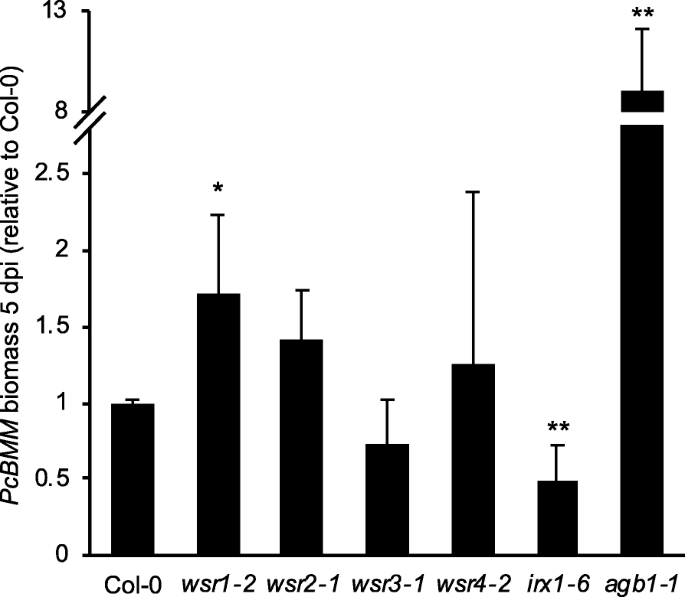
它已被证明是CWI监控RLK那场和mik2.影响病原体易感性[27].在这里,我们研究了WSR基因中的突变,通过接种携带在四个基因中的成人植物与虚营养真菌在四个基因中携带的成人植物影响植物病原体相互作用的结果Plectosphaerella cucumerinaBMM(个人电脑在接种后5天的BMM)和定量真菌生物量(图。7.).拟南芥Gβ1(AGB1-1) 和不规则的木门1(irx1-6)植物被包括作为对照,因为它们表现出降低(AGB1-1)或增强抗性(irx1-6)个人电脑BMM感染[77.那78.].感染的真菌生长wsr2-1那3-1和4 - 2与Col-0对照相似。然而,生长显著增强WSR1-2植物,表明减少WSR1基因表达影响抗性个人电脑BMM感染并暗示这种基因在抗病性中。
相对易感性WSR.植物Plectosphaerella cucumerina.三周大Col-0,WSR1-2那wsr2-1那WSR3-1,WSR4-2那irx1-6(电阻控制)和AGB1-1(易感性控制)植物感染了虚度养殖叶病原体分离物个人电脑BMM。用qPCR法检测感染后5 d的真菌相对生物量个人电脑BMMβ微管蛋白基因。条表示平均值,误差条表示SD(N = 4–6). Asterisks indicate statistically significant differences to the wild type accoding to Student‘s t test (*P.< 0.05;Arunachal Pradesh,P.< 0.01).
讨论
在植物中,存在机制,其监视并保持细胞壁的功能完整性[12那14].这种机制似乎与所描述的机制表现出相似之处酿酒酵母并且能够检测CWD并发动细胞和细胞壁代谢的适应性变化,以保持墙壁的功能完整性[11].植物对CWD感知的分子机制和参与调节CWD反应的信号级联的理解正在增加[16那28].然而,我们对基因的知识和分子过程带来细胞壁代谢的变化,以应对CWD及其在生长和发育过程中的功能非常有限。在这里,我们通过将来自ISX处理的幼苗的转录组织数据与候选基因的FTIR的细胞壁分析组合,通过将来自ISX处理的幼苗与患者候选基因的幼苗的幼苗细胞壁分析结合在成年植物中鉴定成年植物中对成年植物中CWD的反应的基因。从转录组织数据中识别。该方法鉴定了17个基因(23个原始候选物中),其中候选基因中的T-DNA插入似乎导致基于FTIR结果的细胞壁缺陷。这些基因的功能,属于不同基因家族,通常不太理解(附加文件1:表S1)。对…的生物学功能所知甚少AT1G74440除了它可以编码ER膜蛋白。基因涉及由植物利钠肽(PNP)介导的基于共表达的生物和非生物应激反应ATPNP-A.[62.].ATFIM2编码一种属于Fimbrin家族的蛋白质,似乎可以调节肌动蛋白丝的组织[70].SQE2.将角鲨烯环氧酶转化为氧化喹啉酶,其形成所有已知的Ageniosperm循环三萜类化合物的前体[59.].三萜是生产膜甾醇和油菜素内酯所必需的。PSAT1编码在叶绿体中进行丝氨酸生物合成所需的氨基转移酶[69.].丝氨酸的生物合成在光呼吸过程中是必需的,这是碳水化合物代谢和植物生长的先决条件。虽然agp与细胞壁重塑有关,但关于AGP7在这种情况下的具体功能的信息很少[72.].atbxl1.在种皮发育过程中作为α- l -阿拉伯呋喃糖苷酶起作用[60.].PRX47编码推定的过氧化物酶,显然表达在将幼苗根系中的血管组织分化并涉及木质化[68.].UGT71C3和UGT76B1编码udp -糖基转移酶(UGTs), UGTs与植物激素和/或代谢产物的糖基化有关,在生物和非生物胁迫反应中[61.].UGT76B1似乎是糖基异亮酸,这是必需的协调,以SA和ja为基础的防御反应活跃的病原体感染,如两和alertaria brassicicola.[67.].ADR1-L1编码卷曲线圈核苷酸结合亮氨酸富含蛋白质的重复蛋白,并形成植物中效应引发的免疫力的重要元素[64.那79.].回顾现有的知识提供了进一步的证据,表明一些基因可能是与细胞壁相关的过程所必需的(PRX47那ATBXL1那AGP7),膜(SQE2.),光合物(PSAT1)新陈代谢或光感(PKS1).有趣的是UGT76B1那UGT71C3那ADR1-L1那SERK4和AT3G16560在对非生物或生物胁迫的反应中,也涉及到植物细胞壁[61.那67.那79.].在我们的实验条件下,幼苗暴露于CWD而不是生物/非生物胁迫,因此这些基因实际上是在响应细胞壁相关事件的可能性,这也可能发生在生物和非生物胁迫中。更重要的是,研究结果表明,该方法使我们能够在拟南芥基因组的众多基因中识别出那些对CWD的响应以及细胞壁和膜代谢相关方面的调控基因。
我们更详细地表征了四种候选基因。这些基于候选基因中的插入和对其生物学功能的有限详细了解来选择的基于FTIR表型。基于胰岛素处理的幼苗的基于QRT-PCR的表达分析,得到了与转录组学实验的数据类似的结果。The1的丧失和功能等位基因的实验表明ISX诱导的转录水平变化WSR1,2,3和4.对The1的活动的增加敏感(1-4),而减数效果(1-1)不太明显[75.].预期这些结果是预期的,因为The1的完全损失导致对CWD但不完全损失的反应减少,这表明1介导的CWI维护机制是冗余组织的或存在的其他信令机制[16].但是,结果支持概念WSR基因表达由The1介导的CWI维护机制调节WSR活动可能会对转录水平进行控制。
桌子2提供针对四个基因中的插入线观察到的表型的全局概述。减少WSR1和WSR2在通常发现纤维素和果胶诊断信号的区域,活性似乎引起了同样明显的FTIR表型(图。1).为了WSR1-2,我们检测到茎源材料中纤维素、鼠李糖和木糖含量增加,而叶源材料中葡萄糖醛酸含量减少。5.那6.).ISX诱导幼苗和抵抗力的SA生产个人电脑降低成年植物中的BMM(图。3.那7.).在wsr2-1植物,我们还检测到茎衍生材料中纤维素的增加,同时对CWD的反应,个人电脑BMM敏感性和非纤维素细胞壁基质组合物类似于对照(图。3.那5.那6.那7.).减少WSR3和4.似乎导致与纤维素元素,半纤维素和果胶有关的FTIR表型(图。1).在WSR3-1在干细胞来源的细胞壁材料中,我们检测到焦糖、鼠李糖、阿拉伯糖和半乳糖的数量与对照组相比有显著差异(图。6.).在wsr4-2结果表明,茎源和叶源细胞壁材料中纤维素含量均降低,葡萄糖和甘露糖含量分别降低和增加。5.那6.).对CWD的响应分析发现,isx处理降低了JA和木质素的产量wsr4-2幼苗和野生类型的差异WSR3-1苗(无花果。3.那4.).观察到的表型wsr2-1结合有限的可用蛋白质信息,不幸的是没有关于WSR2功能的新见解[55.].对中性细胞糖糖的特定作用WSR3-1植物表明,WSR3可以通过介导Golgi之间的传输(其中含有岩藻糖,鼠李糖,阿拉伯糖,半乳糖的非纤维素细胞壁多糖之间的传输有助于细胞壁多糖代谢代谢。和血浆膜[80].考虑到WSR3 / SFH19属于sec14蛋白家族,该家族的成员参与了膜稳态所需的磷酸肌醇生产和调节细胞过程(如囊泡运输)的信号传导过程[71.那81.].这些结果涉及WSR2和WSR3在细胞壁代谢中,但在此处审查的CWD代表答复中。两个都WSR1 / DIR7和WSR4 / PXC3似乎是对幼苗水平的CWD反应以及成年植物中细胞壁代谢的特定方面,表明它们都涉及调节细胞壁组合物的变化的CWD诱导的信号传导过程。WSR1似乎只需要在isx诱导的CWD中增加SA的产生,然而WSR4JA和木质素生产需要。这wsr4-2表型与CWD反应的描述相似mik2.只有JA和木质素的产量与对照不同,而SA的产量相似[16那27].这些结果表明,对于CWI维护的相同方面,可能需要两个rlks。依赖于依赖的减少WSR4转录水平响应CWD表明它可以压制CWD诱导的反应。这与CWD响应表型类似舍,其中FER KD导致茉莉酸、SA和木质素的产量增加[16].然而,WSR4函数表型损失表明RLK是ISX诱导的JA和木质素生产所必需的。这意味着存在与WSR4相互作用的额外调节元件,从而产生观察到的突变表型。由于相关的RLK PXC1与血管发育有关,因此可以想到与细胞壁代谢的CWD感知的WSR4的功能[57.].
结论
综上所述,在本研究选择的23个候选基因中,有17个插入T-DNA的幼苗表现出FTIR表型。基因表达分析表明WSR基因表达响应于ISX诱导的CWD而调节,调节显然对The1活性的变化显然敏感。这与鉴定到依赖于The1-依赖的CWI维护机制的基因,表明我们的方法已经确定了在拟南芥中调解CWI维护的新组件。用KO或KD线进行后续研究,用于四个候选基因发现成人植物中的细胞壁表型,所有四种和对CWD反应的影响WSR1和4..这些结果还强烈表明,对所确定的剩余候选基因进行更详细的分析,可能会产生有趣的新颖见解,以CWI维持机制和细胞壁代谢的作用方式。
方法
试剂
除非另有说明,所有化学品和酶均购自Sigma-Aldrich。
植物材料
野生型和突变体拟南芥本研究中使用的系系来自诺丁汉拟南芥种群中心(http://arabidopsis.info/).详细信息列于其他文件中1:表S1。在用600nm isoxaben(在DMSO中)处理之前,幼苗在液体培养(2.1g / L murashige和Skoog基础培养基中,0.5g / L mes Salt和Ph 5.7时的1%蔗糖),如下所述16].对于细胞壁分析,植物在漫长的条件下在土壤(Pro-Mix HP)上生长(16小时,11000勒克斯,22°C,8小时黑色,20°C,70%相对湿度)。对于病原体感染测定,在短时间条件下在无菌土壤 - 蛭石(3,1)上在Phytochambers(3,1)下在20-21℃下植入植物的植物化学器(3,1)。
病原体感染测定
为了Plectosphaerella cucumerinaBMM致病性测定,18天生植物(N > 15) were sprayed with a spore suspension (4 × 106.孢子/毫升),如前所述[82.那83.].真菌生物量在Planta.通过确定水平来量化个人电脑对BMM β-微管蛋白基因进行qPCR(正向引物:CAAGTATGTTCCCCGAGCCGT,反向引物:GGTCCCTTCGGTCAGCTCTTC),并将其归一化泛素缀合酶21(UBC21.那AT5G25760).
定量rt - pcr
使用光谱植物总RNA试剂盒(Sigma-Aldrich)分离总RNA。用RQ1 RNase的DNase(Promega)处理两种微量RNA,并用IMC-II逆转录系统(PRomega)处理,用于cDNA合成。使用LightCycler 480 Sybr Green I Master使用罗氏灯笼480系统进行QRT-PCR。如所述确定基因表达水平[24].在Col-0中进行了时间过程表达分析,在那场苗:
ACT2-FOR(5 ' -CTTGCACCAAGCAGCATGAA-3 '),
ACT2-REV(5'-CCGATCCAGACACTGTACTTCCTT-3'),
WSR1-for.(5 ' -TATGGTGATGAACTTTGCGTTC-3 '),
WSR1-Rev.(5'-ACTCAACAGTAGCATCTCCTGA-3'),
WSR1A-for.(5 ' -TACGCTGCTACTGGTCAACG-3 '),
WSR1A-REV(5'-TTCCTCCAATCACCGGCATC-3'),
WSR2-FOR(5 ' -CTCACTTCCATCGTTTCAAGTG-3 '),
WSR2-Rev.(5'-gaaaccaaacgtggcctaaa-3'),
WSR3-FOR(5 ' -GAAAGCACGAGACTGGAACG-3 '),
WSR3-Rev.(5 ' -TATCCACCCTCCAACGCAAA-3 '),
WSR4 - for.(5 ' -AGCCCTGAGAGATCAAGCATT-3 '),
WSR4-Rev.(5'-agctcaactaagccgatgaagc-3')。
为了表征T-DNA插入管线,采用以下引物:
ACT2-for,ACT2-REV,WSR1-for那WSR1-Rev.那WSR2-FOR那WSR2-Rev.那
WSR3-FOR2(5'- TCTTATCCGGTTGCGGAAGG-3'),
WSR3-REV2(5'-GTGGTGAGATGACCCAGAGCC-3'),
WSR4-FOR2(5 ' -CTTGATGCAGTTGTGAAAGCA-3 '),
WSR4-Rev2.(5 ' -TCTTCACCGAAACAATCATCC-3 ').
傅里叶变换红外光谱分析
对于FTIR分析,收集每个基因型的4个生物重复和5个生物重复的5个技术复制(即收集了每个基因型20个光谱)。每个技术复制的光谱从800到5000厘米测量- 1在Bruker Vertex 70上每次测量每次测量15个累积。在10kHz下测量所有光谱,通过Blackman-Harris 3术语进行10kHz的低通滤波器,傅里叶变换进行了3项。使用Opus 5版本的数据对大气补偿进行了大气补偿(www.bruker.com.).光谱被裁剪到802厘米的范围内- 1到1820厘米- 1以涵盖资料丰富的波数,如[58.].基于光谱两端的前10个点来进行线性回归,并用于基线校正。数据被标准化为SUM 1,仍然存在于常规化目的的任何负值。基于用4个生物学重复的三个独立实验和每个生物重复的5个技术复制(即每次实验的20个光谱)确定COL-0对照的生物变化。通过平均线路的所有技术重复来计算插入线和COL-0之间的差异,并从COL-0中减去相应的平均值来计算。通过波长绘制插入线和COL-0之间的差异。选择COL-0的标准偏差作为截止的两倍,因为如果假设在COL-0和插入管线上被认为是对称的自然变化,则表示显着性。
细胞壁的分析
细胞壁制备和分析按所述进行[84.]微小修改。对于干细胞壁组合物的分析,合并每种基因型的三个5周龄植物的主要茎,以形成一种生物重复。对于叶片细胞壁组成的分析,合并每种基因型三个5周龄植物的全叶玫瑰花,以形成一种生物重复。在所有情况下分析了四种生物重复。在取样后立即在液氮中闪蒸植物样品并冻干。干燥的物质是用Labman Robot的氧化锆珠子碾碎(www.labmanautomation.com), 70%乙醇70℃提取3次,真空干燥。根据制造商的说明,使用Megazyme总淀粉试剂盒去除淀粉。真空干燥后,用Labman机器人(0.2 mg耐受量)分别在2ml螺帽管(用于细胞壁单糖分析的2mg AIR)和用于木质素分析的气相色谱瓶(用于木质素分析的1.2 mg AIR)中称量脱淀粉醇不溶残渣(AIR)。纤维素、中性糖和糖醛酸的测定遵循已公布的一步两步水解协议[84.].采用Thermo Fisher Dionex ICS-5000系统,使用CarboPac PA-20和PA-200色谱柱进行高效阴离子交换色谱-脉冲安培检测(HPAEC-PAD),如所述[84.].乙酰溴溶性木质素的定量描述如下[85.].
植物激素分析
JA和SA的提取和分析如下所述[16].简单地说,用10%甲醇/ 1%乙酸萃取栀子-d5.酸和水杨酸-D4.酸(CDN同位素)作为内部标准。定量是在岛本UFLC XR / AB SCIEX Triple Quad 5500系统上进行的,使用以下质量跃迁5.-ja 214 > 62, sa 137 > 93, d4.-sa 141 > 97。
木质素检测在根中
幼苗根源(N > 15) was analysed 24 h after start of treatment. Lignified regions were detected with phloroglucinol-HCl, photographed with a Zeiss Axio Zoom.V16 stereomicroscope and quantified as described [16].
统计分析
使用学生评估统计学意义T.- Microsoft Excel中的检验(双尾分布,两样本不等方差)。统计学差异用*表示P. < 0.05, **P.< 0.01。箱图是使用R包“箱图”和默认设置生成的(范围= 1.5*IQR)。
可用性数据和材料
如果材料尚未从股票中心获得,则应根据相应作者的要求提供。
改变历史
2019年9月05
在发布原始文章[1]之后,提交人报告说,图2中的子图WSR4中的两条曲线应该是另一个方式。
缩写
- 阿巴:
-
脱落酸
- ACT2:
-
actin2.
- ADR1-L1:
-
激活抗病类1
- AGB1-1:
-
拟南芥Gβ1
- AGP7:
-
阿拉伯半乳聚糖蛋白7
- 空气:
-
醇不溶性残留物
- ATBXL1:
-
β-Xylosidase1.
- ATFIM2:
-
丝束蛋白2
- BIK1:
-
葡萄孢菌诱导激酶1
- CIPK26:
-
Calcineurin相互作用激酶26
- CKS:
-
细胞分裂素
- Col-0:
-
Columbia-0
- CrRLK1L:
-
Catharanthus Roseus.Rlk1样激酶
- CWD:
-
细胞壁的破坏
- CWI:
-
细胞壁的完整性
- 脱硫:
-
Deutsche forschungsgemeinschaft.
- DIR7:
-
Dirigent蛋白7.
- DMSO:
-
二甲基亚砜
- DPI:
-
感染后期
- 带:
-
FERONIA
- FTIR:
-
傅立叶变换红外光谱
- g / L:
-
格拉姆/升
- GC:
-
气相色谱法
- GEF:
-
鸟苷核苷酸交换因子
- HPAEC-PAD:
-
高性能阴离子交换色谱,具有脉冲安培检测
- IQR:
-
狭窄的范围
- irx1-6:
-
不规则的木门1
- ISX:
-
Isoxaben
- JA:
-
茉莉酸
- KD:
-
击倒
- kHz:
-
千赫
- 柯:
-
昏死
- MCA1:
-
MID1-COMPLEMENTING活动1
- 市场经济地位:
-
Morpholinoethylsulfonic酸
- MID1 / CCH1:
-
交配诱导死亡1 /钙通道1
- mik2:
-
雄性发现者1-相互作用受体样激酶2
- MSL2:
-
小电导式的机械敏感频道2
- MSL3:
-
小电导式3的机械敏感频道
- NM:
-
纳米摩尔
- PcBMM:
-
Plectosphaerella cucumerina BMM
- PKS1:
-
光敏色素激酶SUBSTRATE1
- pnp型:
-
植物利用肽
- PRX47:
-
过氧化物酶47.
- PSAT 1:
-
磷酸丝氨酸AMINO-TRANSFERASE 1
- PXC3:
-
Phloem嵌入着木质/气管元素分化抑制因子受体相关的3
- qRT - PCR:
-
定量逆转录聚合酶链反应
- Quad:
-
四极
- RBOH D / F:
-
Nadph-氧化酶如呼吸爆发氧化酶同源物
- RLK:
-
受体激酶
- 酿酒酵母:
-
酿酒酵母
- 山:
-
水杨酸
- SD:
-
标准偏差
- SERK4:
-
体细胞胚胎发生受体激酶4
- SFH19:
-
SEC14-同源19
- SOS5:
-
盐过度敏感
- SQP2:
-
角鲨烯MONOOXYGENASE2
- The1:
-
忒修斯1
- UFLC:
-
超快速液相色谱
- UGT76B1:
-
76 b1 UDP糖基转移酶
- ugt:
-
UDP-glycosyltransferases
- WSR:
-
墙压力反应
参考文献
- 1.
植物细胞壁介导的免疫:细胞壁变化触发植物抗病反应。植物j . 2018; 93:614-36。
- 2.
郭涛,王志强,王志强,等。植物细胞壁重构信号通路的研究进展[j]。植物。2018;7:89。
- 3.
Dinakar C,Bartels D.复活植物中的干燥耐受性:转录组,蛋白质组和代谢分析的新见解。前植物SCI。2013; 4:482。
- 4.
Chowdhury J, Schober MS, Shirley NJ, Singh RR, Jacobs AK, Douchkov D,等。下调的葡聚糖synthase-like 6基因(HVGSL6.)导致胼胝质积累减少,细胞壁穿透增加Blumeria Graminis.f . sp。HORDEI..新植物。2016; 212:434-43。
- 5。
陈志强,陈志强。植物细胞壁结构与形态发生的关系。植物学报。J Exp Bot. 2015;67:erv535。
- 6。
pardez AR, Somerville CR, Ehrhardt DW。纤维素合酶的可视化显示了与微管的功能关联。科学。2006;312:1491-5。
- 7。
Gutierrez R,Lindeboom JJ,Paredez Ar,Emons Am,Ehrhardt DW。Arabidopsis皮质微管将纤维素合酶递送到质膜并与纤维素合酶贩运隔间相互作用。NAT细胞BIOL。2009; 11:797-806。
- 8。
Lee Y,Rubio MC,Alassimone J,Geldner N.一种局部木质素沉积在内霉中的机制。细胞。2013; 153:402-12。
- 9。
doblas vg,smakowska-luzan e,藤田s,alassimone j,Barberon M,Madalinski M等。通过血管结构衍生的肽与SGN3受体结合的根部扩散阻挡控制。科学。2017; 355(6322):280-4。
- 10.
Barbosa ICR,Rojas-Murcia N,Geldner N.尸体剥离 - 一个戒指带来细胞生物学,以满足?CurrOgin Biotechnol。2019; 56:121-9。
- 11.
Hamann T.植物细胞壁完整性维护机制 - 组织和行动方式的概念。植物细胞生理。2015; 56:215-23。
- 12.
植物细胞壁信号传导和受体样激酶。j . 2017; 474:471 - 92。
- 13。
de Lorenzo G,法拉利S,Giovannoni M,Mattei B,Cervone F.细胞壁特征,影响植物发育,免疫和生物转化。植物J. 2018; 97:134-47。
- 14。
植物细胞壁完整性的信号传导:malectin结构域激酶和来自其他王国的教训。细胞冲浪。2018;3:1-11。
- 15.
Kieber JJ,Polko J.植物中纤维素生物合成的调节。植物细胞。2019; 31:282-96。
- 16。
Engelsdorf T,Gigli-Bisceglia N,Veerabagu M,McKenna JF,Vaahtera L,Augstein F等人。植物壁完整性维持和免疫信号系统配合控制应力响应拟南芥.Sci信号。2018;11:eaao3070。
- 17。
Heim Dr,Skomp Jr,Tschabold Ee,Larrinua Im。isoxaben抑制拟南芥酸不溶性细胞壁材料的合成。植物理性。1990; 93:695-700。
- 18。
中间WR,Eshed R,Richmond T,Delmer D,Somerville C.纤维素合酶的修饰赋予拟南芥IXR1突变体中的isOxaben和噻唑烷酮除草剂。Proc Natl Acad Sci U S A. 2001; 98:10079-84。
- 19。
纤维素生物合成抑制剂-多功能工具箱。J Exp Bot. 2016; 67:533-42。
- 20.
ellis c,turner jg。拟南芥突变体CEV1具有组成型己酸酯和乙烯信号途径,并增强对病原体的抗性。植物细胞。2001; 13:1025-33。
- 21.
关键词:拟南芥,纤维素合成,木质素化,防御反应植物j . 2003; 34:351 - 62。
- 22。
等。异沙苯习惯拟南芥悬浮培养细胞的新型细胞壁结构:全球转录谱分析和细胞分析。植物j . 2004; 40:260 - 75。
- 23。
王志强,王志强,王志强,等。在拟南芥中,细胞壁损伤诱导的木质素生物合成受到活性氧和茉莉酸依赖过程的调控。植物杂志。2011;156:1364 - 74。
- 24。
陈志强,陈志强,陈志强,等。细胞壁完整性调节拟南芥细胞分裂素和硝酸还原酶依赖的细胞周期基因表达。发展。2018;145:dev166678。
- 25。
赫瓦尼K,Sado Pe,Van Tuinen A,Rochange S,Desnos T,Balzergue S等人。一种受体样激酶介导拟南芥细胞的响应抑制纤维素合成。Curr Biol。2007; 17:922-31。
- 26.
Xu S-LL, Rahman A, Baskin TI, Kieber JJ。在拟南芥中,两个富含亮氨酸重复受体激酶介导信号,连接细胞壁生物合成和ACC合成酶。植物细胞。2008;20:3065 - 79。
- 27.
van der do,boutrot f,engelsdorf t,rhodes j,mckenna jf,vernhettes s等人。拟南芥富含含琥氨酸的重复受体激酶Mik2 / LRR-Kiss连接细胞壁完整性感测,根生长和对非生物和生物应力的反应。Plos Genet。2017; 13:E1006832。
- 28.
冯伟,段强,冯伟,等。在盐胁迫下,FERONIA受体激酶通过钙离子维持细胞壁的完整性2+信令。Curr Biol。2018; 28:666-75。
- 29。
李志强,王志强,王志强,等。植物malectin-样受体激酶的研究进展[J]。植物学报2018;69:301-28。
- 30.
肽激素及其受体蛋白激酶调节植物细胞膨胀。科学。2014;343:408-11。
- 31.
Stegmann M,Monaghan J,Smakowska-Luzan E,Rovenich H,Lehner A,Holton N等人。受体激酶FER是一种RALF调节的支架控制植物免疫信号传导。科学。2017; 355:287-9。
- 32.
关键词:CrRLK1L受体样激酶,ANXUR1, ANXUR2,胞外结构域蛋白质科学。2018;27:886 - 92。
- 33.
Gonneau M,Desprez T,Martin M,Doblas Vg,Backete L,Miart F等人。受体激酶obsus1是拟南芥中的快速碱化因子34受体。Curr Biol。2018; 28:1-7。
- 34.
刘P,Haruta M,Minkoff BB,Sussman Mr。探测植物血浆膜受体激酶的三维结构用质谱法基于蛋白质足部印刷。生物化学。2018; 57:5159-68。
- 35.
陈志强,陈志强,陈志强,等。两种串联malectin-样受体激酶的晶体结构及其在植物生殖中的应用。Acta crystallogica D - Struct Biol. 2018; 74:671-80。
- 36.
引用本文:杨卫东,杨卫东,杨卫东,等。FERONIA受体样激酶在花粉管接受过程中介导雄性与雌性的相互作用。科学。2007;317:656-60。
- 37。
段琦,Kita D,李超,张AY,吴hm。FERONIA受体样激酶调控根毛发育的RHO GTPase信号通路。美国国家科学研究院2010;107:17821-6。
- 38。
金冈MM,鸟居。FERONIA作为植物极性细胞生长的上游受体激酶。美国国家科学研究院2010;107:17461-2。
- 39。
yu f,钱l,nibau c,duan q,kita d,Levasseur K,等。Feronia受体激酶途径通过激活ABI2磷酸酶抑制拟南芥中的脱落酸信号。Proc Natl Acad Sci U S A. 2012; 109:14693-8。
- 40.
施宏威,米勒ND,戴超,斯伯丁EP,中国。拟南芥幼苗的机械信号转导需要受体样激酶FERONIA。咕咕叫医学杂志。2014;24:1887 - 92。
- 41.
郭华,宋光国,谢振华,陈建军,等。FERONIA受体激酶通过抑制植物体内茉莉酸信号传导而促进植物免疫拟南芥.咕咕叫2018:1-9杂志。
- 42.
赵飞,陈伟,崔志强。植物形态建成的机械信号转导。Curr Opin Genet Dev. 2018; 51:26-30。
- 43.
史清,金y,guo y,史蒂文森b,zhu jk。拟南芥SOS5基因座编码推定的细胞表面粘附蛋白,并且是正常细胞膨胀所必需的。植物细胞。2003; 15:19-32。
- 44.
Harpaz-Saad S,McFarlane He,Xu S,Divi UK,前进B,Western TL等。通过Fei2 RLK / SOS5途径和纤维素合酶5的纤维素合成是拟南芥种子涂层粘液的结构所必需的。工厂J1111; 68:941-53。
- 45.
薛洪涛,王志强,王志强,等。Arabidopsis Thaliana Fla4.通过其羧基近端fasiclin 1结构域作为糖稳定的可溶性因子。植物j . 2017; 91:613-30。
- 46。
Nakagawa Y,Katagiri T,Shinozaki K,Qi Z,Tatsumi H,Furuichi T,等。Arabidopsis血浆膜蛋白对CA至关重要2+涌入和触摸感应在根中。Proc Natl Acad Sci U S A. 2007; 104:3639-44。
- 47。
莱文德。酿酒酵母中细胞壁生物发生的调节:细胞壁完整性信号通路。遗传学。2011; 189:1145-75。
- 48。
王志强,王志强,王志强,等。植物细胞壁胁迫对植物生长的影响[J]。植物j . 2009; 57:1015-26。
- 49。
Jiménez-Quesada Mj,TraversoJá,AlchéJDED.NADPH氧化酶依赖于植物生殖组织中的超氧化物生产。前植物SCI。2016; 7。https://doi.org/10.3389/fpls.2016.00359.
- 50。
张志强,张志强,张志强,等。prr相关激酶BIK1对植物免疫过程中NADPH氧化酶RBOHD的直接调控摩尔细胞。2014;54:43-55。
- 51。
韩建平,Köster P,杜鲁普,肖志明,李胜,等。RBOHF活性的微调是通过差异磷酸化和Ca实现的2+绑定。新植醇。2019;221:1935-49。
- 52.
dr . Doblin MS, Johnson KL, Humphries J, Newbigin EJ, Bacic AT。设计师植物细胞壁是一个现实的愿望还是植物新陈代谢的可塑性会胜出?《生物技术》2014;26:108-14。
- 53.
曼斯菲尔德SD. Mahon EL定制树:为便于加工和未来的生物经济而设计的木质素。生物技术。2019;56:147-55。
- 54.
Paniagua C,Bilkova A,Jackson P,Dabravolski S,Riber W,Didi V等人。植物中的降低的蛋白质:在非生物和生物应力暴露期间调节细胞壁代谢。J Exp Bot。2017; 68:3287-301。
- 55.
De Abreu-Neto JB,Turchetto-Zolet AC,De Oliveira LFV,BodaneseZanettini MH,Margis-Pinheiro M.重金属相关的等异戊二烯植物(HIPP):植物独家蛋白质的表征。FEBS J. 2013; 280:1604-16。
- 56.
文森特P,Chua M,Nogue F,Fairbrother A,Mekeel H,Xu Y等。SEC14P-Nodulin结构域磷脂酰肌醇转移蛋白偏振膜生长拟南芥根毛。J细胞BIOL。2005; 168:801-12。
- 57.
王j,kucukoglu m,张l,陈p,decker d,nilsson o等。Arabidopsis LRR-RLK,PXC1是与TDIF-PXY / TDR-WOX4信号通路相关的二次壁形成的调节器。BMC植物BIOL。2013; 13:1-11。
- 58.
Mouille G,Robin S,Lecomte M,Pagant S,Hofte H.使用傅立叶变换红外(FT-IR)微穴位的拟南芥细胞壁突变体的分类和鉴定。工厂J. 2003; 35:393-404。
- 59.
Rasbery JM,Shan H,Leclair RJ,Norman M,Matsuda SP,Bartel B.拟南芥Squalene环氧酶1对于根和种子开发至关重要。J Biol Chem。2007; 282:17002-13。
- 60.
Arsovski AA, Popma TM, Haughn GW, Carpita NC, McCann MC, Western TL. AtBXL1编码一个双功能的- d -木糖苷酶/ - l -阿拉伯糠苷酶在拟南芥粘液分泌细胞中需要果胶修饰。植物杂志。2009;150:1219-34。
- 61.
Rehman HM,Nawaz Ma,Shah Zh,Ludwig-MüllerJ,Chung G,Ahmad MQ,等。三种芸苔属和拟南芥中家庭-1 UDP糖基转移酶的比较基因组和转录组分析表明应力响应性调节。SCI批准。2018; 8。https://doi.org/10.1038/s41598-018-19535-3.
- 62.
Meier S,Bastian R,Donaldson L,Murray S,Bajic V,Gehring C.共同表达和启动子含量分析分析了生物和非生物应激反应对植物利钠肽的作用。BMC植物BIOL。2008; 8:24。
- 63.
等。拟南芥雌配子体基因表达图谱揭示了植物和动物配子体之间的相似性。咕咕叫医学杂志。2010;20:506-12。
- 64.
董晓东,佟敏,李晓东,等。TNL-mediated免疫力的拟南芥需要对冗余人员进行复杂的监管ADR1基因家族。新植醇。2016;210:960 - 73。
- 65.
Wilson Rh,Smith Ac,Kacurakova M,Saunders PK,Wellner N,Waldron Kw。傅里叶变换红外光谱研究植物细胞壁多糖的力学性能和分子动力学。植物理性。2000; 124:397-405。
- 66.
结合FT-IR和多元分析,对苹果发育过程中细胞壁组成变化进行定性定量分析。Carbohydr石油。2015;115:93 - 103。
- 67.
Maksym Rp,Ghirardo A,Zhang W,Von Saint PV,Lange B,Geist B等人。与国防相关的异甲酸在支链氨基酸相关的2-羟基羧酸中含有拟南芥累积。前植物SCI。2018; 9。https://doi.org/10.3389/fpls.2018.00766.
- 68.
Tokunaga N,Kaneta T,Sato S,Sato Y.拟南芥苜蓿三种过氧化物酶基因的表达谱分析。physiol植物。2009; 136:237-49。
- 69.
Wulfert S,Krueger S.磷素Aminotransferase1是丝氨酸生物合成的磷酸化途径的一部分,对光和糖依赖性的生长促进是必不可少的。前植物SCI。2018; 9:1712。
- 70.
Zhang R ., Chang M ., Zhang M ., Wu Y ., Qu X ., Huang S. structural plastic domain linked to distinct functions of fimbrins/ plasins。J Biol Chem. 2016; 291:17881-96。
- 71。
KF de Campos M,Schaaf G. SEC14家族的脂质转移蛋白对细胞极性的调节。CurrOp植物BIOL。2017; 40:158-68。
- 72。
Seifert G.迷人的Fasciclins:令人惊讶的广泛普遍的蛋白质,其介导细胞外部和细胞表面之间的相互作用。int j mol sci。2018; 19:1628。
- 73。
Kami C,Allenbach L,Zourelidou M,Ljung K,SchützF,Isono E等人。减少光擦表PKS.突变体可能是由于生长素调控的基因表达改变或生长素侧向转运减少。植物j . 2014; 77:393 - 403。
- 74。
张志强,张志强,张志强,等。拟南芥富含亮氨酸重复受体样激酶BAK1/SERK3和BKK1/SERK4在半生物营养和生物营养病原体的先天免疫中是必需的。植物细胞。2011;23:2440-55。
- 75。
Merz D,Richter J,Gonneau M,Sanchez-Rodriguez C,Eder T,Sormani R等。T-DNA等位基因QINASE1具有相反效应对细胞壁完整性信号传导。J Exp Bot。2017; 68:4583-93。
- 76.
Alonso JM,Stepanova An,OiseSe TJ,Kim CJ,Chen H,Shinn P等人。拟南芥的基因组型插入诱变。科学。2003; 301:653-7。
- 77.
拟南芥的Llorente F, Alonso-Blanco C, Sanchez-Rodriguez C, Jorda L, Molina A. ERECTA受体样激酶和异三聚体G蛋白是抵抗坏死性真菌黄瓜Plectosphaerella cucumerina所必需的。植物j . 2005; 43:165 - 80。
- 78.
冯德兴,胡建军,冯德兴,等。拟南芥次生细胞壁形成所需的纤维素合成酶的损伤增强了抗病能力。植物细胞。2007;19:890 - 903。
- 79.
Bonardi V, Tang S, Stallmann A, Roberts M, Cherkis K, Dangl JL。植物细胞内免疫受体家族的扩展功能超越了病原效应器的特异性识别。中国科学院院刊2011;108:16463-8。
- 80。
植物细胞壁生物合成中的拓扑问题和核苷酸糖转运体的作用。糖生物学。2016;26:913-25。
- 81。
王志强,王志强,王志强,等。关联罪责:基于表型的植物磷酸肌醇网络观点。植物学报。2017;68:349-74。
- 82。
Delgado-Cerezo M,Sanchez-Rodriguez C,Escudero V,Miedes E,Fernandez PV,Jorda L等。Arabidopsis杂酰基蛋白调节细胞壁防御和对坏养殖真菌的抵抗力。莫尔植物。2011年。https://doi.org/10.1093/mp/ssr082.
- 83.
Sanchez-Vallet A, Ramos B, Bednarek P, Lopez G, Pislewska-Bednarek M, Schulze-Lefert P, et al.;拟南芥色氨酸衍生的次生代谢物赋予了对坏死性黄瓜菌类的非寄主抗性。植物j . 2010; 63:115-27。
- 84.
Yeats T,Vellosillo T,Sorek N,Ibáñeza,Bauer S.通过一步的两步水解和HPAEC焊盘快速测定植物细胞壁中的纤维素,中性糖和尿酸尿酸。植物理性。2016; 6:E1978。
- 85.
张晓芬,钱德拉R,柏丽斯T,比森RP。基于乙酰溴的快速、微尺度、高通量测定拟南芥木质素含量的方法。中国农业科学(英文版)。
致谢
感谢Ane-Kjersti Vie提供的编程支持,以及Trude Johansen和NTNU PROMEC设施在木质素和植物激素定量方面的帮助。
资金
这项工作得到了Gatsby Adhoc资金支持,以及佩德尔Sather Centre的授权,为T.H.和克里斯·萨默维尔。T.E.通过欧盟Marie Curie奖学金“Sugarosmo-Simbering”和DFG博士后团契(EN 1071 / 1-1)支持。L.K.由博士支持。帝国学院搬运工队伍的奖学金。N.G.-B.通过EEA项目授予Cytowall支持。L.D. and A.W were supported through postdoctoral fellowships provided by the Porter Institute at Imperial College and I.C. by a PhD fellowship provided by the Royal Thai government. Research by A.M. was supported by Spanish Ministry of Economy and Competitiveness (MINECO) grant BIO2015–64077-R. The different funders did not have any role in the design of the study and collection, analysis, and interpretation of data and in writing the manuscript.
作者信息
从属关系
贡献
TE,LK,NGB,LV,SB,EM,AM和TH导致实验设计。TE,LK,NGB,LV,SB,EM,AM,LJ和IC生成数据。TE,LK,NGB,LV,SB,EM,AM和TH共同写了稿件。所有作者都阅读了稿件的最终版本并批准了它。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
所有作者都同意了。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
附加文件
额外的文件1:
表S1。FTIR分析选择的基因概述。表S2。基于DNA微阵列的发布数据集中的23个候选基因的表达分析(Hamann等,2009)。图S1。基于来自Genevestigator数据库的数据的不同细胞类型和植物器官中的23个候选基因的转录物水平的图形表示。图S2。野生型(Col-0)和筛选的所有插入线的平均FTIR谱图表示。(a-c)由Col-0平均谱减去得到的差谱。黑线表示col0衍生的幼苗材料的2x SD。不同颜色的线表示从分析的插入线得到的数据。插入株系表现出相似ftir表型的基因排列在面板中(a-c)。(d) Col-0平均光谱。图S3。描述的WSR本文分别插入行。(a)的转录水平WSR1,(b)WSR2, (C)WSR3(d)WSR4采用qRT-PCR对wsmutant幼苗进行检测。值被归一化为ACT2.并且代表了3个独立实验(N.D .:不可检测)的手段。误差条表示SD,根据学生的T检验,星号表示与COL-0的统计学意义差异(*P.< 0.05;Arunachal Pradesh,P.< 0 01;***P. < 0.001). Gene models indicating positions of T-DNA insertion (triangles) and PCR primers (arrows) are shown below bar charts. Exons are represented by boxes, introns by lines and untranslated regions by dashed lines.图S4。ISX诱导候选突变体的根尖中的瘫痪。幼苗是嘲笑或isx治疗24小时。显示了甘油糖醇染色根的代表性图像。图S5。Col-0和WSR.在两个时间点种植。35 d后收获用于细胞壁分析的材料。图S6。成虫茎中木质素含量WSR.植物。测定了5周龄植物细胞壁制备中乙酰溴化木质素的含量。柱状图表示平均值,误差柱状图表示标准差(N= 4)。(PDF 1450 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Engelsdorf,T.,Kjaer,L.,Gigli-Bisceglia,N。et al。介导细胞壁代谢和植物细胞壁完整性受损反应的基因的功能特征。BMC植物BIOL.19,320(2019)。https://doi.org/10.1186/s12870-019-1934-4
收到了:
公认:
发表:
关键字
- 细胞壁
- 细胞壁的完整性
- 细胞壁代谢
- 电池壁信号
- 植物病原体相互作用
- 生物能源生产