摘要
背景
干旱胁迫是影响植物生长和生产力的主要非生物胁迫之一。的GAPCP.基因在多种植物的耐旱性中起着重要作用。本实验的目的是鉴定植物中可能对干旱胁迫作出反应的核心顺式调控元件GAPCP2和GAPCP3启动子序列。
结果
在这项研究中,启动子GAPCP2和GAPCP3被克隆。通过调控Rluc报告基因的表达,启动子活性在非生物胁迫下显著提高,但启动子序列分析表明,这些片段并不完全相同。其中一个启动子控制GUS报告基因表达的转基因拟南芥中,除种子外,几乎所有组织中GUS的活性都很强,且活性是在非生物胁迫下诱导的。酵母单杂交系统和EMSA显示TaMYB结合TaGAPCp2P/ 3.通过分析这些启动子的不同5′缺失突变体,确定TaGAPCp2P(−1312~−528)和TaGAPCp3P( - 2049〜610),包括MyB结合位点,含有增强子元素,这些增强元素增加了干旱胁迫下的基因表达水平。我们使用效应和记者进行共同转化烟草,发现Tamyb与特定的MyB结合位点相互作用TaGAPCp2P(−1197~−635)和TaGAPCp3P(− 1456~ − 1144及 − 718~ − 然后,Y1H系统和EMSA分析证明这些MYB结合位点在TaGAPCp2P( - 1135和 - 985)和TaGAPCp3P( - 1414和-665)是Tamyb的靶标元素。删除启动子片段中的特异性MyB结合位点显着抑制干旱反应,这些结果证实这些MyB结合位点(AACTAAA / C)在改善干旱胁迫下的转录水平方面发挥着重要作用。小麦原生质体的QRT-PCR瞬时过度表达的结果Tamyb.表明tagapcp2 / 3.诱导非生物胁迫是由TaMYB上调。
结论
的MYB结合位点(AACTAAA / C)在TaGAPCp2P /3.P被鉴定为响应干旱胁迫的关键顺式元件,并与转录因子TaMYB结合。
背景
甘油醛-3-磷酸脱氢酶是糖酵解第6步的关键酶,广泛存在于各种生物细胞中[1.].酶是由GAPDH.基因在细胞中具有重要功能[2.,3.].在植物中,GAPDH通常分为磷酸化和非磷酸化两种形式。磷酸化的GAPDH按其在细胞中的分布可分为GAPA/B、GAPC和GAPCp,其中GAPCp存在于非绿色质体中。研究表明AtGAPCp可能在拟南芥ABA信号通路中发挥重要作用[4.].缺乏GAPCP.在植物中可能破坏主要代谢产物的合成,如碳和氮代谢,甘氨酸和谷氨酰胺[5.].突变在GAPCP.基因导致磷酸三糖转运体(TPT)代谢异常[6.].之一的GAPCp的重要功能是提供一种用于在异养胞质合成代谢途径[提供3-磷酸甘油酸(3-PGA)7.].这些结果表明,胁迫诱导GAPCp可以在非生物胁迫响应和信号通路中发挥关键作用。我们已经确定了五个GAPCp的cDNA小麦,并且它们的表达干旱胁迫下被诱导[8.].但是,完整的监管机制治理GAPCP.干旱胁迫下的表达还远远不为人所知。
由于基因表达模式受启动子调控,因此确定启动子中的顺式作用元件非常重要[9].启动子是结构基因5 ' -侧翼区域上游的一个DNA序列,能够特异性识别并结合RNA聚合酶,RNA聚合酶通过结合转录因子的特异性识别位点调控下游基因的表达[10.].鉴定与特定转录因子结合的顺式作用元件可以揭示参与环境适应过程的转录调控机制和基因表达模式[11.].研究表明,通过在缺失一些启动子元素后检测到Gus报道基因的表达强度,可以令人满意地确定拟南芥HSP26启动子对高温和非生物应激的响应[12.]拟南芥AtNCED3基因启动子中重复的5′-CACGTG-3′序列被证实是该基因应对干旱胁迫的重要顺式作用元件[13.].最近,在小麦中发现了与干旱相关的调控因子,包括TaRZF38/70/59/74、PIMP1 (MYB转录因子)、TaERA1/ERF3、TaSnRK2.4/2.8、TaWRKY2/9和TaNAC2a [14.,15.,16.,17.,18.].其中,MYB蛋白是一个大型的转录因子系列,其在生长和对环境压力的反应中具有不同的功能[19.,20.,21.].
MyB通过结合其响应元素来对植物管调节基因进行调节至关重要作用[22.]AtMYB在拟南芥的耐旱和耐盐性中也起着重要作用[23.,24.].在米饭中,表达了OsMYB2通过冷,干旱和盐胁迫[诱导25.].GBMYB5将棉花的响应增加到干旱胁迫[26.].在小麦,几个MYB鉴定了参与各种干旱反应的基因[27.]和转基因拟南芥植物过表达Tamyb.与野生型相比具有增加的耐干旱[28.].
在本报告中,我们克隆并分析了启动子区域TaGAPCp2和TaGAPCp3基因。在转基因拟南芥中,GUS基因的活性受GUS基因驱动TaGAPCp2和TaGAPCp3在干旱胁迫下显着诱导启动子。酵母单杂交文库筛查确定了一种相互作用的转录因子,并且之间的相互作用TaGAPCp2P/ 3.通过酵母环曲调和电泳迁移率移位(EMSA)进一步证实了P和TamyB。通过分析序列和一系列缺失突变体,我们确定了两种MYB结合图案TaGAPCp2和TaGAPCp3启动子是响应干旱胁迫的关键顺式作用元件。
结果
克隆及序列生物信息学分析Tagapcp.3 2 p / p
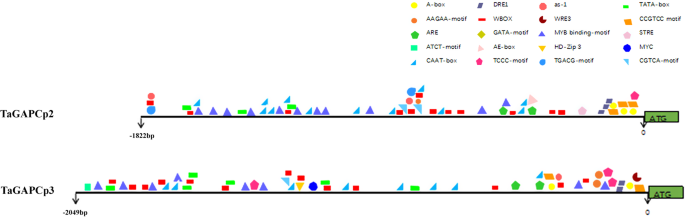
1822年的BPTaGAPCp25'监管区和2049年 英国石油公司TaGAPCp3通过PCR获得5 '调控区域,克隆到PGEM-T Easy载体上进行测序。我们利用Plant cis-acting elements(植物顺式作用元件)数据库在这两个基因的启动子区域中寻找假定的顺式作用元件。http://www.bioinformatics.psb.ugent.be/webtools/plantcare/html/)和植物顺式作用调控DNA元件(PLACE;http://www.dna.affrc.go.jp/PLACE/)[29.].在这两个基因的启动子区域都识别出许多对干旱和ABA反应的调控元件,包括ABA反应元件(ABRE)、脱水反应元件(DREs)、W-box元件以及MYB和MYC结合序列。此外,还识别出赤霉素反应元件(GARE)。1.,附加文件1.;图S1)。
活性检测TaGAPCp2P/ 3.通过农杆菌介导的瞬时表达分析
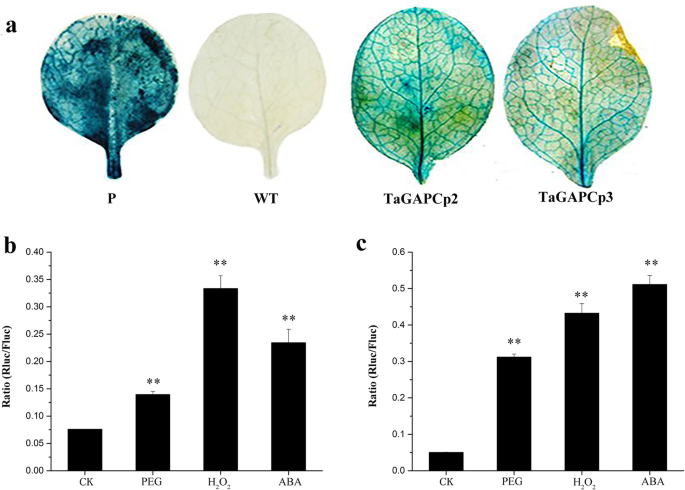
将启动子区域融合到Gus报道载体中以检测其在烟草叶中的活性。进行组织化学测定,结果如图2所示。2.A,揭示了转基因烟草叶中的GUS活性。除了野生型叶子之外,所有烟草叶子都染色了蓝色,这表明了这一点TaGAPCp2P/ 3.在检测启动子活性时,双荧光素酶报告载体比单荧光素酶报告载体更准确可靠TaGAPCp2P/ 3.与对照相比,在水分胁迫下,通过Fluc表达归一化的P结构体显著增加(图2)。2.b,c)。
启动子报告质粒的构建与拟南芥的转化
在用1301-Tagapcp2P / 3p转化的拟南芥中检测潮霉素和启动子的表达,但在野生类型中没有观察到表达(附加文件2.:图S2)。这些结果证实了转化后表达转基因。
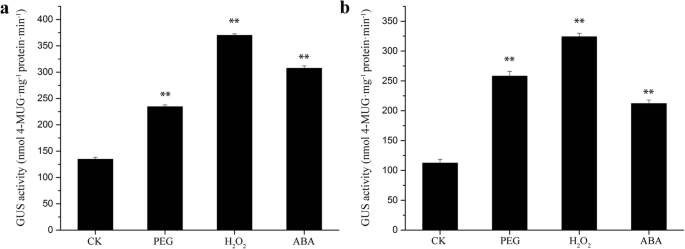
转基因拟南芥植株的组织化学染色研究TaGAPCp2P /3.P产生的启动子活性的(一个全株透视图。3.).在15天举行的拟南芥植物中,在整个植物中存在强大的GUS表达。Gus表达在根和叶子中比标题阶段植物的其他部分更高。在SILIQUES中,GUS表达存在于豆荚中,但不在豆荚内的种子中。在两周的转基因拟南芥植物中,GUS活动TaGAPCp2P/ 3.非生物处理24 h后,P均显著升高(图;4.).为TaGAPCp2P/ 3.P,GUS活动在PEG处理后增加1.8倍和2.1倍。H.之后2.O2.处理后,GUS活性增加TaGAPCp2P/ 3.P含量诱导的2.9倍和2.7倍和ABA处理后的GUS活性TaGAPCp2P/ 3.P分别诱导到2.4倍和1.7倍。这些结果表明TaGAPCp2P/ 3.P可能有一些有意义的干旱相关顺式元件。
tagapcp2 / 3.可以积极应对转基因拟南芥植物中的干旱胁迫
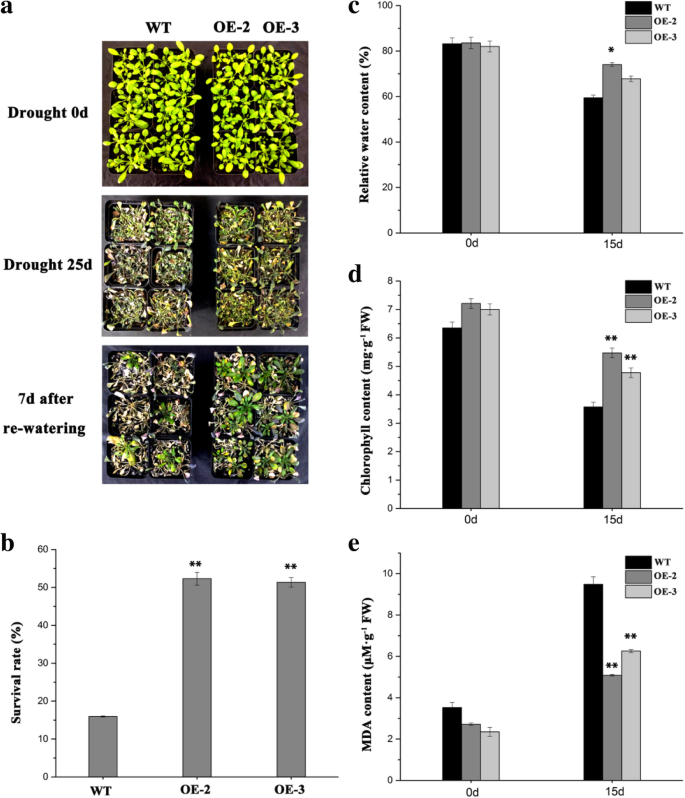
确定tagapcp2 / 3.基因对于干旱胁迫耐受性很重要,我们评估转基因拟南芥植物中的干旱应激反应过表达tagapcp2 / 3.基因对强度35s启动子的控制。将三周的转基因和WT植物幼苗进行水分胁迫25天。我们发现,WT植物对干旱胁迫更敏感,而不是转基因系过表达TaGAPCp2和TaGAPCp325天后扣水(图。5.a,b)。相对含水量(RWC),用于测量干旱耐受性的相关工具,允许对植物水位的可信评估。总叶绿素含量反映了萎缩的存在或不存在。转基因系中的RWC和叶绿素的含量也高于15天扣用水后的WT中的含量(图。5.c, d)。膜损伤的重要指标丙二醛(MDA)在保留水分15天后显著高于转基因株系,表明转基因植株的膜损伤程度低于野生型(图2)。5.e).这些结果表明,TaGAPCp2和TaGAPCp3对干旱胁迫均有正响应。
拟南芥对干旱胁迫的响应一种TaGAPCp2-过表达(OE-2)和TaGAPCp3-过表达(OE-3)品系对干旱胁迫的耐受性反应。干旱25d:保水25d;R7d:保水25d后恢复水分7d。B.在扣留水后,TagapCP2过表达(OE-2)和TagapCP3-过表达(OE-3)转基因系(OE-3)转基因系和WT植物的存活率在扣留水后,在水中恢复水25d。每条线计算并平均至少100种植物。C保留水分15d后WT和转基因系的RWC。D.WT和转基因品系蓄水15 d后叶绿素含量变化。E.WT和转基因品系隔水15d后MDA含量变化。误差条指示±SD (N = 3, from three technical replicates). Significant differences were assessed with one-sided paired t-tests (*,P< 0.05;Arunachal Pradesh,P< 0.01)。进行了三次生物实验,得出了相似的结果
TaMYB与TaGAPCp2P /3.P
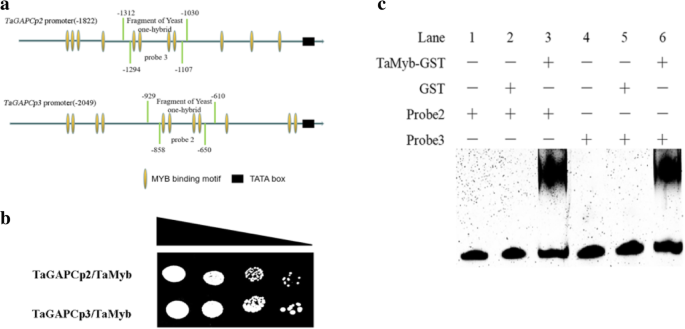
为了进一步了解转录调节机制,构建了一些Y1H报告构建体以筛选麦叶cDNA文库以获得转录因子。此屏幕表示Tamyb可以绑定到TaGAPCp2P/ 3.P.如图1所示。6.B,诱饵载体的CoTrAssformation(Tagapcp2p / 3p在pabai)与鉴定的交流剂(pGadt7中的蛋白质中的单独猎物载体相同,进入Y1H金酵母的相互作用。
为了确定TaMYB蛋白是否直接绑定到TaGAPCp2P/ 3.P在体外,启动子片段包括约30 bp的结合位点作为EMSA的探针(图。6.一种)。结果表明,Tamyb可以直接与启动子片段结合,并清楚地证明转录因子Tamyb可以直接结合TaGAPCp2P/ 3.P,并影响转录水平(图。6.b) 。
TaMYB与一个特定的结合位点相互作用以提高基因的转录水平TaGAPCp2P/ 3.干旱胁迫下的磷
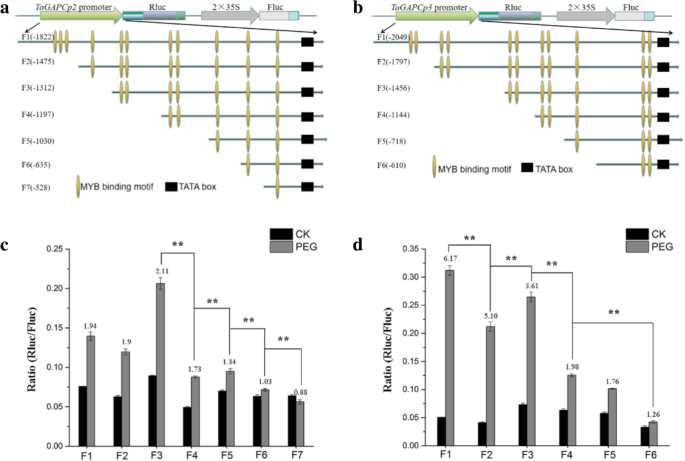
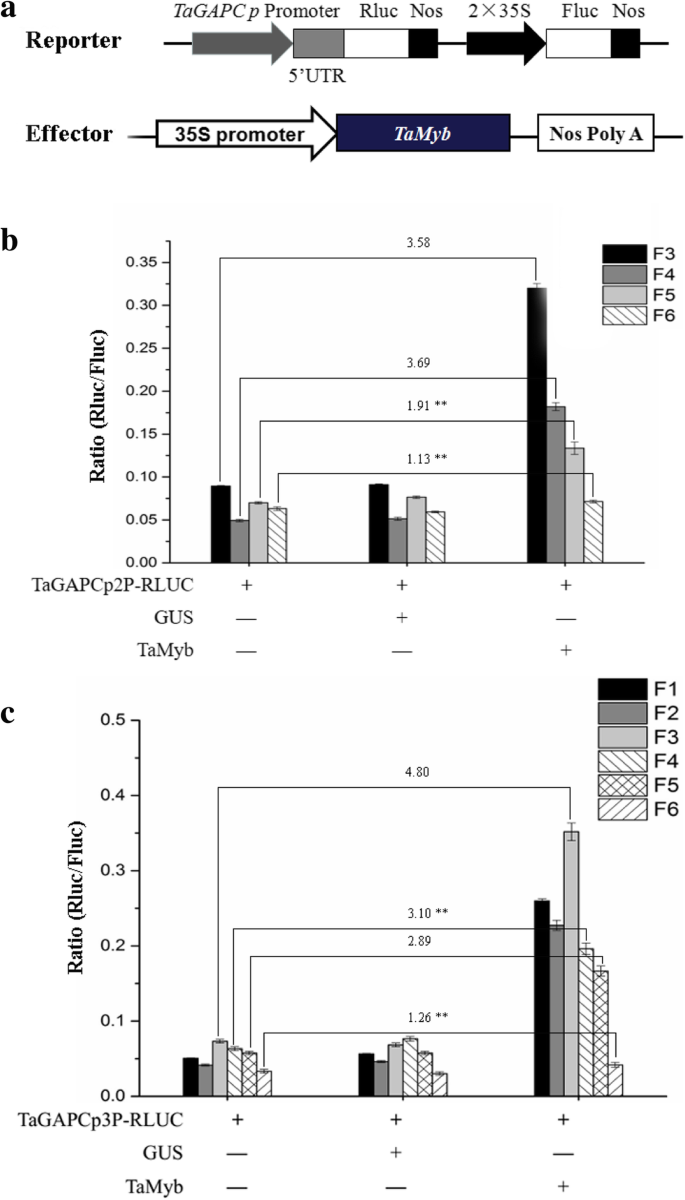
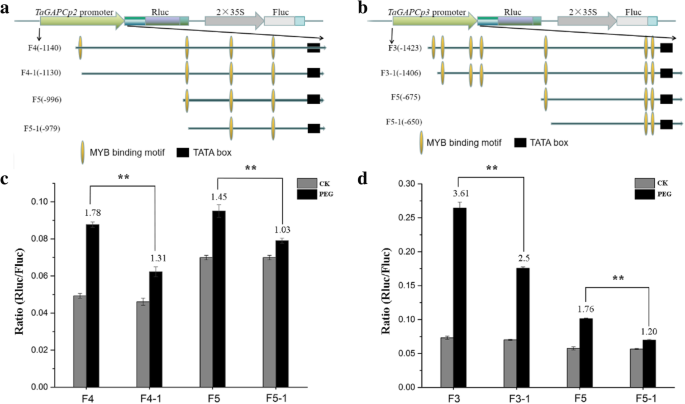
进一步验证Tamyb的贡献tagapcp2 / 3.’的转录水平,一系列的载体与5’删除TaGAPCp2P/ 3.P片段,并检测干旱胁迫后Rluc/Fluc的相对表达(图。7.a, b). 20% PEG 8000处理24 h后,5 ' -序列缺失驱动的Rluc的相对酶活性有显著差异TaGAPCp2P/ 3.P.图7.C表示碎片TaGAPCp2P(−1312~0);7.C表示碎片TaGAPCp3P(− 2049~0)中含有与干旱相关的顺式成分。
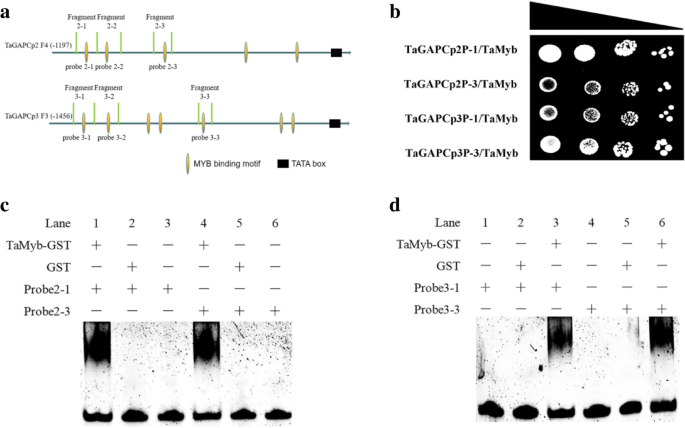
为了进一步探讨上述片段中的MyB结合位点可以通过TamyB结合,我们使用效应器和记者瞬间Cot转移烟草(图。8.一种)。我们发现Tamyb与特定的MyB结合位点相互作用TaGAPCp2P(−1197~−635)和TaGAPCp3P( - 1456〜 - 1144和-718〜610)在植物细胞中(图。8.b、 Y1H系统和EMSA证明MYB结合位点在TaGAPCp2P( - 1135和 - 985)和TaGAPCp3P( - 1414和-665)是Tamyb'靶顺式元素(图。9).通过缺失此类位点进一步评估与转录活性相关的MyB结合位点(图。10.一种)。删除启动子片段中的MyB结合位点全部抑制促进助力的促进剂活性(图。10.c、 这证实了这些MYB结合位点TaGAPCp2P( - 1135和 - 985)和TaGAPCp3P(− 1414和 − 665)在干旱条件下提高转录水平方面发挥了重要作用。MYB结合位点在TaGAPCp2P( - 1135和 - 985)和TaGAPCp3P( - 1414和-665)是全部5'-AACTAAA / C-3'序列,不同于其他MBS。这些结果证实,5'-AACTAA / C-3'序列是TamyB的特定目标顺式元素(附加文件4.:图S4)。
表达tagapcp2 / 3.在ABA信号通路中受TaMYB调节
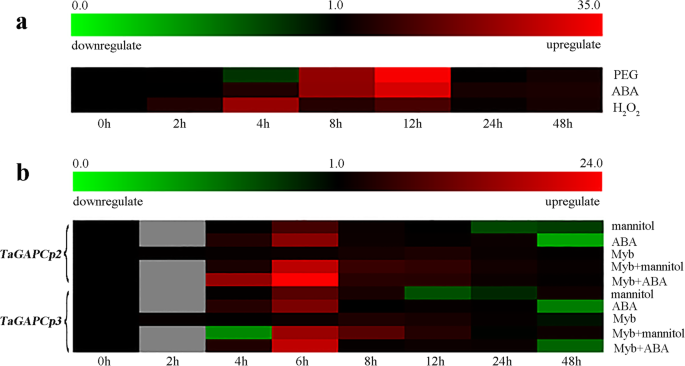
相似tagapcp2 / 3.的转录水平Tamyb.对非生物胁迫的小麦应答(10mm H2.O2., 100 μM ABA和20%PEG8000)(图。11.一个)的表达Tamyb.PEG和ABA处理后8 h,诱导量分别为34.26倍和29.83倍。Tamyb.2周后表达增加5.52倍 h中的h2.O2.处理4 h后达到最高水平(21.33倍),随后下降(图2)。11.a).这表明两者tagapcp2 / 3.和Tamyb.可能参与了应激相关的信号通路。调查是否Tamyb.也参与了ABA诱导的上调表达的表达tagapcp2 / 3.,小麦原生质体中瞬时过量表达Tamyb.在小麦原生质体中过度表达Tamyb.,相对表达tagapcp2 / 3.显著高于对照组(图。11.b) 。此外,还增强了对照原生质体中的Tagapcp2 / 3表达(最高水平的13.36倍和12.16倍)的表达的增加也增强了Tamyb.基因ABA胁迫下(图(23.98倍和18.42倍的最高水平)。11.b) 。这些结果表明了Tamyb.基因在aba诱导的表达上调中起关键作用tagapcp2 / 3..
讨论
干旱胁迫信号在植物体内经过转导等过程,最终引起转录因子积累和活性的变化[30.,31.,32.].相关转录因子与基因启动子上的特定顺式作用元件结合,诱导表达与干旱胁迫耐受性相关的[33.,34.,35.].在我们以前的工作中,人们发现TaGAPCp2和TaGAPCp3在干旱胁迫下表达模式不同,但两个基因在耐旱性方面具有相似的功能。为了进一步研究这些发现,我们克隆并分析了其启动子TaGAPCp2和TaGAPCp3基因。生物信息分析表明,这两个候选基因启动子中的顺式作用基序存在差异,提示它们的调控存在一定差异。
为了详细研究这两个启动子,tagapcp2p.和tagapcp3p.亚克隆至pC0390-GUS载体和pC0390-RUC载体,瞬时转化烟草植株。GUS染色和Rluc比值表明其活性TaGAPCp2和TaGAPCp3启动子可以由PEG,ABA和H诱导2.O2.压力。同时,Gus染色和GUS酶活性的拟南芥植物转化TaGAPCp2P:格斯和TaGAPCp3P:格斯分析不同启动子在非生物胁迫下的表达模式。组织的活动TaGAPCp2和TaGAPCp3在正常条件下启动子几乎相同,并且在干旱胁迫下它们都具有更强的活性(图。4.).这可以被认为是支持GAPCP.干旱响应[36.].对于作物来说,种子是人类的关键产品。随着植物基因工程技术的发展,保护种子不受潜在的遗传污染变得越来越重要。在这项工作中,我们发现TaGAPCp2和TaGAPCp3除种子外,几乎所有组织都有较强的活性。这可能有助于在作物基因工程中的应用。
在转录水平上对基因表达的调控主要由启动子及其顺式作用的调控元件控制[37.,38.].酵母单杂化技术是研究DNA和蛋白质之间的相互作用的经典方法,并允许有效分离和鉴定结合特异性DNA序列的蛋白质[39.,40].相互作用蛋白质TA.MYB的TaGAPCp2P / 3 p通过酵母单杂交系统获得,并通过EMSA分析进行准确验证。自然,在细胞表面发现了许多MYB结合位点tagapcp2 / 3.启动子。早些时候的几份报告说明了TA.MYB抗旱性[41.,42.,43.].在小麦中,TagamyB可能参与热应激反应[44., TaMYB2A增强转基因拟南芥对非生物胁迫的耐受性[45.].Tamyb73通过调节应激响应基因的调节涉及盐度耐受性[42.].与这些报告类似,在小麦,转录水平Tamyb.也增强了对非生物胁迫的反应(图。11.一种)。因此,5'缺失突变体,并且Y1H和EMSA测定法用于确定MYB结合位点,可能的约束TA.MYB与干旱有关。MYBR顺式元件TAACTA/G型被拟南芥MYB96特异性识别,也可能对小麦具有特异性[46.]HvGAMyb与含有胚乳特异基因启动子区5′-TAACAAC-3′和5′-caactac-3′序列的寡核苷酸结合,以调节胚乳发育过程中的基因表达[47.].这项工作表明,TaGAPCp2P(−1135和−985)和TaGAPCp3P(−1414和−665)中的5 ' -AACTAAA/C-3 '型MYB结合位点被TaMYB特异性识别,TaMYB是R2R3-MYB亚家族成员,与AtMYB91(AT2G37630.1)相关[48.)(附加文件3.:图S3,附加文件4.:图S4)。
结论
本研究表明,转录因子MYB可以诱导tagapcp2 / 3.通过与启动子上的MYB结合位点(5′-AAAA/C-3′)结合,从而增强植物在干旱胁迫下的抗性tagapcp2 / 3.基因是响应水稻中的干旱和相关的非生物胁迫,可以是改善作物用水效率和未来生物量生产的候选者。
方法
植物材料及处理
小麦 (普通小麦L.cv。中国春)、烟草(尼科尼亚塔哈瓦姆cv.NC89)和拟南芥(哥伦比亚生态型)种子用于本研究。种子由生命科学学院D209实验室提供。种子经表面消毒,然后于16/8时在温室中培养 h(亮/暗,22/20 摄氏度)。
处理小麦幼苗时,将10日龄的小麦幼苗移入含20% PEG8000的培养皿中,10 mM H2.O2.100 μM ABA溶液处理24 h。处理后的样品(PEG8000, H2.O2.ABA在0,2,4,6,8,12和24 h) 植物被冷冻在液氮中,并储存在低温下− 80 °C进行RNA分离。同时,在正常条件下生长的10天龄小麦幼苗作为对照。所有实验至少重复三次。
对于渗透烟草植株叶片的非生物处理(注射重组质粒),渗透烟草植株喷洒20%PEG8000溶液、100μm ABA和10μm ABA 嗯2.O2..非生物胁迫处理24 h后,将处理后的叶片样品在液氮中冷冻后,置于−80℃保存,直至荧光素酶活性检测。所有的实验都至少重复三次。
野生型和转基因拟南芥株系过度表达TaGAPCp2和TaGAPCp3被用于耐旱性分析。的seeds were sown on 1/2MS medium containing 30 μg/mL hygromycin for 1 week at 23 °C under a 16 h light/8 h dark cycle. Seedlings in similar at growth states were then transplanted into containers filled with soil and watered regularly for 2 weeks. Three-week-old plants were subjected to water withholding for 25 days. One hundred seedlings from each line or control were used to detect survival after 25 days of detained water. After 15 days of withholding water, fresh seedlings were harvested to measure the contents of Relative water content (RWC), chlorophyll and Malondialdehyde (MDA).
RNA提取及qRT-PCR分析
用来自小麦幼苗的Trizol萃取总RNA,并使用Primescript TM RT试剂盒(Takara,Japan)转化为cDNA。用干旱胁迫挑战治疗小麦播种(PEG 8000,ABA和H.2.O2.),在特定的EST的表达TaGAPCp2和TaGAPCp3通过使用SYBR®预混料Ex Taq进行的qRT PCR确定基因家族™ (Tli RNaseH Plus)(日本TaKaRa)根据制造商关于Bio-Rad CFX96系统的说明(美国Bio-Rad实验室)。引物(TagaCP2/3-F和TaGAPCp2/3-R,附加文件5.:在定量RT-PCR使用表S1)具有很强的特异性,通过琼脂糖凝胶电泳确定,并且还通过测序所有的引物对扩增的PCR产物确认。平均表达和标准偏差(SD)是从三次独立实验的结果计算。数据分析和如先前所述进行定量[49.].
隔离与生物信息学分析TaGAPCp2P/ 3.P
根据小麦品种AOTI010005895.1的序列,设计了用于启动子克隆的引物tagapcp2 / 3.基因。上游序列tagapcp2 / 3.由名为2PF / R和3PF / R的引物扩增基因(附加文件5.:表S1),命名为TaGAPCp2P/ 3.P.纯化PCR产物并克隆到PEASY-T1载体中。使用植物护理数据库测序并分析每种反应的几个克隆(http://www.bioinformatics.psb.ugent.be/webtools/plantcare/html/)[29.]和PLACE(http://www.dna.affrc.Go.jp/PLACE/).
柴油机瞬态活性分析TaGAPCp2P/ 3.p在烟草
检测TaGAPCp2P/ 3.P,我们通过使用PC0390-GUS向量和PC0390-RUC向量作为主框架构建了Fusion表达向量。TaGAPCp2P/ 3.P被克隆到载体pC0390 GUS(位于GUS报告基因之前)和pC0390 RUC(位于Rluc报告基因之前)中以产生重组质粒。通过农杆菌介导的瞬时检测将这些融合构建体转移到烟草中。CaMV35S启动子用作阳性对照。
如前所述,通过组织化学分析测定GUS活性[50.].GUS活性被标准化为蛋白质浓度,并表示为Nmol 4-甲基 - Belliferone / min * mg蛋白。GUS测量至少重复三次。组织化学测定转基因植物叶以根据杰斐逊与微小修改描述的染色程序来确定GUS活动[51.].简而言之,在GUS反应缓冲液中孵育样品(50mM Na3.宝4., pH 7.0, 2 mM X-gluc, 0.5 mM K3.菲[CN]6.,0.5 mm k4.菲[CN]6.,10. mM EDTA, and 0.1% Triton X-100) for 24 h at 37 °C. Stained tissues were incubated in 70% ethanol at 37 °C for 6 h to remove chlorophyll and then rinsed in 90% ethanol at 37 °C for 10 h. Finally, GUS histochemical staining was observed under a microscope. Firefly luciferase and renilla luciferase were assayed using the dual luciferase assay reagents (Promega, USA). Data were collected as the ratio of LUC/REN. All transient expression experiments were repeated three times. The data were analyzed using SPSS12.0 software.
转基因拟南芥的产生和压力处理
的长篇TaGAPCp2P/ 3.利用特异性引物Ta1301-2/3F和Ta1301-2/3R进行PCR扩增。然后,扩增产物被克隆到载体中pCAMBIA1301并位于Gus报道基因面前。得到的质粒分别用于农杆菌介导的转化(农杆菌肿瘤术)以获得转基因拟南芥株系。转化植株在含30 mg/L潮霉素和0.8%琼脂的1/ 2ms培养基上22℃培养2周后转入土壤。
利用转基因株系T3纯合子种子进行GUS活性分析。将拟南芥种子置于1/2 MS琼脂板上生长,琼脂板常规于4℃黑暗保存3天以打破休眠状态,然后转移至22℃的组织培养室。在非生物胁迫下,将2周龄的幼苗单独转移到含有20% PEG 8000、100 uM ABA和10 mM H的1/2 MS琼脂平板上2.O2.24小时 h、 来自处理过的或对照过的植物的样本在液氮中冷冻,并储存在低温下− 80 °C,直到检测到GUS活性。所有实验至少重复三次。
酵母单杂交筛选和电泳迁移率转移分析(EMSAs)
的片段TaGAPCp2P/ 3.将P克隆到质粒pAbAi(日本TaKaRa)中以筛选cDNA文库,并根据制造商的说明(Matchmaker One Hybrid system;Clontech Laboratories Inc.,Palo Alto,CA,USA)在20%的浓度下对cDNA文库进行筛选 mM奥瑞巴西丁A(AbA)。
总共100ng的30bp双链探针和1μg纯化TA.MYB用于EMSA反应。在室温孵育40分钟后,将样品装入6%的天然聚丙烯酰胺凝胶中。然后,用Invitrogen™SYBR™安全DNA凝胶染色,并用Bio-Rad凝胶文件系统成像,以检测DNA。
可用性数据和材料
支持本文结论的数据集包含在本文及其附加文件中。
改变历史记录
2020年12月21日
本文已被撤回。详情请参阅撤回通知:https://doi.org/10.1186/s12870-020-02782-w。
缩写
- 3-PGA:
-
3-磷酸
- 上:
-
ABA-responsive元素
- DRES:
-
脱水响应元件
- emsa:
-
电泳迁移率移位测定
- 美国人:
-
萤火虫荧光素酶
- GAPCP:
-
非绿塑体中的甘油醛-3-磷酸脱氢酶
- GAPDH:
-
甘油醛-3-磷酸脱氢酶
- 加:
-
吉布林素响应元素
- MYB:
-
MYB转录因子
- 定量RT-PCR:
-
定量实时聚合酶链反应
- rluc:
-
雷农荧光素酶
- TPT:
-
磷酸丙糖转运蛋白
- Y1H:
-
酵母单杂交
参考
- 1。
Nicholls C,Li H,Liu JP。GAPDH:具有罕见功能的常见酶。Clin Exp Pharmacol physiol。2012; 39(8):674-9。
- 2。
辛格,绿色先生。通过甘氨醛-3-磷酸脱氢酶序列特异性RNA转移RNA。科学。1993年; 259(5093):365-8。
- 3.
曾H,谢Y,刘G,林d,他C,木薯亮点施H.分子鉴定GAPDHs的MeGAPCs和MeATG8s在植物抗病抗木薯白叶枯病的拮抗作用。植物mol biol。2018; 97(3):201-14。
- 4.
JesúsM-B,Borja C-M,AsunciónI-S,Isabel M,Adriano N-N,Alisdair RF,Juan S,Roc R.Plastivial甘油醛-3-磷酸脱氢酶对拟南芥的可行花粉发育至关重要。植物理性。2010; 152(4):1830-41。
- 5。
Anoman AD,JesúsMB,Sara Rt,Maríaft,Ramóns,Eduardo B,Fernie Ar,Juan S,Roc R.plastivial糖酵解甘油糖醛糖醛酸糖醛酶是拟南芥异养细胞碳和氮代谢的重要决定因素.植物理性。2015; 169(3):1619-37。
- 6。
Anoman AD,Flores Tornero M,Rosa Telléz S,Muñoz Bertomeu J,Segura J,Ros R.通过甘油醛-3-磷酸脱氢酶的研究对光合和异养细胞中质体糖酵解的特殊作用进行了详细研究.植物信号行为.2016;11(3):e1128614。
- 7.
Flores-Tornero M,Anoman Ad,Sara Rt,Toujani W,Weber APM,Eisenhut M,Kurz S,Alseekh S,Fernie AR,JesúsMB。磷酸三糖磷酸酯(TPT)的过表达补充了质量代谢和产量甘油糖醛醛-3-磷酸脱氢酶突变体的异常代谢和发育。植物J细胞摩尔Biol。2017; 89(6):1146-58。
- 8.
曾L,邓R,郭Z,杨氏,邓X.基因组鉴定与甘油醛-3-磷酸脱氢酶基因家族(Triticum Aestivum)的鉴定与表征。BMC基因组学。2016; 17(1):240。
- 9.
歌曲S,徐y,黄D,苗族,刘j,jia c,hu w,valarezo av,xu b,jin z.鉴定Banana Aquaporin家族基因(Matip1; 2)的新型启动子转基因拟南芥盐胁迫。植物理性生物化学。2018; 128:163-9。
- 10。
徐峰,黄晓辉,李丽丽,邓刚,程辉,荣晓峰,李建斌,程少英。银杏GbDXS和GbGGPPS基因启动子的克隆与鉴定。中国生物医学工程学报。2013;12(1):293-301。
- 11.
郭H,王L,杨C,张Y,张C,王C.鉴定BPLMYB46涉及非生物应激反应和次壁沉积的新型顺式元素。J Intent Plant Biol。2018; 60(10):1000-14。
- 12.
小麦叶绿体sHSP26启动子在转基因拟南芥中具有热和非生物胁迫诱导表达的功能。《公共科学图书馆•综合》。2013;8 (1):e54418。
- 13。
Babak B,Satoshi I,Miki F,Yasunari F,Hironori T,Yuriko O,Kazuko YS,Masatomo K,Kazuo S.参与脱水诱导转录的9-顺式环氧类胡萝卜素双加氧酶的拟南芥基因启动子区域的特征。DNA Res.2013;20(4):315–24。
- 14。
Manmathan H,Shaner D,Snelling J,Tisserat N,Lapitan N.小麦中拟南芥基因同源物的病毒诱导基因沉默鉴定了提高抗旱性的基因。J Exp Bot.2013;64(5):1381-92。
- 15.
黄志刚,王志刚,王志刚。干旱、盐碱和霜冻对植物生长的影响。植物保护学报。生物技术学报。2003;14(2):194-9。
- 16。
Kam J,Gresshoff P,较短R,Xue GP。环锌指基因的表达分析普通小麦和鉴定含有四个环H2结构域并对叶和根之间的水分亏缺做出差异反应的TaRZF70。植物科学。2007;173(6):650–9。
- 17。
唐y,刘米,高,张z,赵x,zhao c,张f,陈x。小麦新芽基因的分子表征坦克2a吐痰胁迫耐旱性。physiol植物。2012; 144(3):210-24。
- 18.
牛景福,魏伟,周庆y,田阿格,郝YJ,张WK,马B,林Q,张ZB,张JS。小麦WRKY基因TaWRKY2和TaWRKY19调节转基因拟南芥植物的非生物胁迫耐受性。植物细胞环境。2012;35(6):1156-70。
- 19.
Ryoung S,Burch Ay,Huppert Ka,Tiwari SB,Murphy As,Guilfoyle TJ,Schachtman DP。拟南芥转录因子MyB77调节植物素信号转导。植物细胞。2007; 19(8):2440-53。
- 20。
基督教d,何LG,安托B,贡纳尔H,的Elodie L,伊莎贝尔d,让马克R,亚历山德罗A,贝恩德W,Lepiniec L. MYBL2是在拟南芥类黄酮生物合成的新调节剂。植物杂志2008; 55(6):940-53。
- 21。
Kwon Y,Kim Jh,Nguyen Hn,Jikumaru Y,Kamiya Y,Hong SW,Lee H.一种新建的拟南芥MyB样转录因子,MyBH,通过增强疾病累积来调节胚囊伸长。J Exp Bot。2013; 64(12):3911-22。
- 22。
在拟南芥和水稻中进行的生物信息元素分析揭示了bZIP-和myb相关结合位点作为生长素介导的转录中潜在的auxre耦合元件。植物学报。2012;12(1):125。
- 23。
芮X,王Y,郝Z,魏L,吴C,黄J,康Y,杨G,郑C。盐诱导转录因子MYB74在拟南芥中受RNA导向的DNA甲基化途径调控。J Exp Bot.2015;66(19):5997–6008。
- 24。
AtMyb41调节拟南芥对渗透胁迫的转录和代谢反应。植物杂志。2009;149(4):1761 - 72。
- 25。
杨娜,戴X,张华。一个R2R3型MYB基因OsMYB2与水稻耐盐、耐寒和耐脱水性有关。实验学报。2012;63(7):2541-56。
- 26。
陈婷,李伟,胡X,郭杰,刘甲,张乙。棉花MYB转录因子GbMYB5与植物对干旱胁迫的适应性反应呈正相关。植物细胞生理学。2015;56(5):917-29。
- 27。
赵y,cheng x,liu x,wu h,bi h,xu h.小麦Myb转录因子Tamyb31参与拟南芥的干旱应激反应。前植物SCI。2018; 9:1426。
- 28。
唐y,bao x,zhi y,wu q,gu y,yin x,zeng l,li j,张j,他w等。MYB家族基因,OSMYB6的过度表达增加了转基因水稻的干旱和盐度胁迫耐受性。前植物SCI。2019; 10:168。
- 29。
Magali L,Patrice D,Gert T,Kathleen M,Yves M,Yves Vdp,Pierre R,Stephane R. Plantcare,植物CIS作用调节元件的数据库和用于启动子序列的硅分析的工具的门户网站。核酸RES。2002; 30(1):325-7。
- 30.
巴尔多尼E,真加A,Cominelli E.植物MYB转录因子:其在干旱响应机制的作用。诠释J分子科学。2015; 16(7):15811-51。
- 31.
熊L,朱杰克。植物中非生物应激信号转导:分子和遗传观点。physiol植物。2010; 112(2):152-66。
- 32。
赵XB,闫CX,张H,王继,春娟,谢HF,山SH。干旱胁迫下花生(阿拉氏血吸虫)中转录因子家族的差异表达。JAgric Biotechnol。2018; 26(7):1143-54。
- 33。
Shinozaki K., Shinozaki K.转录调控网络的细胞反应和耐受脱水和冷胁迫。植物学报。2006;57(57):781-803。
- 34。
魏伟G,华y,永强湖,玉娇g,中福,慧鲁p,明明x,zhaorong h,齐鑫S,yingyin Y.小麦转录因子Tagamyb rencuits rencuits乙酰转移酶并激发高分子量氨基丁蛋白的表达亚基基因。工厂J. 2015; 84(2):347-59。
- 35。
pcc13 -62启动子的分析预测了Linderniaceae中元素变异和脱水耐性之间的联系。J Exp Bot. 2018;69(15): 3773-84。
- 36。
Munoz-Bertomeu J,Cascales-Minana B,Mulet J,Baroja-Fernandez E,Pozueta-Romero J,Kuhn J,Segura J,ROS R.Plastiveraldehy-3-磷酸脱氢酶缺乏导致根部发育改变并影响糖和影响糖和影响糖拟南芥氨基酸平衡。植物理性。2009; 151(2):541-58。
- 37。
Azimi-Nezhad M,Mirhafez SR,Stathopoulou Mg,Murray H,Ndiaye NC,Bahrami A,Varasteh A,Avan A,Bonnefond A,Rancier M.血管内皮生长因子顺式和转作遗传变异和代谢综合征之间的关系.我是J MED SCI。2018; 355(6):559-65。
- 38。
Mithra Sva,Kulkarni K,Srinivasan R.植物启动子:转基因技术的表征和应用;2017年。
- 39。
Shu-ying F,Kazuhisa O,Takashi I.一种酵母单杂交系统,用于筛选甲基化DNA结合蛋白。核酸RES。2010; 38(20):E189。
- 40.
李志强,李志强,康世东,李志强。高通量酵母单杂交筛选的新型细胞表面荧光素酶报告。核酸学报2017;45(18):e157。
- 41.
李克,邢吨,姚Z,黄X.PBRMYB21,一种Pyrus betulaefolia的新型MyB蛋白,通过调节精氨酸脱羧酶基因来调节多胺水平的作用。植物Biotechnol J. 2017; 15(9):1186-203。
- 42.
何颖,李伟,吕军,贾勇,王敏,夏光。小麦MYB转录因子TaMYB73基因的异位表达对拟南芥耐盐性的影响。中国生物医学工程学报。2012;63(3):1511-22。
- 43.
李俊杰,余强,李玉强,史志林,南正,毕春林,郭建军。普通小麦R2R3-MYB转录因子基因(即TaMYBsm1)参与了转基因拟南芥抗旱性的增强。植物学报2016;129(6):1-11。
- 44。
于伟,冯龙S,华聪,惠如P,中富N,启新S,颖银Y.TamiR159定向小麦TaGAMYB分裂及其与花药发育和热反应的关系.公共科学图书馆学报.2012;7(11):e48445。
- 45。
毛X,贾d,李A,张辉,田S,张X,贾Ĵ,TaMYB2A赋予增强的对拟南芥多种非生物胁迫的河景转基因表达。Funct综合基因组学。2011; 11(3):445-65。
- 46。
SEO PJ,Lee Sb,Suh Mc,Park M-J,Go Ys,Park C-M。MyB96转录因子在 Arabidopsis 中的干旱条件下调节切割蜡生物合成。植物细胞。2011; 23(3):1138-52。
- 47。
砂砾H,凯瑟琳R,米雷耶d,Balfourier女,皮尔S,吉尔C,多米尼克B,的Sascha S,盖革HH,基因大麦编码GAMYB转录因子之间的Andreas G.高水平保护的(大麦芽L.)和面包小麦(普通小麦L.)收藏品。Al Appl Genet。2008; 117(3):321。
- 48。
陈Y,杨X,他K,刘敏,李江,高Z,林Z,张艳,王X,邱X的MYB转录因子家族拟南芥:表达分析和与大米MYB家族系统发育比较。植物mol biol。2006; 60(1):107-24。
- 49。
刘鹏,徐志生,潘潘林,胡东,陈敏,李凌龙,马永忠。小麦PI4K基因的产物具有苏氨酸自磷酸化活性,在拟南芥中具有耐旱和耐盐性。中国农业科学。2013;64(10):2915-27。
- 50
杰斐逊RA。植物嵌合基因的分析:GUS基因融合系统。植物学报。1987;5(4):387-405。
- 51
杰斐逊镭,kavanagh ta,bevan mw。GUS Fusions:β-葡萄糖醛酸酶作为高等植物中的敏感和通用基因融合标记物。EMBO J. 1987; 6(13):3901-7。
致谢
我们要感谢国家自然科学基金的资助。
资金
本研究由国家自然科学基金项目(NO。31271625;不。31671609)。
作者信息
隶属关系
贡献
LZ和ZS设计了实验。LZ,ZS和FL执行实验并分析了相应的结果。ZS和XL起草了手稿。LZ有助于修订稿件。HJ使用软件处理数据和正确的图片。SY监督这一整个过程并审查了本文。所有作者阅读并认可的终稿。
通讯作者
伦理宣言
道德认可和参与同意
不适用。
同意出版物
不适用。
竞争利益
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
Springer Nature在公布的地图和机构附属机构的管辖权主张方面保持中立。
附加文件
附加文件1:
图S1核苷酸序列TaGAPCp2和TaGAPCp3启动子。(DOCX 658 KB)
额外的文件2:
图S2转基因植物的检测。一种PCR分析TaGAPCp2p转基因拟南芥。B.PCR分析TaGAPCp3p转基因拟南芥。(docx 159 kb)
额外的文件3:
图S3MYB TFS的系统发育树。分析了总共169个序列,包括衍生自克隆在该工作中的CDNA的一个序列的小麦MYB TF。(图中所示的GenBank登录)。(PDF 136 KB)
附加文件4:
图S4功能MYB顺式元件的分析TaGAPCp2和TaGAPCp3启动子。多克斯(246 kb)
额外的文件5:
表S1本研究使用的引物和探针序列。(多克斯17 kb)
权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
张,L.,歌曲,Z.,Li,F。等等。撤回文章:MYB特异性结合位点的结合TA.MYB在这一边GAPCP2 / 3.启动子参与小麦的干旱胁迫反应。BMC植物BIOL.19,366(2019)。https://doi.org/10.1186/s12870-019-194870-019-19487.
已收到:
认可的:
发表:
关键词
- 耐旱
- 普通小麦
- Tagapcp.发起人
- Tamyb.