- 研究文章
- 开放获取
- 发表:
基因的全基因组鉴定和表达分析Trihelix.Tarrary Buckwheat的转录因子家庭(Fagopyrum tataricum)
BMC植物生物学体积19,商品编号:344(2019)
摘要
背景
在研究中,Trihelix.家族,又称GT因子,是转录因子家族之一。Trihelix基因在光响应、种子成熟、叶片发育、非生物和生物胁迫等生物活性中发挥着重要作用。然而,Trihelix.苦荞科(Fagopyrum tataricum)是一种重要的药用作物,但尚未得到充分的研究。苦荞基因组为研究苦荞的特性和表达提供了理论基础Trihelix.苦荞基因的全层次分析。
结果
在本研究中,共有31FtTH公司以荞麦基因组为基础进行基因鉴定。他们的名字来自FtTH1来FTTH31.分为5组(GT-1、GT-2、SH4、GTγ和SIP1)。FtTH公司基因在染色体上的分布并不均匀,我们发现了基因片段的重复事件FtTH公司苦荞染色体上的基因。根据基因和基序组成的结果,FtTH公司在同一类群中含有类似的内含子/外显子组织和基序组织。存在显示FtTH公司家族成员在茎、根、叶、果实、花和果实发育过程中有多种表达模式。
结论
通过我们的研究,我们确定了31个FtTH公司进一步综合分析了苦荞麦FtTH蛋白的进化和表达模式。大多数基因的结构和基序组织在每个亚家族中都是保守的,这表明它们可能是功能保守的。这FtTH公司基因表达模式的特征表明季后遇荞麦生命过程中的时间和空间的功能多样性。基于讨论与分析FtTH公司基因功能方面,我们筛选了一些与苦荞生长发育密切相关的基因。这将有助于我们进一步研究FtTH公司通过实验探索苦荞生长基因,改善苦荞果实。
介绍
基因表达调控在许多重要的生物活动中起着重要的作用,如信号转导和细胞分化[1].转录因子(Transcription factor, TF)是结合特定靶基因对应区域和作用元件来激活或抑制其转录的关键调控因子,通常包含DNA结合域、转录激活域和核定位信号[2]. 在植物中发现了60多个转录因子家族[1]. 目前,更多的转录因子,如MYB,NAC,WRKY,和第二章,已经研究过了。这个三螺旋TF家族是近年来备受关注的一类基因家族。这个家族因DNA结合域中存在特殊的三螺旋结构(螺旋-环-螺旋)而得名。该结构域在该家族的不同成员中高度保守,并且富含碱性和酸性氨基酸、脯氨酸和谷氨酰胺[3.]. 一些Trihelix.在苔藓和被子植物的祖先分化之前,家族成员包含两个三螺旋结构域,它们是从同一祖先结构域加倍形成的[4.].此外,该域还与DNA序列上的GT元素特异性结合;因此,家庭也被称为GT家庭 [5.].的守恒域Trihelix.是类似的三个α螺旋(螺旋-螺旋-转角-螺旋)MYB TF公司家庭。因此,一般认为三螺旋TF家族起源于类MYB基因[6.]. 然而,两个三螺旋保守结构域在保守结构域上仍存在差异。两个α螺旋之间的氨基酸序列Trihelix.比…长多年电价,这导致它们的三维构象不同,这就是为什么它们能识别不同的DNA元素[6.].这Trihelix.科广泛存在于陆生植物中,尽管在绿藻中没有发现,在人类和果蝇[1那7.那8.那9.]. 最早确定的Trihelix.家族基因是豌豆GT-1蛋白因子,具体结合从豌豆核中分离的GT元素[3.].随后,也克隆了GT因子的编码基因拟南芥蒂利亚纳,烟草,甘氨酸和其他植物。这些因子通过与同源GT元件结合或与其他转录因子相互作用调控多个基因,在许多生理过程中发挥重要作用[10那11那12那13].目前,Trihelix.已在许多植物中进行了系统鉴定和分析,包括拟南芥,米饭,西红柿,Brassica Rapa.那茶树,大豆,和杨树trichocarpa[5.那14那15那16那17那18那19].Kaplan-levy等分析了30Trihelix.转录因子拟南芥和31分的大米Trihelix.根据其保守结构域的特征,将其分为5个亚家族(GT-1、GT-2、SH4、GTγ和SIP1)Trihelix.[5.].所有亚家族均包含N-和末端三螺旋保守结构域(除At5g47660在拟南芥中),但c端结构域不同。虽然每个亚家族至少包含一个三螺旋结构域,但它们之间存在差异。在GT-1和SH4中,每个三螺旋结构域的α螺旋的内部疏水区域都包含一个色氨酸残基,而在GT-2和gt - γ中,第三个保守色氨酸被苯丙氨酸和异亮氨酸取代。的成员Trihelix.在C端可以形成一个长α-螺旋结构,这可以形成一个螺旋-螺旋结构,介导形成一个二聚体结构(一些拟南芥和大豆Trihelix.委员已获确认)[12那20.那21].此外,除了SH4的成员之外,其他亚壳还含有两性α螺旋结构(第四螺旋);GT-2最值得注意的特征是C末端存在另一个三螺纹域。早期知识Trihelix.是否局限于调节光敏色素等依赖光的靶基因巴[22那23那24].后来,随着对家庭的发现和研究,人们发现Trihelix.作用于叶子和鲜花的形态和遗传控制的关键因素及胎儿和胚胎的发育过程[25那26那27那28那29那30.]. 此外,在盐胁迫和冷胁迫的生物胁迫和非生物胁迫中也起着关键作用[14那18那21那31那32那33].
苦荞是我国传统的小杂粮之一,在自然界中是一种既可食又可药的珍稀作物。在荞麦属中,只有苦荞和普通荞麦可用作食物[34那35那36]. 苦荞含有丰富的黄酮类化合物,如芦丁、槲皮素和山奈酚[37那38那39].芦丁和槲皮素[40]. 芦丁是一种次生代谢物,能吸收UV-b(UV-b),保护植物免受UV-b辐射和疾病的危害[41那42那43].苦荞类黄酮对人体也有很多好处,如降低高血压、降低血管渗透性、抗水肿、减少动脉硬化和作为抗氧化剂[44那45那46].此外,苦荞籽粒还含有高平衡的氨基酸组成的蛋白质、粗纤维、维生素和淀粉[47那48那49那50那51].一个全面和功能的研究三螺旋TF在大量的植物中已经进行了科的研究。我们对其中一些进行了全基因组研究特遣部队家庭,如ARF、MADS、NAC和AP2[52那53那54那55]. 相反,关于Trihelix.在苦荞尚未进行。因为Trihelix.基因具有许多重要的生理功能,对植物具有重要的意义,对其进行系统的分析具有重要的科学意义苦荞麦(Fagopyrum tataricum trihelix) TF家庭成员。2017年,Zhang等人揭示了苦荞的基因组序列,这有助于我们研究全基因组的生理生化特性和表达FtTH公司[56]. 在这项研究中,31FtTH公司根据DNA结合结构域的数量、GT蛋白结构域的保守氨基酸和分类,将这些基因分为5个进化支系拟南芥.我们提供了详细的资料ftth,包括物理性质、基序组织、染色体定位和基因复制事件。建立了苦荞与其他7种双子叶植物的比较系统图。的表达特征FtTH TF公司根据实时定量PCR(qRT-PCR)的结果,总结出在特定组织器官(茎、根、叶、花和果实)中存在的因子。我们进一步分析了28个样本的时间差异和特征FtTH公司不同果实发育阶段的基因采用相同的方法。基因的全基因组鉴定及表达分析Trihelix.鞑靼荞麦的家庭有助于更好地了解特遣部队为进一步验证候选基因的功能和改良物种提供了充分的理论依据。
方法
识别的Trihelix.鞑靼荞麦的家庭
我们利用苦荞基因组计划(TBGP;http://www.mbkbase.org/pinku1//).基于两种BLASTp方法,FtTH公司确定了家庭成员的身份。首先,利用BLASTp技术,参照苦荞基因组中的三螺旋蛋白序列,从苦荞基因组中鉴定出所有可能的FtTH蛋白拟南芥. 从Pfam蛋白家族数据库中获得与三螺旋结构域一致的隐马尔可夫模型(HMM)图谱(http://pfam.sanger.ac.uk/) [57]. 用PFAM和SMART程序筛选出含有三螺旋结构域的FtTH候选蛋白。然后,验证这些三螺旋蛋白是否都是NCBI中BLASTp的三螺旋家族成员。最终筛选出31个苦荞品种Trihelix.基因。此外,通过ExPasy网站()对鉴定出的三螺旋蛋白的编码序列长度(CDS)、等电点(pI)等基本特征进行了测定。http://web.expasy.org/protparam/).
系统发育分析与分类
这拟南芥使用Clustalx1.81程序对三螺旋和FtTH蛋白序列进行多氨基酸序列比对。通过邻域连接(Neighbor-Joining, NJ)方法的Geneious R11,对29三螺旋TF家庭成员的拟南芥从苦荞中分离得到31株。31GT根据DNA结合结构域的数目、GT蛋白结构域的保守氨基酸和蛋白质的分类,因子分布在不同的分支中拟南芥.此外,系统发育树是在季后荞麦中构建的,拟南芥蒂利亚纳那甜菜属那Solanum lycopersicum.那葡萄那水稻和向日葵具有上述相同的方法。这些三菱蛋白序列是从UNIPROT数据库获得的(在线提供:HTTPS:/www.uniprot.org).
外显子/内含子结构与保守基序分析
的外显子/内含子结构FtTH公司基因由基因结构显示服务器产生(GSDS:http://gsds.cbi.pku.edu.cn.)在线工具。比较差异ftth测定了三螺旋蛋白的保守基序。利用蛋白质保守基序在线搜索程序MEME(http:/meme.nbcr.net/meme/intro.html).相关参数设置为基序宽度为6 ~ 200个氨基酸(aa),基序数量为10个[52].
染色体扩散、基因复制和与其他物种的共线分析
的位置信息FtTH公司Circos获得的基因显示所有FtTH公司基因在苦荞染色体上传播[58].基因重复事件的检测与研究FtTH公司使用多个共线扫描工具包(MCScanX)进行基因检测,e值设置为10−5[59]. 同构关系的分析Trihelix.苦荞和其他七种双子叶植物之间的科(拟南芥蒂利亚纳那可可,大豆,甜菜那Solanum lycopersicum.那葡萄, 和向日葵)使用双系统绘图软件(https://github.com/cj-chen/tbools.) [60].
植物材料
本试验所用的苦荞麦加入材料由西昌大学王安虎教授提供。2013年至2018年,西桥被引入中国四川雅安四川农业大学生命科学学院试验田,期间的生态环境和栽培条件相同。这些材料是在2018年收集的。我们收集了3个发育期的花、茎、根、叶和果实,分别是发育期(DPA)后13天(绿果期)、19天(变色期)和25天(成熟期)[61[成熟的Tartary BuckWheat(西樵)在季后赛荞麦实验基地的不同发展阶段,位于四川省农业大学农场。我们将收集的样品保持在-80℃下进行后续实验。
的表达式配置文件FtTH公司基因
与FtTH公司在收集组织中的家庭成员(茎,根,叶,花和水果),我们在QRT-PCR分析的帮助下至少三次分析了它们的表达模式。用于QRT-PCR测定的基因特异性引物在附加文件中显示4.:表S4由Primer3软件设计(http://frodo.wi.mit.edu/).用季后荞麦参考基因进行全表达分析H3作为内部参考。采用SYBR预混料Ex-Taq-II(TaKaRa)进行qRT-PCR检测。到2号- (ΔΔct)方法,最终的测试结果可以计算出相应的数据[62].
统计分析
使用Origin Pro 2018b(美国马萨诸塞州北安普顿OriginLab公司)统计程序对所有数据和结果进行方差分析,并与0.05和0.01水平的最小显著性差异(LSD)进行比较。
结果
识别的FtTH公司鞑靼荞麦的家庭
在研究中,我们确定了31个Trihelix.根据已知的苦荞基因组三螺旋结构域序列,采用两种BLAST方法对苦荞基因组数据库中的基因进行分析Trihelix.通过去除冗余基因来(附加文件)1:表S1)。在附加文件1:表S1,31FtTH公司基因的命名来自FtTH1来FTTH31.根据它们各自在染色体上的顺序。
预测物性及特性FtTH公司基因,包括CDS,分子量(MW),等电点(pI)和亚细胞定位,显示在附加文件1:表S1。31个FTTH蛋白的长度从129(FTTH12,FTTH17和FTTH22)变化至863AA(FTTH6),平均为388AA(附加文件1:表S1)。它们的MW最低,为14.70 KDa(FtTH12)最高MW为95.75 KDa(英尺6),平均为43.79 kda。PI从4.76变化(FTTH8.)至9.53(FtTH7 FtTH18),平均7.37。根据亚细胞定位预测(附加文件1:表S1),29FtTH公司家庭成员可能位于核心,而只有2FtTH公司家族成员可能位于叶绿体中。此外,还确定了FtTH公司FtTH基因及氨基酸序列见附加文件1:表S1。
系统发育分析与分类FtTH公司基因
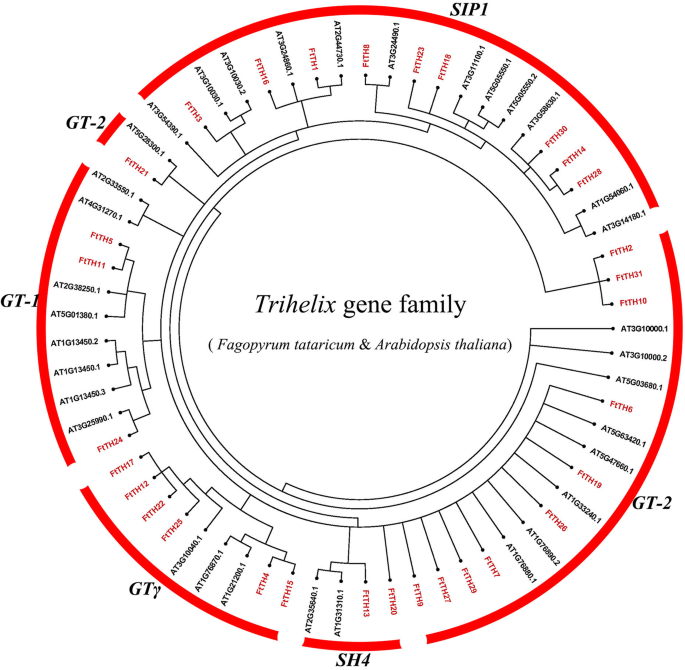
在报告的研究中,30Trihelix.在模型植物中鉴定了基因拟南芥蒂利亚纳. 目的:研究中华绒螯蟹的系统发育关系Trihelix.在苦荞和拟南芥蒂利亚纳,我们选择了29拟南芥trihelix成员和31FtTH公司成员构造一个无根的NJ树(图。1).的系统发育树Trihelix.基因如图所示。1根据DNA结合结构域的数量,GT结构域的保守氨基酸分成5个亚壳(GT-1,GT-2,SH4,GTγ和SIP1)和分类拟南芥蒂利亚纳[5.].在系统发生树中,GT-2与11FtTH公司家庭成员是最大的思工。sh4有2个FtTH公司家庭成员是最小的群体。GT-1、gt - γ和SIP1分支数分别为3、6和9个。根据结果,AT2G33550.1和AT4G31270.1从SH4拟南芥蒂利亚纳因为它们与苦荞的同源性不高,所以没有进行分类FtTH公司基因。
基因结构特征及保守基序组成ftth基因
该系统的特点FtTH公司基因结构见图。2包括外显子和内含子的数量和分布。编码序列(CDS)的一半以上Trihelix.基因由内含子分开。一般来说,根据外显子/内含子的数目,属于同一支系的三螺旋成员具有相似的外显子/内含子组织。通过分析该基因的结构特征,我们确定13FtTH TF公司家庭成员没有内含子,其中它们主要来自CladeGTγ和SIP1。除此之外FtTH公司基因,它们含有1,2,3,6或16内含子。其中,13FtTH公司基因内含子1个,内含子2个FtTH公司基因包含6个内含子和3个其他内含子FtTH公司基因包含2、3或16个内含子。同一分支中内含子的数目FtTH公司基因几乎是一样的,除了FTTH6..外显子数从1个到5个不等,表明31个外显子之间存在一定程度的差异FtTH公司基因。
植物的系统发育关系、基因结构和保守蛋白基序组成FtTH公司来自苦荞的基因。A.利用Geneious R11软件对苦荞三螺旋蛋白全长序列构建系统发育树。B苦荞的外显子-内含子结构Trihelix.基因。绿色框表示未翻译的5′和3′区域;黄框表示外显子,黑线表示内含子。三螺旋结构域以粉红色框突出显示。数字表示相应内含子的阶段。C苦荞三螺旋蛋白的基序组成。这些图案,编号为1-10,被陈列在不同颜色的盒子里。每个主题的序列信息在附加文件中提供2:表S2。可以使用底部的刻度估计蛋白质长度
为了进一步分析Trihelix的多样性,在季后遇荞麦中,MEME搜索工具用于预测图1所示的FTTH蛋白的10个保守的基序(MOTIF1〜MOTIF10)。2c.每个FtTH蛋白的基序组织如图中相应的彩盒所示。2c.每个主题的详细顺序在附加文件中提供2:表S2。基序1、基序3和基序6几乎存在于所有的FtTH蛋白中,并且所有的蛋白质都含有基序6,不同的组具有相似的基序,表明这些保守的基序可能在特定的功能中起着关键作用。此外,一些ftth具有多个基序6,例如FtTH9、FtTH21、FtTH25、FtTH26和FtTH29那除FtTH3缺失基序5外,SIP1的所有苦荞三螺旋家族成员都有基序1、3、5、6和7,而GT-1和GT-2的保守基序组成基本相似;除FtTH19和FtTH24外,它们都具有基序1、2、3、6、7和8。而基序4仅在分支GTγ中发现;基序5几乎完全存在于分支SIP1中;基序9仅见于分支GT-2;四分之二的分支SH4拥有最少的基序,有趣的是,FtTH20只有基序6。
猪的染色体分布和基因复制事件FtTH公司家庭
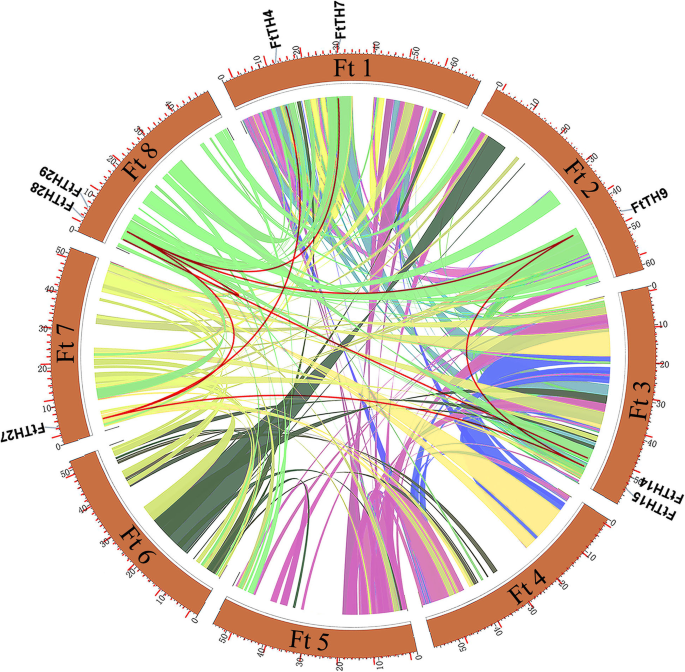
在染色体图中(图。3.),共31人FtTH公司基因分散在8条染色体上。有些染色体含有更多FtTH公司基因。的数量FtTH公司每个染色体上的基因数从1到8不等,其中染色体数目最多FtTH公司基因,第一个染色体上有8个。然而,没有FtTH公司6号染色体上的基因。来分析演变FtTH TF公司分析了家族基因重复事件,包括串联重复事件和片段重复事件。串联和片段复制是丰富蛋白质功能、促进基因进化和扩增的关键因素[63]. 使用MCScanX,发现这两个序列之间没有串联重复事件FtTH公司只有片段重复存在于细胞中FtTH公司基因家族,如图所示。3.和4..虽然这些基因位于苦荞基因组的8条染色体上,但存在一些重复的对FtTH公司基因片段(FTTH29.和FtTH7 / FtTH9 FtTH14 / FtTH27;FtTH15 FtTH9 / FtTH27;FtTH14 FtTH28;FtTH4和FtTH27)位于Tartary荞麦染色体上,并且所有这些都位于两种不同的染色体上,除了染色体4,染色体5和染色体6,其中没有位于ON的重叠区段(图。4.).
进化分析与综合征分析FtTH公司基因和其他一些物种
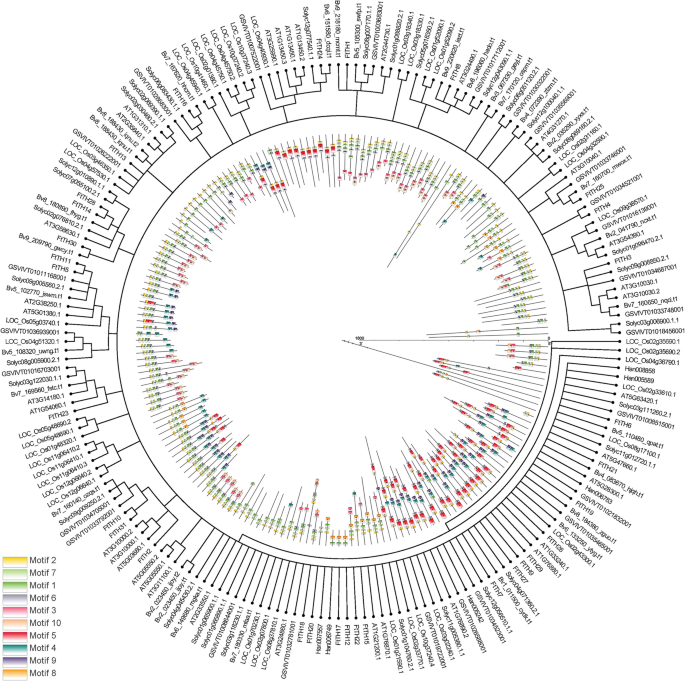
分析期货市场的演化关系Trihelix.苦荞科与六种植物(拟南芥利用Geneious R11的NJ方法,根据31个蛋白质序列,构建了一个未生根的NJ树,该树有10个保守基序FtTH公司基因和其他六种植物Trihelix.基因(图。5.).详细的遗传对应在附加文件中提出3.:表S3。的分布ftth在系统发育树中是相对分散的。几乎所有Trihelix.不同物种的科成员如图所示。5.分享主题2。大多数Trihelix.家族成员包含motif 1和motif 7。
来自七种不同植物物种的三螺纹蛋白的系统发育关系和基序组成(Tartary Buckfreeat,拟南芥甜菜、番茄、葡萄、大米和向日葵)。编号为1-10的图案显示在不同的彩色框中。每个基序的序列信息在附加文件中提供2:表S2
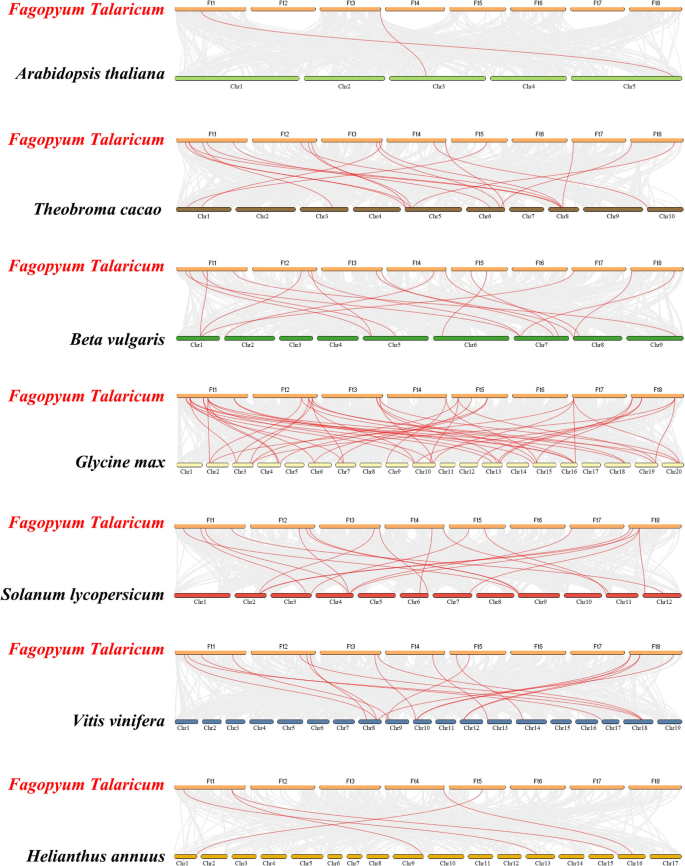
苦荞同步关系分析Trihelix.我们构建了苦荞麦与7种双子叶植物(拟南芥、可可、甜菜、大豆、番茄、葡萄和向日葵)的7种比较系统图,如图所示。6..从附加文件提供的细节3.:表S3,FtTH公司与大豆(46个)、番茄(19个)、可可豆(18个)、葡萄(17个)、甜菜(17个)、葵花(5个)的基因表现出不同程度的同系关系拟南芥蒂利亚纳(2). 一般来说,苦荞与大豆最相似,而苦荞与大豆最相似拟南芥蒂利亚纳通过这些图的比较,可能与它们之间的系统进化关系密切相关。
表达模式FtTH公司不同组织/器官中的基因
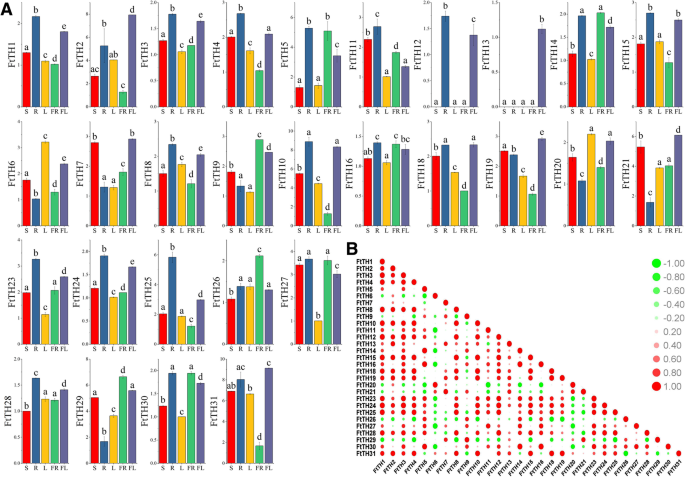
在已经研究和报道的植物中,对许多基因的功能研究表明Trihelix.基因在作物生长发育中起着关键作用[5.].为了深入了解FtTH公司苦荞发育过程中基因的表达FtTH TF公司使用QRT-PCR测量不同组织/器官中的家庭成员。在选定的器官/组织中,包括茎,根,叶,水果和花,表达轮廓FtTH公司基因用直方图表示(图。7.一个)。FtTH公司基因在所有选定的器官/组织中都有表达,除了FtTH17和FtTH22,没有表达。结果表明,转录产品表达29FtTH公司基因在特定器官/组织中高度表达,表明FtTH公司在苦荞发育过程中,家庭成员具有不同的功能。通过查看每个直方图的列高FtTH公司基因(FTTH2,FTTH7,FTTH13,FTTH18,FTTH19,FTTH21和FTTH31)在苦荞花中高水平表达。7.a) ,和FTTH13只在花中表达。十七FtTH公司基因(FtTH1、FtTH3、FtTH4、FtTH5、FtTH8、FtTH10、FtTH11、FtTH12、FtTH15、FtTH16、FtTH18、FtTH23、FtTH24、FtTH25、FtTH27、FtTH28和FtTH30)在根中的表达量高于其他器官/组织,有趣的是,FTTH12.只在根和花中表达。FTTH6.和FTTH20在苦荞叶中高表达。五FtTH公司基因(FtTH9、FtTH14、FtTH26、FtTH29和FtTH30)在果实中表达量较高。在苦荞茎中,表达全部FtTH公司基因少于其他器官/组织。
同时,我们研究了这29种表达谱之间的相关性FtTH公司基因(图。7.b) 是的。大多数人FtTH公司基因间存在正相关,尤其是这些基因FtTH公司基因(FtTH1、FtTH4、FtTH8、FtTH10、FtTH12、FtTH15、FtTH18、FtTH24)与其他许多因素显著相关FtTH公司基因(图。7.b) 是的。而有些FtTH公司基因(FtTH6、FtTH20、FtTH21、FtTH26和FtTH29)与大多数其他人和两组人呈负相关FtTH公司基因(FtTH6和FtTH11/ FtTH27;FTTH20和第11页)两者呈显著负相关。
的表达谱FtTH公司苦荞果实发育阶段的基因
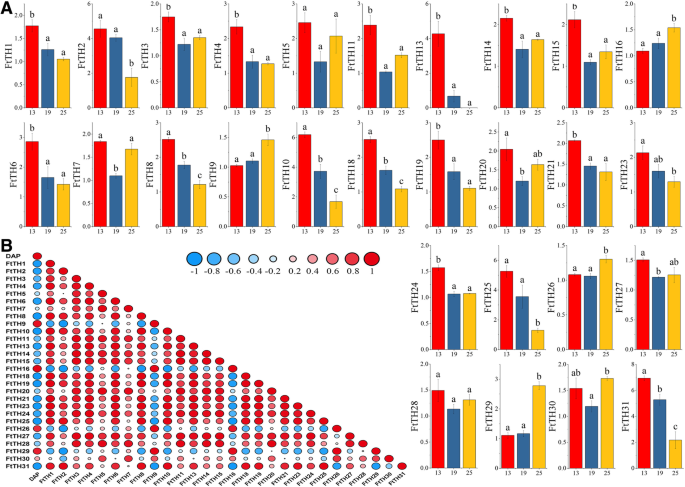
苦荞具有很高的营养价值和药用价值。总黄酮和氨基酸平衡蛋白含量均高于主要粮食作物[38]. 苦荞果实是发挥苦荞价值的主要部分。Trihelix基因调节不同的生物过程,如胚胎发生[5.].因此,对表达的研究具有重要的意义FtTH公司果实发育过程中的基因。通过分析FtTH公司基因表达FtTH公司筛选了与苦荞果实发育密切相关的基因。28的表达式的时间差FtTH公司苦荞果实生长发育的基因以直方图的形式呈现,除了FtTH12、FtTH17和FtTH22(图。8.a).实验结果表明,表达产物丰度为28FtTH公司基因显然在13dPa(绿色果阶段),19dPa(变色阶段)和25dPa(初始成熟阶段)中变化[61,表明有些FtTH公司基因在鞑靼荞麦果的发展阶段具有大量功能。三个表达水平FtTH公司基因(FtTH9、FtTH16、FtTH26)在苦荞果实发育过程中逐渐增加,如图。8.A.十四的表达FtTH公司基因(FtTH1、FtTH2、FtTH4、FtTH6、FtTH8、FtTH10、FtTH13、FtTH18、FtTH19、FtTH21、FtTH23、FtTH24、FtTH25和FtTH31)减少了度。其他11人的表达模式也有所波动。
此外,大多数FtTH公司基因与果实发育呈负相关FTTH10呈显著负相关。这与上述发育过程中的基因表达模式一致。这28个的相关性FtTH公司对苦荞果实的基因表达谱进行了分析。大部分FtTH公司基因有正相关,很多FtTH公司基因(FtTH3和FtTH14/FtTH15;FtTH4和FtTH24;FtTH6和FtTH13/FtTH21;FtTH8和FtTH10/FtTH18;FtTH13和FtTH21;FtTH14和FtTH11/FtTH15;FtTH19和FtTH1/FtTH18;FtTH20和FtTH28;FtTH23和FtTH8/FtTH18/FtTH19)显著正相关(图。8.b)。四个FtTH公司基因(FTTH2.和FTTH9;FTTH16.和FTTH31.)呈显著负相关。
讨论
鞑靼荞麦是一个重要的现金作物[64]. 猪全基因组研究Trihelix.苦荞基因家族尚未见报道。Zhang等人(2017)报道了苦荞的参考基因组,Liu等人(2018-2019)研究了苦荞[52那53那54那55那56那61那65这为我们系统地分析苦荞的特性和功能提供了丰富的理论基础Trihelix..我们确定了31FtTH公司基因(附加文件)1:表S1)和FtTH公司基因与之很接近拟南芥蒂利亚纳还有米饭[5.]. 系统发育分析表明,苦荞属Trihelix.通过构建大型的NJ树来分析和比较,形成基因5分钟以分析和比较Trihelix.家庭成员在拟南芥蒂利亚纳(图。1).在系统发育树的基础上,分析已知基因的功能有助于推断基因的功能FtTH公司为后期候选基因的功能探索提供了一定的理论支持。
分析了其成员的保守母题和结构Trihelix.苦荞麦科(无花果属)2). 其基序和结构与我们的分类结果一致。同一分支中大多数成员的相似性表明保守的基序可能在特定群体的功能中起关键作用。不同分支的基序组成较大;因此,苦荞三螺旋蛋白的功能是复杂的。序列分布表明,含有相同基序的基因可能是由同一群体中的基因扩增产生的。这与《菊花》中的报道类似[66].在五片叉腰中,相对较早地研究GT-1和GT-2,它们之间的同源远高于其他亚属的同源性[5.].GT-1和GT-2中保守基序组成的高度相似性(两个支系的大多数成员共有基序1、2、3、6、7和8)与这一结论一致。
基因复制在基因功能多样性和基因扩增中起着重要作用,是生物进化的重要因素之一,包括串联复制、片段复制和基因组复制[67].与大豆(67)相比,杨树trichocarpa(56)和芸苔属植物拉伯(52),数量FtTH公司来自苦荞的基因较少[16那18那19].这种差异可能是由于在其他物种的祖先分化后发生了σ基因组复制(WGD)事件,而苦荞没有发生。63].此外,基因复制可以放大基因的数量。许多基因家族扩增的主要原因之一是片段复制[63].结果表明,仅发现了节段性重复事件,没有发现串联重复事件。3.和4.). 5条苦荞染色体上有8对片段重复。我们假设FtTH公司基因和进化FtTH公司基因可能是由这些片段复制事件驱动的。这类似于杨树trichocarpa[19].
根据染色体分布的结果,6号染色体无染色体FtTH公司基因,这表明FtTH公司基因家族可能在漫长的进化过程中遭受基因缺失[68].此外,还存在片段复制事件,但没有串联复制事件FtTH公司苦荞基因家族。基因复制在基因组的扩增和重组中起着重要的作用[69].高片段复制率有利于基因进化。一些损失FtTH公司基因可能是由于片段复制后的动态变化,这与结果一致杨树trichocarpa[19].
基因表达模式是判断细胞功能和特性的重要因素三螺旋TF本研究采用qRT-PCR技术检测了苦荞茎、根、叶、果实和花中基因的表达情况。如图直方图所示。7.a、 表达特征FtTH公司基因表达存在空间变异。这Trihelix.基因家族在植物生长发育过程中起着重要作用[5.]. 通过分析一些基因的表达特点FtTH公司特定植物组织/器官中的家族成员,我们可以假设FtTH TF公司在鞑靼荞麦生长和发展中起着具体和重要作用。大部分的FtTH公司家族成员广泛表达于苦荞的组织/器官和两个细胞中FtTH公司基因(FTTH12.和FTTH13)呈现组织特异性表达模式。组织特异性基因可能在相应器官或组织的生长和分化中发挥作用,但这些基因的功能还需要更多的实验来验证FtTH公司基因[66].干旱条件下,根系感知土壤变化,向植物叶片传递一系列信号,从而触发植物的生理生化反应,减少对根系的损害[70].四个FtTH公司基因(FtTH4、FtTH12、FtTH23和FtTH25)在根中显著高表达,可能有助于苦荞对干旱条件的适应。这与苦荞作为一种耐旱作物的性质是一致的。在杨树上也得出了类似的结论[19].在非生物胁迫的背景下,一些研究表明AtGT2L(At5g28300),拟南芥GT-2亚家族的一个成员,在植物的花瓣和叶子中高度表达拟南芥蒂利亚纳,对寒冷胁迫和干旱胁迫有反应,表达量增加[31].FTTH21.GT-2同源ATGT2升在鞑靼荞麦鲜花中有高表达。FTTH21.可以用作候选基因,并且可以进行未来的实验以验证是否通过改变表达水平来验证它是否适应干旱和冷。此外,GTL1(At1g33240)属GT-2亚科,与叶片气孔数有关。GTL1能直接抑制气孔密度和分布1(SDDI)基因。一种丝氨酸蛋白酶,由SDDI对气孔再生起负面作用。因此,gtl1突变体叶片气孔数量减少。在干旱条件下GTL1减少,这有助于用水,因为气孔较少的植物可以减少水量损失[28那32].FTTH6.分组在苦荞GT-2与GTL,在叶片中表达量较高,很可能是通过改变气孔密度来调节水分的利用。苦荞是一种耐旱品种。这一功能与苦荞的生理特性相一致。在SIP1亚家族中,AT3G10030与叶发育有关;该基因的相应突变体短,叶片变形并变色[71].FTTH3.同源,AT3G10030在苦荞叶片中含量最低,可能与叶片的正常发育有关。花瓣损失(PTL),也指定At5g03680,是一个Trihelix.与花瓣和萼片发育有关的GT-2家族成员[25那26那27].PTL蛋白能抑制萼片的生长,使萼片不能融合在一起。Ptl突变体表现出花瓣退化和萼片融合[27]. 此外,PTL激活兔耳(RBE),促进花瓣的生长[72].因此,在开花植物中,PTL公司在鲜花的正常形成和生长中起着重要作用。FTTH2和FTTH31.在苦荞麦花中表现出较高表达的GT-2基因的同源性第。这两个基因可能在控制苦荞花花瓣的发生和发育中起作用,这可以通过以后的实验进一步验证。
进一步探讨功能FtTH公司水果开发中的基因(13,19,25 dpa)的季耳荞麦,我们确定了表达FtTH公司利用qRT-PCR分析果实发育过程中的基因。他们的表情表现出了时间差。在GT-1亚家族中,emb2746(AT5G63420),这存在于拟南芥蒂利亚纳,广泛表达于植物的营养部分拟南芥蒂利亚纳,特别是在种子中。的种子emb2746突变体只会发展到球状阶段;所以,EMB2746是早期胚胎发生所必需的。LOC_Os02g33610在米饭也类似于At5g63420型[73].英尺6,哪个是同源的At5g63420型(图。1),LOC_Os02g33610(图。5.),在所有选定的组织/器官中表达(图。7.a),在13dpa(青果期)在果实中表达量较高,如图所示。8.A.FTTH6.也可能在苦荞果实的早期发育和正常发育中起同样重要的作用。此外,ASIL1(At1g54060)来自SIP1亚家族在从营养生长转变为生殖生长期间发挥重要作用。在幼苗中,ASIL1转录产物与细胞中的抑制元件(GTGATT)结合2 s3种子贮藏蛋白基因启动子避免种子类似贮藏物质,如种子特异贮藏蛋白2S3在幼苗中合成和积累。ASIL1有助于控制种子在适当发育阶段的成熟[74那75那76].FTTH18.和FTTH23.SIP1基因与这些基因同源,在苦荞果实中表达相对较低(图。7.a).特别是FTTH18.与其他组织相比,在果实中最低。这两个的表达模式FtTH公司基因在果实发育阶段减少(图。8.一个)。FTTH18.和FTTH23.也有类似的功能。两者的表达下降FtTH公司基因表明随着表达量的减少FTTH18.和FTTH23.这两个基因对种子成熟基因的抑制作用减弱,苦荞果实在胚胎发生期正常积累蛋白质等贮藏物质,使果实正常发育成熟。果实成熟的时间精确性受到调控。本文的讨论为以后的实验提供了基础,以验证功能特性的相似性FtTH公司基因和拟南芥trihelix苦荞果实生长发育的研究。
结论
我们的第一步是进行全基因组分析来识别和分析FtTH TF公司鞑靼荞麦的家庭。我们确定了31FtTH公司并分析了它们的物理特性、进化关系、基因结构和复制。的表达模式FtTH TFs公司通过QRT-PCR分析正常生长条件。基于上述讨论和假设的功能特征FtTH公司的家庭,FtTH公司基因在苦荞发育过程中起着重要作用。初步筛选了部分关键候选基因,为我们通过实验进一步探索苦荞功能特性,提高苦荞作物产量提供了理论依据。
数据和材料的可用性
苦荞基因组序列用于鉴定Trihelix.本研究的基因定位于苦荞基因组计划(TBGP;http://www.mbkbase.org/pinku1//).本试验所用的苦荞麦加入材料由西昌大学王安虎教授提供。支持本文结论的数据集包括在文章及其附加文件中。
缩写
- Aa:
-
氨基酸
- cd:
-
编码序列长度
- DPA:
-
天postanthesis
- FTTH:
-
Fagopyum talicum trihelix.
- 德牧:
-
基因结构显示服务器
- 唔:
-
隐马尔可夫模型
- 迷幻药:
-
最小显著性差异
- MCScan:
-
多重共线扫描
- 分子量:
-
分子量
- NJ:
-
邻居加入
- 包含了:
-
蛋白质家族
- PI:
-
等电点
- PTL公司:
-
花瓣损失
- qRT PCR:
-
实时定量PCR
- 苏格兰皇家银行:
-
兔耳朵
- SDDI:
-
气孔密度和分布1
- TBGP:
-
苦荞基因组计划
- 运输工具:
-
转录因子
- uv - b:
-
紫外线-b
参考文献
- 1.
Riechmann JL、Heard J、Martin G、Reuber L、Jiang C、Keddie J、Adam L、Pineda O、Ratcliffe OJ、Samaha RR。拟南芥转录因子:真核生物全基因组比较分析。科学。2000;290(5499):2105–10.
- 2.
Wray GA, Hahn MW, Ehab A, Balhoff JP, Margaret P, Rockman MV, Romano LA。真核生物中转录调控的进化。中国生物医学工程学报。2003;20(9):1377-419。
- 3.
绿色睡衣,凯萨,蔡新罕布什尔州。豌豆核因子与rbcS-3A基因上游光响应元件的序列特异性相互作用。EMBO J。1987;6(9):2543–9.
- 4.
陆涛水稻全长cDNA序列比较分析及动植物三螺旋转录因子基因家族比较:上海交通大学2009.
- 5.
转录因子的三螺旋家族——光、胁迫和发育。植物生态学报,2012;30(3):457 - 461。
- 6.
gt -因子三螺旋结构域的一些特征与Myb dna结合结构域相似。植物杂志。2000;124(2):491 - 3。
- 7.
Paulino PR,Diego Mauricio ROP,Corrêa LGG,Rensing SA,Birgit K,Bernd先生:植物转录因子数据库的更新内容和新特性。核酸研究,2010年;38(数据库问题):D822–7。
- 8.
Diego Mauricio ROP,CARRαLGG,RA L TE,Bernd MR. Green转录因子:衣藻概述。遗传学。2008;179(1):31–9.
- 9
何Z,金浦J,Liang T,Yi Z,Xiaocheng G,GE G,Jingchu L. PlanttFDB 2.0:更新和改进综合植物转录因子数据库。核酸RES。2011; 39(数据库问题):D1114-7。
- 10.
Dehesh K, Hung H, Tepperman JM, Quail PH. GT-2:一种具有双自主dna结合域的转录因子,其靶序列特异性密切相关但不同。EMBO j . 1992; 11(11): 4131 - 44。
- 11.
Le Gourrierec J,Li YF,周DX。Arabidopsis GT-1的转录激活可以通过与TFIIA-TBP-TATA复合物的相互作用。工厂J.2010; 18(6):663-8。
- 12.
Ayadi M、Delaporte V、Li YF、Zhou DX。对GT-3a的分析确定了拟南芥中一个独特的三螺旋DNA结合转录因子亚群。费布斯莱特。2004;562(1–3):147–54.
- 13.
吉尔马丁总理,蔡NH。GT-1结合位点在光响应元件内的间距对转录活性至关重要。植物细胞。1990;2(5):447 - 55。
- 14.
acta botanica botanica(云南植物研究中心),云南植物研究中心,云南植物研究中心,云南植物研究中心,云南植物研究中心,云南植物研究中心)中国生物医学工程学报。2010;283(2):157-69。
- 15
yu c,cai x,ye z,李H.番茄三合一体基因家族的基因组型鉴定及表达分析分析。Biochem Biophys Res Communce。2015; 468(4):653-9。
- 16
王W,吴P,刘Tk,任儿,李,侯X.Trihelix家族在Brassica Rapa中的基因组分析和表达分歧:洞察植物的进化模式。SCI批准。2017; 7(1):1-15。
- 17
李H,黄W,刘ZW,吴ZJ,壮族,茶树茶叶(Camellia Sinensis):对非生物压力的识别,分类和表达概况。acta physiol植物。2017; 39(10):217-28。
- 18
Marina Borges O、Lauro BN、Graciela C、Andreia Carina TZ、Beatriz WS、Maria Helena BZ、Márcia议员。大豆三螺旋GT和bHLH转录因子的鉴定和电子表征。基因分子生物学。2012;35(1):233–46.
- 19
王Z、刘Q、王H、张H、徐X、李C、杨C。毛果杨三螺旋基因及其在生物和非生物胁迫下表达的综合分析。Sci代表2016;6:36274–89.
- 20.
拟南芥DNA结合因子GT-2的研究。植物生物学杂志。1993;23(2):337-48。
- 21
谢志明,邹海峰,雷刚,魏伟,周启元,牛长飞,廖勇,田亚荣,马波,张伟坤。转基因拟南芥中大豆三螺旋转录因子GmGT-2A和GmGT-2B提高了植物对非生物胁迫的耐受性。《公共科学图书馆•综合》。2009;4 (9):e6898 - 912。
- 22
周德祥。GT元件和GT因子对植物基因转录的调控机制。植物科学趋势。1999;4(6):210–4.
- 23
倪M,Dehesh K,Tepperman JM,鹌鹑PH.GT-2:体内转录激活活性和具有相互靶序列选择性的新型双DNA结合域的定义。植物细胞。1996;8(6):1041–59.
- 24
关键词:双自主双部核定位信号GT-2中国生物医学工程学报,2010;
- 25
辛莉,耿吉Q,张良C,洪雅G,李佳Q。转录因子PTL的功能获得性突变通过影响生长素的稳态而导致卷曲叶片、矮小和雄性不育。植物分子生物学。2008;66(3):315–27.
- 26.
拟南芥花瓣损失是一个三螺旋转录因子基因,它调节拟南芥花被的结构。发展。2004;131(16):4035 - 45。
- 27.
拟南芥花瓣损失基因(PETAL LOSS gene)调控拟南芥第二轮器官的起始和定位。发展。2000;126(24):5635 - 44。
- 28.
Christian B,Ayako K,Takanari I,Rumi Tw,Takuji W,Youichi K,Shu M,Minami M,Keiko S. The Trihelix转录因子GTL1调节拟南芥培养体中的卵体依赖性细胞生长。植物细胞。2009; 21(8):2307-22。
- 29.
Iris T、Rosanna PM、Allan D、Michael B、Rebecca R、Steven H、T Colleen S、John ME、George A、David P。拟南芥胚胎发育所需基因的鉴定。植物生理学。2004;135(3):1206–20.
- 30.
巴尔斯,威尔曼先生,詹妮克·普德。胚胎成熟中的三螺肌转录因子是否存在作用?植物信号表现。2012; 7(2):205-9。
- 31。
席J,邱,杜L,波瓦耶BW。植物特异性三螺旋转录因子AtGT2L与钙/钙调素相互作用,对冷胁迫和盐胁迫作出反应。植物科学。2012;185-186(4):274–80.
- 32。
Yul YC、Pence HE、Bo JJ、Kenji M、Gosney MJ、Hasegawa PM、Mickelbart MV。拟南芥GTL1转录因子通过转录抑制SDD1调控气孔密度,从而调控水分利用效率和抗旱性。植物细胞。2010;22(12):4128–41.
- 33。
王旭,李QT,陈HW,张WK,马B,陈SY,张JS。三螺旋转录因子GT-4通过与TEM2相互作用介导拟南芥的耐盐性。BMC植物生物学。2014;14(1):339–52.
- 34.
津恩J。苦荞的变异研究。美国国家科学院学报。1919;5(11):506–14.
- 35.
朱峰。苦荞的化学成分及其对健康的影响。食品化学。2016;203:231-45。
- 36.
普通荞麦和苦荞面粉和麸皮中的微量元素。食品化学。2003;83(1):1 - 5。
- 37.
关键词:苦荞幼苗,超声-丙醇-硫酸铵双水相分离,总黄酮,抗氧化活性食品科学。2009;30(2):110 - 3。
- 38.
摘要/ abstract Nina F, Janko R, Iztok Joze K, Zhuanhua W, Zheng Z, Ivan K.苦荞(Fagopyrum tataricum Gaertn.)是一种膳食中芦丁和槲皮苷的来源。农业化学学报,2003;51(22):6452-5。
- 39
林嘉玲、叶世元、黄建华。苦荞和荞麦芽的抗氧化活性。农业食品化学杂志。2008;56(1):173–8.
- 40.
Holasova M、Fiedlerova VH、Orsak M、Lachman J、Vavreinova S。荞麦——功能性食品中抗氧化活性的来源。食品研究国际2002,35(2–3):0–211。
- 41.
Kreft S, Štrukelj B, Gaberščik A, Kreft I.不同UV-B辐射水平下荞麦药材中的芦丁:两种紫外分光光度法和高效液相色谱法的比较。中国生物医学工程学报,2002;
- 42.
姚y,轩Z,李y,他,korpelainenh h,li c.紫外-b辐射对田间条件下急性荞麦(Fagopyrum tataricum)作物生长,发育,产量和叶片色素浓度的影响。Jagron欧元。2006; 25(3):215-22。
- 43.
迪克森·雷,achnine l,kota p,刘cj,reddy ms,王l。苯丙丙烷途径和植物防御 - 一种基因组学视角。莫尔植物途径。2010; 3(5):371-90。
- 44.
Wójcicki J、Barcew Wiszniewska B、Samochowiec L、Rózewicka L。荞麦提取物降低高脂饲料喂养的家兔动脉粥样硬化。制药公司。1995;50(8):560–2.
- 45
渡边M。荞麦儿茶素作为抗氧化剂的研究。Jagricfood化学公司。1998;46(3):839–45.
- 46
Zfass HS.公司。芦丁治疗毛细血管脆性增加;初步报告。弗吉尼亚医学月刊。1947;74(2):56–62.
- 47
从普通荞麦和苦荞中提取的面粉和麸皮的组成和工艺特性。食品化学。2003;80(1):15。
- 48
荞麦(Fagopyrum esculentum Moench)的化学成分和蛋白质品质。植物营养学报。1980;30(3-4):175-9。
- 49
周X,郝T,周Y,唐W,肖Y,孟X,方X。苦荞种子萌发过程中抗氧化物质与抗氧化活性的关系。食品科学技术杂志。2015;52(4):2458–63.
- 50.
关键词:苦荞,种子萌发,营养成分,进化食品化学。2015;186:244-8。
- 51.
秦丕、王QA、单福、侯志、任国玺。不同荞麦品种面粉的营养成分和黄酮含量。国际食品科技杂志。2010;45(5):951–8.
- 52.
刘米,马Z,王A,郑T,黄l,太阳,张y,金w,zhan j,cai y等。天竺葵抗果实(Fagopyrum Tataricum)中的基因组响应因子基因家族。int j mol sci。2018; 19(11):3526-44。
- 53。
关键词:苦荞,MADS基因家族,脱皮基因,全基因组分析足底。2019;1:1-18。
- 54。
刘明,孙伟,马忠,郑T,黄L,吴Q,赵G,唐Z,卜T,李C,等。苦荞AP2/ERF基因家族的全基因组研究。BMC植物生物学。2019;19(1):84–102.
- 55。
刘明,马兹,孙伟,黄力,吴Q,唐Z,卜T,李C,陈H。苦荞NAC转录因子家族的全基因组分析。BMC基因组学。2019;20(1):113–28.
- 56。
关键词:苦荞,芦丁,生物合成,非生物胁迫引用本文:摩尔。2017;10(9):1224 - 37。
- 57。
旋涡sr剖面隐马尔可夫模型。生物信息学》1998。
- 58.
Krzywinski M、Schein JI。Circos:比较基因组学的信息美学。基因组研究,2009年;19(9):1639–45.
- 59.
吴宇鹏,T海宝,D杰里米,D许,T京平,L西银,L泰和,J惠哲,M巴里,G惠:MCScanX:基因共线性和共线性的检测和进化分析工具2012,40(7):e49-e49。
- 60.
刘聪、谢婷、陈聪、栾甲、龙杰、李聪、丁妍、何妍。菠萝R2R3-MYB转录因子家族的全基因组组织和表达谱。BMC基因组学。2017;18(1):503–18.
- 61.
Liu M, Ma Z, Zheng T, Sun W, Zhang Y, Jin W, Zhan J, Cai Y, Tang Y, Wu Q.生理变化与苦荞种子发育的关系Fagopyrum tataricumGaertn)。BMC基因组学。2018;19(1):648 - 68。
- 62.
Livak KJ, Schmittgen TD。采用实时定量PCR和2−ΔΔ C T法对相关基因表达数据进行分析。《方法与酶学方法》2001;25(4):402-8。
- 63.
Cannon SB、Mitra A、Baumgarten A、Young ND、May G。片段和串联基因复制在拟南芥大基因家族进化中的作用。BMC植物生物学。2004;4(1):10–30.
- 64.
关键词:苦荞,种子发育,黄酮类化合物,含量,分布植物保护学报。2016;19(4):1-10。
- 65.
刘明,马志,郑T,王杰,黄力,孙伟,张勇,金伟,詹杰,蔡勇,等.生长素和脱落酸平衡及FtARF2在苦荞果实最终粒径测定中的潜在作用。国际分子科学杂志。2018;19(9):2755–74.
- 66.
宋A,GAO T,DAN W,Xin J,Chen S,Guan Z,Wang H,Jin L,陈F.转录组 - 菊花样转录因子的转录组鉴定及表达分析。植物理性生物化学。2016; 17(2):10-6。
- 67.
张S,徐河,罗X,江泽民,舒H.Malus domestica MAPK和MAPKK基因家族的基因组鉴定及表达分析。基因。2013; 531(2):377-87。
- 68.
刘杰,陈宁,陈芳,蔡波,Santo SD, Tornielli GB, Pezzotti M,程志明。葡萄(Vitis vinifera) bZIP转录因子基因家族的全基因组分析和表达谱分析。BMC基因组学,2014;15(1):281 - 98。
- 69
库马尔,蒂亚吉,夏尔马。番茄生长素反应因子(ARF)基因家族的全基因组分析及其在花果发育中的作用。分子遗传学。2011;285(3):245–60.
- 70
根的结构和植物的生产力。植物杂志。1995;109(1):7 - 13。
- 71.
利用拟南芥基因编码区4000个ds-插入突变体进行表型分析。植物学报。2010;47(4):640-51。
- 72.
Seiji T,Noritaka M,Kiyotaka O.兔耳朵,编码超人样的锌手指蛋白,调节拟南芥的花瓣发育。发展。2004; 131(2):425-34。
- 73.
马库斯S、戴维森TS、老亨兹、帕普UJ、莫尼卡D、马丁V、伯恩哈德SL、德特勒夫W、罗曼JU。拟南芥发育的基因表达图谱。纳特·吉内特。2005;37(5):501–6.
- 74.
关键词:拟南芥,三螺旋转录抑制因子,种子成熟,转录抑制因子植物细胞。2009;21(1):54 - 71。
- 75.
Willmann先生,Mehalick AJ,Packer RL,Jenik警局。小rna调控拟南芥胚胎成熟的时间。植物生理学。2011;155(4):1871–84.
- 76.
G明军,L香,L海伦,Gropp GM,Lydiate DD,Shu W,Hegedus DD.ASIL1是拟南芥种子灌浆的适宜时间。电厂信号行为。2011;6(12):1886–8.
确认
我们感谢实验室所有同事提供有用的讨论和技术援助。我们非常感谢编辑和审稿人对稿件的批判性评价,并为其改进提供了建设性意见。
资金
该研究得到了中国国家自然科学基金(31500289)的支持。资金用于设计和收集,分析和解释数据以及撰写手稿,以及在公开接入付款中。
作者信息
从属关系
贡献
M-YL对研究进行了规划和设计,并对数据进行了分析。Z-TM写了原稿。Z-TM和W-JS通过qRT-PCR检测基因的表达。LH识别了FtTH公司家族基因和可视化的结构。HC和QW进行了进化分析FtGRAS基因和几个不同的物种。T-LB和C-LL执行了FtGRAS基因染色体分布、基因去应用和同步分析。HC、M-YL和Z-TM审查并编辑了手稿。HC监督了这项研究。M-YL和Z-TM贡献相同。所有作者都阅读并批准了最后的手稿。
通讯作者
道德声明
道德认可和参与同意
这些植物材料在世界各地广泛使用,采集植物样品不需要许可证。这些植物材料是按照中国四川农业大学生命科学学院的指导方针来维护的。本文不包含任何关于人类参与者或动物的研究,也不涉及任何濒危或受保护物种。
出版许可
不适用。
相互竞争的利益
作者声明他们没有相互竞争的利益。
额外的信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
权利和权限
开放获取本文在知识共享归属4.0国际许可条款下发布(http://creativecommons.org/licenses/by/4.0/),允许在任何介质中不受限制地使用、分发和复制,前提是您给予原始作者和来源适当的信任,提供到知识共享许可证的链接,并说明是否进行了更改。知识共享公共领域放弃(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
马,Z.,刘,M.,孙,W。et al。基因的全基因组鉴定和表达分析Trihelix.Tarrary Buckwheat的转录因子家庭(Fagopyrum tataricum).BMC植物生物学19,344 (2019). https://doi.org/10.1186/s12870-019-1957-x
已收到:
公认:
出版:
关键字
- FtTH公司
- 鞑靼荞麦
- 发展
- 表达
- 水果