- 研究文章GydF4y2Ba
- 开放访问GydF4y2Ba
- 发表:GydF4y2Ba
植物PARP家族的新观点:GydF4y2Ba拟南芥GydF4y2BaPARP3是无活性的,PARP1表现出响应DNA损伤的主要聚(ADP-核糖)聚合酶活性GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba19.GydF4y2Ba文章编号:GydF4y2Ba364.GydF4y2Ba(GydF4y2Ba2019年GydF4y2Ba)GydF4y2Ba
摘要GydF4y2Ba
背景GydF4y2Ba
聚(Adp-藜糖基)半月(PARINATION)是调节多细胞生物体中的DNA修复,基因转录,应激反应和发育过程的重要性后迁移修饰。聚(ADP-核糖)聚合酶(PARP)通过连续添加来自NAD的ADP-核糖部分来催化氨基化GydF4y2Ba+GydF4y2Ba到目标蛋白质上的氨基酸受体残基。GydF4y2Ba拟南芥GydF4y2Ba有三个典型的PARP成员,其中两个成员,AtPARP1和AtPARP2,已被证明是真正的多聚(adp -核糖)聚合酶,并调节DNA修复和应激反应过程。然而,AtPARP3作为在种子中高度表达的成员,是否与AtPARP1和AtPARP2具有相似的生化活性尚不清楚。此外,虽然AtPARP1和AtPARP2的系统发育关系和结构相似性都表明,AtPARP1和AtPARP2分别对应于动物中的PARP1和PARP2,但之前的两项研究表明,AtPARP2而不是AtPARP1占据了动物中大部分的PARP活性GydF4y2Ba拟南芥GydF4y2Ba,这与PARP1是动物中主要的PARP的认识相反。GydF4y2Ba
结果GydF4y2Ba
在本研究中,我们获得了体外和体内的证据,证明AtPARP3不作为一个典型的PARP在GydF4y2Ba拟南芥GydF4y2Ba.域交换和点突变检测表明AtPARP3已经失去了NADGydF4y2Ba+GydF4y2Ba-binding功能,且未激活。此外,我们的研究结果表明,在对DNA损伤诱导剂zeocin和甲基甲烷磺酸盐(MMS)的反应中,AtPARP1负责大部分的PARP酶活性,并且比AtPARP2更迅速地被激活,这支持了AtPARP1仍然是主要的PARP成员GydF4y2Ba拟南芥GydF4y2Ba.AtPARP1可能首先通过与损伤位点结合而被激活,然后AtPARP2在体内被AtPARP1聚(adp -核糖基)。GydF4y2Ba
结论GydF4y2Ba
总的来说,我们的生化和遗传分析结果强烈支持这样的观点,即AtPARP3在植物中失去了多聚(adp -核糖)聚合酶活性,并与AtPARP1和AtPARP2的功能不同。在种子和幼苗中,AtPARP1而不是AtPARP2在PAR合成中起主要作用。这些数据为我们理解植物PARP家族成员的生理功能提供了新的见解。GydF4y2Ba
背景GydF4y2Ba
聚(adp -核糖)聚合酶(PARP),催化蛋白质聚(adp -核糖)修饰(PARylation)的酶,广泛存在于不同的真核生物中,除了酵母[GydF4y2Ba1GydF4y2Ba].PARP从底物NAD转移adp核糖单元GydF4y2Ba+GydF4y2Ba使受体氨基酸在靶蛋白上产生长线性或支链的聚(adp -核糖)(PAR),然后这些单元可被一种水解酶,聚(adp -核糖)糖水解酶(PARG)除去[GydF4y2Ba1GydF4y2Ba,GydF4y2Ba2GydF4y2Ba].修饰的靶蛋白包括酶本身、组蛋白、DNA修复蛋白、转录因子、染色质调节剂[GydF4y2Ba2GydF4y2Ba,GydF4y2Ba3.GydF4y2Ba和参与防御反应的蛋白质[GydF4y2Ba4GydF4y2Ba].由于其高负荷,主要影响靶蛋白的蛋白质 - 蛋白质相互作用特征。par可能用作蛋白质结合的支架,用于募集其他蛋白质以形成大配合物[GydF4y2Ba2GydF4y2Ba].蛋白质可以通过它们的par结合基序与聚乳酸蛋白结合[GydF4y2Ba2GydF4y2Ba,GydF4y2Ba5GydF4y2Ba].PARP家族成员已经在人类中进行了广泛的研究,因为它们涉及多种发病机制[GydF4y2Ba6GydF4y2Ba,GydF4y2Ba7GydF4y2Ba].在研究或医学上使用的PARP抑制剂已经被开发出来,其中一些类似于NAD的结构GydF4y2Ba+GydF4y2Ba作为竞争抑制剂,如3-氨基苯甲酰胺(3-AB) [GydF4y2Ba5GydF4y2Ba,GydF4y2Ba8GydF4y2Ba,GydF4y2Ba9GydF4y2Ba,GydF4y2Ba10.GydF4y2Ba].在人类十七成员参与各种生理过程,如DNA修复,细胞死亡,转录调节,能量代谢,和染色质重塑[GydF4y2Ba2GydF4y2Ba,GydF4y2Ba11.GydF4y2Ba,GydF4y2Ba12.GydF4y2Ba].GydF4y2Ba
PARP家族在植物中的作用至今仍不为人所知。已在不同物种的细胞核中鉴定出PARP活性,如小麦[GydF4y2Ba13.GydF4y2Ba],豌豆[GydF4y2Ba13.GydF4y2Ba,大豆GydF4y2Ba14.GydF4y2Ba),烟草(GydF4y2Ba15.GydF4y2Ba,GydF4y2Ba16.GydF4y2Ba)、玉米(GydF4y2Ba13.GydF4y2Ba,GydF4y2Ba17.GydF4y2Ba),GydF4y2Ba拟南芥GydF4y2Ba[GydF4y2Ba17.GydF4y2Ba].目前已在植物中发现了三种不同分子量和结构结构的PARPs。在GydF4y2Ba拟南芥,GydF4y2Ba这些parp分别被命名为AtPARP1、AtPARP2和AtPARP3 [GydF4y2Ba18.GydF4y2Ba,GydF4y2Ba19.GydF4y2Ba].ATPARP1和ATPARP2在体外和体内具有自助性活性[GydF4y2Ba17.GydF4y2Ba,GydF4y2Ba20.GydF4y2Ba,GydF4y2Ba21.GydF4y2Ba,GydF4y2Ba22.GydF4y2Ba], AtPARP2是DNA损伤和免疫反应中主要的PARP [GydF4y2Ba22.GydF4y2Ba,但AtPARP3是否具有PARP活性尚不清楚。AtPARP1和AtPARP2已经被证明可以调节基因毒性[GydF4y2Ba23.GydF4y2Ba,GydF4y2Ba24.GydF4y2Ba]、生物及非生物应激反应[GydF4y2Ba4GydF4y2Ba,GydF4y2Ba10.GydF4y2Ba,GydF4y2Ba14.GydF4y2Ba,GydF4y2Ba15.GydF4y2Ba,GydF4y2Ba20.GydF4y2Ba,GydF4y2Ba22.GydF4y2Ba,GydF4y2Ba25.GydF4y2Ba,GydF4y2Ba26.GydF4y2Ba],以及叶和根的发育[GydF4y2Ba9GydF4y2Ba,GydF4y2Ba21.GydF4y2Ba,GydF4y2Ba27.GydF4y2Ba,GydF4y2Ba28.GydF4y2Ba].然而,最近的一项研究表明,PARP家族成员的双突变体和三重突变体在非生物胁迫下没有表型,或者由微生物相关分子模式(MAMP)FLG22刺激的生物应激下[GydF4y2Ba29.GydF4y2Ba,因此,PARPs在生物和非生物胁迫中的体内功能一直存在争议。GydF4y2BaAtPARP3GydF4y2Ba在种子,其中两个被高度表达GydF4y2BaAtPARP1GydF4y2Ba和GydF4y2BaAtPARP2GydF4y2Ba几乎无法察觉[GydF4y2Ba30.GydF4y2Ba,GydF4y2Ba31.GydF4y2Ba].有报道称AtPARP3参与了种子贮藏过程中种子活力的维持[GydF4y2Ba27.GydF4y2Ba,GydF4y2Ba30.GydF4y2Ba],因此推测AtPARP3而不是AtPARP1和AtPARP2是催化PARylation的主要酶,负责种子萌发过程中DNA的修复[GydF4y2Ba30.GydF4y2Ba,GydF4y2Ba31.GydF4y2Ba].GydF4y2Ba
PARP蛋白质分类为由中央六链β片组成的PARP签名,其结合和催化NAD的分解GydF4y2Ba+GydF4y2Ba[GydF4y2Ba11.GydF4y2Ba,GydF4y2Ba19.GydF4y2Ba,GydF4y2Ba32.GydF4y2Ba].在所有活性PARP蛋白中都发现了一个催化核心基序组氨酸-酪氨酸-谷氨酸(H-Y-E)三联基,并参与了NADGydF4y2Ba+GydF4y2Ba绑定。基于蛋白质的域架构,ATPARP1和ATPARP2分别类似于人类Hsparp1和Hsparp2 [GydF4y2Ba18.GydF4y2Ba,GydF4y2Ba19.GydF4y2Ba],而AtPARP3在人类中没有对应的基因。GydF4y2Ba
蛋白质是否具有已知的生化活性对于解释其生理作用是重要的。为了了解AtPARP3在种子中的功能,确定其酶活性是至关重要的。此外,阐明该蛋白家族成员之间的功能关系也将有助于我们了解该家族的进化和分化。在本研究中,我们通过生化和遗传学方法的结合,证明了AtPARP3在体外和体内均不具有聚(adp -核糖基)活性。我们还发现,在种子和幼苗中,当DNA断裂刺激时,AtPARP1相对于其他家族成员表现出显著的PARP酶活性。这一结果与之前的发现不同,即AtPARP2是DNA损伤反应中主要的PARP成员,但与它的动物对等物PARP1的作用相一致,后者占了基因毒性胁迫下大部分细胞内PARP活性。我们的研究结果揭示了植物PARP家族的性质。GydF4y2Ba
结果GydF4y2Ba
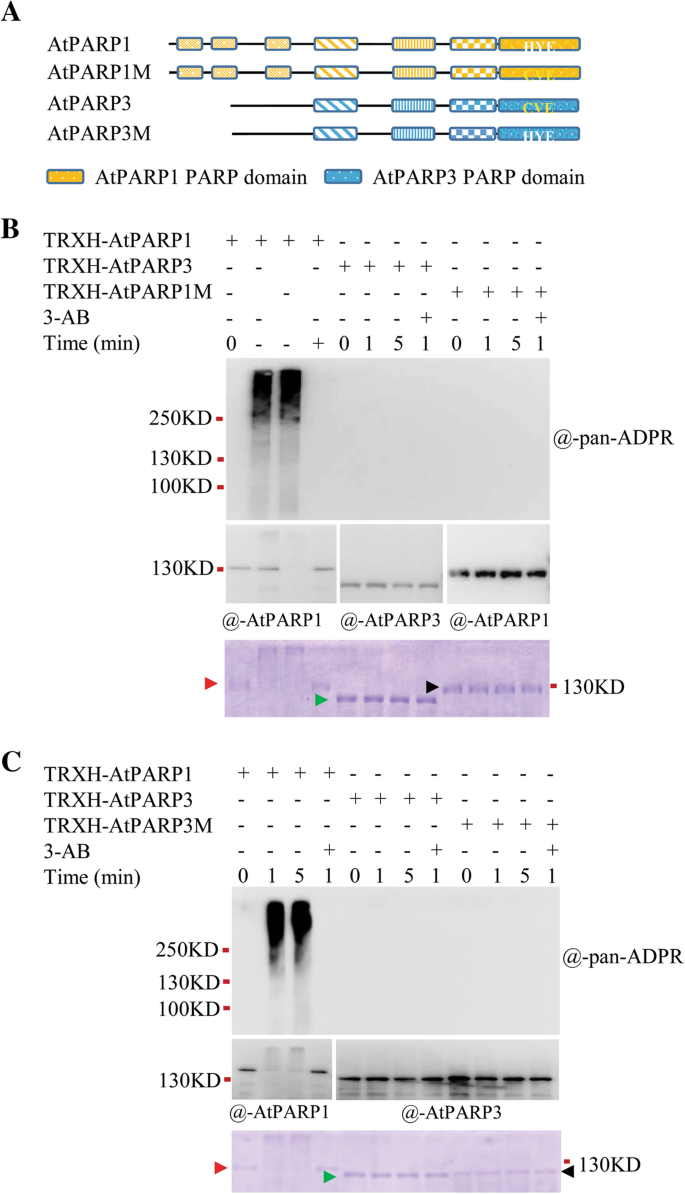
PARP1/2/3的结构域结构和系统发育关系GydF4y2Ba
AtPARP1在域架构方面与HsPARP1非常相似(附加文件GydF4y2Ba1GydF4y2Ba:图S1A)。HsPARP1被认为是人类PARP家族的创始成员[GydF4y2Ba1GydF4y2Ba,GydF4y2Ba3.GydF4y2Ba,GydF4y2Ba11.GydF4y2Ba].HsPARP1和AtPARP1都有5个重要的结构域,从N端到C端都有已知的功能:三个n端锌指负责DNA损伤检测,BRCA-1 c端(BRCT)结构域用于磷酸化蛋白结合,WGR结构域与保守的Trp-Gly-Arg (WGR)基序用于核酸结合,PARP调控结构域(PRD)或螺旋亚结构域(HD)用于调控par分支,以及具有催化活性的c端特征PARP结构域[GydF4y2Ba3.GydF4y2Ba,GydF4y2Ba33.GydF4y2Ba)(附加文件GydF4y2Ba1GydF4y2Ba:图S1A)。既HsPARP2和AtPARP2没有锌指或BRCT域,但做有两个SAF /腺泡/ PIAS基序(SAP)中的N-末端区结构域赋予DNA结合活性[GydF4y2Ba11.GydF4y2Ba,GydF4y2Ba19.GydF4y2Ba,GydF4y2Ba32.GydF4y2Ba].HsPARP3只有三个结构域,即WGR、PRD/HD和PARP结构域,并催化单(adp -核糖基)作用(mART),后者只将一个adp -核糖单元附着到靶蛋白上[GydF4y2Ba34.GydF4y2Ba],而AtPARP3有一个长n端区域,功能未知,具有BRCT、WGR、PRD/HD和PARP催化结构域。GydF4y2Ba
序列分析显示,AtPARP1和AtPARP2都具有典型的H-Y-E催化三联体,而AtPARP3在其催化核心中具有替代的组氨酸-缬氨酸-谷氨酸(C-V-E)三联体(Additional file)GydF4y2Ba1GydF4y2Ba:图S1B)。要了解不同物种中PARP系列的进化关系,我们使用从二十八种生物中鉴定的PARP1 / 2/3同源物构建了系统发育树,包括十八型高昂植物,两个裸子植物,一个Lycopod,一个苔藓,四个美唑烷和两个真菌,使用PARP1子类作为OUTGROUP(附加文件GydF4y2Ba2GydF4y2Ba:图S2)。系统发育树拓扑显示,PARP1 / 2/3亚壳在真核生物中形成两种蛹,每个含有美唑烷成员,这表明含有植物PARP2和植物PARP1 / 3的思工源于真核生物的共同祖先之前的基因重复生物。植物PARP1和PARP3的密切同源物单独的系统发育组,每个涉及Lycopod和Moss成员,这表明这些导致了在远端植物的分歧之前的重复,而是在从美唑烷和真菌分离植物之后。GydF4y2Ba
AtPARP3在体外没有显示自adp -核糖基化活性GydF4y2Ba
由于AtPARP3的活性未知,我们主要关注AtPARP3。我们首先检测了表达于GydF4y2Ba大肠杆菌GydF4y2Ba.为了避免融合标签对蛋白功能的影响,我们使用了两种不同的表达载体pGEX-4 T-1和pET-32a(+),它们分别携带一个谷胱甘肽s -转移酶(GST)和一个硫氧还蛋白和组氨酸(TRXH)标签融合到重组蛋白的N端。据报道,这两种标签有助于正确折叠目标蛋白质,特别是富含半胱氨酸的蛋白质。AtPARP1由pET-32a(+)载体表达,作为活性检测的阳性对照,因为它在体外比AtPARP2表现出更强的活性,正如我们之前的研究所证明的[GydF4y2Ba21.GydF4y2Ba].标记蛋白也用空载体表达,作为阴性对照。我们通过基于PARP蛋白自动修饰特征的标准PARP活性分析评估了它们的活性[GydF4y2Ba35.GydF4y2Ba].一种敏感的ADP-核糖检测试剂,其可以检测抗-PAN-ADP-核糖结合试剂的单 - 和聚-ADP-核糖糖,用于检测蛋白质上的ADP-核糖部分(基于提供的分析证书通过默克)。它已成功用于对人类的研究[GydF4y2Ba36.GydF4y2Ba].如图所示。GydF4y2Ba1GydF4y2Baa, AtPARP1在1分钟内产生了一个强烈的PAR信号,该条带呈向上涂抹的典型的poly (adp - ribosyation),这与之前的观察相符,PARP1是一种在秒内合成PAR的强大酶[GydF4y2Ba35.GydF4y2Ba,GydF4y2Ba37.GydF4y2Ba].信号被PARP抑制剂3-AB抑制,表明是真正的PAR信号。而GST-AtPARP3和TRXH-AtPARP3均未检测到adp -核糖信号。为排除AtPARP3可能需要较长反应时间的可能性,我们将孵育时间延长至30 min,未检测到PAR信号(图)。GydF4y2Ba1GydF4y2Bab)。GydF4y2Ba
ATPARP3酶活性的测定。GydF4y2Ba一种GydF4y2Ba重组AtPARP3活性测定。将纯化的蛋白质与500nm破碎的DNA和1mm NAD一起温育GydF4y2Ba+GydF4y2Ba使用或不使用20mm3 - ab在25°C不同的时间周期。电泳后,用抗泛adpr试剂或其他内对照抗体进行免疫印迹。以空载体pET32a(+)和pGEX-4 T-1表达的标签蛋白TRXH和GST作为阴性对照。底部面板考马斯蓝染SDS-PAGE凝胶显示了TRXH(黑色箭头)、GST(白色箭头)、TRXH- atparp1(红色箭头)、TRXH- atparp3(绿色箭头)、GST- atparp3(橙色箭头)的载药量。GydF4y2BaB.GydF4y2Ba在延长时间段下的活动确定。将纯化的蛋白质与500nm破碎的DNA和1mm NAD一起温育GydF4y2Ba+GydF4y2Ba在25°C的不同时间段。聚(adp -核糖基)蛋白在SDS-PAGE凝胶上分离,分别用抗泛adpr试剂(上图)和抗atparp3和抗atparp1抗体检测GydF4y2Ba
AtPARP3催化结构域无活性GydF4y2Ba
PARP催化结构域对PARP的活性有重要影响。n端DNA结合结构域与DNA结合后可与c端PARP催化结构域相互作用并激活[GydF4y2Ba33.GydF4y2Ba,GydF4y2Ba35.GydF4y2Ba].尽管ATPARP3具有BRCT,WGR,PRD / HD和PARP催化结构域,但在N末端区域中没有识别的DNA结合域(附加文件GydF4y2Ba1GydF4y2Ba:图S1);此外,C-V-E基序在催化核心取代了经典的H-Y-E三元结构。为了评估该结构域是否具有催化PAR形成的功能,我们将AtPARP1的催化结构域与AtPARP3的催化结构域进行了交换,如图所示。GydF4y2Ba2GydF4y2Baa.嵌合蛋白AtP1-P3和AtP3-P1在与AtPARP1和AtPARP3相同的表达系统中产生。与AtPARP1的强活性相比,携带AtPARP3催化结构域的AtPARP1蛋白(AtP1-P3)没有显示出PARP活性(图1)。GydF4y2Ba2GydF4y2Bab),表明ATPARP3催化结构域也未能形成均匀的靶标,即使存在来自ATPARP1的其他功能域。GydF4y2Ba
重组蛋白的结构域交换活性测定。GydF4y2Ba一种GydF4y2BaAtPARP1和AtPARP3之间的域交换实验示意图。不同的方框显示不同的领域。GydF4y2BaB.GydF4y2Ba活性测定的域交换蛋白。将纯化的蛋白质与500nm破碎的DNA和1mm NAD一起温育GydF4y2Ba+GydF4y2Ba在25℃下,对于具有或没有20mm 3-AB的不同时间段,然后通过使用不同抗体免疫印迹检测。Coomassie蓝染色的SDS-PAGE凝胶中的箭头表示重组蛋白TRXH-ATPARP1(红色),TRXH-ATPARP3(绿色),TRXH-ATP1-P3(橙色)和TRXH-ATP3-P1(黑色)。使用抗他的抗体检测表达的TrxH-ATP1-P3和TRXH-ATP3-P1蛋白GydF4y2Ba
然而,嵌合PARP3蛋白AtP3-P1中AtPARP3的大部分结构域被保留,仅催化结构域被AtPARP1取代(图2)。GydF4y2Ba2GydF4y2Baa),表现出组成活性,并且在所有时间点都能检测到PAR信号,甚至在没有外源性补充NAD的时间点“0”也能检测到PAR信号GydF4y2Ba+GydF4y2Ba和DNA(无花果。GydF4y2Ba2GydF4y2Bab). 3-AB只是稍微降低了信号,这表明信号已经在GydF4y2Ba大肠杆菌GydF4y2Ba净化前的细胞GydF4y2Ba,GydF4y2Ba和NADGydF4y2Ba+GydF4y2Ba而在检测过程中补充DNA只轻度增强其活性。这些结果表明,AtPARP3中的AtPARP1结构域的催化活性被构成性地“打开”。GydF4y2Ba
催化三联体之外的其他结构元素也决定了活性GydF4y2Ba
为了了解AtPARP3活性的丧失是否仅仅是催化三合体“H-Y”的改变,我们通过点突变将AtPARP1的“H-Y”突变为“C-V”(AtPARP1M),并将AtPARP3的“C-V”突变为“H-Y”(AtPARP3M)(图3)。GydF4y2Ba3.GydF4y2Baa),然后检查ATPARP1和ATPARP3突变蛋白的活性以及它们的野生型对照的活性。观察到ATPARP1M或ATPARP3M蛋白没有观察到PAR信号(图。GydF4y2Ba3.GydF4y2BaB和C)表明,ATPARP1中的H-Y-E的前两个氨基酸的突变足以消除PARP酶活性;然而,H-Y-E不是确定ATPARP3的活动的唯一重要主题,因为即使是典型的H-Y-E三合会也未能在ATPARP3中重新生成PARP活动。GydF4y2Ba
点突变蛋白的酶活性GydF4y2Ba.一种GydF4y2Ba点突变蛋白的示意图。催化三元结构中的残基在PARP结构域中给出。GydF4y2BaB.GydF4y2Ba突变的AtPARP1蛋白没有催化活性。对于TRXH-AtPARP1M, AtPARP1中的催化三联体由正常的H-Y-E变为C-V-E。GydF4y2BaCGydF4y2BaAtPARP3催化三联体的回突变不能恢复其活性。对于TRXH-AtPARP3M, AtPARP3中的催化三联征由C-V-E变为正常的H-Y-E。纯化蛋白与500 nM DNA和1 mM NAD孵育GydF4y2Ba+GydF4y2Ba使用或不使用20mm3 - ab在25°C不同的时间周期。反应后,使用不同抗体通过免疫印迹分析蛋白质。Coomassie蓝色SDS-PAGE凝胶中的箭头表示重组蛋白TRXH-ATPARP1(红色箭头),TRXH-ATPARP3(绿色箭头),TRXH-ATPARP1M或TRXH-ATPARP3M(黑箭头)GydF4y2Ba
其他几个主题也被认为是重要的PARP活动[GydF4y2Ba31.GydF4y2Ba,而AtPARP3则有所不同。除了催化三元基序外,AtPARP3还在NAD中携带改变基序1和2GydF4y2Ba+GydF4y2Ba褶皱(附加文件GydF4y2Ba1GydF4y2Ba:图S1B)。Histine-glycine-serine (H-G-S) in motif 1 and tyrosine-phenylalanine-alanine (Y-F-A) in motif 2 were replaced by cysteine-glycine-serine (C-G-S) and valine-phenylalanine-alanine (V-C-S), respectively, in AtPARP3, and these two motifs might provide a microenvironment for NAD+GydF4y2Ba绑定。GydF4y2Ba
Atparp3失去了与NAD结合的能力GydF4y2Ba+GydF4y2Ba
底物识别是酶发挥活性的前提。来理解可能存在的结构差异GydF4y2Ba拟南芥GydF4y2BaPARP酶,我们首先模拟了GydF4y2Ba拟南芥GydF4y2BaAtPARP1和AtPARP3,采用HsPARPs的解析晶体结构作为模型。具有代表性的图片说明了PARP催化结构域(绿色)与NAD的结合GydF4y2Ba+GydF4y2Ba分子(白色)如图所示。GydF4y2Ba4GydF4y2Baa.结果表明AtPARP3中的C和V残基不能正确定位NADGydF4y2Ba+GydF4y2Ba分子相对于人和那些GydF4y2Ba拟南芥GydF4y2BaPARP1。研究AtPARP3是否保留了与NAD结合的能力GydF4y2Ba+GydF4y2Ba,我们计算了PARP蛋白与NAD的结合亲和力GydF4y2Ba+GydF4y2Ba分子使用AutoDock软件[GydF4y2Ba39.GydF4y2Ba].ATPARP3与NAD的结合亲和力GydF4y2Ba+GydF4y2Ba显著低于其他已知活性PARP蛋白。PARP蛋白中,AtPARP1、AtPARP2、HsPARP1、HsPARP2为聚(adp -核糖)聚合酶;HsPARP3是单腺苷二磷酸转移酶;HsPARP5a和HsPARP5b介导寡核苷酸(adp -核糖基)作用[GydF4y2Ba32.GydF4y2Ba,GydF4y2Ba40GydF4y2Ba].所有这些蛋白质都可以与NAD结合GydF4y2Ba+GydF4y2Ba.AtPARP3与NAD的结合亲和力较低GydF4y2Ba+GydF4y2Ba提示AtPARP3可能已经失去了与NAD结合的能力GydF4y2Ba+GydF4y2Ba.GydF4y2Ba
PARPs与NAD的结合亲和性计算GydF4y2Ba+GydF4y2Ba.一种GydF4y2BaPARPs与NAD的分子对接模拟GydF4y2Ba+GydF4y2Ba.PARP催化结构域(绿色)与NAD结合的代表性图像GydF4y2Ba+GydF4y2Ba使用Autodock软件分析的分子(白色)。组氨酸(半胱氨酸中的半胱氨酸),酪氨酸(ATPARP3中的缬氨酸)和H-Y-E中的谷氨酸残基(ATPARP3中的C-V-e)三合会基序分别以红色,品红色和黄色标记。HSPARP1结构从先前公布的晶体结构中提取(PDB ID:1UK1)。使用基于同源性的蛋白质结构预测软件PHYRE2产生ATPARP1和ATPARP3结构[GydF4y2Ba38.GydF4y2Ba].GydF4y2BaB.GydF4y2Ba由硅分子对接产生的结合亲和性。对每个蛋白进行相同参数设置的分子对接实验,重复5次。从不同时间点的最高结合亲和力的平均值被用来评估蛋白质与NAD的结合亲和力GydF4y2Ba+GydF4y2Ba分子。从PDB下载人HsPARP1、HsPARP2、HsPARP3、HsPARP5a、HsPARP5b的结构信息GydF4y2Ba拟南芥GydF4y2BaPARPs采用Phyre2建模。使用学生t检验确定显著差异。Arunachal Pradesh,GydF4y2BaPGydF4y2Ba < 0.01
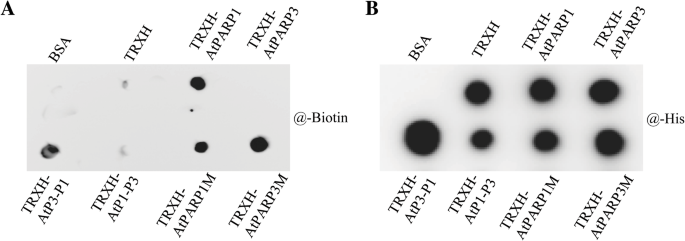
检测NAD的结合活性GydF4y2Ba+GydF4y2Ba到AtPARP3,我们用不相干的牛血清白蛋白(BSA)和融合标签蛋白TRXH作为阴性对照,将纯化的蛋白标记到聚偏氟乙烯(PVDF)膜上,并与生物素化的NAD孵育膜GydF4y2Ba+GydF4y2Ba.如果NADGydF4y2Ba+GydF4y2Ba与细胞膜上的蛋白质结合,NAD上的生物素标签GydF4y2Ba+GydF4y2Ba将允许检测NADGydF4y2Ba+GydF4y2Ba链霉亲和素/HRP信号(图。GydF4y2Ba5GydF4y2Baa).使用内控抗his抗体来观察膜上的蛋白质斑点量(图。GydF4y2Ba5GydF4y2Bab).结果表明,TRXH-AtPARP1和嵌合体TRXH-AtP3-P1蛋白能够与NAD结合GydF4y2Ba+GydF4y2Ba而具有AtPARP3催化结构域的蛋白TRXH-AtPARP3和TRXH-AtP1-P3则不能。此外,失活蛋白TRXH-AtPARP3M也显示出NADGydF4y2Ba+GydF4y2Ba- 措施活动,这表明C-V-E对H-Y-E的反向突变恢复了NADGydF4y2Ba+GydF4y2Ba这一发现进一步支持了H-Y-E三联基周围的其他基序对PARP酶活性也很重要的观点。令人惊讶的是,H-Y-E到C-V-E突变的AtPARP1蛋白仍然保持了NADGydF4y2Ba+GydF4y2Ba- 绕行活动即使它不活跃,但底层分子基础仍然未知。GydF4y2Ba
AtPARP3不负责种子中PAR的形成GydF4y2Ba
PARP通过粉状改变本身和其他蛋白质;因此,体内的PAR水平直接反映了细胞PARP活性。探讨ATPARP3是否在生理学上活跃,对野生型植物中的PAR水平和函数突变体的比较GydF4y2BaAtPARP3GydF4y2Ba至关重要。通过检查PAR水平GydF4y2Baparp3GydF4y2Ba在突变体和野生型植物中,我们可以确定AtPARP3在体内是否有活性。GydF4y2Ba
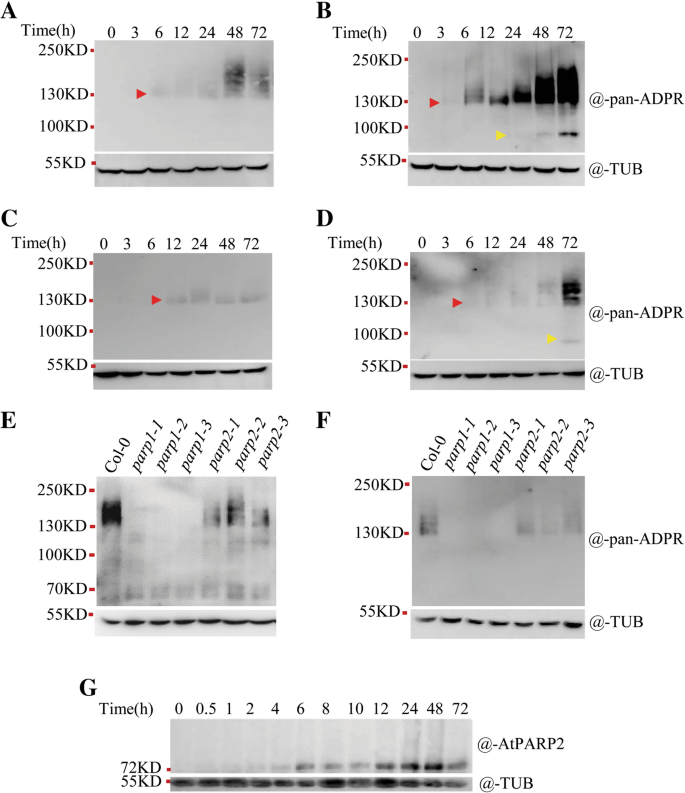
我们订购了T-DNA插入突变体GydF4y2BaAtPARP3GydF4y2Ba从Tair和命名为他们GydF4y2Baparp3-1GydF4y2Ba和GydF4y2Baparp3-2GydF4y2Ba.定量RT-PCR (RT-qPCR)和免疫印迹分析证实它们都是无效突变体(附加文件)GydF4y2Ba3.GydF4y2Ba:图S3A-C)。我们也包括了两者的多个突变体GydF4y2BaAtPARP1GydF4y2Ba和GydF4y2BaAtPARP2GydF4y2Ba进行比较。对于每个基因,至少使用了两个不同的突变体,所有这些突变体都在其他研究中使用过[GydF4y2Ba4GydF4y2Ba,GydF4y2Ba20.GydF4y2Ba,GydF4y2Ba22.GydF4y2Ba,GydF4y2Ba23.GydF4y2Ba,GydF4y2Ba24.GydF4y2Ba,GydF4y2Ba27.GydF4y2Ba,GydF4y2Ba29.GydF4y2Ba].突变体的T-DNA插入位点GydF4y2BaAtPARP1GydF4y2Ba和GydF4y2BaAtPARP2GydF4y2Ba基因显示在附加文件中GydF4y2Ba3.GydF4y2Ba:图S3D和E.GydF4y2Ba
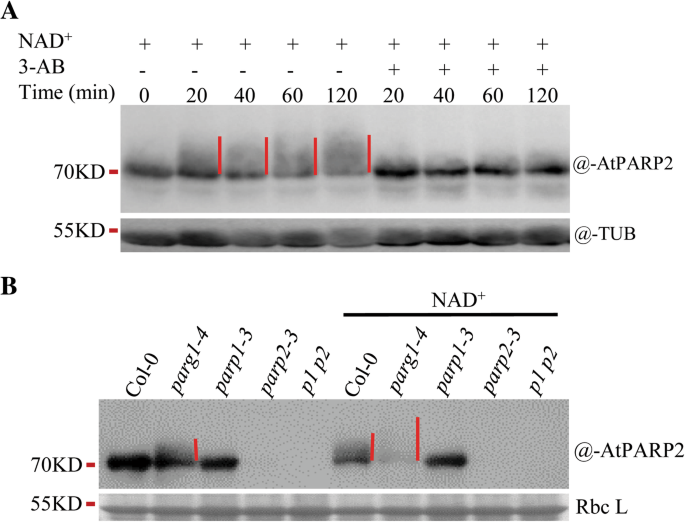
因为GydF4y2BaAtPARP3GydF4y2Ba在种子中大量表达,但在其他组织中表达较差[GydF4y2Ba30.GydF4y2Ba)(附加文件GydF4y2Ba3.GydF4y2Ba:图S3B和C;额外的文件GydF4y2Ba4GydF4y2Ba图S4A和B),如果AtPARP3具有PARP酶活性,则在种子中更容易检测其活性。AtPARP3被认为在修复种子在萌发过程中细胞分裂重新启动前脱水或储存引起的DNA损伤中发挥重要作用[GydF4y2Ba30.GydF4y2Ba,GydF4y2Ba31.GydF4y2Ba].因此,它可能是种子中有活性的PARP酶。而在干燥或萌发的种子中,正常条件下均未检测到PAR信号,基因毒素处理后亦未检测到。RT-qPCR数据也表明GydF4y2BaAtPARP1 / 2/3GydF4y2Bazeocin和甲基甲烷磺酸盐(MMS)处理对种子萌发早期(24 h内)的表达无响应,主要诱导DNA双链断裂和单链断裂[GydF4y2Ba41.GydF4y2Ba,GydF4y2Ba42.GydF4y2Ba)(附加文件GydF4y2Ba4GydF4y2Ba:图S4C和D)。因此,我们修改了我们的检测到更强大的试验。外源NAD.GydF4y2Ba+GydF4y2Ba由于NAD的原因,蛋白质提取物中补充了断裂DNAGydF4y2Ba+GydF4y2Ba是已知的PARP活性的限速因子。在有足够底物(NAD)存在的情况下GydF4y2Ba+GydF4y2Ba)和激活DNA时,可检测到任何残留的PARP活性。令人惊讶的是,我们在野生型的种子中都发现了PAR的形成GydF4y2Baparp2GydF4y2Ba突变体,GydF4y2Baparp3GydF4y2Ba变种人,但不是在两者的种子里GydF4y2Baparp1GydF4y2Ba突变体(无花果。GydF4y2Ba6GydF4y2Baa).由于NAD的充足供应,聚乳酸蛋白在SDS-PAGE凝胶上显示为大的涂片条带GydF4y2Ba+GydF4y2Ba底物中,PAR链明显较长。在两种情况下检测到PAR信号强度GydF4y2Baparp3GydF4y2Ba突变体与野生型比较接近,表明AtPARP3对种子中的PAR信号没有或无法检测到贡献。在GydF4y2Baparp1 parp2GydF4y2Ba(GydF4y2Bap1 p2GydF4y2Ba)双突变体,未检测到PAR信号,证实AtPARP3在体内不产生PAR。有趣的是,在所有带有GydF4y2BaAtPARP1GydF4y2Ba突变,如GydF4y2Baparp1GydF4y2Ba,GydF4y2Baparp1 parp2GydF4y2Ba,GydF4y2Baparp1 parp3GydF4y2Ba(GydF4y2Bap1 p3GydF4y2Ba),GydF4y2Baparp1 parp2 parp3GydF4y2Ba(GydF4y2Bap1 p2 p3GydF4y2Ba)突变体中,未检测到PAR信号,这表明即使在种子中,AtPARP1仍然是负责PAR形成的主要PARP,尽管表达水平GydF4y2BaAtPARP1GydF4y2Ba在种子比低得多GydF4y2BaAtPARP3GydF4y2Ba(附加文件GydF4y2Ba4GydF4y2Ba:图S4A)。为了验证在种子中检测到的PAR信号的有效性,我们在反应样品中加入竞争性抑制剂3-AB。3-AB几乎完全消除了信号(图。GydF4y2Ba6GydF4y2Bab),表明检测到的信号是真实的PAR信号。GydF4y2Ba
ATPARP3未显示种子中的聚(ADP-核糖)聚合酶活性GydF4y2Ba.一种GydF4y2BaPAR信号在野生型和突变型种子中产生,同时存在断裂DNA和NADGydF4y2Ba+GydF4y2Ba.GydF4y2BaB.GydF4y2BaPARP抑制剂3-AB可消除PAR信号。取50毫克野生型或各种突变型种子在蒸馏水中培养24小时。从种子中提取总蛋白,然后用1mm NAD孵育GydF4y2Ba+GydF4y2Ba在500nm的破碎DNA在25℃下持续10分钟。使用抗PAN-ADPR试剂检测PAR信号。在免疫斑测定中使用抗微管蛋白抗体以显示蛋白质负载量。GydF4y2Bap1 p2GydF4y2Ba,GydF4y2Baparp1-3 parp2-3GydF4y2Ba;GydF4y2Bap1 p3GydF4y2Ba,GydF4y2Baparp1-1 parp3-1GydF4y2Ba;GydF4y2BaP2 P3.GydF4y2Ba,GydF4y2Baparp2-1 parp3-1GydF4y2Ba;GydF4y2Bap1 p2p3GydF4y2Ba,GydF4y2Baparp1-3 parp2-3 parp3-1GydF4y2Ba;浴缸,微管蛋白GydF4y2Ba
ATPARP1具有较优异的PARP酶活性,响应Zeocin和幼苗的米姆治疗方法GydF4y2Ba
在种子中获得的结果引起了我们的兴趣,来研究AtPARP1是否也在幼苗中发挥了主导的PAR形成作用。在人体内,HsPARP1贡献了超过90%的PARP总活性,被认为是PARP家族的关键成员[GydF4y2Ba32.GydF4y2Ba,GydF4y2Ba43.GydF4y2Ba].但是,在GydF4y2Ba拟南芥GydF4y2Ba,据报道,AtPARP2而不是AtPARP1是参与幼苗DNA损伤和生物胁迫反应的主要PARP [GydF4y2Ba20.GydF4y2Ba,GydF4y2Ba22.GydF4y2Ba].我们首先检查三个表达水平GydF4y2BaPARPGydF4y2Ba基因在GydF4y2Ba拟南芥GydF4y2Ba发现GydF4y2BaAtPARP1GydF4y2Ba表达量最高GydF4y2BaAtPARP3GydF4y2Ba表达式在正常情况下是最低的(附加文件GydF4y2Ba4GydF4y2Ba:图S4B)。GydF4y2BaAtPARP3GydF4y2Ba在种子和幼苗中不能被Zeocin和MMS诱导(附加文件GydF4y2Ba4GydF4y2Ba:图S4C, D, E和F),而GydF4y2BaAtPARP1GydF4y2Ba和GydF4y2BaAtPARP2GydF4y2Ba在幼苗中zeocin和MMS都显著地诱导了转录(附加文件GydF4y2Ba4GydF4y2Ba:图S4E和F)。GydF4y2Ba
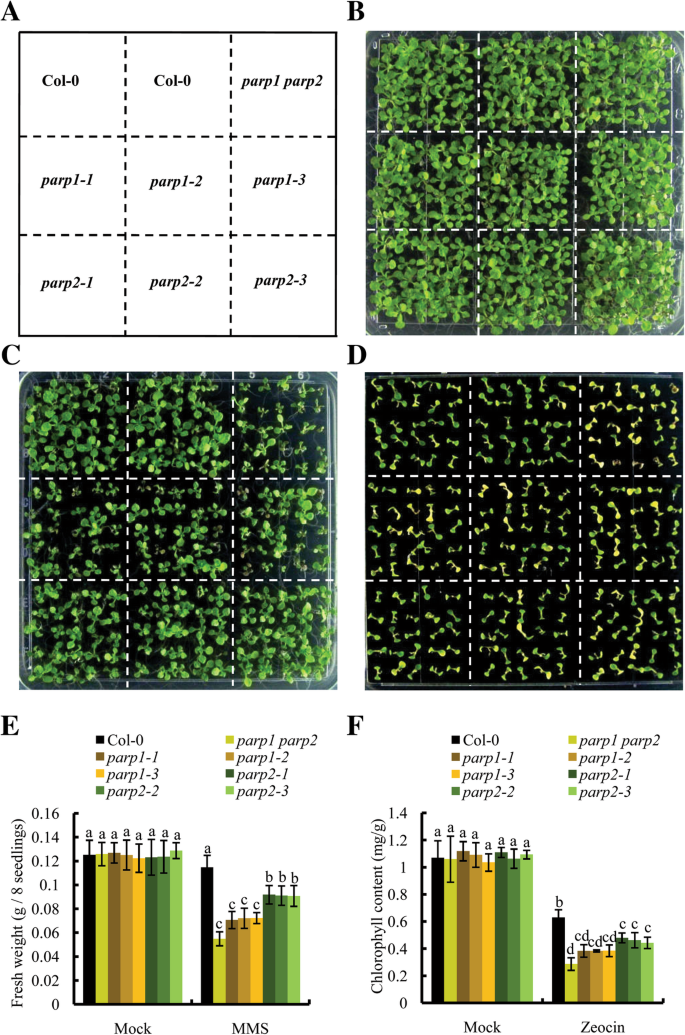
然后我们使用相同的GydF4y2BaparpGydF4y2Ba这些突变体在其他实验室用于研究PAR形成响应的dna损伤剂zeocin和MMS。与预期的一样,野生型幼苗在基因毒素处理后逐渐产生了PAR(图。GydF4y2Ba7GydF4y2Ba模拟)。所有PAR信号都来源于生理PARP活性,因为该实验没有外源NADGydF4y2Ba+GydF4y2Ba和激活DNA。总体而言,zeocin处理产生的PAR信号强于MMS处理(图)。GydF4y2Ba7GydF4y2Ba结果表明,与单链断裂诱导剂MMS相比,双链断裂诱导剂zeocin诱导的PAR形成率更高。更长的暴露时间和更高浓度的基因毒素也会产生更强的PAR信号。有趣的是,几乎没有PAR信号GydF4y2Baparp1-1, parp1-2GydF4y2Ba和GydF4y2Baparp1-3GydF4y2Ba突变体中,我们也没有检测到AtPARP2的自修饰活性GydF4y2Baparp1GydF4y2Ba基因毒素暴露后24小时内突变体(图。GydF4y2Ba7GydF4y2Bae和f),而AtPARP2在野生型幼苗中在这些时间点被很好地诱导(图。GydF4y2Ba7GydF4y2Bag). PAR信号较弱GydF4y2Baparp2-1GydF4y2Ba,GydF4y2Baparp2-2GydF4y2Ba和GydF4y2Baparp2-3GydF4y2Ba这表明AtPARP2的突变降低了AtPARP1的活性。当在含有MMS的培养皿中生长时GydF4y2Baparp1GydF4y2Ba突变体表现出比GydF4y2Baparp2GydF4y2Ba突变体(无花果。GydF4y2Ba8GydF4y2Bac和e,请参阅附加文件GydF4y2Ba5GydF4y2Ba:表S1为源数据);而在zeocin板上,虽然所有的幼苗都不能长大,但是GydF4y2Baparp1GydF4y2Ba突变体的叶绿素含量平均低于GydF4y2Baparp2GydF4y2Ba突变体(无花果。GydF4y2Ba8GydF4y2Bad和f)。我们一起参加,我们的生物化学和遗传数据支持ATPARP1而不是ATPARP2的结论,使其成为对策的最大贡献GydF4y2Ba拟南芥GydF4y2Ba和在DNA损伤响应主导作用。GydF4y2Ba
在zeocin和MMS处理下,AtPARP1产生大部分PAR信号。GydF4y2Ba一种GydF4y2Ba在Zeocin处理在100μg/ ml后,野生型幼苗产生的时间依赖性癌信号。GydF4y2BaB.GydF4y2Ba200 μg/mL zeocin处理野生型幼苗后产生的时间依赖性PAR信号。GydF4y2BaCGydF4y2Ba在100μg/ ml下MMS处理后野生型幼苗产生的时间依赖性癌信号。GydF4y2BaD.GydF4y2Ba野生型幼苗在200 μg/mL MMS处理后产生的时间依赖性PAR信号。GydF4y2BaE.GydF4y2Ba100 μg/mL zeocin处理24 h后,AtPARP1和AtPARP2不同突变体产生的PAR信号。GydF4y2BaFGydF4y2Ba不同的A突变体产生的PAR信号GydF4y2BatPARP1GydF4y2Ba和GydF4y2BaAtPARP2GydF4y2Ba在200μg/ ml的MMS处理24小时后。GydF4y2BaGGydF4y2Bazeocin对AtPARP2的时间依赖性诱导。用抗泛adpr试剂检测PAR信号。用抗AtPARP2抗体检测AtPARP2。用抗微管蛋白抗体检测微管蛋白,以显示蛋白载量。红色箭头表示聚(adp -核糖基)AtPARP1。黄色箭头表示聚(adp -核糖基)AtPARP2。浴缸,微管蛋白GydF4y2Ba
的GydF4y2Baparp1GydF4y2Ba突变体对MMS和zeocin处理比GydF4y2Baparp2GydF4y2Ba突变体。GydF4y2Ba一种GydF4y2Ba植物在板上的布置。GydF4y2BaB.GydF4y2Bacol0和突变体在½MS板上的表型不处理。GydF4y2BaCGydF4y2Ba在含100 μg/mL MMS的½MS板上检测Col-0和突变体的表型。GydF4y2BaD.GydF4y2Ba在含有150 μg/mL zeocin的½MS平板上检测Col-0和突变体的表型。GydF4y2BaE.GydF4y2Ba每八棵有或没有MMS处理的幼苗的鲜重。GydF4y2BaFGydF4y2Ba添加和不添加zeocin处理对幼苗叶绿素含量的影响。将种子播种在½MS板上,4℃暗箱分层3 d,转入光照16 h /暗8 h的生长室。实验采用两周大的幼苗。每个实验至少重复三次。结果显示为平均值±SDs从三个生物重复。双向方差分析与Bonferroni事后检验分析。不同的字母表示显著差异(GydF4y2BaPGydF4y2Ba< 0.05)GydF4y2Ba
在zeocin和MMS处理下,AtPARP1首先被激活,然后AtPARP2被激活GydF4y2Ba
dna损伤剂作用下PAR形成的时间依赖性结果(图。GydF4y2Ba7GydF4y2Baa-d)表明,在AtPARP1大小约为113 kD时,首先出现模糊带。这条模糊的带子全部消失了GydF4y2Baparp1GydF4y2Ba突变体(无花果。GydF4y2Ba7GydF4y2Bae和f),提示与AtPARP1相关。基因毒素攻击时AtPARP1的激活与在人类中观察到的HsPARP1被基因毒素迅速激活的结果一致[GydF4y2Ba44.GydF4y2Ba].在200 μg/ml zeocin处理后约48小时和200 μg/ml MMS处理后72小时,第2个条带开始出现,其大小为AtPARP2 (72 kD)(图2)。GydF4y2Ba7GydF4y2BaB和d),这个乐队消失在GydF4y2Baparp2GydF4y2Ba突变体(附加文件GydF4y2Ba6GydF4y2Ba:图S5),这表明它可能与AtPARP2相对应。如图所示。GydF4y2Ba7GydF4y2Bag,在48 h之前,zeocin已经高度诱导AtPARP2(图。GydF4y2Ba7GydF4y2Bag),但在AtPARP2上未检测到PAR信号,这意味着虽然产生了AtPARP2,但此时可能不会发生自动parylation。GydF4y2Ba
为了进一步验证AtPARP2在体内是被AtPARP1修饰还是自身修饰,我们采用免疫印迹法检测了AtPARP2蛋白的变化。在抗parp2抗体检测时,在生理条件下很难观察到parylate诱导的带移,这可能是由于PAR的负电荷减弱了抗体与修饰蛋白的结合,也可能是由于AtPARP2的PARylation太有限而无法观察到。为了放大PAR形成的典型涂片信号,我们添加了NADGydF4y2Ba+GydF4y2Ba到样品中;使用抗PARP2抗体(检测到非常醒目向上模糊带图。GydF4y2Ba9GydF4y2Baa),向上的痕迹被3-AB消除,这表明AtPARP2在外源NAD存在时确实是poly (ADP-ribosyl) atedGydF4y2Ba+GydF4y2Ba.评估催化活动是否来自ATPARP1或ATPARP2本身,我们使用了GydF4y2Baparp1GydF4y2Ba,GydF4y2Baparp2GydF4y2Ba,GydF4y2Bap1 p2GydF4y2Ba双突变体,GydF4y2Baparg1GydF4y2Ba突变体观察PAR涂片的稳态。PAR信号较强GydF4y2Baparg1GydF4y2BaPARG1主要负责PAR在体内的水解,PARG1的突变使得PARylated蛋白的检测变得容易(图2)。GydF4y2Ba9GydF4y2Bab)。GydF4y2Baparg1GydF4y2Ba突变体,在zeocin处理后48 h, AtPARP2 PARylated非常明显;然而,AtPARP2上的抹灰PAR信号在GydF4y2Baparp1GydF4y2Ba突变体,表明AtPARP2上的大部分PAR信号是由AtPARP1产生的,而不是由AtPARP1本身产生的。在这种情况下,AtPARP2可能不会发生或只发生非常有限的自动parylation。这个结果,连同先前在生理条件下的结果(没有外源性NAD)GydF4y2Ba+GydF4y2BaAtPARP2的PARylationGydF4y2Baparp1GydF4y2Ba未检测到突变体(图。GydF4y2Ba7GydF4y2Ba和额外的文件GydF4y2Ba6GydF4y2Ba:图S5)建议在基因毒应激下,首先激活ATPARP1,随后被激活ATPARP2,ATPARP2通过ATPARP1在体内进行修饰。GydF4y2Ba
AtPARP2在体内由AtPARP1聚(adp -核糖基)GydF4y2Ba.一种GydF4y2BaAtparp2是在补充NAD存在下的聚(ADP-核糖基)GydF4y2Ba+GydF4y2Ba在zeocin治疗。GydF4y2BaB.GydF4y2BaAtPARP2的多聚(adp -核糖基)作用在GydF4y2Baparg1GydF4y2Ba突变的和缩小的GydF4y2Baparp1GydF4y2Ba突变体。的10.-d-old seedlings were treated with 200 μg/mL zeocin for 48 h. The total proteins were extracted with or without exogenously supplemented 1 mM NAD+GydF4y2Ba,用抗泛adpr试剂检测PAR信号。用抗AtPARP2抗体检测AtPARP2。用抗微管蛋白抗体或考马斯色蓝染Rubisco大单位(Rbc L)条带的免疫印迹结果显示蛋白载量。红线表示聚(adp -核糖基)AtPARP2。浴缸,微管蛋白GydF4y2Ba
讨论GydF4y2Ba
确定蛋白质的生化活性对理解其生理功能是很重要的。在这里,我们证明了由于NAD的缺失,AtPARP3失去了PARP酶的活性GydF4y2Ba+GydF4y2Ba虽然根据序列同源性,AtPARP3被归为PARP家族。因此,应该考虑PARP活性之外的其他作用来确定其在体内的功能。我们还发现AtPARP1作为主要的PARPGydF4y2Ba拟南芥GydF4y2Ba在响应zeocin和MMS处理时,AtPARP2可以被AtPARP1修饰。GydF4y2Ba
基于系统发育分析结果(附加文件GydF4y2Ba2GydF4y2Ba(图S2),本研究中使用的大部分植物生物都只有一个PARP3成员GydF4y2Ba大豆GydF4y2Ba(两个副本),它们最近经历了一次全基因组复制事件[GydF4y2Ba45.GydF4y2Ba].此外,在系统发育树中,植物PARP3与人类PARP1的聚类相近,而与人类PARP3的聚类相近,提示PARP3可能已经进化到在动植物中发挥不同的功能。植物PARP3主要在种子中表达。由于AtPARP3不具有PARP酶活性,因此它可能发挥了新的作用,这一发现还需要进一步研究。GydF4y2Ba
人类HsPARP1的晶体结构为理解PARP的构效关系提供了重要信息[GydF4y2Ba33.GydF4y2Ba].分析表明,n端锌指1和3 (Zn1和Zn3)、WGR结构域、PRD/HD和c端催化结构域(CAT)是影响PARP活性的最重要结构域。Zn1, Zn3和WGR结构域共同结合到双链断裂上,导致PRD/HD疏水核心的扭曲,从而降低了CAT结构域的热稳定性,增加了其动力学[GydF4y2Ba33.GydF4y2Ba].GydF4y2Ba
PRD / HD结构域的疏水核心对于对PARP活性的调节至关重要。内部亮氨酸残基诱变到亲水性氨基酸可以在没有DNA的情况下激活Hsparp1 [GydF4y2Ba33.GydF4y2Ba,模拟DNA损伤引起的PRD/HD失真。我们发现AtPARP1的PRD/HD结构域(从S634到H768)中的一些保守的亮氨酸残基已经被AtPARP3的PRD/HD结构域(从A449到Y587)中的亲水氨基酸所取代,这可能解释了为什么将AtPARP1催化结构域放置在AtPARP3 (AtP3-P1)中会产生构成性活性蛋白而不激活DNA(图3)。GydF4y2Ba2GydF4y2Bab).相对于AtPARP1, AtPARP3 PRD/HD结构域的亲水核心可能扭曲了AtP3-P1嵌合蛋白的PRD/HD结构域并激活了AtPARP1催化结构域。利用AtPARP3的PRD/HD结构域,我们可以在不需要DNA激活的情况下,创造出一种新的构成活性PARP蛋白,这对研究PARP的功能具有潜在的价值。GydF4y2Ba
在人类PARP家族的17个成员中,已知只有HsPARP1、HsPARP2和HsPARP3参与DNA修复[GydF4y2Ba2GydF4y2Ba,GydF4y2Ba32.GydF4y2Ba].这些成员之间的距离比其他成员之间的距离更近。GydF4y2Ba拟南芥GydF4y2BaPARP1和PARP2分别对应人类的PARP1和PARP2,基于序列同源性和域结构(附加文件)GydF4y2Ba1GydF4y2Ba:图S1) [GydF4y2Ba18.GydF4y2Ba,GydF4y2Ba19.GydF4y2Ba].然而,GydF4y2Ba拟南芥GydF4y2Ba此前有报道称,PARP2在DNA损伤和生物应激反应中都发挥了主要作用[GydF4y2Ba20.GydF4y2Ba,GydF4y2Ba22.GydF4y2Ba[ATPARP2显示比ATPARP1更强的体外活性。GydF4y2Ba
显然,我们的结果并不支持这一结论,这可能是由于不同研究中使用的实验条件不同。首先,目前尚不清楚MABE1016试剂和抗PAR抗体对不同类型的PAR是否具有不同的敏感性和特异性。抗泛adp -核糖结合试剂(MABE1016,默克公司)声称能够检测单(adp -核糖)和多(adp -核糖),在我们的实验中,对PAR的检测,特别是对植物组织中的PAR的检测,明显比抗聚(adp -核糖)聚合物抗体[10H] (ab14459, Abcam)更敏感。anti-PAR抗体检测到的印迹上没有信号,而anti-pan- adp -核糖结合试剂在相同样品上可以观察到较强的PAR信号(附文件)GydF4y2Ba7GydF4y2Ba图S6A和B)。Anti-PAR抗体只能检测外源性NAD时的PAR信号GydF4y2Ba+GydF4y2Ba和活化的DNA加入到提取缓冲液,以提高催化PARP反应(附加文件GydF4y2Ba7GydF4y2Ba(图S6C),但这不是自NAD以来的一种生理状况GydF4y2Ba+GydF4y2Ba在体内数量有限。在此条件下,所有可能的底物都可能被PARPs PARylated。尽管如此,大多数PAR信号在三年内消失了GydF4y2Baparp1GydF4y2Ba突变体,再次支持AtPARP1贡献了大部分的PARP活性。GydF4y2Ba
其次,对于体外实验,使用不同的蛋白质表达系统。ATPARP1和ATPARP3都有21个半胱氨酸酸,而ATPARP2只有六个半胱氨酸酸。二硫化物形成可能不是ATPARP2的问题,但可以诱导ATPARP1的异常折叠GydF4y2Ba大肠杆菌GydF4y2Ba.因此,选择合适的AtPARP1表达载体显得尤为重要。我们使用pET32a(+)载体产生AtPARPs,因为该载体中的硫氧还蛋白标签可以促进宿主菌株(如BL21(DE3)trxB)中外源蛋白的正确二硫键结合GydF4y2Ba−GydF4y2Ba和Origami(DE3),详见制造商的手册。重组蛋白TRXH-AtPARP1显示鲁棒活性在我们的测定中,产生秒内大量PAR的,这与人类PARP1。在以前的研究中使用麦芽糖结合结构域(MBD)标签来表达重组AtPARP1和AtPARP2蛋白质,并在我们的身边,通过边实验,MBD-融合AtPARP1和AtPARP2均高于TRXH融合AtPARP1不太活跃,AtPARP2,分别为(附加文件GydF4y2Ba8GydF4y2Ba图S7A和B),总的来说,在我们的实验中,在相同的孵育时间内,AtPARP2产生的PAR链比AtPARP1短。GydF4y2Ba
最后,对于体内测定,用于诱导DNA断裂的不同遗传毒素。在先前的研究中使用博来霉素和丝裂霉素(MMC)治疗[GydF4y2Ba22.GydF4y2Ba],而Zeocin和MMS用于我们的实验中。虽然Zeocin属于博来霉素家族,但它施加更温和的DNA损坏效果而不是博来霉素(产品数据表提供GydF4y2Bawww.calbiochem.comGydF4y2Ba).在我们与博莱霉素和zeocin的并排实验中,我们不断观察到AtPARP1负责大部分PAR的产生(附加文件GydF4y2Ba9GydF4y2Ba:图S8B和C)。下温和基因组的刺激,诸如具有低或中等剂量双链或单链DNA破剂的治疗,是在2天(图仅观察到AtPARP1的激活。GydF4y2Ba7GydF4y2Baa和c),之后AtPARP2主要被AtPARP1磷酸化(图1)。GydF4y2Ba7GydF4y2Ba, 图。GydF4y2Ba9GydF4y2Ba和额外的文件GydF4y2Ba6GydF4y2Ba:图S5)。即便如此,在DNA损伤反应的后期阶段或更严重的DNA损伤条件下,也不能排除AtPARP2自我修饰的可能性。GydF4y2Ba
我们的表型分析也表明这三个GydF4y2Baparp1GydF4y2Ba突变体比三基因毒性应激更敏感GydF4y2Baparp2GydF4y2Ba突变体(无花果。GydF4y2Ba8GydF4y2Ba),支持AtPARP1在GydF4y2Ba拟南芥GydF4y2BaDNA损伤反应。在一种nimals, AtPARP1 binds to DNA damage sites in less than 1 s [46.GydF4y2Ba[因此,将快速DNA损伤检测中的作用分配给该蛋白质。ATPARP1也可以作为植物细胞中的DNA断裂的快速检测器。通过与ATPARP2进行交互[GydF4y2Ba22.GydF4y2Ba],它其自激活后修改AtPARP2,然后AtPARP1和AtPARP2协调参与DNA修复过程。亲缘关系和结构的相似性有力地表明,GydF4y2Ba拟南芥GydF4y2BaPARP1更接近动物PARP1,其在体内的贡献超过90%的PARP活性的[GydF4y2Ba43.GydF4y2Ba].我们的生化和遗传数据也支持AtPARP1,类似于HsPARP1 [GydF4y2Ba46.GydF4y2Ba,GydF4y2Ba47.GydF4y2Ba]在DNA损伤反应中起着主导作用GydF4y2Ba拟南芥GydF4y2Ba.GydF4y2Ba
结论GydF4y2Ba
综上所述,我们的研究结果表明,AtPARP3在种子中并不作为PARP酶发挥作用,这意味着AtPARP3需要考虑除PARP酶活性之外的其他作用。此外,AtPARP1,而不是AtPARP2和AtPARP3,是在zeocin和MMS处理下种子和幼苗中负责PARylation的主要酶,支持PARP1在动植物DNA损伤反应中的保守主导作用。GydF4y2Ba
方法GydF4y2Ba
植物材料和生长条件GydF4y2Ba
所有GydF4y2Ba拟南芥GydF4y2Ba种子为col0生态型背景。本文研究的基因序列数据可在TAIR网站(GydF4y2Bahttps://www.arabidopsis.org/GydF4y2Ba)以下加入号码下的GenBank数据库:GydF4y2BaAtPARP1GydF4y2Ba(At2g31320),GydF4y2BaAtPARP2GydF4y2Ba(At4g02390),GydF4y2BaAtPARP3GydF4y2Ba(At5g22470),GydF4y2BaAtPARG1GydF4y2Ba(At2g31870)。col0和T-DNA插入系种子GydF4y2Baparp3-1GydF4y2Ba(Salk_108092C),GydF4y2Baparp3-2GydF4y2Ba(Sail_632_D07)和GydF4y2Baparg1-4GydF4y2Ba(Salk_012110)是从TAIR数据库订购的。以下实验室提供了其他T-DNA突变体:GydF4y2Baparp1-1GydF4y2Ba,GydF4y2Baparp1-2GydF4y2Ba,GydF4y2Baparp2-1GydF4y2Ba,GydF4y2Baparp2-2GydF4y2Ba,GydF4y2Baparp1 parpGydF4y2Ba3,和GydF4y2Baparp2 parp3GydF4y2Ba种子是从马丁·路德大学的埃德加·皮特博士的实验室获得的GydF4y2Baparp1-3GydF4y2Ba,GydF4y2Baparp2-3GydF4y2Ba,GydF4y2Baparp1 parp2GydF4y2Ba种子来自莱顿大学的德·佩特博士的实验室。这些行可以在TAIR数据库的以下库存编号下找到:GydF4y2Baparp1-1GydF4y2Ba(GK_380E06),GydF4y2Baparp1-2GydF4y2Ba(GK_382F01),GydF4y2Baparp1-3GydF4y2Ba(GK_692A05),GydF4y2Baparp2-1GydF4y2Ba(GK_420G03),GydF4y2Baparp2-2GydF4y2Ba(Sail_1250_B03),GydF4y2Baparp2-3GydF4y2Ba(Salk_140400)。GydF4y2Ba
通过基因组DNA PCR,RT-QPCR或免疫印迹分析鉴定纯合体。用于鉴定突变体的PCR引物在附加文件中列出GydF4y2Ba10.GydF4y2BaS2:表。突变体GydF4y2Baparg1-4GydF4y2Ba,GydF4y2Baparp1-1、parp1-2 parp1-3GydF4y2Ba,GydF4y2Baparp2-1、parp2-2 parp2-3GydF4y2Ba,GydF4y2Bap1 p2GydF4y2Ba(GydF4y2Baparp1-3 parp2-3GydF4y2Ba)。[GydF4y2Ba23.GydF4y2Ba,GydF4y2Ba24.GydF4y2Ba,GydF4y2Ba29.GydF4y2Ba,GydF4y2Ba30.GydF4y2Ba].GydF4y2BaP2 P3.GydF4y2Ba建成使用GydF4y2Baparp2-3和parp3-1GydF4y2Ba;GydF4y2Bap1 p3GydF4y2Ba是通过杂交获得的GydF4y2Baparp1-3GydF4y2Ba和GydF4y2Baparp3-1GydF4y2Ba;和GydF4y2Bap1 p2 p3GydF4y2Ba得到使用GydF4y2Baparp1-3, parp2-3GydF4y2Ba和GydF4y2Baparp3-1GydF4y2Ba.幼苗在生长室中生长,在22℃下进行16 h光照和8 h黑暗的光周期循环。GydF4y2Ba
RNA提取和RT-qPCRGydF4y2Ba
总RNA从GydF4y2Ba拟南芥GydF4y2Ba使用Trizol试剂(Takara,Japan)提取幼苗,并如前所述提取来自种子的总RNA [GydF4y2Ba48.GydF4y2Ba].用GDNA橡皮擦(Takara,Japan)的Primesscript™RT试剂盒具有逆转录RNA。使用CFX96™实时PCR检测系统(Bio-Rad,USA)与Sybr Premix ExTaq™套件(Takara,Japan)进行QPCR进行QPCR。的GydF4y2Ba拟南芥UBQ5GydF4y2Ba基因作为内对照,对不同样本进行归一化处理。RT-qPCR引物列于附加文件GydF4y2Ba10.GydF4y2BaS2:表。对每个样品进行三个生物学重复分析。GydF4y2Ba
蛋白表达和adp -核糖基化分析GydF4y2Ba
从10 d龄幼苗的cDNA中扩增出AtPARP1和AtPARP2的编码序列。的GydF4y2BaAtPARP1GydF4y2Ba将编码区克隆到带有TRXH标签的pET32a(+)载体和带有麦芽糖结合域(MBD)标签的pMAL-c5G载体中GydF4y2Ba囊GydF4y2Ba我/GydF4y2Ba不GydF4y2Ba我和GydF4y2Ba濒死经历GydF4y2Ba我/GydF4y2Ba萨尔GydF4y2Ba和GydF4y2BaAtPARP2GydF4y2Ba克隆到pET32a(+)使用GydF4y2BaBamGydF4y2Ba嗨GydF4y2Ba/ XhoI位GydF4y2Ba我的网站。MBP-AtPARP2质粒由何平博士提供[GydF4y2Ba20.GydF4y2Ba].ATPARP3编码序列从GydF4y2Ba拟南芥GydF4y2Ba克隆到pET32a(+)载体和pGEX-4 T-1载体上,并用GST标记GydF4y2Ba萨尔GydF4y2Ba我/GydF4y2Ba不GydF4y2Ba我的网站。根据标准方案(Novagen, Germany)将蛋白表达结构转化为Origami (DE3)感受态细胞。空载体也转化为标签蛋白表达。标记蛋白在生化活性测定中作为阴性对照。重组蛋白用充满镍Sepharose Fast Flow (GE Healthcare, Sweden)的柱纯化。纯化蛋白在10 mM Tris-HCl (pH 7.5)缓冲液中完全透析以除去盐分。将蛋白(1 ~ 10 μg)分别加入含有20 mM Tris-HCl (pH 7.5)、50 mM NaCl、7.5 mM MgCl的试管中GydF4y2Ba2GydF4y2Ba,0.2 mM DTT, and 500 nM synthesized DNA oligos [35.GydF4y2Ba].启动反应,NADGydF4y2Ba+GydF4y2Ba(Sigma Aldrich,美国)加入到每个试管中,使最终浓度为1mm。反应在室温下持续所需时间,然后加入3倍体积的预冷丙酮终止。沉淀蛋白离心后用SDS-PAGE进行免疫印迹或考马斯蓝染色。用抗泛adp -核糖结合试剂(Merck, Germany)、抗his抗体(Proteintech, USA)、抗atparp1多克隆抗体(针对GydF4y2Ba大肠杆菌GydF4y2Ba-表达全长AtPARP1)(优科生物,中国)和抗atparp3多克隆抗体(抗GydF4y2Ba大肠杆菌GydF4y2Ba- 分别用于检测不同信号的atparp3片段160s-392k)(Youke Biotech,中国)。在化学发光反应后,使用ChemScope 3300 mini仪器(Clinx,Chinl)可视化蛋白质带。GydF4y2Ba
点污点GydF4y2Ba
纯化的蛋白印迹在甲醇活化的PVDF膜上(Millipore,美国)。室温干燥后,用25 μM生物素化NAD孵育GydF4y2Ba+GydF4y2Ba(Trevigen, USA)和500 nM在25°C下合成DNA寡聚体30分钟。用TBST缓冲液(50 mM Tris, 0.5 M NaCl, 0.05% Tween-20, pH 8.0)洗涤印迹,然后用streptavidin/HRP (Solarbio, China)在室温下孵育2 h。与化学发光底物反应后,使用ChemScope 3300微型仪器(CLINX, China)检测荧光信号。以BSA和tag蛋白为阴性对照,以AtPARP1为阳性对照。用anti-His抗体(Proteintech, USA)获得的信号作为每个位点的蛋白负载对照。GydF4y2Ba
蛋白质提取和免疫印迹GydF4y2Ba
用不同浓度的zeocin或MMS处理10 d龄幼苗48 h,检测幼苗PAR信号。幼苗(100 mg)在液氮中均质,然后悬浮在蛋白提取缓冲液(50 mM Tris-HCl pH 8.0, 100 mM NaCl, 5 mM MgCl)中GydF4y2Ba2GydF4y2Ba,10%甘油,0.1%NP-40和蛋白酶抑制剂混合物)。的supernatant was isolated by centrifugation, and after SDS loading buffer was added to the sample, the sample tube was boiled for 10 min. After SDS-PAGE analysis, the proteins were blotted onto Immobilon-P Transfer membranes (Millipore, USA). The PAR levels were detected using anti-Pan-ADPR binding reagent or anti-poly (ADP-ribose) polymer antibody [10H] (ab14459, Abcam, UK). AtPARP2 was detected using an anti-AtPARP2 polyclonal antibody (against the大肠杆菌GydF4y2Ba-表达的全长AtPARP2) (Youke Biotech,中国),微管蛋白检测用抗微管蛋白抗体(Beyotime,中国)作为负载对照。使用ChemScope 3300微型仪器(CLINX,中国)对蛋白信号进行可视化。GydF4y2Ba
将干种子(50 mg)浸泡于蒸馏水中24 h,用蛋白提取缓冲液提取总蛋白,检测种子中PAR信号。仔细去除表面漂浮的不溶性和脂肪酸成分后,将上清蛋白与1mm NAD在25°C下孵育10分钟GydF4y2Ba+GydF4y2Ba和500 nm DNA oligos。如上所述进行免疫印迹。GydF4y2Ba
分子对接和结合亲和力计算GydF4y2Ba
对HsPARP1、HsPARP2、HsPARP3、HsPARP5a、HsPARP5b的蛋白结构进行了解析,结构数据可从RCSB蛋白数据库(PDB,GydF4y2Bahttps://www.rcsb.org/GydF4y2Ba).AtPARP1、AtPARP2和AtPARP3没有晶体结构;因此,我们使用在线结构预测软件Phyre2 [GydF4y2Ba38.GydF4y2Ba)(GydF4y2Bahttp://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index.GydF4y2Ba)预测他们的结构。ATPARP1,ATPARP2和ATPARP3的产生结构与HSPARP1,HSPARP2,HSPARP3,HSPARP5A和HSPARP5B的分辨结构一起用于分子对接。GydF4y2Ba
NAD的结构文件GydF4y2Ba+GydF4y2Ba使用ChemBio3D软件生成。开源程序Autodock Vina [GydF4y2Ba39.GydF4y2Ba]被用来进行分子对接实验。具体来说,该蛋白被设定为刚性结构,而NADGydF4y2Ba+GydF4y2Ba分子是柔性的,与所有的可旋转的键的(17个32)自由旋转。在组氨酸的α碳(在AtPARP3半胱氨酸)的坐标被用于居中对接格框,因为三联征基序组氨酸和酪氨酸残基是已知的参与NADGydF4y2Ba+GydF4y2Ba绑定。对接网格盒尺寸为22.5GydF4y2Ba∗GydF4y2Ba22.5GydF4y2Ba∗GydF4y2Ba所有蛋白质22.5(埃单位)。GydF4y2Ba
对于每个蛋白,在相同的参数下重复分子对接实验5次,每次产生9种结合亲和力不同的结合模式。不同时间点的最高结合亲和力的平均值被用来评估蛋白与NAD的结合亲和力GydF4y2Ba+GydF4y2Ba分子。GydF4y2Ba
序列和基序分析GydF4y2Ba
使用Mafft Server进行PARP蛋白序列的对准(GydF4y2Bahttps://www.ebi.ac.uk/Tools/msa/mafft/GydF4y2Ba)[GydF4y2Ba49.GydF4y2Ba].利用NCBI CDD工具预测PARPs的保守功能域(GydF4y2Bawww.ncbi.nlm.nih.gov cddGydF4y2Ba)使用TAIR服务器提供的结构信息(GydF4y2Bawww。GydF4y2Ba拟南芥GydF4y2Ba.orgGydF4y2Ba)作为参考。GydF4y2Ba
鉴定PARP1 / 2/3亚家族成员和系统发育分析GydF4y2Ba
选择28种代表性物种用于PARP基因家族中PARP1 / 2/3亚家族的系统发育分析(附加档案GydF4y2Ba11.GydF4y2Ba:表S3)。19个被选物种的基因组和蛋白质组序列(GydF4y2Ba毛蕨、拟南芥、芥菜、风疹辣椒、番木瓜、黄瓜、甘草酸、短梗苜蓿、流苏、水稻、菜豆、小立碗、毛蕨杨、可可树、卷柏、双色高粱、马铃薯、葡萄GydF4y2Ba和GydF4y2Ba目前GydF4y2Ba)已从Phytozome第12版下载[GydF4y2Ba50.GydF4y2Ba].的蛋白质组序列GydF4y2Ba莲,云杉GydF4y2Ba和GydF4y2Ba银杏叶GydF4y2Ba下载了GydF4y2Bahttps://omicatools.com/lotus-db-tool.GydF4y2Ba[GydF4y2Ba51.GydF4y2Ba], ConGenIE [GydF4y2Ba52.GydF4y2Ba]和GigaDB [GydF4y2Ba53.GydF4y2Ba], 分别。四只动物的蛋白质组学序列(GydF4y2Ba秀丽隐杆线虫,黑腹果蝇,人类,GydF4y2Ba和GydF4y2BaMimulus guttatusGydF4y2Ba)及两种真菌(GydF4y2BaMycena alexandriGydF4y2Ba和GydF4y2BaSarcoscypha coccineaGydF4y2Ba)从Ensembl [GydF4y2Ba54.GydF4y2Ba]及MycoCosm [GydF4y2Ba55.GydF4y2Ba], 分别。GydF4y2Ba
为了鉴定PARP1 / 2/3亚家族的成员,使用ATPARP1,2和3的蛋白质序列用作使用Diamond Blastp对28种所选物种的蛋白质蛋白质爆炸的疑问[GydF4y2Ba56.GydF4y2Ba, e值≤1 × 10GydF4y2Ba- 5GydF4y2Ba.根据Pfam的分析[GydF4y2Ba57.GydF4y2Ba,筛选目标数据集,去除无WGR、PARP_reg或PARP域的序列。在本研究中,只选择了包含所有三个结构域的> 50同源物作为PARP1/2/3亚家族蛋白。使用MAFFT对多个蛋白序列进行比对[GydF4y2Ba49.GydF4y2Ba],使用AliView手动调整默认参数[GydF4y2Ba58.GydF4y2Ba],然后用trimAL [GydF4y2Ba59.GydF4y2Ba],选项为“-gt 0.6”。为了说明PARP1/2/3亚家族之间的进化关系,使用RAxML版本8.1.17构建了最大似然(ML)系统发育树[GydF4y2Ba60.GydF4y2Ba[Protcatjttte]的模型。使用100次重复执行自举显着性测试。GydF4y2Ba
叶绿素提取GydF4y2Ba
大约20 mg的幼苗在液氮中均质,然后在95%丙酮中在黑暗中提取15分钟。离心分离上清液10 min,分光光度法测定OD645、OD663值。总叶绿素含量按以下公式计算:Chl a + Chl b = (20.21GydF4y2Ba∗GydF4y2BaOD645 + 8.02GydF4y2Ba∗GydF4y2BaOD663) / 1000GydF4y2Ba∗GydF4y2Ba体积/重量。GydF4y2Ba
PARP蛋白的结构域交换和点突变GydF4y2Ba
重组蛋白ATP1-P3包括ATPARP3的ATPARP1的氨基酸1-628,ATPARP3的氨基酸424-814。ATP3-P1蛋白由ATPARP1的ATPARP3的氨基酸1-423和ATPARP1的氨基酸组成。氨基酸629-984。使用Novorec®PCR一步克隆套件(Sinobio,China)连接这些区域的cDNA片段。对于点突变,ATPARP1的催化性三合会由三个氨基酸,H833-y867-E960组成,而ATPARP3的催化性三合组由C653-V687-E782氨基酸组成。通过两步PCR位点定向方法获得具有催化三联点突变的蛋白质的编码序列[GydF4y2Ba61.GydF4y2Ba].详细地,将ATPARP1或ATPARP3的DNA序列分成两个碎片。第一点突变被设计在一对引物中,并进行PCR以扩增第一片段。然后将第二点突变包括在另一对引物中并使用相同的方法完成。使用全长引物通过PCR连接两种PCR片段。使用两个点突变的全长片段克隆到PET32a(+)载体中使用GydF4y2Ba萨尔GydF4y2Ba我/GydF4y2Ba不GydF4y2Ba我的网站。上述实验中使用的所有引物列于其他文件中GydF4y2Ba10.GydF4y2BaS2:表。GydF4y2Ba
可用性数据和材料GydF4y2Ba
支持本文中描述的结论的数据集包含在稿件及其附加文件中,并且原始数据可以在合理的请求时从相应的作者获得。GydF4y2Ba
缩写GydF4y2Ba
- 3 ab:GydF4y2Ba
-
3-aminobenzamideGydF4y2Ba
- BRCT:GydF4y2Ba
-
brca1基因糖基GydF4y2Ba
- BSA:GydF4y2Ba
-
牛血清中的白蛋白GydF4y2Ba
- 猫:GydF4y2Ba
-
c端催化领域GydF4y2Ba
- C-G-S:GydF4y2Ba
-
cysteine-glycine-serineGydF4y2Ba
- C-V-E:GydF4y2Ba
-
histidine-valine-glutamic酸GydF4y2Ba
- GST:GydF4y2Ba
-
谷胱甘肽S-transferaseGydF4y2Ba
- 高清:GydF4y2Ba
-
螺旋子域名GydF4y2Ba
- H-G-S:GydF4y2Ba
-
histine-glycine-serineGydF4y2Ba
- H-Y-E:GydF4y2Ba
-
histidine-tyrosine-glutamic酸GydF4y2Ba
- MAMP:GydF4y2Ba
-
微生物相关分子模式GydF4y2Ba
- 集市:GydF4y2Ba
-
单体(ADP-核糖基)GydF4y2Ba
- MBD:GydF4y2Ba
-
maltose-binding域GydF4y2Ba
- MMC:GydF4y2Ba
-
丝裂霉素GydF4y2Ba
- MMS:GydF4y2Ba
-
甲基显示出GydF4y2Ba
- 票面价值:GydF4y2Ba
-
保利(ADP-ribose)GydF4y2Ba
- PARG:GydF4y2Ba
-
保利(ADP-ribose) glycohydrolaseGydF4y2Ba
- PARP:GydF4y2Ba
-
保利(ADP-ribose)聚合酶GydF4y2Ba
- 粉状:GydF4y2Ba
-
保利(ADP - ribosyl)GydF4y2Ba
- 珠江三角洲:GydF4y2Ba
-
PARP监管领域GydF4y2Ba
- PVDF:GydF4y2Ba
-
聚偏二氟乙烯GydF4y2Ba
- 树液:GydF4y2Ba
-
SAF /腺泡/ pia的主题GydF4y2Ba
- TRXH:GydF4y2Ba
-
硫氧还蛋白和组氨酸GydF4y2Ba
- V-C-S:GydF4y2Ba
-
valine-phenylalanine-alanineGydF4y2Ba
- WGR:GydF4y2Ba
-
Trp-Gly-ArgGydF4y2Ba
- Y-F-A:GydF4y2Ba
-
tyrosine-phenylalanine-alanineGydF4y2Ba
参考文献GydF4y2Ba
- 1。GydF4y2Ba
Kim MY, Zhang T, Kraus WL。Poly (ADP-ribosyl)通过PARP-1: ' par -lay ' NAD+形成核信号。基因Dev。2005;19(17):1951 - 67。GydF4y2Ba
- 2。GydF4y2Ba
吉布森Ba,Kraus WL。新洞察聚(ADP-核糖)和PARP的分子和细胞功能。NAT Rev Mol Cell Biol。2012; 13(7):411-24。GydF4y2Ba
- 3。GydF4y2Ba
罗X,kraus wl。与PARP分配:通过聚(ADP-核糖)和PARP-1的细胞应激信号传导。基因开发。2012; 26(5):417-32。GydF4y2Ba
- 4。GydF4y2Ba
冯B,MA S,Chen S,Zhu N,张S,Yu B,Yu Y,Le B,Chen X,Dinesh-Kumar Sp,等。叉头相关域蛋白DaWDER的一般性调节植物免疫力。Embo Rep。2016; 17(12):1799-813。GydF4y2Ba
- 5。GydF4y2Ba
Krishnakumar R, Kraus WL。核的PARP侧:分子作用、生理结果和临床靶点。摩尔细胞。2010;39(1):日到24日。GydF4y2Ba
- 6。GydF4y2Ba
聚ADP核糖聚合酶抑制剂作为靶向抗癌药物的研究进展2015;27(6): 475-81。GydF4y2Ba
- 7。GydF4y2Ba
Anders CK, Winer EP, Ford JM, Dent R, Silver DP, Sledge GW, Carey LA。聚(adp -核糖)聚合酶抑制:靶向治疗三阴性乳腺癌。临床肿瘤杂志2010;16(19):4702-10。GydF4y2Ba
- 8。GydF4y2Ba
菲利普斯R,霍金斯SW。诱导tracheary元件分化的由3-氨基苯甲酰胺和相关化合物的抑制特性。J Exp Bot。1985; 36(1):119-28。GydF4y2Ba
- 9.GydF4y2Ba
舒尔兹P, Neukermans J, van der Kelen K, Muhlenbock P, van Breusegem F, Noctor G, Teige M, Metzlaff M, Hannah MA。化学抑制PARP可促进植物生长GydF4y2Ba拟南芥GydF4y2Ba减少花青素的积累和应激保护机制的激活。《公共科学图书馆•综合》。2012;7 (5):e37287。GydF4y2Ba
- 10.GydF4y2Ba
植物中多聚(adp -核糖)聚合酶影响能量稳态、细胞死亡和胁迫耐受性。植物j . 2005; 41(1): 95 - 106。GydF4y2Ba
- 11.GydF4y2Ba
Poly (adp -核糖):一个古老分子的新功能。细胞生物学杂志。2006;7(7):517-28。GydF4y2Ba
- 12.GydF4y2Ba
Vyas S, Chesarone-Cataldo M, Todorova T, Huang YH, Chang P. A systematic analysis of PARP protein family identification of new functions关键的细胞生理功能。Nat Commun。2013;4(1):2240。GydF4y2Ba
- 13。GydF4y2Ba
陈玉梅,陈玉梅,陈玉梅。植物核中二磷酸腺苷(adp -核糖)聚合酶的研究进展。acta Biochem. 1994; 24(1): 135-42。GydF4y2Ba
- 14。GydF4y2Ba
多聚二磷酸核糖(adp -核糖)聚合酶在植物氧化应激反应中的作用。2月。1998;440(1 - 2):1 - 7。GydF4y2Ba
- 15.GydF4y2Ba
Tian R, Zhang GY, Yan CH, Dai YR. polyadp -核糖聚合酶和caspase-3-like蛋白酶在热休克诱导烟草悬浮细胞凋亡中的作用。2月。2000;474(1):把。GydF4y2Ba
- 16。GydF4y2Ba
威尔米策尔GydF4y2Ba在体外GydF4y2Ba植物核中染色体蛋白的聚(ADP)核糖化共价修饰。2月。1979;108(1):13。GydF4y2Ba
- 17。GydF4y2Ba
Babiychuk E, Cottrill PB, Storozhenko S, Fuangthong M, Chen Y, O’farrell MK, van Montagu M, Inze D, Kushnir S.高等植物具有两种结构上不同的聚(adp -核糖)聚合酶。植物j . 1998; 15(5): 635 - 45。GydF4y2Ba
- 18。GydF4y2Ba
BENGS AG,BENT AF。在植物中聚(Adp-藜糖基)半藻。趋势植物SCI。2011; 16(7):372-80。GydF4y2Ba
- 19.GydF4y2Ba
植物多聚(adp -核糖)聚合酶超家族的功能。细胞生物学杂志。2012;69(2):175-89。GydF4y2Ba
- 20.GydF4y2Ba
Feng B, Liu C, de Oliveira MV, Intorne AC, Li B, Babilonia K, Filho GADS, Shan L, He P. Protein poly (ADP-ribosyl)调控拟南芥免疫基因表达和防御反应。公共科学图书馆麝猫。2015;11 (1):e1004936。GydF4y2Ba
- 21.GydF4y2Ba
刘C,吴q,刘W,ug z,王w,xu p,ma h,ge ge x. poly(adp-ribose)聚合酶调节细胞分裂和发育GydF4y2Ba拟南芥GydF4y2Ba的根源。acta botanica yunnanica(云南植物研究). 2017;59(7):459-74。GydF4y2Ba
- 22.GydF4y2Ba
宋Ĵ,开普勒BD,智者RR,特AF。PARP2是主要的聚(ADP-核糖)聚合酶GydF4y2Ba拟南芥GydF4y2BaDNA损伤和免疫反应。公共科学图书馆麝猫。2015;11 (5):e1005200。GydF4y2Ba
- 23.GydF4y2Ba
Jia Q,Den Dulk-Ras A,Shen H,Hoooykaas PJ,De Pater S. Poly(ADP-Ribose)聚合酶参与了微观学学介导的备用非同源终端连接GydF4y2Ba拟南芥GydF4y2Ba.acta botanica sinica(云南植物学报). 2013;42(4):439 - 451。GydF4y2Ba
- 24.GydF4y2Ba
张H,顾Z,吴庆,杨升,刘成,马H,夏Y,葛X.GydF4y2Ba拟南芥GydF4y2BaPARG1是促进酶调节翻译后的聚(ADP-核糖基)化中细胞存活的关键因素。SCI代表2015; 5(1):15892。GydF4y2Ba
- 25.GydF4y2Ba
Adams-Phillips L,Briggs AG,Bent Af。聚(ADP-核糖基)的破坏机制改变了反应GydF4y2Ba拟南芥GydF4y2Ba生物压力。植物杂志。2010;152(1):267 - 80。GydF4y2Ba
- 26.GydF4y2Ba
van de Cotte B, Metzlaff M, van Breusegem F. Silencing of poly (adp -核糖)polymerase in plants改变非生物胁迫信号转导。中国科学院院刊2007;104(38):15150-5。GydF4y2Ba
- 27.GydF4y2Ba
Pham PA, Wahl V, Tohge T, de Souza LR, Zhang Y, Do PT, Olas JJ, Stitt M, Araujo WL, Fernie AR.分析敲除突变体揭示了聚(adp -核糖)聚合酶亚型的非冗余功能GydF4y2Ba拟南芥GydF4y2Ba.植物mol biol。2015; 89(4-5):319-38。GydF4y2Ba
- 28.GydF4y2Ba
舒尔茨P,Jansseune K,Degenkolbe T,Meret男,CLAEYS H,Skirycz A,Teige男,Willmitzer L,MA汉娜。聚(ADP-核糖)通过促进叶细胞数目聚合酶活性对照植物的生长。Plos一个。2014; 9(2):e90322。GydF4y2Ba
- 29.GydF4y2Ba
没有银弹-典型的聚(adp -核糖)聚合酶(PARPs)是非生物和生物抗逆性的通用因子GydF4y2Ba拟南芥GydF4y2Ba.植物学报2017;8:59。GydF4y2Ba
- 30.GydF4y2Ba
核蛋白多聚(adp -核糖)聚合酶3 (AtPARP3)是种子贮藏性所必需的GydF4y2Ba拟南芥GydF4y2Ba.植物医学杂志。2014;16(6):1058 - 64。GydF4y2Ba
- 31.GydF4y2Ba
亨特L,霍尔兹沃斯MJ,格雷杰。烟酰胺酶活性对种子萌发有重要影响。植物j . 2007; 51(3): 341 - 51。GydF4y2Ba
- 32.GydF4y2Ba
Hottiger Mo,Hassa Po,Luscher B,Schuler H,Koch-Nolte F.朝向哺乳动物ADP-罗基转移酶的统一术语。趋势Biochem SCI。2010; 35(4):208-19。GydF4y2Ba
- 33.GydF4y2Ba
Langelier MF, Planck JL, Roy S, Pascal JM。人PARP-1 DNA损伤依赖的聚(ADP-ribosyl)的结构基础。科学。2012;336(6082):728 - 32。GydF4y2Ba
- 34.GydF4y2Ba
PARP-3是一种单腺苷二磷酸核糖基酶,在DNA缺失的情况下激活PARP-1。[J] .中国生物医学工程杂志。2010;28(11):8054-60。GydF4y2Ba
- 35。GydF4y2Ba
Altmeyer M, Messner S, Hassa PO, Fey M, Hottiger MO. PARP1介导的adp -核糖聚合的分子机制及作为adp -核糖受体位点的赖氨酸残基的鉴定。核酸学报2009;37(11):3723-38。GydF4y2Ba
- 36。GydF4y2Ba
张勇,张勇,姜浩,胡士明,林浩,Schwede F,于勇,Kraus WL。PARP靶点的化学遗传发现揭示了PARP-1在转录伸长中的作用。科学。2016;353(6294):45 - 50。GydF4y2Ba
- 37。GydF4y2Ba
关键词:adp -核糖(ADP-ribose)聚合酶-1,紫外B辐射,早期双相激活中华细胞杂志。2005;118(3):589-99。GydF4y2Ba
- 38。GydF4y2Ba
凯利LA,Mezulis S,耶茨CM,WASS MN,斯腾伯格MJ。该Phyre2门户网站为蛋白质建模,预测和分析。NAT PROTOC。2015; 10(6):845-58。GydF4y2Ba
- 39。GydF4y2Ba
Trott O, Olson AJ。AutoDock vina:通过新的评分功能、高效优化和多线程提高对接的速度和准确性。化学学报。2010;31(2):455-61。GydF4y2Ba
- 40.GydF4y2Ba
poly (ADP-ribose) polymerase activity的全家族分析。Nat Commun。2014;5:4426。GydF4y2Ba
- 41.GydF4y2Ba
Chen J, Ghorai MK, Kenney G, Stubbe J.博莱霉素介导的DNA损伤机制研究:多种结合模式可导致双链DNA切割。核酸学报2008;36(11):3781-90。GydF4y2Ba
- 42.GydF4y2Ba
帕斯库奇B,Russo的MT,克雷森兹男,Bignami男,在G1期MMS诱导单链断裂的Dogliotti E.积累是重组的DNA中聚合酶β缺陷的哺乳动物细胞。核酸RES。2005; 33(1):280-8。GydF4y2Ba
- 43.GydF4y2Ba
Amé J-C, Rolli V, Schreiber V, Niedergang C, Apiou F, Decker P, Muller S, Höger T, de Murcia JM, de Murcia G. PARP-2,一种新的哺乳动物DNA损伤依赖的聚(adp -核糖)聚合酶。中国生物化学杂志。1999;274(25):17860-8。GydF4y2Ba
- 44.GydF4y2Ba
Liu C, Vyas A, Kassab MA, Singh AK, Yu X. polyadp -核糖基化在DNA损伤反应第一波中的作用。核酸学报2017;45(14):8129-41。GydF4y2Ba
- 45.GydF4y2Ba
宋庆林,陈建军,程建军,等。古多倍体大豆的基因组序列。自然。2010;463(7278):178 - 83。GydF4y2Ba
- 46.GydF4y2Ba
Haince JF, McDonald D, Rodrigue A, Dery U, Masson JY, Hendzel MJ, Poirier GG. parp1依赖的MRE11和NBS1蛋白募集到多个DNA损伤位点的动力学。中国生物医学工程学报。2008;28(2):1197-208。GydF4y2Ba
- 47.GydF4y2Ba
王志强,王志强,王志强,等。细胞单链断裂的时空响应研究进展。中国生物医学工程学报。2003;23(11):3974-81。GydF4y2Ba
- 48.GydF4y2Ba
一种基于trizol的快速两步法提取无dna RNAGydF4y2Ba拟南芥是单片机GydF4y2Ba和干燥的种子。Biotechnol j . 2010; 5(2): 183 - 6。GydF4y2Ba
- 49.GydF4y2Ba
kaoh K, Standley DM. MAFFT多序列比对软件版本7:性能和可用性的改进。生物医学进展。2013;30(4):772-80。GydF4y2Ba
- 50。GydF4y2Ba
Goodstein DM, Shu S, Howson R, Neupane R, Hayes RD, Fazo J, Mitros T, Dirks W, Hellsten U, Putnam N,等。植物群落:绿色植物基因组学的比较平台。核酸Res. 2012;40(数据库版):D1178-86。GydF4y2Ba
- 51.GydF4y2Ba
明河,瑞恩·r,刘y,杨m,汉y,李议,张q,金mj,schatz mc,campbell m等。长寿星神圣莲花的基因组(GydF4y2Ba莲属椰子GydF4y2BaGaertn)。基因组医学杂志。2013;14 (5):R41。GydF4y2Ba
- 52.GydF4y2Ba
Nystedt B, Street NR, Wetterbom A, Zuccolo A, Lin YC, Scofield DG, Vezzi F, Delhomme N, Giacomello S, Alexeyenko A等。挪威云杉基因组序列和针叶树基因组进化。自然。2013;497(7451):579 - 84。GydF4y2Ba
- 53.GydF4y2Ba
张关R,赵Y, H,风扇G,刘X,周W,施C,王J,刘W,梁X, et al。活化石的基因组草图GydF4y2Ba银杏叶GydF4y2Ba.Gigascience。2016;5(1):49。GydF4y2Ba
- 54.GydF4y2Ba
Zerbino博士,Achuthan P, Akanni W, Amode MR, Barrell D, Bhai J, Billis K, Cummins C, Gall A, Giron CG,等。运用2018年。核酸Res. 2018;46(D1): D754-61。GydF4y2Ba
- 55.GydF4y2Ba
引用本文:郭志强,张志强,张志强,等。真菌世界门户:准备1000个真菌基因组。42(数据库版):D699-704。GydF4y2Ba
- 56.GydF4y2Ba
谢志强,张志强。使用DIAMOND快速和敏感的蛋白质比对。Nat方法。2015;12(1):59-60。GydF4y2Ba
- 57.GydF4y2Ba
Kalvari, Argasinska J, Quinones-Olvera N, Nawrocki EP, Rivas E, Eddy SR, Bateman A, Finn RD, Petrov AI。Rfam 13.0:转向以基因组为中心的非编码RNA家族资源。核酸Res. 2018;46(D1): D335-42。GydF4y2Ba
- 58.GydF4y2Ba
Larsson a . AliView:用于大数据集的快速和轻量级对齐查看器和编辑器。生物信息学。2014;30(22):3276 - 8。GydF4y2Ba
- 59.GydF4y2Ba
Capella-Gutierrez S, Silla-Martinez JM, Gabaldon T. trimAl:大规模系统发育分析中的自动对齐修剪工具。生物信息学,2009,25(15):1972 - 3。GydF4y2Ba
- 60。GydF4y2Ba
Stamatakis a . RAxML版本8:系统发育分析和大系统发育后期分析的工具。生物信息学。2014;30(9):1312 - 3。GydF4y2Ba
- 61。GydF4y2Ba
Ho SN, Hunt HD, Horton RM, Pullen JK, Pease LR。利用聚合酶链反应通过重叠延伸进行定点突变。基因。1989;77(1):51-9。GydF4y2Ba
确认GydF4y2Ba
感谢德克萨斯A&M大学的何平博士提供MBP-PARP2表达载体,感谢马丁路德大学的Edgar Peiter博士提供MBP-PARP2表达载体GydF4y2BaPARP1-1GydF4y2Ba,GydF4y2BaPARP1-2GydF4y2Ba,GydF4y2Baparp2-1GydF4y2Ba,GydF4y2Baparp2-2GydF4y2Ba,GydF4y2Baparp1 parpGydF4y2Ba3,和GydF4y2Baparp2 parp3GydF4y2Ba莱顿大学的德·佩特博士提供了GydF4y2Baparp1-3GydF4y2Ba,GydF4y2Baparp2-3GydF4y2Ba,GydF4y2Baparp1 parp2GydF4y2Ba种子。GydF4y2Ba
资金GydF4y2Ba
国家自然科学基金资助项目(No. 31770274, No. 31170169);上海市科技创新行动计划项目(No. 18JC1411800)。这些资助者没有参与研究的设计、数据收集和分析,也没有参与手稿的撰写。GydF4y2Ba
作者信息GydF4y2Ba
从属关系GydF4y2Ba
贡献GydF4y2Ba
XG对研究进行了构思和实验设计。ZG、WP、WC、QL、QW、XC和ZL进行了实验。手稿由XG和ZG撰写。所有作者都已阅读并批准了最终稿。GydF4y2Ba
相应的作者GydF4y2Ba
伦理宣言GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
不适用。GydF4y2Ba
同意出版GydF4y2Ba
不适用。GydF4y2Ba
相互竞争的利益GydF4y2Ba
提交人声明他们没有竞争利益。GydF4y2Ba
额外的信息GydF4y2Ba
出版商的注意GydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。GydF4y2Ba
附加文件GydF4y2Ba
额外的文件1:GydF4y2Ba
图S1GydF4y2Ba中PARP构件的域结构和序列分析GydF4y2Ba拟南芥GydF4y2Ba和人类。(a)人类与人类域架构的比较GydF4y2Ba拟南芥GydF4y2BaPARP1, PARP2和PARP3。(b)基于主题的PARP签名序列对齐GydF4y2Ba拟南芥GydF4y2BaPARP1, PARP2和PARP3。恒星在AtPARP1和AtPARP2中显示保守的H-Y-E三联征,而在AtPARP3中有另一种形式。红色框架表示序列图案1、2和3。相同颜色的字母代表保守的氨基酸。(PDF 10681 kb)GydF4y2Ba
额外的文件2:GydF4y2Ba
图S2GydF4y2Ba28个代表性物种PARP1/2/3亚家族成员的最大似然(ML)系统发育树。的GydF4y2Ba拟南芥GydF4y2BaPARP3蛋白用红色实心三角形标记。节点上的橙色实星号表示基因复制事件。对于树上的每个节点,都给出了带有100个副本的引导值(> 50)。来自植物、动物和真菌的基因在附加文件中给出GydF4y2Ba11.GydF4y2Ba:表S3。(PDF 8823 kb)GydF4y2Ba
额外的文件3:GydF4y2Ba
图S3GydF4y2Ba突变体的GydF4y2Ba拟南芥PARPGydF4y2Ba本研究使用的基因。(A) T-DNA插入位点GydF4y2Ba拟南芥parp3GydF4y2Ba突变体。GydF4y2Baparp3-1GydF4y2BaSalk_108092C;GydF4y2Baparp3-2GydF4y2Ba, Sail_632_D07。外显子用填充框表示,内含子用深色线表示,T-DNA插入用填充三角形表示。(B) RT-qPCR分析GydF4y2BaAtPARP3GydF4y2Ba在Col-0和GydF4y2Baparp3GydF4y2Ba突变体种子。利用干种子进行RT-qPCR。的GydF4y2BaAtUBQ5GydF4y2Ba基因作为内部控制。(C)用抗AtPARP3抗体检测种子中的AtPARP3蛋白。用50毫克的干种子从每个样品中提取总蛋白。抗微管蛋白抗体印迹结果作为装载对照。(D) T-DNA插入位点GydF4y2Baparp1GydF4y2Ba突变体。GydF4y2Baparp1-1GydF4y2BaGK_380E06;GydF4y2Baparp1-2GydF4y2BaGK_382F01;和GydF4y2Baparp1-3GydF4y2Ba, GK_692A05。(E) T-DNA插入位点GydF4y2Baparp2GydF4y2Ba突变体。GydF4y2Baparp2-1GydF4y2BaGK_420G03;GydF4y2Baparp2-2GydF4y2BaSail_1250_B03;和GydF4y2Baparp2-3GydF4y2Ba,salk_140400。结果显示为平均值±SDs从三个生物重复。浴缸,微管蛋白。(PDF 4047 KB)GydF4y2Ba
额外的文件4:GydF4y2Ba
图S4GydF4y2Ba转录水平的GydF4y2BaAtPARPsGydF4y2Ba在正常条件下对种子和幼苗进行基因毒素处理。(A)相对表达水平GydF4y2BaAtPARPGydF4y2Ba成员GydF4y2Ba拟南芥GydF4y2Ba干燥的种子。(B)表达水平GydF4y2BaAtPARPGydF4y2Ba成员GydF4y2Ba拟南芥GydF4y2Ba幼苗经蒸馏水处理。(C)表达水平的比较GydF4y2BaAtPARPGydF4y2BaMMS处理后的种子成员。(D)表达水平的比较GydF4y2BaAtPARPGydF4y2Ba经zeocin处理后的种子成员。(E)表达水平的比较GydF4y2BaAtPARPGydF4y2Ba成员GydF4y2Ba拟南芥GydF4y2BaMMS处理后的幼苗。(F)表达水平的比较GydF4y2BaPARPGydF4y2Ba成员GydF4y2Ba拟南芥GydF4y2BaZeocin治疗后的幼苗。Col-0的种子和GydF4y2BaparpGydF4y2Ba分别用蒸馏水(A)、100 μg/mL MMS (C)、200 μg/mL zeocin (D)培养突变体。10-d-old Col-0和GydF4y2BaparpGydF4y2Ba将在½MS板上生长的突变体幼苗喷洒蒸馏水(B)、100 μg/mL MMS (E)或200 μg/mL zeocin (F)不同时间。从种子或幼苗中提取总RNA,进行RT-qPCR分析。的表达水平GydF4y2BaAtPARPsGydF4y2Ba被归一化为GydF4y2BaAtUBQ5GydF4y2Ba.采用蒸馏水处理植物进行同步模拟实验,将处理后的基因表达量与模拟实验的基因表达量进行归一化,计算其fold changes。结果显示为平均值±SDs从三个生物重复。(PDF 12025 kb)GydF4y2Ba
额外的文件5:GydF4y2Ba
表S1GydF4y2Ba基因毒素处理下幼苗鲜重和叶绿素含量的源数据。(XLSX 32 kb)GydF4y2Ba
附加文件6:GydF4y2Ba
图S5GydF4y2BaCol-0中PAR信号的比较,GydF4y2Baparp1GydF4y2Ba和GydF4y2Baparp2GydF4y2Ba突变体。用200 μg/mL zeocin处理10 d幼苗48 h。提取幼苗总蛋白,用抗泛adpr试剂进行检测。用抗微管蛋白抗体检测微管蛋白,以显示蛋白载量。浴缸,微管蛋白。(PDF 2355 kb)GydF4y2Ba
附加文件7:GydF4y2Ba
图S6GydF4y2Ba抗PAN-ADPR试剂和抗PAR抗体检测的PAR信号的比较。GydF4y2Ba(一种)GydF4y2Ba利用抗- adp -核糖结合试剂检测不同植物的PAR信号。GydF4y2Ba(b)GydF4y2Ba用抗PAR抗体检测不同植物的PAR信号。膜上没有检测到信号。GydF4y2Ba(C)GydF4y2Ba利用外源NAD抗PAR抗体检测不同植物的PAR信号GydF4y2Ba+GydF4y2Ba并激活萃取缓冲液中的DNA。0.3毫米GydF4y2Ba+GydF4y2Ba在蛋白提取缓冲液中加入100 nM的断裂DNA以增强PARP催化反应。(A)、(B)、(C)用200 μg/mL zeocin处理10 d幼苗48 h,提取幼苗总蛋白进行western blot。(B)与(A)样本相同,但检测到抗par抗体。(C),总蛋白提取使用与(A)和(B)相同的缓冲液,除了在它的0.3 mM NADGydF4y2Ba+GydF4y2Ba加入100 nM的断裂DNA。浴缸,微管蛋白;@-pan-ADPR anti-pan-ADPR试剂;@-PAR anti-PAR抗体。(PDF 7691 kb)GydF4y2Ba
额外的文件8:GydF4y2Ba
图S7GydF4y2Bambd -融合与trxh -融合重组AtPARP蛋白活性比较。(A)不同标签融合AtPARP1蛋白的活性比较。(B)不同标签融合AtPARP2蛋白活性的比较。纯化蛋白与500 nM DNA和1 mM NAD孵育GydF4y2Ba+GydF4y2Ba在25°C的不同时间段。反应结束后,用抗泛adpr试剂进行免疫印迹分析(上图)。考马斯亮蓝染凝胶底部箭头表示重组蛋白TRXH-AtPARP1(红色)、MBD-AtPARP1(黑色)、TRXH-AtPARP2(青色)和MBD-AtPARP2(蓝色)。(PDF 7207 kb)GydF4y2Ba
附加文件9:GydF4y2Ba
图S8GydF4y2Ba在博莱霉素和zeocin处理下,大部分PAR信号的产生都与AtPARP1有关。GydF4y2Ba(一种)GydF4y2BaPAR信号在不同GydF4y2Baparp1GydF4y2Ba和GydF4y2Baparp2GydF4y2Bamock后突变体(HGydF4y2Ba2GydF4y2BaO)分别处理24小时和48小时。GydF4y2Ba(b)GydF4y2BaPAR信号在不同GydF4y2Baparp1GydF4y2Ba和GydF4y2Baparp2GydF4y2Ba突变体200μg/ ml Zeocin或25μg/ ml玻璃霉素处理24小时。GydF4y2Ba(C)GydF4y2BaPAR信号在不同GydF4y2Baparp1GydF4y2Ba和GydF4y2Baparp2GydF4y2Bamutants after 200 μg/mL zeocin or 25 μg/mL bleomycin treatment for 48 h. 10-d-old seedlings were treated with zeocin or bleomycin for different time periods and then the total proteins were extracted and detected using anti-pan-ADPR reagent. Tubulin was detected using an anti-tubulin antibody to indicate the protein loading amounts. TUB, tubulin; @-pan-ADPR, anti-pan-ADPR reagent. (PDF 9141 kb)
附加文件10:GydF4y2Ba
表S2GydF4y2Ba本工作中使用的引物。(PDF 12294 kb)GydF4y2Ba
附加文件11:GydF4y2Ba
表S3GydF4y2Ba用于PARP家族中PARP1/2/3亚家族系统发育分析的基因列表。(PDF 10506 kb)GydF4y2Ba
权利和权限GydF4y2Ba
开放访问GydF4y2Ba本文根据创意公约署署署的条款分发了4.0国际许可证(GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本条提供的数据,除非另有说明。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
顾志,潘伟,陈伟。GydF4y2Ba等等。GydF4y2Ba植物PARP家族的新观点:GydF4y2Ba拟南芥GydF4y2BaPARP3是不活跃的,PARP1在响应DNA损伤时表现出主要的聚(adp -核糖)聚合酶活性。GydF4y2BaBMC植物BIOL.GydF4y2Ba19,GydF4y2Ba364(2019)。https://doi.org/10.1186/s12870-019-1958-9GydF4y2Ba
收到了GydF4y2Ba:GydF4y2Ba
接受GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
DOIGydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-019-1958-9GydF4y2Ba
关键词GydF4y2Ba
- 拟南芥GydF4y2Ba
- DNA损伤反应GydF4y2Ba
- ADP-ribosylationGydF4y2Ba
- 转译后的修改GydF4y2Ba
- 保利(ADP-ribose)聚合酶GydF4y2Ba