- 研究文章GydF4y2Ba
- 开放获取GydF4y2Ba
- 发表:GydF4y2Ba
的GydF4y2Ba磷酸盐1GydF4y2Ba基因参与盐和磷信号通路,并在大豆进化过程中发挥适应性作用GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba19GydF4y2Ba文章编号:GydF4y2Ba353GydF4y2Ba(GydF4y2Ba2019年GydF4y2Ba)GydF4y2Ba
抽象的GydF4y2Ba
背景GydF4y2Ba
的GydF4y2Ba磷酸盐1GydF4y2Ba(GydF4y2BaPho1.GydF4y2Ba)基因家族在无机磷(Pi)的转运、信号转导和植物发育等方面发挥着不同的作用。然而,大豆的功能和多样化GydF4y2BaPho1.GydF4y2Ba家庭理解得很差。GydF4y2Ba
结果GydF4y2Ba
栽培大豆(GydF4y2Ba大豆)GydF4y2Ba是从野生大豆(GydF4y2Ba甘氨酸大豆GydF4y2Ba).为了在这种进化过程中照亮他们的角色,我们相对调查了GydF4y2Bag . max PHO1GydF4y2Ba基因(GydF4y2Bagmpho1.GydF4y2Ba)在Suinong 14(SN14)和GydF4y2BaG. Soja Pho1.GydF4y2Ba基因(GydF4y2BaGSPHO1.GydF4y2Ba)在ZYD00006(ZYD6)中。正向性的序列GydF4y2BaGm-GsPHO1GydF4y2Ba对被分成两类。在SN14和ZYD6中,I类的表达在发展果实中广泛但相对较高,而II类主要在根中表达。整个家庭展示了各种反应模式,以盐胁迫和在根中饥饿。在SN14和ZYD6之间,大多数GydF4y2BaPho1.GydF4y2Ba与盐度应力类似地反应基因,并且响应于PI-饥饿的一半具有锐度对比,这使得SN14和ZYD6之间的盐度和低PI应力证实了差动响应能力。此外,在转基因中GydF4y2Ba拟南芥GydF4y2Ba植物,大多数二级成员和GydF4y2BaGmPHO1; H9GydF4y2BaII类基因中只有2个(GydF4y2BaGmPHO1; H4GydF4y2Ba和GydF4y2BaGmPHO1; H8GydF4y2Ba)对PI-饥饿的敏感性不同。因此,在转基因中的盐或pi信号通路中改变了临界基因的表达GydF4y2Ba拟南芥GydF4y2Ba植物。GydF4y2Ba
结论GydF4y2Ba
我们的研究表明GydF4y2BaPho1.GydF4y2Ba基因作为大豆改善的有前途的遗传物质,并表明表达变异是对直字的功能分歧的决定性GydF4y2BaGm-GsPHO1GydF4y2Ba在大豆进化过程中起着适应作用。GydF4y2Ba
背景GydF4y2Ba
磷是植物最重要的常量元素之一。无机磷(Pi)是被植物吸收和利用的磷的主要形式,在许多土壤中受到限制。在缺磷条件下,植物可以重塑根系构型,抑制主根生长,促进侧根生长和根毛的形成,以提高磷的获取[GydF4y2Ba1GydF4y2Ba,GydF4y2Ba2GydF4y2Ba].参与Pi信号通路的各种Pi饥饿诱导基因触发不同的分子过程以提高植物在Pi饥饿条件下的存活率[GydF4y2Ba3.GydF4y2Ba], 包含GydF4y2BaAT4GydF4y2Ba,GydF4y2Ba磷酸盐饥饿诱导1GydF4y2Ba(GydF4y2BaIPS1GydF4y2Ba),GydF4y2Ba磷酸盐转运蛋白GydF4y2Ba(GydF4y2Bapht1; 4GydF4y2Ba),GydF4y2Ba磷酸盐1GydF4y2Ba(GydF4y2BaPHO1; H1GydF4y2Ba) 在GydF4y2Ba拟南芥GydF4y2Ba[GydF4y2Ba4GydF4y2Ba,GydF4y2Ba5GydF4y2Ba,GydF4y2Ba6GydF4y2Ba].GydF4y2Ba拟南芥pho1GydF4y2Ba是第一个被报道参与钙从根到芽转移的基因[GydF4y2Ba7GydF4y2Ba,GydF4y2Ba8GydF4y2Ba],并且在PI缺乏症的信号转导[GydF4y2Ba9GydF4y2Ba,GydF4y2Ba10GydF4y2Ba,GydF4y2Ba11GydF4y2Ba].的GydF4y2Ba拟南芥pho1GydF4y2Ba突变体叶片磷含量低,由于无法将磷装载到木质部而表现出严重的茎磷缺乏症[GydF4y2Ba7GydF4y2Ba].GydF4y2BaPho1.GydF4y2Ba主要在根胸骨细胞中表达,并参与将无机PI加载到根的XYLEM中[GydF4y2Ba8GydF4y2Ba].的GydF4y2BaPho1.GydF4y2Ba类基因参与了酵母中的Pi转运(GydF4y2Ba酿酒酵母GydF4y2Ba)[GydF4y2Ba12GydF4y2Ba,暗示了保守的作用GydF4y2BaPho1.GydF4y2Ba在pi运输和稳态。GydF4y2Ba
的GydF4y2Ba拟南芥GydF4y2Ba基因组含有10种其他同源物GydF4y2BaPho1.GydF4y2Ba(确认为GydF4y2BaPHO1; H1GydF4y2Ba来GydF4y2BaPHO1; H10GydF4y2Ba),并且它们的推注编码的蛋白质含有SPX(以SYG1,磷酸酶81和XPR1)和EXS(以ER保留缺陷1,XPR1和SYG1)域命名[GydF4y2Ba11GydF4y2Ba,GydF4y2Ba12GydF4y2Ba].然而,只有GydF4y2BaPho1.GydF4y2Ba和GydF4y2BaPHO1; H1GydF4y2Ba参与从根部到射击的PI运输[GydF4y2Ba6GydF4y2Ba].三GydF4y2BaPho1.GydF4y2Ba同源物(GydF4y2Baospo1; 1GydF4y2Ba,GydF4y2Baospho1; 2GydF4y2Ba, 和GydF4y2Baospo1; 3GydF4y2Ba),但只是在水稻基因组中GydF4y2Baospho1; 2GydF4y2Ba已被证明可以在将PI加载到Xylem中发挥作用[GydF4y2Ba13GydF4y2Ba].这些观察表明,该基因家族发挥着不同的作用。与这个概念相印证的是GydF4y2BaPho1.GydF4y2Ba基因家族在GydF4y2Ba拟南芥GydF4y2Ba也被发现参与信号转导和植物的生长发育。GydF4y2BaBlue1下的短休髓GydF4y2Ba(GydF4y2BaSHB1GydF4y2Ba,亦称GydF4y2BaPHO1; H4GydF4y2Ba)参与蓝光信号反应、开花和种子发育[GydF4y2Ba14GydF4y2Ba,GydF4y2Ba15GydF4y2Ba,GydF4y2Ba16GydF4y2Ba], 然而GydF4y2BaPHO1; H10GydF4y2Ba响应各种非生物和生物胁迫,并参与脱落酸(ABA)介导的信号转导途径[GydF4y2Ba17GydF4y2Ba].有趣的是,GydF4y2Ba拟南芥pho1GydF4y2Ba也有报道在气孔对ABA的响应中起重要作用[GydF4y2Ba18GydF4y2Ba,表明植物不同信号转导途径之间可能存在相互作用,如干旱和盐胁迫。GydF4y2Ba
盐压力在很大程度上影响了全球农业。土壤中过多的可溶性盐可以降低植物生长,从而严重影响作物产量[GydF4y2Ba19GydF4y2Ba,GydF4y2Ba20.GydF4y2Ba].耐盐机制非常复杂,可由离子信号途径、渗透压和aba介导途径控制[GydF4y2Ba21GydF4y2Ba].盐过敏感(SOS)途径通过SOS3-SOS2蛋白激酶复合物控制离子转运体的表达和活性,而SOS3-SOS2蛋白激酶复合物可被盐胁迫诱导的钙信号激活[GydF4y2Ba21GydF4y2Ba,GydF4y2Ba22GydF4y2Ba].Delta1-吡咯啉-5-羧酸合成酶基因(GydF4y2BaP5CS1GydF4y2Ba)编码涉及脯氨酸合成的速率限制酶,可以通过增加渗透压来增加植物中的耐盐性[GydF4y2Ba23GydF4y2Ba,GydF4y2Ba24GydF4y2Ba].与ABA介导的途径有关的其他一些基因,如醇脱氢酶基因(GydF4y2BaADH.GydF4y2Ba) 和GydF4y2BaFIERY1GydF4y2Ba(GydF4y2BaFRY1GydF4y2Ba)基因,也与耐盐性有关[GydF4y2Ba25GydF4y2Ba,GydF4y2Ba26GydF4y2Ba].这些基因通常是盐信号传导途径中的标记基因,并且这些基因表达的变化用作评估植物盐耐受性的诊断参数[GydF4y2Ba21GydF4y2Ba,GydF4y2Ba27GydF4y2Ba].GydF4y2Ba
栽培大豆(GydF4y2Ba甘氨酸最大GydF4y2Ba)被认为是从野生大豆驯化(GydF4y2Ba甘氨酸大豆GydF4y2Ba)在中国早在5000-9000年前[GydF4y2Ba28GydF4y2Ba,GydF4y2Ba29GydF4y2Ba].各种非生物胁迫大大限制大豆产量。中国东北地区是一个主要的大豆种植区,共3.73×10GydF4y2Ba6GydF4y2BaHM.GydF4y2Ba2GydF4y2Ba钠地的[GydF4y2Ba30.GydF4y2Ba].盐胁迫抑制大豆从萌发到繁殖阶段的发育[GydF4y2Ba31GydF4y2Ba,GydF4y2Ba32GydF4y2Ba,使粮食产量锐减至正常情况下的38.9% [GydF4y2Ba33GydF4y2Ba,GydF4y2Ba34GydF4y2Ba].此外,土壤中可溶性PI的低可用性影响了世界各地耕地的大约一半[GydF4y2Ba35GydF4y2Ba],中国约70%的耕地缺磷[GydF4y2Ba36GydF4y2Ba].缺磷显著降低大豆籽粒产量40%,而缺磷分别使大豆籽粒产量和荚果数增加68和61% [GydF4y2Ba37GydF4y2Ba].在大豆中鉴定了与盐度耐受性和PI缺乏有关的几种定量性状基因座(QTL)[GydF4y2Ba38GydF4y2Ba,GydF4y2Ba39GydF4y2Ba,GydF4y2Ba40GydF4y2Ba,GydF4y2Ba41GydF4y2Ba,GydF4y2Ba42GydF4y2Ba].然而,大豆对这些非生物胁迫的反应的机制仍然不清楚。具有更宽的地理分布和更多遗传变异的野生大豆具有适应的应力耐受性,与进化期间的栽培大豆相比[GydF4y2Ba43GydF4y2Ba,GydF4y2Ba44GydF4y2Ba].因此,野生大豆可以作为改善培养大豆的富种质。我们以前确定了12名成员GydF4y2BaPho1.GydF4y2Ba培养大豆的基因家族,并评估它们的表达模式,以应对各种应力[GydF4y2Ba45GydF4y2Ba],这表明了它们在非生物应激耐受性中的功能。但是,这个功能GydF4y2BaPho1.GydF4y2Ba野生和栽培大豆之间大豆和功能多样化的基因家族仍然不清楚。本研究比较了直字GydF4y2BaPho1.GydF4y2Ba在序列,组织特异性表达和对各种非生物应激的反应方面的野生和栽培大豆之间的基因对,包括盐度和PI-饥饿条件,其次是转基因的GydF4y2Ba拟南芥GydF4y2Ba分析。这是第一次调查进化和功能的调查GydF4y2BaPho1.GydF4y2Ba野生大豆和栽培大豆的基因家族。本研究阐明了心理调节的适应性作用GydF4y2BaPho1.GydF4y2Ba并揭示了这些基因在磷和盐信号通路中的潜在聚合作用,从而为作物改良提供了新的遗传材料和思路。GydF4y2Ba
结果GydF4y2Ba
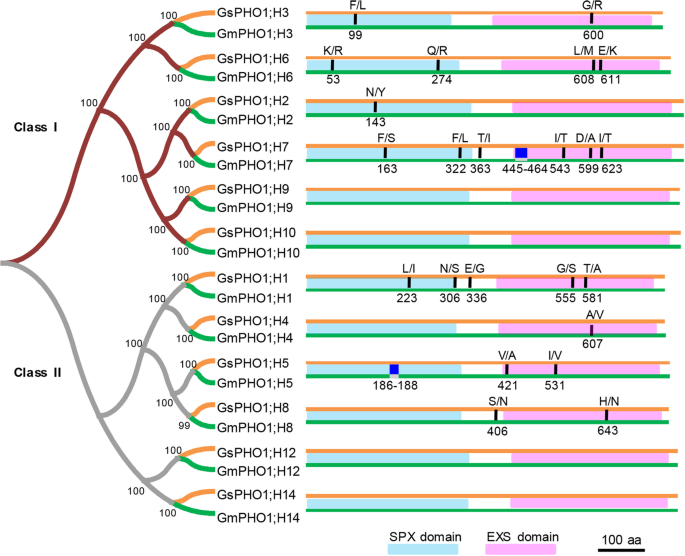
序列比较GydF4y2Bagmpho1.GydF4y2Ba和GydF4y2BaGSPHO1.GydF4y2BaCDNA.GydF4y2Ba
十四个人GydF4y2BaPho1.GydF4y2Ba先前预测了同源基因[GydF4y2Ba45GydF4y2Ba]但是12GydF4y2BaPho1.GydF4y2Ba最终从培养的(前缀GydF4y2Ba通用汽车GydF4y2Ba)或wild(前缀GydF4y2BaGsGydF4y2Ba)大豆(补充文件GydF4y2Ba1GydF4y2Ba:图S1,S2)。它们分为Ⅲ类和II类(图。GydF4y2Ba1GydF4y2Ba,附加文件GydF4y2Ba1GydF4y2Ba:图S2)。当GydF4y2Ba拟南芥pho1GydF4y2Ba基因被包括在内,我们发现其功能特征GydF4y2BaAtPHO1; H4GydF4y2Ba(GydF4y2BaSHB1GydF4y2Ba)基因属于I类,而GydF4y2Baatpho1; h1GydF4y2Ba和GydF4y2Baatpho1.GydF4y2Ba属第II类(附加档案GydF4y2Ba1GydF4y2Ba:图S2),表明类I和II之间的功能分歧。而且,每一个GydF4y2BaPho1.GydF4y2Ba来自培养的大豆苏孔14(SN14)和野生大豆ZYD00006(ZYD6)的基因聚集在一起以形成正交对(图。GydF4y2Ba1GydF4y2Ba,附加文件GydF4y2Ba1GydF4y2Ba:图S2),表明这些源自常见的祖先。ParaLogs在进化期间接受了不同的多样化,差异范围从26.9到95.2%(附加档案GydF4y2Ba2GydF4y2Ba:表S1),暗示功能性分歧,而12正交成对的序列同一性从99.3到100%。两个成员(GydF4y2BaPho1.GydF4y2Ba;GydF4y2BaH9.GydF4y2Ba和GydF4y2BaPho1.GydF4y2Ba;GydF4y2BaH10.GydF4y2Ba)来自I级和两名成员(GydF4y2BaPho1.GydF4y2Ba;GydF4y2BaH12.GydF4y2Ba和GydF4y2BaPho1.GydF4y2Ba;GydF4y2BaH14GydF4y2Ba),其中SN14和ZYD6完全相同,其余的氨基酸替换和插入较少(图。GydF4y2Ba1GydF4y2Ba,附加文件GydF4y2Ba2GydF4y2Ba:表S2)。然后我们通过PROVEAN和SNAP分析估计了这些序列变异在同源对之间的潜在影响,结果表明所有的氨基酸替换和插入都是中性的(附加文件GydF4y2Ba2GydF4y2Ba表S2),表明相应的同源基因对的功能可能没有改变。因此,来自栽培大豆和野生大豆的每一对同源PHO1可能具有相似的功能。GydF4y2Ba
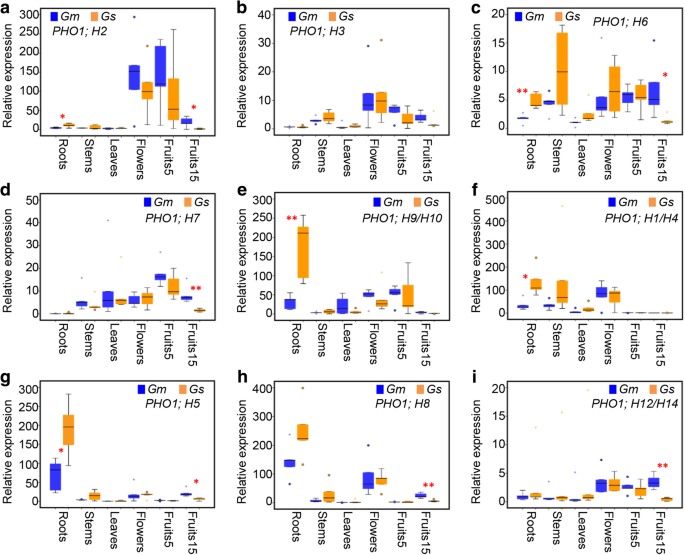
大豆器官特异性表达GydF4y2BaPho1.GydF4y2Ba例如基因GydF4y2Ba
表达多样性评估已被用来确定基因之间的功能差异。目的:探讨组织特异性表达模式GydF4y2BaPho1.GydF4y2Ba- 对SN14和ZYD6中的根部,叶,茎,花和发展果(1,3,5和15天缩短为水果1,水果3,水果5)的总RNA,对SN14和ZYD6缩短为水果1。qrt-pcr。由于高序列同一性,常见但特异性引物被设计用于旁骨基因对GydF4y2BaPHO1; H1GydF4y2Ba/GydF4y2BaH4.GydF4y2Ba,GydF4y2BaPHO1; H9 / H10GydF4y2Ba, 和GydF4y2BaPHO1; H12 / H14GydF4y2Ba.结果表明GydF4y2BaPho1.GydF4y2Ba属于I类和II类的基因表现出不同的器官特异性表达模式GydF4y2Ba1GydF4y2Ba:图S3)。大多数大豆GydF4y2BaPho1.GydF4y2BaⅢ类的基因在蔬菜和生殖器官之间进行差异表达(附加档案GydF4y2Ba1GydF4y2Ba:图S3A-E)。观察到表达的一些极端变化。GydF4y2BaPHO1; H7GydF4y2Ba在大多数发展的器官中活跃,但在根中几乎没有检测到(附加文件GydF4y2Ba1GydF4y2Ba:图S3D),而且GydF4y2BaPHO1; H9GydF4y2Ba/GydF4y2BaH10.GydF4y2Ba主要在根中表达(附加文件GydF4y2Ba1GydF4y2Ba:图S3e)。然而,类基因的表达模式与类基因明显不同,类基因的表达模式相似,主要在植物组织中表达,尤其是根和茎GydF4y2Ba1GydF4y2Ba:图S3f-i)。此外,这些基因在果实中的表达量相对较低GydF4y2Ba1GydF4y2Ba:图S3f-i)。GydF4y2Ba
同源比较GydF4y2BaGm-GsPHO1GydF4y2Ba结果表明,SN14和ZYD6在不同器官中的表达模式不同。GydF4y2BaGmPHO1; H7GydF4y2Ba比GydF4y2BaGSPHO1; H7.GydF4y2Ba在所有评估的器官中(附加文件GydF4y2Ba1GydF4y2Ba:图S3d),而GydF4y2BaGSPHO1; H3.GydF4y2Ba在鲜花和早期发展水果(水果1)中表达了比较高GydF4y2BaGmPHO1; H3GydF4y2Ba在SN14中(附加文件GydF4y2Ba1GydF4y2Ba:图S3b)。然而,一些基因,如GydF4y2BaH2 PHO1;GydF4y2Ba和GydF4y2BaPHO1;代替GydF4y2BaSN14和ZYD6在不同组织中表达模式复杂。GydF4y2BaH2 GmPHO1;GydF4y2Ba在根、叶和花中表达量较低,但在其他器官中表达量较高GydF4y2BaGSPHO1; H2GydF4y2Ba(附加文件GydF4y2Ba1GydF4y2Ba:图S3A)。相似地,GydF4y2BaPHO1;代替GydF4y2Ba在SN14中显示出的根部和叶片中的表达水平较低,但在SN14中的表达更高,而不是在ZYD6中(附加文件GydF4y2Ba1GydF4y2Ba:图S3C)。尽管I类中的基因的复杂表达模式,但在SN14中的SN14中的表达水平比在ZYD6中显示出相对较高的表达水平。然而,II类基因在ZYD6的营养植物部分中高于SN14以及根,茎或叶子(附加文件)GydF4y2Ba1GydF4y2Ba:图S3f-i)。GydF4y2Ba
利用4个野生大豆(Y1、Y2、Y3、Y4)和4个栽培大豆(禾丰48、嫩丰16、禾农35、东农53)进行qRT-PCR分析,进一步验证了上述ZYD6和SN14之间的关系GydF4y2Ba1GydF4y2Ba:图S4)。尽管波动不大,但这反映了ZYD6和SN14在不同组织中的表达模式相似。综合分析和主要结果表明,无论是在野生大豆还是栽培大豆中,I类和II类都表现出保守的组织特异性表达模式:I类的表达域比II类更宽,其中大多数基因主要在根中表达(图2)。GydF4y2Ba2GydF4y2Ba).有趣的是,在野生和培养的大豆之间的根部中具有差异表达模式的基因在野生大豆的根部具有比培养的根部的表达更高,而在果实15中差异表达的基因GydF4y2BaG. Max.GydF4y2Ba和GydF4y2BaG. Soja.GydF4y2Ba在栽培大豆的果实中的表达更高,而不是野生植物(图。GydF4y2Ba2GydF4y2Ba),表明第I类和第II类的功能分化GydF4y2BaPho1.GydF4y2Ba水果(种子)发展和应力反应的基因。GydF4y2Ba
器官特异性表达的变化GydF4y2BaPho1.GydF4y2Ba野生大豆和栽培大豆的基因家族。GydF4y2Ba一种GydF4y2Ba-GydF4y2BaE.GydF4y2Ba大豆的表达变化GydF4y2BaPho1.GydF4y2Ba第一类基因。GydF4y2BaFGydF4y2Ba-GydF4y2Ba一世GydF4y2Ba大豆的表达变化GydF4y2BaPho1.GydF4y2BaII级的基因。GydF4y2BaG. Max.GydF4y2Ba(GydF4y2Ba通用汽车GydF4y2Ba)包括5个品种(SN14、HF、NF、HN和DN)GydF4y2BaG. Soja.GydF4y2Ba(GydF4y2BaGsGydF4y2Ba)由五个野生加入(ZYD6,Y1,Y2,Y3和Y4组成)组成。分析了如所示的各种组织中的基因表达,并将原始数据显示在附加文件中GydF4y2Ba1GydF4y2Ba:图S3和S4GydF4y2Ba
大豆GydF4y2BaPho1.GydF4y2Ba类基因的表达GydF4y2Ba
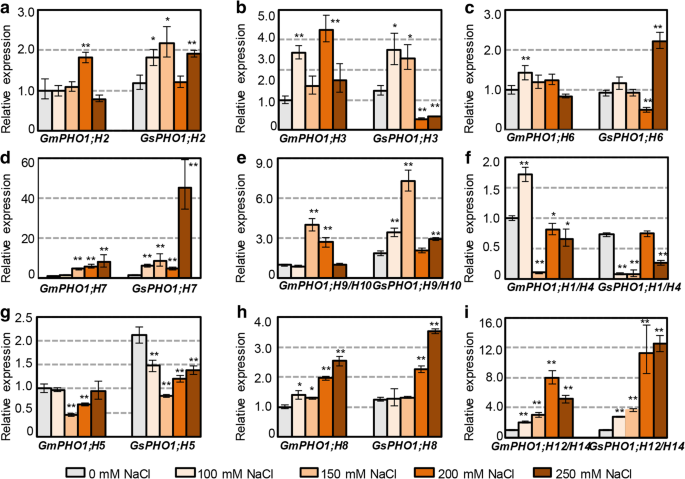
盐度应力GydF4y2Ba
进一步说明大豆的多样性GydF4y2BaPho1.GydF4y2Ba响应非生物应激的基因,用不同水平的盐度处理SN14和ZYD6的两周幼苗,对来自根的总RNA进行QRT-PCR分析(图。GydF4y2Ba3.GydF4y2Ba).第一类基因GydF4y2BaH2 PHO1;GydF4y2Ba,GydF4y2BaPHO1; H7GydF4y2Ba, 和GydF4y2BaPHO1; H9GydF4y2Ba/GydF4y2BaH10.GydF4y2Ba和II类基因GydF4y2BaPHO1; H5GydF4y2Ba,GydF4y2BaPHO1; H8GydF4y2Ba, 和GydF4y2BaPHO1; H12GydF4y2Ba/GydF4y2BaH14GydF4y2Ba在SN14和ZYD6之间显示出与盐应激的类似反应模式(图。GydF4y2Ba3.GydF4y2Baa,d-e g-i),而剩余的基因,包括GydF4y2BaPHO1; H3GydF4y2Ba和GydF4y2BaPHO1;代替GydF4y2Ba在课堂上和GydF4y2BaPHO1; H1GydF4y2Ba/GydF4y2BaH4.GydF4y2Ba在II类中,在SN14和ZYD6之间的盐胁迫下显示出相对不同的表达模式(图。GydF4y2Ba3.GydF4y2Bac、f)。GydF4y2Ba通用汽车GydF4y2Ba-GydF4y2BaGSPHO1; H12.GydF4y2Ba/GydF4y2BaH14GydF4y2Ba在盐胁迫下,ZYD6的反应较强,均一致地诱导局部对。虽然一些直晶对在盐胁迫下显示出类似的表达模式,但是一对或两种基因仅响应某些浓度,例如GydF4y2BaPHO1; H5GydF4y2Ba和GydF4y2BaPHO1; H8GydF4y2Ba第二类和第一类成员GydF4y2BaH2 PHO1;GydF4y2Ba和GydF4y2BaPHO1; H9GydF4y2Ba/GydF4y2BaH10.GydF4y2Ba(无花果。GydF4y2Ba3.GydF4y2Baa,e,g-h)。表达GydF4y2BaGmPHO1; H5GydF4y2Ba只有在150 mM和200 mM NaCl时降低,而在150 mM和200 mM NaCl时降低GydF4y2BaGSPHO1; H5.GydF4y2Ba在所有浓度下表达均降低。GydF4y2BaGmPHO1; H8GydF4y2Ba盐胁迫诱导表达GydF4y2BaGSPHO1; H8.GydF4y2Ba在200 mM和250 mM NaCl处理下只增加。此外,谬误推理GydF4y2BaGsGydF4y2Ba-GydF4y2Bagmpho1.GydF4y2Ba基因在表达趋势和表达量上都有差异。这些发现表明大豆GydF4y2BaPho1.GydF4y2Ba基因可能在盐应激反应中具有不同的作用。GydF4y2Ba
大豆的表达GydF4y2BaPho1.GydF4y2Ba响应盐胁迫的基因。GydF4y2Ba一种GydF4y2Ba-GydF4y2BaE.GydF4y2Ba表达GydF4y2Ba通用汽车GydF4y2Ba-GydF4y2BaGSPHO1.GydF4y2BaI类同源基因对。GydF4y2BaFGydF4y2Ba-GydF4y2Ba一世GydF4y2Ba表达GydF4y2Ba通用汽车GydF4y2Ba-GydF4y2BaGSPHO1.GydF4y2BaII类中的正交基因对。对ZYD6和SN14的两周大幼苗的根部的总RNA进行QRT-PCR的ZYD6和SN14的ZYD6和SN14的盐胁迫下。将每个基因的表达在未处理条件(灰色柱)中用作对照。为了便于比较GydF4y2Ba通用汽车GydF4y2Ba-GydF4y2BaGSPHO1.GydF4y2Ba直言基因对,GydF4y2Bagmpho1.GydF4y2Ba未处理条件下,表达量设为1。*表示意义GydF4y2BaPGydF4y2Ba< 0.05水平,**表示在GydF4y2BaPGydF4y2Ba< 0.01水平GydF4y2Ba
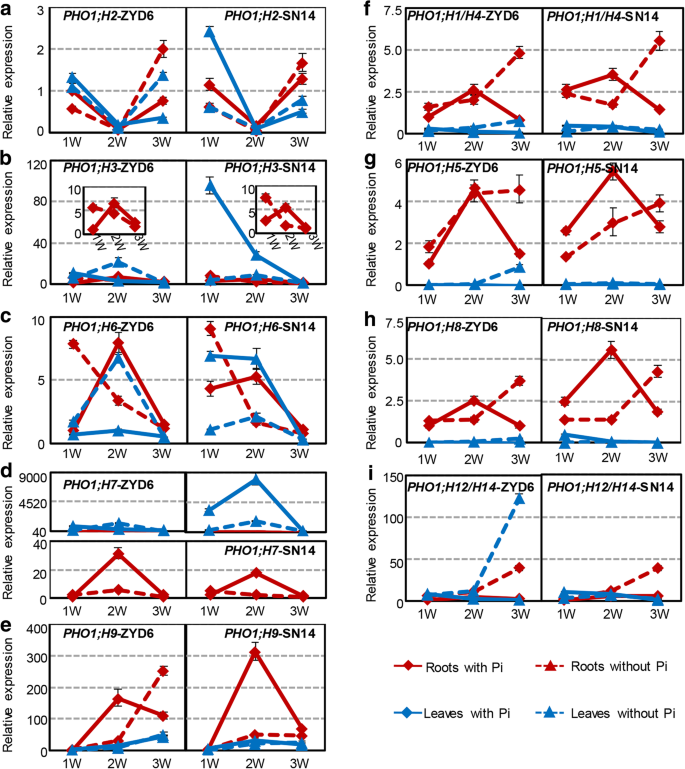
Low-Pi治疗GydF4y2Ba
我们还调查了表达的表达GydF4y2BaPho1.GydF4y2Ba大豆根部和叶片下的基因在pi-饥饿下(图。GydF4y2Ba4GydF4y2Ba).大豆GydF4y2BaPho1.GydF4y2BaI类基因在正常Pi条件下表现出不同的表达谱(图中实线)。GydF4y2Ba4GydF4y2BaA-E)和这些对根和叶中的Pi缺乏的复杂反应(图3中的虚线。GydF4y2Ba4GydF4y2Baa-e)。但是,正交基因对GydF4y2BaH2 PHO1;GydF4y2Ba,GydF4y2BaPHO1; H3GydF4y2Ba,GydF4y2BaPHO1;代替GydF4y2Ba, 和GydF4y2BaPHO1; H7GydF4y2Ba在低磷处理下,ZYD6和SN14对根和叶的响应相似GydF4y2BaPHO1; H9/10GydF4y2Ba仅在ZYD6和SN14之间的叶子中描绘了类似的表达模式。相似的GydF4y2BaPHO1; H9/10GydF4y2Ba在低PI治疗后的前2周,在ZYD6和SN14的根部观察到表达模式;然而,在第三周的PI胁迫下在ZYD6中观察到上调(图。GydF4y2Ba4GydF4y2Bae)。在课堂上,只有GydF4y2BaPHO1; H9/10GydF4y2Ba在PI-饥饿下,在ZYD6的根部是显着和不断上调的,表明其作用是响应低PI条件。GydF4y2Ba
大豆的表达GydF4y2BaPho1.GydF4y2Ba对pi缺乏反应的基因。GydF4y2Ba一种GydF4y2Ba-GydF4y2BaE.GydF4y2Ba表达GydF4y2BaPho1.GydF4y2Ba来自ZYD6和SN14的I级的正交基因。GydF4y2BaFGydF4y2Ba-GydF4y2Ba一世GydF4y2Ba表达GydF4y2BaPho1.GydF4y2BaZYD6和SN14中II类同源基因。大豆在正常(1.25 mM Pi)和缺磷(−Pi, 0 mM Pi)的霍格兰培养基中生长。采用qRT-PCR检测pi缺失1周、2周和3周后根和叶中基因的表达情况。将正常条件下ZYD6根中各基因的表达量设为1。*表示在a处的意义GydF4y2BaPGydF4y2Ba < 0.05 level, and the ** represent the significance at aPGydF4y2Ba< 0.01水平.W,周GydF4y2Ba
二类GydF4y2BaPho1.GydF4y2Ba基因(GydF4y2BaPHO1; H1/4GydF4y2Ba,GydF4y2BaPHO1; H5GydF4y2Ba,GydF4y2BaPHO1; H8GydF4y2Ba, 和GydF4y2BaPHO1; H12 / 14GydF4y2Ba)在正常条件下在根和叶片开发期间显示出类似的表达曲线(红色和蓝色实线,图。GydF4y2Ba4GydF4y2Ba外:我)。在pi缺乏的情况下,这些基因在ZYD6和SN14之间的根中同样上调,并在3周时达到最大值(图中红色虚线)。GydF4y2Ba4GydF4y2Ba外:我)。这些基因在ZYD6的叶片中表达上调,而在SN14的叶片中表达没有变化(图中蓝色虚线)。GydF4y2Ba4GydF4y2Ba外:我)。GydF4y2Ba
这些发现表明GydF4y2BaPho1.GydF4y2Ba基因家族可能在大豆适应和形态分歧中发挥作用。此外,表述变化可能是在原理对之间的决定性进化事件GydF4y2BaPho1.GydF4y2Ba基因发生在野生和栽培大豆的分歧期间发生。因此,我们通过过度表达来自转基因的培养大豆的这些基因的cDNA来通过过表达这些基因的cDNA来测试这些假设GydF4y2Ba拟南芥GydF4y2Ba.GydF4y2Ba
过度表达GydF4y2Bagmpho1.GydF4y2Ba基因在转基因GydF4y2Ba拟南芥GydF4y2Ba
因为在相似对中序列高度相同GydF4y2BaGmPHO1; H9GydF4y2Ba/GydF4y2BaH10.GydF4y2Ba和GydF4y2BaGmpho1; H12 / H14GydF4y2Ba(附加文件GydF4y2Ba2GydF4y2Ba:表S1),GydF4y2BaGmPHO1; H10GydF4y2Ba和GydF4y2BaGmPHO1; H14GydF4y2Ba被排除在外,因此总共10GydF4y2Bagmpho1.GydF4y2Ba来自SN14(品种)的基因被包含在转基因中GydF4y2Ba拟南芥GydF4y2Ba化验。三个TGydF4y2Ba3.GydF4y2Ba经RT-PCR确认的每个转基因株系(附加文件)GydF4y2Ba1GydF4y2Ba:图S5)进行了进一步研究,得到了所有结果GydF4y2Bagmpho1.GydF4y2Ba与野生型(WT)相比,转基因植物没有明显的表型变化GydF4y2Ba拟南芥GydF4y2Ba,包括在正常生长条件下开花时间,种子大小,植物高度和发芽率(附加档案GydF4y2Ba2GydF4y2Ba:表S3),表明过表达GydF4y2Bagmpho1.GydF4y2Ba没有影响植物发展。GydF4y2Ba
GmPHO1改变了转基因拟南芥的耐盐性GydF4y2Ba
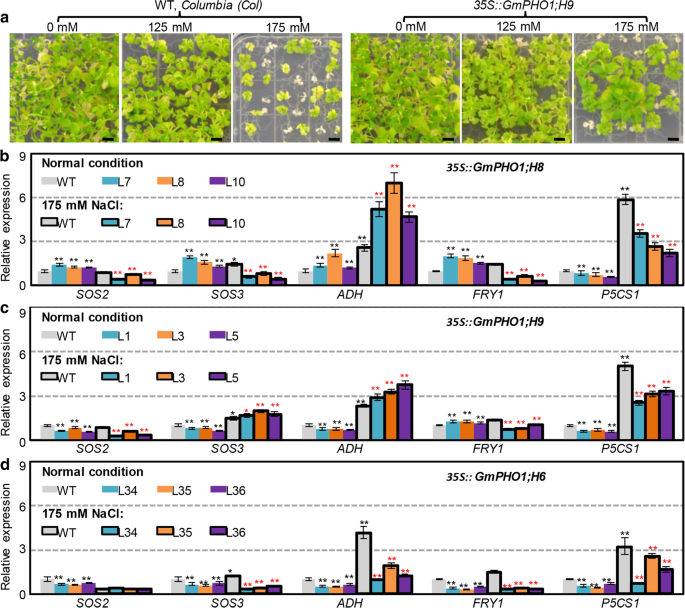
因为大豆表达的改变GydF4y2BaPho1.GydF4y2Ba基因发生在对盐胁迫的反应,我们首先评估的行为GydF4y2Bagmpho1.GydF4y2Ba转基因植物在盐度应力下(图。GydF4y2Ba5GydF4y2Ba,附加文件GydF4y2Ba1GydF4y2Ba:图S6)。在盐胁迫下(分别为125和175mM NaCl)在盐胁迫下进行种子萌发和幼苗绿色速率。转基因系的萌发速率均高于125mM NaCl的WT的萌发速率2天;然而,所有包括的植物线可能会在越来越多的治疗时间(附加文件)发芽GydF4y2Ba2GydF4y2Ba:表S4)。在175 mM NaCl处理下也观察到类似的模式(附加文件GydF4y2Ba2GydF4y2Ba:表S4)。这些结果表明转基因可以提高种子的萌发速度。GydF4y2Ba
gmpho1.GydF4y2Ba改变转基因的耐盐性GydF4y2Ba拟南芥GydF4y2Ba植物。GydF4y2Ba一种GydF4y2Ba的增长GydF4y2BaGmPHO1; H9GydF4y2Ba不同盐胁迫下的转基因植物。野生型(wt)的GydF4y2Ba拟南芥GydF4y2Ba(Col)作为对照。在培养液中生长6周的幼苗被捕获。条= 0.5厘米。GydF4y2BaB-D.GydF4y2Ba耐盐相关基因在转基因植物中的表达GydF4y2Ba拟南芥GydF4y2Ba.表达GydF4y2BaSOS2.GydF4y2Ba,GydF4y2BaSOS3.GydF4y2Ba,GydF4y2BaADH.GydF4y2Ba,GydF4y2BaP5CS1GydF4y2Ba和GydF4y2BaFRY1GydF4y2Ba在转基因中GydF4y2Ba拟南芥GydF4y2Ba植物窝藏GydF4y2BaGmPHO1; H8GydF4y2Ba(GydF4y2BaB.GydF4y2Ba),GydF4y2BaGmPHO1; H9GydF4y2Ba(GydF4y2BaCGydF4y2Ba) 和GydF4y2BaGmPHO1;代替GydF4y2Ba(GydF4y2BaD.GydF4y2Ba),分别。WT和转基因株系在1/ 2ms培养基中培养1周,然后转入175 mM NaCl的盐培养基中培养24 h。0 mM NaCl下WT(灰色列)中各基因的表达量设为1。黑色星形(*或**)表示0 mM NaCl下WT基因表达差异显著,红色星形(*或**)表示175 mM NaCl下WT基因表达差异显著。*表示意义GydF4y2BaPGydF4y2Ba< 0.05水平,**表示在GydF4y2BaPGydF4y2Ba< 0.01水平GydF4y2Ba
在125 mM NaCl条件下,幼苗绿化率无显著差异;然而,在175 mM NaCl条件下观察到差异(附加文件GydF4y2Ba1GydF4y2Ba:图S6a)。只有GydF4y2Ba35s :: gmpho1; h9GydF4y2Ba在NaCl胁迫下,I类转基因植株的幼苗绿化率显著高于野生型(图2)。GydF4y2Ba5GydF4y2Ba一个,附加文件GydF4y2Ba1GydF4y2Ba:图S6a)。然而,GydF4y2Ba35s :: gmpho1; h1GydF4y2Ba,GydF4y2Ba35s :: gmpho1; h5GydF4y2Ba3GydF4y2Ba5 s:GydF4y2Ba:GydF4y2BaGmPHO1; H8GydF4y2Ba, 和GydF4y2Ba35s :: gmpho1; h12GydF4y2BaII类转基因患者在175mM NaCl应力下的WT表现出高于WT的幼苗绿色速率(附加文件GydF4y2Ba1GydF4y2Ba:图S6a)。这些观察结果表明GydF4y2Bagmpho1.GydF4y2Ba但第I类和第II类基因的功能明显不同,第I类基因中只有1个基因,而第II类基因中有许多基因具有耐盐性GydF4y2Ba拟南芥GydF4y2Ba植物。GydF4y2Ba
转基因植物的GydF4y2Ba35s :: gmpho1; h6GydF4y2Ba,GydF4y2Ba35s :: gmpho1; h8GydF4y2Ba, 和GydF4y2Ba35s :: gmpho1; h9GydF4y2Ba选择评估土壤中的耐盐性。将四周的幼苗提供250mM NaCl以诱导盐胁迫。治疗15天后,WT和转基因素窝藏GydF4y2BaGmPHO1;代替GydF4y2Ba表现出广泛的漂白和潮汐,而GydF4y2Ba35s :: gmpho1; h8GydF4y2Ba和GydF4y2Ba35s :: gmpho1; h9GydF4y2Ba转基因株系均表现出强烈的绿色,比野生型更有活力GydF4y2Ba1GydF4y2Ba:图S6b-e)。此外,GydF4y2Ba35s :: gmpho1; h8GydF4y2Ba和GydF4y2Ba35s :: gmpho1; h9GydF4y2Ba转基因植物均显示出明显更高的叶绿素含量,而不是wt和GydF4y2Ba35s :: gmpho1; h6GydF4y2Ba转基因素线(附加文件GydF4y2Ba1GydF4y2Ba:图S6f)。地上生物量GydF4y2Ba35s :: gmpho1; h8GydF4y2Ba和GydF4y2Ba35s :: gmpho1; h9GydF4y2Ba处理1个月后,转基因植株明显高于野生型和转基因植株GydF4y2Ba35s :: gmpho1; h6GydF4y2Ba行(附加文件GydF4y2Ba1GydF4y2Ba:图S6 g)。这些观察结果表明,大豆过表达GydF4y2BaPho1.GydF4y2Ba基因(GydF4y2BaGmPHO1; H1GydF4y2Ba,GydF4y2BaGmPHO1; H5GydF4y2Ba,GydF4y2BaGmPHO1; H8GydF4y2Ba,GydF4y2BaGmPHO1; H9GydF4y2Ba, 和GydF4y2BaGmPHO1; H12GydF4y2Ba)改善耐盐性GydF4y2Ba拟南芥GydF4y2Ba.GydF4y2Ba
Gmpho1影响转基因拟南芥中的耐盐途径GydF4y2Ba
的GydF4y2BaSOS2.GydF4y2Ba,GydF4y2BaSOS3.GydF4y2Ba,GydF4y2BaADH.GydF4y2Ba,GydF4y2BaP5CS1GydF4y2Ba, 和GydF4y2BaFRY1GydF4y2Ba基因基本上涉及植物中的耐盐途径[GydF4y2Ba21GydF4y2Ba,GydF4y2Ba22GydF4y2Ba,GydF4y2Ba23GydF4y2Ba,GydF4y2Ba24GydF4y2Ba,GydF4y2Ba25GydF4y2Ba,GydF4y2Ba26GydF4y2Ba].阐明…可能的联系GydF4y2Bagmpho1.GydF4y2Ba通过盐胁迫途径,我们检查了转基因植物中这些耐盐途径基因的表达。七天幼苗的wt,GydF4y2Ba35s :: gmpho1; h8GydF4y2Ba,GydF4y2Ba35s :: gmpho1; h9GydF4y2Ba, 和GydF4y2Ba35s :: gmpho1; h6GydF4y2Ba转基因GydF4y2Ba拟南芥GydF4y2Ba将植物转移到具有175mM NaCl的培养基中24小时,并且将来自整个幼苗的总RNA进行QRT-PCR。在正常生长(0mM NaCl)条件下,我们发现,与WT(由图1中的开放色柱上方的黑色恒星突出显示,每个转基因可以差异地影响这些标志物基因的表达。GydF4y2Ba5GydF4y2Ba罪犯)。此外,我们观察到这一点GydF4y2BaADH.GydF4y2Ba,GydF4y2BaP5CS1GydF4y2Ba,GydF4y2BaSOS3.GydF4y2Ba, 和GydF4y2BaFRY1GydF4y2Ba的表达上调,而GydF4y2BaSOS2.GydF4y2Ba在WT背景下,表达没有显著影响(图中,与对应的开放灰色列相比,阻塞灰色列上方的黑色星星突出显示)。GydF4y2Ba5GydF4y2Ba罪犯)。此外,这些盐途径标记基因在转基因植株中与盐胁迫下的WT相比存在差异表达(图中被阻断的色柱上方的红色星星相对于被阻断的灰色柱突出显示)。GydF4y2Ba5GydF4y2Ba罪犯)。GydF4y2Ba
在里面GydF4y2Ba35s :: gmpho1; h8GydF4y2Ba转基因植物,除了GydF4y2BaP5CS1GydF4y2Badownregulation,GydF4y2BaSOS2.GydF4y2Ba,GydF4y2BaSOS3.GydF4y2Ba,GydF4y2Ba阿德,GydF4y2Ba和GydF4y2BaFRY1GydF4y2Ba基因在0mM NaCl下升高。但是,与盐处理下的WT相比,只有表达GydF4y2BaADH.GydF4y2Ba急剧增加,而另外的基因被下调(图。GydF4y2Ba5GydF4y2Bab)。尽管如此,相对于0mM NaCl下的相应转基因株,两者GydF4y2BaADH.GydF4y2Ba和GydF4y2BaP5CS1GydF4y2Ba在盐胁迫下,基因表达上调,其他基因表达下调(图。GydF4y2Ba5GydF4y2Bab)GydF4y2Ba.GydF4y2Ba与wt相比,在GydF4y2Ba35s :: gmpho1; h9GydF4y2Ba转基因GydF4y2Ba拟南芥GydF4y2Ba,GydF4y2BaSOS2.GydF4y2Ba,GydF4y2BaSOS3.GydF4y2Ba,GydF4y2BaADH.GydF4y2Ba和GydF4y2BaP5CS1GydF4y2Ba表达下调,而GydF4y2BaFRY1GydF4y2Ba在0mM NaCl条件下上调(图。GydF4y2Ba5GydF4y2Bac).然而,当NaCl处理时GydF4y2BaSOS3.GydF4y2Ba和GydF4y2BaADH.GydF4y2Ba基因在这些转基因中升级,并且GydF4y2BaSOS2.GydF4y2Ba,GydF4y2Ba弗莱GydF4y2Ba和GydF4y2BaP5CS1GydF4y2Ba下调(图。GydF4y2Ba5GydF4y2Bac).相对于未添加NaCl的相应转基因品系,GydF4y2BaSOS3.GydF4y2Ba,GydF4y2BaADH.GydF4y2Ba和GydF4y2BaP5CS1GydF4y2Ba上调,并通过NaCl处理下调其他基因(图。GydF4y2Ba5GydF4y2BaC)。有趣的是,在GydF4y2Ba35s :: gmpho1; h6GydF4y2Ba转基因素,在正常和盐胁迫条件下观察到盐途径标记基因表达的变化(图。GydF4y2Ba5GydF4y2Bad);然而,转基因植株的耐盐性没有变化。与基因表达模式的变化相比GydF4y2Ba35s :: gmpho1; h6GydF4y2Ba转基因素(图。GydF4y2Ba5GydF4y2Bad),上调的GydF4y2BaADH.GydF4y2Ba基因在两种GydF4y2Ba35s :: gmpho1; h9GydF4y2Ba和GydF4y2Ba35s :: gmpho1; h8GydF4y2Ba(无花果。GydF4y2Ba5GydF4y2BaB, c)可能在两种转基因分析中对提高耐盐性起重要作用。然而,在耐盐途径中,标记基因的表达发生了过度表达GydF4y2BaGmPHO1;代替GydF4y2Ba暗示了固有的本质GydF4y2BaPho1.GydF4y2Ba盐反应中的基因。GydF4y2Ba
Gmpho1参与转基因拟南芥中pi-饥饿的反应GydF4y2Ba
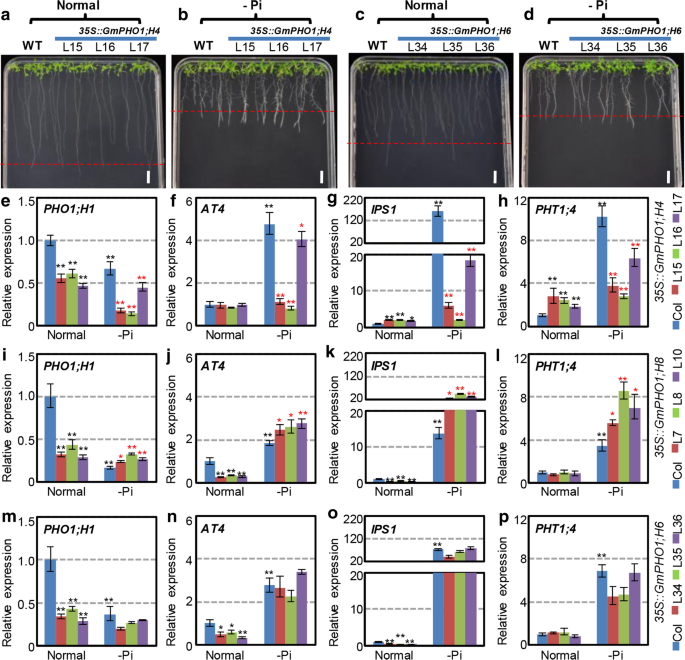
我们进一步研究了GydF4y2Bagmpho1.GydF4y2Ba缺乏磷的转基因植物。根和侧根的生长被认为是植物对磷素缺乏反应的诊断特征GydF4y2Ba35s :: gmpho1; h4GydF4y2Ba和GydF4y2Ba35s :: gmpho1; h6GydF4y2Ba(无花果。GydF4y2Ba6GydF4y2Ba广告)。响应pi缺乏,不仅是wtGydF4y2Ba拟南芥GydF4y2Ba主根长度减少,侧根数增加,但均为转基因GydF4y2Ba拟南芥GydF4y2Ba线路(附加文件GydF4y2Ba1GydF4y2Ba:图S7)。然而,我们发现转基因植物含有GydF4y2BaGmPHO1; H4GydF4y2Ba和GydF4y2BaGmPHO1; H8GydF4y2Ba与野生型相比,转基因小鼠对磷酸盐饥饿表现出不同的反应GydF4y2Ba拟南芥GydF4y2Ba线窝藏其他GydF4y2Bagmpho1.GydF4y2Ba基因,包括GydF4y2Ba35s :: gmpho1; h6GydF4y2Ba植物,没有表现出对pi缺乏症的敏感性的改变(图。GydF4y2Ba6GydF4y2Ba模拟,附加的文件GydF4y2Ba1GydF4y2Ba:图S7)。超表达GydF4y2BaGmPHO1; H4GydF4y2Ba在GydF4y2Ba拟南芥GydF4y2Ba与较长的初级根和较高的数量横向根相关,而不是WT(图。GydF4y2Ba6GydF4y2Baa, b,附加文件GydF4y2Ba1GydF4y2Ba:图S7),从而增强了对PI-饥饿的耐受性,而GydF4y2BaGmPHO1; H8GydF4y2Ba转基因系仅在PI缺陷下显着缩短了主要根源(附加文件GydF4y2Ba1GydF4y2Ba图S7),从而增加了根对Pi不足的敏感性。GydF4y2Ba
对胰岛素缺乏的敏感性改变GydF4y2Bagmpho1.GydF4y2Ba转基因GydF4y2Ba拟南芥GydF4y2Ba.GydF4y2Baa、bGydF4y2Ba35s :: gmpho1; h4GydF4y2Ba转基因系在正常(1.25mm Pi)上生长(GydF4y2Ba一种GydF4y2Ba)和-pi(0 mm pi)培养基(GydF4y2BaB.GydF4y2Ba)两个星期。GydF4y2BaCGydF4y2Ba,GydF4y2BaD.GydF4y2Ba35s :: gmpho1; h6GydF4y2Ba转基因系在正常(1.25mm Pi)上生长(GydF4y2BaCGydF4y2Ba)和-pi(0 mm pi)培养基(GydF4y2BaD.GydF4y2Ba)两个星期。红色虚线表示WT的根长。酒吧= 1厘米。GydF4y2BaE.GydF4y2Ba-GydF4y2BaP.GydF4y2Ba在转基因中涉及PI途径的标记基因的表达GydF4y2Ba拟南芥。GydF4y2Ba表达GydF4y2BaPHO1; H1GydF4y2Ba,GydF4y2BaAT4GydF4y2Ba,GydF4y2BaIPS1GydF4y2Ba, 和GydF4y2Bapht1; 4GydF4y2Ba在转基因中GydF4y2Ba拟南芥GydF4y2Ba植物窝藏GydF4y2BaGmPHO1; H4GydF4y2Ba(GydF4y2Ba超高频GydF4y2Ba),GydF4y2BaGmPHO1; H8GydF4y2Ba(GydF4y2Ba我GydF4y2Ba),GydF4y2BaGmPHO1;代替GydF4y2Ba(GydF4y2Ba大学出版社GydF4y2Ba),分别。野生型(WT)和转基因株在正常或-PI MS培养基中成长2周。在正常条件下的WT(蓝柱)中的每个基因的表达被设定为1.黑色恒星(*或**)表明在正常条件下与WT中的基因表达相对于基因表达的差异显着,而红色表明是显着的PI缺乏基因表达相对于基因表达的差异。*意味着在统计上显着差异GydF4y2BaPGydF4y2Ba< 0.05水平,**表示差异有统计学意义GydF4y2BaPGydF4y2Ba< 0.01水平GydF4y2Ba
Gmpho1影响转基因拟南芥中的PI信号通路GydF4y2Ba
IPS1GydF4y2Ba,GydF4y2BaAT4GydF4y2Ba,GydF4y2Bapht1; 4GydF4y2Ba, 和GydF4y2BaPHO1; H1GydF4y2Ba在调节GydF4y2Ba拟南芥GydF4y2Ba在pi缺陷期间[GydF4y2Ba4GydF4y2Ba,GydF4y2Ba5GydF4y2Ba,GydF4y2Ba6GydF4y2Ba[是否被认为是PI信号途径中的标记基因。进一步评估可能的角色GydF4y2Bagmpho1.GydF4y2Ba我们研究了这些标记基因在转Pi途径中的表达水平GydF4y2Ba拟南芥GydF4y2Ba线条。的GydF4y2Ba35s :: gmpho1; h8GydF4y2Ba,GydF4y2Ba35s :: gmpho1; h4GydF4y2Ba, 和GydF4y2Ba35s :: gmpho1; h6GydF4y2Ba评估植物并与WT进行比较。在正常情况下,GydF4y2BaIPS1GydF4y2Ba和GydF4y2Bapht1; 4GydF4y2Ba被上调GydF4y2Ba35s :: gmpho1; h4GydF4y2Ba转基因素线,而GydF4y2Ba越南河粉;H1GydF4y2Ba被下调,GydF4y2BaAT4GydF4y2Ba表达没有变化(图。GydF4y2Ba6GydF4y2Ba情况)。GydF4y2Bapht1; 4GydF4y2Ba表达没有改变,而GydF4y2Ba越南河粉,H1, IPS1GydF4y2Ba, 和GydF4y2BaAT4GydF4y2Ba被下调GydF4y2Ba35s :: gmpho1; h8GydF4y2Ba与WT相比的转基因线(图。GydF4y2Ba6GydF4y2BaI-L)。这些标志物基因表达中的变化GydF4y2Ba35s :: gmpho1; h6GydF4y2Ba植物与此相似GydF4y2Ba35s :: gmpho1; h8GydF4y2Ba植物(图。GydF4y2Ba6GydF4y2BaM-P)GydF4y2Ba.GydF4y2Ba这些结果表明GydF4y2Bagmpho1.GydF4y2Ba可能会影响Pi通路中相关基因的表达。GydF4y2Ba
但是,在PI-饥饿条件下,我们发现了GydF4y2BaIPS1GydF4y2Ba,GydF4y2BaAT4GydF4y2Ba, 和GydF4y2Bapht1; 4GydF4y2Ba在wt中的pi缺乏症确实上调了GydF4y2Ba拟南芥GydF4y2Ba, 然而GydF4y2BaPHO1; H1GydF4y2Ba被显着下调(蓝柱在PI正常和缺乏条件下的蓝柱比较。GydF4y2Ba6GydF4y2Bae-p)GydF4y2Ba.GydF4y2Ba此外,这些标志物基因的表达水平GydF4y2Ba35s :: gmpho1; h4GydF4y2Ba与WT相比,转基因系减少,表明它们对Pi缺乏的不敏感性(图。GydF4y2Ba6GydF4y2Bae-h),而这些都是上调的GydF4y2Ba35s :: gmpho1; h8GydF4y2Ba转基因素,显示对pi缺乏的过敏率(图。GydF4y2Ba6GydF4y2BaI-L)。但是,这些标志物基因表达的变化GydF4y2Ba35s :: gmpho1; h6GydF4y2Ba转基因植株对pi饥饿的反应与WT相似(图。GydF4y2Ba6GydF4y2Ba大学出版社)。因此,在GydF4y2Bagmpho1.GydF4y2Ba的家庭,GydF4y2BaGmPHO1; H4GydF4y2Ba要么GydF4y2BaGmPHO1; H8GydF4y2Ba可能通过影响同源基因的表达来参与Pi途径GydF4y2Barapidopsis pho; h1GydF4y2Ba,GydF4y2BaIPS1GydF4y2Ba,GydF4y2BaAT4GydF4y2Ba, 和GydF4y2Bapht1; 4GydF4y2Ba.GydF4y2Ba
SN14和ZYD6对盐胁迫和pi饥饿的响应GydF4y2Ba
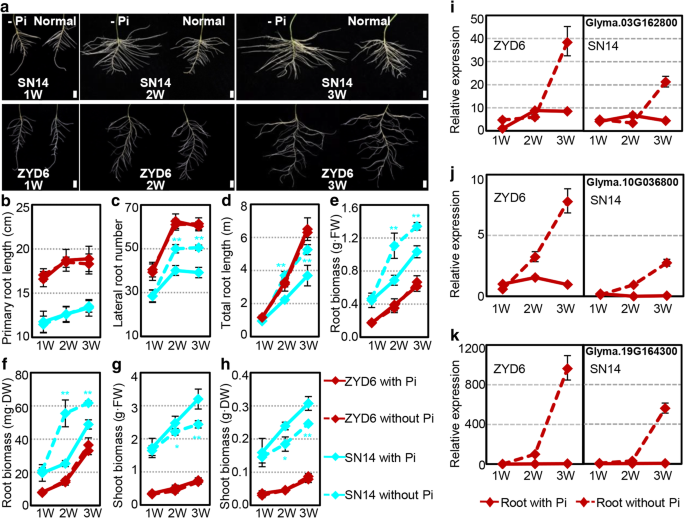
二类GydF4y2Bagmpho1.GydF4y2Ba基因显然可能影响转基因的反应GydF4y2Ba拟南芥GydF4y2Ba植物的压力。这些基因是否导致了大豆在应对压力时的差异?自然的表达GydF4y2BaPho1.GydF4y2Ba在SN14和ZYD6的根部中,伴随盐度和低pi胁迫的基因是多样的(附加文件GydF4y2Ba2GydF4y2Ba:表S5)。但是,如果比较表达式变化模式,我们发现最多GydF4y2BaPho1.GydF4y2Ba基因,特别是II类基因,与盐度应力类似,这些基因的一半响应于PI-饥饿而具有敏锐的对比(附加文件GydF4y2Ba2GydF4y2Ba:表S6),暗示差分响应能力在SN14和ZYD6之间的应力。因此,我们评估了SN14和ZYD6对盐度应激和PI-饥饿的反应。使用各种NaCl浓度来评估大豆盐度耐受性[GydF4y2Ba46GydF4y2Ba,GydF4y2Ba47GydF4y2Ba]在SN14和ZYD6中,两种摘要的大豆幼苗显示出类似的表型变异(附加文件GydF4y2Ba1GydF4y2Ba:图S8),表明两种附加的盐度耐受性没有显着差异。然而,当我们在低PI条件下治疗这些大豆时,在SN14和ZYD6之间观察到差分反应,特别是关于根部发育的差异反应(图。GydF4y2Ba7GydF4y2Ba,附加文件GydF4y2Ba1GydF4y2Ba:图S9)。我们发现,在发芽后,ZYD6的初级根长度比SN14的初始长度长,而未观察到对PI缺乏的响应不同的变化(图。GydF4y2Ba7GydF4y2Ba然而,在SN14中,pi缺失明显促进侧根的发育,而在ZYD6中则没有(图2)。GydF4y2Ba7GydF4y2Baa,c)。响应于PI-饥饿的SN14中横向根数的增加伴随着总根长度和生物质的增加(图。GydF4y2Ba7GydF4y2BaA,C-F)。然而,pi缺乏症诱导SN14地上生物质的显着减少(图。GydF4y2Ba7GydF4y2Bag, h),而ZYD6不敏感,说明野生大豆ZYD6对pi饥饿不敏感。GydF4y2Ba
在Pi缺乏条件下ZYD6和SN14的表型变化。GydF4y2Ba一种GydF4y2Ba大豆在正常(1.25 mM Pi)或缺磷(−Pi, 0 mM Pi)霍格兰培养基上的根系生长在指示时间。W,一周。条= 2厘米。GydF4y2BaB.GydF4y2Ba-GydF4y2BaHGydF4y2Ba量化变异的定量。GydF4y2BaB.GydF4y2Ba主要根长度。GydF4y2BaCGydF4y2Ba侧根数。GydF4y2BaD.GydF4y2Ba总根长。GydF4y2BaE.GydF4y2Ba以肉重计算的根生物量。GydF4y2BaFGydF4y2Ba按干重计算的根生物量。GydF4y2BaGGydF4y2Ba在肉重量方面拍摄生物量。GydF4y2BaHGydF4y2Ba按干重计算的地上部生物量。GydF4y2Ba一世GydF4y2Ba-GydF4y2BaK.GydF4y2Ba表达了三个最近同源物的表达GydF4y2Ba拟南芥PHT1; 4GydF4y2Ba在缺磷条件下的大豆中。将正常条件下1周(W) ZYD6根中各基因的表达量设为1。ZYD6和SN14分别代表野生大豆和栽培大豆。*表示意义GydF4y2BaPGydF4y2Ba< 0.05水平,**表示在GydF4y2BaPGydF4y2Ba< 0.01水平GydF4y2Ba
基于转基因的结果GydF4y2Ba拟南芥GydF4y2Ba分析,然后检查对与之同源的大豆基因的表达GydF4y2Ba拟南芥GydF4y2BaPi通路标记基因。在NCBI和Phytozome数据库中搜索未发现任何同源物GydF4y2Ba拟南芥IPS1GydF4y2Ba和GydF4y2BaAT4GydF4y2Ba在大豆中,而大豆GydF4y2Bapht1; 4GydF4y2Ba发现了基因。系统发育重建GydF4y2Bapht1; 4GydF4y2Ba基因描绘了大豆基因的推定原理(Glyma.03g162800,Glyma.10G036800和Glyma.19G164300)和GydF4y2Ba拟南芥PHT1; 4GydF4y2Ba(附加文件GydF4y2Ba1GydF4y2Ba:图S10)。利用qRT-PCR分析了大豆根系的总rnaGydF4y2Bapht1; 4GydF4y2Ba类基因在ZYD6和SN14根系发育过程中表达谱相似,但在根系中表达量不同。其中,Glyma.19G164300在正常情况下有微量表达(图)。GydF4y2Ba7GydF4y2Ba我知道)。此外,这些全部在ZYD6和SN14下都在PI缺乏症下(图。GydF4y2Ba7GydF4y2Ba我知道)。然而,基因表达水平响应于ZYD6中的PI-饥饿的增加显着高于SN14。GydF4y2Ba
这些结果表明,野生和栽培大豆在表型和分子水平下融化的含水和pi饥饿的差异响应能力,与之相关GydF4y2BaPho1.GydF4y2Ba基因家族以来,盐和PI信号通路可能受到一些表达的影响GydF4y2Bagmpho1.GydF4y2Ba基因。GydF4y2Ba
讨论GydF4y2Ba
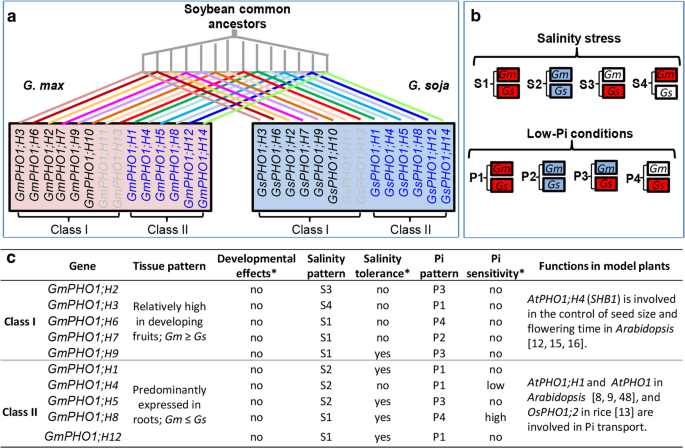
的GydF4y2BaPho1.GydF4y2Ba基因家族在GydF4y2Ba拟南芥GydF4y2Ba参与磷转移、胁迫反应和种子发育调控[GydF4y2Ba8GydF4y2Ba,GydF4y2Ba16GydF4y2Ba,GydF4y2Ba17GydF4y2Ba].我们之前研究了系统发育和表达GydF4y2Bagmpho1.GydF4y2Ba基因,表明潜在的副病毒潜在的功能分歧[GydF4y2Ba45GydF4y2Ba].本研究旨在探讨GydF4y2Bags-gmpho1GydF4y2Ba在不同条件下的序列和表达模式方面的正交基因对,评估其作用,在确定大豆探剂之间的盐度和pi饥饿的响应能力和进行转基因的作用GydF4y2Ba拟南芥GydF4y2Ba分析(图。GydF4y2Ba8GydF4y2Ba)提供进一步的见解,进一步了解功能多样化和适应性的角色GydF4y2BaPho1.GydF4y2Ba大豆进化期间的基因家族。GydF4y2Ba
的进化GydF4y2BaPho1样GydF4y2Ba大豆形态的基因。GydF4y2Ba一种GydF4y2Ba大豆的分子演变GydF4y2BaPho1.GydF4y2Ba基因。大豆的序列演变GydF4y2BaPho1.GydF4y2Ba基因家族被该基因家族的系统发育树(这项工作; [GydF4y2Ba45GydF4y2Ba])。GydF4y2BaB.GydF4y2Ba,GydF4y2BaCGydF4y2Ba大豆的表达多样化GydF4y2BaPho1.GydF4y2Ba基因和功能多样化。灰色的转录序列和I类基因的表达(在GydF4y2Ba一种GydF4y2Ba)未检测到,从而表明假性化。响应于指示的应力的表达模式总结在SN14和ZYD6的根部(GydF4y2BaB.GydF4y2Ba),而该基因家族的组织特异性表达模式是由所有家谱数据推断的GydF4y2BaG. Soja.GydF4y2Ba和GydF4y2BaG. Max.GydF4y2Ba这是在这项工作中使用的(GydF4y2BaCGydF4y2Ba).每个基因对压力的反应。红色、蓝色和白色的方框分别表示对所示胁迫的表达上调、下调和不变。总体而言,野生大豆和栽培大豆在盐胁迫(S1-S4)和低磷(P1-P4)条件下的基因表达变异模式有4种(详情见附加文件)GydF4y2Ba2GydF4y2Ba:表S6)。GydF4y2Ba通用汽车GydF4y2Ba,GydF4y2BaG. Max.GydF4y2Ba;GydF4y2BaGsGydF4y2Ba,GydF4y2BaG. Soja.GydF4y2Ba.大豆的功能GydF4y2BaPho1.GydF4y2Ba基因是从转基因中推断出来的GydF4y2Ba拟南芥GydF4y2Ba由明星(*)表示。的GydF4y2BaPho1.GydF4y2Ba来自模型植物的功能GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba和水稻被包括在内,以支持第I类和第II类的不同作用和功能的分化GydF4y2BaPho1.GydF4y2Ba基因家族GydF4y2Ba
大豆GydF4y2BaPho1.GydF4y2Ba基因与盐度或磷酸盐途径有关GydF4y2Ba
大豆的表达及分化规律分析GydF4y2BaPho1.GydF4y2Ba基因表明该基因家族在植物和种子发育中的作用。但是,大豆过表达GydF4y2BaPho1.GydF4y2Ba基因在转基因GydF4y2Ba拟南芥GydF4y2Ba没有透露种子萌发,开花时间,幼苗形态,植物高度和种子大小的任何变化。这些调查结果与那些有名的调查结果GydF4y2Ba拟南芥pho1GydF4y2Ba基因[GydF4y2Ba15GydF4y2Ba,GydF4y2Ba16GydF4y2Ba],从而暗示了GydF4y2BaPho1.GydF4y2Ba基因可能在植物开发中功能均相传。大豆基因响应盐度和磷酸盐缺乏的表达表明,这些可能在这些过程中发挥作用,以及含有特异性大豆的转基因植物GydF4y2BaPho1.GydF4y2Ba基因揭示了对盐度胁迫或缺乏症的耐受性的改变。GydF4y2Ba
Overexpressing的GydF4y2Bagmpho1.GydF4y2Ba基因在转基因GydF4y2Ba拟南芥GydF4y2Ba该基因家族的5个成员(GydF4y2BaGmPHO1; H1GydF4y2Ba,GydF4y2BaGmPHO1; H5GydF4y2Ba,GydF4y2BaGmPHO1; H8GydF4y2Ba,GydF4y2BaGmPHO1; H9GydF4y2Ba, 和GydF4y2BaGmPHO1; H12GydF4y2Ba)改善耐盐性GydF4y2Ba拟南芥GydF4y2Ba.盐胁迫下的萌发率,绿色速率和生长均未受到影响,甚至比wt好。我们进一步调查了表达GydF4y2BaSOS2.GydF4y2Ba,GydF4y2BaSOS3.GydF4y2Ba,GydF4y2BaADH.GydF4y2Ba,GydF4y2BaP5CS1GydF4y2Ba, 和GydF4y2BaFRY1GydF4y2Ba参与盐耐受途径的基因[GydF4y2Ba21GydF4y2Ba,GydF4y2Ba22GydF4y2Ba,GydF4y2Ba23GydF4y2Ba,GydF4y2Ba24GydF4y2Ba,GydF4y2Ba25GydF4y2Ba,GydF4y2Ba26GydF4y2Ba].GydF4y2Bagmpho1.GydF4y2Ba基因显然具有使用各种机制影响这些基因的表达的能力,从而影响转基因中的耐盐性GydF4y2Ba拟南芥GydF4y2Ba植物。之间的分子相互作用GydF4y2Bagmpho1.GydF4y2Ba家庭和耐盐途径需要进一步调查。然而,并非所有基因都赋予转基因的耐盐性GydF4y2Ba拟南芥GydF4y2Ba植物,可能是由于在进化过程中分子相互作用的变化。然而,表型可能取决于转基因如何影响GydF4y2BaADH.GydF4y2Ba表达。增加GydF4y2BaADH.GydF4y2Ba表达似乎是赋予转基因的强盐耐受性必不可少的GydF4y2Ba拟南芥GydF4y2Ba植物。GydF4y2Ba
过度表达GydF4y2Bagmpho1.GydF4y2Ba在转基因中GydF4y2Ba拟南芥GydF4y2Ba植物展示了这一点GydF4y2BaGmPHO1; H4GydF4y2Ba和GydF4y2BaGmPHO1; H8GydF4y2Ba也可能影响对PI缺乏的耐受性。这些观察结果同意各种植物中的研究结果。在GydF4y2Ba拟南芥GydF4y2Ba,GydF4y2BaPho1.GydF4y2Ba和GydF4y2BaPHO1; H1GydF4y2Ba参与了从根到木质部嫩枝的磷酸盐转移[GydF4y2Ba6GydF4y2Ba,GydF4y2Ba8GydF4y2Ba,GydF4y2Ba48GydF4y2Ba].的GydF4y2BaPho1.GydF4y2Ba基因也被证明参与了水稻和马铃薯的磷转移[GydF4y2Ba13GydF4y2Ba,GydF4y2Ba49GydF4y2Ba].各种基因,比如GydF4y2BaIPS1GydF4y2Ba,GydF4y2BaAT4GydF4y2Ba, 和GydF4y2Bapht1; 4GydF4y2Ba被认为是标记基因GydF4y2Ba拟南芥GydF4y2Ba响应pi-饥饿[GydF4y2Ba4GydF4y2Ba,GydF4y2Ba5GydF4y2Ba], 和GydF4y2BaPho1.GydF4y2Ba显示与Pi缺乏相关的所有标志,包括较差的血液生长和众多PI缺乏响应基因的过表达[GydF4y2Ba2GydF4y2Ba,GydF4y2Ba11GydF4y2Ba].GydF4y2BaPho1.GydF4y2Ba转录因子WRKY6受泛素E3连接酶降解的调控GydF4y2Ba拟南芥GydF4y2Ba[GydF4y2Ba9GydF4y2Ba,GydF4y2Ba48GydF4y2Ba].这一调控机制需要在大豆中进一步研究。然而,我们发现上述Pi信号通路的标记基因在GydF4y2Bagmpho1.GydF4y2Ba转基因植物受到差异影响,这反过来支持对PI-饥饿的耐受性的多样性。与低PI条件下的WT相比,PI信号途径的所有四个标记基因的表达增加GydF4y2Ba35 s:: GmPHO1; H8拟南芥GydF4y2Ba在低磷条件下,植株的根系发育受到抑制,表现出对低磷条件的过敏反应,并伴有根的缩短GydF4y2Ba35s :: gmpho1; h8GydF4y2Ba转基因GydF4y2Ba拟南芥GydF4y2Ba植物有pi-饥饿。然而,观察到相反GydF4y2Ba35s :: gmpho1; h4GydF4y2Ba植物。这些标记基因的表达模式GydF4y2Ba35s :: gmpho1; h6GydF4y2Ba植物与那些相似GydF4y2Ba35s :: gmpho1; h8GydF4y2Ba植物在正常情况下。然而,相对于WT,在该标志物基因的表达中没有观察到这些标记基因的表达没有变化GydF4y2Ba35s :: gmpho1; h6GydF4y2Ba在低磷条件下,未检测到任何表型变异。这些结果表明了低pi水平反应的调控机制的复杂性。然而,同源的GydF4y2Ba拟南芥PHT1; 4GydF4y2BaSN14和ZYD6之间的差异表达,进一步证实了两种大豆对低磷处理的不同响应。GydF4y2Ba
转基因分析还表明,一些具有少量的转基因植物GydF4y2Bagmpho1.GydF4y2Ba基因如GydF4y2BaGmPHO1; H8GydF4y2Ba对盐胁迫表现出很强的耐受性,对钙离子缺乏的敏感性提高,表明这两个非生物信号通路可能相互作用。然而,这种可能的相声的分子细节和如何GydF4y2Bagmpho1.GydF4y2Ba基因影响转基因植物的适应性(包括产量、生物量积累等)GydF4y2Ba拟南芥GydF4y2Ba植物需要进一步调查。然而,这些结果表明大豆GydF4y2BaPho1.GydF4y2Ba基因参与了盐度或Pi途径,这在植物物种中是保守的[GydF4y2Ba8GydF4y2Ba,GydF4y2Ba9GydF4y2Ba,GydF4y2Ba13GydF4y2Ba,GydF4y2Ba48GydF4y2Ba,进一步表明大豆PHO1同源基因在响应非生物胁迫方面的功能差异。GydF4y2Ba
大豆的进化意义GydF4y2BaPho1.GydF4y2Ba基因GydF4y2Ba
种植大豆至少在5000年前就从野生大豆驯化而来[GydF4y2Ba28GydF4y2Ba,GydF4y2Ba29GydF4y2Ba].编码序列或驯养基因表达的变化是影响植物驯化期间表型的主要致病力[GydF4y2Ba50GydF4y2Ba,GydF4y2Ba51GydF4y2Ba,GydF4y2Ba52GydF4y2Ba,GydF4y2Ba53GydF4y2Ba,GydF4y2Ba54GydF4y2Ba,GydF4y2Ba55GydF4y2Ba].差异表达GydF4y2BaPho1.GydF4y2Ba在野生大豆和栽培大豆之间检测到发育果实的基因;然而,这在功能上与任何与水果相关的驯化性状无关。野生大豆由于地理分布广泛,遗传变异丰富,具有抗逆等优良农艺性状[GydF4y2Ba43GydF4y2Ba,GydF4y2Ba44GydF4y2Ba].然而,与种子大小不同,自适应变异似乎似乎不是驯化性状,而是环境中挑战的结果。在野生或栽培途径中涉及相关途径的某些基因的精英等位基因可能会赋予某些应力的耐受性。我们观察到培养的大豆Sn14和野生大豆Zyd6对低Pi显示出明显的敏感性,尽管检测到对盐度的耐受性没有明显的差异。对比较的研究GydF4y2BaPho1.GydF4y2Ba这两种遗传类型之间的基因将为观察到的差异提供见解。该基因家族从大豆共同祖先进化而来,并在大豆进化过程中呈现出总体相似的变异模式(图)。GydF4y2Ba8GydF4y2Baa - c)。大豆GydF4y2BaPho1.GydF4y2Ba两者的基因GydF4y2BaG. Max.GydF4y2Ba和GydF4y2BaG. Soja.GydF4y2Ba被分为两类,即一类和二类。十四名成员GydF4y2BaPho1.GydF4y2Ba大豆的家系预测[GydF4y2Ba45GydF4y2Ba];然而,在本研究中,我们确认表达了12个成员,因此,伪析化可能发生在两种情况下GydF4y2BaG. Max.GydF4y2Ba和GydF4y2BaG. Soja.GydF4y2Ba.I类中的积极表达基因基本存在于所有评估的器官中,而II类的基因主要积累在根中,从而提示两类功能分歧。II类的受限制表达GydF4y2BaPho1.GydF4y2Ba根中的基因可能限制它们在根发育和适应中的作用。这一观点进一步得到了大豆根基因表达变化的观察结果的支持GydF4y2BaPho1.GydF4y2Ba基因响应盐度应激和PI-饥饿。GydF4y2Ba
最多GydF4y2BaPho1.GydF4y2Ba基因在SN14和ZYD6之间的根部显示出类似的表达趋势(图。GydF4y2Ba8GydF4y2Bab,c),因此,在两个附加过程之间赋予相似的耐盐性,而相互作用GydF4y2BaPho1.GydF4y2Ba基因,特别是两个基因(GydF4y2BaGmPHO1; H4GydF4y2Ba和GydF4y2BaGmPHO1; H8GydF4y2Ba)来自II级似乎在赋予低pi的大豆耐受性方面表现出基本作用。此外,转基因GydF4y2Ba拟南芥GydF4y2Ba分析进一步证实了这些概念,并揭示了操纵GydF4y2BaPho1.GydF4y2Ba家族基因可能改变植物对盐胁迫或低磷处理的耐受性(图。GydF4y2Ba8GydF4y2Ba这些观察结果表明GydF4y2BaPho1.GydF4y2Ba基因家族参与决定耐盐和低磷胁迫。特别是被转基因所证实的GydF4y2Ba拟南芥GydF4y2Ba分析,GydF4y2BaGmPHO1; H4GydF4y2Ba和GydF4y2BaGmPHO1; H8GydF4y2Ba是赋予大豆敏感性对低pi的潜在功能构件(图。GydF4y2Ba8GydF4y2Bac),可以通过影响表达来满足GydF4y2Bapht1; 4GydF4y2Ba基因,因为GydF4y2Ba拟南芥PHT1; 4GydF4y2Ba基因,在PI收购中起重要作用[GydF4y2Ba5GydF4y2Ba,在转基因植株中受到显著影响GydF4y2Ba拟南芥GydF4y2Ba植物。而且,表达了GydF4y2Bapht1; 4GydF4y2Ba在ZYD6中响应低pi的基因显着高于SN14中的,与ZYD6不敏感的两种载体之间的差分响应能力与差异响应能力相关的差异响应能力与SN14不敏感。之间的关系GydF4y2BaPho1.GydF4y2Ba和GydF4y2Bapht1; 4GydF4y2Ba大豆的基因还需要进一步的研究,但我们的结果提示了大豆的功能和分化GydF4y2BaPho1.GydF4y2Ba基因家族与进化过程中的植物适应关系。尽管如此,不是全部GydF4y2Bagmpho1.GydF4y2Ba成员改变了转基因的盐度和低pi的耐受性GydF4y2Ba拟南芥GydF4y2Ba植物(图。GydF4y2Ba8GydF4y2Bac),暗示大豆旁泡糖糖蛋白酶之间的功能分歧,这可能主要是由于基因重复后编码序列的变化。GydF4y2Ba
的GydF4y2BaPho1.GydF4y2Ba直向同源基因GydF4y2BaG. Max.GydF4y2Ba和GydF4y2BaG. Soja.GydF4y2Ba来自普通大豆祖先(图。GydF4y2Ba8GydF4y2Ba一种)。我们发现12个活跃GydF4y2BaPho1.GydF4y2Ba野生大豆和栽培大豆的同源基因对显示出有限的序列差异,所有检测到的变异均为中性变异,表明大豆具有保守的功能GydF4y2BaGm-GsPHO1GydF4y2Ba野生和培养的大豆之间的直向性基因对。但是,我们也透露了GydF4y2BaGm-GsPHO1GydF4y2Ba正交基因对在果实发育和基因表达模式期间显示不同的组织特异性表达模式,以及应对各种非生物胁迫,包括盐度和PI缺乏,表明驯化会影响其表达。有趣的是,水平GydF4y2BaPho1.GydF4y2Ba果实发育过程中的基因表达GydF4y2BaG. Max.GydF4y2Ba是否总体上高于GydF4y2BaG. Soja.GydF4y2Ba,而这件事GydF4y2BaPho1.GydF4y2Ba在根的表达GydF4y2BaG. Soja.GydF4y2Ba一般高于GydF4y2BaG. Max.GydF4y2Ba,表明这些基因在大豆驯化过程中存在功能差异。特别是第一类的表达式GydF4y2BaPho1.GydF4y2Ba基因已经广泛地扩展到各种组织,并且它在野生和栽培大豆之间显示出差异表达。这种差异表达模式可以参与多种发育角色,并且可能与大豆驯化期间的表型分歧相关,因为I类基因GydF4y2BaAtPHO1; H4GydF4y2Ba(GydF4y2BaSHB1GydF4y2Ba)在种子大小和开花时间中发挥发育角色GydF4y2Ba拟南芥GydF4y2Ba[GydF4y2Ba12GydF4y2Ba,GydF4y2Ba15GydF4y2Ba,GydF4y2Ba16GydF4y2Ba].但是,转基因GydF4y2Ba拟南芥GydF4y2Ba大豆分析GydF4y2BaPho1.GydF4y2Ba基因并不支持这一观点(图。GydF4y2Ba8GydF4y2BaC)。大豆基因响应盐度和低pi胁迫的作用在转基因中得到了很好的证明GydF4y2Ba拟南芥GydF4y2Ba研究表明,这与观察到的大豆的表达一致GydF4y2BaPho1.GydF4y2Ba基因多移地应对应力,并且在大豆中响应盐度(S1-S4)或低PI(P1-P4)条件而发生的总体基因表达的总体四种模式,其中一些GydF4y2Ba通用汽车GydF4y2Ba-GydF4y2BaGSPHO1.GydF4y2Ba正交成对在盐度应激或Pi缺乏下具有不同程度的反应模式。然而,其他在表达趋势和强度方面具有完全不同的表达变化,即使是相反的趋势(图。GydF4y2Ba8GydF4y2Bab)。GydF4y2BaPho1.GydF4y2Ba两种大豆品种对盐胁迫和低磷胁迫的响应基因差异然而,仅观察到对低Pi的不同反应,表明GydF4y2BaPho1.GydF4y2Ba基因主要参与PI途径,而这些基因在盐度应力中的作用,其反映在转基因中GydF4y2Ba拟南芥GydF4y2Ba,可以通过其他大豆基因的变化来掩盖。在大豆中对盐度和低pi的反应的分子基础可能是高度复杂的。然而,表达的分歧及其对应力的反应GydF4y2BaPho1.GydF4y2Ba基因家族在SN14和ZYD6的根GydF4y2BaG. Max.GydF4y2Ba和GydF4y2BaG. Soja.GydF4y2Ba,可以在区分应力信号感知和转导的能力方面发挥作用,因此在演化过程中对两种物种之间的某些应力进行耐受性。GydF4y2Ba
植物的功能多样化GydF4y2BaPho1.GydF4y2Ba基因GydF4y2Ba
的GydF4y2BaPho1.GydF4y2Ba基因家族在植物发育和进化过程中起着多种作用。GydF4y2Ba拟南芥SHB1GydF4y2Ba(GydF4y2BaPHO1; H4GydF4y2Ba),参与开花时间和种子尺寸控制[GydF4y2Ba12GydF4y2Ba,GydF4y2Ba15GydF4y2Ba,GydF4y2Ba16GydF4y2Ba,属于一类转基因GydF4y2Ba拟南芥GydF4y2Ba分析没有显示任何证据支持这种作用GydF4y2BaPho1.GydF4y2Ba在大豆中般的基因。然而,这种作用并未排除,因为I类基因的表达在GydF4y2BaG. Max.GydF4y2Ba和GydF4y2BaG. Soja.GydF4y2Ba在水果开发期间。或者,它在种子大小中的作用可能是特定的GydF4y2Ba芸苔属植物GydF4y2Ba物种或仅限GydF4y2Ba拟南芥GydF4y2Ba.I类基因显示出广泛而多样化的表达模式,这表明具有多种发育角色。II类成员在低PI中的作用在各种植物中特别保守,包括GydF4y2Ba拟南芥GydF4y2Ba[GydF4y2Ba6GydF4y2Ba,GydF4y2Ba8GydF4y2Ba], 白饭 [GydF4y2Ba13GydF4y2Ba],栽培大豆[GydF4y2Ba45GydF4y2Baparato [GydF4y2Ba49GydF4y2Ba,表明第二类的具体作用GydF4y2BaPho1.GydF4y2BaPI信号通路中的基因。这种观察到一定程度地证实了SN14和ZYD6对低PI治疗的不同反应。我们还阐明了大豆的作用GydF4y2BaPho1.GydF4y2Ba响应盐胁迫的基因,以及转基因基因GydF4y2Ba拟南芥GydF4y2Ba在美国,大多数II类基因改变了对盐胁迫的耐受性。然而,只有一个基因GydF4y2BaGmPHO1; H9GydF4y2Ba从课堂上,我做了,进一步支持两班之间的功能分歧。但是,这些差异表达GydF4y2BaPho1.GydF4y2Ba基因对SN14和ZYD6的耐盐性差异不明显,进一步反映了植物响应非生物胁迫的分子机制的复杂性。这种植物GydF4y2BaPho1.GydF4y2Ba基因家族具有不同的作用,这是由表达差异决定的。GydF4y2Ba8GydF4y2BaB, c),尽管表达差异背后的分子变异需要进一步研究。在响应各种非生物胁迫的整个大豆家族中,所有大豆基因的表达似乎都具有不同程度的活性,这暗示了大豆基因的多样性GydF4y2BaPho1.GydF4y2Ba类基因主要参与植物的适应性进化。GydF4y2Ba
结论GydF4y2Ba
在一起,不同组织中基因表达的显着变化,特别是在发展水果和根部,以及响应低PI和盐度应力的根部的变化在很大程度上是局部基因对的功能分歧GydF4y2BaPho1.GydF4y2Ba野生和栽培大豆之间的家庭。未观察到直接功能证据以支持其在大豆果实开发中的作用,然而,根部的表达变化在确定不同大豆换算中的响应能力方面的表达变化。大豆功能演化的模式GydF4y2BaPho1.GydF4y2Ba基因整体不清楚,但转基因GydF4y2Ba拟南芥GydF4y2Ba分析表明,该基因家族成员在响应盐度和低磷胁迫方面存在功能差异,因此支持GydF4y2BaPho1.GydF4y2Ba基因在大豆进化中起着适应性的作用。大豆的机理GydF4y2BaPho1.GydF4y2Ba与各种胁迫相关的基因、它们的串扰和适应进化的作用需要在原生寄主中进一步研究。该研究也为作物改良提供了有前景的遗传材料;例如,基因操纵GydF4y2Bagmpho4.GydF4y2Ba,GydF4y2Bagmpho8.GydF4y2Ba, 和GydF4y2BaGmpho9.GydF4y2Ba能提高大豆在盐胁迫和低磷条件下的生产性能。GydF4y2Ba
方法GydF4y2Ba
植物材料和生长条件GydF4y2Ba
栽培大豆苏门14(SN14)和野生加入ZYD00006(ZYD6)[GydF4y2Ba56GydF4y2Ba]在植物研究所(中国北京)的温室中长日条件(23°C - 25°C下16 h光照/8 h黑暗)下生长。采集3周龄幼苗的根、叶和茎,采集成熟花朵和受精后1、3、5或15天的果实。另外四种野生大豆(Y1、Y2、Y3和Y4)和栽培大豆(河丰48、嫩丰16、河农35和东农53)的生物样本[GydF4y2Ba57GydF4y2Ba,用于组织特异性表达谱分析。大豆种子仅供研究使用。GydF4y2Ba
大豆的盐胁迫与低磷处理GydF4y2Ba
在盐胁迫条件下,将SN14和ZYD6种子在蛭石中1/5霍格兰(1/5 hogland)溶液中萌发2周,然后添加不同NaCl浓度(100 mM、150 mM、200 mM和250 mM)的1/5霍格兰(1/5 hogland)溶液。以不加盐处理的大豆幼苗为对照。处理4 h后采收根系进行基因表达研究。GydF4y2Ba
对于低PI治疗,SN14和ZYD6的种子在腔室中萌发并培养,具有1/5的HOAGLAND溶液,正常浓度Pi(1.25mm)或3周。分别在一个,两次和3周后收获的根和叶子治疗基因表达分析。GydF4y2Ba
每次治疗都包括三个重复。对于表型观察,相同的溶液在盐度应力中每2天补充每2天或每周在低PI处理中刷新,直至所示的观察时间。GydF4y2Ba
定量RT-PCR(QRT-PCR)分析GydF4y2Ba
使用SV总RNA分离系统(Promega, Madison, WI, USA)提取总RNA,然后用DNase I (Promega)处理,消化残留DNA。用oligo (dT)合成cDNAGydF4y2Ba18GydF4y2Ba继底漆后的M-MLV cDNA合成试剂盒(Invitrogen,Carlsbad,USA)的说明。使用Sybr Premix Ex Taq(Takara,China)对MX3000P QPCR系统(Agilent,CA)进行QRT-PCR进行QRT-PCR。大豆GydF4y2Ba肌动蛋白GydF4y2Ba基因(Glyma18G52780)用作内部对照。使用三个独立的生物样品进行每个实验,并提出了平均值±标准偏差。特异性基因引物GydF4y2BaPho1.GydF4y2Ba家庭的设计如前所述[GydF4y2Ba45GydF4y2Ba].底漆GydF4y2Ba拟南芥GydF4y2Ba如前一项研究中所述,分别合成PI信号传导途径和耐盐途径基因的标记基因[GydF4y2Ba3.GydF4y2Ba,GydF4y2Ba56GydF4y2Ba].本工作中设计的所有引物序列均在附加文件中列出GydF4y2Ba2GydF4y2Ba:S7表。GydF4y2Ba
转基因GydF4y2Ba拟南芥GydF4y2Ba分析GydF4y2Ba
的开放阅读框架(ORF)GydF4y2Bagmpho1.GydF4y2Ba将基因插入到由花椰菜马赛克病毒35s启动子驱动的PCAMBIA1300载体中。每个构建体都被转化为GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba由介导的GydF4y2Ba根癌土壤杆菌GydF4y2Ba菌株GV3101采用花浸渍法[GydF4y2Ba58GydF4y2Ba].在含有35mg /L湿霉素(Roche, Basel, Switzerland)的Murashige & Skoog (MS)培养基上筛选转基因植株,并通过RT-PCR进行验证。GydF4y2Ba拟南芥GydF4y2Ba植物在长日照条件下(在23°C - 25°C下光照16 h /黑暗8 h)在生长室中生长。GydF4y2Ba
T的种子GydF4y2Ba3.GydF4y2Ba转基因GydF4y2Ba拟南芥GydF4y2Ba植物用70%乙醇(v/v)消毒3 min,用15% NaClO (v/v)消毒10 min。然后用无菌的ddH冲洗四到五次GydF4y2Ba2GydF4y2Bao在4℃下分层3天,然后转移到生长室。将种子在1/2 ms培养基上发芽1周,然后转移到土壤中以观察转基因植物的表型。还在4天内检查发芽率。在开花时间记录了螺栓连接时的玫瑰花叶的数量。测量了七周幼苗的高度。使用实验室余额(Mettler-Toledo,苏黎世,瑞士)加权,并在立体显微镜(尼康,东京,日本)下拍摄。GydF4y2Ba
转基因的盐处理GydF4y2Ba拟南芥GydF4y2Ba线GydF4y2Ba
为了观察绿化率,种子在含125 mM和175 mM两种浓度NaCl的1/ 2ms培养基上放置6周。分别在接种后第2、4和6天记录发芽率。为了进一步观察转基因品系的耐盐性,将转基因植株在1/ 2ms培养基上培养1周,然后转入土壤3周。用250 mM NaCl处理(每5天1次)。处理后约15 d,测定植物的漂白程度和叶绿素含量。然后测定处理第30天的地上部生物量。将生长在1/2 MS上的1周幼苗转移到175 mM NaCl培养基上培养24 h,收获整株幼苗,研究耐盐途径基因的表达情况。GydF4y2Ba
转基因低磷处理GydF4y2Ba拟南芥GydF4y2Ba植物GydF4y2Ba
种子在1/ 2ms低pi和正常pi培养基上萌发2周。低(0毫米KHGydF4y2Ba2GydF4y2Ba宝GydF4y2Ba4GydF4y2Ba)和正常(1.25 mM KHGydF4y2Ba2GydF4y2Ba宝GydF4y2Ba4GydF4y2BaPi培养基以pH 5.7、0.5% (w/v)蔗糖、0.4% (w/v)植tagel的Murashige和Skoog培养基为基础进行修饰。基本培养基如前所述制备[GydF4y2Ba59GydF4y2Ba].GydF4y2Ba
叶绿素含量的测定GydF4y2Ba
空中部分GydF4y2Ba拟南芥GydF4y2Ba采集植物,在无水酒精中粉碎。将混合物迅速摇匀,置于黑暗中放置16小时。用紫外-可见分光光度计(ChemitoSpectrascan, UV 2600)记录上清液在663 nm和645 nm波长下的吸光度。叶绿素含量根据Arnon(1949)估算[GydF4y2Ba60GydF4y2Ba].GydF4y2Ba
大豆形态学分析GydF4y2Ba
盐度应力和低PI治疗后,使用相机(日本尼康,日本)拍摄幼苗。特别是,在低PI处理之后,使用Winrhizo根分析系统(WinRhizo,Regent,Canada)测量根长度,并且手动计数根部。使用实验室余额记录新鲜和干燥的生物量(塞里奇,瑞士苏黎世)。GydF4y2Ba
统计分析GydF4y2Ba
除非另有说明,否则使用三个独立的生物重复或重复三次进行每个实验/测量。学生的双尾GydF4y2BaT.GydF4y2Ba-test用于统计分析,它是通过使用IBM SPSS统计来执行的Windows,版本24.0(IBM Corp,Ny,Ny,USA)进行。GydF4y2Ba
测序分析GydF4y2Ba
的GydF4y2BaPho1.GydF4y2BaWilliams 82的类基因在我们之前的工作中得到了描述[GydF4y2Ba45GydF4y2Ba].基因特异性引物被设计为获得SN14的完整cDNA序列(GydF4y2Bagmpho1.GydF4y2Ba)和zyd6(GydF4y2BaGSPHO1.GydF4y2Ba).通过使用Mega5基于氨基酸序列构建大邻邻近(NJ)系统发育树[GydF4y2Ba61GydF4y2Ba].序列分歧GydF4y2Ba通用汽车GydF4y2Ba-GydF4y2BaGsGydF4y2Ba使用Snap和Provean预先预测Pho1的原言对,包括替代和框架插入和缺失,[GydF4y2Ba62GydF4y2Ba,GydF4y2Ba63GydF4y2Ba].Seedence由Taihe Biotechnology Company(北京,中国)进行。本研究中使用的引物(附加文件GydF4y2Ba2GydF4y2Ba表S7)为泰和生物技术公司商业化合成。GydF4y2Ba
可用性数据和材料GydF4y2Ba
所有相关的支持数据都可以在本文附带的附加文件中找到。本文中描述的序列数据可以在Genbank找到(GydF4y2Bahttp://www.ncbi.nlm.nih.gov.GydF4y2Ba),由MH668976-MH668999加入。GydF4y2Ba
缩写GydF4y2Ba
- cDNA:GydF4y2Ba
-
互补脱氧核糖核酸GydF4y2Ba
- ML:GydF4y2Ba
-
最大似然GydF4y2Ba
- NJ:GydF4y2Ba
-
邻接GydF4y2Ba
- 子:GydF4y2Ba
-
开放阅读框GydF4y2Ba
- Pho1.GydF4y2Ba:GydF4y2Ba
-
磷酸盐1GydF4y2Ba
- Pi:GydF4y2Ba
-
无机磷酸盐GydF4y2Ba
- QRT-PCR:GydF4y2Ba
-
定量rt - pcrGydF4y2Ba
- RT-PCR:GydF4y2Ba
-
逆转录 - 聚合酶链反应GydF4y2Ba
参考GydF4y2Ba
- 1.GydF4y2Ba
牛玉峰,柴瑞森,金光良,王辉,唐春霞,张永生。根构型发育对低磷有效性的响应研究进展。安机器人。2013;112:391 - 408。GydF4y2Ba
- 2.GydF4y2Ba
Péret B, Desnos T, Jost R, Kanno S, Berkowitz O, Nussaume L.根建筑的响应:寻找磷酸盐。植物杂志。2014;166:1713-23。GydF4y2Ba
- 3.GydF4y2Ba
Jost R, Pharmawati M, Lapis-Gaza HR, Rossig C, Berkowitz O, Lambers H,等。分化磷酸盐依赖和非磷酸盐依赖的系统磷酸盐饥饿反应网络GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba通过磷矿的应用。J Exp Bot。2015; 66:2501-14。GydF4y2Ba
- 4.GydF4y2Ba
Martín AC, del Pozo JC, Iglesias J, Rubio V, Solano R, de La Peña A, et al。细胞分裂素对磷素饥饿反应基因表达的影响GydF4y2Ba拟南芥GydF4y2Ba.植物j . 2000; 24:559 - 67。GydF4y2Ba
- 5.GydF4y2Ba
Shin H,Shin HS,Dewbre Gr,哈里森MJ。磷酸盐运输GydF4y2Ba拟南芥GydF4y2Ba:PHT1; 1和PHT1; 4在低磷酸盐环境中发挥着磷酸盐的主要作用。工厂J. 2004; 39:629-42。GydF4y2Ba
- 6.GydF4y2Ba
Stefanovic A,Rizot C,Rouached H,Wang Y,Chong J,Belbahri L等。成员GydF4y2BaPho1.GydF4y2Ba基因家族在磷酸盐转移到芽中显示有限的功能冗余,并通过明显的途径通过磷酸盐缺乏调节。工厂J. 2007; 50:982-94。GydF4y2Ba
- 7.GydF4y2Ba
赵志刚,赵志刚,赵志刚,等GydF4y2Ba拟南芥GydF4y2Ba缺乏磷酸盐的木质荷载。植物理性。1991; 97:1087-93。GydF4y2Ba
- 8.GydF4y2Ba
汉堡D, Rezzonico E,麦当劳-康柏Petetot J, Somerville C, Poirier yGydF4y2Ba拟南芥pho1GydF4y2Ba参与向木质部装载磷酸盐的基因。植物细胞。2002;14:889 - 902。GydF4y2Ba
- 9.GydF4y2Ba
陈毅,李LQ,徐Q,孔耶,王H,吴WH。的GydF4y2BaWRKY6.GydF4y2Ba转录因子调制GydF4y2Ba磷酸盐1GydF4y2Ba在低PI胁迫下的表达GydF4y2Ba拟南芥GydF4y2Ba.植物细胞。2009; 21:3554-66。GydF4y2Ba
- 10.GydF4y2Ba
Rouached H,Stefanovic A,Secco D,Arpat Ab,Gout E,Bligny R等人。将磷酸盐缺乏从其对生长和转录组的主要影响GydF4y2BaPho1.GydF4y2Ba表达式GydF4y2Ba拟南芥GydF4y2Ba.植物j . 2011; 65:557 - 70。GydF4y2Ba
- 11.GydF4y2Ba
魏格,张志强,张志强,等。PHO1的EXS结构域通过根-茎信号参与幼苗对缺磷的响应。植物杂志。2015;170:385 - 400。GydF4y2Ba
- 12.GydF4y2Ba
王Y,Rizot C,Rezzonico E,Poirier Y.结构和表达剖面GydF4y2Ba拟南芥pho1GydF4y2Ba基因家族表明在无机磷酸盐稳态中的广泛作用。植物理性。2004; 135:400-11。GydF4y2Ba
- 13.GydF4y2Ba
Secco D,Baumann A,Poirier Y.米饭的特征GydF4y2BaPho1.GydF4y2Ba基因家族揭示了一个关键的作用GydF4y2Baospho1; 2GydF4y2Ba在磷酸盐稳态和双子叶片中不同腕表的演变。植物理性。2010; 152:1693-704。GydF4y2Ba
- 14.GydF4y2Ba
康X,Ni M.GydF4y2Ba拟南芥GydF4y2BaBlue1下的短胚轴包含SPX和EXS域并采用密码转力信号传导。植物细胞。2006; 18:921-34。GydF4y2Ba
- 15.GydF4y2Ba
周颖,倪敏。SHB1在光周期和自主开花中的双重作用。Dev杂志。2009;331:50-7。GydF4y2Ba
- 16.GydF4y2Ba
周勇,赵学勇,康旭,张学森,倪敏GydF4y2BaMINISEED3GydF4y2Ba和GydF4y2BaHAIKU2GydF4y2Ba启动子GydF4y2Ba在活的有机体内GydF4y2Ba规范GydF4y2Ba拟南芥GydF4y2Ba种子发展。植物细胞。2009; 21:1-12。GydF4y2Ba
- 17.GydF4y2Ba
Ribot C, Zimmerli C, Farmer E, Reymond P, Poirier yGydF4y2Ba拟南芥pho1; h10GydF4y2Ba通过12-氧代 - 植物学的基因,而不是通过冠状素内敏感的1依赖性途径而不是茉莉酸。植物理性。2008; 147:696-706。GydF4y2Ba
- 18.GydF4y2Ba
Zimmerli C,Rizot C,Vavasseur A,Bauer H,Hedrich R,Poirier Y.GydF4y2BaPho1.GydF4y2Ba保护细胞中的表达介导对脱钙酸的气孔反应GydF4y2Ba拟南芥GydF4y2Ba.植物j . 2012; 72:199 - 211。GydF4y2Ba
- 19.GydF4y2Ba
Sairam RK,Tyagi A.植物中盐度胁迫耐受性的生理学和分子生物学。Curr SCI。2004; 86:407-21。GydF4y2Ba
- 20。GydF4y2Ba
植物耐盐机理研究。植物学报2008;59:651-81。GydF4y2Ba
- 21。GydF4y2Ba
朱杰克。盐胁迫下离子稳态的调节。CurrOp植物BIOL。2003; 6:441-5。GydF4y2Ba
- 22。GydF4y2Ba
Quan Rd,Lin HX,Mendoza I,Zhang Yg,Cao Wh,Yang YQ等。SCABP8 / CBL10,推定的钙传感器,与蛋白激酶SOS2相互作用以保护GydF4y2Ba拟南芥GydF4y2Ba生长于盐胁迫。植物细胞。2007;19:1415-31。GydF4y2Ba
- 23。GydF4y2Ba
等。1-吡咯-5-羧酸合成酶基因的诱导与脯氨酸积累的关系GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba在渗透压下。工厂J. 1995; 7:751-60。GydF4y2Ba
- 24。GydF4y2Ba
E, Cséplo A, Rigó G, Zsigmond L, Csiszár J,等。复制GydF4y2BaP5CS.GydF4y2Ba基因的GydF4y2Ba拟南芥GydF4y2Ba在脯氨酸生物合成的胁迫调控和发育调控方面发挥着独特的作用。植物j . 2008; 53:11-28。GydF4y2Ba
- 25.GydF4y2Ba
熊,李B,Ishitani M,Lee H,张C,朱JK。GydF4y2BaFIERY1GydF4y2Ba编码肌醇多磷酸三磷酸酶是脱落酸和应力信号的负调节剂GydF4y2Ba拟南芥GydF4y2Ba.基因Dev。2001;15:1971 - 84。GydF4y2Ba
- 26.GydF4y2Ba
施Ht,刘,姚y,魏yx,陈泽。GydF4y2Ba醇脱氢酶1GydF4y2Ba(GydF4y2BaADH1GydF4y2Ba)赋予非生物和生物应激抗性GydF4y2Ba拟南芥GydF4y2Ba.植物SCI。2017; 262:24-31。GydF4y2Ba
- 27.GydF4y2Ba
史清,李·鲍,吴SJ,朱杰克。血浆膜Na的过度表达GydF4y2Ba+GydF4y2Ba/小时GydF4y2Ba+GydF4y2Ba反转运体基因改善耐盐性GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba.NAT BIOTECHNOL。2003; 21:81-5。GydF4y2Ba
- 28.GydF4y2Ba
Hyten DL,Song QJ,Zhu Yl,Choi Iy,Nelson RL,Costa JM等。遗传瓶颈对大豆基因组多样性的影响。Proc Natl Acad Sci U S A. 2006; 103:16666-71。GydF4y2Ba
- 29。GydF4y2Ba
李加,克劳福德GW,刘林,佐佐木Y,陈XX。考古大豆(GydF4y2Ba甘氨酸最大GydF4y2Ba)在东亚:规模重要吗?《公共科学图书馆•综合》。2011;6:e26720。GydF4y2Ba
- 30。GydF4y2Ba
马海英,杨海英,梁志伟,黄文敏。10年管理制度对盐碱草地土壤种子库的影响《公共科学图书馆•综合》。2015;10:e0122319。GydF4y2Ba
- 31。GydF4y2Ba
王德,香农MC。盐度下大豆品种和成熟群的出苗和幼苗生长。植物土壤。1999年; 214:117-24。GydF4y2Ba
- 32。GydF4y2Ba
徐德,做了大豆和大豆盐水和殖民耐受性的遗传研究。品种sci。2012; 61:559-65。GydF4y2Ba
- 33。GydF4y2Ba
常瑞忠,陈永文,邵光华,万志伟。盐对大豆种子农艺性状和化学品质的影响。大豆科学。1994;13:101-5。GydF4y2Ba
- 34.GydF4y2Ba
Do TD,Chen H,Hien Vt,Hamwieh A,Yamada T,Sato T等人。GydF4y2BaNclGydF4y2Ba同步调节钠GydF4y2Ba+GydF4y2BaKGydF4y2Ba+GydF4y2Ba, clGydF4y2Ba-GydF4y2Ba在大豆中,大大提高了盐水场条件下的谷物产量。SCI REP。2016; 6:19147。GydF4y2Ba
- 35.GydF4y2Ba
林基jp,朗格km。农业新的根源:利用根本。Philos T R SoC B. 2012; 367:1598-604。GydF4y2Ba
- 36.GydF4y2Ba
杨杰,王ZG,周j,江嗯,张俊,潘p等。低P土壤中无机磷分馏及其转运动态。J环境放射性。2012; 112:64-9。GydF4y2Ba
- 37.GydF4y2Ba
何静,金勇,杜玉玲,王涛,Turner NC,杨立峰,等。大豆产量、产量构成因素、根系形态和构型与水分和磷供应关系的基因型变异植物学报2017;8:1499。GydF4y2Ba
- 38.GydF4y2Ba
Tuyen DD,Lal Sk,徐德。鉴定野生大豆的主要QTL等位基因(GydF4y2Ba甘氨酸大豆GydF4y2Ba摘要。&Zucc。)用于提高大豆碱性耐盐性。Al Appl Genet。2010; 121:229-36。GydF4y2Ba
- 39.GydF4y2Ba
Hamwieh A,Tuyen Dd,Cong H,Benitez Er,Takahashi R,徐DH。大豆耐盐耐盐性QTL的鉴定。Euphytica。2011; 170:451-9。GydF4y2Ba
- 40.GydF4y2Ba
关键词:磷酸转运蛋白,功能特性,表达量性状,基因座GydF4y2BaGmPT1GydF4y2Ba在大豆。植物细胞环境。2014; 37:462-72。GydF4y2Ba
- 41.GydF4y2Ba
张达,李海,王继,张清,胡泽,楚ss等。高密度遗传造影识别大豆中低磷胁迫的新主要基因座。前植物SCI。2016; 7:372。GydF4y2Ba
- 42.GydF4y2Ba
蔡志东,程彦波,冼培强,马庆波,温凯,夏庆军,等。酸性磷酸酶基因GydF4y2BaGmHAD1GydF4y2Ba通过精细定位与大豆耐低磷有关。Theor Appl Genet. 2018; 131:1715-28。GydF4y2Ba
- 43。GydF4y2Ba
李FS。野生大豆中国资源生态地理分布研究。SCI AGR SIN。1993年; 26:47-55。GydF4y2Ba
- 44。GydF4y2Ba
温ZX,丁YL,赵TJ,盖JY。遗传多样性和年野生大豆的特殊性(GydF4y2BaG. Soja.GydF4y2Ba摘要。(Et Zucc.)来自中国各生态区。Theor Appl Genet. 2009; 119:371-81。GydF4y2Ba
- 45。GydF4y2Ba
他ll,赵m,王y,gai Jy,他是我的。植物的系统发育,结构演化和功能多样化GydF4y2Ba磷酸盐1GydF4y2Ba基因家族:一个关注GydF4y2Ba甘氨酸最大GydF4y2Ba.BMC Evol Biol. 2013;13:103。GydF4y2Ba
- 46。GydF4y2Ba
关锐,曲勇,郭勇,于磊,刘勇,姜建军,等。大豆的耐盐性是由大豆的自然变异所调节的GydF4y2BaGMSALT3.GydF4y2Ba.植物j . 2014; 80:937-50。GydF4y2Ba
- 47。GydF4y2Ba
齐X,Li MW,谢米,刘X,Ni M,Shao G等。全基因组测序鉴定野生大豆中新型盐耐受基因。NAT Communce。2014; 5:4340。GydF4y2Ba
- 48。GydF4y2Ba
叶青,王浩,苏涛,吴文辉,陈玉峰。泛素E3连接酶PRU1通过调控WRKY6的降解来调节磷酸盐在低磷胁迫下的稳态GydF4y2Ba拟南芥GydF4y2Ba.植物细胞。2018;30:1062 - 76。GydF4y2Ba
- 49.GydF4y2Ba
周晓军,查先生,黄杰,李玲,Imran M,张昌成。StMYB44通过抑制的表达负调控磷酸转运GydF4y2Ba磷酸盐1GydF4y2Ba在土豆。J Exp Bot. 2017; 68:1265-81。GydF4y2Ba
- 50。GydF4y2Ba
刘建军,刘建军,刘建军,等。GydF4y2BaFW2.2GydF4y2Ba:是影响番茄果实大小进化的一个数量性状位点。科学。2000;289:85-8。GydF4y2Ba
- 51。GydF4y2Ba
Konishi S,Izawa T,Lin Sy,Ebana K,Fukuta Y,Sasaki T等人。SNP在米驯化期间引起了种子破碎的损失。科学。2006; 312:1392-6。GydF4y2Ba
- 52。GydF4y2Ba
田泽,王XB,李河,李毅,杰尔,纳尔逊rl等。用于确定大豆生长习性的人工选择。Proc Natl Acad Sci U S A. 2010; 107:8563-8。GydF4y2Ba
- 53。GydF4y2Ba
Tsiantis m.a转座子GydF4y2BaTB1.GydF4y2Ba把玉米驯化。Nat麝猫。2011;43:1048-50。GydF4y2Ba
- 54。GydF4y2Ba
温德尔JF。大丰收:作物驯化表型的基因组研究。植物生物学杂志。2013;64:47-70。GydF4y2Ba
- 55。GydF4y2Ba
Sun LJ,苗族,蔡厘米,张DJ,赵MX,吴益等。GydF4y2BaGmHs1-1GydF4y2Ba,编码钙调磷酸酶样蛋白,控制大豆的硬籽性。Nat麝猫。2015;47:939-43。GydF4y2Ba
- 56。GydF4y2Ba
赵敏,顾永忠,何丽丽,陈青松,何春云。基因序列和表达变异提示基因的适应作用GydF4y2BaDA1GydF4y2Ba- 在大豆的演变中,般的基因家族。BMC植物BIOL。2015; 15:120。GydF4y2Ba
- 57。GydF4y2Ba
高洪辉,王勇,李伟,顾永忠,赖永昌,毕亚东,等。转录组比较揭示了大豆种子发育进化的潜在遗传变异。J Exp Bot. 2018; 69:5089-104。GydF4y2Ba
- 58.GydF4y2Ba
花浸法:农杆菌介导的植物转化的一种简便方法GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba.植物j . 1998; 16:735-43。GydF4y2Ba
- 59.GydF4y2Ba
López-Bucio J, Hernández-Abreu E, Sánchez-Calderón L, Nieto-Jacobo MF, Simpson J, Herrera-Estrella LGydF4y2Ba拟南芥GydF4y2Ba根系系统。植物理性。2002; 129:244-56。GydF4y2Ba
- 60。GydF4y2Ba
阿诺迪。铜酶在分离的叶绿体中,多酚氧基酶GydF4y2BaBeta寻常魅力GydF4y2Ba.植物理性。1949年; 24:1-15。GydF4y2Ba
- 61。GydF4y2Ba
田ura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. MEGA5:利用最大似然、进化距离和最大简约法的分子进化遗传学分析。生物化学学报2011;28:2731-9。GydF4y2Ba
- 62。GydF4y2Ba
非同义多态性对功能的影响。核酸Res. 2007; 35:3823-35。GydF4y2Ba
- 63.GydF4y2Ba
陈安平。氨基酸取代和吲哚的功能效应的预测。《公共科学图书馆•综合》。2012;7:e46688。GydF4y2Ba
确认GydF4y2Ba
我们欣赏Yongcai Lai教授提供大豆种子。我们非常感谢匿名评论者进行修改稿件的建设性评论和建议。GydF4y2Ba
资金GydF4y2Ba
国家自然科学基金项目(no . 31525003);中国科学院环发基金项目(no . ZDRW-ZS-2019-2, no . XDA08010105)。关键词:边坡,边坡稳定性,边坡稳定性资助方不参与研究的设计、数据的收集、分析和解释以及手稿的撰写。GydF4y2Ba
作者信息GydF4y2Ba
隶属关系GydF4y2Ba
贡献GydF4y2Ba
Cyh设计了研究并构思了实验。YW,HHG和LLH分离序列和研究基因表达。LXY参与大豆中的应力处理和基因表达。llh生成转基因GydF4y2Ba拟南芥GydF4y2Ba线条。YW,HHG和WWZ参与表征转基因GydF4y2Ba拟南芥GydF4y2Ba.YW、HHG、WWZ、LXY、QSC、CYH分析数据。YW和CYH起草了手稿。所有作者阅读并批准了手稿。中华健同意作为作者负责联系并保证沟通。GydF4y2Ba
通讯作者GydF4y2Ba
道德声明GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
不适用。GydF4y2Ba
同意出版物GydF4y2Ba
不适用。GydF4y2Ba
利益争夺GydF4y2Ba
两位作者宣称他们没有相互竞争的利益。GydF4y2Ba
额外的信息GydF4y2Ba
出版商的注意事项GydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。GydF4y2Ba
附加文件GydF4y2Ba
附加文件1:GydF4y2Ba
图S1GydF4y2Ba.没有记录的GydF4y2Bapho1; h11GydF4y2Ba和GydF4y2BaPHO1; H13GydF4y2Ba在大豆中被检测到。GydF4y2Ba图S2GydF4y2Ba.大豆和大豆家族的系统发育分析GydF4y2Ba拟南芥GydF4y2Ba.GydF4y2Ba图S3GydF4y2Ba.特定器官特异性表达GydF4y2BaPho1.GydF4y2BaZyd6和SN14中的基因家庭。GydF4y2Ba图S4GydF4y2Ba.特定器官特异性表达GydF4y2BaPho1.GydF4y2Ba各种大豆之间的基因。GydF4y2Ba图S5GydF4y2Ba.分子的验证GydF4y2Bagmpho1.GydF4y2Ba转基因GydF4y2Ba拟南芥GydF4y2Ba植物。GydF4y2Ba图S6GydF4y2Ba.盐的宽容GydF4y2Bagmpho1.GydF4y2Ba转基因GydF4y2Ba拟南芥GydF4y2Ba.GydF4y2Ba图S7GydF4y2Ba.转基因植物根系发育GydF4y2Ba拟南芥GydF4y2Ba在Pi缺乏条件下。GydF4y2Ba图S8GydF4y2Ba.不同盐胁迫下大豆幼苗的表型。GydF4y2Ba图S9GydF4y2Ba.缺磷大豆幼苗的表型研究。GydF4y2Ba图S10GydF4y2Ba.PHT1;4-like蛋白的NJ树GydF4y2Ba拟南芥GydF4y2Ba.(PDF 940 KB)GydF4y2Ba
附加文件2:GydF4y2Ba
表S1。GydF4y2BaGsPHO1和GmPHO1蛋白的序列特征。GydF4y2Ba表S2。GydF4y2BaGSPHO1和GMPHO1蛋白的变化。GydF4y2Ba表S3。GydF4y2Ba表型GydF4y2Bagmpho1.GydF4y2Ba转基因植物在GydF4y2Ba拟南芥GydF4y2Ba.GydF4y2Ba表S4。GydF4y2Ba研究了转基因植株在1/ 2ms不同NaCl浓度下的发芽率。GydF4y2Ba表S5。GydF4y2BamRNA积累GydF4y2BaPho1.GydF4y2Ba在不同应力下SN14和ZYD6的根中的基因。GydF4y2Ba表S6。GydF4y2Ba的变化模式GydF4y2BaPho1.GydF4y2Ba基因响应SN14和ZYD6中的应力。GydF4y2Ba表S7。GydF4y2Ba在本作工作中使用的引物。(PDF 535 KB)GydF4y2Ba
权利和权限GydF4y2Ba
开放获取GydF4y2Ba本文根据创意公约署署署的条款分发了4.0国际许可证(GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)除非另有说明,否则适用于本文中提供的数据。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
王,Y.,高,H.,他,L.GydF4y2Ba等等。GydF4y2Ba的GydF4y2Ba磷酸盐1GydF4y2Ba基因参与盐和PI信号传导途径,并在大豆进化过程中起适应性作用。GydF4y2BaBMC植物杂志GydF4y2Ba19,GydF4y2Ba353(2019)。https://doi.org/10.1186/s12870-019-1959-8GydF4y2Ba
已收到GydF4y2Ba:GydF4y2Ba
接受GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
DOIGydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-019-1959-8GydF4y2Ba
关键词GydF4y2Ba
- 非生物胁迫GydF4y2Ba
- 自适应演化GydF4y2Ba
- 功能多样化GydF4y2Ba
- 基因表达GydF4y2Ba
- 直言基因GydF4y2Ba
- Pho1.GydF4y2Ba基因家族GydF4y2Ba
- 大豆GydF4y2Ba