摘要
背景
花青素的合成受多种因素的影响,其中温度是一个重要的环境因素。在中国上海,茄子在种植季节通常暴露在高温下。因此,我们采用RNA -seq分析方法来确定高温胁迫对茄子花青素生物合成途径中基因表达的影响(茄属植物melongenaL.)。
结果
我们对耐热品种“特旺达”进行了试验。将植株分别在38℃和45℃下孵育,以适宜茄子生长的温度作为对照。治疗时间分别为3 h和6 h。取茄子皮进行转录组测序、qRT-PCR分析和生物信息学分析。结果表明,770个基因在不同处理间有差异表达。基因本体(GO)数据库和京都基因基因组百科全书(KEGG)数据库分析鉴定出16个与花青素合成相关的基因,其中CHSB基因表达上调。其他基因BHLH62、MYB380、CHI3、CHI、CCOAOMT、AN3、ACT-2、HST、5MA-T1、CYP75A2、ANT17、RT、PAL2和花青素5-芳香酰基转移酶均下调。此外,Myb转录因子家族PHL11调节在CK 3 h vs 45°C 3 h, CK 3 h vs 38°C 3 h, h和CK 6 vs 38°C 6 h比较,和转录因子bHLH35调节CK 3 h vs 38°C 3 h和CK 6 h vs 38°C 6 h比较。
结论
这些结果表明高温会下调茄子花青素生物合成途径中的大部分基因。该数据对茄子的耐热机理有参考价值,也可为茄子花青素含量耐热种质的分子育种提供指导。
背景
花青素属于植物次生代谢产生的类黄酮。一种酚类化合物,它能决定花、水果和种子的颜色[1].这些化合物的合成途径是苯基丙烷生物合成途径的分支[2]这些化合物由三个芳香环组成,根据植物种类的不同,可以有不同构型的羟基、糖、酰基和甲基取代[3.].花青素生物合成途径需要两种基因:一种是结构基因,直接参与酶的形成;另一种是调控基因,调控酶基因的表达[4].花青素对植物和人体都有好处。近年来研究发现,花青素最重要的生理功能是抗氧化功能。在对茄子样品的分析中,我们发现,花青素含量较少的绿皮茄子比紫皮茄子更容易氧化发黑。这些代谢物在植物中广泛存在,并具有重要的作用,同时也是决定花色和果色的主要物质。因为花青素导致植物颜色,这是水果成熟的信号,它们是昆虫和动物的引诱剂[4]可以吸引传播植物种子的动物。花青素还能保护叶片的光合系统免受损害[5].这些化合物在植物抗逆性方面起着积极的作用。花青素可能在植物的生长发育中起到间接的作用,当植物暴露于环境胁迫时,花青素作为活性氧信号的调节因子[6].花青素被称为天然着色剂,具有抗氧化、抗菌和抗癌作用;因此,它们被广泛应用于食品和制药行业[7,8].花青素可以减少A2E积累对RPE的不良影响,从而保护视力[9]这些代谢物还可以通过减少脂肪组织来降低肥胖程度[10].
由于这些功能,花青素引起了许多研究者的注意,他们研究了与花青素生物合成相关的基因,从而阐明了它们的生物合成过程,这些数据可能对农业和医学有价值。
随着研究的不断深入,花青素苷的合成途径已被阐明。
苯丙氨酸是花青素生物合成的前体,其被苯丙氨酸氨 - 裂解酶(PAL)脱键,形成胰腈酸,即肉桂酸4-羟化酶(C4H)的基材。发生香豆酸的形成,并产生木质素的分支。香豆素酸辅酶A由4-香豆酰基:Co一个连接酶(4Cl)制备。在第二阶段,通过Chalcone合成酶(CHS)形成一种香豆酸和三个丙基-CoA分子,然后通过Chalcone异构酶(Chi)催化Chalcone催化至黄烷酮柚皮素。
柚皮素被黄酮3-羟化酶(F3H)羟化,产生二氢黄酮醇。下一步是二氢黄酮醇-4还原酶(DFR)生产无色花青素,花青素合成酶/白花青素双加氧酶(ANS/LDOX)催化形成彩色花青素。此时形成的花青素是不稳定的,必须经过一系列的甲基化、糖基化和酰化反应才能形成稳定的花青素。稳定的花青素通过谷胱甘肽转移酶(GST)转运到液泡。以上是花青素合成的一般过程[11].木质素将与花青素竞争相同的前体[12].阐明花青素合成过程,鉴定参与花青素合成过程的基因,将有助于进一步的实验和分析。
在花青素生物合成过程中,不仅结构基因,还有一些调控转录因子都起着非常重要的作用,这些基因包括MYB、bHLH、W40和WRKY,转录因子R2R3MYB和bHLH共同与WD40形成复合物,调控结构基因的表达[13].
研究人员研究了不同植物中参与花青素生物合成的转录因子。在红苹果中,WRKY家族转录因子MdWRKY11的过度表达促进了F3H、DFR、ANS和UFGT的表达,从而增加了苹果中花青素的积累[14].研究人员对红紫菠菜进行了转录组分析,发现红紫菠菜中两个MYB基因、三个bHLH基因和一个WD40基因显著上调[15]GmMYB10转录因子在山竹成熟过程中花色苷的合成中起着重要作用[16].在属植物中茄属中的CAPRICE(MYB)和GLABRA3(bHLH)基因拟南芥对番茄进行了评估;结果表明,CAPRICE抑制花青素的积累,而GLABRA3促进花青素的积累,这是受关键基因调控的。这些酶进一步调节花青素的合成[17]转录因子SmMYB1在紫茄子花青素生物合成中起着积极的调节作用[18].
温度是影响花青素合成的一个重要因素。因此,我们希望探索高温条件下参与花青素合成的基因的表达变化。因此,我们检查了以前发表的研究。热处理后,桃叶片中参与花青素生物合成的基因表达量显著降低,导致花青素积累减少[19]高温抑制了花青素的合成和运输,导致红色猕猴桃的着色不良和质量下降[20].在杂交百合中,高温抑制LhMYB12、CHS、F3H和DFR的转录,表达降低[21].高温影响花青素的机制不仅是关键基因的表达减少,而且还抑制了COP1和花青素生长调节剂(HY5),以及COP1-HY5信号模块在高温环境下抑制花青素[22]高温可能会影响浆果中ABA的表达水平,进而影响参与花青素合成的酶的表达[23].高温影响了浆果UFGT的活性,降低了苯丙氨酸的浓度,从而减少了花青素的积累[24].
紫茄子是一种稀有蔬菜,花青素含量高。它在育种研究和提取利用方面都有很大的潜力。然而,与模型植物相比,例如拟南芥目前,对茄子花青素生物合成的研究严重滞后,甚至不及同属番茄和马铃薯 摄氏度40度 夏季摄氏度,这意味着室内生长的茄子必须面对更高的温度。然而,当茄子暴露在高温胁迫下,与花青素合成相关的基因表达水平将如何变化?目前,研究很少。本研究以茄子品种“Twanda”为实验材料高温处理后,取茄子皮进行转录组分析,鉴定了高温胁迫下参与花青素生物合成的一些差异表达基因,包括调控基因和结构基因,并用实时定量PCR对筛选出的基因进行了验证,结果表明从而了解茄子花色素苷生物合成对高温胁迫的响应机制,为进一步研究茄子耐热机理提供有价值的数据。
结果
高温降低了花青素的积累
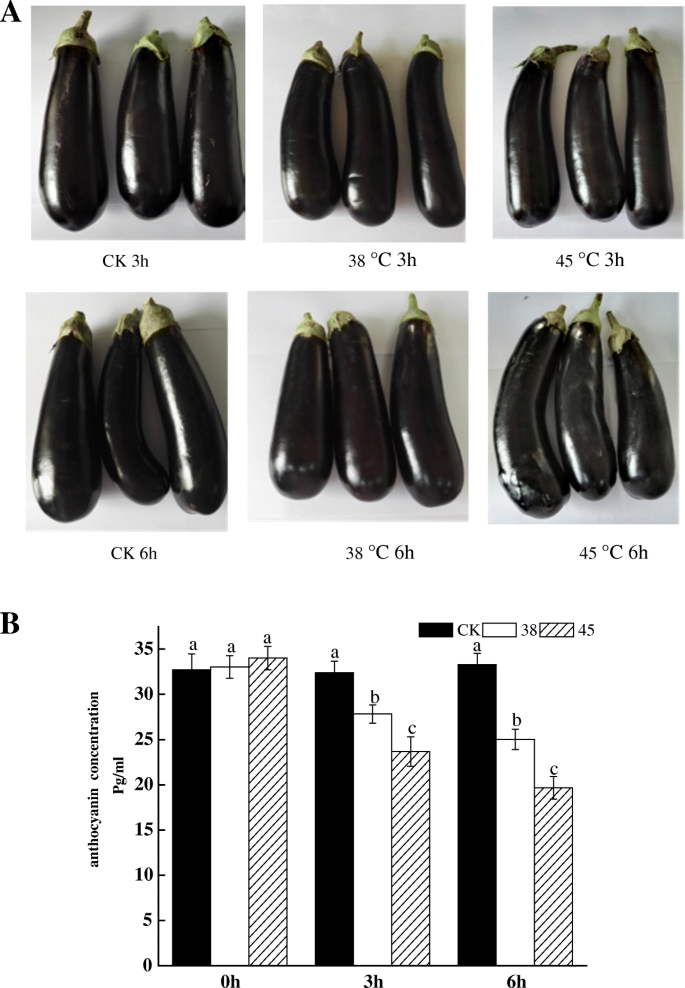
为了更直观地观察高温对花青素浓度的影响,我们进行了9个处理,即CK 0 h、 三十八 摄氏度0 h、 45 摄氏度0 h、 CK3h,38 摄氏度3 h、 45 摄氏度3 h、 CK 6 h、 三十八 摄氏度6 h、 45°C6 h、 从无花果。1a、 短期高温处理对花色素苷的影响在外观上不是很明显,但是我们仍然可以看到茄子会脱水收缩,因此我们进行了花色素苷浓度的测定,如图所示。1b.结果表明,enck 0 h、38℃0 h和45℃0 h间花青素含量无显著差异。随着温度的升高和时间的延长,花青素浓度呈下降趋势。不同处理温度和同一处理时间之间存在显著差异。这些数据表明,花青素确实受到高温的影响,浓度降低。
差异表达基因分析
这些干净的基因被定位到茄子的参考基因组(http://eggplant.kazusa.or.jp/) [25,如所述使用hisat2软件[26].如附加文件1表S1所示.大多数的阅读被映射到参考基因组。在18个样本中,能够映射到基因组的“干净解读”的百分比都超过了85%。每个实验组的参考序列上的比对位置较少,大部分读只映射到一个唯一的位置。左链读、右链读、正链读和负链读的比例在41%到43%之间。在45℃下映射到两个外显子的拼接reads的数量大于其他两组温度,而映射到整个片段的未拼接reads的数量小于其他两组温度。在适当的配对中映射的读的数量大多在70%到80%之间。然后利用这些图谱分析基因表达在不同的比较。(附加文件1:表S1)。
在分析了6个处理组的基因表达后,比较了相同处理时间和不同处理温度的处理组,初步探讨了高温对基因表达的影响,进而分析了高温对花青素生物合成基因的影响。
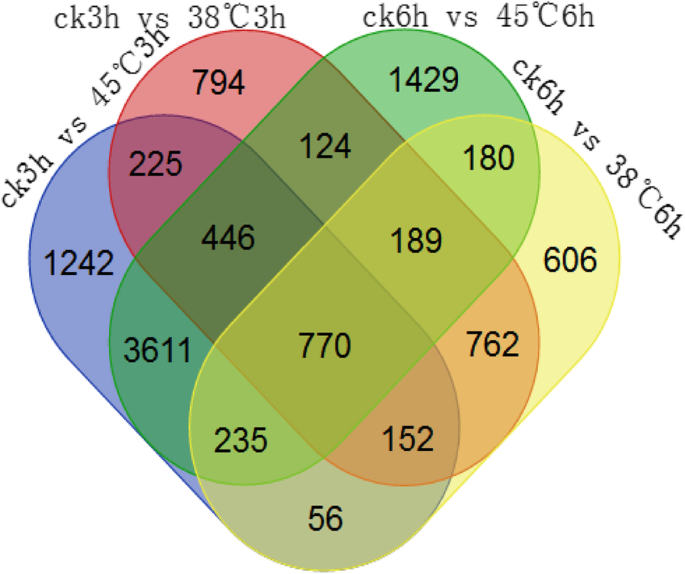
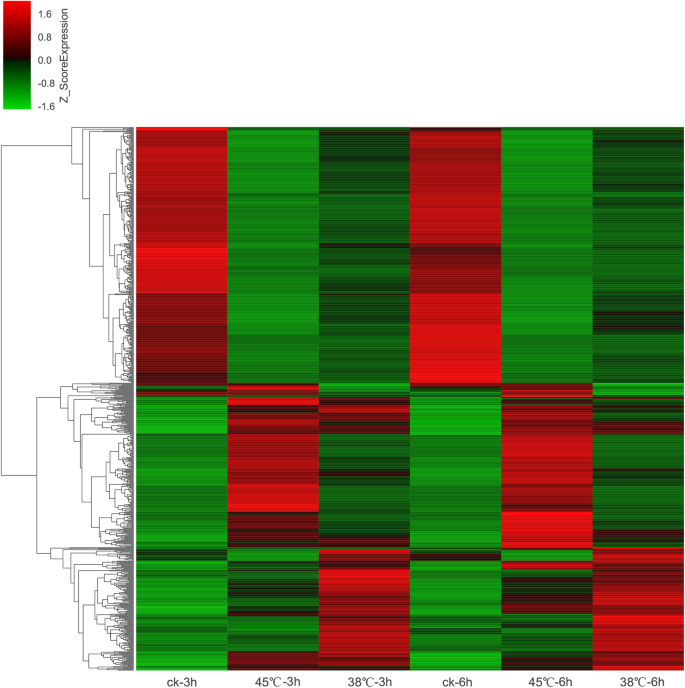
在分析同一基因在两个样本中表达的差异时,我们采用了两个参数:一个是fold change,该因子反映了同一基因在不同样本中的差异倍数;另一个是p价值。差异表达基因的标准是p-value< 0.05且差异乘数大于2。fold change和p-value数据显示,有3462个差异表达基因,其中1742个基因表达上调,1720个基因表达下调。对比CK 3 h处理和45℃3 h处理,发现差异表达基因6737个,其中3334个上调,3403个下调。在较长时间的高温处理下,结果显示有2950个差异表达基因,其中CK 6 h和38℃6 h处理下有1272个基因表达上调,1678个基因表达下调。与其他比较组相比,CK 6 h治疗和45°C 6 h treatmenthad最多的差异表达基因,分析表明,共有6984个差异基因,基因差异的数量是3466年,下调基因的数量是3518。维恩图显示,在上述4个比较组中共鉴定出770个共同的差异表达基因(图1)。2)然后制作热图,更清楚地显示差异表达基因的表达模式(图。3.).结果表明,在相同温度下3 ~ 6 h,这些基因的表达模式基本一致。从图上半部分可以看出,38℃和45℃高温应力的表达模式与对照相反。在图的下半部分,38°C和45°C高温胁迫导致部分基因较对照高表达,进一步说明38°C和45°C处理下部分基因表达模式相反。
差异表达基因功能富集分析
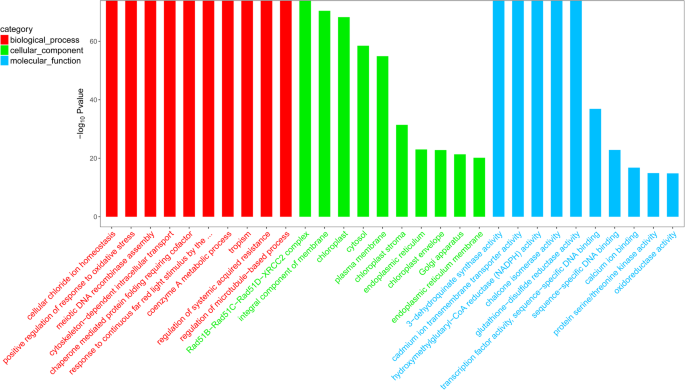
为了了解差异表达基因的功能,进行了GO和KEGG pathyway分析。在比较上述四组后,我们发现CK 6 h和45 摄氏度6 h组最显著,差异表达基因的数量大于其他组。在对照组中,进行GO功能富集分析(图。4).在生物过程中,我们可以注意到。
分子功能列项均明显富集。在细胞组分中,“Rad51B-Rad51C-Rad51D-XRCC2 complex”显著富集,其后的4个项目也富集差异表达基因。在分子功能方面,前5项显著富集。
鉴定出一条与花青素合成相关的途径,即“查尔酮异构酶活性”。查尔酮异构酶是花青素生物合成途径中的关键酶。这种酶可以将四种羟查尔酮转化为柚皮素。
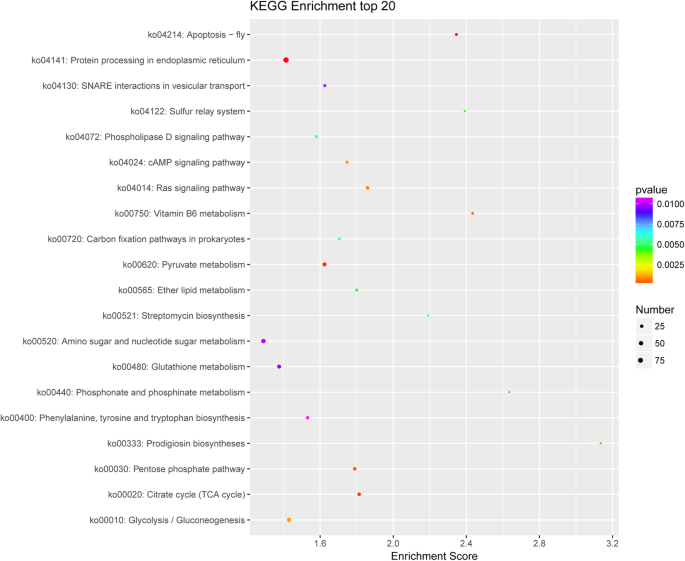
为了明确不同样本中可能富集的差异表达基因,我们采用KEGG通路分析的方法进行探索。图中列出了前20种途径的筛选条件。5是大于2的listhits,它们根据-log10Pvalue从大到小排列。差异表达基因主要富集于“内质网蛋白加工”、“yruvate代谢”、“112氨基糖和核苷酸糖代谢”、“谷胱甘肽代谢”和“糖酵解/糖异生”。
花青素生物合成相关差异表达基因分析
我们在CK3中鉴定了770个差异表达基因 h比45 摄氏度3 h、 肌酸激酶3 h比38 摄氏度3 h、 CK 6 h比45 摄氏度6 h和CK 6 h比38 摄氏度6 h通过维恩图进行比较(图。2).我们从这770个基因中寻找与花青素合成相关的基因,这些基因主要是关键结构酶基因和转录因子。我们鉴定的基因如表所示1. 这些基因大部分被下调。此外,我们还发现了两个特殊的基因。这两个基因是Sme2.5_01944.1_g00011.1,在CK 3中上调 h比45 摄氏度3 h、 Ck 6 h比45 摄氏度6 h、 和CK 6 h比38 摄氏度6 h和CK-3表达无差异 h比38 摄氏度3 h、 Sme2.5_10927.1_g00004.1,在CK 3中上调 h比45 摄氏度3 h、 肌酸激酶3 h比38 摄氏度3 h、 和CK 6 h比38 摄氏度6 h和CK-6之间没有表达差异 h和45 摄氏度6 H
与热休克蛋白和热休克因子相关的差异表达基因分析
结果表明,在CK 6 h vs 45℃6 h中,鉴定出65个与Hsps和Hsfs相关的deg,比其他组多,但在45℃3 h vs 45℃6 h中仅鉴定出3个相关基因。在CK 3h与45°C 3h、CK 3h与38°C 3h、CK 6h与45°C 6h、CK 6h与38°C 6h比较中,我们发现24个Hsps基因和4个Hsfs基因有差异表达。Hsp21、Hsp23、Hsp70、Hsp90-5、Hsp18.2、Hsp17.9A、Hsp101、Hsp15.7、Hsp98.7、Hsp90-6、Hsp22.7、Hsp90-1、Hsp18.2、Hsp26.5、Hsp70 - 8、Hsp18.2、Hsp17.5-E、Hsp83A、Hsp18.1、Hsp70 - 7、Hsp18.1、HsfA3、HsfA2B、HsfA4A和HsfA4C。这些基因都是上调的。
Q RT-PCR验证与花青素生物合成相关的差异表达基因
为了确定我们筛选出的17个基因的表达情况,我们进行了定量PCR。引物设计清单见附加文件1:表1。我们确定了如附加文件4中所示的定量结果4:5.大多数结果与转录组分析一致,证明了转录组结果的可靠性(附加文件3.:图S1)。
讨论
花青素对人体有很多好处[27,28,29]和植物[30]因此,对富含花青素的园艺植物进行了大量的研究。茄子的紫色果皮富含花青素[31,这让我们想要学习。温度是影响花青素含量的重要环境因素。研究表明低温促进花青素的积累[32,33],高温会降低花青素合成过程中的基因表达[34,35]在我们的研究中,从上述四组差异表达基因的结果来看,Sme2.5_00283.1_g00002.1的表达在高温条件下被发现上调,表明该基因在高温环境中对黄酮类化合物的合成起到积极的调节作用。该基因被注释为查尔酮合酶B,在GO分析中作为柚皮素查尔酮合酶在类黄酮生物合成过程中发挥作用。与KEGG相关的途径是黄酮类化合物的生物合成。查尔酮合酶在黄酮类化合物和其他次生代谢产物的合成中起着非常重要的作用。这种酶在类黄酮代谢的第二阶段非常活跃,这是合成花青素的关键时期。查耳酮合酶催化一分子香豆酸和三分子丙二酰辅酶A合成四羟基查耳酮,然后通过查耳酮异构酶将其转化为柚皮素[11].
CHSB属于CHS基因家族,CHS基因可被环境刺激诱导,如环境因子的变化和各种理化因子的变化,可以用来探索植物与环境的相互作用[36].过表达CHS基因可以合成更多的花青素,增强植物在强光下的抗氧化能力和抗性拟南芥[37].CHS基因在植物抗逆性方面表现出强烈的响应,使植物增强对不利环境条件的耐受性。低温增加了葡萄柚中CHS基因的表达[38]Chunthabur等人[39]结果表明,CHS基因在盐胁迫下的表达增加,表明花青素的积累有助于植物抵御盐胁迫。在我们的研究中,与对照相比,高温胁迫下茄子中查尔酮合成酶B(Sme2.5_00283.1_g00002.1)表现出高表达。在38岁时,双端阅读中的基因计数接近对照的3倍 °C,并且在更极端的45℃高温下 °C时,表达水平仍高于对照组,这表明当植物面临胁迫时,该基因会增加,从而减少环境变化对植物造成的损害。
转录因子是RNA聚合酶催化DNA转录为RNA所必需的辅因子。MYB转录因子在植物代谢调控中起着重要作用。这些基因在植物抵抗非生物胁迫方面具有重要作用[40].在模型工厂拟南芥, MYB转录因子参与调控类黄酮代谢途径、花青素生物合成等次级代谢途径[41].不同的MYB转录因子对花青素合成显示不同的调节作用。一些研究人员发现,在拟南芥R3-Myb蛋白家庭中,在花青素的合成中发挥负调节作用[42].转录因子AtMYB75是这一过程的正调控因子[43].本实验转录组数据分析显示,Myb家族转录因子PHL11 (Sme2.5_10927.1_g00004.1)在38℃、38℃和45℃条件下分别上调3 h、6 h和3 h, 45℃条件下6 h无组上调。的区别。转录因子MYB380 (sme2.5 _00749.1 .1_g00006.1)表达下调。这两个基因的注释是转录调控,我们推测高温会导致同一家族中不同的转录因子做出不同的反应。
bHLH(basic-helix-loop-helix)转录因子与MYB相似,在植物抗逆性中起着重要的调控作用,该基因参与植物的抗旱、耐盐和耐寒性[44,45,46,b HLH122在抗干旱和渗透胁迫中发挥重要作用,因为b HLH122可以直接与CYP707A3启动子中的G-box/E-box顺式元件结合,抑制其表达[47].当茄子遭遇高温胁迫时,该家族的转录因子可以调控花青素的形成;转录组和中存在数据的条件下,这个实验表明,bHLH35 (Sme2.5_01944.1_g00011.1)是调节在38°C 3 h和38°C 6 h和表达下调45°C 3 h,表达并没有不同的45°C 6 h。这些发现表明该基因可以承受高温,但过高的温度会导致该基因的表达减少。转录因子bHLH62 (sme2.5 _00081.1 .1_g00022.1)表达下调。本实验结果表明,由于差异基因数据比较中未检测到WD40转录因子,“特王大”茄子果实可能在38℃和45℃的花青素合成途径中形成MYB-bHLH复合物。在上述数据中,我们发现了来自同一家族的3个正调控基因和一些负调控基因。数据分析表明,茄子果实在高温胁迫下,大部分参与花青素合成途径的基因都受到了负调控。这些基因在苯丙烷生物合成/类黄酮生物合成途径中富集,但它们的GO项不相同,因此,我们分析了两组数据。
一组包括类黄酮合成途径中的一些结构基因。Sme2.5_01638.1_g00005.1是一种无色花青素双加氧酶,又称花青素合成酶LDOX (ANS)。该基因参与花青素合成的后期。无色花青素在该酶的催化下形成各种彩色花青素[48].同源基因的描述拟南芥是含花青素化合物的生物合成过程,氧化还原过程,原花青素生物合成过程,对茉莉酸的反应,对伤害的反应,液泡组织。AT4G22880的同源基因拟南芥,在原花青素合成中起积极作用[49].最近有报道指出,葡萄在30-35℃时,白花青素双加氧酶的表达低于25℃[50].本实验结果表明,“特旺达”果实在高温胁迫下,该基因表达下调。
Sme2.5_00188.1_g00020.1的注释是查尔酮黄酮酮异构酶3,Sme2.5_01193.1_g00009.1是查尔酮黄酮酮异构酶。这些酶在类黄酮生物合成的早期步骤中起催化作用,与植物对环境的适应性和对胁迫的保护反应有关;此外,这些酶es在小麦中表现出复杂的调控[51].SME2.5_04313.1_G00001.1与黄酮类3',5'-羟化酶活性有关;该酶参与德尔芬蛋白途径,可催化二氢酰酚酚的二氢霉素的形成。肖等人。[52].克隆了彩色马铃薯F3’5’h基因的cDNA,同源关系与茄科相似。他们的实验证实,花青素的积累与F3 ' 5'H的表达呈正相关[52].高温条件下花青素的合成受到抑制。这一结果与之前的研究一致。Sme2.5_00015.1_g00020.1注释为柚皮素和2-氧戊二酸3-双加氧酶。柚皮素是花青素合成的第二阶段形成的类黄酮,在此之后形成各种花青素的一个分支。sme2.5 _29581.1 1_g00001.1与肉桂酸生物合成过程有关,肉桂酸是花青素合成的早期中间体,由苯丙氨酸脱胺形成;对苯丙氨酸解氨酶也有影响。由此可知,活性与花青素形成的初始阶段有关。
第二组包括与转移酶活性相关的氧化石墨烯通路。当花青素的6个前体合成时,第二阶段即一系列糖基化、甲基化、酰化反应发生,产物转化为稳定的花青素[53],经PAT和GST储存于液泡中。差异表达转移酶具有重要作用。许多学者对这种转移酶——花青素3- o -葡萄糖转移酶(UFGT)进行了研究。有报道称高温下UFGT的表达明显低于低温下[54].Sme2.5_06210.1_g00004.1注释为花青素3-O-葡萄糖基转移酶。研究证实,该基因是花粉特异性黄酮醇的末端修饰酶佩妮矮牵牛[55].当茄子果实暴露于高温胁迫时,基因被下调;然后,花青素合成减少,3GT的表达降低,这与先前研究的结果一致。SME2.5_04555.1_G00001.1作为Shikimate O-羟基氨基酰基酰基转移酶注释。这些酶参与了类黄酮合成途径。研究表明,随着温度的增加,该基因的表达将降低[56].sme2.5 _00461.1 .1_g00010.1注释为agmatine-coumaroyltransferase-2。Sme2.5_05988.1_g00001.1的GO项为细胞质、花青素5-芳香酰基转移酶活性、咖啡酰辅酶a:天皮苷-3,5-二葡萄糖苷和5- o -glucoside-6- o -羟基肉桂酸moyltransferase活性。Sme2.5_00029.1_g00004.1的GO项为caffeoyl-CoA O-methyltransferase活性。上述三个基因分别通过酰基化、甲基化和糖基化修饰花青素的碳骨架。
热休克蛋白(Heat shock proteins, HSPs)种类丰富,定位于线粒体、叶绿体和内质网,在非生物胁迫下可在短时间内表达[57,58].热休克蛋白可以帮助蛋白质的结构折叠,恢复正常的蛋白质构象,以维持细胞的稳定性[59].热休克蛋白按分子量可分为:Hsp100、Hsp90、Hsp70、Hsp60和小热休克蛋白(sHsps或Hsp20)。在我们的分析中,除了Hsp60家族的基因外,其他基因均未发现。从蚕豆中克隆的叶绿体Hsp100基因证实了叶绿体Hsp100基因的表达与蚕豆热胁迫相关[60].过表达HSP90可以维持植物细胞稳定性并改善植物耐热性[61]已有研究表明,辣椒耐热品种中Ca-Hsp70的表达呈上升趋势,可以提高辣椒的耐热性[62].cpshsp在番茄耐热性中起重要作用[63]在热休克转录因子的情况下,我们发现差异表达基因聚集在Hsf A家族中。在拟南芥和番茄中发现,Hsf A2在热激和恢复过程中可以持续积累,显著提高植物的耐热性[64].在番茄中,Le Hsf A4也是调控热应激基因表达的重要调控基因之一,但其活性可被Le Hsf A5特异性抑制[65].番茄slhsfa3在拟南芥可以显着提高植物耐热性[66].我们推测Hsps和Hsfs在高温胁迫中发挥了积极的作用,以减少高温胁迫对茄子的伤害。它们还可以提高表达水平,以帮助植物抵御生物和非生物胁迫。是否有助于减少高温胁迫对花青素生物合成过程的破坏是一个有趣的研究内容,值得进一步研究。
通过对转录组的分析可以看出,高温对花青素的产生影响较大,会使大部分基因表达下调,造成这种现象的原因可能是花青素生物合成的起始转录受到抑制,具体机制有待进一步研究。
结论
4组转录组分别在38℃和45℃处理茄子皮3 h和6 h的结果显示,45℃处理6 h的差异表达基因数为6934个,45℃处理3 h的差异表达基因数为6737个。38℃下3 h和6 h的差异表达基因分别为3462和2950个。结果表明,45℃对茄子皮的影响大于38℃。为了揭示茄子皮在一般高温条件下花青素合成相关基因的表达情况,进一步分析发现在所有4组中有770个基因存在差异表达。GO和KEGG途径分析鉴定出一些与茄子皮花青素合成相关的结构基因和调控基因,分析表明大部分基因表达下调。为后续相关研究提供了有价值的信息。此外,这些基因在高温下的具体调控机制还有待进一步研究。
方法
植物材料和高温处理
茄子品种“特旺达”是我们在上海农业科学院实验室培育的一个新品种。选取18株相同生育期的茄子,随机分为6组,每组3株。这些植物在生长培养箱(杭州泽达仪器有限公司,中国杭州)中生长,设置在27°C (CK), 38°C或45°C 3或6小时(一组植物/处理)。实验重复三次,处理后的植株立即进行组织取样。用水果刀从单个茄子果实上切下带有少量果肉组织的果皮。用三个水果代表一个处理,三个相同处理的果皮混合,在−80°C下保存直到使用。
花青素浓度的测定
0.1 g茄子皮样品在液氮中研磨,然后添加0.9 mL浓度为0.05的磷酸盐缓冲盐水 mol/L和PH 7.8。在1000×g条件下离心20分钟 4分钟 °C,取上清液进行下一步。花青素的浓度通过植物花青素ELISA试剂盒(江苏美棉实业有限公司,盐城,中国)测定。ELISA试剂盒的原理是双抗体夹心法。将纯化的植物花青素抗体置于微孔板中形成固相抗体。将样品作为抗原加入微孔板中。然后将辣根过氧化物结合第二抗体添加到微孔板中。抗原和酶标记的特异性抗体结合在固相复合物上,彻底清洗后去除未结合的抗原和酶标记的特异性抗体。添加基质TMB以显影颜色,然后50 μl/1 加入mol/L硫酸作为停止溶液,最终呈黄色。450时样品的OD值 用酶标仪检测nm。根据标准样品的OD值和浓度建立标准曲线。通过线性回归方程计算样品中花青素的浓度。
总RNA提取
使用mirVana分离总RNA™ 符合制造商协议的miRNA分离试剂盒(美国马萨诸塞州Thermo)。提取的总RNA储存在室温下− 70 °C。使用NanoDrop 2000(美国马萨诸塞州Thermo)分析总RNA样本的浓度和质量。单个样本的A260/280比值均在2以上。使用安捷伦2100系统(美国加利福尼亚州安捷伦)测定28S/18S比率和RIN值。
图书馆准备
Agencourt Ampure XP(Beckman Coulter,CA,USA)和Qubit RNA测定套件(Life Technologies,CA,USA)用于检测RNA的纯度和浓度。并且,我们评估了使用BioAnalyzer 2100 RNA-6000纳米的RNA的完整性使用Bioanalyzer 2100系统(Agilent Technologies,CA,USA).Truseq Stranded MRTNA Ltsample准备套件(Illumina,CA,USA)来构建测序库。
基因水平量化、差异表达基因分析(DEGs)、聚类分析、GO和KEGG富集
本研究中获得的原始读数按照说明使用NGS QC工具包进行处理[67],滤除低质量碱基和N个碱基后,收集干净读数。每个基因的FPKM值(每千碱基外显子模型的片段每百万标记reads)使用袖扣计算[68],每个基因的读计数由htseq-count获得[69].使用DESeq (2012) R包的estimateSizeFactors函数对数据进行归一化[70],并使用nbinomTest函数计算pvalue和foldchange值进行差异比较。P-价值观< 0.05和foldChange> 2或折叠更改< 将0.5作为显著差异表达的阈值。使用热图显示不同样品之间差异基因的表达模式。基于超几何分布,使用R分别对DEGs进行GO富集和KEGG途径富集分析[71].
定量实时PCR(q RT-PCR)分析
利用q - RT-PCR技术对筛选出的17个花青素合成相关基因的表达量进行分析。总RNA来源于用于转录组测序的剩余RNA。然后去除总RNA中的DNA。使用HiScript II Q RT SuperMix for qPCR (+gDNA wiper)反转录形成cDNA (Vazyme,南京,中国)。q RT-PCR反应体系使用QuantiFast®SYBR®Green PCR Kit (Qiagen,Duesseldorf,Germany)配制,然后在荧光定量PCR仪(Roche,Switzerland,Basel)上进行实验。循环反应在95°C 10 min, 95°C 10s, 60°C 30s进行40个循环。重复两次以减少误差。引物采用罗氏LCPDS2软件设计,由北京青科新工业生物技术有限公司合成。引物序列列在附加文件中2:表2.基因表达的计算由2-∆∆计算机断层扫描方法[72].
可用性数据和材料
支持结果和结论的数据图表包括在文章和其他文件中。所有转录组数据已保存在NCBI序列读取档案(SRA)中,登录号为PRJNA555165 (http://www.ncbi.nlm.nih.gov/sra).
缩写
- 4 cl:
-
4-香豆素:Co A连接酶
- 答:
-
花青素合成酶
- bHLH:
-
基本helix-loop-helix (bhlh)
- C4H:
-
肉桂酸4-羟化酶
- 气:
-
查耳酮异构酶
- CHS:
-
查耳酮合酶
- DFR:
-
二氢烷醇-4-还原酶
- F3H:
-
黄烷酮3-hydroxylase
- 走:
-
基因本体
- 销售税:
-
谷胱甘肽S-转移酶
- KEGG:
-
京都基因和基因组百科全书
- 朋友:
-
苯丙氨酸氨裂解酶
- 问PCR:
-
实时定量PCR
- RNA-seq:
-
RNA-sequencing
- UFGT:
-
类黄酮3-O-glucosyltransferase
参考文献
- 1.
施QQ,林泽,李奎。植物花青素生物合成的转录调控。为杂志2015;28:570-6。
- 2.
Wada T、Onishi M、Kunihiro A、Tominaga Wada R.过度表达CAPRICE和GLABRA3不会改变番茄(茄属番茄)果皮的花青素含量。植物信号行为。2015;10:e1000131。
- 3.
Provenzano S, Spelt C, Hosokawa S, Nakamura N, Brugliera F, Demelis L, et al.;花色苷甲基化的遗传控制与进化。植物杂志。2014;165:962 - 77。
- 4.
Jaakola L.在胆汁果实发育过程中涉及三孔素生物合成中的基因的表达,所述基因素生物合成和黄酮醇水平。植物理性。2002; 130:729-39。
- 5.
Silva VO,Freitas AA,Maçanita AL,Quina FH。天然植物色素的化学和光化学:花色苷。物理与组织化学杂志。2016;29:594–9.
- 6.
Hatier J-HB,Gould Ks。营养器官中的花青素功能。在:Winefield C,Davies K,Gould K,编辑。花青素:生物合成,功能和应用。纽约:斯普林克;2009.1-19。
- 7.
弗拉米尼,Mattivi F, Rosso M, Arapitsas P, Bavaresco L.三个重要的葡萄酚类:花青素,二苯乙烯和黄酮醇的高级知识。中华医学杂志。2013;14:19651-69。
- 8.
Wang L-S, Stoner GD。花青素及其在癌症预防中的作用。癌症。2008;269:281 - 90。
- 9.
张玉萍,周杰,Nakanishi K,Sparrow JR.花青素对视网膜色素上皮细胞中A2E光氧化和膜通透性的保护作用.Photochem Photobiol.2007;81:529-36。
- 10.
Azzini e,giacometti j,Russo GL。花青素在临床前临床研究中的抗菌作用。氧化med cell longev。2017; 2017年:1-11。
- 11.
Chaves Silva S,Santos ALD,Chalfun-Júnior A,Zhao J,Peres LEP,Benedito VA.了解花青素生物合成植物-培育紫色水果和蔬菜品种的工具。植物化学。2018;153:11–27。
- 12.
叶淑英,胡彻里格,叶淑英,等。草莓果实中花青素和木质素生物合成之间的代谢相互作用与过氧化物酶FaPRX27有关。植物杂志。2013;163:43-60。
- 13
Albert NW,Lewis DH,Zhang H,Schwinn KE,Jameson PE,Davies KM。矮牵牛花中R2R3-MYB转录因子家族的成员在发育和环境方面受到调控,以控制复杂的花和植物色素沉着模式。植物杂志,2011;65:771–84。
- 14
王宁,刘伟,张涛,姜胜,徐辉,王勇,等。对红肉苹果的转录组分析揭示了MdWRKY11在类黄酮和花青素生物合成中的新作用。农业食品化学。2018;66:7076-86
- 15
蔡晓霞,林林,王雪峰,徐超,王强。高转录水平与花青素积累的关系花青素生物合成基因在菠菜。基因组。2018;61:487 - 96。
- 16
Palapol Y,Ketsa S,Lin-Wang K,Ferguson IB,Allan AC。MYB转录因子调节花青素生物合成山竹果(藤黄属植物mangostana成熟期间的果实。《植物志》2009;229:1323-34。
- 17
田和田,国宽A,富美永R。拟南芥CAPRICE (MYB)和GLABRA3 (bHLH)对照番茄(茄属植物lycopersicum)花青素生物合成。Plos一个。2014; 9:E109093。
- 18.
张勇,胡震,褚刚,黄超,田胜,赵震,等。茄子花色苷积累及花色苷生物合成相关基因的分子分析(茄属植物melongenaL.)。JAgric Food Chem。2014; 62:2906-12。
- 19.
周勇,郭东,李军,程军,周华,顾超,等。协调的监管花青素生物合成光呼吸作用和温度对桃(桃李).树木基因组。2013;9:265-78。
- 20.
满一平,王永春,李志忠,姜志伟,杨海龙,龚建军,等。高温抑制花青素的生物合成和转运,导致红肉猕猴桃的红色显色不良。杂志。2014;153:565 - 83。
- 21.
高温通过抑制LhMYB12转录抑制东方杂交百合花被片中花青素的合成。Sci Hortic。2011;132:59 - 65。
- 22.
Kim S,Hwang G,Lee S,Zhu JY,Paik I,Nguyen TT,等。高环境温度抑制花青素生物合成通过降解HY5。植物学报2017;8:1787。
- 23.
Yamane T,Jeong ST,Goto Yamamoto N,Koshita Y,Kobayashi S.温度对花青素生物合成葡萄浆果皮。amerj Enol Viticult. 2006;57:54。
- 24.
关键词:水稻,水稻,调控机制花青素生物合成在“巨峰”葡萄中,浆果在不同温度条件下生长。环境控制生物学。2004;42:21–30.
- 25
Hirakawa H, Shirasawa K, Miyatake K, Nunome T, Negoro S, Ohyama A, et al.;茄子基因组草图(茄属植物melongenal .):代表茄属原产于旧大陆的物种。DNA研究》2014;21:649-60。
- 26
Kim D,Langmead B,Salzberg SL.HISAT:一种具有低内存需求的快速拼接对准器。Nat方法。2015;12:357–60.
- 27
Smeriglio A,Barreca D,Bellocco E,Trombetta D.《花色素苷的化学、药理学和健康益处》,Phytother Res.2016;30(8):1265-86。
- 28
Middleton E,Kandaswami C,Theoharide Tc。植物黄酮对哺乳动物细胞的影响:炎症,心脏病和癌症的影响。Pharmacol Rev. 2000; 52(4):673-751。
- 29
Pojer E, Mattivi F, Johnson D, Stockley CS。食用花青素促进人体健康的案例:综述。食品科学与食品安全。2013;12(5):483-508。
- 30.
Ahmed NU,Park JI,Jung HJ,等.油菜二氢黄酮醇4-还原酶(DFR)基因的特征及其与低温和冷冻胁迫的关系[J].基因.2014;550(1):46-55。
- 31.
野田毅,克内尤基T,伊加拉希K,等.茄子皮中花青素nasunin的抗氧化活性[J].Res.commun.mol.pathol.pharmacol.2000;102(16):6272-5。
- 32.
Løvdal T,Olsen KM,Slimestad R,等。氮素耗竭、温度和光照对番茄叶片中酚类化合物含量和基因表达的协同效应[J]。植物化学。2010;71(5):605-13。
- 33.
姜敏,刘艳,任磊,等。茄子花青素生物合成基因的克隆与鉴定(茄属植物melongenal .) [J]。植物生理学报,2016;38(7):163。
- 34.
林旺K,Micheletti D,Palmer J,等。高温通过调节花青素调节复合物降低苹果果实颜色[J]。植物细胞环境。2011;34(7):1176–90.
- 35.
等。葡萄VviPrx31过氧化物酶基因的克隆及表达分析[J]。acta botanica yunnanica(云南植物研究);2016;
- 36.
库什尼TPT,兰姆AJ。黄酮类化合物的抗菌活性。国际抗菌药物杂志2005;26:343-56。
- 37
张晓华,郑晓涛,孙斌,彭春林,周文生。CHS基因的过表达增强了拟南芥叶片对强光的抗性。Environ Exp Bot. 2018; 154:33-43。
- 38
关键词:低温胁迫,葡萄,花青素合成,功能保护,表达模式基因。2015;574:168 - 77。
- 39
盐胁迫对黑糯稻幼苗花青素含量及花青素合成基因表达的影响。acta botanica yunnanica(云南植物研究)2016;15:56-65。
- 40
陈永华,曹媛媛,王丽娟,李利民,杨娟,邹明明。玉米MYB转录因子基因的鉴定及其在非生物胁迫中的表达。医学杂志。2018;62:222-30。
- 41.
刘宇,史志,马克西莫娃,佩恩·乔丹,吉尔蒂南·乔丹。Tc-MYBPA是拟南芥tt2样转录因子,在可可原花青素合成调控中的作用。BMC Plant Biol. 2015;15:160。
- 42.
Matsui K,Umemura Y,Ohme Takagi M.AtMYBL2是一种具有单个MYB结构域的蛋白质,充当细胞凋亡的负调节因子花青素生物合成在里面拟南芥.植物j . 2008; 55:954 - 67。
- 43.
黄志强,王志强,王志强,等。黄酮类化合物的合成及其代谢产物的调控拟南芥通过MYB75转录因子的过度表达:山奈酚-3,7-地那西苷在抗特种昆虫草食性昆虫中的作用地区brassicae.J Exp Bot。2014; 65:2203-17。
- 44.
Cobb G,Witmer J,Cryer J.基本Helix-Loop-Helix转录因子适应旱灾的可能作用。植物SCI。2014; 223:1-7。
- 45.
孟C-M,张天志,郭文志。陆地棉bHLH基因对ABA和干旱胁迫的响应植物学报2009;27:381-7。
- 46.
周杰,李菲,王建利,马Y,庄K,徐耀义。野生稻碱性螺旋-环-螺旋转录因子(OrbHLH2)提高拟南芥对盐胁迫和渗透胁迫的耐受性。植物生理学。2009;166:1296–306.
- 47.
刘开,太极,李思,高W,赵米,谢C等人。BHLH122是拟南芥的干旱和渗透胁迫性和抑制ABA分解代谢的重要性。新植物。2014; 201:1192-204。
- 48.
亚伯拉罕斯,李E,沃克AR,坦纳GJ,拉金PJ,阿什顿AR拟南芥TDS4基因编码白细胞花青素双加氧酶(LDOX),对原花青素合成和液泡发育至关重要。《植物杂志》,2003年;35:624–36.
- 49
刘永强,史志强,马志强,等。在可可树中原花青素的合成:编码花青素合成酶,花青素还原酶和白花青素还原酶的基因。植物学报。2013;13(1):202。
- 50。
金诗雅,吴sk,安诗雅,尹香港。高温影响葡萄果实中类黄酮和二苯乙烯合成基因的表达。地球科学进展。2018;36(5):607-18。
- 51
编码查尔酮-黄烷酮异构酶的同源基因Triticum aestivum.L:小麦植株不同部位的结构特征和表达。基因。2014;538:334–41。
- 52
关键词:彩色马铃薯,黄酮-3 '羟化酶5 ' -羟化酶(F3 ' 5 ' h),基因表达基因组学应用生物学。2015;34:1494-502。
- 53.
Sasaki N,Nishizaki Y,Ozeki Y,Miyahara T.酰基葡萄糖在花青素修饰中的作用.分子.2014;19:18747-66。
- 54.
Pastore C,Dal Santo S,Zenoni S,Movahed N,Allegro G,Valentini G,Filippetti I,Tornielli GB.全植物温度调控影响葡萄果实的类黄酮代谢和转录组。前沿植物科学杂志,2017;8:929。
- 55.
Knoch E,Sugawara S,Mori T,et al.UGT79B31负责矮牵牛花粉特异性类黄酮生物合成的最终修饰步骤[J].植物学报.2018;247(4):779-90。
- 56.
吴旭,谭刚,徐铮,王峰,熊安。鸭羟基肉桂酸转移酶基因的克隆及其对不同温度的响应。《西北植物学报》2015;35:1289-96。
- 57.
宋仁,安玉杰。DcHsp17.7是胡萝卜中一个小的热休克蛋白,在盐胁迫下有组织特异性表达,具有耐盐性。生物科技新》。2011;28(6):698 - 704。
- 58.
Wahid A,Gelani S,Ashraf M,等。植物的耐热性:综述。环境实验机器人。2007;61(3):199–223.
- 59.
郑大世女装日报。α -晶体蛋白-小热休克蛋白超家族的家谱。国际生物医学杂志。1998;22(3-4):151-62。
- 60。
等。ClpB/Hsp100基因在蚕豆(Vicia faba L.)植物热胁迫响应中的表达分析中国生物医学杂志。2016;23(2):243-7。
- 61。
Neuer A,Spandorfer SD,Giraldo P,等。热休克蛋白在生殖中的作用。人类生殖更新。2000;6(2):149-59。
- 62。
Guo M,Liu Jh,Ma X等。辣椒(辣椒增压液L.)中HSP70家族基因的全基因组分析及CAHSP70-2中CAHSP70-2的功能鉴定。植物SCI。2016; 252:246-56。
- 63
Heckathorn SA, Downs CA, Coleman JS。小热休克蛋白保护叶绿体和线粒体中的电子运输。黑旋风。1999;(6):865 - 76。
- 64
张媛媛,刘春春,刘颖,等。热诱导转录因子HsfA2在拟南芥获得的耐热性的扩展中是必需的。植物杂志。2007;143(1):251 - 62。
- 65.
陈志强,陈志强,陈志强,等。热应激转录因子HsfA5作为HsfA4特异性抑制因子的作用生物化学学报。2006;282(6):3605-13。
- 66.
李志,张磊,王安,等。番茄热胁迫转录因子SlHsfA3的异位过表达增强了拟南芥的热耐性和盐敏感性。《公共科学图书馆•综合》。2013;8 (1):e54880。
- 67.
Jain M. NGS QC工具包:用于下一代测序数据质量控制的工具包。《公共科学图书馆•综合》。2012;7:e30619。
- 68.
张志强,张志强,张志强,等。[J]。基因组医学杂志。2011;12 (3):R22。
- 69.
Anders,Pyl PT,Huber W.HTSeq——一种处理高通量测序数据的Python框架[J].生物信息学.2015;31(2):166-9。
- 70.
在基因水平上RNA-Seq数据的差异表达- DESeq包。欧洲摩尔生物学实验室,2013。
- 71
王志强,王志强,王志强,等。KEGG将基因组与生命和环境连接起来。核酸学报2008;36:480-4。
- 72。
Kenneth J,Schmittgen TD。应用实时定量PCR和2−ΔCT法。方法。2001;25:402–8.
致谢
我们感谢丁信顺教授对手稿的修改。
资金
国家“十三五”科技支撑计划项目(No. 2017YFD0101904);农业委员会基础项目(上海农业字(2015)No. 6-2-3);CARS-25)。资助机构没有在研究的设计、数据的收集、分析和解释以及手稿的撰写中发挥作用。
作者信息
从属关系
贡献
DZ和XW提出了研究,ZZ和ZY进行了试验材料的制备和处理。XW和AZ设计并进行了实验。SZ分析了数据并撰写了手稿。YZ修改了文章。所有作者都阅读并批准了最终手稿。
通讯作者
道德宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们没有相互竞争的利益。
补充资料
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
额外的文件1:
表S1。与参考基因组比较率的比较结果。A:与参考基因组比较率的比较结果。总读数:测序数据过滤后测序序列的统计数(干净读数);总映射:可映射到基因组的测序序列数;通常,如果没有污染,并且适当选择参考基因组时数据百分比大于70%;多重映射:参考序列上具有多个对齐位置的测序序列数;唯一pPE:参考序列中具有唯一对齐位置的测序序列的数量;Read-1、Read-2:分别映射到参考基因组的左读和右读的数量。B:与参考基因组比较率的比较结果。读取映射到“+”,读取映射到“-”:映射到位置的序列的统计信息基因组上的ve和负链;剪接读取:总映射读取,与两个外显子上的测序序列分段对齐(也称为连接读取的统计数据,非剪接读取要测序到外显子的序列的统计数据。剪接读取的百分比取决于序列的长度;正确成对的读取:双端比率。(DOCX 14 kb)
额外的文件2:
表S2。q RT-PCR基因引物序列(DOCX 354kb)
额外的文件3:
图S1。q - RT-PCR分析花青素合成相关基因的表达。y轴为q RT-PCR分析的基因相对表达量。(多克斯19 kb)
权利和权限
开放存取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
张淑娟,张安,吴旭。等等。转录组分析显示茄子花色苷生物合成相关基因的表达(茄属植物melongena在高温应力下。植物生物学19,387(2019)。https://doi.org/10.1186/s12870-019-1960-2
收到了:
接受:
发表:
关键词
- 茄子(茄属植物melongena五十、 )
- 花青素生物合成
- 基因表达
- 高温
- 转录组
- 中存在