摘要
背景
作为一种传统中草药,红花(Carthamus tinctoriusL.)的小花有预防心脑血管疾病的作用。根据以往的化学分析,其小花中的主要活性成分为黄酮类化合物。虽然黄酮的生物合成途径在许多模式种中已被证实,但在红花中独特的生物合成途径仍有待探索。值得注意的是,查尔酮异构酶(CHI)作为一种重要的过渡酶,在红花中尚未被鉴定。
结果
根据我们之前的研究,在我们实验室建立的红花转录组文库中鉴定出了CHIs。为了对红花中的CHI基因进行表征,将其命名为Ct鉴定出CHI1。多序列比对和系统发育树证明了这一点CtCHI1具有92%的氨基酸同源性,与CHI to关系密切光学美杜莎.此外,亚细胞定位分析表明CtCHI1-GFP融合蛋白主要存在于细胞核中。此外,我们净化了CtCHI1蛋白来源于大肠杆菌在体外能有效催化2 ',4 ',4,6 ' -四羟基查尔酮异构化生成柚皮素。通过基因工程技术,成功获得了转基因烟草和红花品系。在转基因烟草中,过表达CtCHI1显著抑制了槲皮素(ovx-5系~ 79.63%)和花青素(ovx-15系~ 64.55%)等主要次生代谢产物的积累。在转基因红花中,过表达CtCHI1导致上游基因CtPAL3和CtC4H1显著增加(高达~ 3.9倍)Ct4 cl3,CtF3H和CtDFR2被抑制。通过PCA和PLS-DA对整个代谢组学数据库进行比较,标记出788个潜在差异代谢产物,其中大部分表现为上调趋势。同时分离出一些次生代谢产物,如羟基红花黄A (HSYA)、芦丁、山奈酚-3O-β-芦丁苷和二氢山奈酚在转基因红花植株中积累。
结论
在这项研究中,我们发现CtCHI1是一种活性、功能性、催化蛋白。此外,CtCHI1对烟草花青素和槲皮素通路分支具有负向竞争性调控作用。相比之下,CtCHI1对红花黄酮醇和查尔酮代谢流量具有正向调控作用。本研究为了解CHI在类黄酮途径中的不同生化功能特征提供了一些线索。更多的CHI分子机制有待于进一步探索。
背景
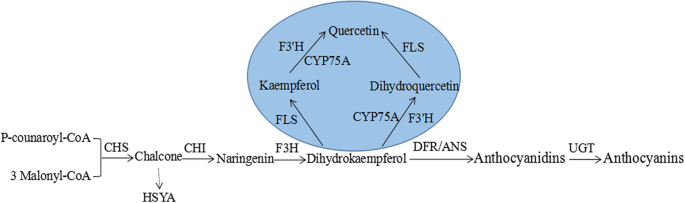
类黄酮是一类植物特有的次生代谢产物,在植物生长发育过程中具有多种功能,包括花的着色、抵御紫外线照射、抵御病原体、花粉发育、细胞周期调节和生长素运输[1,2,3.].在类黄酮生物合成途径中,查尔酮合成酶(CHS)首先生成查尔酮,然后查尔酮异构酶(CHI, EC 5.5.1.6)催化查尔酮立体定向转化为相应的(2年代)-启动类黄酮代谢流的黄酮。随后,黄酮3-羟化酶(F3H)催化黄酮羟化并将其转化为二氢黄酮醇。二氢黄酮醇4还原酶(DFR)和花青素合成酶(ANS)连续作用,以二氢黄酮醇为底物,促进花青素的合成。接下来的花青素糖基化通常是由udp -葡萄糖介导的(图。1).许多纪录片报道,虽然查尔酮类化合物可以非酶或非化学异构成(2RS)-黄酮在中性溶液中,只有(2年代-黄酮是后续类黄酮类天然次生产物的重要中间体。例如,2 ',4 ',4,6 ' -四羟基查尔酮(查尔酮柚皮素)能迅速异构成5,7,4 ' -三羟基黄酮(柚皮素),而6 ' -脱氧查尔酮由于底物分子内氢键的差异,异构成5-脱氧黄酮的反应较慢[4].
cDNA交叉杂交和抗原交叉反应表明,豆科植物和非豆科植物CHI蛋白的不同底物特异性是由CHI蛋白结构引起的[5].CHIs可分为4个亚族(第一类至第IV类)[6],而它们的分布具有高度的家族特异性[4,7].I型CHIs通常存在于非豆科植物中,只容易使6 ' -羟基查尔酮异构生成(2年代)-柚皮素,而豆科植物特有的II型CHIs可将6 ' -羟基查尔酮和6 ' -脱氧查尔酮转化为(2年代-柚皮素和(2年代) -liquiritigenin,分别。III型CHIs广泛存在于绿藻和陆生植物中,而IV型CHIs仅限于陆生植物。结构分析表明,所有的CHIs都具有相似的骨架构象[8,9].然而,III型和IV型CHIs不具有CHI活性,这导致这两种类型的CHIs被重命名为CHI样蛋白(CHI -like proteins, CHIL)。III型CHI褶皱在植物脂肪酸代谢中起重要作用[8].有趣的是,生化证据表明豆科植物如甘草有刺的[4]包括I型和II型CHI。CHI常被报道为唯一的植物特异性制造基因[5].然而,通过查尔酮异构酶家族序列和三维折叠分析,细菌和真菌物种具有查尔酮异构酶样基因,且倾向于缺乏查尔酮合成酶的同源物[10].I型和IICHIs的分子量约为24 ~ 29kDalton。编码这两种类型的CHIs的基因已经从不同的植物物种中克隆和鉴定[11,12,13,14,15,16].根据推导出的氨基酸序列比对,同一类型的CHI的同源性约为70%,而I型和II型CHI的同源性仅为50%左右[7].用x射线晶体学研究了I型和II型CHI的结构。在拟南芥,解剖I型CHI-fold家族,包括配体结合特性、晶体结构和体内功能表征[8].其中,苜蓿的结构(紫花苜蓿) CHI (type II CHI)蛋白提供了详细的动态反应机制[17].
我们前期研究系统分析了红花归一化cDNA文库和基因芯片数据[18].利用芯片和qPCR对23个黄酮相关基因进行了定量分析。其中只有2个CHI被功能注释标记,1个CHI也是黄酮类增强剂,另一个CHI是纯查尔酮异构酶。在这篇文章中,我们将描述一个真正的CHI基因的克隆和生化特征从红花。此外,我们还探讨了CHI在次生代谢物生物合成途径中的潜在作用。
结果
分离和表征CtCHI1
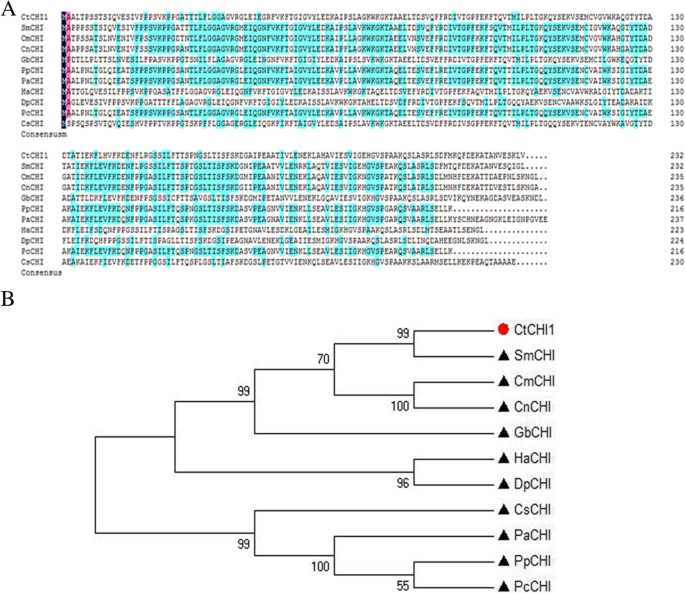
的全长cDNA序列CtCHI1基因从Carthamus tinctoriusL.命名CtCHI1 (GenBank登录号;MF421811)。该基因编码一个232个氨基酸的预测多肽。推导出的cDNA氨基酸序列表明,其编码的多肽长度约为24.9 kDa,等电点为5.8。DNAMAN多序列比对表明,CHIs具有92%和85%的氨基酸同源性光学美杜莎CHI (GenBank accession No.Q8LKP9.1)和山楂树CHI (KVI06946.1)。2a).系统发育树(图;2b)基于假定氨基酸序列的邻域连接(NJ)方法生成CtCHI1与CHI from关系密切美国美杜莎,通过在毛状根培养物中过表达查尔酮异构酶基因,可以促进芹菜素的生物合成。
一个推导的对齐CtCHI1氨基酸序列与其他植物的比较。相同的残留物突出显示在黑色背景上,相似的残留物突出显示在粉红色和蓝色背景上。GenBank的加入编号如下:SmCHI: Q8LKP9.1 from光学美杜莎;厘米CHI: A1E261.1 from菊花;CnCHI1: ASX95441.1 fromChamaemelum高贵的;GbCHI: BAJ17665.1 fromGynura二色的;页CHI: XP_007218371.1 from碧桃;巴勒斯坦权力机构CHI: AJO67964.1 from李属鸟结核;哈CHI: XP_022013593.1 from向日葵;DpCHI: BAJ21533.1 from大丽花pinnata;个人电脑CHI: AKV89240.1 from李属cerasifera;CsCHI: ASU87415.1 from茶树.b植物氨基酸序列的无根系系比较CtCHI1与其他功能特征的CHI蛋白。所使用的序列与图中所示相同。2a.系统发育树用MEGA构建,系统发育树用ClustalX软件比对。使用邻居加入引导分析(1000个引导重复)估计节点支持
亚细胞定位
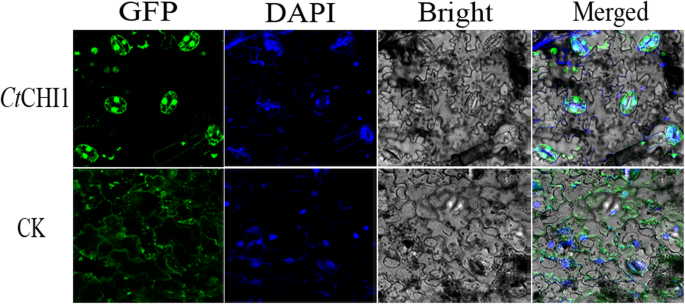
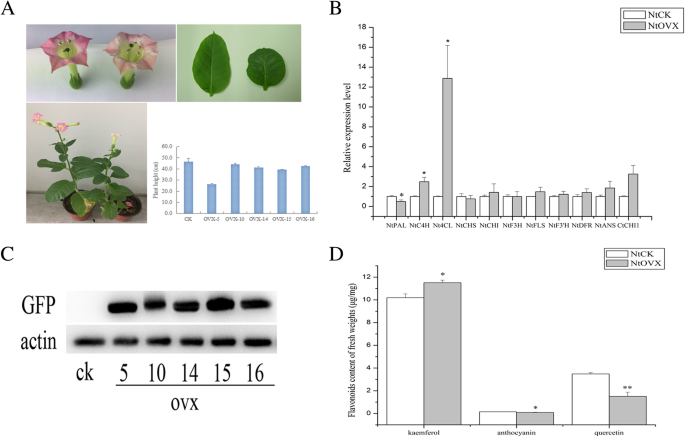
检查局部化CtCHI1蛋白CtCHI1-GFP融合构建,由CaMV 35S启动器,被改造成根癌土壤杆菌GV3101随后以注射的方式轻轻导入烟叶细胞。先用1 ml无针注射器在烟叶下方渗透,再用针扎一个小孔,使构建质粒的悬浮缓冲液顺利进入烟叶。渗透烟草benthamiana会得到很好的控制。在显微镜成像前,将烟草植株置于黑暗24小时后的光照下72小时。结果表明,在捕捉GFP信号的瞬间表达时,在细胞核中检测到GFP荧光CtCHI1烟草。从GFP、DAPI和亮场的合并图像中,可以清楚地看到细胞核中的GFP信号Ct对照组时CHI1组定位于细胞质和细胞膜(图;3.).
分子对接分析
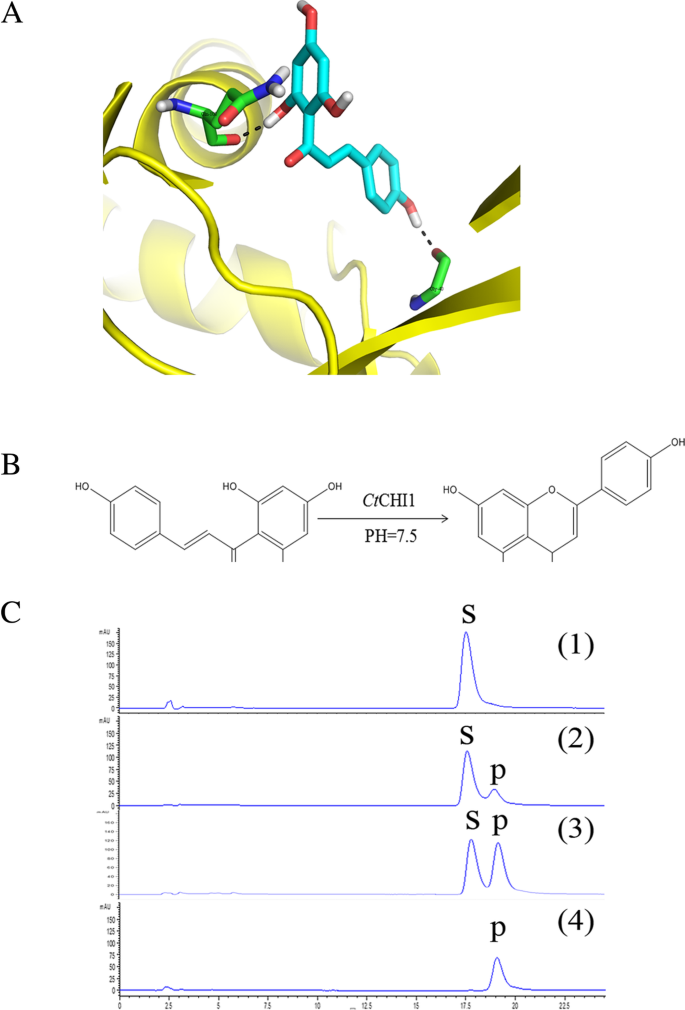
揭示…的潜在作用CtCHI1在催化2 ',4 ',4,6 ' -四羟基查尔酮中的作用并了解可能的相互作用模式[19],进行分子对接模拟。蛋白质结构由其同源蛋白查尔酮异构酶(PDB ID: 1EYQ)与modeleller构建(图。4a). Ramachandran图证明结构合理(http://services.mbi.ucla.edu/SAVES/Ramachandran/)以及由procheck [20.,21].结果表明,该酶能与2 ',4 ',4,6 ' -四羟基查尔酮结合。这个化合物形成了两个氢键CtThr 105、Leu 104、Phe 50、Leu 41、Arg 39、Lys 112、Glu 111和Lys 112催化袋中的CHI1。
函数表达式CtCHI1在大肠杆菌、纯化、酶促测定
的CtCHI1基因在30°C的条件下异质性表达大肠杆菌BL21(DE3)在pMAL-c5x载体中携带mbp标记蛋白的plycell。重组蛋白以可溶性的形式得到。因此,利用MBP对麦芽糖的亲和层析,对重组蛋白的可溶性部分进行了纯化和浓缩。纯化后的CHI在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶上迁移,分子质量为24.9 kDa。验证的功能Ct在体外,我们试图测试一组类黄酮化合物作为底物。在HEPES缓冲液中,我们发现重组Ct在30°C条件下,CHI1能有效催化2 ',4 ',4,6 ' -四羟基查尔酮异构化生成柚皮素(图。4B和c),虽然2 ',4 ',4,6 ' -四羟基查尔酮也可以以非酶的方式异构化为柚皮素[22].chi催化的2 ',4 ',4,6 ' -四羟基查尔酮的反应可以忽略不计,在本研究所采用的测定条件下,在4°C下发生得非常缓慢。最适pH值Ctchi1催化的2 ',4 ',4,6 ' -四羟基查尔酮异构化反应为7.5 [23].结果表明CtCHI1属于I型CHIs。
确定的酶动力学值CtCHI1,首先分别绘制柚皮素和2 ',4 ',4,6 ' -四羟基查尔酮(查尔酮柚皮素)的标准曲线(附加文件1:图S1)。基于这些曲线,我们在180分钟内精确检测了底物和产物化合物的数量,仅在20分钟内就显示了数据(附加文件1:图S1)(这些曲线数据包括自发率)。已有报道利用2 ',4 ',4,6 ' -四羟基查尔酮作为底物,Kcat = 11180±1380 min−1, Km = 112±28 μm,高于大豆CHI的自发反应速率。值得注意的是,在HEPES (pH = 7.5)存在时,动力学分析表明CtCHI1有效地催化查尔酮柚皮素转化为柚皮素,Km = 1。585 mM, Kcat =1.87 × 109最小值−1.酶活性Ct包括自发反应在内的CHI比in的CHI快金鱼草majusl . (THC: Kcat = 1.7 (s−1)公里= 7.0μM, PHC: Kcat = 2.3 = 0.16 (s−1)公里[μM]) (22],也比3个CHIs强Lotus对虾[7].
转录表达模式Ct烟草和红花花瓣中的CHI1
为了研究烟草和红花中相关黄酮基因的转录表达水平,采用基因特异性引物进行实时定量聚合酶链反应(PCR)。的表达模式Ct从花瓣中提取总RNA,检测CHI1及相关黄酮类基因。如图所示。5B,的相对转录水平CtCHI1过表达显著增加Ct与对照组相比,CHI1在ovx-10烟草花瓣中表达量最高(~ 6.37倍),而在ovx-14(~ 3.17倍)和ovx-16(~ 3.48倍)中表达量较高(额外文件)2:图S2A)。
定量PCR结果表明,苯丙类途径上游基因包括NtC4H和Nt4CL增长强劲,而NtPAL在转基因烟草中略有下降。此外,类黄酮生物合成下游基因的表达水平发生了显著但不规律的变化,包括NtFLS的,NtF3'H,NtDFR,NtANS(无花果。5b和附加文件2:图S2A)。这表明,下调的结构基因可能具有指向不同代谢通量分支的潜在竞争。
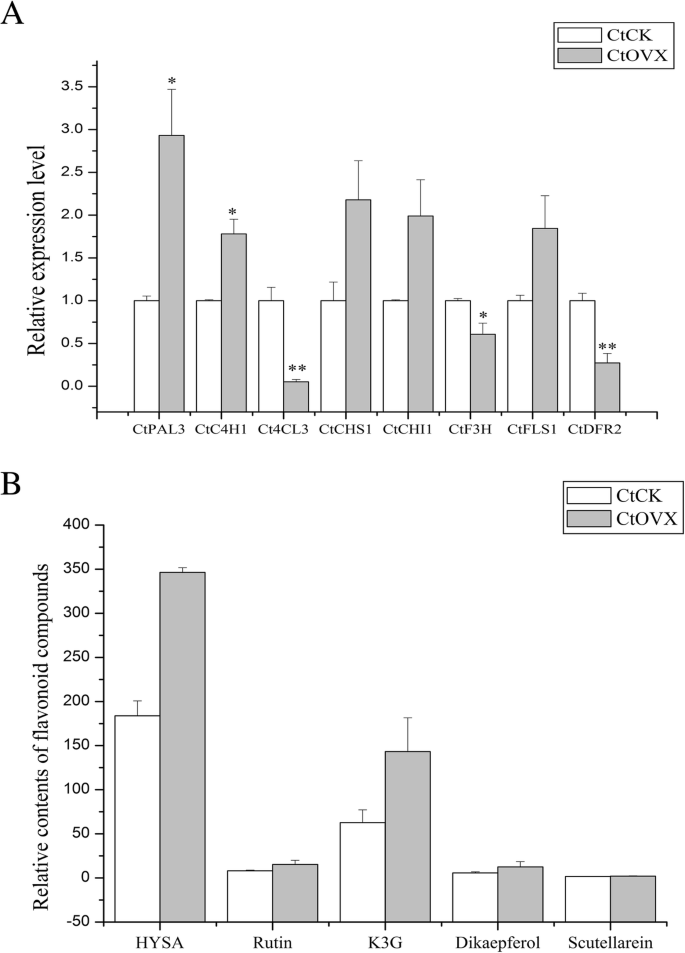
与此同时,对于转基因红花,黄酮相关基因的表达水平如图所示。6a,特别是ovx-3, ovx-5和ovx-6(附加文件3.:图S3A)。显然,内生Ct在ovx-5细胞系中CHI1过表达达2.70倍。如图所示,上游基因CtPAL3和CtC4H1在ovx-3基因中表达明显上调3.88-和2.12倍,下游基因则明显上调CtF3H和Ct在ovx-3和ovx-6中DFR2明显降低(≥50%)3.:图S3A)。这表明过度表达CtCHI1可能抑制CtDFR2基因表达,可能影响花青素通路。总之,定量PCR结果显示过表达CtCHI1对烟草和红花类黄酮代谢产物的积累具有个体和不同的影响。
西方墨点法
利用gfp融合蛋白抗体进行Western blotting分析,发现该靶蛋白与阴性对照(CK)相比表达水平有明显差异。肌动蛋白作为参考蛋白。这个结果表明CtCHI1蛋白过表达,且在不同转基因烟草株系中表达水平不同(图2)。5c)。
转基因烟草类黄酮积累分析
过度表达Ct对烟草中CHI1基因进行了鉴定。表型差异明显,转基因烟草植株的花颜色由粉红色变为浅粉色(图2)。5此外,与空病媒对照相比,转基因烟草的叶片变得更小、更绿、更圆(图2)。5a).但是通过测量株高,我们发现株高略短,而且ovx-5株高明显变短,没有统计学差异(图。5a).高效液相色谱(HPLC)结果(图;5D)转基因烟草中花青素和槲皮素明显减少,山奈酚明显增加,对应于颜色变化和蛋白质表达水平的变化。山奈酚在ovx-5、ovx-14和ovx-16系中分别增加11.84、13.07和20.88%。相比之下,槲皮素在ovx-5系中下降幅度最大(~ 79.63%),ovx-15系中下降幅度第二(~ 70.56%),而花青素在每种过表达中均被显著抑制Ct烟草CHI1株和最佳品系(ovx-15)增产64.55%2:图S2B)。结果表明,过表达Ct烟草CHI1促进山奈酚的积累,抑制花青素和槲皮素的生成。简而言之,过度表达CtCHI1可引起山奈酚和槲皮素在烟草黄酮醇生物合成途径上的竞争,并对烟草花青素途径分支进行负调控。
转基因红花的代谢组学分析
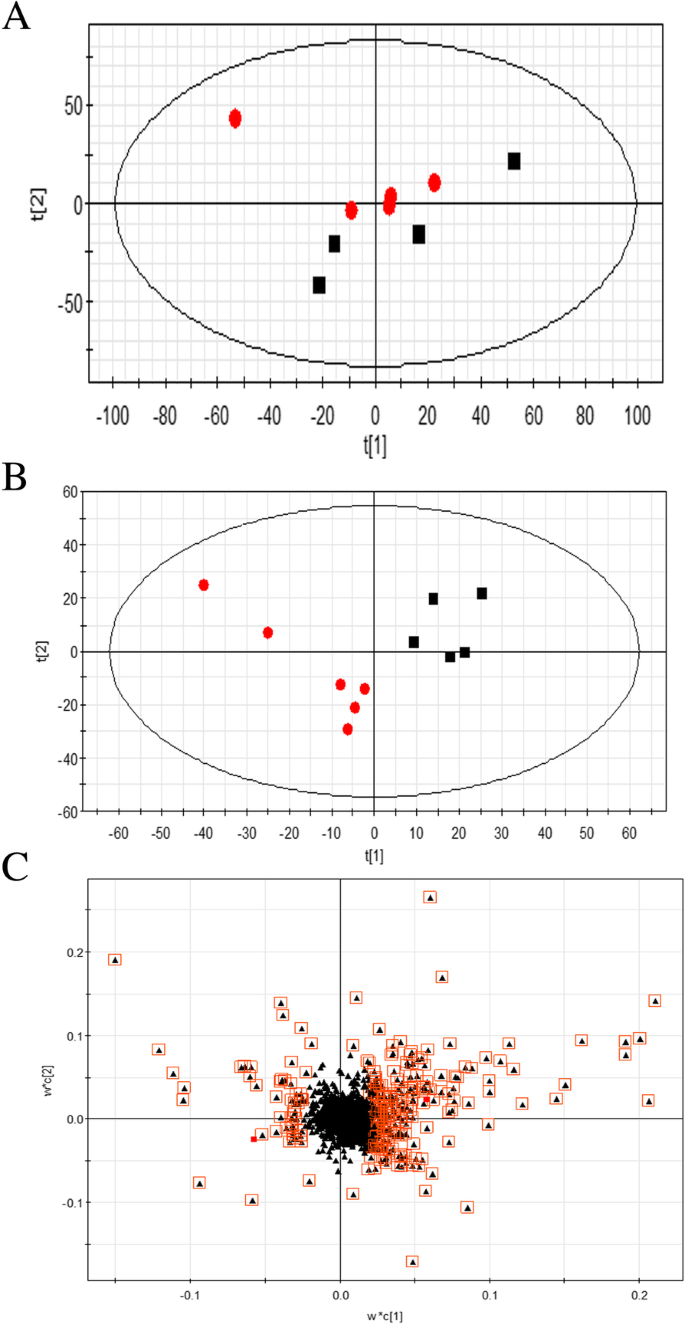
为了对整个代谢数据库进行评价,采用主成分分析(PCA)和偏最小二乘判别分析(PLS-DA)模式识别。采用无监督主成分分析(unsupervised PCA)作为一种无偏统计方法来调查各组之间的一般相互关系,并得到分离(图。7a).这表明代谢谱发生了显著的改变CtCHI1超表达。同时,为了发现对照组和ovx组之间代谢谱的变化,采用监督PLS-DA方法促进代谢物的检测,负模式PLS-DA模型具有更好的组间区分能力(图2)。7b).对应的加载图(图;7C为负离子模式)选择电位差异代谢物,其中离原点最远的离子对两组的聚类有显著贡献。每个点代表一种内源性物质,位于图的末端的点更有助于组间的区分。最后,根据前面方法中的变量重要性,从负离子模式中筛选出了788个差异代谢物离子。代谢物概述在附加文件4:表S1。主要的差异代谢物还有待于通过高分辨率质谱和MS/MS实验来鉴定。
此外,我们在红花黄酮通路中检测到了一些重要的活性化合物,而标准化合物则保存在我们的实验室中。HSYA,芦丁,山奈酚-3O-芦丁苷和二氢山奈酚在一些转基因株系中显著增加(图2)。6b).典型地,对于ovx-6系,前面提到的四种次生代谢产物分别显著提高了3.11-、3.04-、3.50-和4.27倍(附加文件3.图S3B)。
讨论
CHI是一种有潜力的功能酶,可定向生成多种活性类黄酮化合物。尽管对CHI的分类和克隆进行了广泛的研究,但对红花中CHI对次生代谢产物的调控知之甚少[24,25,26,27].在本研究中,我们进行了一个纯的序列分析Ct研究了CHI1基因在烟草和红花转基因株系中的体外活性、转录本丰度和代谢积累。
的ORFCtCHI1全长1378 bp,编码232个氨基酸。多序列比对证明了这一点Ctchi1具有92%的氨基酸同源性,与CHI同源关系密切美国美杜莎.一般来说,查尔酮异构酶在非酶促或酶促条件下催化上游酶查尔酮合成酶衍生的2 ',4 ',4,6 ' -四羟基查尔酮分子内环化生成(2S)-柚皮素(5,7,4 ' -三羟基黄酮)[28,29].在view of spontaneously cyclizing, CHI guarantees the formation of biologically active (2年代黄烷酮类。在我们的报告中,对接分析预测了这一点CtCHI1可能催化2 ',4 ',4,6 ' -四羟基查尔酮生成柚皮素。体外实验证实(2年代柚皮素是黄酮醇葡萄糖苷和花青素色素的代谢前体。这表明CtCHI1是一种活性酶,属于I型CHI蛋白。
批文显示,过表达CHI可提高黄酮醇含量,负调控花青素生产,如矮牵牛和烟草[30.,31].在拟南芥,类黄酮结构酶,包括CHS、CHI、F3H和DFR,组装为大分子复合物,以定向依赖的方式相互作用,以确保高效的类黄酮生产[32,33,34].在烟草中,过度表达CtCHI1提高了烟草中4CL的表达水平,抑制了花青素的积累。更有趣的是,过度表达CtCHI1促进山奈酚积累,抑制槲皮素产生,与以往报道不同[35].我们的研究结果表明CtCHI1在黄酮醇通路中执行改变调控模型。详细的分子机制CtCHI1增加类黄酮相关次生代谢产物尚不清楚。我们的代谢组学分析提供了一个线索,788种代谢物化合物被确定为差异标记,其中大多数显著增加(p< 0.05)CtCHI1。同时,HSYA、芦丁、山奈酚-3-O-β-芦丁苷和二氢山柰酚在转基因红花系中表达上调。结果表明CtCHI1直接与CHS和FLS相互作用,促进黄酮醇和查尔酮的积累,在红花中起黄酮增强剂的作用。
结论
全长Ct红花小花中的CHI1具有活性CtCHI1,属于I型chiis,位于细胞核内。CtCHI1在烟草花青素和槲皮素生物合成途径中起抑制作用。然而,与烟草不同,CtCHI1是红花中查尔酮类化合物和黄酮醇类化合物的潜在增强剂。本研究为进一步研究其分子机制提供了依据CtCHI1。未来,进一步的机制和更多的视野有待于在其他植物中研究。
方法
植物材料
烟草种子(烟草l .简历。W38)来自BIORUN有限公司.有限公司(中国)用15% NaClO消毒10分钟,然后用无菌蒸馏水洗涤三次。种子在pH为5.8的MS固化培养基上萌发。烟草植株在25°C的生长室内栽培,光照和黑暗各16−/8小时。光照强度设置为22000lx。XHH002系系采自新疆农业科学院红花种质资源。XHH002红花系在第二军医大学温室栽培,光照周期为16 h,暗光照周期为8 h,辅助光照由高压钠灯提供。它被确认为Carthamus tinctoriusL.郭美丽教授。凭证标本为SMMU141205。保存于第二军医大学药学院生药学系药用植物标本室。收集盛开的花朵,立即在液氮中冷冻,并保存在−70°C。烟草Benthamiana获得于复旦大学生命学院,并进行亚细胞定位。
全长放大CtCHI1 cDNA
根据制造商说明书(天根,中国),用TRIzol™试剂提取总RNA。红花5 '和3 ' cDNA文库由Clontech Smart™RACE cDNA扩增试剂盒(Clontech, USA)构建。引物设计完成后(CtCHI1-GSP1: ACACCATGCTCCCCAATCACTGACTCG;CtCHI1-GSP2: ATCGTCTTTCCGCCCTCCGTCAAGCC), PCR使用Advantage®2 PCR试剂盒(Clontech, USA)进行。条件为5个循环:94°C 30 s, 72°C 3 min;5个循环:94°C 10 s, 70°C 30 s, 72°C 3 min;30个循环:94°C for 10s, 68°C for 30s,72°C for 3min。PCR产物用1.0%琼脂糖凝胶(QIAquick®Gel Extraction Kit, Qiagen, Germany)分离并测序。基于5 ' -和3 ' - race产品的序列组装,我们尝试设计全长引物(正向引物:CtCHI1-5 ' -ACCTGTTTTACTAGTTTCAGGATCG-3 ',反向引物:CtCHI15“-TTCTCCTAGGCAACTACAATGGC-3”)。随后,使用cDNA模板(TransScript®One-step gDNA Removal and cDNA Synthesis SuperMix, TransGen,中国)和高保真KOD-Plus-Neo聚合酶(Toyobo,日本)在以下条件下进行PCR: 94℃预热2 min, 94℃变性10 s, 58℃退火30 s, 72℃扩增60 s, 4℃保存。PCR产物克隆到pmd19 T载体(Takara, Japan)中。利用QIAquick®Spin Plasmid Mini-prep kit (Qiagen, Germany)提取重组质粒并测序。
生物信息学分析
在GenBank数据库中执行BLASTn和BLASTx算法检测基因注释。通过NCBI数据库中的ORF Finder工具翻译核苷酸序列以识别开放阅读帧(ORF) (https://www.ncbi.nlm.nih.gov/)。多序列比对Ct用DNAMAN检测CHI1和其他CHI蛋白。的系统发育分析CtCHI1与Clustal W对齐[36采用MEGA4.0软件,采用NJ法进行进化分析[37]以1000倍的复制进行引导测试。此外,在ExPASy服务器上预测了理论等电点(pI)和分子量(http://web.expasy.org/compute_pi/) [38,39,40].
亚细胞定位
的整个编码序列(cd)Ct通过PCR扩增剔除终止密码子的CHI1基因。所得到的质粒按照先前描述的方法构建[18].该结构经测序确认,并转化为E。DH5a。融合蛋白的定位检测n Benthamiana共聚焦激光扫描显微镜下的细胞(徕卡TCS SP5,德国)。同时拍摄亮场图像、GFP荧光和DAPI并合并。绿色荧光蛋白在488 nm波长下检测到,DAPI染色在364 nm波长下检测到。使用LAS AF Lit软件(徕卡,德国)捕获图像。
的异源表达和纯化CtCHI1在大肠杆菌
来表达蛋白质大肠杆菌,Ct采用无缝克隆引物(正向引物:GGAAGGATTTCACATATGTCCATGGCATCCTTAACCGATAT;反向引物:attttaattacctgcagggctttcagcggcaatgggggtgg), PCR程序与克隆全长相同CtCHI1 (Tm取决于特殊引物)。PCR产物克隆到pMAL-c5X载体(经酶切后)以区域我和Bam嗨)。将重组质粒(pMAL-c5X-CHI1)转化为大肠杆菌BL21 (DE3) pLys (NEW ENGLAND Biolabs, USA)并测序。转化细胞在含有100 mg/L氨苄西林和34 mg/L湿霉素的2 ml LB培养基中培养,37℃摇晃。然后在含有氨苄西林和湿霉素的50 ml新鲜LB培养基中培养。当培养物的光密度在600 nm处达到约0.6 ~ 0.8时,在37°C下生长。0.5 mM异丙基1-β-d在培养基中加入-硫半乳糖苷诱导蛋白表达,然后在30°C下再培养5 h。
所有步骤都在4°C下进行。所得细胞在5000×g离心10分钟,重悬于pH 8.0的1 ×磷酸盐缓冲盐水缓冲液中。用超声波裂解细胞悬液。用直链树脂亲和柱(pMAL™protein Fusion & Purification System, NEW ENGLAND Biolabs)纯化表达蛋白,并根据Laemmli [41].酶液用Amicon Ultra-15离心过滤装置(30,000 MWCO;Millipore, Billerica, MA, USA)。
酶测定
反应混合物(100 μl)由20 mM 2 ',4 ',4,6 ' -四羟查尔酮(溶解于甲醇中)、50 mM HEPES-NaOH、pH 7.4和酶组成。不含酶的混合物作为对照组。采用Agilent HPLC系列1100,紫外检测器和Waters Symmetry C18色谱柱(粒径5 μm, C18反相4.6 mm × 250 mm)对化合物进行分析。色谱柱之前用0.2% (v/v)甲酸在水中和100%乙腈在7:3 (v/v)平衡。注入20 μl后,在25℃下以1.0 ml/min流速初始显影柱,在254 nm处进行紫外检测。
植物转化
的ORFC将tCHI1克隆到二进制载体pMT39中,生成pMT39-CtCHI1的结果结构受制于CaMV35S启动子。具体步骤如下:将质粒和农GV3101感受态细胞冰敷5min,液氮冷冻5min, 37°C水浴5min,最后冰敷5min。结果构建物转化为农杆菌GV3101。细菌再悬浮的浸润培养基为0.02% (v/v) Silwet L-77和5%蔗糖(w/v)。植物转化是在其他地方描述的农杆菌属-介导的叶盘转化[42].通过基因组PCR对转化植株进行鉴定。筛选出5个具有代表性的转化者进行分析。阴性对照(CK)设空载体。的农杆菌属GV3101重悬与所产生的结构物通过花粉管转化为红花,正如我们团队先前所描述的[18].
定量RT-PCR分析
使用第一链cDNA合成试剂盒(TransGen Biotech, Beijing, China)反转录总RNA (1 μg)。实时PCR由SYBR Green real-time Master Mix试剂盒(Toyobo, Japan)指导,ABI 7500系统(ABI, USA)进行。引用了PCR条件和特异性引物[18,43].将管家基因60S (60S酸性核糖体蛋白)归一化作为内参基因。基因的折叠变化由2——ΔΔCt方法。标准差来自三个独立的重复。
Western blotting分析
用蛋白分离缓冲液提取总蛋白,包括45 ml 1 M Tris-HCL (pH 8.0)、75 ml甘油、6 g聚乙烯吡罗烷酮,加入无菌水至300 ml。用小鼠EGFP (Enhanced Green Fluorescent Protein)一抗和山羊igrp二抗进行Western blot检测。肌动蛋白作为参考蛋白。采用Tanon 5200(中国)自动采集图像。
转基因烟草和红花的代谢产物分析
冷冻后的烟草花期花样品立即粉末状称量。采用高效液相色谱法对烟草中的3种代表性化合物山奈酚、槲皮素和花青素进行了分析。上述三种化合物的提取实验如前所述,并进行了如下修改[34].简而言之,在2 ml 1% HCl/甲醇(v/v)中,从约200 mg的碎烟花中提取山奈酚和槲皮素,同时从80%甲醇溶解的碎烟花中分离出花青素。山奈酚和槲皮素的提取首先超声30分钟,然后在4°C保存过夜,而花青素的提取仅在4°C保存24小时。在本实验中,所有具有代表性的化合物都采用酸水解萃取法确定为苷元。离心处理后,取400 μl黄酮醇上清液移至新管中,加入120 μl 3 N HCl酸水解,90°C水浴孵卵1 h,再与200 μl甲醇混合。另一方面,将200 μl花青素上清液移至新管中,加入220 μl 3n HCl酸水解,90°C水浴孵育3h,然后与200 μl甲醇混合。在上传样品之前,水解溶液应通过0.22 μm过滤膜(Millipore, USA)仔细过滤。安捷伦1100系列高效液相色谱系统,配备安捷伦TC-C18色谱柱为5 μm, 4.6 × 250 mm。流速0.4 ml/min。山奈酚和槲皮素的波长为350 nm,而花青素的波长为650 nm。三种标准化合物购自Sigma-Aldrich (St. Louis, MO, USA)和Yuanye Bio Int (China)。用R绘制并计算标准曲线2(约0.997 - -0.999)。转基因红花次生代谢物分析的样品制备如前所述[18].将盛开的花朵收集起来,立即放置在液氮中。冷冻花样品在50°C下干燥,研磨成细粉用于HLPC分析。
转基因红花代谢组学的色谱和质谱分析条件
高效液相色谱-飞行时间分析使用安捷伦1100 LC系统和安捷伦6220质谱仪(安捷伦,美国)完成。色谱分离在Waters ACQUITY UPLC BEH C上进行18柱(100mm × 2.1 mm, 2.5 μm, Waters Corporation,美国)。流动相由溶液A(0.1%甲酸水溶液)和溶液B(0.1%甲酸乙腈)组成。洗脱条件为:0 ~ 2 min, 5% B;2 ~ 2.5 min, 5 ~ 15% B;2.5 ~ 7.5 min, 15% B;7.5 ~ 8 min, 15 ~ 20% B;8 ~ 10 min, 20 ~ 21% B;10 ~ 18 min, 21-95% B;18 ~ 25 min, 95% b后置时间为10 min。注射量为5 μl,流速为0.50 ml/min。 The temperatures of the autosampler and analytical chromatographic column were set at 4 °C and 25 °C, respectively. An electrospray ionization source was carried out in negative modes. The negative mode conditions were as follows: capillary voltage, 3.5 kV; drying gas flow, 11 L/min; gas temperature, 350 °C; nebulizer pressure, 45 psi; frag mentor voltage, 165 V; skimmer voltage, 65 V. The mass spectrum was set from 100 to 1200 m / z在质心模式。通过TIC表征对样品进行概述。导出HPLC-MS数据用于PCA和PLS-DA (VIP > 1.0,p< 0.05)。
数据和材料的可用性
所有支持研究结果的数据都包含在手稿及其补充文件中。
缩写
- 答:
-
花青素合成酶
- bHLH:
-
基本helix-loop-helix
- cd:
-
编码序列
- 气:
-
查耳酮异构酶
- CHS:
-
查耳酮合酶
- CK:
-
消极的控制
- DFR:
-
dihydroflavonol 4-reductase
- F3H:
-
黄烷酮3-hydroxylase
- 高效液相色谱法:
-
高效液相色谱法
- HSYA:
-
羟基红花黄色
- IPTG:
-
异丙基1 -β-D-thiogalactoside
- 兆瓦:
-
分子量
- MYB:
-
成髓细胞瘤
- 子:
-
开放阅读框
- 主成分分析:
-
主成分分析
- pI:
-
理论等电点
- PLS-DA:
-
偏最小二乘判别分析
- qPCR:
-
实时定量PCR
- 抽搐:
-
总离子色谱图
参考文献
- 1.
杨晓明,张晓明,张晓明,等。植物防御基因对紫外光或真菌诱导子的响应。Nat。1984;311:76。
- 2.
迪克森RA。植物抗毒素反应:诱导,信号和控制宿主基因表达。中国生物医学杂志,1986;29(3):349 - 349。
- 3.
兰姆CJ,劳顿MA,德龙M,迪克森RA。植物防御微生物攻击激活的信号和转导机制。细胞。1989;56(2):215 - 24。
- 4.
木村Y, Aoki T. Ayabe S-i:在产5-脱氧黄酮的豆科植物紫果甘草培养细胞中,对6 ' -羟基-和6 ' -脱氧查尔酮具有不同底物特异性的查尔酮异构酶同工酶。植物细胞生理学杂志,2001;42(10):1169-73。
- 5.
Dixon RA, Richard Blyden E, Robbins MP, Van Tunen AJ, Mol JN。查尔酮异构酶的比较生物化学研究。植物化学。1988;27(9):2801 - 8。
- 6.
班志,秦华,Mitchell AJ,刘波,张峰,翁建凯,Dixon RA,王刚。葎草非催化查尔酮异构酶折叠蛋白是戊烯化类黄酮生物合成的辅助成分。美国国家科学院学报,2018;115(22):E5223-E5232。
- 7.
岛田N,青木T,佐藤S,中村Y,田田S,绫部S- i。一组基因编码两种类型的查尔酮异构酶参与一般黄酮类化合物和豆类特异性5-脱氧(iso)黄酮类化合物的生物合成Lotus对虾.植物科学进展。2003;31(3):341。
- 8.
Ngaki MN, Louie GV, Philippe RN, Manning G, Pojer F, Bowman ME, Li L, Larsen E, Wurtele ES, Noel JP。查尔酮-异构酶折叠从脂肪酸结合到立体定向催化的演化。Nat。2012;485(7399):530 - 3。
- 9.
朴硕,李长泉,赵森明,李宏,朴宏,李俊,李俊华。南极维管植物Deschampsia查尔酮异构酶的晶体结构和酶学性质。Plos One. 2018;13(2):e0192415。
- 10.
查尔酮异构酶家族和折叠:不再是植物特有的。蛋白质科学,2004;13(2):540-4。
- 11.
Mehdy MC, Lamb CJ。查尔酮异构酶cDNA的克隆及真菌激发子、损伤和感染对mRNA的诱导。中国科学院学报。1987;6(6):1527-33。
- 12.
范图宁AJ,科斯RE,斯佩尔特CE,范德克罗尔AR,斯图特耶AR,摩尔JN。矮牵牛查尔酮类黄酮异构酶两个基因的克隆:类黄酮基因的坐标、光调节和差异表达。中国科学d辑,1998;7(5):1257-63。
- 13.
Blyden ER, Doerner PW, Lamb CJ, Dixon RA。菜豆查尔酮异构酶cDNA的序列分析。植物分子生物学,1991;16(1):167-9。
- 14.
玉米查尔酮类黄酮异构酶基因的分离与鉴定。Mol Gen Genet MGG。1994年,242(1):1 - 8。
- 15.
黄志刚,黄志刚,黄志刚。葡萄黄酮和二苯乙烯合成相关结构基因的克隆与分子分析(葡萄l .)。植物分子生物学,1994;24(5):743-55。
- 16.
来自豌豆上胚轴查尔酮异构酶的cDNA编码。植物科学进展。1994;40(4):366 - 366。
- 17.
Jez JM, Bowman ME, Dixon RA, Noel JP。进化上独特的植物酶查尔酮异构酶的结构与机制。生物工程学报,2000;7:786。
- 18.
郭东,薛勇,李东,何斌,贾欣,董霞,郭敏CtCHS1促进红花喹诺查尔酮的积累。植物科学,2017;8:1409。
- 19.
王晓燕,王晓燕,王晓燕,等。蛋白质结构的建模方法。《生物信息学》,2016;54:5.6.1-5.6.37。
- 20.
拉斯科夫斯基RA,麦克阿瑟MW,莫斯DS,桑顿JM。PROCHECK:一个检查蛋白质结构立体化学质量的程序。岩石力学与工程学报,2001;26(2):366 - 366。
- 21.
拉斯科夫斯基RA, Rullmannn JA,麦克阿瑟MW,卡普滕R,桑顿JM。AQUA和PROCHECK-NMR:通过NMR解决的蛋白质结构质量检查程序。J Biomol NMR。1996; 8(4): 477 - 86。
- 22.
Fujino N, Yamazaki T, Li Y, Kera K, Furuhashi E, Yamashita S, Morita Y, Nakayama M, Takahashi S, Nakayama T.金鱼查尔酮异构酶折叠蛋白cDNA的克隆与鉴定(金鱼草majusl .)花。植物学报。2014;31(2):105-14。
- 23.
Jez JM, Noel JP。查尔酮异构酶的反应机制:pH依赖性、扩散控制和产物结合差异。中国生物医学工程杂志,2002;27(2):1361-9。
- 24.
李红,董艳,杨娟,刘霞,王艳,姚楠,管玲,王楠,吴娟,李霞。红花新生转录组及油酸苷和黄酮类化合物生物合成推测基因的鉴定。公共科学学报,2012;7(2):e30987。
- 25.
胡璐琳,肖燕,裴胜,文涛,尚琴。基于illumina的红花花转录组测序与分析。公共科学学报,2012;7(6):e38653。
- 26.
刘霞,董勇,姚楠,张艳,王楠,崔霞,李霞,王勇,王峰,杨杰,等。对红花转录组进行从头测序和分析,以发现与红花黄相关的推测基因Carthamus tinctorius中华分子生物学杂志,2015;16(10):25657-77。
- 27.
陈娟,唐晓霞,任超,魏波,吴勇,吴强,裴娟。红花类黄酮生物合成的转录组全长序列及推测基因的鉴定。BMC基因组学。2018;19(1):548。
- 28.
黄酮异构酶的分离纯化及性质研究。植物化学,1967;6(5):625 - 32。
- 29.
Hahlbrock K, Zilg H, Grisebach H.绿豆幼苗异构酶促4,2 ',4 ' -三羟基查尔酮循环生成7,4 ' -二羟基黄酮的立体化学研究。生物化学学报,2000,15(1):13-8。
- 30.
Muir SR, Collins GJ, Robinson S, Hughes S, Bovy A. Ric De Vos CH, van Tunen AJ, Verhoeyen ME:矮矮树查尔酮异构酶在番茄中的过表达导致果实中黄酮醇含量增加。生物技术学报。2001;19(5):470-4。
- 31.
van Tunen AJ, Mur LA, Recourt K, Gerats AG, Mol JN。矮牵牛花药中类黄酮基因表达的调控与调控:Po突变的分子基础。植物细胞。1991;3(1):39。
- 32.
伯布利斯IE,温克尔-雪莉B.酶的相互作用拟南芥类黄酮生物合成途径。自然科学进展,1999;26(3):339 - 344。
- 33.
Winkel-Shirley B.类黄酮生物合成:遗传学、生物化学、细胞生物学和生物技术的丰富多彩的模型。植物科学进展。2001;26(2):457。
- 34.
黄伟,曾松,肖刚,魏刚,廖松,陈杰,孙伟,吕华,王艳。淫羊藿黄酮类活性成分的生物合成及其调控机制。植物科学进展(英文版);
- 35.
周玲,王勇,任玲,史强,郑波,苗凯,郭旭Ps-CHI1,牡丹查尔酮异构酶基因的同源物(牡丹),降低转基因烟草花色素沉着的强度。中国生物医学工程学报,2014;29(3):344 - 344。
- 36.
Larkin MA, Blackshields G, Brown NP, Chenna R, McGettigan PA, McWilliam H, Valentin F, Wallace IM, Wilm A, Lopez R,等。Clustal W和Clustal X 2.0版本。生物信息学。2007;23(21):2947 - 8。
- 37.
Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. MEGA5:利用最大似然,进化距离和最大简约方法进行分子进化遗传学分析。分子生物学杂志,2011;28(10):2731-9。
- 38.
Bjellqvist B, Hughes GJ, Pasquali C, Paquet N, Ravier F, Sanchez J-C, Frutiger S, Hochstrasser D.多肽在固定化pH梯度中的聚焦位置可以通过其氨基酸序列预测。Electrophor。1993;14(1):1023 - 31所示。
- 39.
Bjellqvist B, Basse B, Olsen E, Celis JE。比较来自不同人类细胞类型的蛋白质的二维图的参考点,定义在pH值尺度,其中等电点与多肽组成相关。Electrophor。1994;15(1):529 - 39。
- 40.
Gasteiger E, Hoogland C, Gattiker A, Se D, Wilkins MR, Appel RD, Bairoch A. expasy服务器上的蛋白质鉴定和分析工具。入:沃克JM,编辑。蛋白质组学协议手册。托托瓦:新泽西州:Humana出版社;2005.p . 571 - 607。
- 41.
Laemmli英国。在T4噬菌体头部组装过程中结构蛋白的切割。Nat。1970;227(5259):680 - 5。
- 42.
李志刚,李志刚,李志刚。一种简单而通用的植物基因转移方法。Sci。1985;227(4691):1229。
- 43.
涂艳,刘峰,郭东,范玲,朱智,薛艳,高艳,郭敏。茉莉酸甲酯刺激下两个红花化学分型系黄酮3-羟化酶基因及类黄酮积累的分子特征。中国生物医学工程学报。2016;16(1):132。
致谢
作者非常感谢新疆农业科学院为XHH002红花株系提供种子。我们感谢Felix Hauser(加州大学圣地亚哥分校)对手稿的批判性阅读。
资金
国家自然科学基金(81473300和81973421)、上海市自然科学基金(13ZR1448200)和郭明明“863”高新技术专项(2008AA02Z137)资助了本工作。MLG发起了该研究项目。DDG、YG、BXH负责基因功能验证。FL和XLJ负责基因克隆。
作者信息
从属关系
贡献
MLG提出了该研究项目。大部分研究由DDG和YG进行(生物信息学分析、植物转化、植物表型分析和代谢物分析)。FL用RACE方法克隆该基因。BXH和XLJ负责样品采集。FWM进行了对接分析。HZ进行代谢组学分析。DDG在MLG的帮助下分析数据并撰写文章。所有作者均已阅读并批准最终稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
附加文件
附加文件1:
图S1。(A). chalconenaringenin标准曲线。(B).柚皮素标准曲线(C).催化反应前20 min中chalconararingenin的消耗量和柚皮素的产量。(TIF 2080 kb)
附加文件2:
图S2。(A)转基因烟草株系黄酮相关基因的相对转录丰度。(B)转基因烟草单株鲜重(μg/mg)中黄酮类化合物含量。误差条为均值±标准差,数据代表生物重复。*p≤0.05,**p≤0.01。(TIF 5762 kb)
附加文件3:
图S3。(A)转红花个体黄酮相关基因的相对转录丰度。(B)红花各株系黄酮通路相关化合物的相对含量变化。误差条为均值±标准差,数据代表生物重复。*p≤0.05,**p≤0.01。(TIF 190kb)
附加文件4:
表S1。总结了负离子模式下的代谢物差异离子。(xlsx51 kb)
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
郭东,高勇,刘飞,刘伟。et al。整合分子特征和代谢产物特征CtCHI1在Carthamus tinctoriuslBMC植物生物学19,376(2019)。https://doi.org/10.1186/s12870-019-1962-0
收到了:
接受:
发表:
关键字
- Carthamus tinctoriusl
- 模式植物
- 类黄酮生物合成
- 查耳酮异构酶
- 代谢数据库