- 研究文章
- 开放获取
- 发布:
核基因组中叶绿体DNA入侵的细胞遗传学和基因组组织分析芦笋officinalisL.在性染色体演变中提供进化复杂性和信息性的签名
BMC植物生物学体积19文章编号:361(2019)
摘要
背景
叶绿体DNA向核基因组的转移是植物中常见的过程。这些转移形成质体dna的核整合体(NUPTs),被认为是基因组进化的驱动力,包括性染色体的进化。本研究对雌雄异株植物基因组中的NUPTs进行了研究芦笋officinalis为了研究该物种核基因组内NUPTs的特征及其与性染色体进化的关系,对该物种进行了系统分析。
结果
共检测到3155个NUPT插入,约占核基因组的0.06%。约有45%的nupt是分组举办的。这些集群来自于各种各样的进化事件。Y染色体中NUPTs数量最多,比例最大,表明NUPTs在性染色体上积累较多。nupt广泛分布于所有的染色体中,并有部分区域倾向于这种插入。NUPTs在Y染色体47 kb区域密度最高;超过75%的区域被nupt占领。进一步的细胞遗传学和序列比对分析表明,该区域可能是性染色体的着丝粒区域。另一方面,Y染色体雄性特异性区域(MSY)及其邻近区域没有NUPT插入。
结论
这些结果表明NUPTs参与了水稻基因组的形成答:officinalis通过复杂的过程。唐氏可能在Centromere染色体的Centromere成型中发挥重要作用答:officinalis,但与MSY的形成无关。
背景
植物细胞中除了核基因组外,还有两个细胞器基因组,即线粒体基因组和质体基因组。这三个基因组在每个细胞内共存,DNA在这些细胞部分之间水平转移,特别是从细胞器到细胞核[1那2].细胞细胞DNA进入细胞核的广泛序列转移产生了线粒体DNA(NUMTS)的塑性DNA(NUPTS)或核整合体的核整合体。nupts和Numts为基因组复杂性提供了新的原材料,并且显着促进了染色体演变[3.那4.那5.那6.].numt广泛存在于动物、植物、真菌和原生生物中[7.那8.],而NUPTs只存在于植物中。numt已被广泛研究[9.那10]但尚未在一些植物中探讨他们的研究11].
nupt广泛分布于植物物种中[8.那12].nupt的大小、丰度、年龄、结构和染色体定位等特性已经在几种模式植物中进行了分析[13那14].在拟南芥,大约18%的蛋白质编码基因来自叶绿体[13].在栽培稻,大型爆破痕迹主要分布在焦化物附近。此外,在整合体液DNA后,这些痕迹迅速碎片,淋上,其中大多数在一百万年内从核基因组中丢弃。这些数据在o .漂白亚麻纤维卷表明植物核基因组正处于叶绿体基因组频繁整合和快速清除的动态过程中,而长着丝粒间区域是NUPTs更替的热点[15].NUPTs的染色体分布、与转座因子(TEs)的相关性和进化动力表现出种特异性。虽然NUPTs的整合机制尚未完全阐明,但DNA双链断裂的非同源端连接和微同源端连接很可能是细胞器DNA片段整合到细胞核的机制[16那17].nupt也在一些植物中进行了细胞遗传学分析。例如,利用荧光原位杂交(fluorescence in situ hybridization, FISH)技术,利用14个叶绿体基因组重叠片段,在10个玉米自交系中检测到了NUPT位点。nupt的集成是最近才出现的,而且经常发生,因为不同线路之间的分布模式差异很大[18].然而,涉及生物信息学分析和细胞遗传学实验的系统分析尚未在大多数植物物种中进行。
与TES类似,插入的纽扣可以导致基因组的不稳定性,例如引起染色体结构重排,尺寸膨胀和异质色素化[6.那19那20.].因此,nupt整合到核基因组中增加了遗传多样性,具有生理和进化的重要性[21那22].几项研究表明,唐氏优先积聚在雌雄植物的性染色体中[23那24那25].例如,在SILON LATIFOLIA.其中,含有部分叶绿体基因组的细菌人工染色体(BAC)克隆与Y染色体杂交较强,但与X染色体和常染色体的杂交较弱。这些nupt的积累可能是导致Y染色体大小扩大的主要因素之一美国latifolia[23].在另一个小型模型植物中,番木瓜,在Y染色体(MSY)的雄性特异性区域中积累的末末节和Y的雌雄同体特定区域H(HSY)是X染色体的12倍,是全基因组平均水平的4倍。这种差异是由增殖引起的,通常是在MSY和HSY中与nupt周围的逆转录转座子共扩增[25].这些研究表明,NUPTs的积累与植物性染色体的进化密切相关。
雌雄异株植物中,芦笋officinalis是一种经济上和营养上都很重要的蔬菜作物,在世界各地都有种植。单倍体基因组大小为1308 Mb,含2N= 2X= 20 chromosomes [26那27].性别类型答:officinalis由一对同形性染色体X和y决定,最近检测到一个大小为847 kb的小MSY [28].此外,YY基因型('超级男性')也是可行的[29].这些特征表明性染色体答:officinalis处于性染色体进化的早期阶段。的年轻性染色体答:officinalis可以用作有用的模型来表征性染色体进化的早期阶段。最近测序答:officinalis基因组为整个基因组内nupt的系统研究提供了独特的机会。本研究应用生物信息学方法分析了NUPTs的数量、分布格局和年龄,并通过FISH分析对NUPTs的细胞染色体定位进行了研究。所得数据可为进一步研究黄芩的基因组结构和性染色体演化提供有价值的依据答:officinalis.
结果
核基因组中的陈述鉴定答:officinalis
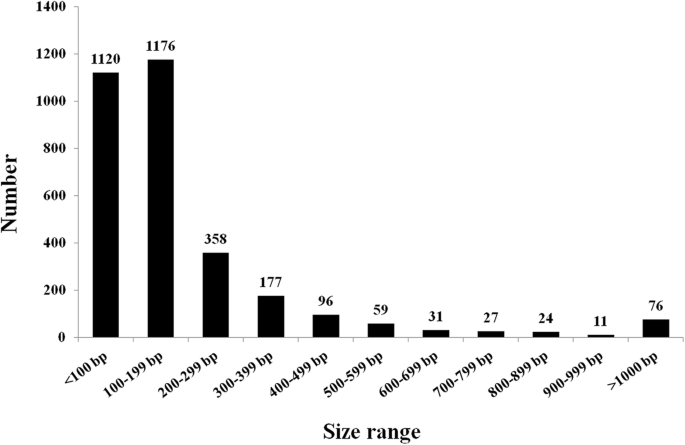
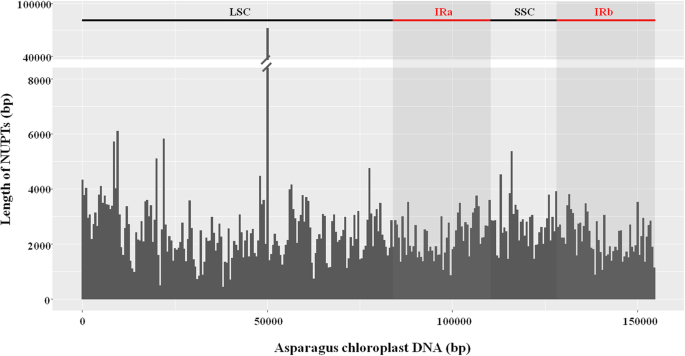
我们分析了整合在核基因组中的叶绿体DNA序列答:officinalis.共鉴定出3155个NUPT插入。这些nupt的累积长度为703058 bp,约占总核基因组的0.06%。这些核序列与叶绿体DNA (cpDNA)序列的一致性为71.81 ~ 100%。NUPT序列长度从33到8733 bp不等,平均长度为223 bp(附加文件1:表S1)。nupt按尺寸的分布如图所示。1.一般情况下,NUPTs的数量随着尺寸范围的增大而急剧下降。大约72.8%的nupt的大小为33-199 bp,其中1120个小nupt小于100 bp, 1176个nupt的大小在100 - 199 bp之间。共有76个NUPTs(2.4%)的长度大于1000 bp。在这些长nupt中,19个定位于染色体1,即Y染色体[28].
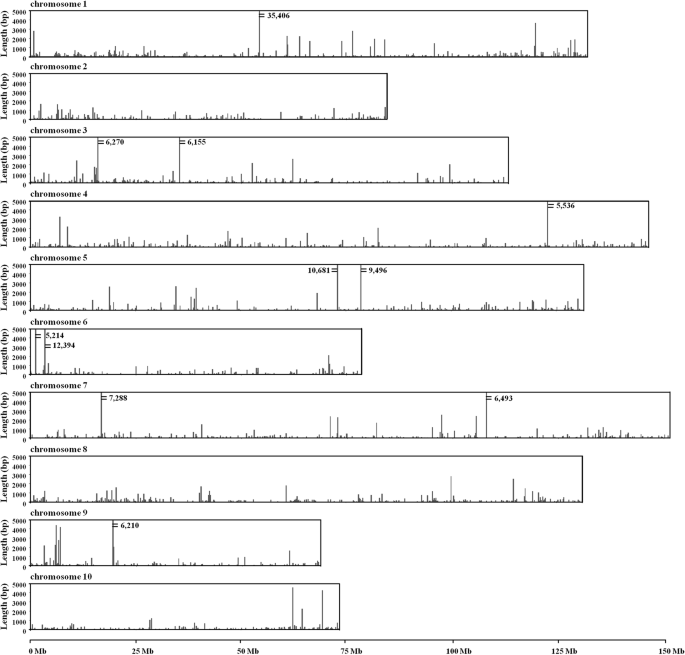
分析NUPT序列在不同染色体上的分布及其位置(表1)1,无花果。2).染色体1(Y染色体)呈现了最大的少数比例和最大的检测到的延误。总共440次氮在染色体1上定位,占检测到的总南部的13.95%。染色体1中的纽扣的总长度为114,469 bp,占其规模的约0.09%。染色体1的氮气总和标准长度(86,463bp / 100mb)大于其他染色体的总长度。相比之下,染色体10具有最少的曲线(169)。然而,考虑到染色体尺寸,染色体4被最低比例覆盖(〜0.047%)(表1).
在宏观尺度上,nupt广泛分布于每条染色体(图。2).然而,不同的染色体区域之间的曲线变化。一些染色体区域清楚地利用纽约术。在200kb的每个滑动窗口中,在11个区域中发现了NUPT的总长度> 5000bp(图。2)染色体3、5、6和7各有两个这样的区域,而染色体1、4和9各有一个这样的区域。NUPT覆盖范围最高的区域在1号染色体内,在200 kb的区域内检测到35406 bp的NUPT序列。该区域的详细分析显示NUPTs主要分布在小于47 kb的区域(位点:54519138-54,565,922)。在这个46,785 bp的区域中,有35328 bp的序列被检测为nupt。
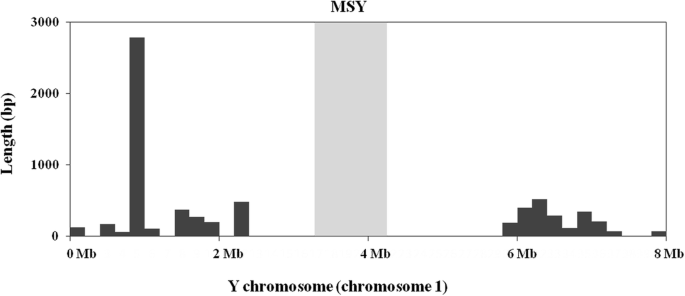
有趣的是,虽然Y染色体(染色体1)的NUPT插入数量最多,但MSY(位点:3411433 - 4258,465)及其邻近区域没有NUPT插入(图1)。3.),这意味着NUPTs可能不参与中MSY的形成答:officinalis.
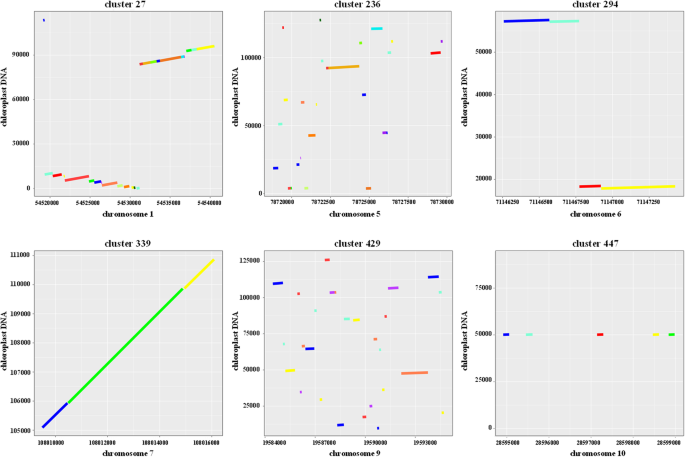
曲调的染色体分布分析显示它们通常是聚集的。然后,我们进行集群分析,其中如果它们分配两个谷物,如果它们被分隔小于5kb,则分配给一个群集。我们发现,在这种集群中举办了1396年,或近45%的芦笋少年(附加文件1:表S1)。这些nupt被划分为484个簇,其中最大的簇(236簇)包含26个nupt,位于第5染色体。另一个大簇(簇27)在染色体1中有25个nupt(附加文件1:表S1)。如图2所示,在点图中可视化一些典型的簇。4..观察到表示不同插入模式的氮簇。这些簇通常通过独特的插入事件来源,该事件受到后续插入,导致分开但紧密地连接为簇(图。4.集群,339)。NUPT簇也经常来自叶绿体DNA的几个区域,每个区域在进化过程中经历重排(图)。4.,簇27和294)。我们还识别出由各个氮素插入组织的一些氮簇,其源自几乎相同的叶绿体DNA区域(图。4.集群,447)。此外,一些NUPT聚类来自叶绿体DNA的不同区域,使这些区域成为NUPT插入的染色体热点(图1)。4.(236和429)。
一些典型NUPT簇的点图分析。NUPT集群名称报告在每个地块的顶部。X轴表示所示染色体的位置。Y轴为叶绿体序列坐标。图中的彩色线表示不同的NUPT序列。关于这些区域的详细信息报告在附加文件中1:表S1
nupt的分布根据它们来自叶绿体基因组
了解叶绿体DNA转移到核基因组的模式答:officinalis,分析了nupt的起源。在3155个NUPTs中,571个来自反向重复(IR), 2166个来自大单拷贝区域(LSC), 418个来自小单拷贝区域(SSC)(表1)2).IR,LSC和SSC的尺寸分别为52,942,83,821和17,901bp,而源自IR,LSC和SSC的纽扣的密度分别为11 / KB,26 / KB和23 / KB(表2).显然,来自LSC区域的dna更频繁地转移到核基因组。进一步分析发现,LSC区域的高频率转移主要是由于一个小区域,大小为286 bp(位点:50003 - 50288)。共有443个nupt来自该地区,占nupt总数的14%。nupt的累积长度为65,490 bp。显然,286-bp区域的序列向核基因组的转移频率高得出乎意料(图5)。5.).
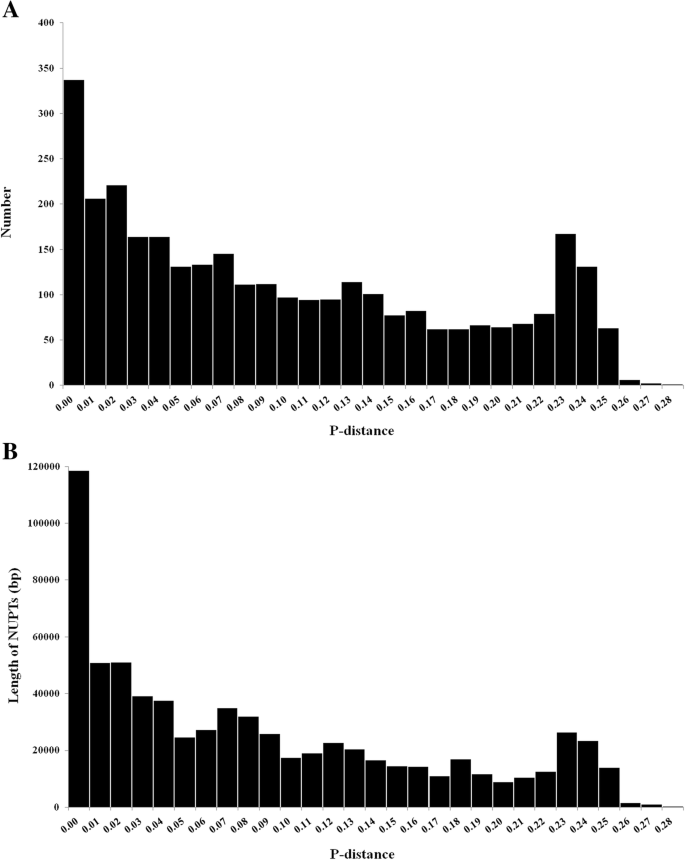
nupt的插入年龄
我们使用了P.- 计算每个氮的相对插入年龄计算。对于数字和累计的累积长度都有高峰P.- 0-0.01的间隔(图。6.),代表了最年轻的年龄。然后,随着增加P.- 除了在观察到一个小峰之外,抑制的数量和累积长度减少了P.- 0.23-0.25的抗静间隔(图。6.).该峰值主要是由于LSC区域内286-BP序列的高转移频率,因为来自286-BP区域的大多数谷数显示出大P.从0.23 - -0.25——远程。一般而言,NUPTs的演化时间随着NUPTs长度的减小而增加。的意思是P.-distance为0.10,长度在500 ~ 1000 bp之间的NUPTs为0.07,大于1000 bp的NUPTs仅为0.05。不同叶绿体DNA来源间nupt的平均插入年龄和平均插入长度略有差异。起源于LSC区域的NUPTs显示出平均值P.- 218 bp的0.11和平均长度。源自IR和SSC区域的延伸的平均插入时代略低,平均值略低P.- 达到0.09。源自IR和SSC区域的延伸的平均尺寸分别为238和225bp(表2).
染色体定位
共设计32对引物用于叶绿体片段重叠,平均期望片段长度约为4051 bp。最终成功扩增出28个叶绿体片段。其中,LSC区17个,IR区8个,SSC区3个。
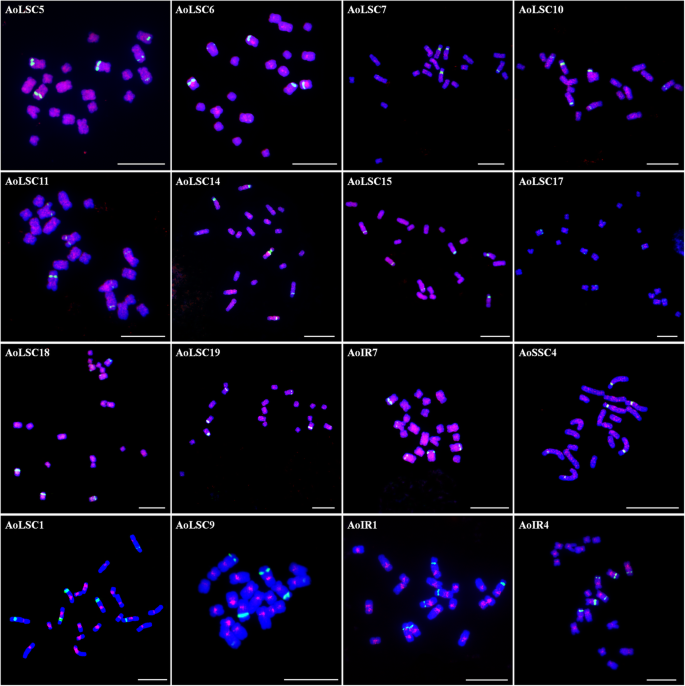
鱼分析表明,24个探针中的24个可能会产生稳定和清晰的信号答:officinalis染色体。其中,12个探针几乎分散在所有染色体上(图1)。7.).AoLSC5、AoLSC15、AoLSC18、AoLSC19和AoIR7在所有染色体上信号分布均匀,而AoLSC6、AoLSC7、AoLSC10、AoLSC11、AoLSC14和AoSSC4更倾向于沿着染色体成块分布(图)。7.).AoLSC17的弱信号主要出现在染色体的中丝粒区域。AoLSC1、AoLSC9和AoIR1主要分布在着丝粒区域,而AoIR4分布在所有染色体的着丝粒和邻近的着丝粒区域(图1)。7.).
其余8种探针在特定染色体上信号更强烈,其中AoSSC3和AoLSC4主要分布在2号染色体的着丝粒区域(图1)。8.).AoSSC3只定位于2号染色体的着丝粒区域(图。8.a、c),而AoLSC4除分布在2号染色体外,还分布在其他染色体上(图。8.B,D)。
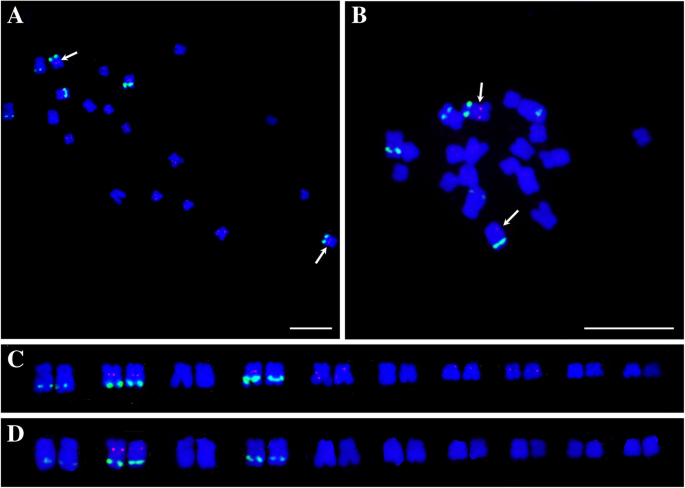
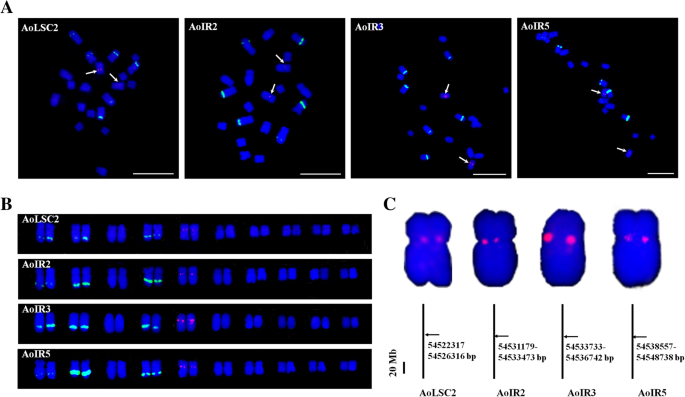
更重要的是,AoLSC2、AoIR2、AoIR3、AoIR5均定位于一对染色体的着丝粒区域(图1)。9.a).核型分析显示,4个探针定位于同一对染色体上,即5号染色体(图5)。9.b)。以前的研究报道说,核型分析中的一对染色体5是性染色体答:officinalis[30.那31].基因组序列分析表明,基因组序列中的第1号染色体为性染色体。因此,核型分析中的5号染色体对应于基因组序列的1号染色体。此外,我们还进行了BLAST分析,研究了来自于4个叶绿体DNA片段的NUPTs在基因组中的分布模式答:officinalis.结果表明,来源于这4个叶绿体DNA片段的NUPTs主要分布在基因组组装的第1染色体的相邻区域(图1)。9.c).这些序列集中在1号染色体54-55 Mb左右的区域,位于NUPTs密度最大的区域内,超过一半的区域被NUPTs占据(图)。2).结合鱼类结果,这些序列主要位于性染色体的焦化区,结果表明,54-55 MB区域应在性染色体的浓核区域内或周围的性别区内和性别的焦化区域染色体答:officinalis被大量的nupt占据。
讨论
在进化过程中,植物核基因组通过采集各种起源的新序列而成。这些序列包括TES和衍生自线粒体DNA(NUMT)和CPDNA(NUPTS)的序列。在许多植物基因组中被广泛研究了TES,并显示出在基因组进化中发挥各种作用,染色体重排,基因产生和调节[32那33那34那35那36].在动物中广泛研究了Nomts [7.那37那38].相比之下,nupt只存在于植物中,并且在有限的植物种类中得到了研究[6.那31那39].本研究以雌雄异株为对象,对nupt进行了系统分析和细胞遗传学定位答:officinalis.NUPTs在芦笋基因组中的比例(0.06%)在其他植物中观察到的范围内。例如,nupt在当前分析的核基因组中的百分比在0.024%Sorgum二色的年的0.222%o .漂白亚麻纤维卷[40].核基因组中NUPT的比例取决于DNA从质体迁移到核基因组的频率和核基因组中NUPT的损失率的平衡[39].基因组的组装和注释质量以及分析中使用的方法也影响着这一结果。
所有质体的DNA序列都可以转移到核基因组中答:officinalis,表明所有序列都是可转换的。然而,来自多样性基因组不同部分的转移频率变化。LSC区域显示出高的传输速率,这主要是由于286-BP序列具有意外高的转移频率。在大多数研究的植物基因组中,尽管转移率在叶绿体基因组的不同区域之间变化,但没有区域具有极低或高的转移频率[40].因此,在其他物种中还没有报道过这种小面积区域的高转移频率。这是因为几乎所有插入的nupt都来自于这286-bp区域,表现出相似且相对较大的特征P.-distance(范围为0.19-0.24,只有一个例外),我们推测这些NUPT插入是老化的,可能是由压力引起的突发事件形成的。事实上,实验研究证实,压力可以促进DNA从叶绿体迁移到细胞核。例如,在两个转基因烟草株系中,轻度热胁迫显著增加了DNA从叶绿体到细胞核的迁移[22].
nupt的聚类分析显示,近45%的nupt被组织成簇。进一步的点图分析表明,这些聚类可能是通过不同的进化路径形成的,这意味着基因组形成的机制复杂答:officinalis.相当多的NUPT序列可以通过一个或两个插入事件衍生出来,这些插入事件随后发生突变和染色体重排。突变和染色体重排可以将整合的cpDNA分裂成独立的,但共线性的区域。这种最初由较长的cpDNA插入和随后的片段形成的簇也在其他物种的细胞器插入中被广泛观察到[6.那41].假设长综合的唐氏抑制是年轻的和最近的插入,而短片段通常是旧插入[42那43那44].对nupt的相对年龄分析结果答:officinalis与这个假设一致。此外,通过在基因组中广泛观察到的共线簇区域很好地支持答:officinalis.在持续的进化过程中,长nupt可能会因突变和染色体重排而降解和破碎。成簇的nupt也经常来自叶绿体DNA的不同区域。这些染色体区域招募了大量NUPT序列,但未发现共线性模式。这些复杂的区域可能是通过不同的NUPT直接插入形成的,这意味着这些区域对cpDNA的整合更有吸引力。这种现象可能是由于染色体区域本身的特征,如该区域的凝结状态。例如,常呈现致密异染色质状态的中着丝粒区域是细胞器-细胞核DNA转移的热点[15].或者,这些区域可能是通过染色体重排而形成的基因组改组。
nupt在染色体内分布不均匀答:officinalis.一些区域更喜欢NUPT插入。我们发现了一个47kb的区域,其中超过75%被nupt占据。在其他分析的植物基因组中也发现了这种偏态分布模式。例如,在染色体中发现了一些富含nupt的区域Lotus对虾那o .漂白亚麻纤维卷, 和Zea Mays.[40].有报道称NUPTs经常分布在着丝粒间区域,特别是在基因组大小较小的物种中,而NUPTs在基因组大小较大的物种中分布广泛[6.].染色体组合中着丝粒的位置尚不清楚答:officinalis.然而,FISH分析显示,4条叶绿体DNA序列优先分布在所有染色体的着丝粒和邻近区域。另外,有4个片段专门位于性染色体的着丝粒区域,另外2个序列主要位于第2号染色体的着丝粒区域。这些结果表明nupt可能更多地聚集在着丝粒或着丝粒周围区域答:officinalis.着丝粒和上丝粒区域是细胞器-细胞核DNA转移的热点[15那39],由于这些区域的基因密度和高异铬蛋白含量的低[43那44那45那46],这可能为细胞器衍生DNA的整合提供一个稳定的基因组环境[6.那15].然而,Yoshida等人发现NUPTs也在染色体的远端区域积累[38].这一发现可能意味着,除了外着丝粒区域,其他区域也对nupt具有较高的耐药性。
生物信息学分析和细胞遗传学分析均表明答:officinalis包含更多的NUPTs。然而,MSY和邻近区域没有NUPT插入。这些结果表明NUPTs可能促进了性染色体的形成,但不参与MSY的进化。研究表明nupt优先积累在性染色体上R. acetosa.那美国latifolia, 和c .木瓜[23那24那25].这些转移的细胞器DNA序列可能是雌雄异株植物性染色体进化的驱动力之一。人们普遍认为性染色体来源于常染色体对[47].在进化过程中,性染色体可以招募大量的te和细胞器dna [25那48,这些序列可能促进性染色体的结构进化。例如,插入的te和细胞器dna可能导致性染色体的结构和形态分化,并导致Y染色体的变性[49].然而,对nupt在MSY地层中的作用研究甚少。在c .木瓜,在HSY和MSY中积累的少得多远远超过X染色体和自染素的那些25].此外,HSY与X之间的细胞器DNA插入稀疏,说明HSY重组后细胞器DNA积累受到抑制。NUPTs在木瓜中的积累导致了HSY的急剧扩张和重复积累[25].在这项研究中,NUPTS在MSY中没有积累答:officinalis,表明NUPTs没有促进MSY在该雌雄异株中的形成和重组抑制。性染色体答:officinalis很年轻。这些结果与番木瓜中的发现一致,其抑制了HST以重组后发生的纽约插入。然而,性染色体含有比常染素更少的污染物。这些氮气在性染色体的重组区域中的机制和功能目前尚不清楚。一个合理的解释是,尽管MSY之外的序列通常与性别测定无关,但由于连锁不平衡,它们也遭受性选择,并且与纯度染色物上的序列相比,可以显示出不同的进化速率。事实上,性别测定和性染色体进化的机制可能比传统上欣赏和通常不可预测的更复杂。例如,最近发现的基因MpFGMYB,它编码了苔类植物雌性分化的关键调控因子,定位于常染色体,而不是性染色体[50].充分了解涉及性别测定和性染色体进化的这些过程需要进一步研究和积累更多数据。目前,X染色体答:officinalis尚未被测序。将来,随着X染色体的序列可用,可以进行X和Y染色体的序列之间的比较。可以获得有关性染色体进化早期阶段的更多信息。
结论
综上所述,本研究提供了一个全面的NUPTs核基因组的生物信息学和细胞遗传学分析答:officinalis是一种重要的植物和模式雌雄异株植物,用于研究性染色体进化的早期阶段。超过45%的nupt被组织成紧密的簇,主要包括独立但共线的簇和混杂的插入簇,没有共线模式。NUPT起源的巨大差异表明,整合区域可能是通过不同的进化路径形成的,NUPT参与了基因组的形成答:officinalis通过复杂的机制。nupt较好地聚集在性染色体上答:officinalis但不是在MSY。因此,NUPTs可能在性染色体结构的形成中发挥作用,但与MSY的形成无关。我们的分析为人类的基因组结构和进化提供了新的见解答:officinalis为进一步研究性染色体进化奠定了基础答:officinalis.
方法
植物材料
答:officinalis以河南师范大学园地栽培的UC309为试验材料。原种子于2005年从河南益农公司购得。由种子产生的一株雄性和一株雌性植株杂交产生F1.F2从F1在这项研究中使用了相应的种子。
数据源
核基因组答:officinalis是下载https://www.ncbi.nlm.nih.gov/genome/?TERM=10978.[28,叶绿体基因组的序列是由Pires博士提供的[51].核和叶绿体基因组的尺寸分别为1187.54mbp和154,664bp。
检测NUPTs
NUPT插入是使用BLAST程序包中的BLASTN局部对齐工具来识别的。2.2.31),以叶绿体基因组DNA为查询序列,核基因组数据为数据库。参数说明如下:-dust no,E.-value阈值为1e-4,错配惩罚为−2,字大小为9。来源于叶绿体基因组IR区域的nupt的BLAST命中只被计数一次,因为这些BLAST命中都是在两个IR区域中获得的,不能被区分。根据滑动窗口长度分别为200 kb和500 bp,可以观察到分布在核染色体上的nupt和来自cpDNA的nupt。
延长年龄分布的估计
这P.计算每个NUPT与相应叶绿体DNA序列之间的距离,估算相对整合时间。P.=ND./N,在那里ND.核苷酸的数量有区别吗N是对齐核苷酸的数量[10].
PCR扩增CPDNA地区
总基因组DNA从幼叶中分离出来芦笋officinalis.获得代表整个叶绿体基因组的重叠片段答:officinalis,使用Oligo 7程序设计了引物[52].入门集列在附加文件中2S2:表。从总提取的基因组DNA中扩增出包含叶绿体DNA的32个叶绿体DNA PCR产物。PCR扩增片段经5’-和3’-端序列测序验证。
鱼的过程
如前所述,利用从根尖扩散的有丝分裂中期制备玻片、探针标记、杂交和图像处理[53].单个叶绿体区域用德克萨斯红-5-DCTP(以红色显示)标记,并以每种Ng /μl的最终浓度杂交。用荧光素-488-DUTP(以绿色显示)标记45s rdNA,进行双色鱼,以更好地表征染色体。在杂交和洗涤后,在可视化之前,用Vectashield(载体实验室,伯氏菌,加利福尼亚酯)处理所有载玻片。
数据和材料的可用性
核基因组答:officinalis是下载https://www.ncbi.nlm.nih.gov/genome/?TERM=10978..支持本研究结果的数据和植物材料可根据要求从通讯作者处获得。本研究中产生或分析的所有数据均包含在这篇发表的文章中。
缩写
- BAC:
-
细菌人工染色体
- cpDNA:
-
叶绿体DNA
- DAPI:
-
4',6-二氨基-2-苯基吲哚
- 鱼:
-
荧光原位杂交
- HSY:
-
雌雄同体的特定区域H
- 红外:
-
倒置重复
- LSC:
-
大的单拷贝区域
- MSY:
-
Y染色体的男性特异性区域
- numts:
-
线粒体DNA的核整合体
- NUPTs:
-
质体dna的核整合物
- SSC:
-
小单拷贝区域
- TES:
-
转座的元素
参考文献
- 1.
对混杂DNA没有基因组障碍;DNA序列在线粒体、叶绿体和核基因组之间的移动甚至比预期的还要多。科学。1984;224:970-1。
- 2.
马丁W,赫尔曼RG。基因从细胞器转移到细胞核:多少,发生了什么,为什么?植物杂志。1998;118:9-17。
- 3.
陈H,Yu Y,Chen X,Zhang Z,Gong C,Li J,Wang A.植物核基因组中的塑性DNA插入:位点,丰度和年龄,以及预测启动子分析。Funct综合基因组学。2015; 15:131-9。
- 4.
Lough AN, Roark LM, Kato A, Ream TS, Lamb JC, Birchler JA, Newton KJ。在玉米中,线粒体DNA转移到细胞核产生广泛的插入位点变异。遗传学。2008;178:47-55。
- 5.
Martis MM, Klemme年代,Banaei-Moghaddam,布拉特纳FR,玛咖J,污物T,朔尔茨U, Gundlach H,柳条T,Šimkova H,诺瓦克P,诺伊曼P, Kubalakova M,鲍尔E, Haseneyer G, Fuchs J,多尔žel J,斯坦N,梅耶尔KFX,胡本a .自私的超数染色体显示它的起源作为宿主基因组的马赛克和organellar序列。P美国Natl科学院。2012; 109:13343-6。
- 6。
Michalovova M, Vyskot B, Kejnovsky E.分析6种植物的细胞核质体和线粒体DNA插入(NUPTs和NUMTs):大小、相对年龄和染色体定位。遗传。2013;111:314-20。
- 7。
张德生,张德生,张德生。线粒体假基因:进化错位的见证人。趋势生态演变。2001;16:34 - 21。
- 8.
Hazkani-Covo E,Zeller RM,Martin W.分子策划者:线粒体DNA拷贝(Numts)中的测序核基因组。Plos Genet。2010; 6:E1000834。
- 9.
KO YJ,Kim S.九种植物种类核线粒体DNA片段分析:尺寸,分布和插入基因座。基因组学通知。2016; 14:90-5。
- 10.
Yoshida T,Furihata Hy,Kawabe A.核线粒体DNA的分析和影响植物物种整合模式的因素。基因类型系统。2017; 92:27-33。
- 11.
Smith博士,Crosby K, Lee RW。核质体DNA丰度与质体数量之间的相关性支持有限转移窗口假说。基因组生物学进化。2011;3:365-71。
- 12.
Ayliffe MA, Scott NS, Timmis JN。高等植物核基因组质体类dna序列分析。生物学报,1998;15:38 - 45。
- 13.
Martin W,Rujan T,Richly E,Hansen A,Cornelsen S,Lins T,Leister D,Stoebe B,Hasegawa M,Penny D.进化分析拟南芥,蓝藻和叶绿体基因组揭示质体系统发育和数以千计的蓝藻基因在核。P美国Natl科学院。2002; 99:12246-51。
- 14.
Shahmuradov Ia,Akbarova Yy,Solovyev VV,Aliyev Ja。大量的水稻核基因组的塑性DNA插入拟南芥.植物学报,2003;
- 15.
Matsuo M,ITO Y,Yamauchi R,Obokata J.水稻核基因组连续整合,洗牌,并消除叶绿体基因组,导致叶绿体 - 核DNA通量。植物细胞。2005; 17:665-75。
- 16。
用核外细胞DNA修补断裂的染色体。摩尔细胞。1999;4:873 - 81。
- 17。
郭X,阮S,Hu,Cai D,风扇L.叶绿体DNA插入水稻核基因组:涉及的基因,位点和衰老。Funct综合基因组学。2008; 8:101-8。
- 18。
Roark LM, Hui AY, Donnelly L, Birchler JA, Newton KJ。叶绿体DNA最近频繁插入玉米核染色体。Cytogenet Genome Res. 2010; 129:7-23。
- 19.
关键词:有花植物,核基因组,细胞器DNA,插入基因组研究》2005;15:616-28。
- 20。
Sheppard Ae,Timmis JN。核基因组中塑性DNA的不稳定性。Plos Genet。2009; 5:E1000323。
- 21。
黄迪,亚历弗夫马,蒂米斯JN。通过在烟草中新转移的叶绿体DNA产生的简单和复杂的核基因座。P美国Natl科学院。2004; 101:9710-5。
- 22.
王D,刘依德,朱美。环境胁迫增加了植物细胞质细胞器DNA进入细胞核的量。P美国Natl科学院。2012; 109:2444-8。
- 23.
关键词:水稻,Y染色体,叶绿体,DNA序列积累SILON LATIFOLIA..遗传。2006;128:167 - 75。
- 24.
植物叶绿体DNA在Y染色体上的强积累Rumex acetosa和SILON LATIFOLIA..Cytogenet Genome Res. 2014; 142:59-65。
- 25.
木瓜性染色体中细胞器DNA的积累。分子基因。2013;288 - 277。
- 26.
关键词:植物,核DNA,核DNAPlant Mol Biol Rep. 1991; 9:28 - 18。
- 27.
埃里森jh。芦笋繁殖。在:Bassett MJ,编辑器。育种蔬菜作物。Westport:Avi;1986. p。523-68。
- 28。
Harkest A,周J,Xu C,Bowers Je,Der Hulst RV,Ayyampalayam S,Mercati F,Riccardi P,Mk,Kakrana A,Tang H,Ray J,Groenendijk J,Arikit S,Mathioni Sm,Nakano M,山H,Telgmann-Rauber A,Kanno A,Yue Z,Chen H,Li W,Chen Y,Xu X,Zhang Y,Luo S,Chen H,Gao J,Mao Z,Ping JC,Luo M,Kudrna D,Wingra,meyers bc,yi k,kong h,lavrijsen p,sunseri f,sunseri f,malavigna a,ye y,leebens-mack jh,陈g。芦笋基因组脱落在杨y染色体的起源和演变上。NAT Communce。2017; 8:1279。
- 29。
植物的性别:性染色体正从迷雾中浮现。趋势麝猫。2004;20:432-8。
- 30.
Löptien H.芦笋性染色体对的鉴定(芦笋officinalisl .)。Z Pflanzenzuechtung。1979;82:162 - 73。
- 31。
由多胚种子产生的单倍体芦笋officinalis学报,2002;589:217-21。
- 32。
关键词:水稻,根发育,逆转录转座子,微rna海绵Elife。2017;6:e30038。
- 33。
关键词:转座因子,植物基因组,结构,功能,进化植物生物学杂志。2014;65:505-30。
- 34.
在芦笋中,逆转录转座子的增殖与雌雄异株的进化相一致。2016; 6:2679-85。
- 35.
Li SF,Su T,Cheng GQ,Wang Bx,Li X,Deng Cl,Gao Wj。与植物重复序列和表观遗传学相关的染色体演变。基因。2017; 8:290。
- 36.
关键词:卵菌,反转录转座子,转录聚合,植物暴徒的DNA。2017;八4。
- 37.
Hazkani-Covo E,GRATR D.人类和黑猩猩Numt演变的比较分析。mol Biol Evol。2007; 24:13-8。
- 38.
Schiavo G,Stillacci Mg,Ribani A,Bovo S,Roman-Ponce Si,Cerolini S,Bertolini F,Bagnato A,Fontanesi L.少量线粒体DNA序列插入土耳其(吐绶鸡)核基因组:家族谱系中的进化分析和信息能力。动物麝猫。2018;49:259 - 64。
- 39.
E, Leister D. NUPTs在测序的真核生物和他们的基因组组织与NUMTs的关系。《生物学报》2004;21:1972-80。
- 40.
植物叶绿体DNA片段的基因组整合模式。DNA研究》2014;21:127-40。
- 41.
Schiavo G,Hoffmann Oi,Ribani A,Utzeri vj,Ghionda MC,Bertolini F,Geraci C,Bovo S,Fontanesi L.猪核基因组中线粒体DNA插入的基因组景观提供了梭菌外加剂的进化特征。DNA Res。2017年; 24:487-98。
- 42。
黄春英,Grünheit N, Ahmadinejad N, Timmis JN, Martin W.最近叶绿体和线粒体基因组的突变衰变和年龄转移到被子植物核染色体。植物杂志。2005;138:1723-33。
- 43。
关键词:水稻,10L染色体,基因组序列,基因重复,叶绿体DNA插入Mol Gen Genomics. 2002; 267:713-20。
- 44。
拟南芥基因组倡议。开花植物基因组序列分析拟南芥蒂利亚纳.大自然。2000;408:796 - 815。
- 45。
关键词:植物,着丝粒,反转录转座子,细胞遗传学暴徒的DNA。2011; 2:4。
- 46.
廖勇,张旭,李斌,刘涛,陈杰,白忠,王敏,史杰,瓦林建国,Wing RA,蒋军,陈明栽培稻和选用brachyantha基因组揭示了选择驱动的基因从着丝粒区域逃逸。植物细胞。2018;30:1729-44。
- 47.
Ming R,Bendahmane A,Renner SS。土地植物中的性染色体。Annu Rev植物Biol。2011; 62:485-514。
- 48.
通过对一个具有巨大Y染色体的物种的雄性和雌性基因组的转座因子和细胞器DNA的分析,发现了独特的Y着丝粒。植物j . 2016; 88:387 - 96。
- 49.
李顺丰,张国军,袁建华,邓春林,高文杰。重复序列和表观遗传修饰:不可分割的伴侣在植物性染色体的进化中起着重要作用。足底。2016;243:1083 - 95。
- 50.
Hisanaga T,Okahashi K,Yamaoka S,Kajiwara T,Nishihama R,Shimamura M,Yamato Kt,Bowman JL,Kohchi T,Nakajima K.A独联体-作用的双向转录开关控制着苔类的性二型性。EMBO j . 2019; 38: e100240。
- 51.
Steele PR, Hertweck KL, Mayfield D, mccain MR, Leebens-Mack J, Pires JC。从大量平行序列中恢复的数据的质量和数量:以芦笋和禾本科为例。中国生物医学工程学报,2012;
- 52.
Rychlik W. OLIGO 7引物分析软件。方法《Mol Biol》2007;402:35-60。
- 53.
李顺丰,郭亚杰,李建军,张德兴,王宝祥,李宁,邓春林,高文杰。雌雄异株菠菜基因组中转座因子和卫星dna的分布(菠菜oleraceal .)。移动DNA。染色体res。2019; 10:3。
确认
作者感谢Pires博士和Hertweck博士(国家进化综合中心,达勒姆,北卡罗来纳州,美国),用于提供氯化物DNA序列答:officinalis.
资金
这项工作是财务支持由中国国家自然科学基金(31470334和31470334),创新研究团队项目(科技)河南大学(17 irtsthn017)和基础河南省高校青年教师ggjs(2016 - 051)。各基金支持实验材料费、论文改稿费、论文发表费等。资助者在研究设计、数据收集和分析、决定出版或手稿准备方面没有任何作用。
作者信息
隶属关系
贡献
SL分析数据并撰写稿件,HZ和JY参与了数据分析,JL, JW, RD和KJ进行了实验,CD和NL在数据分析方面提供了有益的建议并对稿件进行了实质性修改,WG设计了项目并对稿件进行了修改。所有作者阅读并批准最终稿件。
通讯作者
道德声明
伦理批准和同意参与
本研究中使用的植物材料在世界各地广泛使用,采集植物样本不需要许可证。植物材料按照中国河南师范大学生命科学学院的制度指南进行维护。本文未包含任何人类或动物参与的研究,也未涉及任何濒危或受保护物种。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
权利和权限
开放获取本文在知识共享归属4.0国际许可条款下发布(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介中不受限制地使用、分发和复制,只要您给予原作者和来源适当的信任,提供知识共享许可的链接,并说明是否有更改。“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
李,科幻小说。那Li, JR., Wang, J.et al。核基因组中叶绿体DNA入侵的细胞遗传学和基因组组织分析芦笋officinalisL.在性染色体演化中提供进化复杂性和信息性的签名。BMC植物杂志19,361(2019)。https://doi.org/10.1186/s12870-019-1975-8
已收到:
公认:
发表:
关键字
- 叶绿体DNA
- 芦笋officinalis
- Y染色体雄性特异性区域(MSY)
- 塑性DNA的核整合体(唐氏)
- 性染色体