摘要
背景
同时发生的冷、旱胁迫会在形态、生理和分子水平上改变植物的反应,最终影响作物的生产,而不是单一的胁迫。了解作物对复合胁迫的响应对于提高作物的耐受性和维持作物生产是必要的,特别是在复合胁迫频繁发生的地区。本研究以番茄品种“金陵美玉”为例,对其抗寒抗旱结合的机理进行了初步探讨。
结果
在对照、寒冷、干旱和联合处理42 h后,番茄出现了生理和遗传反应。与对照相比,在低温、干旱和复合胁迫下,植株取样40 min后失水速率显著降低。H的含量2O2、玉米素核苷(ZR)和褪黑素均显著高于对照组。与对照相比,单干旱胁迫和复合干旱胁迫诱导了ABA和IAA的积累。单独的低温和复合应力显著降低了PSII的最大量子效率(Fv/ F米), PSII的量子产额(F问”/ F米”)和电子传递速率(ETR)。总共有7141、1850和7841个基因参与了对寒冷、干旱及其组合的应激反应。对胁迫诱导基因的功能分析为复合胁迫的复杂调控机制提供了更深入的认识。采用实时荧光定量PCR (qRT-PCR)方法检测12个基因的表达水平。
结论
我们发现胁迫特异性基因的表达随着生理变化而变化,这表明生理反应和遗传反应之间存在密切的串扰,特别是在复合胁迫下。本研究为研究番茄(金陵美玉)叶片对非生物胁迫的复杂调控机制基因提供了新的认识。
一句话总结
冷、旱复合胁迫是番茄以冷为主的一种新状态胁迫。
背景
在世界上寒冷和干旱的地区,植物遭受低温和缺水的影响[1,2,3.].据报道,冷胁迫会对多种作物的生长发育产生负面影响,如水稻[4],小麦[5]和番茄[6,7].同样,干旱胁迫对包括番茄在内的作物来说也是一种自然挑战,会对产量产生不利影响[1,8,9].由于全球环境的快速动态变化,在田间条件下生长的植物越来越频繁地面临各种非生物胁迫的组合[10],例如寒冷和干旱。涉及寒冷和干旱胁迫的研究通常单独研究压力,而很少有研究将寒冷和干旱结合在一起[10,11].
番茄(茄属植物lycopersicumL.)是世界上重要的经济作物,对一系列非生物胁迫,特别是极端温度和干旱敏感。据报道,寒冷和干旱会使番茄产量下降,而全球气候变化又加剧了这种损害[12,13].寒冷和干旱同时对作物生长产生不利影响,影响生产力[11,14,导致经济损失。在中国很多地区,番茄幼苗在立春和冬末容易出现低温亏水现象。例如,由于寒冷和干旱胁迫,品种“金陵美玉”在江苏的推广受到限制。因此,确定像“金陵美玉”这样的番茄如何应对寒冷和干旱的双重胁迫是至关重要的。
相对含水量(Relative water content, RWC)是植物水分状况的定量指标[6].冷胁迫(3℃处理16 h)和干旱胁迫(5 d不灌溉)导致番茄RWC显著下降[6,15],与水土流失相关。外源H可提高冷胁迫下番茄叶片RWC2O2预处理(6].番茄植株可以通过增加NADPH氧化酶介导的H来维持获得性耐受性2O2温度压力,例如热压力[16].干旱胁迫导致活性氧(ROS)增加,通过信号转导途径与H2O2作为二级信使,与ABA(脱落酸)密切相关[17].植物激素如ABA, IAA(生长素),GA3.(赤霉素)、ZR(玉米素核苷)和褪黑素在提高植物对非生物胁迫的耐受性方面起着重要的动态作用[11].例如,寒冷和干旱胁迫都能诱导植物体内ABA的积累[17,18].先前的研究清楚地证明了IAA在寒冷/干旱介导的植物生长中的重要性,植物生长受生长素载体的极地部署和运输的调控[19,20.].植物在非生物胁迫下GA生物合成的减少导致DELLA蛋白介导的生长抑制[21].相反,转基因高羊茅的耐寒性增强,ZR含量增加农杆菌基因(22].褪黑素是植物中的天然抗氧化剂,可有效去除ROS [23].此外,由于光合作用对非生物胁迫的敏感性较高,净光合速率较低,Fv/ F米(PSII的最大量子效率)在低温(3±2°C) 16 h的番茄中观察到[7]和干旱不灌溉5天[15].一般来说,在低温和干旱胁迫下,植物在与ROS相关的激素、抗氧化反应和信号转导等方面有许多共同的反应。(11].然而,与单独胁迫相比,低温干旱复合胁迫下番茄激素含量的变化尚不清楚,这些变化对番茄光合作用和生长的影响尚需进一步研究。
由于RNA测序(RNA-seq)效率的提高,转录组分析已经确定了许多涉及植物寒冷或干旱反应的基因,如水稻[24],玉米[25]和番茄[26,27].低温诱导植物基因表达发生深刻变化[3.]和干旱[28].例如,参与信号转导的基因(如丝裂原活化蛋白激酶或MAPK)和渗透胁迫信号感知的基因(如MYB29)都对寒冷和干旱条件有反应[11].此外,据报道WRKY转录因子在应对寒冷和干旱等非生物胁迫中发挥重要作用[29,30.].有些基因仅受寒冷诱导,而有些基因仅受干旱诱导[11].寒冷和干旱胁迫的一个关键特征是ABA的积累,ABA可以促进植物的一系列反应,如ABA依赖的基因表达[18,31].
作物生理学和基因组学为提高植物耐受性提供了有用的知识(Tuberosa & Salvi, 2006)。据我们所知,番茄在低温和干旱双重胁迫下的生理和分子反应很少。本研究通过转录组分析,探讨了低温、干旱条件下番茄叶片水分状况、光系统II (PSII)活性、抗氧化剂、植物激素和关键基因的响应机制。以番茄品种“金陵美玉”为例,从叶片生理和分子水平阐明低温、干旱及其组合对番茄的影响,并阐述单株和组合胁迫响应之间的关系。我们的假设是:1)与以寒冷为主要胁迫因素的个体胁迫相比,寒冷和干旱的组合胁迫产生了不同的应激反应;2)冷、旱复合胁迫对番茄叶片生理反应的影响由信号转导和光合电子传递相关基因调控。本研究采用植物生理和转录相结合的方法,综述了番茄‘金陵美玉’对复合胁迫的响应。
结果
生理反应
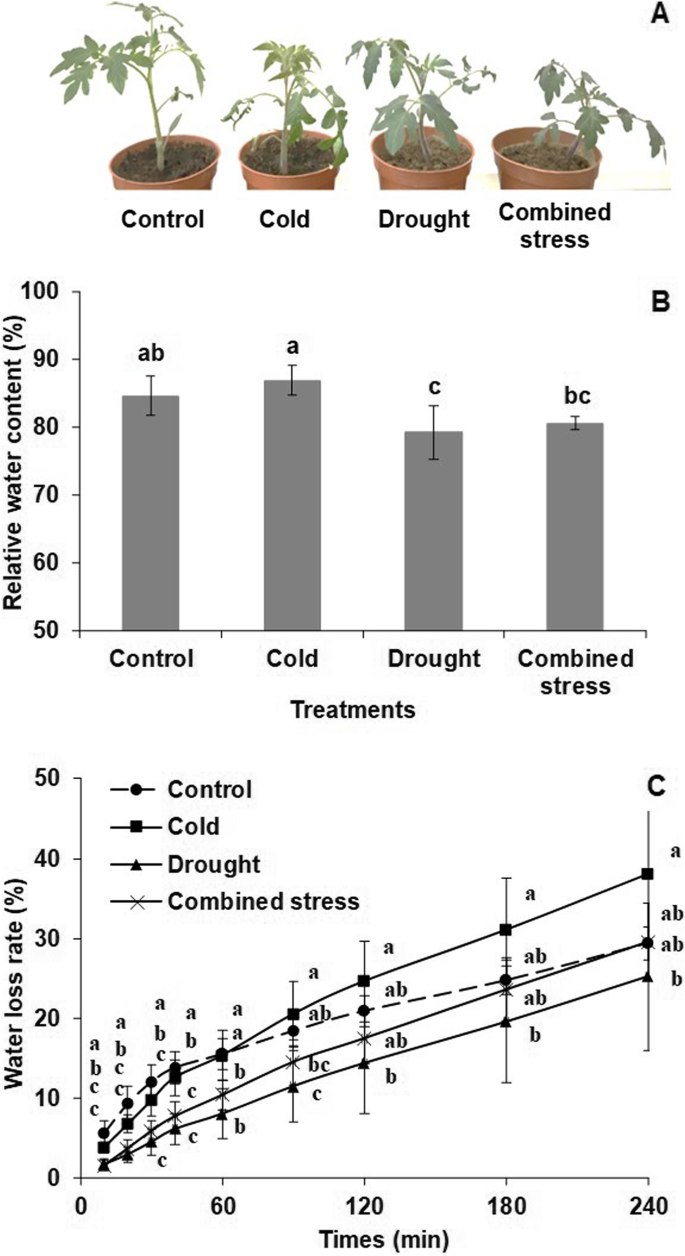
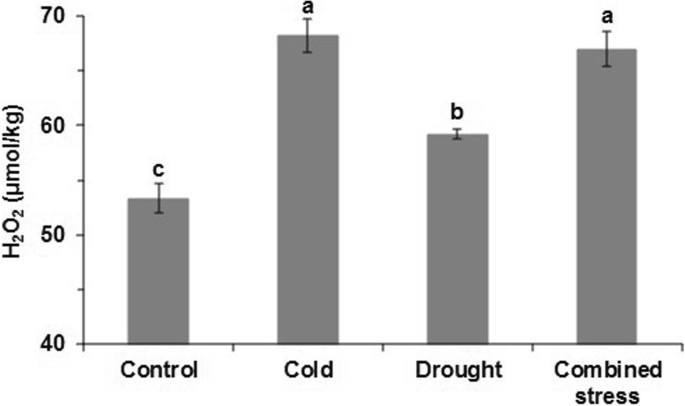
在三种胁迫下处理42小时后,番茄的生长速度比对照组慢(图2)。1a).干旱胁迫后叶片RWC显著低于对照,而冷胁迫后叶片RWC显著高于干旱和复合胁迫(图2)。1b).采样后10 min至40 min,所有应力暴露后的失水率均显著低于对照,但在后期(120 min至240 min)这种趋势消失(图2)。1c).此外,所有胁迫处理均显著提高了H2O2叶片中H含量最高2O2低温和复合应力诱导的含量(图;2).
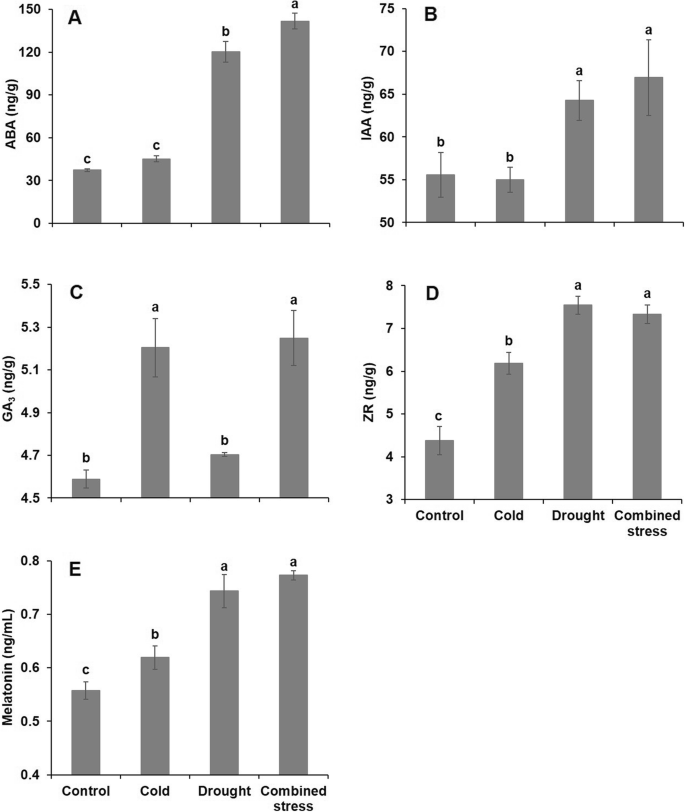
不同胁迫处理对植物激素的调节差异很大。ABA和IAA的含量只有在单独干旱或低温胁迫下才会升高(图2)。3.a, b),复合胁迫后ABA含量高于单一干旱胁迫后。GA的内容3.只有在单独暴露于寒冷和联合应激时,才会上调(图;3.c),而ZR和褪黑素在所有应激处理下均上调,但在干旱单独或与寒冷联合作用时上调幅度更大(图2)。3.d, e)。
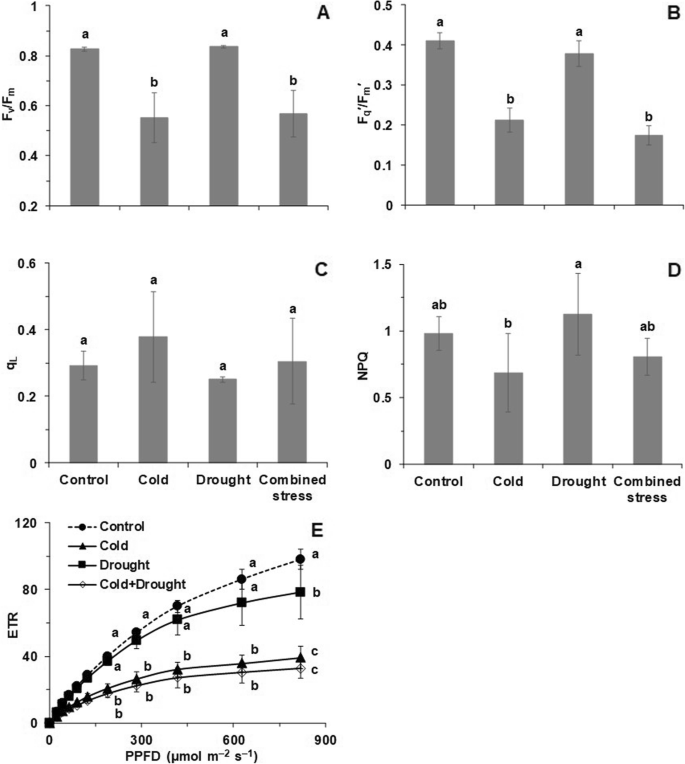
Fv/ F米和F问”/ F米”(PSII的量子产率)在冷胁迫和复合胁迫下均显著低于对照和干旱胁迫(图2)。4a, b), ql(PSII中心开放分数)表现出与NPQ(非光化学猝灭)相反的模式,冷增加,干旱减少l但这里的变化阻止了任何显著差异的建立(图。4c).胁迫42 h后,干旱处理增加NPQ,寒冷处理降低NPQ,使冷、干旱处理与对照和复合胁迫之间存在显著差异(图2)。4d). PPFD(光合光子通量密度)在0 ~ 822 μmol m范围内,低温处理和复合胁迫处理的电子传递速率(ETR)显著低于对照−2年代−1(无花果。4e).相比之下,只有在PPFD最高时,干旱处理的ETR显著低于对照(图5)。4e)。
分子反应
4个cDNA文库经对照、冷、旱处理及组合处理后,分别产生25,082,239、29,815,250、28,754,112和27,195,304个清洁reads, GC百分比分别为43.3、43.0、42.8和43.3%。各自的Q30.番茄对对照、寒冷、干旱及其组合反应的百分比(测序错误率< 0.1%)分别为92.9、93.0、92.5和91.9%,表明测序数据符合进一步分析的条件。在四个处理中,总共有50,162,479,59,630,499,57,508,225和54,390,609个reads被鉴定出来3.:表S1)。从头组装预测了755个新的基因,这些基因尚未出现在COG (clustered of Orthologous Groups,http://www.ncbi.nlm.nih.gov/COG/), GO(基因本体联盟,http://www.geneontology.org/京都基因与基因组百科全书,http://www.genome.jp/kegg/), KOG(真核同源群,http://www.ncbi.nlm.nih.gov/KOG/), Pfam(同源蛋白家族,http://pfam.xfam.org/Swissprot(一个手动注释的、无冗余的蛋白质序列数据库,http://www.uniprot.org/基因的进化谱系:非监督的同源群,http://eggnog.embl.de/)和nr(无冗余蛋白序列数据库,ftp://ftp.ncbi.nih.gov/blast/db/)(附加文件1:图S1)。共识序列的eggNOG功能分类显示,大部分基因的功能仍然未知,许多基因在“L”(复制、重组和修复)、“Q”(次生代谢产物的生物合成、转运和分解代谢)和“T”(信号转导机制)部分发挥作用(附加文件)1:图S1)。
RNA-seq提供了番茄在不同胁迫下差异表达基因的概述(图2)。5).与对照相比,低温、干旱和复合胁迫后番茄的7141、1850和7841个基因的表达量分别存在显著差异(图2)。5a).复合胁迫诱导的44个和7886个基因的表达量分别与单株寒冷和干旱显著不同(图2)。5a).在显著差异表达基因(差异表达基因)中,只有1165个基因存在于对照与复合胁迫中,而对照与冷胁迫和对照与干旱胁迫中(图5)。5b).总体而言,低温胁迫下番茄基因的表达模式与复合胁迫相似(图2)。5c)。
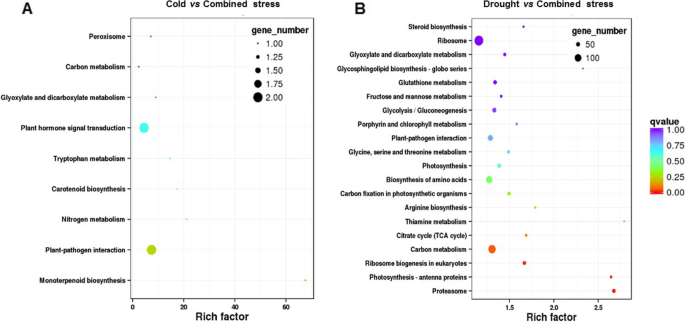
复合胁迫后番茄中水平差异显著的基因在碳代谢、氨基酸生物合成、植物-病原菌相互作用等方面发挥作用(附加文件)2:图S2)。与冷胁迫相比,联合胁迫下表达的基因在植物激素信号转导、植物-病原菌相互作用等方面发挥了作用。6a).在核糖体、碳代谢、氨基酸生物合成、植物-病原菌相互作用、糖酵解/糖异生等方面对联合胁迫反应的基因不同于干旱。6b)。
京都基因和基因组百科全书,http://www.genome.jp/kegg)差异表达基因(DEGs)通路富集分析(一个)寒冷vs综合压力和(b)干旱与综合压力
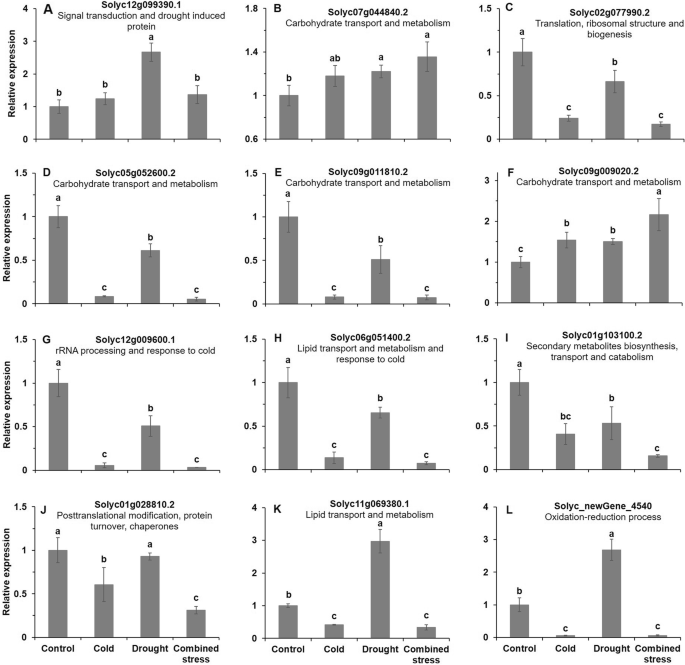
采用qRT-PCR(实时荧光定量PCR验证)检测12个RNA-seq表达水平显著变化的基因的表达水平。与对照相比,干旱胁迫显著提高了Solyc12g099390.1的表达水平(图2)。7a).干旱和复合胁迫后番茄中Solyc07g044840.2基因的表达量显著高于对照(图2)。7b).寒冷、干旱和复合胁迫显著降低了Solyc02g077990.2、Solyc05g052600.2、Solyc09g011810.2、Solyc12g009600.1、Solyc06g051400.2和Solyc01g103100.2的表达量,而显著提高了Solyc09g009020.2的表达量(图5)。7我)。与对照相比,低温和复合胁迫后,番茄中Solyc01g028810.2、Solyc11g069380.1和Solyc11g069380.1和Solyc_newGene_4540 (Solyc_newGene_4540)的表达量显著下降,而干旱胁迫后,番茄中Solyc11g069380.1和Solyc_newGene_4540的表达量显著升高(图5)。7j-l)。这12个被验证的基因的主要功能是信号转导、碳水化合物运输和代谢、翻译以及对干旱和寒冷的翻译后修饰(图。7).12个基因的详细信息在附加文件中显示3.:表S2。
讨论
植物通过一系列生化、生理和遗传过程来应对寒冷和干旱胁迫[11,32].分子和基因组研究表明,寒冷和干旱胁迫会诱导具有多种功能的基因[32].了解与胁迫信号网络和胁迫耐受性有关的生理和基因机制是作物改良和生产的关键[3.,11].
番茄在胁迫下的生理反应与关键基因密切相关
植物低温缺水的常见表型症状是暴露期间叶片萎蔫、生长迟缓甚至死亡[3.,17].根据我们以往的研究[15,33],干旱胁迫降低了番茄的RWC和失水速率(图;1).植物在冷胁迫下往往表现出水分胁迫症状,这是由于冷胁迫抑制了水分的吸收和流失[6,17].由此可见,番茄叶片在3种胁迫下的萎蔫和卷曲与低RWC和失水速率的降低相关,尤其是在取样后的早期。
除改变水分状态外,H2O2在3种胁迫下,观察番茄的含量(图2)。2),说明低温和缺水条件导致ROS生成。在选定的压力水平下,冷却温度会产生更多的H2O2而不是干旱。我们发现,参与ROS反应的基因的表达水平在三种胁迫下发生了显著变化(附加文件)3.:表S3)。例如,与对照相比,低温胁迫下番茄叶片中Solyc02g086050.2和Solyc12g070270.1的表达量显著降低了1.76和1.48,而Solyc02g078360.2的表达量显著提高了1.29。类似地,响应冷胁迫的3个ROS相关基因在组合胁迫下表达水平呈现相同的趋势。此外,干旱条件下番茄叶片中Solyc10g044550.1基因的表达量较对照下调了−1.61。H2O2Cruz de Carvalho(2008)指出,这可能是在寒冷和/或干旱胁迫下开启番茄应激反应基因的信号的一部分[17]及亚达夫(2011)[3.].H2O2可以作为氧化爆发信号,激活植物的应激防御系统[34].在本研究中,寒冷、干旱和复合胁迫分别诱导了829、175和907个在信号转导机制中起作用的基因(附加文件)3.:表S4)。许多转录因子基因是胁迫诱导的,寒冷和/或干旱胁迫在信号转导途径中诱导了不同的转录调控机制[35,36].因此,在本研究中,寒冷、干旱和复合胁迫诱导的转录因子如基本结构域亮氨酸拉链(bZIP)家族、MYB家族和WRKY家族成员。这些转录因子在番茄中可以调控多种胁迫诱导基因,并建立相应的基因网络以应对各种胁迫条件。
此外,植物激素是各种信号通路的重要组成部分[37],例如,ABA可以刺激H .2O2在警卫室和H轮流2O2aba介导的气孔关闭[38].干旱和ABA反应之间存在显著的相互作用,因为超过一半的干旱诱导基因也由ABA处理诱导[36].考虑到干旱和复合胁迫后番茄ABA含量的增加(图;3.),表明水分缺乏与ABA增强之间存在正相关关系。ABA和IAA(促生长激素)在所有胁迫下对番茄的反应相似,这与冷休克处理小麦的结果一致[39].在寒冷等非生物胁迫下,GA含量的降低和信号通路对植物生长产生不利影响[21].然而,与我们的研究结果相反,低温诱发了GA3.不考虑干旱压力的积累,这可能是由于其他激素反应的影响。耐寒性增强的ipt转基因株系ZR含量比未转化株系高65 ~ 400% [22],表明所研究的番茄通过增加ZR含量来积极响应胁迫条件。以往研究发现,褪黑素参与机体ROS和ABA的调节马吕斯受干旱影响的物种[38].干旱胁迫下番茄褪黑素含量的增加有助于缓解相对较低的H对ROS的损害2O2与冷应力和复合应力的含量比较。因此,建议通过诱导产生H2O2植物激素是植物应对非生物胁迫的关键机制。ABA合成是植物在非生物胁迫下最快速的反应之一,触发ABA诱导基因的表达[40].我们发现在植物激素信号转导中起作用的120、43和125个基因分别受寒冷、干旱和复合胁迫的显著调控(附加文件)3.:表S5)。这部分可以通过胁迫条件下番茄植物激素含量的显著变化来解释(图2)。3.).
番茄的PSII活性表现出明显的变化,特别是在暴露于寒冷和复合胁迫后。根据Baker和Rosenqvist (2004) [41],正如预期的那样,干旱本身并不影响Fv/ F米也没有在生长PPFD测量的荧光猝灭参数(图。4).然而,任何涉及10°C温度的胁迫均显著降低Fv/ F米运行效率F问”/ F米”,在增长PPFD。PSII的氧化态和ql在PPFD的生长过程中,天线中的光控散热NPQ受到显著影响(图。4).但是,从ETR的快速光响应曲线中可以看出,PPFD增加的处理之间的差异越来越大,这意味着在接近光饱和时,在中间PPFD所看到的趋势变得明显不同。同时,我们发现在低温、干旱和复合胁迫条件下,分别有36个、4个和38个表达水平显著不同的基因参与光合电子传递(附加文件)3.:表S6)。番茄在低温和复合胁迫下的这种生理和遗传反应,如果保护机制不能消耗过多的能量,又会导致ROS的产生和氧化损伤,这部分解释了为什么低温和复合胁迫下的番茄具有较高的H2O2内容比干旱。
寒旱复合胁迫是一种以寒为主的新型胁迫状态
Deng et al.(2012)发现干旱引起的生理变化与寒冷引起的生理变化有很大不同[42].本研究通过RWC、失水率、H等生理参数证实了这一点2O2含量,植物激素含量和叶绿素荧光。Sales et al.(2013)发现单是干旱胁迫(11天不灌溉)就会严重影响甘蔗的ETR [43].我们发现,与干旱相比,低温和复合胁迫对ETR的影响更大,因为光呼吸的增加可能保护了ETR免受干旱的损害。更重要的是,在大多数情况下,低温和复合胁迫之间的生理反应是相似的,这表明低温在低温和干旱结合时起主导作用。由于水分亏缺是一个渐进的过程,需要时间才能发生,因此在温度胁迫前三天停止灌溉。冷的主导作用可能是由于番茄对干旱的反应缓慢,水分逐渐亏缺,而对低温的反应非常快。
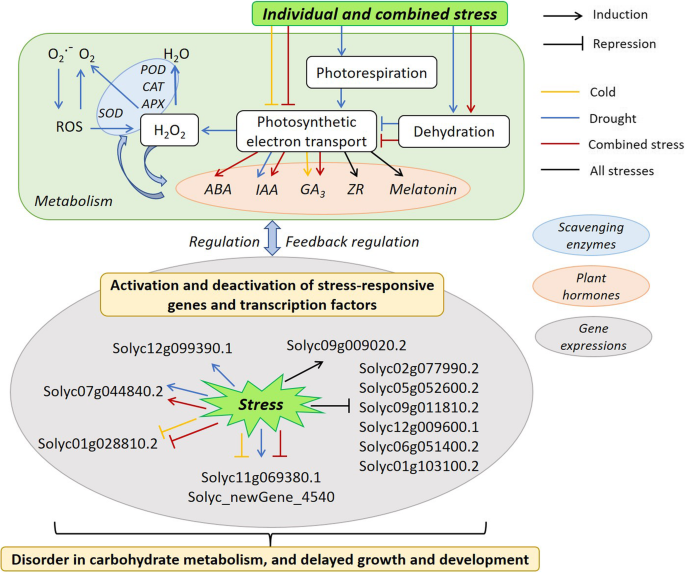
只有10%的干旱诱导基因也被寒冷诱导[36],这与我们的研究结果一致,即个别低温和干旱条件下番茄中有少数基因是共享的。除了生理反应外,干旱对4111和3457个基因的调控与寒冷相比有所上升和下降(图2)。5),表明它们对两种胁迫的反应有不同的分子策略。寒冷和干旱诱导了常见的胁迫诱导基因,而其中一种胁迫则特异性地诱导了一些基因[44].相比之下,还发现了一些冷胁迫和复合胁迫之间表达水平不同的基因(图。5).例如,参与ROS反应的基因在低温和复合胁迫下表达水平相似,但在干旱和复合胁迫下则表现出不同的表达模式(附加文件)3.:表S3)。与单独的寒冷和干旱相比,分别有3个和852个特异基因参与响应联合胁迫的信号转导机制(附加文件)3.:表S4)。这就解释了为什么在联合胁迫和低温条件下,少数基因在番茄中发挥作用(图2)。6).在我们之前的研究中,干旱胁迫与热胁迫结合时起主导作用[15].显然,当干旱和寒冷结合时,情况就不一样了,这是由应对寒冷和干旱的复杂生理和分子网络所表明的。低温和干旱联合胁迫导致番茄脱水,光合电子传递下降,ROS代谢紊乱,激素水平升高,胁迫响应基因和转录因子激活(图2)。8).干旱胁迫对光合电子传递的影响小于低温胁迫和复合胁迫,这是因为干旱胁迫增加了光呼吸作用,同时降低了H2O2和遗传算法3.内容(无花果。8).如图所示,重叠基因对番茄个体和组合胁迫的反应。8强调它们在增强植物对非生物胁迫的耐受性方面的重要性。通过比较,分别对个体胁迫和组合胁迫反应的特异性基因表明,组合胁迫是一种新的状态,特异性反应基因被激活(图2)。8).
结论
总的来说,冷、旱联合胁迫是番茄‘金陵美玉’幼苗的一种新的胁迫状态,而不是单纯的单独胁迫的添加。番茄叶片生理与ROS、植物激素、信号转导、光合电子转运和碳水化合物转运相关基因表达之间的串扰导致碳水化合物代谢紊乱,从而导致非生物胁迫下植物生长发育延迟(图2)。8).本研究以番茄“金陵美玉”为例,揭示了植物叶片抗寒、抗旱及其组合的生理和分子机制。
方法
植物材料和生长条件
以江苏省农业科学院选育的番茄品种“金陵美玉”单粒种子为试验材料。幼苗在26/18℃(14 h/10 h,昼夜)和相对湿度50-60%的气候箱(RDN-560E-4,东南仪器有限公司,中国宁波)中生长。光强为300 μmol m−2年代−1白光LED(中国宁波东南仪器有限公司)提供的PPFD在工厂的水平。播种后每5 d用水灌溉,播种后15 d每3 d用营养液灌溉。营养液是根据日本花园试验配方[Ca(NO3.)2•4 h2O, 945毫克L−1;先3., 809毫克L−1;NH4H2阿宝4, 153毫克L−1;MgSO4•7 h2O, 493毫克L−1;FeSO4•7 h2O, 13.9 mg L−1;Na2-EDTA, 18.6 mg L−1;H3.薄3., 2.86 mg L−1;MnSO4•4 h2O, 2.13 mg L−1;ZnSO4•7 h2O, 0.22 mg L−1;CuSO4•5 h2O, 0.08 mg L−1;(NH4)6莫7O24•4 h2O, 0.02 mg L−1].21天生的均匀植株被转移到塑料盆(直径11厘米,高9厘米)中,每盆一株。塞盘和塑料盆都填充泥炭基质(Pindstrup,丹麦)。三天后,我们停止灌溉一半的幼苗。将27日龄的灌溉植株在26°C和10°C、300 μmol m连续处理42 h−2年代−1分别作为对照和冷胁迫处理植株。未灌溉的27日龄植株在26℃和10℃、300 μmol m条件下处理42 h−2年代−1分别以干旱和复合胁迫处理植物。
叶片相对含水量和失水速率
4次重复处理42小时后,从植株顶部剪下最后一片完全展开的叶片。立即测量叶片的鲜重(FW)。叶片浸泡在dd-H中2O,室温孵育4小时。从dd-H中取出叶片后,测定叶片膨大重量(TW)2O和吸干叶片表面的水分。叶片干重(DW)在80°C下干燥24 h。叶片相对含水量(RWC)以%计算为RWC = [(FW - DW)/(TW - DW)]*One hundred.在室温下测定切后即刻(0 min)、10 min、20 min、30 min、40 min、60 min、90 min、2 h、3 h、4 h叶片的FW。刈割后叶片失水率x min % = [(FW .0分钟- - - - - -弗兰克-威廉姆斯x分钟) / FW0分钟]*One hundred.
叶H2O2内容
每个处理取三个植株的最后一个完全展开的叶片作为三个重复进行测量。用紫外分光光度计(TU-1810,北京浦肯野通用仪器,北京,中国)在560 nm处测定吸光度,采用亚铁氧化二甲酚橘色法。2 g叶片样品在4℃下于2 mL预冷丙酮中接地,10,000 r min离心−14°C 10分钟。然后,将1 mL上清液与2.25 mL四氯化碳和0.75 mL三氯甲烷充分混合。然后,5 mL ddH2加入O,混合均匀,5000 r min离心−11分钟。将1 mL上清液与2 mL A、B试剂(体积比1:10)混合均匀。试剂A含量为3.3 mmol L−1硫酸亚铁,3.3 mmol L−1硫酸铵和412.5 mmol L−1硫酸。B的含量为165 μmol L−1二甲酚橙和165 mmol L−1山梨糖醇。
叶片植物激素含量
取顶部最后一片完全展开的叶片,重复3次,立即冷冻于液氮中测定ABA、IAA、GA3.ELISA法测定ZR、褪黑素含量。如He(1993)所述[45]和Yang等(2001)[46], 2 mL预冷80% (v/v)甲醇加1mmol L−1加入BHT(丁基羟基甲苯)。样品均质,10000 r min离心−14°C。然后,上清液通过C-18固相萃取柱(Waters, Milford, MA),在N中干燥2.样品在0.01 mol L中溶解−1PBS (pH 7.4)水平测定植物激素含量。通过添加已知量的标准激素,百分率回收率的ABA, IAA, GA3.和ZR计算。样品均质后,采用植物MT ELISA试剂盒(蓝派生物,上海,中国)测定褪黑素含量。将标准品和样品加入孔中,加入100 μL HRP辣根过氧化物酶。用胶条覆盖样品,在37℃下孵育1小时。对井进行抽气和清洗,重复5次。在孔中分别加入50 μL底物A和50 μL底物B,在37℃黑暗中孵育15 min。在孔中加入50 μL的停止缓冲液。在15分钟内使用微量滴度板阅读器记录450 nm处的光密度(O.D.)。样品中的褪黑素含量是通过比较标准曲线中样品的od值来计算的。
叶片叶绿素荧光
处理42 h后,每处理4株植株顶部最后一片完全展开的叶片被用于测量。将幼苗置于黑暗中20 min后进行淬火分析。Fv/ F米F问”/ F米”,问lPPFD为285 μmol m时的NPQ值−2年代−1使用MINI-PAM-II (Walz, Eiffeltrich, Germany)测量,并根据Murchie和Lawson(2013)的总结计算[47].将叶片暴露在0 ~ 1496 μmol m的10个不同光化水平下30 s,得到了叶片ETR的快速光响应曲线−2年代−1PPFD(0、24、45、65、90、126、190、285、420、630和822 μmol m)−2年代−1)使用MINI-PAM-II。在测量过程中避免了叶片的主脉。
叶样本文库构建及rna序列分析
每次处理42 h后,从植株顶部收集第一片完全展开的叶片,重复3次。在测序前,12个样品立即在液氮中冷冻并保存在−80°C。使用总植物RNA提取试剂盒(Karroten, Beijing, China)提取总RNA。RNA浓度和RNA完整性检测使用NanoDrop 2000 (Thermo Scientific, DE, USA)和RNA Nano 6000的Agilent Bioanalyzer 2100系统(Agilent Technologies, CA, USA),以确保合格的RNA-seq样品。文库使用NEBNext UltraTM RNA文库Prep Kit for Illumina (NEB, USA)构建。详细地,mRNA被捕获聚t寡聚附着磁珠(NEB,美国)。使用NEBNext第一链合成反应缓冲液(NEB, USA)随机分割mrna。以mRNA为模板,通过添加缓冲液、dNTPs、RNase H和DNA聚合酶I合成cDNA的第一条链。使用AMPure XP系统(Beckman Coulter, Beverly, USA)纯化cdna,修复远端,连接尾部和适配器。利用AMPure XP珠筛选片段大小,通过PCR富集获得cDNA文库。
利用Agilent Bioanalyzer 2100 (Agilent Technologies, Palo Alto, CA)和qPCR (BioMarker Technologies Co. Ltd., Beijing)对cDNA文库质量进行检测,以确保cDNA文库符合测序要求。然后,利用HiSeq X-ten(北京生物标记技术有限公司)对合格的cDNA文库进行测序。
番茄‘金陵美玉’叶片差异表达基因的鉴定及功能注释
四种处理植物的RNA-Seq数据来自3个生物重复。从原始读取中删除空读取、适配器序列和低质量序列以获得干净的读取。样本中基因的转录丰度由每千碱基片段外显子每百万片段(FPKM)计算。利用生物信息学方法测定了4种处理对番茄DEGs的响应。筛选DEGs的标准为fold change≥2,false discovery rate (FDR) < 0.05。在GO和KEGG数据库的基础上,对deg进行功能分析。
中存在的验证
使用Trizol试剂(Invitrogen, CA, USA)提取总rna。使用Prime Script RT reagent Kit (TaKaRa,大连,中国),将合格的总rna在42°C 60 min, 70°C 15 min,并在Eppendorf Mastercycler Gradient (Mastercycler®ep realplex,汉堡,德国)中逆转录为cDNA,冷藏3 min。使用SYBR Premix Ex TaqTM (Takara,大连,中国),在Eppendorf实时PCR仪(Mastercycler®ep realplex,德国汉堡)中,在95°C 2 min, 40个循环,95°C 15 s, 60°C 15 s和72°C 20 s进行cDNA扩增。反应重复三次,分为三次技术重复和三次生物重复。用2−ΔΔCt方法EF1α作为内参基因。qRT-PCR引物使用引物5.0 (primer - e Ltd., Plymouth, UK)设计,见附加文件3.:表S7。
数据分析和数据访问
采用SPSS 16.0 (SPSS Inc.)软件对对照、寒冷、干旱和复合胁迫下植物生理参数进行方差分析。芝加哥,伊利诺伊州,美国)。采用方差分析(ANOVA)对4个处理下番茄12个基因的qRT-PCR数据进行分析。利用超几何分布(生物标记技术有限公司,北京)对DEGs进行KEGG通路富集分析。显著性差异在P< 0.05。测序数据已提交给NCBI,登录号为SRP156535https://www.ncbi.nlm.nih.gov/sra/SRP156535.
数据和材料的可用性
测序数据已提交给NCBI,登录号为SRP156535https://www.ncbi.nlm.nih.gov/sra/SRP156535.
本研究期间或分析期间的种子、植物材料和数据集可根据合理要求从通讯作者处获得。
缩写
- 阿坝:
-
脱落酸
- 度:
-
差异表达基因
- DW:
-
干重
- ETR:
-
电子传递速率
- 罗斯福:
-
错误发现率
- FPKM:
-
每千碱基的片段数,每百万片段数
- F问”/ F米”:
-
光系统的量子产额
- Fv/ F米:
-
光系统的最大潜在量子效率
- 弗兰克-威廉姆斯:
-
鲜重
- 遗传算法3.:
-
赤霉素
- 走:
-
基因本体联盟
- 国际宇航科学院:
-
生长素
- KEGG:
-
京都基因和基因组百科全书
- NPQ:
-
non-photochemical淬火
- PPFD:
-
光合光子通量密度
- PSII:
-
光系统II
- 问l:
-
开放PSII中心的比例
- 存在:
-
实时定量PCR
- RWC:
-
相对含水量
- TW:
-
浮夸的重量
- ZR型:
-
玉米素核苷
参考文献
- 1.
Cattivelli L, Rizza F, Badeck FW, Mazzucotelli E, Mastrangelo AM, Francia E, Marè C, Tondelli A, Stanca AM。作物抗旱性的改善:从育种到基因组学的综合观点。农田作物决议2008;105:1-14。
- 2.
吴国强,吴国强。甘蔗水分关系及其对水分亏缺的响应。农田作物决议2005;92:185-202。
- 3.
植物耐冷胁迫机制研究。复习一下。农业可持续发展,2011;30:605-20。
- 4.
Hussain S, Khan F,曹伟,吴玲,耿敏。种子启动对亚最佳温度和营养供应条件下水稻幼苗活性氧中间产物产生和解毒的影响。前沿植物科学,2016;7:439。
- 5.
李霞,蔡娟,刘峰,周强,戴涛,曹伟,姜东。冬季增温对小麦春季低温胁迫的影响更大。植物生长学报,2015;
- 6.
İşeri ÖD, Körpe DA, Sahin FI, Haberal M.过氧化氢预处理增强低温胁迫下番茄根系氧化应激反应。植物学报。2013;35:1905-13。
- 7.
Starck Z Niemyska B Bogdan J Tawalbeh RNA。番茄植株对低温胁迫的反应与营养或磷饥饿有关。植物土壤。2000;226:99-106。
- 8.
李文杰,李志强,李志强,等。干旱条件下作物生产研究进展及展望。中国生物工程学报。2005;47(2):344 - 344。
- 9.
Petrozza A, Santaniello A, Summerer S, Di Tommaso G, Di Tommaso D, Paparelli E, Piaggesi A, Perata P, Cellini F.干旱胁迫下番茄植株对Megafol®处理的生理响应:现象和分子方法。科学通报。2014;174:185-92。
- 10.
非生物胁迫,野外环境和胁迫组合。植物科学进展,2006;11:15-9。
- 11.
Hussain HA, Hussain S, Khaliq A, Ashraf U, Anjum SA, Men S, Wang L.作物低温和干旱胁迫:影响,相声和潜在的管理机会。植物科学,2018;9:393。
- 12.
番茄抗环境胁迫育种。入:编辑Kalloo G。番茄的遗传改良。柏林:施普林格;1991.p . 153 - 65。
- 13.
朴永杰,叶克尼克Z, Sakamoto A, DeNoma J, Yuwansiri R,村田N,陈thh。番茄中甜菜碱合成的基因工程可以保护种子、植物和花免受低温伤害。植物J. 2004; 40:474-87。
- 14.
Tommasini L, Svensson JT, Rodriguez EM, Wahid A, Malatrasi M, Kato K, Wanamaker S, Resnik J, Close TJ。脱氢酶基因表达为低温和干旱胁迫提供了一个指标:大麦的转录组分析(大麦芽l .)。功能与整合基因组学。2008;8:387-405。
- 15.
周瑞,于旭,Ottosen CO, Rosenqvist E,赵玲,王勇,余伟,赵涛,吴哲。干旱胁迫对3个番茄品种复合胁迫的影响均大于热胁迫。BMC植物生物学,2017;17:24。
- 16.
孙敏,姜峰,岑斌,文杰,周勇,吴志刚。环境:呼吸突发氧化酶同源物依赖性H2O2和叶绿体H2O2在驯化后的恢复过程中保持获得的耐热性是必不可少的。中国生物医学工程学报,2018;
- 17.
干旱胁迫和活性氧:产生,清除和信号。植物信号与行为。2008;3:156-65。
- 18.
Liu Q, Kasuga M, Sakuma Y, Abe H, Miura S, Yamaguchi-shinozaki K, Shinozaki K.在拟南芥中,EREBP/AP2 DNA结合域的转录因子DREB1和DREB2分别分离了干旱和低温响应基因表达的两条细胞信号转导途径。《植物科学》1998;10:1391-406。
- 19.
生长素:冷应激反应的调节因子。植物学报。2013;147:28-35。
- 20.
史华,陈琳,叶涛,刘霞,丁凯,陈忠。拟南芥生长素含量调控提高了抗旱性。植物化学学报,2014;
- 21.
Colebrook EH, Thomas SG, Phillips AL, Hedden P.赤霉素信号在植物对非生物胁迫反应中的作用。中国生物医学工程学报。2014;
- 22.
胡勇,贾伟,王杰,张勇,杨林,林忠农杆菌基因表现出增强的耐寒性。植物细胞学报2005;23:705-9。
- 23.
Tan D-X, Hardeland R, Manchester LC, Korkmaz A, Ma S, roales - corral S, Reiter RJ。褪黑素在植物中的功能作用,以及在营养和农业科学中的观点。中国科学(d辑),2012;
- 24.
沈超,李东,何瑞,方忠,夏勇,高娟,沈红,曹敏。冷胁迫下耐冷水稻和冷敏感水稻基因型RNA-seq数据的比较转录组分析。中国植物学报,2014;29(3):437 - 448。
- 25.
宋坤,金兴昌,申申,金克辉,文成良,金志勇,李文明。干旱胁迫下玉米叶片开花时间基因的转录组分析。植物科学学报,2017;
- 26.
陈红,陈霞,陈东,李娟,张勇,王安。两种耐冻性不同基因型番茄低温转录组的比较:茄属植物lycopersicum而且茄属植物habrochaites.BMC植物生物学,2015;15:132。
- 27.
李朱M,孟X, Cai J, G,李董T, z基本亮氨酸拉链转录因子SlbZIP1调节盐和干旱胁迫耐受茄。BMC植物生物学,2018;18:83。
- 28.
杨晓明,王晓明,杨晓明,等。干旱胁迫下植物的分子响应。生物工程学报。2017;61:201-9。
- 29.
陈宏,赖志,史俊,肖勇,陈志,徐旭。WRKY18、WRKY40和WRKY60转录因子在植物对脱落酸和非生物胁迫响应中的作用。植物学报。2010;10:1-15。
- 30.
陈玲,宋勇,李松,张玲,邹超,于东。WRKY转录因子在植物非生物胁迫中的作用。工商管理学士-基因调控机制。1819;2012:120-8。
- 31.
朱镕基JK。盐和干旱胁迫在植物中的信号转导。植物学报,2002;23(3):457 - 457。
- 32.
杨晓明,杨晓明,杨晓明。干旱和寒冷胁迫下植物基因表达的调控网络。植物学报,2003;6:410-7。
- 33.
周睿,孔林,吴震,Rosenqvist E,王勇,赵林,赵涛,Ottosen CO.番茄在干旱、高温及其组合下的生理响应。物理植物。2019;165:144-54。
- 34.
Mittler R, Vanderauwera S, Suzuki N, Miller G, Tognetti VB, Vandepoele K, Gollery M, Shulaev, Van Breusegem F. ROS信号:新浪潮?植物科学进展,2011;16:300-9。
- 35.
吴艳,张海生,朱涛,王霞,Harper J.拟南芥转录组对盐、渗透和冷胁迫的响应。植物科学学报,2002;30(2):344 - 344。
- 36.
Seki M, Narusaka M, Ishida J, Nanjo T, Fujita M, Oono Y, Kamiya A, Nakajima M, Enju A, Sakurai K.监测7000的表达谱拟南芥基因在干旱,寒冷和高盐度胁迫下使用全长cDNA微阵列。植物学报,2002;31:29 - 32。
- 37.
韩艳,李安,李峰,赵敏,王伟。一种小麦的性状分析(小麦L.)扩增素基因TaEXPB23参与非生物胁迫反应和植物激素调控。植物化学学报。2012;44:49 - 58。
- 38.
李超,谭晓东,梁东,常超,贾东,马峰。褪黑素介导干旱胁迫下两种苹果ABA代谢、自由基清除和气孔行为的调控。中国科学(d辑),2015;
- 39.
Kalapos B, Dobrev P, Nagy T, Vítámvás P, Györgyey J, Kocsy G, Marincs F, Galiba G.转录本和激素分析揭示了aba信号、激素串谈和基因型特异性生物学过程在小麦冷休克反应中的参与。植物科学进展(英文版);
- 40.
Yamaguchi-Shinozaki K, Shinozaki K.细胞反应和耐受脱水和冷应激的转录调节网络。植物学报。2006;57:781-803。
- 41.
Baker NR, Rosenqvist E.叶绿素荧光的应用可以改善作物生产策略:对未来可能性的检查。中国科学(d辑),2004;
- 42.
邓波,杜伟,刘超,孙伟,田松,董慧。烟草两倍体对干旱、寒冷和营养胁迫的抗氧化反应:低资源需求使多倍体具有多耐性?植物生长学报。2012;66:37-47。
- 43.
销售CRG, Ribeiro RV, Silveira JAG, Machado EC, Martins MO, Lagôa A.M.超氧化物歧化酶和抗坏血酸过氧化物酶促进了甘蔗植株在水分亏缺和低温条件下光合作用的恢复。植物物理学报,2013;
- 44.
Rabbani MA, Maruyama K, Abe H, Khan MA, Katsura K, Ito Y, Yoshiwara K, Seki M, Shinozaki K, Yamaguchi-Shinozaki K.利用cDNA微阵列和RNA凝胶印迹分析监测水稻基因在寒冷、干旱和高盐度胁迫下的表达谱。植物物理学报。2003;133:1755-67。
- 45.
何卓。大田作物化学防治技术实验室指南。入职:何Z,编辑。北京:北京农业大学出版社;1993.60-8页。
- 46.
杨永明,徐国忠,王文明,贾建忠。植物生长调节剂对棉纤维二次壁增厚的影响。植物生长学报。2001;35:233-7。
- 47.
Murchie EH, Lawson T.叶绿素荧光分析:良好实践指南和理解一些新的应用。中国科学(d辑),2013;
确认
作者感谢王银蕾博士、赵丽萍女士和黄端月先生在实验过程中的帮助。
资金
资助者在实验设计、数据分析、发表决定或手稿准备中没有任何作用。作者感谢中国自然科学基金(31601745)、江苏省青年自然科学基金(BK20160579)和奥胡斯大学研究基金(AUFF资助,30379)的资助。
作者信息
从属关系
贡献
RZ和XY设计并执行了实验。RZ, XY和TZ分析数据。RZ撰写了手稿。CO、ER和ZW对手稿提出了宝贵的意见。所有作者都阅读了手稿,给出了评论并批准了手稿的最终版本。
相应的作者
道德声明
伦理批准并同意参与
本研究所用番茄品种“金陵美玉”的种子和植株材料由江苏省南京市农业科学院捐赠。对植物的实验研究符合机构、国家或国际准则。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
附加文件
附加文件1:
图S1。(一个)通过从头组装预测的新基因数量,(B) Nr同源种分布及(C一致序列的eggNOG函数分类。Nr表示无冗余蛋白序列数据库,其网站为ftp://ftp.ncbi.nih.gov/blast/db/.eggNOG表明基因的进化谱系:非监督的同源群,其网站为http://eggnog.embl.de/.(JPG 158kb)
附加文件2:
图S2。京都基因和基因组百科全书,http://www.genome.jp/kegg)差异表达基因(DEGs)通路富集分析(一个)控制vs冷,(B)控制vs干旱,(C)控制vs组合应力和(D寒冷vs干旱。(JPG 230kb)
附加文件3:
表S1。阅读对照、寒冷、干旱及其组合下番茄RNA-seq数据的概述.表S2。12个差异表达基因(DEGs)的详细信息用于qRT-PCR验证。表S3。番茄在对照、低温、干旱及其组合条件下活性氧(ROS)的差异表达基因(DEGs)。表S4。番茄在对照、寒冷、干旱及其组合条件下信号转导的差异表达基因(DEGs)表S5。番茄在对照、寒冷、干旱及其组合条件下参与激素信号转导的差异表达基因(DEGs)表S6。在对照、低温、干旱及其组合条件下,参与番茄光合电子传递的差异表达基因(DEGs)。表S7。差异表达基因(DEGs) qRT-PCR验证引物。(xlsx714kb)
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
周荣,余X,赵涛。et al。生理分析和转录组测序揭示了寒旱复合胁迫对番茄叶片的影响。BMC植物生物学19日,377(2019)。https://doi.org/10.1186/s12870-019-1982-9
收到了:
接受:
发表:
关键字
- 番茄
- 复合应力
- 生理反应
- RNA序列