摘要
背景
植物免疫反应可以由植物根际促生细菌(PGPRs)诱导,但具体诱导抗性的化合物尚不清楚。在这里,我们从PGPR中鉴定了新的天然激发子3,4-二羟基-3-甲基-2-戊酮枯草芽孢杆菌HN09主导HN09诱导的系统抗性(ISR)。
结果
HN09菌株作为一种促进植物生长的根际细菌,能诱导植物的系统性抗性拟南芥植物对两PV。番茄本研究探讨DC3000及其代谢物3,4-二羟基-3-甲基-2-戊酮在诱导抗性机制中的作用。3,4-二羟基-3-甲基-2-戊酮立体异构体表现出不同的抗性诱导活性答:芥.B16,三异构体的1:1混合物(3 r, 4 s)和(3 s, 4 r),显着优于B17,红细胞异构体的类似混合物(3 r, 4 r)和(3 s, 4 s).此外,与B17相比,B16诱导的胼胝质沉积更快、更强。RT-qPCR和RNA-seq结果表明,B16和B17通过JA/ET和SA信号通路诱导系统抗性。B16和B17激活不同但重叠的信号通路,这些化合物具有相同的化学结构,但在立体结构上有细微的差异。
结论
我们的结果表明,3,4-二羟基-3-甲基-2-戊酮是植物中优异的免疫引导物。该化合物对HN09诱导的全身性抗性很重要。它的繁殖 - 异构体(3 r, 4 s)和(3 s, 4 r)比红异构体(3 r, 4 r)和(3 s, 4 s).这一过程涉及到SA和JA/ET信号通路。
背景
植物生长促进殖民宿主根系的根瘤菌(PGPRS)可以改善抗病性和促进植物生长[1那2那3.].大多数PGPRs产生一系列次级代谢物[4.]作为植物防御响应的elictors,从而直接或间接触发诱导的全身性阻力(ISR)。迄今为止,许多Elicitors已经表征。M-甲酚和苯甲酸甲酯(MEBA),作为活性挥发性化合物Ampelomyces sp。和枝孢属sp。,分别可以产生对抗病原体的ISR [5.].3-丁醇和3-甲基-1-丁醇的挥发性有机化合物B.枯草芽孢杆菌GB03和b . amyloliquefaciensIN937a授予ISR以对抗细菌病原体Erwinia carotovora无性系种群。胡萝卜(1那6.].胞外多糖、2,3-丁二醇、杆菌素、艰难梭菌素、大乳素、杆菌烯、表面素、杆菌霉素D、丰霉素等b . amyloliquefaciensSQR9代谢物可改善全身抗p .两PV。番茄DC3000和葡萄孢菌[7.].
诱导子被识别后,在植物中通过茉莉酸(JA)、乙烯(ET)和水杨酸(SA)信号通路激活ISR [8.],由复杂的信号网络和串扰相互连接[9.].这类ISR的分子基础已被广泛描述。从答:芥在JA或ET信号通路受损的突变体中,发现JA和ET可以调节根际细菌介导的ISR [10].蛋白质组分析表明,细菌挥发物由B.枯草芽孢杆菌GB03显著诱导ET生物合成酶上调[11].b . amyloliquefaciensNC6可以产生PEBA1蛋白,其诱导对抗病原体的全身性抗性,包括真菌病原体b .灰质和烟草马赛克病毒(TMV)。用PEBA1处理后,SA响应PR1a那PR1b那PR5,朋友,以及ja-enveryivePDF1.2和COI1,被上调。
激发子的手性构型显著影响其生物活性。gb03 - syntheses (2R,3R)-丁二醇触发ISR对Erwinia carotovorassp.胡萝卜scc1 in.烟草,但另一种立体异构体(2S,3S)-丁二醇则没有同样的效果[1那12].同样,草食诱导子volicitin具有明显的昆虫源诱导子结构特异性。该化合物具有活性的l -异构体,但无活性的d -异构体[13].在PGPR代谢产物中已经证实了立体异构体特异性的存在,但对手性化合物激活的特定ISR信号通路的比较报道有限,部分原因是分离立体异构体的技术难度。虽然手性化合物的结构相似,但它们实际上是两种不同的物质,往往具有不同的功能。手性化合物的分离和这些化合物激活的抗性相关信号通路的比较是重要的。这些研究机械地理解了植物的免疫反应,并允许通过合理的设计识别新的化学诱导剂。
B.枯草芽孢杆菌HN09通过次生代谢产物诱导对许多植物病害的抗性。(3 r, 4 s)和(3 s, 4 r3,4-二羟基-3-甲基-2-戊酮1:1外消旋体B16和(3 r, 4 r)和(3 s, 4 s) 3,4-二羟基-3-甲基-2-戊酮1:1外消旋体B17从HN09培养液中分离得到,并证实其参与HN09诱导的系统抗性p .两PV。番茄DC3000在答:芥.我们的数据显示B16的能力与另一对立体异构体B17之间的显着差异,以引发植物,细胞和分子水平的防御反应。
结果
HN09代谢物诱导抗性答:芥
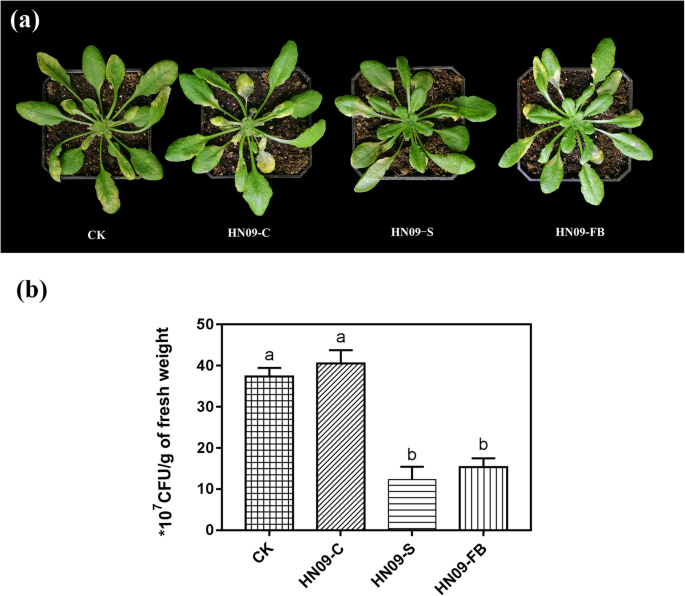
PGPRS的代谢产物在ISR中发挥着重要作用。PGPR.b . amyloliquefaciensSQR9可诱导全身抗p .两PV。番茄DC3000和Botrytis cinerea。然而,SQR9突变体缺乏胞外化合物的产生,包括胞外多糖、2,3-丁二醇、芽孢杆菌素、艰难梭菌素、大乳杆菌素、杆菌烯、表面素、杆菌霉素D和凤霉素[7.].B.枯草芽孢杆菌HN09强烈增强了机体对Magnaporthe oryzae和Fusarium oxysporumf . sp。radicis-lycopersici在大米和西红柿(附加文件1:图S1),显著促进了的增长答:芥(附加文件2:图S2)。为了进一步确定PGPR HN09诱导的系统抗性是否依赖于该生物体的代谢物,我们检测了HN09- c(只包含HN09细胞)、HN09- s(只包含HN09代谢物)和HN09- fb(同时包含HN09细胞和代谢物)诱导DC3000抗性的能力。经HN09-C处理的植株叶片表现出典型的细菌性斑点病症状,黄色斑点或水浸斑点周围被褪绿病包围(图2)。1a). HN09-FB和HN09-S显著降低了病原菌在叶片中的生长(图2)。1b).这些数据表明,HN09代谢物确实诱导了植物对DC3000的系统抗性,但HN09细菌细胞没有同样的作用。
HN09代谢物诱导抗性答:芥.诱导全身抵抗丁香假单胞菌。番茄DC3000在答:芥用HN09及其发酵液处理col0植物。答:芥用HN09细菌细胞(HN09- c)、HN09发酵液处理col0植株600= 0.1 (HN09- fb), HN09发酵液上清液(HN09- s)和10 mM MgSO4.(CK)。5 d后,OD时喷施DC3000细胞悬浮液600= 0.02。(一种)接种后5 d拍摄HN09-C、HN09-S和HN09-FB的代表植株。(B.)DC3000在叶子中的殖民地密度答:芥不同处理组的植物。值为每克叶子的平均CFU;每个处理12株,每株3片叶片定量测定DC3000密度(最小显著性差异试验;P.< 0.05).所有实验均采用相似的结果进行两次
复合光谱数据和结构测定
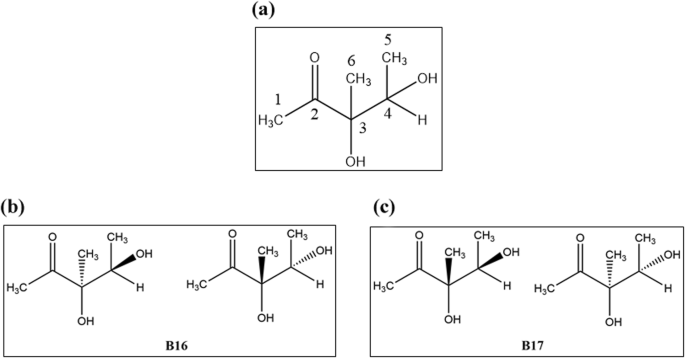
为了鉴定HN09代谢物中的活性化合物,我们从HN09培养滤液中分离出代谢物,得到两个活性化合物,分别为B16和B17。B16是一种无色油;\({\左[a \ recte]} _ {\ mathrm {d}} ^ {24}}±0°(C = 0.202,MeOH);阳性EI-MS M / Z:133 [M + H] +,155 [M + NA] + 1;1H NMR(600MHz,MEOD)δ3.83(Q,J = 6.0 Hz,1h,h−4), 2.24 (s, 3 h, h), 1.28(年代,3 h - 6), 1.10 (d J = 6.0 Hz 3 h, H-5)。13C NMR (150 MHz, MeOD) δ 215.81(C-2), 82.77(C-3), 72.61(C-4), 26.57(C-1), 21.39(C-6), 17.78(C-5) (Fig.2).
B17也是一种无色油;\({\左[a \ recte]} _ {\ mathrm {d}} ^ {24}}±0°(c = 0.277, MeOH);积极EI-MS m / z: [m + H] + = 133, [m + Na) + = 155;1 h NMR (600 MHz, MeOD)δ3.97 (q, J = 6.0赫兹,1 h, H-4), 2.26 (s, 3 h, h), 1.21(年代,3 h - 6), 1.18 (d J = 6.0 Hz 3 h, H-5)。13 c NMR (150 MHz, MeOD)δ215.23 (c - 2), 82.94(颈),72.50 (c - 4), 25.81(颈- 1),22.02(其他),17.05 (c - 5)(图。2).
B16和B17的NMR数据与3,4-二羟基-3-甲基-2-戊酮非常相似[14].根据它们的旋光值,很明显,这两个化合物都是由对映体异构体组成的外消旋体。因此,B16被鉴定为(3R,4S)-和(3S,4R)-3,4-二羟基-3-甲基-2-戊酮的1:1混合物,B17被鉴定为(3S,4S)-和(3R,4R)-3,4-二羟基-3-甲基-2-戊酮的1:1混合物。2) [14].
B16和B17诱导抗性p .两DC3000在答:芥
是否B16,B17及其1:1混合物(混合)可以触发ISR到DC3000答:芥植物进行了测试。以水为阴性对照,ISR化学苯并噻二唑(BTH)为阳性对照。接种DC3000 5 d后,接种假体的植株出现典型的DC3000侵染症状。叶片变黄或有水浸斑点,周围有广泛的褪绿(图。3.a).与模拟处理的植株相比,B16-和B17处理的植株发病面积要小得多。此外,接种B16、B17和Mix处理的植株在接种DC3000 5 d后,叶片中DC300的密度比模拟处理降低了67.03、52.18和48.6%(图3)。3.b)。在BTH处理的植物中,DC3000的密度降低了83.43%(图。3.b).有趣的是,B16对DC3000的生防活性显著高于B17和混合处理。
为了确定B16和B17是否具有直接的抑菌活性,我们检测了DC3000在含有100 μM B16、B17、Mix或商品杀菌剂福美尔的液体培养基中的生长(表1)1).只有B16微弱地抑制了DC3000的生长,而福美尔完全消除了细菌的生长。该结果排除了B16和B17的抗菌活性。
B16和B17诱导调用沉积答:芥
B16和B17增强细胞防御反应激活的启动机制答:芥植物被检查了。SA或BTH-预处理植物在感染遗址周围产生更多胼ins沉积物[15那16].在用DC3000接种12小时后,在B16-和B17处理中调用沉积答:芥观察到叶子,区域为1.04和3.29 mm2分别;而CK处理和接种dc3000的叶片在同一时间点均未观察到胼胝质沉积(图3)。4.).在24 HPI时,在CK治疗中未观察到这些防御反应,但B16-和B17处理的植物展示了较大的胼沉积区域(109.29和35.99mm2与单独接种DC3000 (16.69 mm)的植株相比,接种DC3000的植株表现出明显的差异2)(图。4.).重要的是,B16诱导的胼胝质沉积比B17更强。
防务相关的酶活性
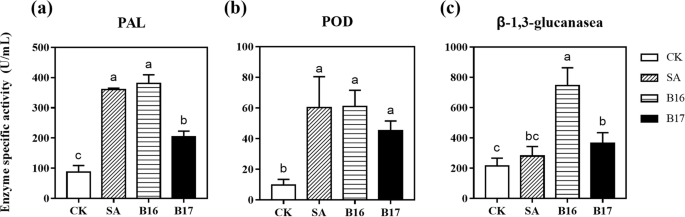
为了进一步验证B16和B17诱导的抗病能力,对B16和B17处理24 h后的植物关键防御相关酶的活性进行了分析。苯丙氨酸解氨酶(PAL)是酚类生物合成的重要酶,连接初级代谢(莽草酸途径)和次级代谢(苯丙氨酸途径),催化苯丙氨酸生物合成的第一步,在防御反应中起重要作用[17].B16-和b17处理植株的PAL活性显著高于水处理对照,且B16处理植株的PAL活性高于b17处理植株,与sa处理阳性对照的PAL活性相当(图2)。5.一种)。BTH是SA的衍生物,SA和BTH都可以设置为该实验的阳性控制。如果使用BTH作为阳性控制会更好,以更加一致。但SA的现象增加了与BTH中的抗辩酶活性更好。因此,我们在该实验中使用SA作为阳性控制。植物抗性响应的早期阶段涉及两种反应性氧(ROS),H2O.2和O2−,可由非生物或生物激发子诱导,但过量的ROS对植物细胞有害[18].过氧化物酶(POD)可抑制氧化应激。当ROS水平升高时,H2O.2通过荚果氧化通过酚醛化合物如酚醛化合物的氧化来分解。细胞壁的施工,刚性和最终瘫痪涉及豆荚酶,这可以避免植物组织的损伤[19].在我们的研究中,在B16和B17处理的植物中,POD酶活性显着高于水处理对照中的豆类活性,并且在SA治疗的阳性对照中等于这表明B16和B17可以成功地引发植物防御反应,类似于Phytohormone SA(图。5.b).真菌细胞壁的β-1,3-葡聚糖等成分可能被β-1,3-葡聚糖酶等致病相关蛋白水解,从而破坏繁殖体或致病结构。一般认为,β-1,3-葡聚糖酶的积累可指示诱导抗性。本实验结果表明,β-1,3-葡聚糖酶的活性答:芥B16和B17处理显著增强植株的抗性,表明B16和B17处理可提高植株的抗性(图2)。5.c)。
B16和B17诱导防御相关基因表达答:芥
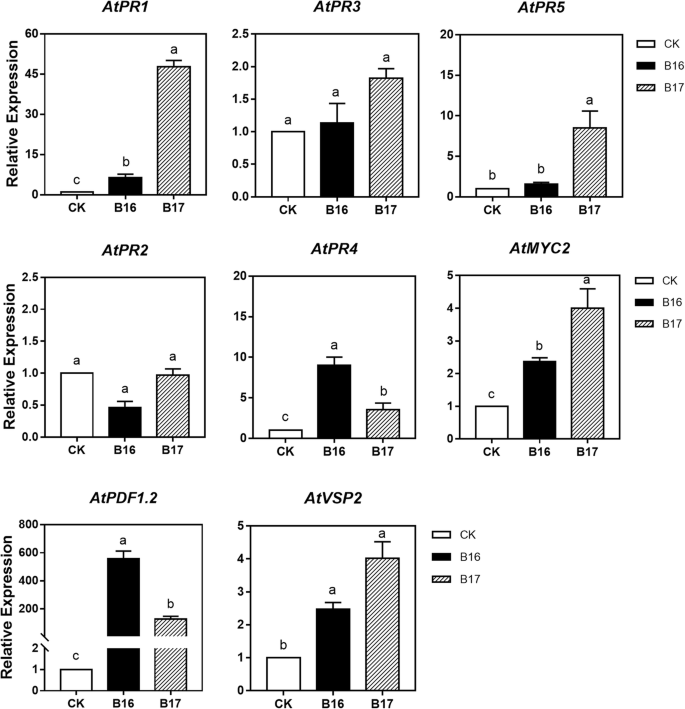
进一步研究这些信号通路标记基因在B16和B17胁迫下的诱导模式,从而明确SA-、JA-和et相关信号转导通路在B16和B17诱导的系统抗性中的作用。用B16和B17处理植株24 h。ja诱导基因的转录AtVSP2和myc2,JA / ET-inducible基因PR3和PDF1.2,ET-inducible基因PR4,和SA-inducible基因PR1那PR2,PR5实时定量RT-PCR分析(图。6.).B16和B17处理的植株中sa依赖的标记基因表达量较高PR-1(分别超过6倍和47倍)。B17处理也增加了PR5(8.5倍)。在B16和B17处理的植株中,et诱导标记基因的表达PR4JA-inducible基因myc2.JA/ et诱导标记基因PDF1.2是调节。在实验中,JA/ et诱导基因PR3和sa-inducible基因PR2没有明显的表达(< 2倍)。
值得注意的是,尽管B16和B17同时诱导了SA或JA / ET依赖性基因的上调,但表达水平明显不同。JA / ET依赖性标记基因PDF1.2在B16-和b17处理的植株中,表达量分别是对照的557.05和125.51倍。然而,sa依赖的标记基因PR1在B16-和b17处理的植株中,表达量分别是对照的6.48和47.72倍。这表明JA和ET可能参与了B16-和b17诱导的抗性,但在分子水平上模式不同。
B16-和b17引发转录组变化
为了阐明B16-和b17诱导的植物抗病的分子机制和生物活性的差异,我们在14 d的平板生长中分析了触发的反应答:芥用100 μM B16或B17处理幼苗12和24 h,进行mRNA测序(mRNA-seq)。作为对照,我们使用模拟处理(只有溶剂)。MeJA(易于转化为JA)是一个阳性对照,因为它依赖于JA基因PDF1.2在B16-和b17处理的Col-0答:芥.所有差异表达基因(DEGs)均在附加文件中列出4.:数据集S1。
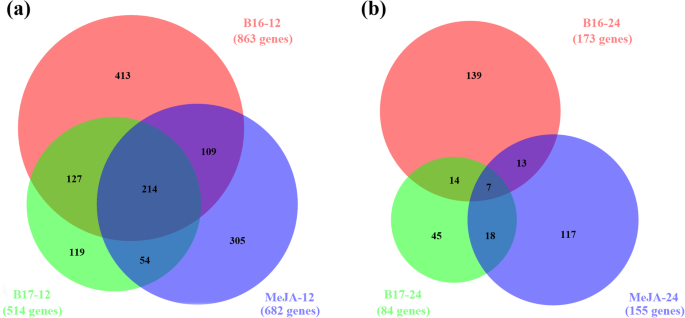
在12 h, B16处理(B16 - 12)共863个基因的转录水平发生显著改变,其中162个基因表达上调,702个基因表达下调。在B17 - 12处理(B17处理12 h)中,差异表达基因(DEGs)的数量略低于B16-12处理(514 DEGs),有98个基因上调,416个基因下调。作为对照,外源MeJA-12处理(MeJA处理12 h)诱导了682个DEGs,其中在B16处理中也诱导了323个DEGs(超过47%),在B17处理中诱导了268个DEGs(超过39%)。7.),显示B16,B17和MEJA之间的大重叠。这一发现表明B16和B17可能模仿一些JA函数来激活植物防御信号的转换。
基于基因本体数据库确定的B16-12和B17-12集合中的高度显着富集的基因本体论(GO)术语表明B16-12基因的集体作用主要富集为“植物型过敏反应的调节(GO:0010363)“,”响应脱落酸(GO:0009737)“,”蛋白质靶向膜(GO:0006612)“,”,对乙烯(GO:0009723)“和”对茉莉酸的反应“(GO:0009753)“。除了“对乙烯(GO:0009723)的反应”之外,“对茉莉酸(GO:0009753)的反应”和“植物型过敏反应的调节(GO:0010363)”,B17-12基因在GO中富集术语“对几丁质的反应(GO:0010200)”(表2).几丁质是n -乙酰- d -氨基葡萄糖(NAG)的聚合物,是一种常见的引起植物免疫的PAMP [20.那21].B17诱导的DEGs显著富集氧化石墨烯“对几丁质的反应”和“蛋白靶向膜”,提示B17可能被细胞膜上的免疫受体蛋白鉴定为PAMP,可以激活几丁质信号转导通路。GO术语“几丁质反应”仅在B17处理的植物中富集,而在B16处理的植物中不富集,说明3,4-二羟基-3-甲基-2-戊酮受体具有结构特异性,这可能是B16和B17在上述实验中表现出显著差异的原因。B16-和B17诱导的deg主要富集防御相关的GO术语,如调控植物型超敏反应或植物激素反应的相关术语,再次表明B16和B17在植物中是成功的诱导子。
在24 h时,B16-24和B17-24的DEGs组明显小于之前的时间点(分别为173个和84个基因)2).作为对照,meja诱导的DEGs在24小时也表现出减少(只有155个基因)。当受到生物或非生物胁迫时,植物通过调节钙离子迅速将防御信号传递到全身2+浓度,从而诱导防御反应,如防御标记基因表达增加,JA和JA- ile的积累[22].这个过程很快,只需30到60分钟即可完成[22].因此,在24 h时,我们观察到B16-、B17-和meja诱导的DEGs数量减少。然而,B16和B17诱导的deg具有富集的术语“dna模板转录,延伸(GO:0006354)”(Table2),提示早期防御信号激活下游防御基因的转录和翻译。在“前体代谢物和能量的生成(GO:0006091)”和与光合作用相关的术语中也富集了DEGs。防御反应和不断增加的能量需求之间存在相关性。在植物的防御反应中,植物的呼吸受到高度刺激[23].根据植物防御和光合作用的研究,在植物防御反应中,光合代谢被局部抑制[24那25].光合机构对防御相关氧化刺产生的roi高度敏感[24].
综上所述,结果表明,3,4-二羟基-3-甲基-2-戊酮诱导的转录变化在12和24 h都有两个清晰可识别的趋势:(1) B16和B17触发了大量显著差异表达的基因,(2)增强了与防御相关的氧化石墨烯术语,如调节植物型超敏反应、对氧化应激的响应和对植物激素的响应(表1)2).此外,B16、B17和MeJA共同诱导了大量的DEGs,表明B16和B17是植物防御激素JA的部分激动剂。
讨论
在感测特征微生物或病原体相关的分子模式(MAMPS或PAMP)之后,植物细胞表面图案识别受体将激活模式触发的免疫力。PGPR产生的代谢物可以增强植物自我免疫力[26].2,3-丁二醇分离得到枯草芽孢杆菌GB03触发ISR,转基因株系B.枯草芽孢杆菌分泌的2,3-丁二醇降低了抵抗能力答:芥防止病原体感染[1]这表明PGPR代谢物基本上贡献为ISR。枯草芽孢杆菌HN09是一种能促进植物生长的根际细菌,从印楝根际土壤中分离得到。在我们之前的工作中,我们发现HN09可以成功地控制番茄镰刀菌素冠腐及根腐病[27,但诱导抗病的机制尚不清楚。Kutschera等[28]报道豁免权答:芥植物可由细菌中链3-羟基脂肪酸代谢物触发。因此,我们检测了HN09代谢产物是否能诱导植物抗性。数据表明,仅用HN09-C处理不会增强答:芥抗DC3000,但HN09-FB和HN09-S治疗显着降低了叶中的DC3000生长(图。1),表明hn09诱导的抗病能力取决于其代谢产物。
为了分离HN09次级代谢物,我们得到了两种化合物,即B16和B17(图。2),这可能引起全身抵抗答:芥.B16与B17具有相同的化学结构,但这些化合物的立体构型不同。大量研究表明,立体构型的差异可以显著影响化合物与其受体蛋白之间的亲和力,进而影响化合物的生物活性[29那30.].在Elicitors的研究中也观察到这种现象。观察到(2 r, 3 r)形式在2,3-丁二醇诱导的抗性中起主要作用Erwinia carotovora无性系种群。胡萝卜,但(2 s, 3 s)形式不起这样的作用[1那6.].Kutschera等[28]还发现(R)-3-羟基癸酸比(S) -3-羟基癸酸诱导的免疫信号更强。在答:芥表型实验,我们观察到类似的结果,证明了4-二羟基-3-甲基-2-戊酮的血酮血糖酮溶解的DC3000比红细胞异构体B17更有效的生物防治(图。3.).此外,B16也优于Mix,说明B16 (3R, 4 s)或(3年代,4 r)异构体可能是触发DC3000植物ISR的最佳配置。
在胼胝质沉积实验中,B16-和b17处理的植物提高并增强了对病原菌DC3000的细胞防御反应(图3)。4.).胼胝质沉积是植物中一种重要的细胞防御反应,可以防止病原体的传播[2].两效应剂可诱导敏感细胞的胼胝质沉积答:芥植物 [31].此外,我们在植物ISR的触发中观察到B16和B17之间的B16和B17之间的显着差异(图。4.),与表型实验结果一致。
一般来说,ISR依赖于JA或ET信号通路,而systemic acquired resistance (SAR)依赖于SA信号通路[22].然而,许多新研究已经证明ISR还涉及SA信号通路。例如,SA信号通知路径在诱导到殖民化的系统抵抗力方面起着重要作用木霉属asperellumSKT-1。JA/ET和SA信号通路共同作用,诱导对该生物体培养滤液的抗性[32].同样,SA、JA和ET信号标记基因的表达是由分离的长链挥发性物质触发的ISR启动的Paenibacillus polymyxaE681 [33].在我们的研究中,在B16和B17处理的植物中上调SA,JA和ET信号通路基因转录水平(图。6.),这表明B16和b17诱导的防御答:芥涉及JA / ET和SA信令。另一方面,RNA-SEQ数据也表明,B16-和B17诱导的DEGS与JA或ET响应相关的GO条款(GO:0009723; GO:0009753,表2和额外的文件5.:数据集S2)显着富集。此外,很少有富含SA相关的GO条款(GO:0009862; GO:0009697附加文件5.:数据集S2)。JA反应是有益微生物诱导ISR的一种典型机制。此外,从PGPR中分离到B16和B17枯草芽孢杆菌HN09。因此,我们推测JA/ET信号通路在B16-和b17诱导的植物免疫中起主导作用,而SA信号通路也参与了这一过程。然而,SA-JA-ET信号通路与复杂的串音相关,本研究没有足够的证据阐明B16/B17与SA-JA-ET信号通路之间的具体作用机制,但我们期待在后续研究中进一步研究这一机制。
有趣的是,B16和B17是一对手性异构化合物,其不仅有所不同,而且效果显着差异。在受体和复合物中具有高度的结构特异性,化合物的立体剖面大大影响了其生物活性。天然产物(+) - 冠状素诱导冠状素内溶解度1(COI1; SKP / CULLIN / F-BOX型遍突蛋白连接酶复合物的蛋白质 - 蛋白质相互作用)和茉莉醇ZIM域(JAZ)转录抑制蛋白,引起植物生长抑制或衰老和植物防御反应[29].然而,冠状嘌呤的立体化学异构体只能与JAZ9和JAZ10相互作用,而不能与其他JAZ异构体相互作用,在生长和防御之间没有权衡[34].在本研究中,B16或B17与植物免疫系统上游受体结合方式和强度的差异可能导致了下游防御反应的差异,如胼胝质沉积、防御相关酶活性、防御相关基因表达等。
RNA-seq显示,与水处理对照相比,B16或B17处理后诱导了许多deg(图2)。7.).通过氧化石墨烯富集分析,我们发现这些DEGs在植物抗病相关途径中显著富集(表)2),再次表明B16和B17是植物中成功的elicitors。
结论
我们从植物根际促生菌的代谢产物中分离并鉴定了一种新的激发子3,4-二羟基-3-甲基-2-戊酮枯草芽孢杆菌HN09。3,4-二羟基-3-甲基-2-戊酮诱导植物抗性并表现出构象特异性,而三异构体B16和红异构体B17在表型、细胞和分子水平上诱导抗性差异显著。我们的数据表明,在所有的实验中,B16比B17诱导了更强的防御反应,植物激素SA, JA和ET信号通路参与了这种防御反应。本研究对细菌代谢产物作为植物防御反应启动剂的作用提供了新的认识,进一步开辟了通过合理设计识别新型化学诱导剂的可能性。
方法
植物、菌株和生长条件
在实验中,答:芥(生态型Columbia, Col-0)种子取自拟南芥生物资源中心(https://abrc.osu.edu/).种子在4°C的冷水中浸泡过夜后,在花盆中种植在泥炭土壤中。两周大的种子在200 ml的花盆中生长,在荧光灯下(100 μ E m)−2年代−1,23°C,暗光/ 14小时10小时)。
我们越来越长的病原体两PV。番茄DC3000在28°C液体King 's medium B (KB)中过夜[2) (20 g•L−1胨,1.5 g•L−1MgSO4., 1.5 g•L−1K.2HPO.4., 10 mL•L−1甘油)包含50 mg•l−1利福平。进行离心(2000×G,3分钟)以沉淀培养的DC3000细胞,用无菌水洗涤并重悬于10mM MgSO中4.含有0.01%(v / v)的表面活性剂Silwet L-77(Sigma)。之后,它被调整为OD600= 0.01梯度稀释至所需浓度。
在这个实验中,枯草芽孢杆菌HN09分离自广东省华南农业大学杀虫植物园内印楝根际土壤[27].我们在酵母提取物 - 蛋白胨 - 右旋糖(YPD)液体培养基(3 G•L.)中增长HN09−1牛肉精,5克•L−1酵母粉,20克•L−1蛋白胨,12.5 g•l−1葡萄糖)在28°C下24小时。通过离心(2000×G,3分钟)沉积细菌细胞,重悬于无菌0.85%NaCl,并调整为OD600HN09细胞处理(HN09- c) = 0.10。将含有HN09代谢产物的上清液用0.2 μm注射器驱动过滤器过滤,作为NH09上清液处理(HN09- s)。HN09发酵(HN09- fb)处理同时包含HN09细菌细胞和代谢产物,并根据OD调节其浓度600= 0.10。
代谢物的提取和分离
石油醚、CHCl3.层,n-BuOH依次提取HN09培养滤液3次,得到干燥石油醚溶物(29.87 g)、CHCl3.- 溶解(16.03g),EtoAc可溶性(30.6g)和正丁醇可溶性(80.15g)提取物。在用CHCL洗脱的硅胶柱(100-200目)上对EtOAc可溶性提取物进行通过3.-极性增加的甲醇混合物(100:0-90:10-80:20-70:30-60:40-50:50,v/v)。共得到10个馏分(E1-E10)。E4 (7.4 g)经CHCl洗脱得到3.-MeOH(80:20),在develsil ODS (10 μm, Nomura Chemical Co. Ltd, Japan)柱上进行重色谱。E4经甲醇- h洗脱得到16个亚组分(E4 - 1 - E4 - 16)2O混合物(3:7,1:1和7:3)。制备高效液相色谱法用于分离小分支E4-1,运行是一个日本岛津公司RID-10A示差折光检测器和一个日本岛津公司LC-6广告泵通过YMC-pack ODS-A C18柱(5μm, 250×20毫米)和MeOH-water混合物(7:93,v / v)作为流动相生成B16转椅(2.86克)和B17 (1.76 g)。
植物处理和病原菌接种
后答:芥在每个罐的表面上倒入2周,10ml HN09-S,HN09-C和HN09-FB的罐中的生长。相同体积的无菌10 mm mgso4.用于控制治疗。治疗后五天,用毒性病原体的细胞悬浮液喷洒叶子两PV。番茄在OD DC3000600= 0.01,直到细液滴覆盖所有叶片,接种所有处理的植物。对于HN09代谢物B16和B17处理,4周龄答:芥用100 μM B16、B17、Mix (B16和B17的混合物)、BTH和MgSO处理植株4.通过喷洒树叶。处理24小时后,用细菌注射(稀释至OD值)接种DC3000病原体600= 0.001),通过叶片背面的气孔进入叶片。接种后,在相对湿度100%的露珠室中保存3 d,然后转移到生长室(100 μ E m)−2年代−1,23°C,暗光/ 14小时10小时)。
DC3000的量化在答:芥叶子
接种后第5天取样,测定DC3000的密度答:芥叶子。每个处理12株,每株3个代表叶片用于DC3000密度的定量分析。所有样品称量,75%乙醇浸泡30 s进行表面消毒,用无菌蒸馏水洗涤3次,然后用无菌研钵和杵用10 mM MgSO均质4..将适当的稀释液镀到添加100mg•L的KB培养基上−1环己亚胺和50 mg•L−1利福平,将其在28℃下孵育。孵育48小时后,我们计算了利福平抗性病原体菌株DC3000的菌落数。细菌密度表示为每克叶片鲜重(CFU•G.−1).这个实验进行了四次。最低显著差异(LSD)测试(P.= 0.05)进行均值比较。记录LSD结果和标准误差。
胼胝质沉积
答:芥在24 hpi上抽出叶子,并如niu所述描述治疗[2,以便测定胼胝质沉积。每个处理6株,每株获得3片代表性叶片进行胼胝质沉积分析。将所有叶片浸泡在40 mL脱色液(乙醇/水/乳酸/甘油/苯酚= 8:1:1:1:1 (v/v/v/v/v))中,真空渗透10分钟。然后在60°C水浴中孵育30 min,清除叶绿素。用清水冲洗后,将无叶绿素的叶片在150 mM K的0.01% (w/v)苯胺蓝染色液中黑暗浸泡2 ~ 4 h2HPO.4.(pH值9.5)。最后,在Olympus BX51显微镜下用紫外激发滤光片(Olympus, Shinjuku, Tokyo, Japan)观察和拍照。胼胝质沉积面积的像素由Adobe Photoshop 2015 CC计算,然后根据每平方毫米的像素数转换成面积。
酶活性测定
经过液氮研磨后答:芥用1.5 mL磷酸盐缓冲液(50 mM, pH 7.8)均质叶片(0.5 g)。我们在4°C下以10,000 rpm离心15分钟。上清液测定苯丙氨酸解氨酶(PAL)和过氧化物酶(POD)活性。POD酶活性测定如下[35].混合酶液0.1 mL, 4%愈创木酚0.2 mL, 0.46% H 0.2 mL2O.2,及2.5 mL 0.1 M磷酸钠缓冲液(pH 7.0)。我们记录了在25°C 470nm处3分钟吸光度的增加。以1单位的POD活性为导致吸光度每分钟变化0.01的酶量,按以下公式计算⋅分钟)]=ΔOD470⋅D / (0.01⋅ W ⋅t)(ΔOD470:吸光度的变化;D:稀释因子;W:鲜重;T:反应时间)。我们将含有0.1ml酶提取物,L-苯丙氨酸(2mM)和硼酸钠缓冲液(20mM,pH 8.8)的测定混合物在30℃下孵育1小时,对于PAL活性。测量由形成反式肉桂酸糖形成引起的0.01单位的吸光度增加。PAL酶活性[U /(g ⋅ h)] = ΔOD290.⋅D / (0.01⋅ W ⋅t) (36].改进β-1,3- a法测定葡聚糖酶活性[37].使用5ml乙酸钠缓冲液(50mM,pH 5.0)均匀化一克叶片样品,其在8000rpm下在4℃下进一步离心20分钟,得到粗提物。为了检测β-1,3-葡聚糖酶,将100ml粗提取物和100ml 1%层状蛋白的混合物在37℃下温育60分钟。将样品在沸水中加热10分钟以终止反应。催化1mg葡萄糖的产生所需的酶量−1β-1,3-葡聚糖酶活性的一个单位。
实时RT-PCR分析
如前所述,我们进行了定量RT-PCR [27]为了监测与防御相关的基因表达。植物RNA试剂盒(Omega,USA)用于从子叶中提取总RNA。通过紫外分光光度法测定260和280nm的吸光度与测量RNA质量的比率。为了去除污染基因组DNA,通过IScript逆转录(Bio-rad,USA)通过DNA酶I(NEB,USA)通过1μg的总RNA合成第一链互补DNA(cDNA)。由BGI Tech Solutions Co.,Ltd。合成引物(中国广东深圳)合成。附加文件3.:表S1列出引物序列[5.].采用CFX Connect实时PCR检测系统(Bio-Rad, USA),在光学96孔板中进行PCR,总体积为20 μL,包含10 μL 2× IQ SYBR Green Supermix试剂(Bio-Rad, USA),两种基因特异性引物各0.5 μL (10 pmol μL)−1),1μlcDNA,和8μlDDH2最终体积为20 μL。采用ΔΔCT(周期阈值)方法对所选基因与内参基因的相对表达量进行归一化AtUBQ5使用以下等式:目标量= 2−ΔΔCT,其中ΔΔCT = (Ct,目标- CT, ubq5)治疗- (Ct,目标- CT, ubq5)Ck[38].每个处理12株,3个生物重复,每个生物重复4株。
RNA-SEQ分析
莲座叶子浸入模拟的B16, B17或MeJA (Sigma,上海,中国)溶液中治疗四周大的婴儿答:芥植物。在B16、B17和MeJA溶液中分别有0.015% (v/v) Silwet L77和100 μM B16、B17和MeJA。模拟溶液含有0.015% (v/v) Silwet L77 (Sigma)。处理12和24 h后,收获第6片叶片(从最老的真叶到最年轻的真叶)答:芥被迅速冷冻在液氮中的植物[39].每次处理和每个时间点的三种盆栽植物的叶子被混合作为单一样本进行测序。RNA-seq由恒创基因技术公司(中国广东深圳)完成。原始RNA-Seq读取数据存储在序列读取归档(http://www.ncbi.nlm.nih.gov/sra/;BioProject ID: PRJNA555596)。根据制造商的说明,用于Illumina®(NEB,美国)的NEBNext®Ultra™RNA库准备试剂盒用于生成测序库。差异表达分析使用DEGSeq [40].问值(或FDR) < 0.01和|log2 (foldchange)| > 1为显著差异表达阈值。利用GOseq对差异表达基因(DEGs)进行基因本体论(GO)富集分析,并校正基因长度偏倚。GO功能分析为deg提供GO功能富集分析,为deg提供GO功能分类注释。基于基因本体数据库(http://www.geneontology.org/).
数据和材料的可用性
支持本文结果的数据集包含在本文及其附加文件中。基于基因本体数据库(http://www.geneontology.org/).原始RNA-Seq读取数据存储在序列读取归档(http://www.ncbi.nlm.nih.gov/sra/;BioProject ID: PRJNA555596)。
缩写
- 蓝芽:
-
Benzothiadiazole
- 度:
-
差异表达基因
- 等:
-
乙烯
- 去:
-
基因本体论
- ISR:
-
诱导全身性抵抗
- 是:
-
茉莉酸
- mamp:
-
微生物相关的分子模式
- 惩罚:
-
茉莉酸甲酯
- 朋友:
-
苯丙氨酸ammonia-lyase
- PAMPS:
-
其分子模式
- PGPR:
-
促进植物生长rhizobacterium
- 圆荚体:
-
过氧化物酶
- ROS:
-
活性氧
- 山:
-
水杨酸
- 特别行政区:
-
系统获得的阻力
参考文献
- 1.
Ryu Cm,Farag Ma,Hu Ch,Reddy Ms,Kloepper JW,ParéPW。细菌挥发物在拟南芥中诱导全身性抗性。植物理性。2004; 134:1017-26。
- 2.
牛德东,刘海霞,姜春华,王艳萍,王启云,金海林,郭建华。植物促生根际细菌蜡样芽孢杆菌AR156通过同时激活水杨酸盐和茉莉酸盐/乙烯依赖的信号通路,诱导拟南芥系统抗性。微生物与植物的互动。2011;24:533-42。
- 3.
植物生长促进真菌Penicillium simplicissimum GP17-2通过激活多种防御信号诱导拟南芥抗性。acta botanica yunnanica(云南植物研究). 2007;48:1724-36。
- 4.
Pieterse CM, van wee SC, van Pelt JA, Knoester M, Laan R, Gerrits H, Weisbeek PJ, van Loon LC。一种控制拟南芥诱导系统抗性的新信号通路。植物细胞。1998;10:1571 - 80。
- 5.
Naznin HA,Kiyohara D,Kimura M,Miyazawa M,Shimizu M,Hyakumachi M.植物生长促进真菌发出的挥发性有机化合物诱导的全身性抗性拟南芥。Plos一个。2014; 9:E868821。
- 6。
Farag MA, Ryu CM, Sumner LW, Paré PW。根际细菌挥发物的GC-MS SPME分析揭示了植物生长促进和诱导系统抗性的潜在诱导剂。植物化学。2006;67:2262-8。
- 7。
吴伙,刘y,徐义,张克,沉Q,张立。探讨芽孢杆菌淀粉胺氨基唑米硫杆菌SqR9诱导植物全身性抗性及其与植物信号通路的相互作用。Mol植物微生物相互作用。2018; 31:560-7。
- 8。
vlot ac,dempsey da,klessig df。水杨酸,一种对抗疾病的多方素激素。安努。Rev. phytopathol。2009; 47(1):177-206。
- 9.
Loon LCV, Rep M, Pieterse CMJ。诱导性防御相关蛋白在受感染植物中的意义。植物病理学杂志。2006;44:135-62。
- 10.
Pieterse CMJ, Zamioudis C, Berendsen RL, Weller DM, wee SCMV, Bakker PAHM。诱导有益微生物的全身抗性。植物病理学杂志。2014;52:347-75。
- 11.
Youngsang K, Choongmin R, Soohyun L, hyobe P, Han KS, junhan L, Kyunghee L, Woosik C, Mijeong J, Heekyu K.拟南芥幼苗对细菌挥发性物质的蛋白质组学分析。足底。2010;232:1355 - 70。
- 12.
丁二醇和苯并噻二唑对烟草炭疽病诱导抗性的比较。植物病理学研究。2010;59:643-53。
- 13.
Truitt CL, Paré PW。玉米的质膜蛋白与草食激发子volicitin结合。植物细胞。2004;16:523-33。
- 14.
王志强,王志强,王志强,等。蜡样芽孢杆菌YUF-4中2,3-丁二醇立体异构体形成机制的发现。发酵生物技术。1998;85:79-83。
- 15.
苯并噻二唑诱导的拟南芥对病原菌侵染、伤害和水渗入叶片的增强反应需要NPR1/NIM1基因。植物杂志。2002;128(3):1046 - 56。
- 16.
Rahman A,Kuldau Ga,uddin W.诱导多年生黑麦草在Magaporthe oryzae感染常年黑麦草中的水杨酸介导的防御反应。植物病理学。2014; 104(6):614-23。
- 17。
刘H,周X,Dong N,Liu X,张H,张Z.麦田MYB基因在转基因烟草中的表达增强了洛尔逊症的耐药性,以及干旱和盐胁迫。Funct综合基因组。2011; 11:431-43。
- 18。
孙建军,李超,李丽,友旭,李丽。3个荔枝品种鲜果6天贮藏过程中膜降解、酶促褐变和氧化胁迫的研究。Sci Hortic。2012;148:97 - 103。
- 19.
孙建明,付建峰,周荣军,苏文宁,闫晓荣。茉莉酸甲酯对人参根腐病发展的影响。Adv Mater Res. 2013; 610:3511-7。
- 20.
几丁质二聚体激活植物免疫受体。科学。2012;336(6085):1160 - 4。
- 21.
Cao Y,Liang Y,Tanaka K,Nguyen CT,Jedrzejczak RP,Joachimiak A,Stacey G.激酶Lyk5是拟南芥中的一个主要的几丁质受体,形成含有相关激酶Cerk1的甲壳素诱导的络合物。Elife。2014; 3:E03766。
- 22.
谷氨酸触发长距离钙基植物防御信号。科学。2018;361:1112-5。
- 23.
茉莉酸如何赢得他们的荣誉:过去和现在。植物生长规律。2015;34:761-94。
- 24.
博尔顿MD。原发性代谢与植物防御 - 火灾燃料。Mol植物微生物相互作用。2009; 22:487。
- 25.
植物生理学与植物病理学:植物初级代谢与植物-病原互作。J Exp Bot. 2007; 58:4019-26。
- 26.
张辉,刘明杰。植物和细菌之间通过空气信号的动态化学通讯:由细菌挥发物诱导的抗性。J Chem Ecol. 2013; 39:1007-18。
- 27.
林F,Liu N,Lai D,Kang Xh,Pang NW,江HK,徐HH。用芽孢杆菌种子播种的纽约饼。提供对番茄镰刀冠和根腐的控制。Biocontrol SCI技术。2017; 27:393-407。
- 28.
Kutschera A, Dawid C, Gisch N, Schmid C, Raasch L, Gerster T, Schaffer M, Smakowska-Luzan E, Belkhadir Y, Vlot AC,等。细菌中链3-羟基脂肪酸代谢物在拟南芥植物中触发免疫。科学。2019;364(6436):178 - 81。
- 29。
Monte I,Hamberg M,Chini A,Gimenezibanez S,GarcíacasadoG,Porzel A,Pazos F,Boter M,Solano R.族酸盐拮抗剂的合理设计。NAT CHEM BIOL。2014; 10:671-6。
- 30.
陈志强,陈志强,陈志强,等。肌醇磷酸增强COI1-JAZ共受体对茉莉酸的感知。大自然。2010;468(7322):400 - 5。
- 31.
Hauck P, Thilmony R, He SY。丁香假单胞菌III型效应抑制敏感拟南芥的细胞壁细胞外防御。美国国立科学研究院2003;100:8577-82。
- 32.
水稻苗期病害微生物农药asperellumtrichoderma SKT-1诱导拟南芥系统抗性。农业科学。2012;68:60-6。
- 33.
Lee B, Farag MA, Park HB, Kloepper JW, Lee SH, Ryu CM。长链细菌挥发物诱导抗性:多粘类芽孢杆菌产生的C13挥发物诱导植物系统防御。《公共科学图书馆•综合》。2012;7:e48744。
- 34.
一种合理设计的JAZ亚型选择性茉莉酸感知激动剂。Nat Commun。2018;9:3654 - 67。
- 35.
孙军,友新,李丽,彭华,苏伟,李超,何强,廖芳。磷脂酶D抑制剂对荔枝果实采后酶促褐变和氧化应激的影响。采后生物技术。2011;62:288-94。
- 36.
吕旭,孙丹,李艳,石伟,孙国刚。采前和采后水杨酸处理可缓解菠萝果实内部褐变并保持果实品质。Sci Hortic。2011;130:97 - 101。
- 37.
孙丹,吕旭,胡玉英,李伟,洪锴,莫颖,卡荷DM,谢建军。茉莉酸甲酯诱导香蕉对尖孢镰刀菌4小种的抗性增强。Sci Hortic。2013;164:484 - 91。
- 38.
Livak KJ, Schmittgen TD。利用实时荧光定量PCR技术分析相关基因表达数据−ΔΔCT方法。方法。2001;25:402-8。
- 39.
Van Verk MC, Van Dijken AJH, Mendes MP, Vroegop-Vos IA。茉莉酸基因调控网络的结构与动态。植物细胞。2017;29:2086 - 105。
- 40.
利用DESeq2对RNA-seq数据的折叠变化和离散度进行调节估计。基因组医学杂志。2014;15(12):550。
确认
我们承认Xiaoyi Wei(中国科学院华南植物园),以分析化合物B16和B17的立体异构结构的指导。
资金
基金资助:国家重点研发计划项目(no. 2017YFD0201100, no. 2017YFD0200307);广东省科技计划项目(no. 2017YFD0200307);广州市科技支撑项目(批准号:2014A050503056);201707020013和201707020013)。资助方在相关数据的设计、收集、分析或解释或手稿的写作中没有发挥任何作用。
作者信息
从属关系
贡献
FL和HHX构思和设计了这项工作。NL和XL进行了实验和数据分析。LLZ和YQT分离和鉴定的HN09发酵液中的代谢物B16和B17。FL和DL帮助写了稿件。所有作者都阅读并批准了手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
附加文件
额外的文件1:
图S1。枯草芽孢杆菌HN09诱导多种植物对不同病原体的防御反应。(一种) HN09增强全身抵抗Fusarium oxysporumf . sp。radicis-lycopersici在番茄。用HN09浸湿番茄植株的根(600 nm OD光密度600= 0.1)与ck处理(仅用溶剂)植物相比,叶片中疾病严重程度降低7 dpi (n= 4)。红框表示从植物根部开始出现的症状。(B.HN09增强抵抗力Magnaporthe oryzaegd00 - 193大米。在OD值下,用HN09处理一般感病品种丽江新团黑谷(LTH)和抗病品种HNBL9的2周龄水稻根600= 0.1;7 d后,在叶片上喷施1 × 10的g00 - 193细胞悬浮液5.CFU /毫升。采用实时荧光定量RT-PCR对g00 - 193在叶片上的生长情况进行定量分析。χ2对差异显着分析进行了测试;**表示显着差异P.< 0.01;***P.< 0.001。所显示的数据至少代表了三个独立的实验。(TIF 386 kb)
额外的文件2:
图S2。经济增长促进答:芥Col-0 HN09。1周答:芥用HN09、DH5α或无菌水处理col0不育植株,以后者作为对照。每次处理有30株植物。(一种)在处理后14 d拍摄各处理的代表性植株。(B.)每种治疗厂的干重。提出的数据来自代表性实验,其重复三次以相似的结果。不同的字母表明治疗之间的统计学意义差异(Fisher的最低差异;P.< 0.05).(TIF 8405 KB)
额外的文件3:
表S1。本研究使用的引物。(多克斯15 kb)
附加文件4:
数据集S1。本研究中B16,B17和JA治疗的DEGS列表。(XLSX 67 KB)
额外的文件5:
数据集S2。富集的氧化石墨烯从B16, B17和JA处理组的DEGs。(XLSX 29 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
刘楠,罗旭东,田勇。et al。的立体异构的枯草芽孢杆菌HN09代谢产物3,4-二羟基-3-甲基-2-戊酮诱导抗性拟南芥通过不同的信号通路。BMC植物杂志19,384(2019)。https://doi.org/10.1186/s12870-019-1985-6
收到了:
公认:
发表:
关键字
- PGPR.
- ISR
- 代谢物
- 3, 4-dihydroxy-3-methyl-2-pentanone
- 立体异构体