- 研究文章gydF4y2Ba
- 开放访问gydF4y2Ba
- 发表:gydF4y2Ba
转录组和磷蛋白蛋白质分析和代谢物分析揭示了Nahco的机制gydF4y2Ba3.gydF4y2Ba-诱导的葡萄根有机酸分泌gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba19.gydF4y2Ba文章编号:gydF4y2Ba383.gydF4y2Ba(gydF4y2Ba2019gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
有机酸分泌是植物对碱度的普遍生理反应。然而,人们对碱诱导的有机酸分泌的特征和潜在机制知之甚少。gydF4y2Ba
结果gydF4y2Ba
草酸是葡萄(葡萄属杂种)合成和分泌的主要有机酸gydF4y2Ba葡萄属amurensisgydF4y2Ba,gydF4y2Ba诉? ?gydF4y2Ba和gydF4y2Ba诉锐利gydF4y2Ba)根,乙酸的合成和苹果酸的分泌也在NaHCO下得到促进gydF4y2Ba3.gydF4y2Ba压力。NaHCOgydF4y2Ba3.gydF4y2Ba应力增强了HgydF4y2Ba+gydF4y2Ba葡萄根的流出速率,与质膜H有关gydF4y2Ba+gydF4y2Baatp酶活性。转录组分析显示,碳水化合物代谢是NaHCO作用下最显著的生物过程gydF4y2Ba3.gydF4y2Ba压力;共7个与有机酸代谢相关的基因发生显著改变,包括2个磷酸烯醇丙酮酸羧化酶和磷酸烯醇丙酮酸羧化酶激酶。此外,五种表达水平gydF4y2BaATP结合盒转运体gydF4y2Ba, 特别gydF4y2Ba磷酸腺苷盒式B19gydF4y2Ba,及gydF4y2Baal-活化的苹果酸盐转运蛋白2 sgydF4y2Ba被NaHCO大幅上调gydF4y2Ba3.gydF4y2Ba压力。磷蛋白组学分析表明,在分子功能方面,改变的磷蛋白主要与结合活性、催化活性和转运活性有关。磷酸化水平磷酸烯醇丙酮酸羧化酶3,两个质膜HgydF4y2Ba+gydF4y2Ba-ATPases 4、atp结合盒B19和多效性耐药12明显增加。此外,对乙烯合成和感知的抑制完全阻断了NaHCOgydF4y2Ba3.gydF4y2Ba-诱导有机酸分泌,而抑制吲哚乙酸合成减少了NaHCOgydF4y2Ba3.gydF4y2Ba-诱导有机酸分泌。gydF4y2Ba
结论gydF4y2Ba
我们的结果表明,草酸是碱胁迫下产生的主要有机酸,揭示了乙烯在调节有机酸分泌中的必要性。此外,我们进一步确定了几个负责有机酸代谢和分泌的候选基因和磷蛋白。gydF4y2Ba
背景gydF4y2Ba
土壤碱度是一个重要的环境问题,碱胁迫主要由NaHCO引起gydF4y2Ba3.gydF4y2Ba和钠gydF4y2Ba2gydF4y2Ba一氧化碳gydF4y2Ba3.gydF4y2Ba严重影响全球超过4.34亿公顷土地上的作物生长和发展[gydF4y2Ba1gydF4y2Ba]与中性盐胁迫相比,碱胁迫不仅引起渗透胁迫和离子伤害,而且还导致高pH伤害[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba];因此,碱胁迫比盐胁迫更具破坏性[gydF4y2Ba4gydF4y2Ba]然而,与植物耐盐性的广泛研究相比,人们很少关注探讨碱胁迫下植物耐盐性的机制。gydF4y2Ba
在碱胁迫下,植物必须调节细胞内pH值和根外pH值,以维持根的功能。有机酸在调节细胞和根际pH水平中起着关键作用。有报道称有机酸代谢与碱胁迫耐受性密切相关[gydF4y2Ba4gydF4y2Ba].gydF4y2Ba星星草gydF4y2Ba碱胁迫下根系积累和分泌柠檬酸到根际[gydF4y2Ba5gydF4y2Ba].HCOgydF4y2Ba3.gydF4y2Ba−gydF4y2Ba诱导水稻根中产生苹果酸、琥珀酸和柠檬酸[gydF4y2Ba6gydF4y2Ba]和玉米根中的苹果酸盐[gydF4y2Ba7gydF4y2Ba].此外,有机酸已被报道在植物适应其他非生物胁迫中发挥作用。例如,棉花和紫花苜蓿分别在干旱和盐胁迫下积累更多的柠檬酸[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].植物面对铝、磷、镉毒害时,在细胞中积累有机酸并分泌到根际[gydF4y2Ba10.gydF4y2Ba,gydF4y2Ba11.gydF4y2Ba,gydF4y2Ba12.gydF4y2Ba]关于碱诱导有机酸合成和分泌的机制,一些参与有机酸代谢的关键酶,如柠檬酸合成酶、苹果酸合成酶和异柠檬酸裂解酶,已被建议用于确定碱胁迫耐受性[gydF4y2Ba13.gydF4y2Ba].质膜HgydF4y2Ba+gydF4y2Ba-Atpases,如gydF4y2Ba拟南芥gydF4y2BaAHA2和AHA7是植物耐碱性质子分泌所必需的[gydF4y2Ba11.gydF4y2Ba,gydF4y2Ba14.gydF4y2Ba]此外,一些研究表明乙烯和生长素在根H的调节中起作用gydF4y2Ba+gydF4y2Ba通过调节H分泌和碱应力gydF4y2Ba+gydF4y2Baatp酶(gydF4y2Ba15.gydF4y2Ba,gydF4y2Ba16.gydF4y2Ba].gydF4y2Ba
到目前为止,在碱胁迫下,葡萄细胞内的有机酸代谢和有机酸挤出的途径仍然是未知的。基因表达谱的基因组规模分析是揭示植物非生物逆境耐受机制的一种有力方法[gydF4y2Ba17.gydF4y2Ba,gydF4y2Ba18.gydF4y2Ba].例如,转录组分析揭示了小麦耐碱性的遗传基础[gydF4y2Ba18.gydF4y2Ba和对NaHCO反应的基因网络gydF4y2Ba3.gydF4y2Ba压力gydF4y2Ba甘蒙柽柳hispidagydF4y2Ba[gydF4y2Ba17.gydF4y2Ba].对mRNA转录组的定量和全面的见解将有助于促使有机酸分泌的关键机制响应碱处理。另一方面,磷酸化代表了各种生物途径中最重要的后翻译方法之一。与有机酸合成和挤出有关的几种蛋白质的活性,例如磷酸丙酮酸羧酸盐(Pepc)和H.gydF4y2Ba+gydF4y2Baatp酶(gydF4y2Ba19.gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba],已被证明受磷酸化的调节。为了更好地了解碱胁迫下有机酸的分泌过程,需要对碱胁迫诱导的全面磷酸化修饰进行分析。gydF4y2Ba
葡萄作为深根多年生植物,是世界上重要的经济水果作物,其生长和果实品质在很大程度上受土壤碱度和盐度的影响。大多数用于葡萄栽培的商品化砧木和品种对碱胁迫有中等敏感性。而候选砧木品种A15具有较强的耐碱性,是鉴定耐碱相关基因的合适材料。此外,A15被鉴定为比其他中等或弱耐碱的葡萄砧木具有更高的有机酸分泌能力[gydF4y2Ba21.gydF4y2Ba].本研究确定了有机酸和H的积累和分泌gydF4y2Ba+gydF4y2BaNaHCO后不同时间点的射流gydF4y2Ba3.gydF4y2Ba治疗。此后,使用转录组和磷蛋白酶分析鉴定上述方法中涉及的关键基因和磷蛋白。另外,评价乙烯和吲哚乙酸(IAA)在碱土中介导有机酸分泌的作用。结果提供了解剖葡萄树根中碱应激耐受性的代谢和调节途径的有价值的信息。gydF4y2Ba
结果gydF4y2Ba
NaHCO的影响gydF4y2Ba3.gydF4y2Ba葡萄根中有机酸的合成与分泌gydF4y2Ba
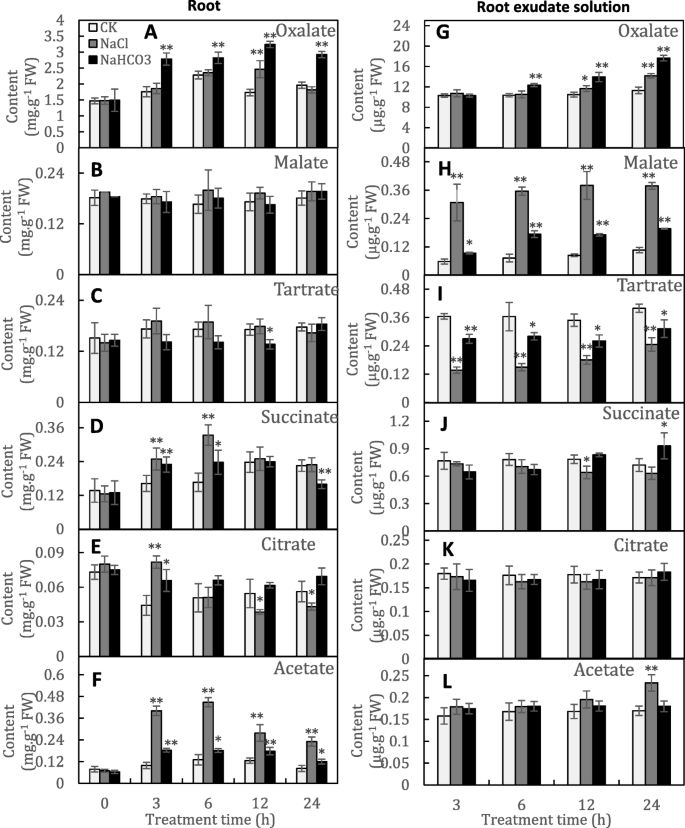
共鉴定出六种有机酸:草酸、苹果酸、酒石酸、琥珀酸、柠檬酸和乙酸。草酸是主要的有机酸,占对照根中六种有机酸总量的69.5-71.3%。相比之下,其他五种有机酸,尤其是柠檬酸,浓度相对较低(图。gydF4y2Ba1gydF4y2BaA-F)。还发现了在培养溶液中有机酸浓度的类似差异(图。gydF4y2Ba1gydF4y2Bag-l);因此,草酸是葡萄根合成和分泌的主要有机酸。NaHCO中草酸的含量gydF4y2Ba3.gydF4y2Ba-处理的根系在处理3 ~ 24 h显著增强,在12 HAT时比对照根系最大增加87.1%(图2)。gydF4y2Ba1gydF4y2Baa) 。草酸合成的增加促进了草酸的分泌,并导致培养液中草酸的持续积累;NaHCO中的草酸含量gydF4y2Ba3.gydF4y2Ba培养液在24小时内达到对照溶液的1.56倍(图。gydF4y2Ba1gydF4y2Bag) .此外,NaHCOgydF4y2Ba3.gydF4y2Ba治疗持续显著增强乙酸酯合成,但没有促进其分泌(图。gydF4y2Ba1gydF4y2Baf、 相比之下,其他有机酸通常不受NaHCO的影响gydF4y2Ba3.gydF4y2Ba治疗。然而,值得注意的是,在含NaHCO的培养液中苹果酸的含量gydF4y2Ba3.gydF4y2Ba在所有时间点上显著增加(图2)。gydF4y2Ba1gydF4y2Bah).另一方面,NaCl作为正对照处理对有机酸的合成和分泌产生不同的影响,例如,NaCl对草酸和苹果酸分泌的影响分别比NaHCO减少和更强gydF4y2Ba3.gydF4y2Ba(无花果。gydF4y2Ba1gydF4y2Bag、 h)。因此,NaHCO作用下有机酸合成和分泌的变化gydF4y2Ba3.gydF4y2Ba都是由NagydF4y2Ba+gydF4y2Ba和gydF4y2Ba- - - - - -gydF4y2BaHCOgydF4y2Ba3.gydF4y2Ba.gydF4y2Ba
NaHCOgydF4y2Ba3.gydF4y2Ba治疗促进H.gydF4y2Ba+gydF4y2Ba葡萄藤根的分泌物gydF4y2Ba
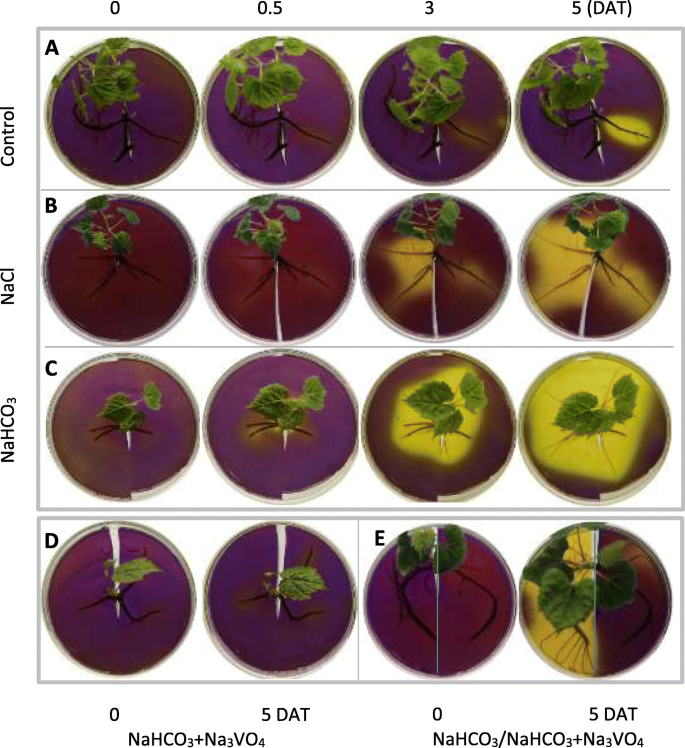
检测根HgydF4y2Ba+gydF4y2Ba将不同处理的葡萄根置于pH敏感的溴甲酚紫固体培养基中培养10天 h(图。gydF4y2Ba2gydF4y2Ba)。根周围出现颜色变化,表明pH值发生变化。对于对照根,在0.5和3时,只有酸性物质分泌较少,如淡黄色所示 在处理后(DAT)天,酸性物质逐渐分泌和积累,在5 DAT时在根周围的小区域产生清晰的黄色(图。gydF4y2Ba2gydF4y2Baa).相反,用NaHCO处理的根gydF4y2Ba3.gydF4y2Ba在0.5 DAT时开始产生清晰的黄色,并在3和5 DAT时产生大面积的黄色(图。gydF4y2Ba2gydF4y2BaC),表明有大量酸性物质积累。此外,NaCl处理为阳性对照,其颜色呈清晰的黄色,但面积和强度均小于NaHCO处理gydF4y2Ba3.gydF4y2Ba治疗(图。gydF4y2Ba2gydF4y2BaB,C);因此,酸性物质的生产归因于NAgydF4y2Ba+gydF4y2Ba和gydF4y2Ba−gydF4y2BaHCOgydF4y2Ba3.gydF4y2Ba.此外,HgydF4y2Ba+gydF4y2Ba-ATP酶抑制剂钠gydF4y2Ba3.gydF4y2BaVOgydF4y2Ba4gydF4y2Ba几乎完全抑制了黄色的产生(图。gydF4y2Ba2gydF4y2Bad),表明酸分泌与PM H有关gydF4y2Ba+gydF4y2Baatp酶活性。值得注意的是,黄色的产生伴随着新生长的根的出现(图。gydF4y2Ba2gydF4y2Baa-c),同时处理NaHCO几乎完全抑制黄颜色和新根的产生gydF4y2Ba3.gydF4y2Ba加钠gydF4y2Ba3.gydF4y2BaVOgydF4y2Ba4gydF4y2Ba(无花果。gydF4y2Ba2gydF4y2Bad)。使用固体培养基进一步实验,其中一半含有NagydF4y2Ba3.gydF4y2BaVOgydF4y2Ba4gydF4y2Ba,表明根系生长和HgydF4y2Ba+gydF4y2Ba分泌物基本上受到影响gydF4y2Ba+gydF4y2Ba-ATP酶活性(图。gydF4y2Ba2gydF4y2Bae)。因此,NaHCOgydF4y2Ba3.gydF4y2Ba治疗诱导HgydF4y2Ba+gydF4y2Ba分泌,伴随着新根的生长。gydF4y2Ba
NaHCO的影响gydF4y2Ba3.gydF4y2Ba、NaCl和钒酸盐对根际酸化的影响。5周龄离体芽培养物的根用pH 7.0水处理(gydF4y2Ba一个gydF4y2Ba)、75 mM NaCl (pH 7.0) (gydF4y2BabgydF4y2Ba), 75 mM那科gydF4y2Ba3.gydF4y2Ba(pH值8.7)(gydF4y2BacgydF4y2Ba)和75 mM NaHCOgydF4y2Ba3.gydF4y2Ba加0.1 嗯,那gydF4y2Ba3.gydF4y2BaVOgydF4y2Ba3.gydF4y2Ba(gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba) 6小时。用去离子水冲洗根后,将根小心地铺在培养皿底部,然后用含有0.006%溴甲酚紫色和0.8%琼脂的琼脂片覆盖根。除溴甲酚紫和琼脂外,钠gydF4y2Ba3.gydF4y2BaVOgydF4y2Ba4gydF4y2Ba添加到整个琼脂板中gydF4y2BadgydF4y2Ba并进入琼脂薄片的右侧gydF4y2BaegydF4y2Ba
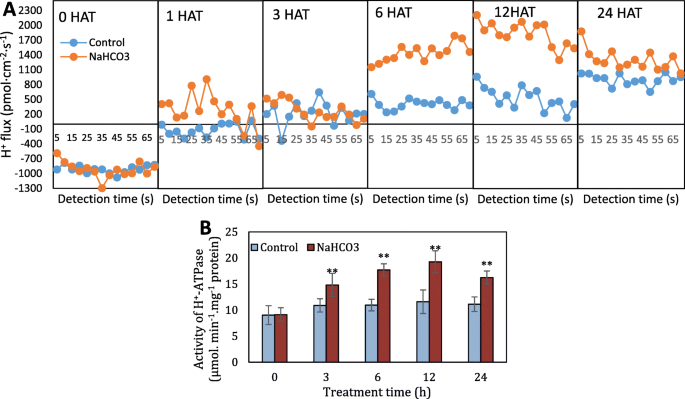
另一方面,HgydF4y2Ba+gydF4y2Ba采用无创微量检测技术进一步测定HgydF4y2Ba+gydF4y2BaNaHCO下的分泌gydF4y2Ba3.gydF4y2Ba治疗(图。gydF4y2Ba3.gydF4y2Baa). H的高负值gydF4y2Ba+gydF4y2Ba处理前的通量表明H的流入gydF4y2Ba+gydF4y2Ba进入根细胞。相比之下,HgydF4y2Ba+gydF4y2Ba流量逐渐变为流出,这可以从控制组和NaHCO的正值看出gydF4y2Ba3.gydF4y2Ba从1 HAT处理根。与低H相比gydF4y2Ba+gydF4y2Ba控制根的射流速率,HgydF4y2Ba+gydF4y2BaNaHCO处理根的流出速率gydF4y2Ba3.gydF4y2Ba在6点和12点的时候非常高。此外,HgydF4y2Ba+gydF4y2Ba处理后的根内流出率在12 HAT时发生。另一方面,NaHCOgydF4y2Ba3.gydF4y2Ba- 治疗的根具有更高的hgydF4y2Ba+gydF4y2Ba-ATPase活性显著高于对照,其中12hat处理根的-ATPase活性最高,是对照的0.46倍。gydF4y2Ba3.gydF4y2Bab)。gydF4y2Ba
鉴定葡萄根对NaHCO反应的转录组变化gydF4y2Ba3.gydF4y2Ba
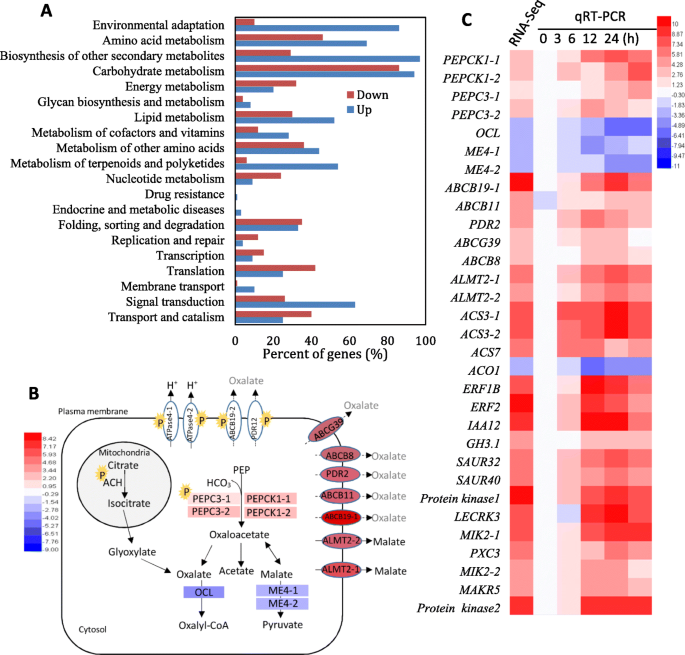
通过对对照和NaHCO的RNA-Seq分析,探讨碱胁迫诱导草酸分泌的机制gydF4y2Ba3.gydF4y2Ba对处理过的葡萄根进行量化基因变化。共有3232个基因和1714个基因在NaHCO中至少有一倍的上调和下调gydF4y2Ba3.gydF4y2Ba-处理的葡萄根,gydF4y2Ba2gydF4y2Ba),展示NahcogydF4y2Ba3.gydF4y2Ba处理引起了葡萄根中大量的转录重编程。所有注释的差异表达基因(DEGs)都与20个生物学过程相关。碳水化合物代谢过程中含有最多的DEGs;此外,其他次生代谢产物的生物合成、环境适应、氨基酸代谢和信号转导等生物过程也发生了明显的变化(图2)。gydF4y2Ba4gydF4y2Ba一个)。gydF4y2Ba
功能类别(gydF4y2Ba一个gydF4y2Ba),以及参与有机酸代谢和挤压的关键基因和蛋白(gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba)与乙烯、IAA和受体激酶相关的信号传导(gydF4y2BacgydF4y2Ba).NaHCO处理12 h后,用10毫米长的葡萄根进行RNA-SeqgydF4y2Ba3.gydF4y2Ba治疗。在面板gydF4y2Ba一个gydF4y2Ba根据基因本体对RNA-Seq中的DEG进行功能分类gydF4y2BabgydF4y2Ba,利用与有机酸代谢和挤压相关的基因和蛋白构建了原理图。基因表达的归一化值以颜色标度显示,以黄色背景色突出的P表示磷蛋白。灰色表示草酸可能的转运体。在面板gydF4y2BacgydF4y2Ba,利用乙烯和IAA的代谢和信号转导及受体激酶相关基因构建了热图。基因表达的归一化值用颜色标度表示。通过比较所选基因在NaHCO中的相对表达值,计算qRT-PCR的Fold changegydF4y2Ba3.gydF4y2Ba-处理和控制藤根gydF4y2Ba
在碳水化合物代谢过程中,NaHCO显著改变了参与草酸和苹果酸代谢的7个基因的表达gydF4y2Ba3.gydF4y2Ba治疗(图。gydF4y2Ba2gydF4y2Ba和图。gydF4y2Ba4gydF4y2Bab) .两个PEPC及其激酶(PEPCK)显著上调,对草酰乙酸的生物合成起到积极作用,从而为草酰乙酸和苹果酸的生物合成提供底物gydF4y2Ba草酸——辅酶a连接酶gydF4y2Ba基因(gydF4y2BaOCLgydF4y2Ba)和两个gydF4y2BaNADP-malic酶gydF4y2Ba(ME)基因显著下调,分别降低草酸和苹果酸的降解。此外,表达五gydF4y2Ba磷酸腺苷磁带gydF4y2Ba(gydF4y2Ba美国广播公司gydF4y2Ba)gydF4y2Ba转运蛋白gydF4y2Ba,属于膜转运过程,表达量大幅增加,特别是表达量增加gydF4y2Ba磷酸腺苷盒式B19gydF4y2Ba(gydF4y2BaABCB19gydF4y2Ba)增加了9.66倍。两个gydF4y2Baaluminum-activated苹果酸转运蛋白gydF4y2Ba(gydF4y2BaALMTsgydF4y2Ba)在NaHCO中表达高于5.0倍gydF4y2Ba3.gydF4y2Ba-处理的根比对照根的根大。gydF4y2Ba血浆膜gydF4y2Ba(gydF4y2Ba颗粒物gydF4y2Ba)gydF4y2BaHgydF4y2Ba+gydF4y2Baatp酶PMA2gydF4y2Ba和gydF4y2BaAHA11gydF4y2Ba只在NaHCOgydF4y2Ba3.gydF4y2Ba-处理的根,但每千碱基转录本每百万映射reads (RPKM)值非常低,表明它们可能不是葡萄根的主要质子泵。gydF4y2Ba
在信号转导过程中,变化最显著的途径是乙烯信号通路,其中与乙烯生物合成和信号转导相关的51个基因被转录修饰。六个gydF4y2Ba1-aminocyclopropane-1-carboxylic酸gydF4y2Ba(gydF4y2BaACCgydF4y2Ba)gydF4y2Ba合成酶gydF4y2Ba(gydF4y2BaACSsgydF4y2Ba)被NaHCO显著上调gydF4y2Ba3.gydF4y2Ba治疗;相比之下,两个gydF4y2BaACC氧化酶类gydF4y2Ba(gydF4y2BaACOsgydF4y2Ba)转录改变,和gydF4y2BaACO1gydF4y2Ba下调2.97倍(附加文件gydF4y2Ba1gydF4y2Ba:表S1)。此外,IAA代谢和信号传导也发生了显著变化。与IAA代谢和信号相关的四个基因的表达上调超过5倍,包括gydF4y2Baindole-3-acetic acid-amido合成酶gydF4y2Ba(gydF4y2BaGH3gydF4y2Ba)和三gydF4y2BaIAA反应因素gydF4y2Ba(gydF4y2BaIAA12.gydF4y2Ba,gydF4y2BaSAUR32gydF4y2Ba和gydF4y2Ba索尔40gydF4y2Ba).此外,位于质膜的6个蛋白激酶被NaHCO显著上调gydF4y2Ba3.gydF4y2Ba提示质膜蛋白受磷酸化调控。gydF4y2Ba
另一方面,采用qRT-PCR检测了NaHCO后不同时间34个差异表达基因,其中包含了参与有机代谢和转运以及激素生物合成和信号转导的基因gydF4y2Ba3.gydF4y2Ba治疗。在DEG标签谱中也发现了类似的表达变化,这不仅验证了DEG的可靠性,而且还展示了它们在碱胁迫下的表达模式(图)。gydF4y2Ba4gydF4y2Bac) 。gydF4y2Ba
定量分析磷酸化蛋白水平显著改变响应NaHCOgydF4y2Ba3.gydF4y2Ba
我们鉴定了2669个独特的磷酸化蛋白,共包含6312个非冗余磷酸化位点。其中丝氨酸磷酸化位点5404个(85.6%),苏氨酸磷酸化位点877个(13.9%),酪氨酸磷酸化位点31个(0.49%)。在2669个磷酸化蛋白中,鉴定出2141个磷酸化蛋白,其磷酸化位点数量从1个到25个不等;总共有1822个和608个磷酸化蛋白分别包含一个和两个磷酸化位点(附加文件gydF4y2Ba2gydF4y2Ba:表S2)。gydF4y2Ba
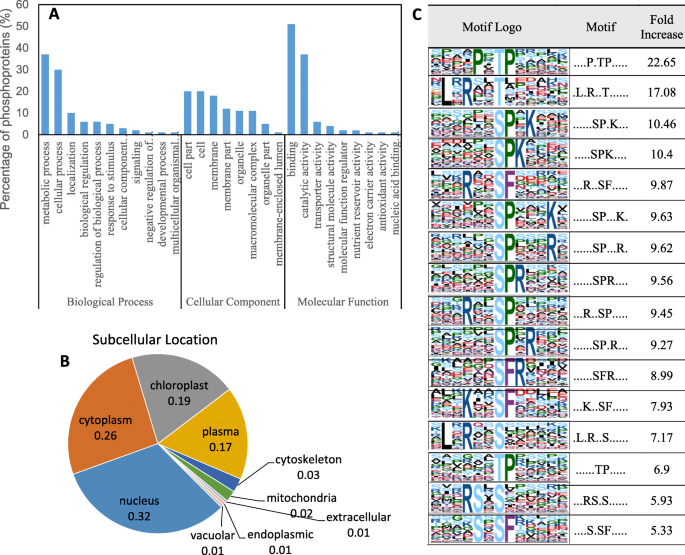
比较NaHCO之间的磷酸化水平时gydF4y2Ba3.gydF4y2Ba-处理和对照样品中,共有197个磷酸化蛋白(270个磷酸化位点)发生了显著变化(比率≥1.5,gydF4y2BaPgydF4y2Ba < 0.05),其中107个上调,163个下调(附加文件gydF4y2Ba2gydF4y2Ba:表S2)。根据生物过程、细胞成分和分子功能,使用Blast2GO对197个磷蛋白进行注释(图。gydF4y2Ba5gydF4y2Baa).将磷酸化蛋白分为11个生物过程,其中代谢过程、细胞过程和定位是前三大类。在分子功能方面,磷蛋白被分为9类,前3类分别是结合活性、催化活性和转运活性。在细胞组分中,细胞部分、细胞和细胞膜中磷蛋白含量最高(图2)。gydF4y2Ba5gydF4y2Baa) .经NaHCO修饰的磷蛋白gydF4y2Ba3.gydF4y2Ba主要定位于细胞核、细胞质、叶绿体和血浆(图。gydF4y2Ba5gydF4y2Bab).此外,Motif-X分析鉴定出16个显著富集的motif(图2)。gydF4y2Ba5gydF4y2Bac) 。gydF4y2Ba
差异磷酸化蛋白的分布(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba)显著富集磷酸化位点(gydF4y2BacgydF4y2Ba).根据197种磷酸化蛋白的生物学过程、细胞成分、分子功能和亚细胞位置对其进行了分类(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba).基因本体论(GO)注释蛋白质组来源于UniProt-GOA数据库(www。gydF4y2Bahttp://www.ebi.ac.uk/GOA/gydF4y2Ba).Soft motif-x用于分析所有蛋白质序列中由修饰-21-mers特定位置的氨基酸构成的序列模型(该位点上游和下游的10个氨基酸,但与修饰-13-mers的磷酸化是该位点上游和下游的6个氨基酸)。所有数据库蛋白质序列都用作背景数据库参数和其他默认参数gydF4y2Ba
参与草酸和苹果酸合成的Aconitate hydratase (ACH)和PEPC3-1在NaHCO中显著磷酸化gydF4y2Ba3.gydF4y2Ba与对照组比较(图。gydF4y2Ba4gydF4y2Bab;表格gydF4y2Ba1gydF4y2Ba).两种质膜定位atp酶(ATPase4-1,特别是ATPase4-2)的磷酸化水平显著增强,这与HgydF4y2Ba+gydF4y2Ba为草酸盐和苹果酸盐穿过质膜的运输提供能量。此外,两种质膜ABC转运体ABCB19-2和草酸的潜在转运体多效耐药12 (PDR12)也显著磷酸化。此外,两种质膜定位的丝氨酸/苏氨酸蛋白激酶(STY46亚型X1和CDL1)、乙烯合成的ACO4和ACO11以及乙烯信号转导的EIN2的磷酸化水平也发生了显著变化(图2)。gydF4y2Ba4gydF4y2Bab;表格gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
葡萄根系分泌有机酸涉及乙烯和IAAgydF4y2Ba
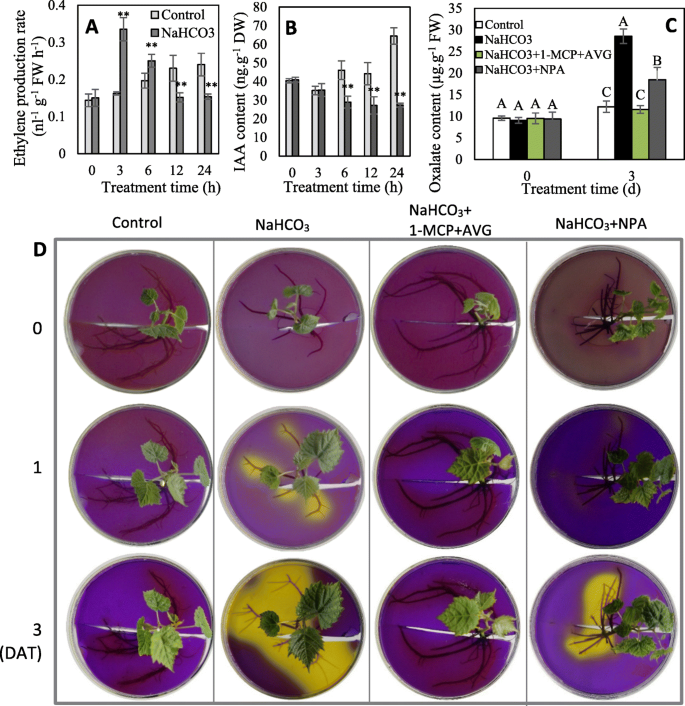
转录组学和/或磷酸化蛋白质组学分析表明,NaHCO显著改变了IAA和乙烯的代谢和信号传导gydF4y2Ba3.gydF4y2Ba治疗。揭示乙烯和IAA在介导NaHCO中的作用gydF4y2Ba3.gydF4y2Ba-NaHCO诱导有机酸分泌、乙烯和IAA的变化gydF4y2Ba3.gydF4y2Ba研究了乙烯、IAA生物合成和/或信号转导对有机酸分泌的影响。与对照组相比,NaHCOgydF4y2Ba3.gydF4y2Ba处理显著提高了3和6 HAT的乙烯产量,但显著降低了12和24 DAT的乙烯产量。NaHCO可显著降低IAA含量gydF4y2Ba3.gydF4y2Ba在6 DAT时,IAA含量下降了57.6%(图2)。gydF4y2Ba6gydF4y2Baa, b).此外,通过氨基乙氧基乙烯甘氨酸(AVG)和1-甲基环丙烯(1-MCP)抑制乙烯生物合成和感知完全阻断了NaHCOgydF4y2Ba3.gydF4y2Ba-诱导的有机酸分泌和通过1-N-萘酞酸(NPA)抑制IAA生物合成显著降低了NaHCOgydF4y2Ba3.gydF4y2Ba-诱导的有机酸分泌(图。gydF4y2Ba6gydF4y2Bac, d).因此,乙烯信号在NaHCO作用下调节有机酸分泌是必要的gydF4y2Ba3.gydF4y2Ba, IAA也参与了这一进程;此外,它们的作用很大程度上受它们在植物中的浓度影响。gydF4y2Ba
乙烯的变化(gydF4y2Ba一个gydF4y2Ba)和IAA(gydF4y2BabgydF4y2Ba)及其对有机酸分泌的抑制作用(gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba).1-MCP, 1-甲基环丙烯,乙烯感知抑制剂;AVG, 1- n -萘基酞酸,IAA转运抑制剂;AVG,氨基乙氧基乙烯基甘氨酸,乙烯生物合成抑制剂。DAT,治疗后几天。在面板gydF4y2Ba一个gydF4y2Ba-gydF4y2BacgydF4y2Ba,值表示三个重复的平均值±标准差。**高度显著差异,gydF4y2BaPgydF4y2Ba< 0.01;由不同大写字母表示的值在gydF4y2BaPgydF4y2Ba< 0.01gydF4y2Ba
讨论gydF4y2Ba
草酸的积累和分泌是葡萄根对碱胁迫的重要生理反应gydF4y2Ba
植物根系与土壤直接接触,通过分泌大量化合物来适应不利的根际环境,这是根系对环境胁迫最直接、最明显的反应[gydF4y2Ba5gydF4y2Ba]在碱胁迫下,许多植物中观察到有机酸的积累。在碱胁迫下,葡萄根系高度积累和分泌草酸(图。gydF4y2Ba1gydF4y2Baa,g)。在根部中也发现了大量的草酸盐gydF4y2BaKochia sieversianagydF4y2Ba和gydF4y2Ba碱蓬glaucagydF4y2Ba在碱胁迫下[gydF4y2Ba22.gydF4y2Ba,gydF4y2Ba23.gydF4y2Ba].相比之下,gydF4y2Ba虎尾草gydF4y2Ba在碱胁迫下,小麦根系分泌大量乳酸、乙酸和甲酸[gydF4y2Ba24.gydF4y2Ba,gydF4y2Ba25.gydF4y2Ba].有机酸的积累和分泌,包括草酸、柠檬酸和苹果酸,通过在碱和盐胁迫下提供负电荷,在渗透调节、pH调节和离子平衡维持中发挥重要作用[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba22.gydF4y2Ba,gydF4y2Ba23.gydF4y2Ba].这项研究表明,NahcogydF4y2Ba3.gydF4y2Ba和NaCl刺激有机酸的分泌,而NaHCO的分泌则相反gydF4y2Ba3.gydF4y2Ba产生了更酸性的根际环境(图。gydF4y2Ba2gydF4y2Bab、 c)此外,NaHCOgydF4y2Ba3.gydF4y2BaNaCl对草酸盐、醋酸盐和苹果酸有不同的影响(图。gydF4y2Ba1gydF4y2Ba).同样,以往的报道也表明碱和盐胁迫对有机酸的代谢和分泌有不同的影响。以枸橼酸为例,枸橼酸是最主要的有机酸,其浓度在碱胁迫下显著增加,而在盐胁迫下显著降低gydF4y2Ba星星草gydF4y2Ba根;此外,碱胁迫会使柠檬酸分泌到根际,而盐胁迫则不会[gydF4y2Ba5gydF4y2Ba].柠檬酸和苹果酸的含量也有不同的变化gydF4y2Ba虎尾草gydF4y2Ba在碱及盐压力下[gydF4y2Ba25.gydF4y2Ba].gydF4y2Ba
因此,有机酸的分泌是植物普遍的生理反应,而草酸是葡萄根合成和分泌的主要有机酸。此外,gydF4y2Ba−gydF4y2BaHCOgydF4y2Ba3.gydF4y2Ba对诱导葡萄根中草酸的合成和分泌起关键作用。gydF4y2Ba
碱胁迫下有机酸合成和分泌的可能途径gydF4y2Ba
植物中草酸的生物合成有三个途径,即乙醇酸/乙醛酸途径、抗坏血酸途径和草酰乙酸(OAA)途径[gydF4y2Ba26.gydF4y2Ba,gydF4y2Ba27.gydF4y2Ba].在碱胁迫下,大量的gydF4y2Ba−gydF4y2BaHCOgydF4y2Ba3.gydF4y2Ba进入根,为PEP提供底物,利用β-羧化催化PEP生成OAAgydF4y2Ba−gydF4y2BaHCOgydF4y2Ba3.gydF4y2Ba在不可逆过程中的胞质中[gydF4y2Ba28.gydF4y2Ba];随后,OAA可转化为草酸、乙酸和苹果酸(图。gydF4y2Ba4gydF4y2Bab)。gydF4y2Ba拟南芥gydF4y2Ba,gydF4y2Bapepc3gydF4y2Ba突变体消除了盐胁迫引起的苹果酸的增加,表明了苹果酸的作用gydF4y2BaAtPEPC3gydF4y2Ba在规管有机酸合成方面[gydF4y2Ba29.gydF4y2Ba].两种表达显著上调gydF4y2BaPepc3.gydF4y2Ba碱胁迫下的基因可能增强OAA合成和随后的OAA转化为草酸盐和乙酸盐(图。gydF4y2Ba4gydF4y2Bab,c)。除了转录调节之外,Pepc活性还通过磷酸溶胶羧基羧化酶激酶(PEPCK)催化的磷酸化来调节[gydF4y2Ba20.gydF4y2Ba].PEPC磷酸化在gydF4y2Bapepc3gydF4y2Ba突变体gydF4y2Ba拟南芥gydF4y2Ba在盐胁迫下[gydF4y2Ba20.gydF4y2Ba,提示PEPC3可能是PEPCKs的靶蛋白。两种表达水平显著升高gydF4y2BaPEPCK1gydF4y2Ba基因和PEPC3-1的磷酸化水平也表明PEPCK1s对PEPC3-1的磷酸化调控(图3)。gydF4y2Ba4gydF4y2Ba综上所述,OAA途径是碱胁迫下草酸和乙酸盐生物合成的主要途径。然而,值得注意的是,葡萄根中的乙醇酸/乙醛酸通路也可能在碱胁迫下被修改,这可以从乙醇酸/乙醛酸通路的关键蛋白aconitase (aconitase)的磷酸化水平显著升高中看出[gydF4y2Ba30.gydF4y2Ba].gydF4y2Ba
HgydF4y2Ba+gydF4y2Ba有机酸阴离子在质膜上的挤压和转运是由PM H控制的gydF4y2Ba+gydF4y2Ba- atp酶,通过为转运体创造电化学质子梯度提供能量[gydF4y2Ba31.gydF4y2Ba].点HgydF4y2Ba+gydF4y2Ba- atp酶在根质子分泌适应碱性胁迫中起重要作用[gydF4y2Ba15.gydF4y2Ba];高H点gydF4y2Ba+gydF4y2Ba-ATP酶活性和质子分泌已被证明能增强植物对碱性胁迫的耐受性[gydF4y2Ba32.gydF4y2Ba],而较低的pmhgydF4y2Ba+gydF4y2Ba- atp酶活性和质子分泌导致对碱性胁迫的敏感性[gydF4y2Ba33.gydF4y2Ba].PM H.gydF4y2Ba+gydF4y2Ba- atp酶活性受到若干N-和c -末端残基磷酸化的严格调控,特别是暴露在各种环境刺激下[gydF4y2Ba34.gydF4y2Ba].磷酸化水平的显着增加表明,两个ATP酶4是碱应激下葡萄根中的钥匙质子泵(图。gydF4y2Ba4gydF4y2Bab,表gydF4y2Ba1gydF4y2Ba).atp酶4gydF4y2Ba拟南芥gydF4y2Ba(AHA4)和烟草(PMA4)植物也被报道参与耐盐性[gydF4y2Ba35.gydF4y2Ba,gydF4y2Ba36.gydF4y2Ba]因此,ATP酶4可能在植物对碱和盐胁迫的耐受性中起作用。gydF4y2Ba
相比之下,草酸的具体转运体仍不清楚。然而,一些实验已经表明了ABC转运体在植物中转运有机酸的作用。四种ABC转运体(ABCG11, ABCG21, ABCA2, ABCB21)被认为可能参与铝胁迫下草酸和/或柠檬酸的分泌gydF4y2Ba粮食苋菜gydF4y2Ba根(gydF4y2Ba10.gydF4y2Ba].AtPDR6,属于ABC转运子家族中的ABCG亚家族,参与有机酸的根挤压,包括琥珀酸、富马酸和苹果酸[gydF4y2Ba37.gydF4y2Ba].在本研究中,五种基因的表达水平gydF4y2BaABC运输机gydF4y2Ba年代,特别是gydF4y2BaABCB19-1gydF4y2Ba,显著增加NaHCOgydF4y2Ba3.gydF4y2Ba治疗(图。gydF4y2Ba4gydF4y2Bab、 附加文件gydF4y2Ba1gydF4y2Ba表S1),表明它们与有机酸分泌有关。特别地,表示gydF4y2BaABCB19-1gydF4y2Ba与根中草酸含量密切相关(图。gydF4y2Ba4gydF4y2Bac,无花果。gydF4y2Ba1gydF4y2BaA),表明其在运输草酸盐中的作用。此外,两种ABC转运蛋白ABCB19-2和PDR12显著磷酸化(见表)gydF4y2Ba1gydF4y2Ba)和PDR12已被报道介导水溶性羧酸阴离子在酵母中的挤出[gydF4y2Ba38.gydF4y2Ba];因此,ABCB19-2和PDR12可能参与了有机酸的转运。然而,上述转运体的具体功能还需进一步研究。gydF4y2Ba
ALMTs在植物基因组中被发现,并参与不同细胞类型的一系列不同功能。ALMT1在许多植物耐铝反应中介导有机酸分泌的作用[gydF4y2Ba39.gydF4y2Ba].相比之下,ALMT2转运体介导了有机阴离子(如苹果酸和柠檬酸)通过小麦质膜的铝独立电致转运[gydF4y2Ba40gydF4y2Ba].两种基因的上调gydF4y2BaALMT2S.gydF4y2Ba(无花果。gydF4y2Ba4gydF4y2Bab、c)和苹果酸含量的增加表明ALMT2转运体介导了盐和碱诱导的葡萄根苹果酸的挤压。值得注意的是,在盐和碱胁迫下,苹果酸分泌的大量增加并没有伴随其积累(图。gydF4y2Ba1gydF4y2Bab, h).在铝胁迫下的其他植物中也发现了类似的现象[gydF4y2Ba22.gydF4y2Ba,gydF4y2Ba41.gydF4y2Ba].因此,在碱胁迫下,苹果酸的代谢不是一个限制因素,而是转运体对苹果酸的分泌更为重要。gydF4y2Ba
碱胁迫诱导有机酸分泌的信号通路gydF4y2Ba
乙烯是一种重要的信号分子,介导了许多重要的生物过程,包括对非生物胁迫的反应[gydF4y2Ba42.gydF4y2Ba].在本研究中,乙烯生物合成和感知抑制剂的应用表明,在碱性胁迫下,乙烯在有机酸分泌中的必要性(图。gydF4y2Ba6gydF4y2Bac、 d)。然而,外源性应用或内源性乙烯生产过剩对HgydF4y2Ba+gydF4y2Ba- atp酶活性和HgydF4y2Ba+gydF4y2Ba碱压力下稻根中的渗透[gydF4y2Ba17.gydF4y2Ba];此外,氢氧化钠还能降低乙烯的生成gydF4y2Ba3.gydF4y2Ba治疗(图。gydF4y2Ba6gydF4y2Ba一个)。类似地,具有较差的乙烯生物合成的转基因烟草植物表现出耐盐性升高,而用乙烯处理的水稻植物表现出盐超敏反应[gydF4y2Ba43.gydF4y2Ba,gydF4y2Ba44.gydF4y2Ba]因此,乙烯的作用可能与浓度有关[gydF4y2Ba42.gydF4y2Ba,gydF4y2Ba45.gydF4y2Ba,低浓度的乙烯可能是介导NaHCO的必要条件gydF4y2Ba3.gydF4y2Ba-诱导有机酸分泌。乙烯生物合成主要由ACS和ACO在转录和翻译后水平调控[gydF4y2Ba46.gydF4y2Ba,gydF4y2Ba47.gydF4y2Ba].当葡萄园受到碱应激时,亚乙基产量的下降伴随着(图。gydF4y2Ba6gydF4y2BaA)通过减少表达gydF4y2BaACO1gydF4y2Ba(无花果。gydF4y2Ba4gydF4y2Bac)和ACO4、ACO11磷酸化水平(表gydF4y2Ba1gydF4y2Ba),但增加的表情gydF4y2BaACS3gydF4y2Ba和gydF4y2BaACS7gydF4y2Ba(无花果。gydF4y2Ba4gydF4y2Bac),表明ACOs在调节碱胁迫下乙烯合成中的关键作用。此外,EIN2是乙烯信号转导的中枢调控因子[gydF4y2Ba48.gydF4y2Ba[控制从ER膜的转导到核中的乙烯信号gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba48.gydF4y2Ba],其磷酸化抑制乙烯信号转导(表gydF4y2Ba1gydF4y2Ba;48)。EIN5、EIN6、EIN3等介导的信号级联后,乙烯信号被传递到乙烯信号通路的最后一个下游成分——乙烯响应因子(ERFs),从而调控乙烯调控基因的表达[gydF4y2Ba43.gydF4y2Ba]在这里,大量ERFs表达的变化可能与碱胁迫下乙烯调节的不同生物过程有关。gydF4y2Ba
据报道,生长素可以控制根外体酸化,增强铝诱导的柠檬酸盐渗出,并促进PM H的磷酸化gydF4y2Ba+gydF4y2Baatp酶(gydF4y2Ba13.gydF4y2Ba,gydF4y2Ba45.gydF4y2Ba,gydF4y2Ba49.gydF4y2Ba]此外,PIN2(生长素外排转运体)激活质膜HgydF4y2Ba+gydF4y2Ba-ATP酶释放质子,这是细胞适应所必需的gydF4y2Ba拟南芥gydF4y2Ba对碱胁迫[gydF4y2Ba15.gydF4y2Ba].因此,生长素对碱胁迫下有机酸的分泌具有重要的调节作用。最近的一项研究发现,内源性生长素控制胞质酸化;然而,生长素生物合成基因过表达的内源性增加或生长素水平的外源性增加都会引起瞬时碱化[gydF4y2Ba45.gydF4y2Ba,这与上面讨论的乙烯的作用类似。在这里,NaHCOgydF4y2Ba3.gydF4y2Ba处理导致IAA减少,但NPA处理减少了有机酸分泌(图。gydF4y2Ba6gydF4y2Bab-d),提示IAA生物合成的微调可能对有机酸分泌的调控至关重要。此外,基因gydF4y2BaIAA12.gydF4y2Ba和gydF4y2BaGH3gydF4y2Ba作为IAA抑制因子[gydF4y2Ba45.gydF4y2Ba,gydF4y2Ba50.gydF4y2Ba]也显著上调(图。gydF4y2Ba4gydF4y2Bac),可能减少IAA合成和信号传导。小的生长素上升RNA (SAUR)基因是生长素应答基因中最大的家族,参与生长素介导的PM HgydF4y2Ba+gydF4y2Baatp酶激活(gydF4y2Ba45.gydF4y2Ba,gydF4y2Ba51.gydF4y2Ba].表达量大幅增加gydF4y2BaSAUR32gydF4y2Ba和gydF4y2Ba索尔40gydF4y2Ba提示它们可能是对葡萄根生长素的反应来调节有机酸的分泌。特别是,已经证明生长素通过介导乙烯信号传导来控制根的生长[gydF4y2Ba52.gydF4y2Ba].因此,我们推断乙烯最有可能通过碱应力下的藤根中的羊酸信号传导来调节有机酸分泌。gydF4y2Ba
另一方面,细胞膜上有数百种不同的受体激酶,它们在细胞膜胞外一侧的受体域接收环境信号,并通过胞内蛋白激酶域将这些信号转化为细胞反应[gydF4y2Ba34.gydF4y2Ba].点HgydF4y2Ba+gydF4y2Ba- atp酶被报道与多种受体激酶相互作用[gydF4y2Ba53.gydF4y2Ba].受体激酶介导的质膜主要活性质子泵浦的控制,如PSY1R,通过与AHA2/AHA1相互作用和磷酸化,增加质子从根外流[gydF4y2Ba54.gydF4y2Ba]在本研究中,11种位于质膜的受体激酶的高水平表达和/或磷酸化可能参与ATP酶的调节。尽管候选基因的确切作用仍有待研究,但我们的数据为这些基因的进一步功能分析提供了一个平台。gydF4y2Ba
结论gydF4y2Ba
草酸是NaHCO胁迫下葡萄根合成和分泌的主要有机酸gydF4y2Ba3.gydF4y2BaOAA途径包括两个PEPC3s和PEPCK1s,在草酸合成中起关键作用gydF4y2Ba+gydF4y2Ba由pm h控制gydF4y2Ba+gydF4y2Ba-ATPases和两个磷酸化的PM ATPases 4是NaHCO作用下的主要质子泵gydF4y2Ba3.gydF4y2Ba压力。此外,ABCB19-2和PDR12可能参与草酸等有机酸的转运。低浓度的乙烯介导NaHCOgydF4y2Ba3.gydF4y2Ba-诱导的有机酸分泌,IAA也参与了这一过程。gydF4y2Ba
方法gydF4y2Ba
葡萄根系和根系分泌物中有机酸的测定gydF4y2Ba
在初夏摘除A15葡萄藤健康的顶端生长尖,建立葡萄藤离体茎培养。在含3% (w/v)蔗糖的Murashige和Skoog培养基上进行继代培养。lgydF4y2Ba- 1gydF4y2Ba琼脂0.2毫克。lgydF4y2Ba- 1gydF4y2BaIBA。将5周龄的葡萄藤试管苗转移到高度为10厘米、直径为5厘米的玻璃瓶中。以50ml水(pH 7.0)、75mm NaCl (pH 7.0)和NaHCO作为对照gydF4y2Ba3.gydF4y2Ba(pH值8.7)。每个玻璃瓶都有一个氧气机(SenSen Group,中国)提供足够的氧气。在25°C、16 h光周期、600 μmol/m光强的控制环境生长箱中培养gydF4y2Ba2gydF4y2Ba/s、 在不同处理后的不同时间点,收集根并立即冷冻在液氮中进行有机酸提取。收集处理液并用旋转蒸发器蒸发至干燥,残余物溶解于1 ml双蒸馏水。滤液通过0.45μm过滤器,用于有机酸测定。使用毛细管电泳系统(Beckman P/ACE,加利福尼亚州帕洛阿尔托)从根中提取有机酸并测定其对根提取物和处理液的测定如我们之前的研究所述[gydF4y2Ba55.gydF4y2Ba].gydF4y2Ba
HgydF4y2Ba+gydF4y2Ba分泌试验gydF4y2Ba
HgydF4y2Ba+gydF4y2Ba根据先前所述的方法检测分泌物[gydF4y2Ba56.gydF4y2Ba].用pH 7.0水、75 mM NaCl (pH 7.0)、75 mM NaHCO处理5周龄葡萄A15离体芽培养物gydF4y2Ba3.gydF4y2Ba(pH 8.7)和75 mM NaHCOgydF4y2Ba3.gydF4y2Ba加0.1 嗯,那gydF4y2Ba3.gydF4y2BaVOgydF4y2Ba3.gydF4y2Ba六 h、 然后,冲洗根,小心地铺在皮氏培养皿中,并用固体培养基(pH)覆盖 5.8),其中包括0.006%溴甲酚紫(pH指示剂,变色范围为5.2–6.8),1 毫摩尔 lgydF4y2Ba- 1gydF4y2Ba卡索gydF4y2Ba4gydF4y2Ba, 2.5 mmol lgydF4y2Ba- 1gydF4y2BaKgydF4y2Ba2gydF4y2Ba所以gydF4y2Ba4gydF4y2Ba和0.8%的琼脂。在25°C、400 μmol/m连续光照条件下,在控制环境生长箱中生长gydF4y2Ba2gydF4y2Ba/ s光强度。gydF4y2Ba
测量HgydF4y2Ba+gydF4y2Ba- atp酶活性和HgydF4y2Ba+gydF4y2Ba通量的根gydF4y2Ba
植物材料与有机酸测定部分描述的相同。质膜蛋白的提取及质膜蛋白活性的测定gydF4y2Ba+gydF4y2Ba- atp酶的测定方法参照Yan et al. (2002) [gydF4y2Ba56.gydF4y2Ba].H的活性gydF4y2Ba+gydF4y2Ba- atp酶在0.5 ml 30 mM BTP/MES缓冲液(pH 6.5)、5 mM MgSO中反应30 min后测定Pi值gydF4y2Ba4gydF4y2Ba, 50毫米氯化钾,1毫米钠gydF4y2Ba2gydF4y2BaMoo.gydF4y2Ba4gydF4y2Ba,1毫米南gydF4y2Ba3.gydF4y2Ba, 5 mM ATP, Brij 58 (0.02% w/v)。加入5 mg膜蛋白启动反应,加入1 ml终止剂(2% HgydF4y2Ba2gydF4y2Ba所以gydF4y2Ba4gydF4y2Ba, 5% SDS, 0.7% NHgydF4y2Ba4gydF4y2Ba)gydF4y2Ba2gydF4y2BaMoo.gydF4y2Ba4gydF4y2Ba),再加入50 μl抗坏血酸(10% w/v)。30分钟后显色完成。用分光光度计测量在820 nm处的吸光度。gydF4y2Ba
根HgydF4y2Ba+gydF4y2Ba使用扫描离子选择电极技术和无创显微测试技术系统(NMT,北京旭月科技有限公司,北京,中国)测量通量。将距根尖10mm长的根在测量溶液中平衡20分钟 分钟,然后固定在测量室中5分钟 新鲜测量溶液毫升。gydF4y2Ba
RNA序列和定量实时PCR(qRT PCR)gydF4y2Ba
采用TRIzol Reagent (Invitrogen, Carlsbad, CA, USA)从葡萄根尖提取10 mm长的根总RNA,采用poly-T oligo attached magnetic beads分离mRNA。转录组测序和分析由OE Biotech Co., Ltd (Shanghai, China)进行。测序库使用NEBNext®Ultra™RNA Library Prep Kit for Illumina®(7530 L, NEB,美国)构建,在Illumina HiSeq 4000平台上测序,生成150-bp的配对端reads。使用Cufflinks参考葡萄基因组(gydF4y2Bahttp://genomes.cribi.unipd.it/grape/gydF4y2Ba).采用RPKM定量分析非基因表达水平。使用错误发现率< 0.05和绝对对数筛选两个样本间差异表达的UnigenesgydF4y2Ba2gydF4y2Ba(fold change)≥1为阈值。对对照和NaHCO产生3个生物重复gydF4y2Ba3.gydF4y2Ba治疗。gydF4y2Ba
采用SYBR Green MasterMix (SYBR Premix EX Taq TM, Dalian, China)在Bio-Rad iQ5 (Hercules, CA, United States)仪器上进行qRT-PCR,引物列于附加文件gydF4y2Ba3.gydF4y2Ba:表S3。gydF4y2Ba
磷酸肽和磷酸蛋白的鉴定和定量gydF4y2Ba
用BCA试剂盒(Beyotime,北京,中国)提取葡萄中的蛋白质并进行定量。胰蛋白酶消化后,肽混合物在X层C上脱盐gydF4y2Ba18.gydF4y2BaSPE柱(Phenomenex,Torrance,CA,USA)。每种肽均经真空干燥并在0.5%溶液中重组 M TEAB(美国西格玛)。使用TMT试剂盒(美国加利福尼亚州托伦斯市赛默飞世尔科学公司)标记肽混合物根据制造商的介绍。TMT标记的肽通过高pH反相高效液相色谱分离并通过真空离心浓缩。磷酸肽使用IMAC微球富集,然后用洗脱缓冲液洗脱,然后进行冻干和LC-MS/MS分析。磷酸肽被分离在0.1%甲酸(溶剂A)中溶解,并加载到C上gydF4y2Ba18.gydF4y2Ba-反相柱(15厘米长,75 μm i.d,内部包装),在EASY-nLC 1000 UPLC系统(Thermo)上以0.4 μL/min的恒定流速,以线性梯度溶剂B(0.1%甲酸/ 98%乙腈)进行分离。用6 ~ 23%溶剂B洗脱26 min, 23 ~ 35%溶剂B洗脱8 min, 80%溶剂B洗脱6 min。采用Q ExactiveTM Plus (Thermo)在线耦合UPLC的串联质谱(MS/MS)对多肽进行检测和鉴定,UPLC由京洁PTM生物实验室(中国杭州)支持。使用Maxquant搜索引擎(v1.5.2.8)搜索MS/MS数据gydF4y2Bavitis ViniferagydF4y2Ba蛋白质组与反向诱饵数据库连接。Maxquant搜索的参数为:胰蛋白酶/P最大缺失裂解量,2;肽质量耐受性,第一次搜索20ppm,主搜索5ppm;MS/MS公差0.02 Da;氨基甲脒在Cys上的固定修饰;可变修饰,Met上的氧化。FDR调整为小于1%。gydF4y2Ba
IAA的提取与测定gydF4y2Ba
根据我们以前的研究进行IAA提取[gydF4y2Ba57.gydF4y2Ba].IAA的分离和定量使用Scientific Ultimate 3000高效液相色谱系统(Thermo, San Jose, CA, USA)与TSQ Quantum Access MAX系统(Thermo, San Jose, CA, USA)耦合。采用Thermo Scientific Hypersil Gold色谱柱(50 × 2.1 mm, 1.9 μm)进行高效液相色谱分离。进样量为10 μL。流动相为0.5%乙酸水溶液(A)和甲醇(B),流速为1.0 ml.mingydF4y2Ba- 1gydF4y2Ba: 0-0.5 min, 0-20% B;0.5-3.0 min, 20-90% B;3.0-6.5 min, 90% B;6.5-10.0 min, 90-20% B;10.0 ~ 15.0 min, 20% b。采用ESI阴性模式进行IAA检测和定量。实验参数为:母质量-电荷质量(m/z)为263.1,子质量-电荷质量(m/z)为153.0,碰撞能量为14 eV。gydF4y2Ba
乙烯产率的测定gydF4y2Ba
使用配备GDX-502柱和火焰离子化检测器的GC-9A气相色谱仪(日本岛津)测量乙烯产率。葡萄根被封闭在一个带有密封膜的5ml离心管中,并在25℃下孵化 3摄氏度 h。使用气密注射器,通过隔膜塞从每根管中抽出5毫升顶空气体,并进行分析。gydF4y2Ba
统计分析gydF4y2Ba
采用SPSS (V19.0)统计软件包进行统计学分析。采用单因素方差分析和邓肯多极差检验。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
质谱蛋白质组数据已通过PRIDE合作伙伴存储库存储到ProteomeXchange联盟,数据集标识符为PXD013746 (gydF4y2Bahttp://www.ebi.ac.uk/pridegydF4y2Ba).将完整的RNA-Seq数据提交到NCBI的序列读取档案(SRA)中,样本为BioSample SAMN11579694和SAMN11579695 (gydF4y2Bahttps://www.ncbi.nlm.nih.gov/sragydF4y2Ba).gydF4y2Ba
缩写gydF4y2Ba
- 1-MCP:gydF4y2Ba
-
1-methylcyclopropenegydF4y2Ba
- ABCB19:gydF4y2Ba
-
磷酸腺苷盒式B19gydF4y2Ba
- ACC:gydF4y2Ba
-
1-aminocyclopropane-1-carboxylic酸gydF4y2Ba
- ACH:gydF4y2Ba
-
Aconitate水合酶gydF4y2Ba
- 华:gydF4y2Ba
-
1-aminocyclopropane-1-carboxylic酸氧化酶gydF4y2Ba
- ACS:gydF4y2Ba
-
1-氨基环丙烷-1-羧酸合酶gydF4y2Ba
- ALMT:gydF4y2Ba
-
铝活性苹果酸盐转运蛋白gydF4y2Ba
- AVG:gydF4y2Ba
-
AminoethoxyvinylglycinegydF4y2Ba
- DAT:gydF4y2Ba
-
天治疗后gydF4y2Ba
- 度:gydF4y2Ba
-
差异表达基因gydF4y2Ba
- 帽子:gydF4y2Ba
-
治疗后的小时数gydF4y2Ba
- 国际宇航科学院:gydF4y2Ba
-
吲哚乙酸gydF4y2Ba
- 我:gydF4y2Ba
-
苹果酸脱氢酶gydF4y2Ba
- NPA:gydF4y2Ba
-
1-N-naphthylphthalamic酸gydF4y2Ba
- OCL:gydF4y2Ba
-
Oxalate-CoA连接酶gydF4y2Ba
- PDR12:gydF4y2Ba
-
多效性耐药性12gydF4y2Ba
- Pepc:gydF4y2Ba
-
磷酸烯醇丙酮酸羧化酶gydF4y2Ba
- PEPCK:gydF4y2Ba
-
PEPC激酶gydF4y2Ba
- 下午:gydF4y2Ba
-
血浆膜gydF4y2Ba
- 存在:gydF4y2Ba
-
定量实时PCRgydF4y2Ba
- RPKM:gydF4y2Ba
-
读取每千碱基的转录每百万映射读取gydF4y2Ba
参考文献gydF4y2Ba
- 1。gydF4y2Ba
金辉,杨振宇,李振华,等。叶和根的EST谱比较gydF4y2Ba羊草gydF4y2Ba,一种喜旱草,适合于高pH值的苏打土。植物科学。2006;170:1081–6.gydF4y2Ba
- 2。gydF4y2Ba
龚斌,文德,李雪梅,杨芳,等。NaCl和NaHCO的效果比较gydF4y2Ba3.gydF4y2Ba对番茄根系呼吸代谢、抗氧化系统、营养状况和有机酸代谢的胁迫植物生理学报。2014;36:2167-81。gydF4y2Ba
- 3。gydF4y2Ba
杨超,史东,王东。盐胁迫对耐碱盐生植物生长、渗透调节和离子平衡的影响gydF4y2Ba碱蓬glaucagydF4y2Ba《植物生长条例》,2008;56:179-90。gydF4y2Ba
- 4.gydF4y2Ba
石丹,盛彦。不同盐碱混合胁迫条件对向日葵幼苗的影响及其胁迫因子分析。环境J Exp Bot. 2005; 54:8-21。gydF4y2Ba
- 5。gydF4y2Ba
郭磊,史东,王东。耐碱盐生植物对碱胁迫的关键生理响应gydF4y2Ba星星草gydF4y2Ba是大量有机酸积累而成的流纹层。中国农业科学(英文版);2010;gydF4y2Ba
- 6。gydF4y2Ba
杨X,Römheld V,Marschner H.碳酸氢盐对缺锌和缺锌水稻品种根系生长和有机酸积累的影响(gydF4y2Ba栽培稻gydF4y2Ba《植物土壤》,1994;164:1-7。gydF4y2Ba
- 7。gydF4y2Ba
高盐胁迫对植物生长、根系有机酸积累和铁吸收的影响。植物营养学报1997;20:1731-53。gydF4y2Ba
- 8.gydF4y2Ba
Timpa JD, Burke JJ, Quisenberry JE, Wendt CW。水分胁迫对棉花植株有机酸和碳水化合物组成的影响植物杂志。1986;82:724-8。gydF4y2Ba
- 9.gydF4y2Ba
Fougère F, Le Rudulier D, Streeter JG。盐胁迫对紫花苜蓿根、杀菌剂和聚伞花序氨基酸、有机酸和碳水化合物组成的影响(gydF4y2Ba紫花苜蓿gydF4y2Bal .)。植物杂志。1991;96:1228-36。gydF4y2Ba
- 10.gydF4y2Ba
粉丝W,徐继,娄H,小C,陈W,杨j.谷物铝诱导有机酸阴离子分泌的生理分子分析(gydF4y2Ba千穗谷gydF4y2Ba根。Int J Mol Sci。2016;17:608.gydF4y2Ba
- 11.gydF4y2Ba
袁伟,张东,宋涛,徐凤英,林胜,徐伟,等。gydF4y2Ba拟南芥gydF4y2Ba质膜HgydF4y2Ba+gydF4y2Ba-ATPase基因AHA2和AHA7在根尖H的调控中有明显的重叠作用gydF4y2Ba+gydF4y2Ba低磷胁迫下的外排反应。J Exp机器人。2017;68:1731–41.gydF4y2Ba
- 12.gydF4y2Ba
陶Q,侯D,杨X,李T。小麦根尖的草酸分泌gydF4y2Ba景天属植物alfrediigydF4y2Ba有助于镉的过度积累。植物土壤。2016;398:139–52。gydF4y2Ba
- 13。gydF4y2Ba
王鹏,于伟,张军,任格尔,徐军,韩强,等。生长素通过上调柠檬酸盐的分泌来增强铝诱导的柠檬酸盐的分泌gydF4y2Ba格马特gydF4y2Ba以及质膜H的活化gydF4y2Ba+gydF4y2Ba- atp酶。安机器人。2016;118:933-40。gydF4y2Ba
- 14。gydF4y2Ba
刘杰,郭勇。植物的耐碱性gydF4y2Ba拟南芥gydF4y2Ba需要通过PKS5激酶的失活部分稳定微丝。基因组学杂志。2011;38:307-13。gydF4y2Ba
- 15。gydF4y2Ba
徐伟,贾林,Baluška F,丁刚,石伟,叶宁,张建品gydF4y2Ba拟南芥gydF4y2Ba根通过调节质子的分泌来适应碱性胁迫。J Exp Bot. 2012; 63:6105-14。gydF4y2Ba
- 16。gydF4y2Ba
陈华,张强,蔡辉,徐飞。乙烯负调控质膜H介导碱诱导水稻生长抑制gydF4y2Ba+gydF4y2Ba- atp酶活性。植物学报2017;8:1839。gydF4y2Ba
- 17。gydF4y2Ba
王C,Gao C,王L,郑L,杨C,王Y. Nahco的综合转录分析gydF4y2Ba3.gydF4y2Ba-ressessed.gydF4y2Ba甘蒙柽柳hispidagydF4y2Ba根揭示了反应基因的网络。植物分子生物学。2014;84:145–57.gydF4y2Ba
- 18.gydF4y2Ba
孟C,全天宇,李志勇,崔克良,严玲,梁勇,等。转录组分析揭示了小麦耐碱性的遗传基础。BMC基因组学。2017;18:24。gydF4y2Ba
- 19.gydF4y2Ba
陈Q,甘Q,王平,余W,余Y,赵Y,等。磷酸化和与质膜H+-ATP酶14–3-3蛋白的相互作用参与了镁介导的铝诱导蚕豆柠檬酸分泌增加的调节(gydF4y2Ba蚕豆根尖gydF4y2Bal .)。acta botanica yunnanica(云南植物研究). 2015;56:1144-53。gydF4y2Ba
- 20gydF4y2Ba
Boxall SF,Dever LV,KnerováJ,Gould PD,Hartwell J.磷酸烯醇式丙酮酸羧化酶的磷酸化对于最大程度和持续的暗CO是必不可少的gydF4y2Ba2gydF4y2Ba专性景天蓝酸代谢物种的固定和核心昼夜时钟操作gydF4y2Ba高凉菜属fedtschenkoigydF4y2Ba《植物细胞》2017;29:2519-36。gydF4y2Ba
- 21gydF4y2Ba
郭胜,牛勇,翟华,韩宁,杜勇。碱性胁迫对葡萄杂种砧木根系有机酸代谢的影响。Sci Hortic。2018;227:255-60。gydF4y2Ba
- 22gydF4y2Ba
Ma J,Ryan PR,Delhaize E.植物对铝的耐受性和有机酸的络合作用.趋势植物科学.2001;6:273-8。gydF4y2Ba
- 23gydF4y2Ba
杨超,王平,李超,史东,王东。盐和碱胁迫对小麦生长和光合作用的影响比较。Photosynthetica。2008;46:107-14。gydF4y2Ba
- 24gydF4y2Ba
杨果碱胁迫诱导小麦有机酸积累和分泌。Afr J Agric Res. 2012; 7:2844-52。gydF4y2Ba
- 25gydF4y2Ba
王浩,白斌,白志华,石磊,叶军,樊胜,等。耐碱盐生植物中有机酸代谢的酶的调节gydF4y2Ba虎尾草gydF4y2Ba在对盐和碱胁迫的反应中。Afr J Biotechnol. 2016; 15:2243-50。gydF4y2Ba
- 26gydF4y2Ba
Franceschi VR, Nakata PA植物中的草酸钙:形成和功能。植物学报2005;56:41-71。gydF4y2Ba
- 27gydF4y2Ba
于磊,姜建军,张超,姜玲,叶宁,陆勇,等。乙醛酸盐是水稻草酸盐生物合成的有效前体,而不是抗坏血酸盐。J Exp Bot. 2010; 61:1625-34。gydF4y2Ba
- 28gydF4y2Ba
Poschenrieder C,Fernández JA,Rubio L,Pérez L,Terés J,BarcelóJ.植物中重碳酸盐的运输和使用:当前知识和未来挑战。Int J Mol Sci。2018;19:1352.gydF4y2Ba
- 29gydF4y2Ba
Feria AB, Bosch N, Sánchez A, Nieto-Ingelmo AI, Osa CD, Echevarría C,等。磷酸烯醇丙酮酸羧化酶(PEPC)和PEPC-激酶(PEPC-k)同工酶gydF4y2Ba拟南芥gydF4y2Ba:在控制和非生物应激条件中的作用。足底。2016;244:901-13。gydF4y2Ba
- 30.gydF4y2Ba
乌头酸水合酶4的分离与鉴定(gydF4y2BaAco4gydF4y2Ba)来自大豆的基因。Can J Plant Sci.2017;97:684–91。gydF4y2Ba
- 31.gydF4y2Ba
植物质膜HgydF4y2Ba+gydF4y2Ba-ATPase:结构,功能和调节。Biochim Biophys Acta Biomembr。2000; 1465:1-16。gydF4y2Ba
- 32.gydF4y2Ba
Fuglsang at,guo y,cuin ta,秋q,歌曲c,kristiansen ka,等。gydF4y2Ba拟南芥gydF4y2Ba蛋白激酶PKS5抑制质膜HgydF4y2Ba+gydF4y2Ba- atp酶通过阻止14-3-3蛋白的相互作用。植物细胞。2007;19:1617-34。gydF4y2Ba
- 33.gydF4y2Ba
杨强,秦勇,谢超,赵飞,赵军,刘东,等。的gydF4y2Ba拟南芥gydF4y2Ba伴侣J3调节质膜HgydF4y2Ba+gydF4y2Ba通过与PKS5激酶的相互作用。植物细胞。2010;22:1313-32。gydF4y2Ba
- 34.gydF4y2Ba
p . J ., p . J ., p . J .gydF4y2Ba+gydF4y2Ba- 植物生理中心中的蛋白调节。莫尔植物。2016; 9:323-37。gydF4y2Ba
- 35。gydF4y2Ba
Vitart V, Baxter I, Doerner P, Harper JF。质膜H在生长和耐盐性中作用的证据gydF4y2Ba+gydF4y2Ba-根内皮层中的ATP酶。植物杂志2001;27:191-201。gydF4y2Ba
- 36。gydF4y2Ba
Gévaudantf,戴卜,Stedingk ev,Zhao R,Morsomme P,Boutry M.表达式活性等离子体膜H.gydF4y2Ba+gydF4y2Ba- atp酶改变植物发育,增加耐盐性。植物杂志。2007;144:1763 - 76。gydF4y2Ba
- 37。gydF4y2Ba
罗瑶-瓦尔加斯VM, Broeckling CD, De-la-Peña C, Jasinski M, Sanelia D, et al.;根分泌物中次生代谢物的变化gydF4y2Ba拟南芥gydF4y2Baatp结合盒转运体突变体。植物杂志。2008;146:762 - 71。gydF4y2Ba
- 38。gydF4y2Ba
王志强,王志强,王志强,等。Pdr12 ABC转运体是酵母培养弱有机酸抗性所必需的。EMBO j . 1998; 17:4257 - 65。gydF4y2Ba
- 39。gydF4y2Ba
Sharma T, Dreyer I, Kochian L, Piñeros MA。植物中有机酸转运体的ALMT家族及其在解毒和营养安全中的作用。植物学报2016;7:1488。gydF4y2Ba
- 40.gydF4y2Ba
Ligaba A,Maron L,Shaff J,Kochian L,Piñeros M.玉米ZmALMT2是一种根阴离子转运体,介导组成性根苹果酸外流。植物细胞环境。2012;35:1185–200。gydF4y2Ba
- 41.gydF4y2Ba
富铝植物荞麦al诱导基因的转录组分析gydF4y2BaFagopyrum esculentumgydF4y2Ba《植物细胞生理学》2014;55:2077-91。gydF4y2Ba
- 42.gydF4y2Ba
张敏,蒋超。乙烯和活性氧(ROS)在植物盐胁迫反应中的调控作用。植物学报。2016;91:651-9。gydF4y2Ba
- 43.gydF4y2Ba
乙烯反应因子:激素和应激信号的关键调控枢纽。植物杂志。2015;169:32-41。gydF4y2Ba
- 44gydF4y2Ba
杨超,马斌,何淑娟,熊强,段坤,尹超,等。毛虎子6/ETHYLENE INSENSITIVE3-LIKE1和ETHYLENE INSENSITIVE3-LIKE2调控水稻根和胚芽鞘的乙烯反应,并对水稻耐盐性产生负面影响。植物杂志。2015;169:148 - 65。gydF4y2Ba
- 45gydF4y2Ba
Barbez E,DünserK,Gaidora A,Lendl T,Busch W.助生阉牛通过Applastic pH调节膨胀gydF4y2Ba拟南芥gydF4y2Ba.《美国国家科学院学报》上。2017; 114:4884 - 93。gydF4y2Ba
- 46gydF4y2Ba
Argueso CT, Hansen M, Kieber JJ。乙烯生物合成调控。植物生长调节剂。2007;26:92-105。gydF4y2Ba
- 47gydF4y2Ba
Lyzenga WJ,展位JK,Stone SL.ThegydF4y2Ba拟南芥gydF4y2Ba环型E3连接酶XBAT32介导乙烯生物合成酶1-氨基环丙烷-1-羧酸合酶的蛋白酶体降解7.植物杂志2012;71:23–34。gydF4y2Ba
- 48gydF4y2Ba
Ju C,Yoon GM,Shemansky JM,Lin D,Ying Z,Chang J,等。CTR1磷酸化中央调节器EIN2,以控制从内质网膜到细胞核的乙烯激素信号传导gydF4y2Ba拟南芥gydF4y2Ba.《美国国家科学院学报》上。2012; 109:19486 - 91。gydF4y2Ba
- 49gydF4y2Ba
生长素激活质膜HgydF4y2Ba+gydF4y2Ba-小麦下胚轴伸长过程中ATP酶的磷酸化gydF4y2Ba拟南芥gydF4y2Ba.植物杂志。2012;159:632-41。gydF4y2Ba
- 50.gydF4y2Ba
陈志强,陈志强,陈志强,等。葡萄生长素与吲哚-3-乙酸氨基合成酶的关系。植物细胞。2012;24:4525-38。gydF4y2Ba
- 51.gydF4y2Ba
李志强,李志强,李志强,等。SAUR抑制PP2C-D磷酸酶可激活质膜HgydF4y2Ba+gydF4y2Ba- 促进细胞扩张的过程gydF4y2Ba拟南芥gydF4y2Ba.植物细胞。2014;26:2129-42。gydF4y2Ba
- 52.gydF4y2Ba
李军,徐海华,刘伟,张旭,陆玉英。乙烯通过AUXIN1抑制碱胁迫下植物根系伸长及其生长素积累。植物杂志。2015;168:1777 - 91。gydF4y2Ba
- 53.gydF4y2Ba
Ladwig F, Dahlke RI, Stührwohldt N, Hartmann J, Harter K, Sauter mgydF4y2Ba拟南芥gydF4y2Ba通过质膜上的响应模块,该模块包括环核苷酸门控通道17,HgydF4y2Ba+gydF4y2Ba腺苷三磷酸酶,BAK1。植物细胞。2015;27:1718-29。gydF4y2Ba
- 54.gydF4y2Ba
Fuglsang AT, Kristensen A, Cuin TA, Schulze WX, Persson J, Thuesen KH, et al.;受体激酶介导的原生质膜活性质子泵的控制。植物j . 2014; 80:951 - 64。gydF4y2Ba
- 55.gydF4y2Ba
姚烨,李敏,刘志,郝烨,翟浩。利用cDNA-AFLP方法筛选出一个新基因,该基因有助于降低苹果果实的酸度。植物生理生化。2007;45:139–45.gydF4y2Ba
- 56.gydF4y2Ba
严飞,朱毅,Müller C, Zörb C,舒伯特S.《诗经》的改编gydF4y2Ba+gydF4y2Ba-泵浦和质膜HgydF4y2Ba+gydF4y2Ba-缺磷条件下白羽扇豆蛋白质类根中的ATP酶活性。植物生理学。2002;129:50–63。gydF4y2Ba
- 57.gydF4y2Ba
徐丽,岳强,向光,卞飞,姚玉玲。褪黑素通过增加ABA、H水平促进葡萄果实成熟gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba尤其是乙烯。Hortic杂志2018;41。gydF4y2Ba
致谢gydF4y2Ba
不适用。gydF4y2Ba
资金gydF4y2Ba
本研究得到国家自然科学基金(31872068)、国家重点研究开发项目(2018YFD10000200)、山东省“双顶”项目(SYL2017YSTD10)和中国农业研究体系(CARS-29)的资助。没有任何资助机构在研究设计、数据收集、分析和解释以及撰写手稿方面发挥任何作用。gydF4y2Ba
作者信息gydF4y2Ba
隶属关系gydF4y2Ba
贡献gydF4y2Ba
YY和GX对研究进行构思和设计;GX、WM和SG进行了实验;ZJ和QY分析数据;原稿由YY撰写。所有作者阅读并批准了手稿。gydF4y2Ba
相应的作者gydF4y2Ba
伦理宣言gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
提交人声明他们没有竞争利益。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。gydF4y2Ba
附加文件gydF4y2Ba
额外的文件1:gydF4y2Ba
表S1。gydF4y2Ba对照和NaHCO的RNA-Seq谱gydF4y2Ba3.gydF4y2Ba治疗葡萄根。使用错误发现率< 0.05和绝对对数筛选两个样本间差异表达的UnigenesgydF4y2Ba2gydF4y2Ba(折叠变化) ≥ 1作为阈值。(XLSX 1337 kb)gydF4y2Ba
额外的文件2:gydF4y2Ba
表S2。gydF4y2BaNaHCO对葡萄根磷酸肽变化的分析gydF4y2Ba3.gydF4y2Ba压力。通过≥1.5或≤0.67倍的变化来筛选两个样本之间显著改变的磷蛋白(gydF4y2BaPgydF4y2Ba< 0.05)。(XLSX 96 kb)gydF4y2Ba
额外的文件3:gydF4y2Ba
表S3。gydF4y2Ba用于实时定量RT-PCR的引物序列。基因ID来自葡萄基因组(gydF4y2Bahttp://genomes.cribi.unipd.it/grape/gydF4y2Ba).(多克斯17 kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放访问gydF4y2Ba本文根据知识共享署名4.0国际许可的条款分发(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条提供的数据,除非另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
向刚,马伟,高胜。gydF4y2Ba等。gydF4y2Ba转录组和磷蛋白蛋白质分析和代谢物分析揭示了Nahco的机制gydF4y2Ba3.gydF4y2Ba-诱导的葡萄根有机酸分泌。gydF4y2BaBMC植物BIOL.gydF4y2Ba19,gydF4y2Ba383(2019)。https://doi.org/10.1186/s12870-019-1990-9gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-019-1990-9gydF4y2Ba
关键词gydF4y2Ba
- 葡萄藤gydF4y2Ba
- 转录组gydF4y2Ba
- PhosphoproteomegydF4y2Ba
- 有机酸分泌gydF4y2Ba
- 碱胁迫gydF4y2Ba