摘要
背景
磷通常以无机磷酸盐(Pi)的形式自然存在于土壤中,但由于土壤溶解度和流动性较低,在许多生态系统中磷的生物有效性受到限制。植物对低圆周率的反应是圆周率饥饿反应,包括圆周率感知和远距离信号传递。在Pi稳态机制和其他阴离子的稳态机制之间存在广泛的交叉对话,以响应Pi的有效性。
结果
重组自交系(RIL)和全基因组关联(GWA)定位群体,源自或由天然种质拟南芥在充足和不足的磷供应下生长。各性状均有显著处理效应,叶片Pi和硫酸盐浓度之间存在显著的基因型x处理互作。利用RIL/QTL群体,我们鉴定了24个叶片Pi和其他阴离子浓度的QTL,其中一个主要的叶片硫酸盐浓度QTL (SUL2)位于染色体(Chr) 1的底部。GWA图谱发现188个SNPs与所测性状相关,对应152个基因。其中一个与叶Pi浓度相关的snp被映射到PP2A-1,一种编码蛋白磷酸酶2A催化亚基的异构体的基因。在另外两个与磷酸盐利用效率(PUE)相关的snp中,一个映射到AT5G49780,编码一种参与信号转导的富含亮氨酸的重复蛋白激酶,另一个映射到AT5G49780SIZ1这是一种编码SUMO E3连接酶的基因,也是一种已知的磷饥饿依赖反应的调节因子。发现了一个与叶片硫酸盐浓度相关的SNPSULTR2; 1,编码一种硫酸盐转运蛋白,已知在缺磷条件下促进硫酸盐从根到茎的转运。最后,一个SNP被映射到FMO GS-OX4,该基因编码硫代葡萄糖苷s -加氧酶,参与硫代葡萄糖苷生物合成,位于的置信区间内SUL2轨迹。
结论
我们确定了几个已知的与负离子稳态相关的候选基因,以响应Pi的可用性。需要进一步的分子研究来确认和验证这些候选基因,并了解它们在检测性状中的作用。这些知识将有助于未来改良作物PUE的育种。
背景
目前密集的大田作物种植做法导致土地退化,降低土壤肥力和生产力,同时严重依赖化肥的广泛使用。为了满足不断增长的世界人口对粮食的需求,未来的农业可能需要扩展到目前未开垦的边缘土地。或者,开发更有效利用资源的栽培方法和相应的作物品种。在任何一种情况下,未来的作物将需要应对较低的宏量营养素输入,如磷(P)、氮、钾和硫,这些都是植物生长、发育和生产力所必需的[1,2]。作物更有效地吸收和利用养分将是未来植物育种的一个重要目标,以开发新的、可持续的作物品种。
土壤中的磷大部分是不流动的,土壤溶液中的无机磷酸盐(Pi)只占土壤总磷的很小一部分[3.]。只有Pi能被植物和微生物吸收,是一个繁荣的生态系统所不可或缺的,为最重要的生物过程提供营养,如光合作用、能量储存、碳固定、脂质代谢和呼吸[4,5]。在数百万年的进化过程中,植物已经发展出优雅的养分获取策略,在磷有限的土壤条件下有效地获取和利用磷[6,7]。然而,由于Pi在土壤中的溶解度和流动性较低,它被根系吸收的效率相对较低[8,9,10],使得Pi的有效性成为全球植物生长和生产力的最限制因素之一。其中一个原因是土壤pH, Pi主要在6.5 < pH < 7.5范围内有效。在酸性土壤中,Fe/ al - p矿物较为常见,形成不溶性化合物,不易被植物吸收[11]。在较碱性的土壤中,Ca/ mg - p矿物主要析出,使Pi不可用[10]。尽管目前使用了过量的磷肥料,但平均只有10-20%的磷可以被作物利用,而剩余的磷将通过淋滤进入地下水或在土壤中长期固定而损失,这两种情况都会导致巨大的社会经济和环境成本[12]。
为了克服磷的缺乏,植物可以从根部产生和释放有机酸,有机酸可以溶解Pi [13]。几份报告显示豇豆根释放柠檬酸、苹果酸和草酸[14],白卢平[15,16],及大豆[17]低Pi供应。总的来说,磷缺乏引起的有机酸代谢变化在根和叶之间存在差异[18],然而,缺乏磷是如何影响有机酸在茎部的积累和根系释放的还不清楚。测定植酸盐(IP6)、硝酸盐和硫酸盐的浓度也很有趣,因为这些化合物可能受Pi供应的影响,并可能受到控制低Pi响应的相似基因的调节。例如,在种子和叶片中检测到IP6和Pi浓度的主要数量性状位点(QTL)拟南芥(拟南芥)19]。虽然有机酸会影响根中的Pi吸收,但假设其产生的遗传变异在叶片中也有表达和功能并非不切实际。至少对于硫酸盐和Pi通量控制,描述了一个通用的调节步骤[20.]。此外,最近报道了Pi的检测与硝酸盐状态之间的串扰[21]。
开发在吸收、运输、储存、调动和/或利用Pi方面更有效的新作物品种的需求日益增加[22]。植物大约90%的磷储存在种子中,主要以IP6的形式,大约10%储存在叶子中。在萌发过程中,种子表达了降解IP6的酶,并再次释放Pi。食物或饲料中的IP6被人类或非反刍动物消化不良,导致磷在食物链中的额外损失,增加环境污染。因此,还需要减少IP6在种子中的积累,以更容易消化的形式储存磷的作物[8,19,23]。
通过研究模型、野生植物物种或古代作物种质中增强Pi吸收和利用效率的自然遗传多样性,可以发现哪些基因有助于提高Pi效率的线索[2,24]。在低磷土壤上,高磷利用效率的植物可以提高产量并带来良好的生产性能。然而,低Pi条件下的良好性能和Pi利用效率是复杂的性状,受许多因素的影响,这些因素似乎与植物对Pi限制的反应直接或间接相关[25,26]。植物已经进化出一种高效的Pi饥饿反应,包括Pi传感和长距离Pi信号传递,以促进Pi的利用效率[26,27,28]。一些与感知Pi缺乏症有关并对其做出反应的因素已经为人所知(正如最近由[26])。它涉及多个转录因子和mirna,控制在植物中获得足够的Pi后,Pi获取、再动员、分布和(再)封存相关基因的转录反应。过量的Pi储存在液泡中,在发生额外的缺陷时,它可以从液泡中重新动员到细胞质中[20.,27,29]。
基因型在不同环境中产生不同的形态生理和生化表型以适应环境的能力取决于发育阶段,被称为表型可塑性。表型可塑性的自然变异被称为环境相互作用基因型(GxE)。评估拟南芥对不同水平磷有效性的响应,作为环境因素,为稳定拟南芥生产力的遗传改良提供了坚实的基础,并有助于识别不同水平磷的优良等位基因[30.]。已经采取了几种方法来理解Pi内稳态,包括那些专注于解决调节网络的方法[31,32,33,34]。此外,涉及Pi稳态的新因素也可以通过解剖物种种质内发现的遗传变异来阐明,或者通过检查双亲杂交的后代,例如在经典的连锁映射研究中,重组自交系(RIL)群体[35],或通过全基因组关联研究(GWAS)对更大的基因型库进行研究[36]。这种方法将识别qtl,并最终确定导致表型变异的潜在因果等位基因变异。然而,尽管GWAS可以对潜在位点进行高精度的定位,但与RIL/QTL分析相比,它往往缺乏检测稀有等位基因效应的能力,即使它们具有较大的表型效应,以及被群体结构混淆的等位基因[37,38,39]。因此,结合GWAS和RIL/QTL作图来分析一个性状,将得到高精度的作图,并通过考虑假阳性和避免假阴性来结合两种方法的优点[30.,39]。在RIL和GWA映射模型中纳入环境因素(在本例中为Pi有效性),可以映射QTL及其与环境的相互作用(QTL × E) [30.]。这反过来有助于区分具有协同多效效应的QTL,即一个等位基因对两个或两个以上性状具有积极作用的QTL,与具有拮抗多效效应的QTL,即两个等位基因对两个或两个以上性状具有相反作用的QTL,其中一个等位基因增强一个性状,另一个等位基因增强其他性状。此外,它还促进了条件中性QTL的映射,即一个QTL在一个环境中对某个性状有影响,但在其他环境中没有影响[30.]。在标记辅助育种中选择理想的QTL时,了解每个QTL的作用至关重要。
在这里,我们研究了叶片产量的遗传学(以干重测量;不同基因型拟南芥的DW,以及在充足(+Pi)和缺乏(- Pi)处理下植株的Pi浓度和磷酸盐利用效率(PUE)。此外,我们还研究了同一植物部位中植酸、硝酸盐、柠檬酸、草酸和硫酸盐的浓度。我们研究了这些性状,以确定QTL,以及可能构成这些QTL的候选基因,方法是使用RIL群体中的传统连锁作图(RIL/QTL)和HapMap多样性面板的GWAS分析(HapMap/GWAS)。我们还研究了两种处理中这些位点的G x E相互作用效应。
结果
对映射种群进行表型分析
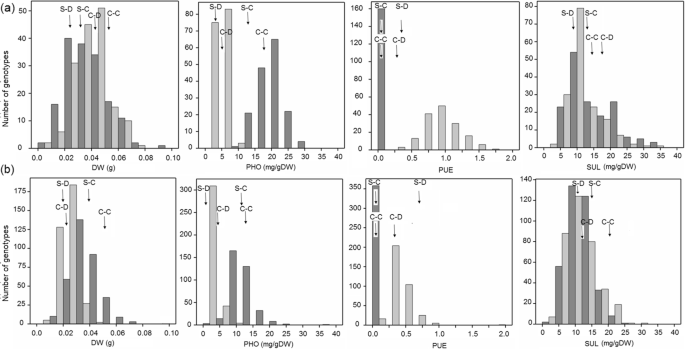
随着F6 RIL/QTL群体的增长,由164个系组成,来自Shahdara (Sha)和Columbia (Col)品系的杂交[76],在充足(+Pi)和缺乏磷酸盐(−Pi)供应下,-Pi处理对所有性状均有显著影响,基因型x处理对叶片Pi、植酸盐和硫酸盐浓度有显著交互作用。在增加了360个不同的HapMap/GWAS群体,其中包括Sha和Col, [77]进行了相似的处理,再次发现所有性状都有显著的处理效果和基因型x处理的相互作用(表1和附加文件1).在RIL/QTL群体中,这些性状的遗传力在0.42-0.73之间,而在HapMap/GWAS群体中,这些性状的遗传力在0.38-0.80之间1).
两个群体所测性状的频率分布均显示出所有性状均超过亲本系(图2)。1和附加文件2).在每个群体中,当将+Pi处理中测量到的每个性状与-Pi处理中测量到的性状进行比较时,都存在正相关(表1)2和附加文件1).在两个处理和两个居群中,叶片Pi与IP6浓度也呈显著正相关。同样,两种处理下,两个居群叶片硝酸盐、硫酸盐和柠檬酸盐浓度均呈显著正相关,与草酸盐浓度呈显著负相关。
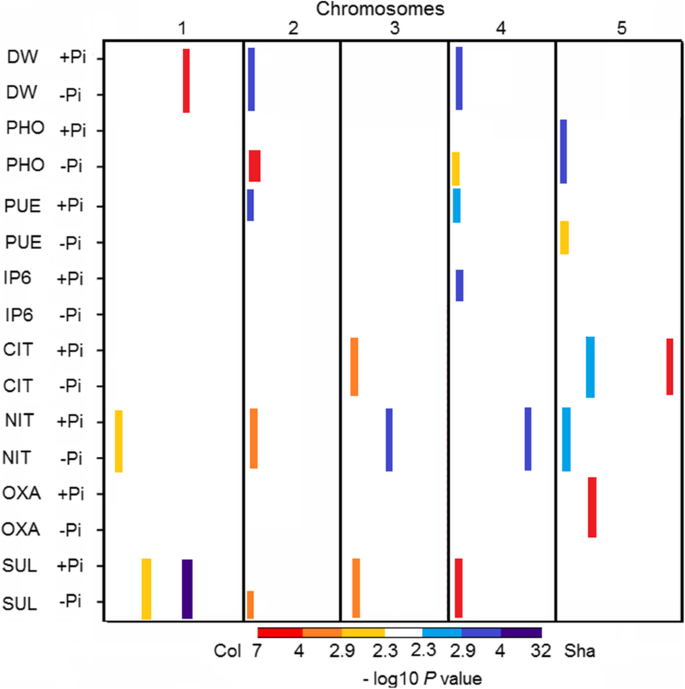
RIL/QTL群体中的QTL定位
利用RIL/QTL群体共定位了24个显著QTL,其中9个QTL表现出显著的QTLxE效应(图5)。2、表3.和附加文件1).在ch2、ch4和ch5的顶部分别定位了3个QTL簇。叶片Pi浓度的qtlPHO1,PHO2和PHO3,与磷利用效率qtl位于同一位置,PUE1,PUE2和PUE3,分别。在Chr 2顶部,观察到可能的拮抗多效作用PHO1叶片硝酸盐浓度的qtlNIT2和叶片硫酸盐浓度SUL3,具有来自Col等位基因的积极作用,以及DW2和PUE1,与Sha等位基因的积极作用。一个主要的QTL,SUL2在+Pi和-Pi处理下,QTLxE互作对叶片硫酸盐浓度变化的解释分别为42.9和33.7%。的Sha等位基因SUL2与Col等位基因相比,两种Pi处理的叶片硫酸盐浓度较高。SUL2co-localised与DW1,含有Col等位基因的QTL具有较高的DW,表明可能具有拮抗多效作用。7个qtl显示条件中立性,如PHO1,PHO2,PUE3,SUL3,具有来自Col等位基因的积极作用,以及PUE1,PUE2,IP6.1,与Sha等位基因的积极作用。IP6.1与其他SUL5在chr4顶部,+P处理的等位基因效应相反。
利用HapMap/GWAS群体绘制叶片中阴离子积累的snp
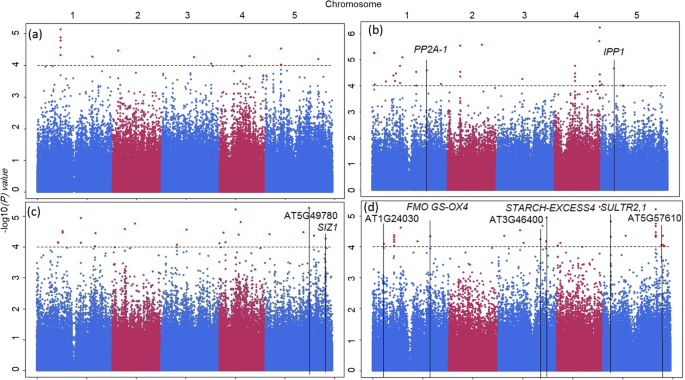
我们用-log法鉴定了188个显著单核苷酸多态性(SNPs)10(P)≥4,对应152个基因(图;3.,其他文件3.和4).表格4如TAIR所述,如果以某种方式与磷酸盐缺乏有关,则显示所选的显著snp及其具有已知生物学功能的相应基因。例如,一个与Pi浓度相关的显著SNP映射在蛋白磷酸酶2a-1 (pp2a-1 -AT1G59830) [40],一种编码蛋白磷酸酶2A催化亚基的一种异构体的基因。该SNP的非col等位基因在+Pi处理中的表型效应比在-Pi处理中的表型效应大10倍。另外一个与PUE相关的SNP被映射到AT5G49780 [41],它编码一种富含亮氨酸的重复受体样蛋白激酶。又映射到一个与PUE相关的SNPSIZ1(AT5G60410) [42],它编码参与蛋白质降解的SUMO E3连接酶。这是已知的磷饥饿依赖反应的调节因子[43]。对于与PUE相关的两个snp,在两种磷酸盐处理中,非Col等位基因给予的表型效应大约是Col等位基因的两倍。
使用多性状混合模型(MTMM)方法的HapMap/GWA映射显示−log10(P)的值(y轴),对于所有snp (x轴)。所测性状为玫瑰花结干重(一个)和叶Pi浓度(b)、Pi使用效率(c),以及叶片硫酸盐浓度(d).与候选基因相关的snp列于表中4用垂直的黑线表示。在每幅图中,5个拟南芥染色体对应的snp以蓝/紫交替表示,横轴表示基因组序列位置。−日志10(P)任意显著性阈值4用水平虚线表示
结果表明,叶片硫酸盐浓度与单核苷酸多态性之间存在一定的相关性硫酸盐转运蛋白2(SULTR2; 1- AT5G10180)基因,该基因参与硫酸盐摄取[44,45]。对于该位点,非col等位基因在-Pi处理下的效果约为+Pi处理的5倍,且方向相反。另一种关联被发现在一个SNP在双特异性蛋白磷酸酶4(DSP4- AT3G52180)基因,编码一种植物特异性葡聚糖磷酸酶,该酶在蛋白质和淀粉去磷酸化过程中参与硫代葡萄糖苷生物合成[46,47,48,49],硫酸盐浓度。该SNP对磷素有效性表现出拮抗作用,其中含有Col的等位基因增加了+Pi处理下叶片硫酸盐浓度,而不含Col的等位基因增加了-Pi处理下叶片硫酸盐浓度。三个与叶片硫酸盐浓度相关的基因,AT5G57610 [50]、AT3G46400及AT1G24030 [51],编码参与蛋白质磷酸化的蛋白激酶。对于AT5G57610,非Col等位基因在+Pi处理中的效果大约是Col等位基因在-Pi处理中的效果的三倍。AT1G24030的非col等位基因在+Pi处理中的效果比在-Pi处理中的效果高6倍。另外一个与叶片硫酸盐浓度相关的SNP在早花的亲戚基因(REF6- AT3G48430),该基因编码组蛋白H3赖氨酸27去甲基酶[52]以flc依赖的方式作为开花的正向调节因子[53]。
的SUL2在RIL/QTL群体中定位的QTL也在HapMap/GWAS群体中发现
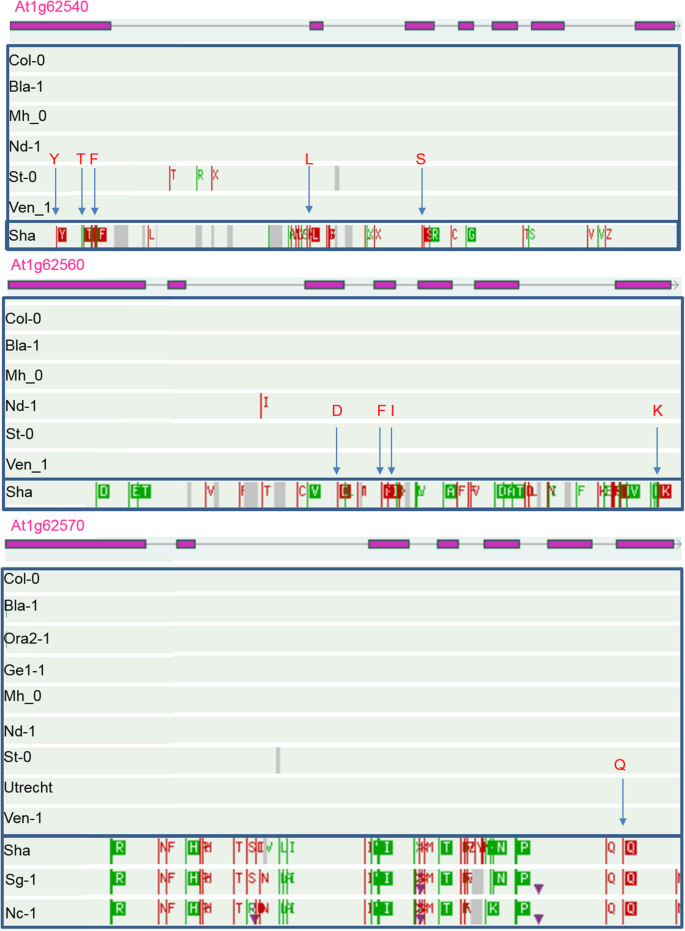
通过HapMap/GWAS与Sha x Col RIL/QTL群体中鉴定的QTL进行比较,以确定是否在两个群体中都存在。这就是SUL2轨迹(表3.),其中-log值最高的SNP10(P)的值为23,381千基对(kb)。这与23,171 kb(−log)的显著SNP共存10(P) = 4.4)在HapMap/GWAS中检测到,且与磷酸盐有效性有显著的相互作用(表4).这个SNP映射到黄素单加氧酶硫代葡萄糖苷s -加氧酶(FMO GS-OX4;AT1G62570)基因[54]。硫代葡萄糖苷s -加氧酶催化甲基硫代烷基葡萄糖苷转化为甲基亚砜烷基葡萄糖苷。在-Pi处理下,该SNP的非col等位基因增加了叶片硫酸盐浓度。未发现与基因存在链不平衡(LD)的snpFMO GS-OX4,但相邻的两个基因来自同一个家族,即。FMO GS-OX2和FMO GS-OX3,都在的置信区间内SUL2。虽然这些基因中有额外的snp,但在AT1G62540 (FMO GS-OX2) [55]和4个在AT1G62560 (FMO GS-OX3) [54],而非LD(图;4),这些与叶片硫酸盐浓度无显著相关性,也不太可能导致相关的表型差异。使用包含额外全基因组序列信息的拟南芥1001基因组浏览器,比较三者预测的氨基酸序列FMO GS-OX观察到Col和Sha单倍型组之间的基因差异,氨基酸序列差异,这可能是造成表型差异的原因(图2)。4).
AT1G62540三个基因氨基酸序列的比较(FMO GS-OX2),AT1G62560 (FMO GS-OX3),及AT1G62570, (FMO GS-OX4).Col和Sha单倍型3个基因氨基酸序列的比较。对于每个基因,外显子用紫色框表示,内含子用线连接。与Col-0参考基因组不同的氨基酸用绿色和红色标记。蓝色箭头表示Col和Sha之间的非同义氨基酸差异。箭头上方字母表示氨基酸,Y =酪氨酸,T =苏氨酸,F =苯丙氨酸,L =亮氨酸,S =丝氨酸,D =天冬氨酸,I =异亮氨酸,K =赖氨酸,Q =谷氨酰胺(图片来自http://signal.salk.edu/atg1001/3.0/gebrowser.php)
讨论
目前的工作旨在绘制与叶片Pi浓度、Pi利用效率和叶片硫酸盐浓度相关的基因组位点和候选基因,并研究它们对磷酸盐供应作为环境变量的相互作用和稳态响应。结果表明,在-Pi处理下,叶片Pi与硫酸盐浓度降低,且两者呈正相关。这与早期的一项研究相似,该研究报告了-Pi处理下拟南芥幼苗中叶片Pi和硫酸盐浓度的下降[20.]。叶片中Pi含量与硫酸盐含量呈正相关,这在一定程度上可由转录因子基因解释PHR1。这编码了参与Pi反应的myb样转录因子,并在参与Pi运输和再动员的基因的表达调节中发挥核心作用[56]。它还通过控制硫酸盐转运蛋白的表达,作为硫酸盐稳态的常见调节因子SULTR响应π饥饿的基因[20.]。PHR1通过上调蛋白的表达,促进芽根硫酸盐转运SULTR1; 3下调的表达SULTR2; 1和SULTR3; 4[20.]。也在芸苔属植物显著的表达式BnPHR1是由茎和根的π饥饿引起的[57]。进一步的串扰在水稻中被观察到OsSULTR3; 3降低了稻谷中的植酸盐和磷的浓度,并改变了代谢物的分布[58]。另一种类似于sultr的转运蛋白OsSULTR3;4,也被称为SPDT (SULTR-like P distribution transporter),被报道参与水稻中P的分配,并在籽粒中优先分配P [59]。在我们的研究中,我们预测到了这一点PHR1,位于chr4顶部,是导致糖尿病的致病基因PHO2QTL,特别是当它与SUL5QTL,对叶片Pi和硫酸盐浓度的影响相似。这种共定位可以解释多效效应,并为在-Pi处理下硫酸盐和Pi信号通路之间的强协调提供了可能的解释。在-Pi处理下,PHR1蛋白被SIZ1(一种SUMO E3连接酶蛋白和一种已知的P饥饿依赖反应的调节因子)磺酰化[43]。一个与PUE相关的显著SNP也被映射到SIZ1在HapMap/GWAS中。拟南芥siz1突变体在磷缺乏反应中表现出初生根伸长和侧根发育减少,这是生长素分布模式受到负调控影响的证据[43]。
基因来自SULTR家族编码细胞摄取硫酸盐所需的硫酸盐转运蛋白。我们的HapMap/GWAS结果显示了一个SNP映射到SULTR2; 1和叶片硫酸盐浓度。SULTR2; 1是一个主要的硫酸盐运输合作SULTR3; 5将硫酸盐从根转移到新梢该SNP在-Pi处理下的效果比+Pi处理高出5.6倍。我们的发现强化了这一命题SULTR2; 1在缺乏磷和硫酸盐的情况下,参与亚砜类生物合成的增强和磷脂被亚砜类取代[20.,29],此外,SULTR2; 1据报道,在磷饥饿的响应下,主要在根中,少量在芽中上调和过表达[20.,60],所有这些都支持其参与对Pi缺乏症的反应。
硫代葡萄糖苷生物合成需要细胞内硫酸盐[61],需要几种硫代葡萄糖苷生物合成基因的表达。其中之一是黄素单加氧酶硫代葡萄糖苷s加氧酶(FMO GS-OX)基因家族包括FMO GS-OX4[54,62]。我们的结果显示两个snp映射到相似的等位基因效应SULTR2; 1和FMO GS-OX4这与叶片硫酸盐浓度有关。在-Pi处理中,两种snp的非Col等位基因的影响分别比+Pi处理中的Col等位基因的影响高5.6倍和7倍,这表明硫代葡萄糖苷生物合成对硫酸盐输入的预期。SNP映射到FMO GS-OX4(无花果。3.的区间内SUL2,叶片硫酸盐浓度的主要QTL定位于Chr 1的底部(图1)。1).如沙等位基因为FMO GS-OX4/SUL2在-Pi处理下增加叶片硫酸盐浓度,我们预期Sha和Col单倍型之间的氨基酸序列差异是致病基因,这确实是发现了FMO GS-OX4等位基因。总之,这些结果支持候选人FMO GS-OX4是潜在的致病基因SUL2。然而,有两段对话Fmo gs-ox4, Fmo gs-ox2[55),FMO GS-OX3,与硫酸盐代谢功能相似[54],在该基因的侧翼,也位于的区间内SUL2。因为这些的Sha和Col单倍型FMO GS-OX2和FMO GS-OX3编码氨基酸序列不同的蛋白质的基因,任何一种,甚至全部三种,FMO GS-OX基因可能会导致SUL2QTL。
同样的分析也被用于5 '腺苷酰磷酸硫酸还原酶2(APR2基因(AT1G62180) [63,64],它也位于SUL2置信区间,但在HapMap/GWAS中与显著snp无关。该基因参与硫酸盐还原[63],并曾与沙湾鲤群的硫酸盐含量有关[63]。比较氨基酸序列APR2等位基因也揭示了Sha和Col等位基因之间的差异,这与早先的报告一致[64的弱等位基因APR2。然而,由于这个弱等位基因并没有导致Sha和Col-0叶片硫酸盐浓度的差异,作者认为,还应该存在进一步的调节硫酸盐积累的水平APR2,我们认为是其中的一个或多个FMO GS-OX基因图谱就在附近。此外,作者也未能识别任何与之相关的snpAPR2通过GWAS分析,认为叶片总硫浓度变化的原因基因。尽管如此,他们证实了APR2对拟南芥Col-0和Hodonin (Hod)杂交的F2群体进行硫酸盐还原,使用批量分离分析结合SNP微阵列基因分型[64]。既不是虚弱的沙,也不是强壮的荷德功能低下APR2等位基因在其他任何附加中都存在,这表明这些等位基因在全球拟南芥HapMap/GWAS群体中很罕见,而且它们的频率太低,无法在GWAS中提取。这也解释了为什么我们不能将与叶片硫酸盐浓度相关的显著SNP映射到APR2基因。
另一个与叶片硫酸盐浓度相关的SNP被定位到早花的亲戚(REF6)基因,是flc依赖通路中开花的正向调节因子[53]。此外,还有一些关于多效性作用的报道方法[65,66,67对花期以外的其他性状的影响,最近一项研究[68)建议方法,以及SULTR2; 1,作为潜在的候选的主要QTL调节硫代葡萄糖苷在整个生命周期的变化Aethionema arabicum。除了在应对硫饥饿方面的作用外[44,45],SULTR2; 1已知对氮饥饿具有多效性[69]以及干旱和盐度胁迫[70]。多效性效应也被报道FMO GS-OX4,仅次于硫代葡萄糖苷生物合成[54,62]参与金属稳态[71],以及植物的抗冻性[72,73],盐[74],以及干旱[75]。因此,我们提出多效性效应是二者共存的原因PHO1和NIT2在-Pi处理下,QTL全部映射到Chr 2的顶部PHO3和NIT5,在Chr 5的顶部。这些多向效应表明硝酸盐和磷之间可能存在交叉作用,最近在水稻中发现硝酸盐触发的磷信号抑制因子SPX4的降解激活了磷和硝酸盐反应基因,这也很好地支持了这一结果[76]。多向效应也可能是共定位的原因PHO2与SUL5在Chr 4。在这两种情况下,Col等位基因增加了性状值。该QTL与之前定位的PO3.4 QTL共同定位,与Bay-0 x Sha RIL群体不同氮效度下Pi含量相关[77]。同样的,PHO3和NIT5与氮素含量QTL NO.10.8共定位,定位于同一群体ch5的顶部[77]。这些共同定位表明,可能有相似的位点参与控制对磷和氮缺乏的反应。早期的研究[78]报道了氮和磷的缺乏都会导致黄酮醇在两者的幼苗组织中积累答:芥和番茄。在高粱上的另一项研究表明,不仅缺乏磷,而且缺乏氮,增加了从根部渗出的独脚金内酯[79]。在本文提供的数据中也发现了几种这样的共定位。例如,三个qtl,PHO3,PUE3和NIT5,与NO.10.8共定位[77]。此外,SUL1QTL与NO.10.1共定位于Chr 1顶部,QTL与NO.10.1共定位于Chr 1顶部SUL2QTL与PO3.2共定位于Chr 1的底部SUL4QTL定位于Chr 3顶部,与NO10.6共位[77],利用Pi和phytate的两个qtl [19]。最后,在Chr 3顶部绘制了正常硝酸盐处理下硫酸盐浓度的QTL [80],与CIT1和SUL3。
在所有已鉴定的共定位位点的旁边还有几个特异位点,表明在氮或硫稳态的缺磷反应调控的共同因子旁边,也有几个特异位点,表明存在不同程度的(共)调控,但也说明了性状的遗传复杂性和多基因性质。
结论
本文所研究的性状与几个已知功能的基因之间的关联,这些功能与负离子交叉和响应Pi可用性的稳态相关,证实了以下HapMap/GWAS方法在识别候选基因时的适用性,而不需要额外的精细定位,因为在RIL群体中确定qtl将需要精细定位。SNP映射到FMO GS-OX4位于叶片硫酸盐浓度的主要QTL区间内,SUL2,映射到Chr 1的底部。比较了氨基酸序列Fmo gs - ox2,3,和4在该位点串联排列的基因,将Col与Sha单倍型群区分开来,支持至少一个单倍型的候选性FMO GS-OX基因是因果关系SUL2QTL。将在RIL群体中观察到的QTL共定位与早期研究进行比较,表明控制叶片Pi浓度、氮和硫酸盐浓度的QTL可能具有多效性。如果这确实可以在作物中得到证实,这将意味着这些性状的育种不需要单独进行,而可以在几轮选择中实现。然而,要做到这一点,需要确认qtl的实际共定位答:芥,以分子遗传数据为支持,将是必要的。
方法
植物材料和实验装置
拟南芥Sha x Col核心重组自交系(RIL)群体由164个F6 RIL组成[81]以及一个由360个全球成员组成的多样性小组,称为HapMap联合小组[82],用于遗传分析。Sha x Col RIL群体已从Versailles拟南芥种群中心(publiclines.versailles.inra.fr瑞来斯/索引),该HapMap已从欧洲拟南芥种群中心(arabidopsis.info).实验采用完全随机分组设计,其中两个重复组用于QTL/RIL群体,三个重复组用于HapMap/GWAS群体。所有实验均在生长箱中进行,生长箱日长为12 h,温度为20℃,湿度为60%,光照强度为200 μmol m−2年代−1。种子在4°C下分层7天,然后种植在岩棉块上。植物在充足(+Pi)和缺乏(−Pi)处理下生长。用Hyponex营养液(NH . 7)每周浇灌3次(第2、4和7天),持续5分钟4+1.4;K+5.7;Na+0.2;没有3.−, 5.7 mM;hyponex.co.jp),或补充1.2 mM KH2阿宝4,为+Pi,或100 μM KH2阿宝4,用于-Pi处理。
离子测量
植株生长4周后,收集植株的莲座(嫩枝),在液氮中冷冻干燥48 h,测定总莲座干重(DW)。将6至9毫克的干材料在微移管中研磨,在100℃下与1毫升含50毫克/升t-附子的0.5 N HCl一起煮15分钟。样品以14000 rpm离心5 min,上清液转入300 μl玻璃瓶。使用高效阴离子交换色谱(HPAE) (Dionex®AS50)测量叶Pi、IP6、柠檬酸盐、硝酸盐、草酸盐和硫酸盐浓度。去离子水和50 mg/l t-乌头酸溶液分别作为阴性对照和内标。Pi利用效率(PUE)以枝条干重/叶片Pi浓度[24]。
统计分析和基因组图谱
采用SPSS v21进行统计学分析。对于每个性状,采用方差分析检验各处理和品系之间的显著性差异以及G × E的显著性水平[83]。各性状的广义遗传力用遗传方差的比值来估计Vg,和总表型方差Vt,Vt=Vg+已经,在那里已经是环境变异,即每一行复制之间的变异。如前所述,一般多环境混合模型方法用于链接和GWA映射[67,84]。采用单性状多环境方法在RIL群体中进行QTL定位,使用GenStat for Windows 16版(VSN International, Hemel Hempstead, UK),并带-log10(P)阈值= 2.9,根据GenStat中实现的方法计算[85],将全基因组I型误差水平设为0.05。然而,我们报告的qtl具有较低的阈值,即至少2.3,如果它们与密切相关性状的显著qtl共定位。对于GWA映射,多特征混合模型方法[84],并使用任意的-log10(P)阈值为4,次要等位基因频率为0.05,这与早期研究相似[67,86,87],但低于非常严格的-log10(P) = 6.6阈值时,应用Bonferroni校正多重测试假设snp之间的独立性。列出了在LD (LD > 0.3)中发现的基因,或者如果没有发现LD,则在显著SNP两侧10 kb内发现的基因。所有候选基因的描述均来自拟南芥信息资源(The Arabidopsis Information Resource, TAIR;www.arabidopsis.org).拟南芥1001基因组浏览器(signal.salk.edu/ atg1001/3.0 / gebrowser.php) (88]用于比较与显著SNPs共定位的所有基因的预测氨基酸序列。
数据和材料的可用性
本研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。
缩写
- +π/−π:
-
充足/缺乏磷酸盐供应
- DW:
-
干重
- GWAS:
-
全基因组关联研究
- GxE:
-
环境相互作用基因分型
- IP6:
-
肌醇六磷酸
- Kb:
-
Kilobasepair
- LD:
-
连锁不平衡
- 病人:
-
磷
- 越南河粉:
-
叶Pi浓度
- Pi:
-
无机磷酸盐
- PUE:
-
磷酸盐利用效率
- QTL:
-
数量性状位点
- 瑞来斯:
-
重组自交系
- SNP:
-
单核苷酸多态性
- 南:
-
叶片硫酸盐浓度
- TAIR:
-
拟南芥信息资源(www.arabidopsis.org)
参考文献
Baligar VC, Fageria NK, He ZL。植物养分利用效率。土壤科学,2001;32(7-8):921-50。
Heuer S, Gaxiola R, Schilling R, Herrera-Estrella L, López-Arredondo D, Wissuwa M, Delhaize E, Rouached H.提高磷利用效率:一个具有新兴机会的复杂性状。植物学报,2017;30(5):868 - 868。
高等植物对磷酸盐的获取:根系释放羧酸盐的影响。一个批判性的评论。植物营养与土壤学报,2015;26(3):353 - 353。
Weihrauch C, Opp C.土壤中与生态相关的磷池及其动态:迄今为止的故事。Geoderma。2018;325:183 - 94。
C乌德-斯通,柯津,Ramirez-Yáñez M;尼龙过滤器阵列揭示了白露蛋白根对磷缺乏反应的差异基因表达。植物科学进展。2003;32(3):344 - 344。
哈蒙德JP,怀特PJ。蔗糖在韧皮部的转运:整合根系对磷饥饿的反应。中国机械工程学报,2008;29(1):1 - 9。
Singh Gahoonia T, Nielsen NE。根系性状作为创造磷高效作物品种的工具。植物学报。2004;26(1):457 - 457。
Secco D, Bouain N, Rouached A, Prom UTC, Hanin M, Pandey AK, Rouached H.植物中的磷酸盐,植酸和植酸酶:从拟南芥的基础知识到小麦的潜在生物技术应用。生物工程学报。2017;37(7):1-13。
环境:正在消失的营养物。大自然。2009;461(7265):716 - 8。
杨晓明,杨晓明,杨晓明,等。植物磷素利用效率的遗传决定因素研究。插入:植物非生物胁迫基因。霍博肯:著名;2009.p . 143 - 65。
马吉诺J,萨默R,穆卡拉玛J,帕里克SJ。磷的生物循环受磷肥形态的影响。水土保持学报,2017;29(8):899-909。
杨晓明,杨晓明,杨晓明。土壤中磷的化学转化研究。进:斯图尔特学士,编辑。土壤科学进展。纽约:施普林格纽约;1991.1 - 120页。
Ryan PR, Tyerman SD, Sasaki T, Furuichi T, Yamamoto Y, Zhang WH, Delhaize E.抗铝基因的鉴定为提高酸性土壤作物产量提供了机会。中国机械工程学报,2011;26(1):19 - 21。
詹默,阿拜杜,罗永杰,王永杰。缺磷胁迫对豇豆耐铝性的影响。中国植物科学,2007;26(4):344 - 344。
李志强,李志强,王志强,Römheld V.白露蛋白根发育对磷缺乏的生理适应。足底。1999;208(3):373 - 82。
柯克比EA,约翰斯顿AE。土壤和肥料磷与作物营养的关系。进:White PJ, Hammond JP,编辑。植物-磷相互作用的生态生理学研究。多德雷赫特:施普林格荷兰;2008.p . 177 - 223。
王辽H, H, Shaff J, X,燕X, Kochian LV。大豆中磷铝相互作用与耐铝性的关系。由完整根系的不同部位分泌的特定有机酸。植物科学进展。2006;32(2):344 - 344。
林志华,陈立林,陈瑞斌,张富珍,蒋海霞,唐宁,史密斯布瑞。茶树根系有机酸释放和代谢对磷供应的响应。中国植物科学,2011;29(7):344 - 344。
王晓明,王晓明,王晓明,王晓明,等。拟南芥种子和叶片植酸和磷酸盐积累的遗传学研究。应用理论与实践。2003;36(7):344 - 344。
Rouached H, Secco D, Arpat B, Poirier Y.转录因子PHR1在拟南芥磷酸盐饥饿时硫酸盐幼苗根通量调控中起关键作用。BMC植物生物学2011;11:19。
Poza-Carrión C, Paz-Ares J.当硝酸盐和磷酸盐传感器相遇。植物学报,2019;5(4):339-40。
Gomez-Roldan V, Fermas S, Brewer PB, Puech-Pages V, Dun EA, pilojp, Letisse F, Matusova R, Danoun S, Portais JC,等。独脚金内酯抑制枝条分枝。自然。2008;455(7210):189 - 94。
李志强,李志强,李志强,李志强。提高植物磷吸收效率的研究进展。中国农学通报,2010;17(2):379 - 379。
Gourley CJP, Allan DL, russell MP。植物养分效率:定义的比较和改进建议。植物土壤学报。1994;58(1):29-37。
Uzokwe VNE, Asafo-Adjei B, Fawole I, Abaidoo R, Odeh IOA, Ojo DK, Dashiell K, Sanginga N.低磷土壤自由结瘤大豆杂交株磷利用效率的代均值分析。植物营养学报,2017;36(2):369 - 369。
王峰,邓敏,徐娟,朱晓霞,毛超。高等植物磷酸盐转运与信号转导的分子机制。中国生物医学工程学报,2018;
Raghothama公斤。磷酸的收购。植物学报,1999;50(1):665-93。
米普加,罗jas - triana M, de Lorenzo L, Leyva A, Rubio V, Paz-Ares J.植物饥饿反应调控中的新信号:事实和承诺。植物学报,2017;39:40-9。
王志刚,王志刚,王志刚,王志刚。拟南芥P、S、Fe和Zn营养信号的整合:磷酸饥饿反应1 (PHR1)的潜在参与。植物科学进展(英文版);
El-Soda M, Malosetti M, Zwaan BJ, Koornneef M, Aarts MG。植物基因型x环境相互作用QTL定位:拟南芥的经验教训。植物科学进展,2014;9(6):390-8。
Hammond JP, Bennett MJ, Bowen HC, Broadley MR, Eastwood DC, May ST, Rahn C, Swarup R, Woolaway KE, White PJ。拟南芥幼苗在磷酸盐饥饿过程中基因表达的变化及培育智能植物的潜力。植物科学进展。2003;32(2):578-96。
Bonnot C, Pinson B, Clément M, Bernillon S, Chiarenza S, Kanno S, Kobayashi N, Delannoy E, Nakanishi TM, Nussaume L,等。一种化学遗传策略识别了PHOSTIN,一种在拟南芥中触发磷酸盐饥饿反应的合成分子。中国植物学报,2016;39(1):379 - 379。
Ayadi A, David P, Arrighi J-F, Chiarenza S, Thibaud M-C, Nussaume L, Marin E.减少拟南芥磷酸盐转运蛋白的遗传冗余,研究磷酸盐摄取和信号转导。中国生物医学工程学报,2015;26(4):344 - 344。
孙玲,宋玲,张艳,郑志刚,刘东。拟南芥PHL2和PHR1作为磷酸饥饿转录应答中枢调控系统的关键元件。中国生物医学工程学报,2016;29(1):349 - 349。
Hammond JP, Mayes S, Bowen HC, Graham NS, Hayden RM, Love CG, Spracklen WP, Wang J, Welham SJ, White PJ,等。不同土壤磷供给条件下油菜调控热点与植物基因表达相关。中国生物医学工程学报。2011;36(3):344 - 344。
宁玲,阚刚,杜伟,郭松,王强,张刚,程华,于东。大豆苗期耐磷性单核苷酸多态性的关联分析[Glycine max (L) Merr.]。育种科学2016;66(2):191-203。
Eichler EE, Flint J, Gibson G, Kong A, Leal SM, Moore JH, Nadeau JH。遗传性缺失和寻找复杂疾病潜在原因的策略。植物学报。2010;11(6):446-50。
罕见和常见的变体:20个参数。植物学报。2012;13(2):135-45。
Brachi B, Faure N, Horton M, Flahauw E, Vazquez A, Nordborg M, Bergelson J, Cuguen J, Roux f拟南芥自然界的开花时间。公共科学学报,2010;6(5):e1000940。
Arino J, Perez-Callejon E, Cunillera N, Camps M, Posas F, Ferrer A.高等植物蛋白磷酸酶:拟南芥2A型磷酸酶的多样性。植物分子生物学,1993;21(3):475-85。
Sottosanto JB, Gelli A, Blumwald E.缺乏空泡Na+/H+反转运体的拟南芥DNA阵列分析:AtNHX1对基因表达的影响。植物学报,2004;40(5):732 - 732。
刘玲,闫霞,孔霞,赵艳,龚志,金剑杰,郭艳。OTS1 SUMO蛋白酶维持转录基因沉默需要dna依赖的聚合酶v依赖通路。中国生物医学工程学报,2017;29(1):344 - 344。
Miura K, Rus A, Sharkhuu A, Yokoi S, Karthikeyan AS, Raghothama KG, Baek D, Koo YD, Jin JB, Bressan RA,等。拟南芥SUMO E3连接酶SIZ1控制磷酸盐缺乏反应。中国科学(d辑),2005;26(4):457 - 457。
Maruyama-Nakashita A, Watanabe-Takahashi A, Inoue, Yamaya T, Saito K, Takahashi H.在硫缺乏条件下拟南芥根中,3 ' -非转录基因间区硫响应元件对诱导SULFATE TRANSPORTER 2;1基因表达至关重要。植物学报。2015;27(4):1279-96。
Kawashima CG, Yoshimoto N, Maruyama-Nakashita A, Tsuchiya YN, Saito K, Takahashi H, Dalmay T.硫饥饿诱导microRNA-395及其一个靶基因的表达,但在不同的细胞类型中。植物学报,2009;26(2):326 - 326。
银DM, Kotting O, Moorhead GB。磷酸葡聚糖磷酸酶的功能揭示了淀粉的降解。植物科学进展,2014;19(7):471-8。
Silver DM, Silva LP, Issakidis-Bourguet E,闪耀MA, Schriemer DC, Moorhead GBG。深入了解参与淀粉降解的磷酸葡聚糖磷酸酶SEX4的氧化还原调控。中国生物医学工程学报。2013;29(2):344 - 344。
Santelia D, Kötting O, Seung D, Schubert M, Thalmann M, Bischof S, Meekins DA, Lutz A, Patron N, Gentry MS,等。在拟南芥中,磷酸葡聚糖磷酸酶性4 - 2在c3 -位置去磷酸化淀粉。植物学报。2011;23(11):4096-111。
Kerk D, Conley TR, Rodriguez FA, Tran HT, Nimick M, Muench DG, Moorhead GBG。拟南芥中叶绿体定位的双特异性蛋白磷酸酶含有一个系统发育上分散的古老碳水化合物结合结构域,该结构域与多糖淀粉结合。植物学报,2006;46(3):400-13。
Ichimura K, Shinozaki K, Tena G, Sheen J, Henry Y, Champion A, Kreis M, Zhang S, Hirt H, Wilson C,等。丝裂原活化蛋白激酶在植物中的级联:一个新命名。植物科学进展,2002;7(7):301-8。
Nemoto K, Seto T, Takahashi H, Nozawa A, Seki M, Shinozaki K, Endo Y, Sawasaki T.利用无细胞系统对拟南芥蛋白激酶进行自磷酸化分析。植物化学。2011;72(10):1136 - 44。
陆峰,崔旭,张s, Jenuwein T,曹霞。拟南芥REF6是一种组蛋白H3赖氨酸27去甲基酶。Nat Genet. 2011;43:715。
卢彬,李世华,金海杰,李庚,申娥娥,李敏,郑克杰,Doyle MR, Amasino RM,卢永善。一对同源朱蒙吉/锌指类转录因子蛋白在拟南芥开花时间调控中的分歧作用。《植物科学》2004;16(10):2601-13。
李J, Hansen BG, Ober JA, Kliebenstein DJ, Halkier BA。参与脂肪族硫代葡萄糖苷生物合成的黄素单加氧酶的亚支。植物科学进展。2008;38(3):344 - 344。
Hansen BG, Kliebenstein DJ, Halkier BA。黄酮单加氧酶在拟南芥脂肪族硫代葡萄糖苷生物合成中的s -加氧酶鉴定。植物学报,2007;26(5):528 - 528。
Rubio V, Linhares F, Solano R, Martín AC, Iglesias J, Leyva A, Paz-Ares J.一种保守的MYB转录因子参与维管植物和单细胞藻类的磷酸盐饥饿信号。基因工程学报2001;15(16):2122-33。
任峰,郭秋秋,常丽丽,陈琳,赵成珍,钟辉,李晓波。甘蓝型油菜PHR1基因编码myb样蛋白对磷酸盐饥饿的响应。公共科学学报。2012;7(8):e44005。
赵华,Frank T,谭勇,周超,Jabnoune M, Arpat AB,崔华,黄俊,何忠,Poirier Y,等。OsSULTR3;3的破坏降低了水稻中植酸盐和磷的浓度,并改变了代谢物的分布。植物学报。2016;211(3):926-39。
山治N,竹本Y,宫治T,三谷上野N,吉田KT,马JF。减少磷在水稻籽粒中的积累与节点中的转运蛋白受损。大自然。2017;541(7635):92 - 5。
谢立龙,林思,施志昌,陈建文,林文文,曾勇,李文华,邱廷杰。通过深度测序揭示拟南芥中小rna介导的磷酸盐缺乏应答。植物科学进展。2009;32(4):344 - 344。
Davidian J-C, Kopriva S.硫酸盐吸收和同化的调节-相同还是不相同?植物学报。2010;3(2):314-25。
李J, Kristiansen KA, Hansen BG, Halkier BA。参与硫代葡萄糖苷生物合成的黄素单加氧酶的细胞和亚细胞定位。中国机械工程学报,2011;26(3):344 - 344。
Loudet O, Saliba-Colombani V, Camilleri C, Calenge F, Gaudon V, Koprivova A, North KA, Kopriva S, Daniel-Vedele F.拟南芥硫酸盐含量的自然变异受APR2高度控制。中国科学。2007;39(7):896-900。
Chao D-Y, Baraniecka P, Danku J, Koprivova A, Lahner B, Luo H, Yakubova E, Dilkes B, Kopriva S, Salt DE.拟南芥硫和硒积累的变化受关键硫同化酶ADENOSINE 5 ' -PHOSPHOSULFATE REDUCTASE2自然存在的异构体控制。中国生物医学工程学报。2014;36(3):344 - 344。
Boss PK, Bastow RM, Mylne JS, Dean C.决定开花的多种途径:使能,促进和重置。植物细胞。2004;16(增刊):S18-31。
王晓明,张晓明,王晓明,等。转基因烟草的研究进展。中国烟草学报,2005;26(6):357 - 357。
El-Soda M, Willem K, Malosetti M, Koornneef M, Aarts MGM。拟南芥干旱响应的数量性状位点及环境互作基因型下的候选基因。植物生态学报。2015;38:585-99。
李志强,李志强,李志强,李志强。开花位点C (FLC)是油菜Aethionema arabicum(芸苔科)发育阶段硫代葡萄糖苷含量的潜在主要调节因子。植物科学进展,2017;
彭敏,毕艳梅,朱涛,罗斯坦。拟南芥泛素连接酶基因NLA对氮限制应答转录组的全基因组分析。植物分子生物学杂志,2007;26(6):775-97。
Gallardo K, Courty P-E, Le Signor C, Wipf D, Vernoud V.植物对干旱和盐度反应中的硫酸盐转运蛋白:调控和可能的功能。植物科学进展(英文版);
贝谢尔,李志刚,李志刚,李志刚。超富集锌植物拟南芥幼苗中金属稳态基因的高表达。植物学报,2004;37(2):251-68。
Oono Y, Seki M, Satou M, Iida K, Akiyama K, Sakurai T, Fujita M, Yamaguchi-Shinozaki K, Shinozaki K.利用DNA微阵列技术监测拟南芥冷驯化和非驯化过程中的基因表达。中国基因组学杂志。2006;6(3):212-34。
张欣,Fowler SG,郑华,娄勇,李世永,Stockinger EJ, Thomashow MF。低温敏感番茄具有功能性的CBF冷响应途径,但CBF调控与耐寒拟南芥不同。植物学报,2004;39(6):905-19。
Taji T, Seki M, Satou M, Sakurai T, Kobayashi M, Ishiyama K, Narusaka Y, Narusaka M, Zhu J-K, Shinozaki K.利用拟南芥微阵列研究拟南芥和拟南芥相关盐生植物盐芥的耐盐性比较基因组学。植物科学进展。2004;35(3):379 - 379。
黄东,吴伟,艾布拉姆斯SR,卡特勒AJ。拟南芥干旱相关基因表达与激素和环境因子的关系。中国机械工程学报,2008;29(11):379 - 379。
胡斌,蒋震,王伟,邱勇,张震,刘勇,李安,高旭,刘磊,钱勇,等。硝酸盐- nrt1.1 b - spx4级联集成植物中的氮和磷信号网络。植物学报。2019;5(4):401-13。
杨晓明,陈晓明,陈晓明,陈晓明,等。水稻水分和阴离子含量与氮素有效性相互作用的数量性状位点分析拟南芥。遗传学。2003;163(2):711 - 22所示。
陈志刚,陈志刚,陈志刚,陈志刚。氮磷缺乏对植物组织中黄酮醇积累的影响。植物细胞环境。2001;24(11):1189-97。
Yoneyama K, Xie X, Kusumoto D, Sekimoto H, Sugimoto Y, Takeuchi Y, Yoneyama K.高粱缺氮和缺磷促进了丛枝菌根真菌和根寄生虫的宿主识别信号5-脱氧三甘醇的产生和分泌。足底。2007;227(1):125 - 32。
Koprivova A, Giovannetti M, Baraniecka P, Lee BR, Grondin C, Loudet O, Kopriva S. ATP硫化酶ATPS1亚型的自然变异对拟南芥硫酸盐水平的控制中国生物医学工程学报,2013;29(3):344 - 344。
Simon M, Loudet O, Durand S, Bérard A, Brunel D, Sennesal F-X, Durand- tardif M, Pelletier G, Camilleri C.拟南芥5个大型重组自交系群体的数量性状位点定位遗传学。2008;178(4):2253 - 64。
李艳,黄艳,Bergelson J, Nordborg M, Borevitz JO。植物局部气候敏感数量性状位点的关联制图拟南芥。自然科学进展,2010;26(4):369 - 369。
Giraud E, Ho LHM, Clifton R, Carroll A, Estavillo G, Tan Y-F, Howell KA, Ivanova A, Pogson BJ, Millar AH,等。拟南芥中ALTERNATIVE OXIDASE1a基因的缺失导致其对光和干旱胁迫的急性敏感性。植物科学进展。2008;32(2):595-610。
Korte A, Vilhjalmsson BJ, Segura V, Platt A, Long Q, Nordborg M.结构化群体相关性状全基因组关联研究的混合模型方法。中国科学,2012;44(9):1066-71。
李娟,季林。利用相关矩阵的特征值调整多位点分析中的多重检验。遗传。2005;95(3):221 - 7。
Olivas NHD, Kruijer W, Gort G, Wijnen CL, Loon JJA, Dicke M.通过全基因组关联分析揭示了拟南芥单一和复合胁迫响应的不同遗传结构。中国植物学报,2017;26(2):344 - 344。
Kooke R, Kruijer W, Bours R, Becker F, Kuhn A, van de Geest H, Buntjer J, Doeswijk T, Guerra J, Bouwmeester H,等。全基因组关联作图和基因组预测阐明了拟南芥形态性状的遗传结构。中国生物医学工程学报,2016;30(4):457 - 457。
Weigel D, Mott R. 1001基因组计划拟南芥。中国生物工程学报。2009;10(5):107。
确认
我们感谢Taede Stoker和Gerrit Stunnenberg的Unifarm, Wageningen UR,他们在植物繁殖方面的帮助。
资金
这项研究由荷兰研究生院实验植物科学和生物系统基因组学中心资助。这些资助机构在研究设计、数据收集、分析和解释以及撰写手稿方面没有任何作用。
作者信息
从属关系
贡献
MGMA和CNM:实验计划和设计。CNM和NGM:进行实验。DJ:进行HPLC分析。ME:分析了数据。ME、CNM、MK和MGMA共同撰写了手稿。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
M.G.M.A.是BMC植物生物学编辑委员会的成员,但对这篇手稿的出版没有编辑影响力。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
附加文件
附加文件2:
RIL/QTL (a)和HapMap/GWAS (b)群体非归一化性状的频率分布。Sha-C和Col-C为充足Pi生长的亲本系的值,Sha-D和Col-D为不足Pi生长的亲本系的值,均用箭头表示。充足磷处理的数据用深灰色条表示,缺乏磷处理的数据用浅灰色条表示。纵轴表示每个性状值类的基因型数,横轴表示不同的性状值类。IP6 =叶片植酸盐浓度,CIT =叶片柠檬酸盐浓度,NIT =叶片硝酸盐浓度,OXA =叶片草酸盐浓度。(PNG 267 kb)
附加文件3:
使用多特征混合模型方法的HapMap/GWA映射显示−log10(P)值(y轴),对于所有SNPs (x轴)测量的性状是植酸盐(a),柠檬酸盐(b),硝酸盐(c)和草酸盐(d)。附加文件中列出了与候选基因相关的SNPs4用垂直的黑线表示。在每幅图中,5个拟南芥染色体对应的snp以蓝/紫交替表示,横轴表示基因组序列位置。−日志10(P)任意显著性阈值4用水平虚线表示。(PNG 1619 kb)
附加文件4:
在充足磷酸盐(+Pi)和缺乏磷酸盐(- Pi)处理下,所有候选基因在HapMap/GWAS群体中定位。PHO =叶片Pi浓度,PUE =叶片Pi利用率,IP6 =叶片植酸盐浓度,Cit =叶片柠檬酸盐浓度,Nit =叶片硝酸盐浓度,Oxa =叶片草酸盐浓度,SUL =叶片硫酸盐浓度。MAF为次要等位基因频率。日志10(P)表示关联的显著性水平。β表示SNP在(+Pi)或(- Pi)上的表型效应,正值表示Col等位基因对性状值的正向作用。标记染色体数目(Chr.)。每个染色体上的SNP位置以千碱基对(kb)为单位给出。SNP位置和描述均基于TAIR v.10(www.arabidopsis.org).如果没有发现链不平衡(LD),则列出显着SNP两侧10 kb以内的链不平衡(LD > 0.3)基因。(xlsx38kb)
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
El-Soda, M., Neris Moreira, C., Goredema-Matongera, N.。et al。与叶片阴离子浓度相关的QTL和候选基因对磷素供给的响应拟南芥。BMC植物生物学19日,410(2019)。https://doi.org/10.1186/s12870-019-1996-3
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-019-1996-3
关键字
- 负离子浓度
- 缺磷
- QTL和关联映射
- QTL x E