- 研究文章GydF4y2Ba
- 开放获取GydF4y2Ba
- 发表:GydF4y2Ba
葡萄风信子R2R3-MYB菌株MaMybA与MaAN2不同,能使烟草产生强烈的品红花青素色素GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba19GydF4y2Ba, 文章编号:GydF4y2Ba390.GydF4y2Ba(GydF4y2Ba2019年GydF4y2Ba)GydF4y2Ba
摘要GydF4y2Ba
背景GydF4y2Ba
花中的主要颜料是花青素,其生物合成主要由R2R3-MOBS调节。GydF4y2BaMuscari armeniacumGydF4y2Ba是一种观赏花园植物,开深蓝色的花,花青素为基础。与花青素相关的R2R3-MYB MaAN2此前已在GydF4y2Bam . armeniacumGydF4y2Ba花;在这里,我们还对一种新的R2R3-MYB MaMybA进行了表征,以确定其功能,并突出MaMybA与MaAN2之间的异同。GydF4y2Ba
结果GydF4y2Ba
本研究从花青素中分离到一个新的R2R3-MYB基因GydF4y2Bam . armeniacumGydF4y2Ba花和功能鉴定。序列比对显示MaMybA中含有典型的与MaAN2及其同源基因保守的基序。MaMybA与MaAN2的氨基酸序列同源性为43.5%。系统发育分析表明,它们均聚在R2R3-MYB家族的AN2亚群中,但不在同一分支。我们还鉴定了一个IIIf bHLH蛋白,MabHLH1GydF4y2Bam . armeniacumGydF4y2Ba花。双分子荧光互补实验表明,MabHLH1与MaMybA或MaAN2在体内相互作用;双荧光素酶检测表明MaMybA单独或与MabHLH1相互作用均可调控MabHLH1的表达GydF4y2BaMadfr.GydF4y2Ba和GydF4y2BaAtDFRGydF4y2Ba,但Maan2要求mabhlh1这样做。过度表达时GydF4y2BaMamyba.GydF4y2Ba在GydF4y2Ba尼科尼亚塔哈瓦姆GydF4y2Ba’NC89’转基因烟草叶片、花瓣、花药和花萼的花色苷呈强烈的品红色,而OE-转基因烟草的花色苷则呈强烈的品红色GydF4y2Ba马南GydF4y2Ba植物有较轻的色素沉着。但是,OE的卵巢壁和种子皮肤GydF4y2BaMamyba.GydF4y2Ba烟草几乎没有着色,而OE-GydF4y2Ba马南GydF4y2Ba烟草是红紫色的。此外,过表达GydF4y2BaMamyba.GydF4y2Ba与OE-相比,能明显改善烟草花青素色素沉着GydF4y2Ba马南GydF4y2Ba和控制植物,通过大量上调花青素的生物合成和内源性GydF4y2BaBhlh.GydF4y2Ba基因。值得注意的是GydF4y2BaNtF3的5是什么GydF4y2Ba在OE -GydF4y2BaMamyba.GydF4y2Ba烟草可能导致飞燕草苷3-芦丁苷的额外积累,这在OE-中几乎没有检测到GydF4y2Ba马南GydF4y2Ba和控制植物。我们得出结论,高浓度的花青素和新产生的DP3R导致OE的颜色较暗GydF4y2BaMamyba.GydF4y2Ba与OE相比GydF4y2Ba马南GydF4y2Ba烟草。GydF4y2Ba
结论GydF4y2Ba
新鉴定的R2R3-MYB转录因子MamyBA在花青素生物合成中的作用,但与MAAN2有一些差异;Mamyba也可用于修改观赏植物中的花色。GydF4y2Ba
背景GydF4y2Ba
令人满意的花色是观赏植物的典型特征[GydF4y2Ba1GydF4y2Ba];它主要是由花青素、类胡萝卜素和甜菜碱[GydF4y2Ba2GydF4y2Ba].花青素是花、水果和其他植物组织中的主要色素,能赋予从红色到紫色/蓝色的各种颜色。GydF4y2Ba3.GydF4y2Ba].它们还在花授粉中起作用,增强植物对生物和非生物胁迫的耐受性。此外,它们在食品工业中很重要,在那里它们用作安全和自然着色剂[GydF4y2Ba2GydF4y2Ba].花青素生物合成途径,其中花青素生物合成基因及其调节剂对生产花青素至关重要,是广泛和彻底的研究的主题[GydF4y2Ba4.GydF4y2Ba].近年来,基因工程已被证明是一种有希望的花卉颜色修改方法[GydF4y2Ba5.GydF4y2Ba];在观赏植物中,主要方法是通过遗传调节进行花青素合成的分子育种[GydF4y2Ba6.GydF4y2Ba].虽然有许多成功的例子,在各种观赏植物的花修饰工程,或通过过表达或沉默多种花青素生物合成基因,如非洲菊[GydF4y2Ba7.GydF4y2Ba],玫瑰[GydF4y2Ba4.GydF4y2Ba],康乃馨[GydF4y2Ba8.GydF4y2Ba]和菊花[GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba10GydF4y2Ba[调节蛋白还可以在控制花青素生物合成中具有相当大的潜力。GydF4y2Ba
花青素生物合成调节因子包括R2R3-MYB转录因子(TFs)、其配对的基本螺旋-环-螺旋(bHLH)蛋白和WD-repeat (WDR)蛋白;它们共同形成MYB-bHLH-WDR (MBW)复合物,其中调控花青素生物合成的R2R3-MYBs是决定植物色素沉积强度和模式的关键转录因子[GydF4y2Ba8.GydF4y2Ba].双子叶和单子叶观赏植物中均存在R2R3-MYBs。在双子叶观赏植物中,例如AmRosea1, AmRosea2和AmvenosaGydF4y2BaAntirrhinum Majus.GydF4y2Ba已被证明可以控制花不同部位花青素的积累[GydF4y2Ba11GydF4y2Ba].在GydF4y2Ba桔梗GydF4y2Ba,过度的GydF4y2BaAmRosea1GydF4y2Ba导致花青素的水平增加和转基因植物的花瓣和萼片中的改变颜色[GydF4y2Ba12GydF4y2Ba].另外,表达两者GydF4y2BaAmRosea1GydF4y2Ba和GydF4y2BaAmDelilaGydF4y2Ba(它编码与金鱼花花色苷色素沉着相关的bHLH蛋白)已经被证明可以在转基因番茄果实的果皮和果肉中诱导高浓度的基于飞燕草苷(Dp-)的花色苷[GydF4y2Ba13GydF4y2Ba].GMYB10,一种促进花青素的R2R3-MYBGydF4y2Ba非洲菊矮牵牛GydF4y2Ba,过度表达GydF4y2Ba非洲菊GydF4y2Ba栽培品种“露天素”(基于Pelargonidin的花),显然增强了花青素水平,诱导新型Cyanidin(Cy)生物合成[GydF4y2Ba7.GydF4y2Ba那GydF4y2Ba14GydF4y2Ba].在单子叶花,GydF4y2Ba百合属植物GydF4y2BaLHMYB12-LAT [GydF4y2Ba15GydF4y2Ba],GydF4y2Ba安杉西亚姆GydF4y2BaAaMYB2 [GydF4y2Ba16GydF4y2Ba], 和GydF4y2BaMuscari armeniacumGydF4y2BaMaAN2 [GydF4y2Ba17GydF4y2Ba已被证明能促进烟草植株中花青素的积累。在模型工厂GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba,PAP1和PAP2在过表达转基因时增加了花青素积累GydF4y2Ba拟南芥GydF4y2Ba、烟草和GydF4y2Ba罗莎矮牵牛GydF4y2Ba[GydF4y2Ba18GydF4y2Ba那GydF4y2Ba19GydF4y2Ba那GydF4y2Ba20.GydF4y2Ba].因此,对这些花色苷调控因子的鉴定对花色苷的分子育种具有重要意义,对花色苷在食品工业中的应用具有重要意义。GydF4y2Ba
葡萄风信子(GydF4y2Bam . armeniacumGydF4y2Ba)是一种多年生球茎单子叶植物,在中春开花,常被用作园林观赏植物。它的花是天然的深钴蓝色,含有基于dp的花青素[GydF4y2Ba21GydF4y2Ba那GydF4y2Ba22GydF4y2Ba],它为单像中的蓝色花色研究提供合适的材料[GydF4y2Ba23GydF4y2Ba].在我们之前的研究中,我们通过功能注释在转录组中只筛选到一个与花青素相关的R2R2-MYB单基因GydF4y2Bam . armeniacumGydF4y2Ba花(GydF4y2Ba23GydF4y2Ba[然后将其命名为Maan2,其鉴定它可以诱导烟草中的花青素积累,并与BHLH蛋白,ATTT8相互作用,以调节花青素晚生物合成基因的表达(LBGS;即,GydF4y2BaMadfr.GydF4y2Ba和GydF4y2BaMaANSGydF4y2Ba) [GydF4y2Ba17GydF4y2Ba]。在本研究中,我们挖掘了一个新的与花青素相关的R2R3-MYB TF,命名为MaMybA,使用了典型的花青素调节剂AtPAP1GydF4y2Bam . armeniacumGydF4y2Ba鲜花转录组(GydF4y2Ba23GydF4y2Ba],由本地BLASTP (BLAST蛋白数据库)检测。我们发现MaMybA与MaAN2不同,进一步验证了MaMybA的功能GydF4y2BaMamyba.GydF4y2Ba在烟草中异源表达的花青素生物合成中。该研究旨在确定治理着色的监管机制GydF4y2Bam . armeniacumGydF4y2Ba鲜花,鉴定有价值的花青素促进调节基因,用于在观赏植物中改变花色,并确定在花青素合成中Mamyba和Maan2之间的相似性和差异。GydF4y2Ba
结果GydF4y2Ba
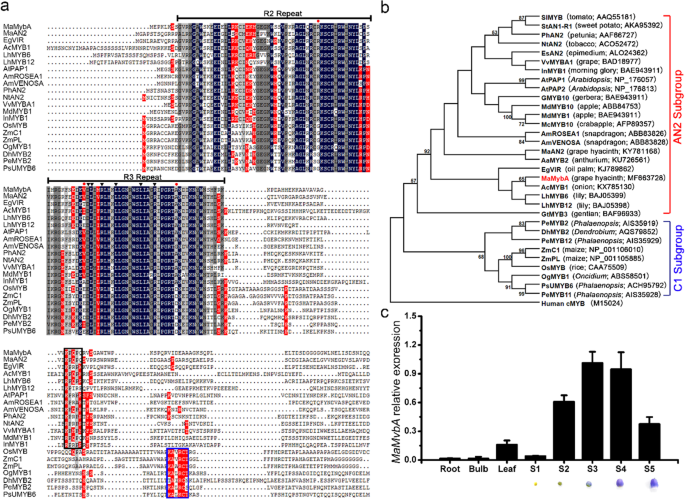
MaMybA菌株R2R3-MYB序列比对及系统发育分析GydF4y2Bam . armeniacumGydF4y2Ba
用局部BLASTP筛选一个R2R3-MYB UNIGENE,使用来自Ahthocyanin相关的R2R3-MYB TF ATPAP1GydF4y2Bam . armeniacumGydF4y2Ba花转录组(GydF4y2Ba23GydF4y2Ba].其全长cDNA序列通过RACE-PCR获得。711 BP开放阅读框架(ORF)GydF4y2BaMamyba.GydF4y2Ba编码237个氨基酸。将cDNA序列提交给NCBI Genbank(登录号MF663728)。GydF4y2Ba
序列对准表明,高度保守的MyB结构域(即,R2R3重复)存在于MamyBA,Maan2和其他与之相关的r2R3-Mybs的N-末端(图。GydF4y2Ba1GydF4y2Baa).此外,一个保守motif [D/E]LXGydF4y2Ba2GydF4y2Ba[r / k] xGydF4y2Ba3.GydF4y2BaLXGydF4y2Ba6.GydF4y2BaLXGydF4y2Ba3.GydF4y2BaR,它是MYB结构域与R样bHLH蛋白相互作用所必需的[GydF4y2Ba24GydF4y2Ba],存在于MaMybA,MaAN2和其他花青素相关R2R3-MYBS(图的R3重复。GydF4y2Ba1GydF4y2Baa).考虑整个氨基酸序列,MaMybA与MaAN2的同源性仅为43.5%,与EgVIR(控制种子颜色的R2R3-MYB)的同源性仅为47.3%GydF4y2BaElaeis Guineensis.GydF4y2Ba[GydF4y2Ba25GydF4y2Ba]和43.07%的共享身份与ACMYB1(R2R3-MYB调节灯泡的花青素积累)GydF4y2Ba洋葱GydF4y2Ba) [GydF4y2Ba26GydF4y2Ba(图。GydF4y2Ba1GydF4y2Ba一个)。此外,Mamyba和Maan2在R2R3重复中共用三个保守的氨基酸[Arg(R),Val(V)和Ala(A)],以及高度保守的基序[k / R] p [q / r] p [Q / R]在C末端的eybs中的eudicots和一些单焦点的亚组中的mybs(图。GydF4y2Ba1GydF4y2Ba一个)。GydF4y2Ba
多重比对、系统发育分析和转录表达GydF4y2BaMamyba.GydF4y2Ba.GydF4y2Ba一种GydF4y2Ba部分氨基酸的序列比对氨基酸从MaMybA,MaAN2和其它R2R3-MYBS推导。R2R3重复序列比对上方所示。三个保守在双子叶植物中花色素苷促进MYBS的R2R3重复氨基酸[精氨酸(R),缬氨酸(V),和丙氨酸(A)]被标记使用红色实心圆。该基序[d / E] LXGydF4y2Ba2GydF4y2Ba(K / R) XGydF4y2Ba3.GydF4y2BaLXGydF4y2Ba6.GydF4y2BaLXGydF4y2Ba3.GydF4y2BaR3重复R.与BHLH(基本螺旋环 - 螺旋)蛋白相互作用是必需的,并且由深度的三角形表示。C1子组中AN2子组和KAX [K / R] C [S / T]中的典型图案[k / r] p [q / r] p [q / r]由黑盒子和蓝色显示盒子分别。GydF4y2BaB.GydF4y2BaMamyba,Maan2和其他与三孔素相关的R2R3-MOBS引用的整个氨基酸序列的系统发育分析。通过使用Mega 6.0软件的最大似然方法构建系统发育树。节点旁边的数字表示从1000复制的引导值。人体CMYB(M15024)用作生根异常。从Genbank数据库中检索不同植物物种的R2R3-MYB蛋白序列,并在括号中列出了他们的GenBank登录号。GydF4y2BaCGydF4y2Ba表达谱的GydF4y2BaMamyba.GydF4y2Ba在不同的组织中GydF4y2BaMuscari armeniacumGydF4y2Ba;GydF4y2BaMaactin.GydF4y2Ba是参考基因。误差栏表示平均结果的标准偏差(SD)GydF4y2Ba
系统发育分析表明MaMybA与MaAN2、AtPAP1、LhMYB6和AcMYB1聚类为AN2亚群,与AcMYB1关联最密切(图2)。GydF4y2Ba1GydF4y2Bab)。然而,从单子宫家庭Poaceae和兰科的Mybs被分组到C1亚组中(图。GydF4y2Ba1GydF4y2Bab).此外,的相对表达GydF4y2BaMamyba.GydF4y2Ba在根、鳞茎、叶和5个不同的花发育阶段(S1~S5)显示GydF4y2BaMamyba.GydF4y2Ba在有色花中主要表达。mRNA水平GydF4y2BaMamyba.GydF4y2Ba在S1的根,灯泡和舞台上的鲜花中非常低,比叶子低得多。这GydF4y2BaMamyba.GydF4y2Ba花中转录因子逐渐增加,在S3期达到峰值,然后从S3期到S4期略有下降,在S5期呈现下降趋势(图4)。GydF4y2Ba1GydF4y2Bac)。GydF4y2Ba
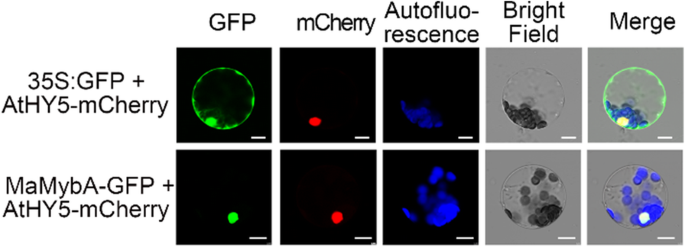
Mamyba本地化在细胞核中并具有转录激活能力GydF4y2Ba
为了检测Mamyba的亚细胞定位,质粒35s:GFP(绿色荧光蛋白)和MamyBA-GFP与Athy5-(细长的次杆子5; AT5G11260)MCHERRY分别分别是COTRANSFORMEDGydF4y2Ba拟南芥GydF4y2Ba叶肉原生质体。MaMybA的GFP荧光与AtHY5的mCherry荧光重叠,AtHY5是一种已知的核蛋白[GydF4y2Ba27GydF4y2Ba],表明Mamyba在核中局部化GydF4y2BaA. Thaliana.GydF4y2Ba原生质体(无花果。GydF4y2Ba2GydF4y2Ba).GydF4y2Ba
我们在酵母中进行了反式激活测定,以评估Mamyba的转录激活能力。如附加文件所示GydF4y2Ba1GydF4y2Ba图S1,仅转化阳性对照(pGBKT7-53 + pGADT7-T)的酵母,pGBKT7/MaMybA质粒在添加40 μg mL的SD/-Trp培养基中能够生长GydF4y2Ba- 1GydF4y2BaX-α-GAL和200ng mlGydF4y2Ba- 1GydF4y2Baaureobasidin A (AbA),呈蓝色斑块。阴性对照在SD/-Trp + 200 ng mL培养基中不能生长GydF4y2Ba- 1GydF4y2BaABA或40μgmlGydF4y2Ba- 1GydF4y2BaX-α-GAL和200ng mlGydF4y2Ba- 1GydF4y2Ba阿坝。结果表明,Mamyba具有转录激活能力。GydF4y2Ba
MabHLH1与MaMybA或MaAN2在体内相互作用GydF4y2Ba
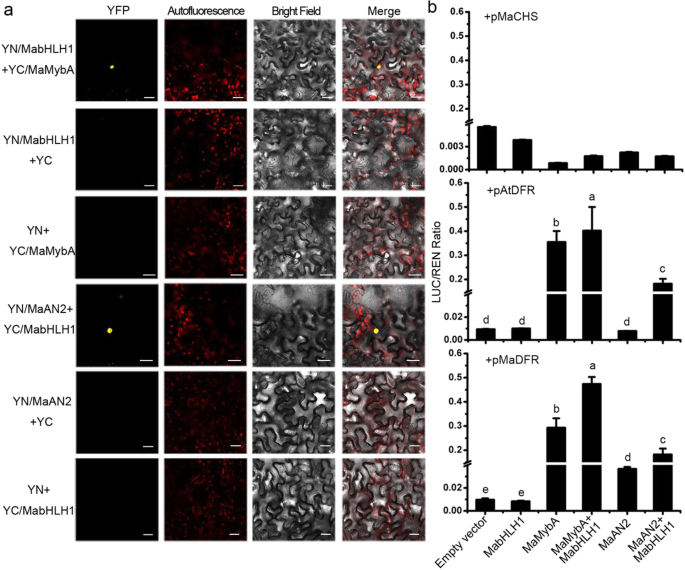
R2R3-MYBS已报告与IIIF的bHLH蛋白调节花青素合成[互动GydF4y2Ba28GydF4y2Ba那GydF4y2Ba29GydF4y2Ba那GydF4y2Ba30.GydF4y2Ba].我们从该基因的转录组中筛选到一个与花青素相关的bHLH单基因GydF4y2Bam . armeniacumGydF4y2Ba使用R-like IIIf bHLH蛋白AtTT8进行局部BLASTP。获得了全长为2001 bp的cDNAGydF4y2Bam . armeniacumGydF4y2Ba用逆转录聚合酶链反应(RT-PCR)的花朵,并命名GydF4y2Bamabhlh1.GydF4y2Ba(MF663729)。MabHLH1在n端包含一个高度保守的MYB相互作用区域,在c端包含一个bHLH DNA结合区域(附加文件)GydF4y2Ba2GydF4y2Ba:图S2a)。系统发育分析显示,MabHLH1与LhbHLH1和ZmLC一起被归入类黄酮相关bHLH蛋白IIIf亚群的LC/JAF13/DEL分支(Additional file)GydF4y2Ba2GydF4y2Ba:图S2b),在不同组织中也有组构表达GydF4y2Bam . armeniacumGydF4y2Ba(附加文件GydF4y2Ba2GydF4y2Ba:图。S2C)。亚细胞定位和转录激活能力测定结果显示MabhlH1在细胞核中定位并具有转移能力,因此意味着它是TF(附加文件GydF4y2Ba3.GydF4y2Ba:图S3)。然后通过双分子荧光互补(BiFC)试验验证MabHLH1与MaMybA或MaAN2在体内的相互作用(图)。GydF4y2Ba3.GydF4y2Baa). YC/MaMybA与YN/MabHLH1或YC/MabHLH1与YN/MaAN2共表达GydF4y2Ba烟草benthamianaGydF4y2Ba叶表皮细胞核中可见黄色荧光蛋白(YFP)荧光(图。GydF4y2Ba3.GydF4y2Baa).因此,MabHLH1被证明是一个与花青素相关的R2R3-MYBs相互作用的蛋白GydF4y2Bam . armeniacumGydF4y2Ba,它能够在体内与Mamyba或Maan2互动。GydF4y2Ba
双分子荧光互补(BIFC)测定和双荧光素酶测定。GydF4y2Ba一种GydF4y2Ba进行BIFC测定以确认MabhlH1和Mamyba或Maan2之间的相互作用GydF4y2Ba烟草benthamianaGydF4y2Ba叶子。酒吧:25μm。GydF4y2BaB.GydF4y2Ba双荧光素酶检测MabHLH1是否含有MaMybA或MaAN2:对转录调控的影响GydF4y2Ba马赫GydF4y2Ba那GydF4y2BaMadfr.GydF4y2Ba, 和GydF4y2BaAtDFRGydF4y2Ba分别启动子GydF4y2Ban benthamianaGydF4y2Ba叶子。结果表明,启动子活性表示为GydF4y2Ba马赫GydF4y2Ba那GydF4y2BaMadfr.GydF4y2Ba, 和GydF4y2BaAtDFRGydF4y2Ba启动子,LUC到35S: REN。误差栏表示平均结果的标准偏差(SD)GydF4y2Ba
MaMybA激活了花青素生物合成基因启动子GydF4y2Ba
为了研究Mamyba或mabhlH1是否能够控制花青素生物合成基因的表达,对双荧光素酶测定进行GydF4y2Ban benthamianaGydF4y2Ba叶子(图。GydF4y2Ba3.GydF4y2Bab).花青素早期生物合成基因(EBG)的启动子GydF4y2Ba马赫GydF4y2Ba(GydF4y2Bam . armeniacumGydF4y2Ba;KY781171)和关键的LBG,GydF4y2BaAtDFRGydF4y2Ba(GydF4y2BaA. Thaliana.GydF4y2Ba;AT5G42800)和GydF4y2BaMadfr.GydF4y2Ba(GydF4y2Bam . armeniacumGydF4y2Ba;KY781169),与LUC(萤火虫荧光素酶)融合。GydF4y2BaMamyba.GydF4y2Ba那GydF4y2Ba马南GydF4y2Ba, 和GydF4y2Bamabhlh1.GydF4y2Ba由35S启动子驱动。每个或两个tf与每个启动子共同渗透。结果表明,单个或两种转录因子均不能提高启动子的活性GydF4y2Ba马赫GydF4y2Ba.然而,单独的Mamyba可以激活GydF4y2BaMadfr.GydF4y2Ba和GydF4y2BaAtDFRGydF4y2Ba而MaAN2和MabHLH1均不能激活两者。MaMybA与MabHLH1共表达时,MabHLH1的启动子活性GydF4y2BaMadfr.GydF4y2Ba和GydF4y2BaAtDFRGydF4y2Ba被显著促进,由1.6和1.1倍当与单独MaMybA渗透,分别(图高于。GydF4y2Ba3.GydF4y2Bab). MaAN2与MabHLH1共渗时,启动子活性GydF4y2BaMadfr.GydF4y2Ba和GydF4y2BaAtDFRGydF4y2Ba与单独浸润MaAN2相比,分别提高了4.0倍和22.2倍。GydF4y2Ba3.GydF4y2Bab).因此,结果表明MaMybA单独或与MabHLH1相互作用均可控制MabHLH1的转录GydF4y2BaMadfr.GydF4y2Ba但是,Maan2要求与Mabhlh1直接互动。GydF4y2Ba
异源表达GydF4y2BaMamyba.GydF4y2Ba在烟草中强烈促进花青素的积累GydF4y2Ba
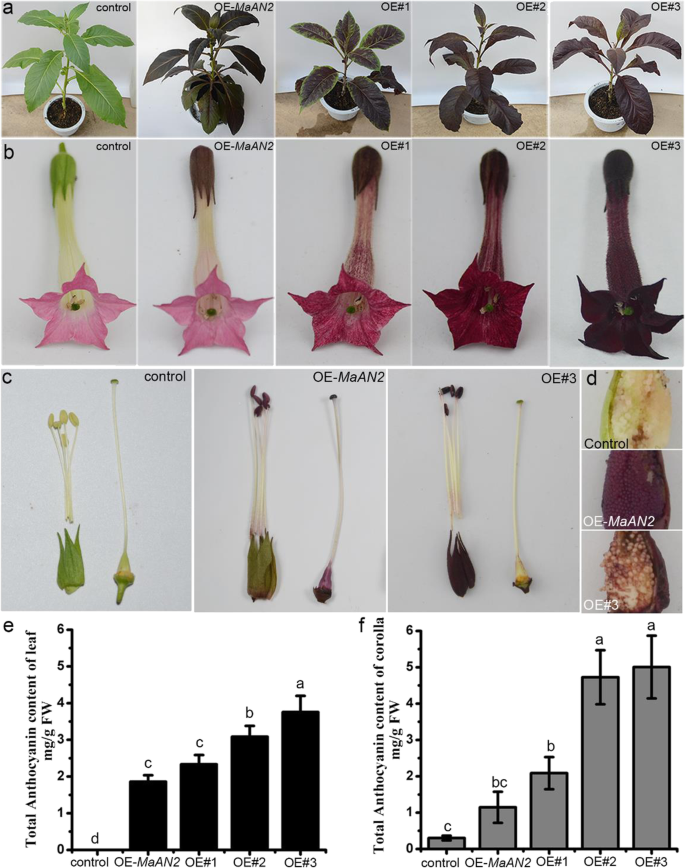
为了表征函数GydF4y2BaMamyba.GydF4y2Ba那GydF4y2BaMamyba.GydF4y2Ba由35S启动子驱动的转化为烟草(GydF4y2Ban .烟草GydF4y2Ba' NC89 ')叶盘由一个GydF4y2Ba农杆菌属GydF4y2Ba介导的转换。三个TGydF4y2Ba1GydF4y2Ba过度表达GydF4y2BaMamyba.GydF4y2Ba(OE -GydF4y2BaMamyba.GydF4y2Ba)转基因品系,命名为OE#1,OE#2,和OE#3,产生了(图GydF4y2Ba4.GydF4y2Ba此外,TGydF4y2Ba1GydF4y2Ba过度表达GydF4y2Ba马南GydF4y2Ba(3个OE-中色素沉着线(即线2)最多)GydF4y2Ba马南GydF4y2Ba转基因植物关于Chen等人。[GydF4y2Ba17GydF4y2Ba)作为阳性对照(OE-GydF4y2Ba马南GydF4y2Ba),并且将空载体转基因植物用作阴性对照(对照)。结果表明,Mamyba强烈增加了花青素生产,并在烟草中赋予强烈的红紫色,特别是在叶子,花萼,花瓣和花药中(图。GydF4y2Ba4.GydF4y2Baa-c),而子房壁和种皮几乎没有花青素色素沉着(图。GydF4y2Ba4.GydF4y2BaC,D)。但是,OE-GydF4y2Ba马南GydF4y2Ba烟草呈现在叶,花萼轻得多的洋红色,和花药比没有OE-GydF4y2BaMamyba.GydF4y2Ba烟草;然而,卵巢壁和种子皮肤都是用红色颜色的色素沉着,并且花冠深粉红色(图。GydF4y2Ba4.GydF4y2Ba模拟)。GydF4y2Ba
表型观察和对照的叶片和花冠的总花青素含量,OE(过表达) -GydF4y2Ba马南GydF4y2Ba,和三个OE-GydF4y2BaMamyba.GydF4y2Ba线(OE#1,OE#2和OE#3)Tobaccos。总植物的表型(GydF4y2Ba一种GydF4y2Ba),花的表型(GydF4y2BaB.GydF4y2Ba),花萼,花药,长丝和花卵巢(GydF4y2BaCGydF4y2Ba)和种子(GydF4y2BaD.GydF4y2Ba).定量测定叶片的花青素含量(GydF4y2BaE.GydF4y2Ba)和花冠(GydF4y2BaFGydF4y2Ba)在控制,OEGydF4y2Ba-maan2.GydF4y2Ba,和三个OE-GydF4y2BaMamyba.GydF4y2Ba烟草。采用高效液相色谱法对叶片和花冠中的花青素进行分析,并在530 nm处进行监测。以花青素3-芦丁苷含量的标准曲线为对照,计算了烟草中花青素的含量。误差棒表示平均花青素含量的标准差GydF4y2Ba
花的颜色与花器官内部或表面的组织形态以及花细胞中花青素色素的类型和含量有关;然而,色素是关键的决定因素[GydF4y2Ba1GydF4y2Ba].我们首先使用高效液相色谱法(HPLC)确定携带烟草中花青素的含量和类型。花青素浓度在叶子和三个OE的花冠GydF4y2BaMamyba.GydF4y2Ba烟草明显高于OE-GydF4y2Ba马南GydF4y2Ba并控制脚趾(图。GydF4y2Ba4.GydF4y2Bae, f)GydF4y2BaMamyba.GydF4y2Ba叶子比OE高为1.25至2倍 -GydF4y2Ba马南GydF4y2Ba叶子。三行的花青素水平 -GydF4y2BaMamyba.GydF4y2Ba花冠比OE高1.8至4.3倍 -GydF4y2Ba马南GydF4y2Ba花冠,比对照花冠的高6.9-至16.7倍(图。GydF4y2Ba4.GydF4y2Bae,f)。在对照烟草叶中几乎不可检测到花青素(图。GydF4y2Ba4.GydF4y2Bae,无花果。GydF4y2Ba5.GydF4y2Ba一个,附加文件GydF4y2Ba4.GydF4y2Ba:图S4)。其次,我们在3个OE-的叶片和花冠中检测到2个主要花青素(峰1和峰2)GydF4y2BaMamyba.GydF4y2Ba行(OE#3作为图中的代表。GydF4y2Ba5.GydF4y2Ba一个;额外的文件GydF4y2Ba4.GydF4y2Ba:图S4),而在对照和三个OE-的花冠中主要检测到一个单一的花青素(峰2)GydF4y2Ba马南GydF4y2BaChen等人提到的[GydF4y2Ba17GydF4y2Ba)(图中第2行为代表。GydF4y2Ba5.GydF4y2Ba一个,附加文件GydF4y2Ba4.GydF4y2Ba:图S4)。GydF4y2Ba
对照的叶片和花冠的花青素组成分析,OE-GydF4y2Ba马南GydF4y2Ba和OE -GydF4y2BaMamyba.GydF4y2Ba烟草。花青素提取物的高效液相色谱分析(GydF4y2Ba一种GydF4y2Ba),和其相应的水解产物(GydF4y2BaB.GydF4y2Ba)在控制的叶子和花冠中,OE-GydF4y2Ba马南GydF4y2Ba和OE -GydF4y2BaMamyba.GydF4y2Ba烟草。根据序列中的色谱峰,图中分别为飞翠素3-芦丁苷、花青素3-芦丁苷、天竺葵苷3-芦丁苷(从左到右)GydF4y2Ba一种GydF4y2Ba;从左到右依次为飞燕草苷、花青素、牵牛花苷、天竺葵苷和锦葵苷GydF4y2BaB.GydF4y2Ba.Delphinidin 3-Rutinoside的质谱和结构模式(GydF4y2BaCGydF4y2Ba)GydF4y2Ba
以前的研究表明,烟草中的原发性花青素是Cyanidin 3- rutinoside(Cy3R)[GydF4y2Ba31.GydF4y2Ba];Delphinidin 3- rutinoside(DP3R)和Cy3R标准物的保留时间非常接近峰1和2(图。GydF4y2Ba5.GydF4y2Ba),分别;和Dp (a峰)和Cy (b峰)的水解检测(图。GydF4y2Ba5.GydF4y2Bab)。因此,我们做了一个初步推测峰1和2分别表示Dp3R和Cy3R。此外,两个花青素是超高效液相色谱(UPLC) - 时间飞行(TOF)-Tandem质谱(MS / MS)分析证实。详细地,峰1在611.1601的质量 - 电荷比(M / Z)[M]表明典型的分子离子GydF4y2Ba+GydF4y2Ba(CGydF4y2Ba27GydF4y2BaHGydF4y2Ba31.GydF4y2BaO.GydF4y2Ba16GydF4y2Ba),其与DP3R的分子量一致。另外,两个产物离子,一个在M / z 465.1018和m / z 303中的产物离子表明,从一个分子的DP分子释放一个葡萄糖和鼠李酮中的一种分子(图。GydF4y2Ba5.GydF4y2Bac)。另外,代谢物也用于搜索Scifinder和Reaxys数据库。因此,峰值1和2被识别为代表DP3R和Cy3R(附加文件GydF4y2Ba5.GydF4y2Ba:图S5)。GydF4y2Ba
此外,显微镜观察表明,在对照烟草的这些细胞类型中没有发现花青素(附加文件)GydF4y2Ba6.GydF4y2Ba:图S6a-d)。花青素主要积聚在栅栏薄壁组织、背面表皮细胞和毛状体中GydF4y2Ba马南GydF4y2Ba和OE -GydF4y2BaMamyba.GydF4y2Ba烟叶(另附档案GydF4y2Ba6.GydF4y2Ba:图S6E-1)。花青素也散落在Adaxial表皮细胞,海绵状实质和皮下粥幼儿细胞中(附加档案GydF4y2Ba6.GydF4y2Ba(图S6 g, h, k, l)GydF4y2Ba马南GydF4y2Ba和OE -GydF4y2BaMamyba.GydF4y2Ba植物,根据扫描电子显微镜(附加文件GydF4y2Ba7.GydF4y2Ba:图S7)。GydF4y2Ba
过度表达GydF4y2BaMamyba.GydF4y2Ba在烟草中上调花青素途径基因的表达水平GydF4y2Ba
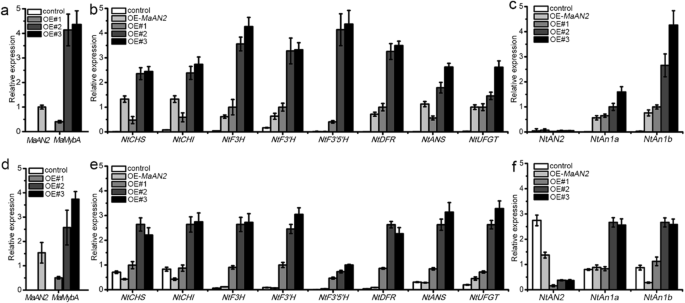
我们首先进行定量实时聚合酶链反应(QRT-PCR)测定以测试GydF4y2BaMamyba.GydF4y2Ba转基因烟草中的转录物,发现GydF4y2BaMamyba.GydF4y2Ba在三种转基因系(OE#1,OE#2和OE#3)的叶子和花冠中表达,但不在阴性对照植物中(即,控制,图。GydF4y2Ba6.GydF4y2Baa, d).此外,GydF4y2Ba马南GydF4y2Ba也表达在阳性对照烟草(即,OE-GydF4y2Ba马南GydF4y2Ba,无花果。GydF4y2Ba6.GydF4y2Baa, d)。接下来,我们对对照OE-的叶片和花冠中的花青素生物合成和TF基因进行了qRT-PCR检测GydF4y2Ba马南GydF4y2Ba和OE -GydF4y2BaMamyba.GydF4y2Ba烟草。结果表明,所有的花青素结构基因,包括GydF4y2Ba如果说GydF4y2Ba那GydF4y2BaNtCHIGydF4y2Ba那GydF4y2Bantf3h.GydF4y2Ba那GydF4y2Ba5是什么,NtDFR NtF3'H, NtF3”GydF4y2Ba那GydF4y2BaNTANS.GydF4y2Ba, 和GydF4y2BaNtUFGTGydF4y2Ba,在叶片和转基因植物的花冠被上调,特别是在OE#2和OE#3(图GydF4y2Ba6.GydF4y2Bab, e).两个内源性bHLH TF基因GydF4y2BaNtAn1aGydF4y2Ba和GydF4y2BaNtAn1bGydF4y2Ba,它调节烟草中类黄酮的合成[GydF4y2Ba32.GydF4y2Ba],也在OE的叶子和花冠上上调 -GydF4y2BaMamyba.GydF4y2Ba植物(图。GydF4y2Ba6.GydF4y2Bac, f).然而,抄本GydF4y2BaNTAN2.GydF4y2Ba在烟草的所有基因型的叶子几乎检测不到,而那些在OE-的花冠GydF4y2Ba马南GydF4y2Ba和OE -GydF4y2BaMamyba.GydF4y2Ba结果表明,与对照相比,对照植株的生长速率较低。GydF4y2Ba6.GydF4y2BaC,F)。GydF4y2Ba
花青素生物合成基因和内源转录因子(TF)基因在对照OE-叶片和花冠中的相对表达GydF4y2Ba马南GydF4y2Ba,和三个独立的OEGydF4y2BaMamyba.GydF4y2Ba转基因植物(OE#1,OE#2和OE#3)。表达概况GydF4y2BaMamyba.GydF4y2Ba在叶子里(GydF4y2Ba一种GydF4y2Ba)和花冠(GydF4y2BaD.GydF4y2Ba)控制,OE#1,OE#2和OE#3;表达剖面GydF4y2Ba马南GydF4y2Ba在叶子里(GydF4y2Ba一种GydF4y2Ba)和花冠(GydF4y2BaD.GydF4y2Ba) OE-GydF4y2Ba马南GydF4y2Ba烟草;花青素生物合成基因的表达水平(GydF4y2Ba如果说GydF4y2Ba那GydF4y2BaNtCHIGydF4y2Ba那GydF4y2Bantf3h.GydF4y2Ba那GydF4y2Bantf3'h.GydF4y2Ba那GydF4y2BaNtF3的5是什么GydF4y2Ba那GydF4y2BaNtDFRGydF4y2Ba那GydF4y2BaNTANS.GydF4y2Ba, 和GydF4y2BaNtUFGTGydF4y2Ba)在叶子里(GydF4y2BaB.GydF4y2Ba)和花冠(GydF4y2BaE.GydF4y2Ba)不同的烟草基因型;以及三个内源性TF基因的相对表达(GydF4y2BaNTAN2.GydF4y2Ba那GydF4y2BaNtAn1aGydF4y2Ba和GydF4y2BaNtAn1bGydF4y2Ba)在叶子里(GydF4y2BaCGydF4y2Ba)和花冠(GydF4y2BaFGydF4y2Ba)不同的烟草基因型。GydF4y2Banttuba1.GydF4y2Ba作为内部控制。误差栏表示平均结果的标准偏差(SD)GydF4y2Ba
讨论GydF4y2Ba
花青素是花的主要色素。花青素生物合成由R2R3-MYB TFs或MBW复合物调控[GydF4y2Ba33.GydF4y2Ba].在各种观赏植物中发现了涉及花色的R2R3-MYB TFS,包括GydF4y2Ba非洲菊矮牵牛GydF4y2Ba那GydF4y2Ba百合属植物GydF4y2Ba, 和GydF4y2Ba花烛属植物GydF4y2Ba[GydF4y2Ba14GydF4y2Ba那GydF4y2Ba15GydF4y2Ba那GydF4y2Ba16GydF4y2Ba].在葡萄葫芦术中,先前的研究表明,烟草中的花青素相关的R2R3-myb,诱导烟草中的Cyanidin生物合成的明显增量,并依赖于ATTT8或MabhlH1以激活LBG表达[GydF4y2Ba17GydF4y2Ba(图。GydF4y2Ba3.GydF4y2Bab).在本研究中,我们分离到一种新的R2R3-MYB, MaMybA,它不同于MaAN2。异源表达GydF4y2BaMamyba.GydF4y2Ba使烟草中的花青素发生强烈的深色色素沉着,并产生一种新的花青素Dp3R。本研究明确了MaMybA和MaAN2在花青素生物合成中的功能差异,进一步揭示了MaMybA和MaAN2在花青素生物合成中的调控机制GydF4y2Bam . armeniacumGydF4y2Ba花。GydF4y2Ba
MaMybA是R2R3-MYB家族AN2子群中的一个R2R3-MYB TFGydF4y2Ba
促花青素R2R3-MYB转录因子具有特定的结构和典型的基元。在GydF4y2Bam . armeniacumGydF4y2Ba,我们表征了类似于MAAN2的R2R3-MYB MAMYBA,其在N末端区域的高度保守的R2R3结构域中含有三个保守的氨基酸(ARG,VAL和ALA)和典型的基序[K / R] P [Q./ r]在C末端区域中p [q / r]。这些保守的氨基酸和典型的基序也据报道,如在Dicots的AN2亚组的AN2亚组的促进R2R3-MYBS中存在[GydF4y2Ba7.GydF4y2Ba那GydF4y2Ba11GydF4y2Ba那GydF4y2Ba20.GydF4y2Ba还有一些单像[GydF4y2Ba15GydF4y2Ba那GydF4y2Ba16GydF4y2Ba那GydF4y2Ba17GydF4y2Ba那GydF4y2Ba34.GydF4y2Ba(图。GydF4y2Ba1GydF4y2Ba值得注意的是,单子叶植物MaMybA和MaAN2在禾草科和兰科植物科R2R3-MYBs的C1亚群中未发现基序KAX[K/R]C[S/T](图2)。GydF4y2Ba1GydF4y2Baa,b)。另外,图案[d / e] lxGydF4y2Ba2GydF4y2Ba[r / k] xGydF4y2Ba3.GydF4y2BaLXGydF4y2Ba6.GydF4y2BaLXGydF4y2Ba3.GydF4y2Ba在MaMybA和MaAN2的R3重复序列中的R。GydF4y2Ba1AGydF4y2Ba)表示Mamyba和Maan2可以与BHLH TFS互动。Mamyba被鉴定为TF,因为它局部化在细胞核中,并且具有转录激活能力(图。GydF4y2Ba2GydF4y2Ba额外的文件GydF4y2Ba1GydF4y2Ba:图S1)。GydF4y2Ba
据我们所知,所有花青素相关的DiCot r2R3-MYB TFS已被分组为R2R3-MYB系列的AN2子组。在单焦点中,只有那些痘痘和兰科的MYBS被聚集到C1子组中[GydF4y2Ba30.GydF4y2Ba那GydF4y2Ba35.GydF4y2Ba那GydF4y2Ba36.GydF4y2Ba];其他单子叶myb被置于AN2亚群中[GydF4y2Ba16GydF4y2Ba那GydF4y2Ba17GydF4y2Ba那GydF4y2Ba25GydF4y2Ba那GydF4y2Ba26GydF4y2Ba那GydF4y2Ba34.GydF4y2Ba].因此,为了确定双子叶和单子叶间的聚类规律,需要挖掘更多与花青素相关的r2r3 - myb。GydF4y2Ba
系统发育分析表明MaMybA的进化关系比MaAN2更接近AcMYB1。MaMybA和MaAN2在整个氨基酸序列上的同源性仅为43.5%。的相对表达GydF4y2BaMamyba.GydF4y2Ba在不同的组织中表明,它主要在色素花中表达(图。GydF4y2Ba1GydF4y2Bac).它的表达与的协调,虽然稍早于的GydF4y2Ba马南GydF4y2Ba,以及花发育过程中色素的积累[GydF4y2Ba17GydF4y2Ba].GydF4y2Ba
大家族R2R3-MYB的是MYB蛋白的主要家族。R2R3-MYBS都具有在N-末端,其决定调控特异性,并提供了MYB核定位信号的高度保守的结构域R2R3,而C-末端区域通常具有反式激活或DNA-抑制基序[GydF4y2Ba37.GydF4y2Ba那GydF4y2Ba38.GydF4y2Ba].在GydF4y2Ba拟南芥GydF4y2Ba,根据c端重复出现的氨基酸基序,r2r3 - myb被分为22个亚群[GydF4y2Ba39.GydF4y2Ba].具体来说,AN2亚群(即亚群6)的R2R3-MYBs,由c端区域的保守基序([K/R]P[Q/R]P[Q/R])组成,在诱导花青素生物合成中起作用[GydF4y2Ba34.GydF4y2Ba];亚组4的R2R3-MYBS在C-Termini功能中含有保守的耳动图案(LXLXL),在还原花青素生物合成中的作用中[GydF4y2Ba40GydF4y2Ba].之前的研究也表明,r2r3 - myb中含有高度保守的基序和外显子长度,具有相似的功能GydF4y2Ba拟南芥GydF4y2Ba和GydF4y2Bavitis.GydF4y2Ba,虽然所有R2R3-MYB蛋白的c端序列同源性较低。因此,尽管发生了变异,高度保守的区域仍然可以保持特定的功能,而c端区域的变异可以促进新的或合作功能的获得[GydF4y2Ba37.GydF4y2Ba].GydF4y2Ba
在Planta中,存在许多实例,其中两个或更多个R2R3-MYB基因在花青素生物合成中的功能,在单一植物物种(例如ATPAP1和ATPAP2)中发现GydF4y2Ba拟南芥GydF4y2Ba[GydF4y2Ba20.GydF4y2Ba].然而,在同一植物中发现的一些R2R3-MYB花青素调控因子通过在不同组织或器官中的花青素色素沉着发挥作用而表现出多样性;例如,GydF4y2Ba矮牵牛GydF4y2BaAN2主要负责花枝色素沉着,AN4主要调节花药花色苷的积累[GydF4y2Ba41.GydF4y2Ba];在GydF4y2BaSolanum lycopersicum.GydF4y2Ba中,两个不同的R2R3 MYB,SlANT1和SlAN2,都可以诱导花青素合成,但仅在合成花青素后者功能在高光或低温条件[营养组织GydF4y2Ba42.GydF4y2Ba].在葡萄胺中,四种有关的三孔素相关的R2R3 MyBS具有不同的C-Termini的氨基酸长度。特别是,VVMYBA2具有两个C末端重复,而VVMYBA1具有一个,VVMYBA3缺少该基序。此外,MYBA1和MYBA2功能果实着色,但MYBA3损失了累积花青素的功能。这些差异可能导致新颖或合作职能[GydF4y2Ba43.GydF4y2Ba].在本研究中,MaMybA和MaAN2的c端都只包含一个保守基序(KPQPQ)。MaMybA和MaAN2的c端结构域均未过早终止(MaMybA和MaAN2的氨基酸长度分别为237和240),两种myb均可在烟草花青素生物合成中完成完整的功能。因此,MaAN2可能是MaMybA在进化过程中通过基因复制的类似物,其c端变异表明其在葡萄风信子中可能具有冗余、重叠或合作功能。因此,基于此,MaMybA和MaAN2之间可变c端功能的实验证据是我们未来工作的方向。GydF4y2Ba
MaMybA单独或与MabHLH1互作均能激活花青素生物合成基因启动子GydF4y2Ba
花青素的生物合成是由MYB-bHLH复合物调控的,在几乎所有的植物物种[GydF4y2Ba33.GydF4y2Ba].在本研究中,得到的mabhlH1在C末端区域的N-末端和BHLH DNA结合结构域上含有MyB相互作用区域,以及参与黄酮类生物合成的其他IIIf BHLH蛋白[GydF4y2Ba28GydF4y2Ba那GydF4y2Ba30.GydF4y2Ba那GydF4y2Ba44.GydF4y2Ba](附加文件GydF4y2Ba2GydF4y2Ba:图S2a)。系统发育分析表明,MabHLH1被归入IIIf bHLH TF家族的LC/JAF13/DEL分支[GydF4y2Ba26GydF4y2Ba那GydF4y2Ba45.GydF4y2Ba](附加文件GydF4y2Ba2GydF4y2Ba:图S2B)。这些发现表明Mabhlh1可能在花青素生物合成中发挥作用GydF4y2Bam . armeniacumGydF4y2Ba.然而,GydF4y2Bamabhlh1.GydF4y2Ba在不同的组织中组成型表达,并不伴随着花卉发育的色素沉着(附加档案GydF4y2Ba2GydF4y2Ba:图S2c中),其也已在苹果[发现GydF4y2Ba46.GydF4y2Ba)、葡萄(GydF4y2Ba47.GydF4y2Ba], 和GydF4y2Ba蝴蝶兰属GydF4y2Ba[GydF4y2Ba36.GydF4y2Ba].GydF4y2Ba
mabhlh1在体内与mamyba或maan2相互作用;这是通过BIFC测定证实的(图。GydF4y2Ba3.GydF4y2Baa).在双荧光素酶检测中,我们发现启动子活性GydF4y2Ba马赫GydF4y2Ba(EBG)在本实验中没有被所有的TFs(每一个或两个MYB-bHLH复合物)诱导,这与结果一致GydF4y2BaMRCH.GydF4y2Ba启动子对MRMYB1或MRBHLH1或MRMYB1-MRBHLH1的启动子没有响应GydF4y2BaMyrica Rubra.GydF4y2Ba[GydF4y2Ba48.GydF4y2Ba].单独的Mamyba能够规范表达GydF4y2BaMadfr.GydF4y2Ba(LBG),而相比之下,MaAN2,这依赖于MabHLH1到控制GydF4y2BaMadfr.GydF4y2Ba表达(图。GydF4y2Ba3.GydF4y2Bab)。在玉米中,单独的ZMP可以激活类黄酮生物合成基因,但ZMC1需要与BHLH蛋白R / B的直接相互作用进行[GydF4y2Ba49.GydF4y2Ba];在GydF4y2Ba蝴蝶兰属GydF4y2Ba,Pemyb11依赖于PEBHLH1,而PemyB2和Pemyb12则独立于PEBHLH1在调节方面GydF4y2BaPedfr.GydF4y2Ba表达 [GydF4y2Ba36.GydF4y2Ba].ZMP,PemyB2和PemyB12的调节模式与Mamyba的调节模式一致。但是,在GydF4y2Ba拟南芥GydF4y2Ba, AtPAP1与AtTT8或AtGL3相互作用调控GydF4y2BaAtDFRGydF4y2Ba表达 [GydF4y2Ba50.GydF4y2Ba那GydF4y2Ba51.GydF4y2Ba].Phan2还需要BHLH Cofactor phan1或phjaf13来增强启动子活动GydF4y2Ba佩妮PhDFRGydF4y2Ba[GydF4y2Ba44.GydF4y2Ba];MdMYB10-MdbHLH3和MdMYB10-MdbHLH33复合物均可激活的表达GydF4y2BaMdDFRGydF4y2Ba在苹果GydF4y2Ba28GydF4y2Ba].这些调节模式与MAAN2高度一致。GydF4y2Ba
OE之间的表型差异GydF4y2BaMamyba.GydF4y2Ba和OE -GydF4y2Ba马南GydF4y2Ba烟草可以归因于高浓度的花青素和新产生的DP3R在OE-GydF4y2BaMamyba.GydF4y2Ba烟草GydF4y2Ba
模型植物中基因的异位表达迅速促进其功能鉴定,可见的花青素色素沉着可以直接证明其在花青素生物合成中的功能[GydF4y2Ba52.GydF4y2Ba].许多研究表明,过表达的花青素相关的R2R3-MYB基因可以通过基因促进烟草中的花青素产生GydF4y2BaAtPAP1GydF4y2Ba[GydF4y2Ba18GydF4y2Ba那GydF4y2Ba20.GydF4y2Ba], 和GydF4y2BaAamyb2.GydF4y2Ba[GydF4y2Ba16GydF4y2Ba].在本研究中,过度表达GydF4y2BaMamyba.GydF4y2Ba在烟草中诱导叶,花瓣,花药和花萼中的高水平花青素生产,所有含有桑树色素沉着料(图。GydF4y2Ba4.GydF4y2Ba子房壁和种皮几乎没有色素(图a-c)。GydF4y2Ba4.GydF4y2BaC,D)。但是,OE-GydF4y2Ba马南GydF4y2Ba叶、花萼、花药呈品红色,花冠呈深粉色,颜色较OE-淡GydF4y2BaMamyba.GydF4y2Ba烟草(图。GydF4y2Ba4.GydF4y2Baa - c);OE-的子房壁和种皮GydF4y2Ba马南GydF4y2Ba烟草表现出一种红颜色,与OE的不同之处不同GydF4y2BaMamyba.GydF4y2Ba(无花果。GydF4y2Ba4.GydF4y2BaC,D)。OE-的显微观察GydF4y2BaMamyba.GydF4y2Ba烟草叶片表明,花青素主要存在于栅栏薄壁组织、毛状体和下表皮,部分色素分布于上表皮和海绵状叶肉;色素沉着较OE-明显加深GydF4y2Ba马南GydF4y2Ba转基因植物(附加文件GydF4y2Ba6.GydF4y2Ba:图S6)。在OE -GydF4y2BaAtPAP1GydF4y2Ba烟草,色素沉着细胞在毛状体和下表皮[进行了初步发现GydF4y2Ba18GydF4y2Ba].因此,不同的R 2R 3-MYBS对不同组织或细胞的分粒素积累影响到各种范围,并且花青素的分布可能影响植物颜色。GydF4y2Ba
已有研究表明,烟草花冠中的初级花青素为Cy3R [GydF4y2Ba31.GydF4y2Ba].在本研究中,新产生的花青素,Dp3R,在OE-的叶子和花冠发现GydF4y2BaMamyba.GydF4y2Ba在烟草中,除Cy3R外,初级花青素(图。GydF4y2Ba5.GydF4y2Ba一种);这与OE不同GydF4y2Ba马南GydF4y2Ba其中,叶片和花冠中的初级花青素为Cy3R(图。GydF4y2Ba5.GydF4y2Baa).另外,在三个OE-中,叶片和花冠的花青素水平GydF4y2BaMamyba.GydF4y2Ba转基因株系均大于2.0 mg gGydF4y2Ba- 1GydF4y2Ba鲜重(FW),而OE-GydF4y2Ba马南GydF4y2Ba植物均均低2.0mg / l fw(图。GydF4y2Ba4e,fGydF4y2Ba).先前的研究表明,两种花青素调节基因(GydF4y2Ba拟南芥GydF4y2BaR2R3 MYB基因GydF4y2BaMPAP1GydF4y2Ba和GydF4y2BaZea Mays.GydF4y2BaBHLH型基因GydF4y2BaB-PERU.GydF4y2Ba)过表达GydF4y2Ban .烟草GydF4y2BaL.,提高花青素含量,并在转基因烟草花枝中产生一种新型色素Dp3R,呈暗红色[GydF4y2Ba53.GydF4y2Ba].本研究采用水解液法从OE-的叶片和花冠中提取花青素GydF4y2BaMamyba.GydF4y2Ba结果表明,Cy是主要的花青素,其次是Dp。GydF4y2Ba5.GydF4y2Bab);这与OE-的花青素水解结果相似GydF4y2BaAtPAP1GydF4y2Ba烟草(GydF4y2Ba18GydF4y2Ba]GydF4y2Ba.GydF4y2Ba先前的研究表明,葡萄风信子的红紫色花朵(GydF4y2BaM.吊兰GydF4y2Ba'plumosum')含有两种主要的花青素(DP和Cy),有助于其颜色[GydF4y2Ba22GydF4y2Ba].因此,我们认为红色的cy基衍生物与蓝色的dp基衍生物以及较高的花青素浓度是导致OE-呈深紫红色的原因GydF4y2BaMamyba.GydF4y2Ba烟草。此外,在模式植物中过表达不同的R2R3-MYB基因时,所产生的植物表型在花青素定位、类型和含量上都不同,这可能是因为不同的R2R3-MYB转录因子调控不同的靶基因,在不同的组织中诱导出不同的花青素。GydF4y2Ba
MBW复合物的R2R3-MYB蛋白在花青素积累中起核心作用,MBW复合物可能诱导整个花青素生物合成途径[GydF4y2Ba8.GydF4y2Ba].在本研究中,几乎所有花青素生物合成基因(GydF4y2Ba如果说GydF4y2Ba那GydF4y2BaNtCHIGydF4y2Ba那GydF4y2Bantf3h.GydF4y2Ba那GydF4y2Bantf3'h.GydF4y2Ba那GydF4y2Banntdfr.GydF4y2Ba那GydF4y2BaNTANS.GydF4y2Ba, 和GydF4y2BaNtUFGTGydF4y2Ba)和内源性的BHLH TF基因(GydF4y2BaNtAn1aGydF4y2Ba和GydF4y2BaNtAn1bGydF4y2Ba)在3种OE-的叶片和花冠中表达上调GydF4y2BaMamyba.GydF4y2Ba转基因线(特别是在OE#2和OE#3中;图。GydF4y2Ba6.GydF4y2Ba);这是与结果OE-的叶子一致GydF4y2BaAamyb2.GydF4y2Ba和OE -GydF4y2Ba马南GydF4y2Ba烟草(GydF4y2Ba16GydF4y2Ba那GydF4y2Ba17GydF4y2Ba(图。GydF4y2Ba6.GydF4y2Bab, c).然而,抄本GydF4y2BaNTAN2.GydF4y2Ba在所有检测到的烟草的叶子中未检测到(图。GydF4y2Ba6.GydF4y2Bac),因为NtAN2是花组织特异性花青素相关的R2R3-MYBGydF4y2Ban .烟草GydF4y2Ba[GydF4y2Ba54.GydF4y2Ba].的表达水平GydF4y2BaNTAN2.GydF4y2Ba在转基因植物的甘蓝中低于对照(图。GydF4y2Ba6.GydF4y2BaF);这是类似的过表达的结果GydF4y2BaB-peruGydF4y2Ba和GydF4y2BaMPAP1GydF4y2Ba在烟草中,表明过量的花青素色素沉着可以通过反馈调节抑制内源基因的表达[GydF4y2Ba53.GydF4y2Ba].值得注意的是,GydF4y2BaNtF3的5是什么GydF4y2BaOE的叶片和花冠的转录物GydF4y2BaMamyba.GydF4y2Ba与对照和OE-相比,e -含量显著升高GydF4y2Ba马南GydF4y2Ba植物(图。GydF4y2Ba6.GydF4y2Bab, e).这些结果表明MaMybA通过上调花青素合成途径中的生物合成基因来促进花青素的积累。这些上调的花青素生物合成基因导致代谢物的增加,这些代谢物形成了后续催化反应的底物,从而使花青素的浓度得以积累。此外,高表达GydF4y2BaNtF3的5是什么GydF4y2Ba负责催化Dp3R的产物,该产物在之前的研究中也在转基因烟草的花枝中发现[GydF4y2Ba53.GydF4y2Ba].GydF4y2Ba
结论GydF4y2Ba
在本研究中,一种新的R2R3-MYB TF,MamyBA,其从花转录组中鉴定GydF4y2Bam . armeniacumGydF4y2Ba,被发现在花青素色素沉着中起作用。通过外源基因表达,我们确定了MaMybA在烟草花青素生物合成中的作用,并确定了OE-的深红紫色花青素着色GydF4y2BaMamyba.GydF4y2Ba烟草可归因于高浓度的花青素和新产生的DP3R。结果表明GydF4y2BaMamyba.GydF4y2Ba这可能是修饰花卉颜色的候选基因,并有可能在高水平的花青素工程。此外,我们还确定了MaMybA和MaAN2在花青素合成方面的异同:它们都可以与bHLH蛋白相互作用,但前者是独立的,而后者依赖bHLH调节lbg。MaMybA与MaAN2在诱导烟草花青素和着色组织的含量和组成方面存在差异,这表明MaMybA在葡萄风信子中的作用有待进一步研究。GydF4y2Ba
方法GydF4y2Ba
植物材料GydF4y2Ba
葡萄风信子(GydF4y2Bam . armeniacumGydF4y2Ba)植物在试验田在中国西北农林科技大学,杨凌区,陕西省,种植。(S1〜S5)主要是根据花瓣的色素沉着的程度被片分为五个阶段:S1所示无色素沉着;S2表明色素沉着在基部可见;S3指示开始变成蓝色颜料;S4表示为,花朵或全蓝,但没有打开;和S5表示的花朵完全打开时,根据Chen等人的方法。[GydF4y2Ba17GydF4y2Ba然后,然后将和储存并储存,与营养组织(根,灯泡和叶子)一起收集并储存,直至使用直至使用。无菌烟草(GydF4y2Ban .烟草GydF4y2Ba'NC89')幼苗用于四叶阶段的遗传转化。T.GydF4y2Ba1GydF4y2Ba代转基因烟草植物从无菌培养室到温室转移。这mature, fully expanded tobacco leaves and fully opened flower limbs were picked and stored at − 80 °C in readiness for the next test.拟南芥蒂利亚纳GydF4y2Ba(col-0)和GydF4y2Ban benthamianaGydF4y2Ba在16小时光/ 8小时的暗循环下在光培养箱中生长植物,直至实现四到六叶阶段,以克隆GydF4y2BaAtDFRGydF4y2Ba启动子和GydF4y2BaAtHY5GydF4y2Ba基因,双荧光素酶分析。GydF4y2Ba
定量实时PCR测定GydF4y2Ba
来自不同组织的总RNA提取GydF4y2Bam . armeniacumGydF4y2Ba使用Chen等人描述的方案进行了烟草,cDNA合成和QRT-PCR测定。[GydF4y2Ba17GydF4y2Ba].qRT-PCR引物列于附加文件GydF4y2Ba8.GydF4y2BaS1:表。GydF4y2BaMaactin.GydF4y2Ba和GydF4y2Banttuba1.GydF4y2Ba被用作GydF4y2Bam . armeniacumGydF4y2Ba和烟草分别。使用三个样品进行分析,三个复制。GydF4y2Ba
基因克隆GydF4y2Ba
本地BLASTP软件用于筛选一种含有的花青素相关的R2R3-MYB和一种与过孔素相关的BHLH UNIGENE,使用来自转录组的ATPAP1和ATTT8GydF4y2Bam . armeniacumGydF4y2Ba花(GydF4y2Ba23GydF4y2Ba];unigenes被指定GydF4y2BaMamyba.GydF4y2Ba和GydF4y2Bamabhlh1.GydF4y2Ba,分别。然而,R2R3-MYB单基因缺乏5 ' -和3 ' -非翻译区域。因此,我们采用5 ' -RACE和3 ' -RACE方法获得了该基因的全长cDNA序列GydF4y2BaMamyba.GydF4y2Ba从GydF4y2Bam . armeniacumGydF4y2Ba花。获得全长cDNA的详细协议GydF4y2BaMamyba.GydF4y2Ba遵循Chen等人描述的方法[GydF4y2Ba17GydF4y2Ba]和huang等人。[GydF4y2Ba55.GydF4y2Ba].的全长cDNAGydF4y2Bamabhlh1.GydF4y2Ba被克隆GydF4y2Bam . armeniacumGydF4y2Ba使用rt - pcr的花朵;用于基因克隆的引物列在附加文件中GydF4y2Ba8.GydF4y2BaS1:表。获得的cDNA序列提交到NCBI GenBank数据库,登录号为MF663728 (GydF4y2BaMamyba.GydF4y2Ba)及MF663729 (GydF4y2Bamabhlh1.GydF4y2Ba).GydF4y2Ba
序列对准和系统发育分析GydF4y2Ba
推导的氨基酸序列GydF4y2BaMamyba.GydF4y2Ba和GydF4y2Bamabhlh1.GydF4y2Ba,以及从GenBank数据库中检索到的其他与花青素相关的r2r3 - myb和bHLH蛋白,分别进行序列比对和系统发育分析。多序列比对采用DNAMAN软件8.0 (Lynnon Biosoft, CA, USA)进行分析。系统发育树首先使用CLUSTALW软件进行分析,然后使用MEGA软件6.0版本构建[GydF4y2Ba56.GydF4y2Ba],使用最大似然方法。引导程序设置为1000复制。不同蛋白质类型的登录号在图2中列出。GydF4y2Ba1GydF4y2Ba和额外的文件GydF4y2Ba2GydF4y2Ba:分别为图S2。GydF4y2Ba
亚细胞定位和转录激活能力测定GydF4y2Ba
对于亚细胞定位试验,两者的ORFGydF4y2BaMamyba.GydF4y2Ba或GydF4y2Bamabhlh1.GydF4y2Ba如果没有终止密码子,使用无缝克隆和装配套件(NoveProtein,Shanghai,China)插入PCAMBIA2300(PC2300)-GFP中,以产生PC2300-MAMYBA-GFP(MAMYBA-GFP)或PC2300-MABHLH1-GFP(MABHLH1-GFP)分别。另外,全长cDNA序列GydF4y2BaAtHY5GydF4y2Ba(AT5G11260)编码核定位标记蛋白GydF4y2BaA. Thaliana.GydF4y2Ba(Col-0),插入pBI221-mCherry,生成pBI221-AtHY5-mCherry (AtHY5-mCherry)。引物在附加文件中列出GydF4y2Ba8.GydF4y2BaS1:表。pC2300-GFP(35S:GFP)用作阳性对照。各种质粒共转化GydF4y2BaA. Thaliana.GydF4y2Ba叶片原生质体使用Yoo等人描述的协议。[GydF4y2Ba57.GydF4y2Ba].转化原生质体培养16 h后,用激光扫描共聚焦显微镜(Leica TCS SP8, Wetzlar, Germany)观察。GydF4y2Ba
为了构建检测MaMybA和MabHLH1转录激活能力的酵母表达载体,将两个ORF PCR产物分别融合到pGBKT7中。引物在附加文件中列出GydF4y2Ba8.GydF4y2BaS1:表。pGBKT7-53与pGADT7- t共转化为阳性对照,pGADT7为阴性对照。酵母转化和自动激活试验均按照Chen等人的描述进行[GydF4y2Ba17GydF4y2Ba].GydF4y2Ba
双分子荧光互补测定GydF4y2Ba
为了验证bHLH蛋白与R2R3-MYBs之间的相互作用GydF4y2Bam . armeniacumGydF4y2Ba,进行了BiFC测定GydF4y2Ban benthamianaGydF4y2Ba确认mabhlh1与mamyba或maan2之间的相互作用(花青素相关的R2R3-MYBGydF4y2Bam . armeniacumGydF4y2Ba;KY781168)[GydF4y2Ba17GydF4y2Ba].的ORF序列GydF4y2Bamabhlh1.GydF4y2Ba和GydF4y2Ba马南GydF4y2Ba单独插入pspyne(r)173(yn)中以分别产生Yn / mabhlH1和Yn / Maan2。另外,ORF序列没有任何一个GydF4y2BaMamyba.GydF4y2Ba或GydF4y2Bamabhlh1.GydF4y2Ba将终止密码子插入pspyce(m)(Yc)中以分别产生Yc / mamyba和Yc / mabhlH1。引物在附加文件中列出GydF4y2Ba8.GydF4y2BaS1:表。通过电穿孔将重组和空载体质粒转化为GV3101,以及各种转化的GydF4y2Ba农杆菌属GydF4y2Ba培养物被共浸入GydF4y2Ban benthamianaGydF4y2Ba叶子。在光培养箱中培养3d后,用激光扫描共聚焦显微镜(Leica TCS SP8, Wetzlar, Germany)观察并拍照。GydF4y2Ba
双荧光素酶检测GydF4y2Ba
双荧光素酶检测,全长cDNA序列GydF4y2BaMamyba.GydF4y2Ba那GydF4y2Ba马南GydF4y2Ba, 和GydF4y2Bamabhlh1.GydF4y2Ba每个都克隆到pgreenii 62-sk中。EBG的启动子GydF4y2Bam . armeniacumGydF4y2Ba(GydF4y2Ba马赫GydF4y2Ba,KY781171)和关键的LBGGydF4y2Bam . armeniacumGydF4y2Ba(GydF4y2BaMaDFR,GydF4y2BaKY781169)和GydF4y2BaA. Thaliana.GydF4y2Ba(GydF4y2BaAtDFRGydF4y2Ba分别插入pGreenII 0800-LUC。引物在附加文件中列出GydF4y2Ba8.GydF4y2BaS1:表。所有重组质粒均电孔至GV3101。浸润,瞬时表达分析,酶活性测定的LUC和GydF4y2BaRenillaGydF4y2Ba荧光素酶(REN)是根据之前引用的协议进行的[GydF4y2Ba17GydF4y2Ba那GydF4y2Ba58.GydF4y2Ba那GydF4y2Ba59.GydF4y2Ba].使用四种生物重复进行双荧光素酶测定的统计分析。GydF4y2Ba
稳定的烟草改造GydF4y2Ba
以验证的功能GydF4y2BaMamyba.GydF4y2Ba,ORF序列没有终止密码子GydF4y2BaMamyba.GydF4y2Ba插入pCambia1304。引物列在附加文件中GydF4y2Ba8.GydF4y2BaS1:表。因此,GydF4y2BaMamyba.GydF4y2Ba由35S启动子促进。通过电穿孔将重组质粒或空质粒导入GV3101。根据Horsch等人描述的协议进行烟叶盘转化[GydF4y2Ba60.GydF4y2Ba].用25mg L筛选转化烟草植株GydF4y2Ba- 1GydF4y2Ba潮霉素抗生素,用作植物选择性标志物。下一个分析阶段使用GydF4y2Ba1GydF4y2Ba产生过表达转基因植株GydF4y2BaMamyba.GydF4y2Ba(OEGydF4y2Ba-mamyba.GydF4y2Ba叶和花的颜色发生了明显的变化。得到T的方法GydF4y2Ba1GydF4y2Ba产生过表达转基因烟草GydF4y2Ba马南GydF4y2Ba按照我们之前研究的议定书[GydF4y2Ba17GydF4y2Ba]GydF4y2Ba.GydF4y2Ba
HPLC分析GydF4y2Ba
从不同转基因烟草基因型的新鲜、成熟、完全展开的烟叶和完全张开的花枝中提取花青素的方法如Chen等人所述[GydF4y2Ba17GydF4y2Ba].此外,将300 μL等量6 M盐酸煮沸1 h,释放花青素苷元,得到花青素水解液。提取液经0.22 μm滤膜过滤后进行反相高效液相色谱分析。HPLC实验条件、仪器和方案均按照Chen等人的方法进行[GydF4y2Ba17GydF4y2Ba].首先参考商业标准鉴定花青素提取物(所提到的所有标准列在图1中。GydF4y2Ba5.GydF4y2Ba;σ,美国)。根据Cy3R标准曲线测定花青素含量。采用3个生物重复对烟草样品中的花青素含量进行了分析。GydF4y2Ba
UPLC-Triple-Tof-MS / MS条件GydF4y2Ba
对UPLC实验进行了与C18柱(1.8μm,100mm×4.6mm; Agilent Zorbax-SB,CA,USA)的Acquity™UPLC系统(Waters,MA,USA)进行了UPLC实验。柱温保持在30°C;检测波长为530nm。洗脱液由水溶液(0.1%甲酸中)和有机溶剂B(乙腈中0.1%甲酸)的流速组成,流速为0.8mL minGydF4y2Ba- 1GydF4y2Ba.梯度洗脱程序为:0~2 min, 5% B;25分钟,50% B;35分钟,95% B;37分钟,95% B;38min, 5% b,注射量为5 μL。GydF4y2Ba
质谱(MS)在TOF质谱仪(三重TOF™5600+系统)上进行,双喷雾™源在正负电喷雾电离模式下工作(AB SCIEX, CA, USA)。优化后的MS/MS检测器工作参数为:离子喷雾电压,−4.5 kV(负),5.5 kV(正);离子源加热器,550°C(负)和600°C(正);帘气、离子源气1、离子源气2分别设置为35、50、50 psi;实验采用100~1000 m/z扫描。MS实验中,聚束势和碰撞能级分别设置为100 V和10 V;MS/MS数据采集采用TOF MS- product Ion-IDA (information-dependent acquisition)模式;碰撞诱导解离能级分别设为−20、−40和−60 V。此外,采用自动标定传递系统同时对MS和MS/MS实验进行标定,将质量轴误差减小到2 × 10以内GydF4y2Ba- 6GydF4y2Ba.GydF4y2Ba
花青素的组织定位及扫描电镜观察GydF4y2Ba
使用细小钳子从叶片上剥离表皮。使用剃刀刀片手工制作新鲜叶组织的横截面。将样品立即转移到具有水滴的玻璃载玻片上,并在显微镜下观察(尼康Eclipse 50i,东京,日本)。GydF4y2Ba
根据QI等人描述的先前公布的协议进行扫描电子显微镜。[GydF4y2Ba61.GydF4y2Ba].具体地,转基因烟草的着色叶片和甘蓝首先固定在4%戊二醛中,然后在醇系列中脱水。接下来,样品是临界点干燥和用铂涂覆涂覆。最后,在扫描电子显微镜(JEOLJSM-6360LV,日本)下观察到所有样品。GydF4y2Ba
统计分析GydF4y2Ba
统计分析使用SPSS 20.0软件(SPSS公司,Chicago,USA)进行。数据表示为平均值GydF4y2Ba±GydF4y2Ba标准偏差(SD)。统计学显着性的水平由GydF4y2Ba最小显著性差异GydF4y2Ba(GydF4y2Ba迷幻药GydF4y2Ba)分析:GydF4y2BaP.GydF4y2Ba< 0.05。GydF4y2Ba
可用性数据和材料GydF4y2Ba
本研究期间生成或分析的所有数据都包含在本发布的文章及其补充信息文件中。GydF4y2Ba
缩写GydF4y2Ba
- 阿巴:GydF4y2Ba
-
Aureobasidin A.GydF4y2Ba
- ANS:GydF4y2Ba
-
花青素合成酶GydF4y2Ba
- bHLH:GydF4y2Ba
-
基本螺旋循环螺旋GydF4y2Ba
- BIFC:GydF4y2Ba
-
双分子荧光互补GydF4y2Ba
- 气:GydF4y2Ba
-
查耳酮异构酶GydF4y2Ba
- CHS:GydF4y2Ba
-
Chalcone合成酶GydF4y2Ba
- CY:GydF4y2Ba
-
Cyanidin.GydF4y2Ba
- Cy3R:GydF4y2Ba
-
Cyanidin 3- rutinosideGydF4y2Ba
- DFR:GydF4y2Ba
-
二氢烷醇4-还原酶GydF4y2Ba
- DP:GydF4y2Ba
-
Delphinidin.GydF4y2Ba
- Dp3R:GydF4y2Ba
-
飞燕草色素-3-芸香糖甙GydF4y2Ba
- EBG:GydF4y2Ba
-
早期的生物合成的基因GydF4y2Ba
- F3'H:GydF4y2Ba
-
黄酮类化合物3'-羟化酶GydF4y2Ba
- F3'5'H:GydF4y2Ba
-
类黄酮3 ' 5 '羟化酶GydF4y2Ba
- F3h:GydF4y2Ba
-
黄烷酮3-羟化酶GydF4y2Ba
- 绿色荧光蛋白:GydF4y2Ba
-
绿色荧光蛋白GydF4y2Ba
- HPLC:GydF4y2Ba
-
高效液相色谱法GydF4y2Ba
- LBG:GydF4y2Ba
-
晚期生物合成的基因GydF4y2Ba
- LUC:GydF4y2Ba
-
萤火虫荧光素酶GydF4y2Ba
- m / z:GydF4y2Ba
-
质荷比GydF4y2Ba
- 多发性硬化症:GydF4y2Ba
-
质谱GydF4y2Ba
- 女士/小姐:GydF4y2Ba
-
串联质谱GydF4y2Ba
- OE:GydF4y2Ba
-
OverexpressingGydF4y2Ba
- 子:GydF4y2Ba
-
开放阅读框GydF4y2Ba
- 存在:GydF4y2Ba
-
实时定量聚合酶链反应GydF4y2Ba
- 仁:GydF4y2Ba
-
RenillaGydF4y2Ba荧光素酶GydF4y2Ba
- rt - pcr:GydF4y2Ba
-
逆转录 - 聚合酶链反应GydF4y2Ba
- TF:GydF4y2Ba
-
转录因子GydF4y2Ba
- 到F:GydF4y2Ba
-
飞行时间GydF4y2Ba
- UFGT:GydF4y2Ba
-
尿苷二磷酸 - 糖:黄酮糖基糖基转移酶GydF4y2Ba
- UPLC:GydF4y2Ba
-
超高效液相色谱GydF4y2Ba
- 沃尔:GydF4y2Ba
-
WD-REPEAT.GydF4y2Ba
- yfp:GydF4y2Ba
-
黄色荧光蛋白GydF4y2Ba
参考文献GydF4y2Ba
- 1.GydF4y2Ba
赵东,陶杰。观赏植物花色发育与调控的研究进展。植物学报。2015;6:261。GydF4y2Ba
- 2.GydF4y2Ba
陈志强,王志强,王志强,等。工程抗灰霉病,抗氧化能力,色素沉着在甜菜碱生产作物和观赏植物。中国科学技术大学学报2017;114:9062-7。GydF4y2Ba
- 3.GydF4y2Ba
王志强,王志强,王志强,等。生物技术在植物色素修饰中的应用研究进展。中华医学杂志。2009;10:5350-69。GydF4y2Ba
- 4.GydF4y2Ba
Katsumoto Y, Fukuchi-Mizutani M, Fukui Y, Brugliera F, Holton TA, Karan M,等。玫瑰类黄酮生物合成途径工程成功地产生了积累飞燕草苷的蓝色花。植物生理学报。2007;48:1589-600。GydF4y2Ba
- 5。GydF4y2Ba
Azadi P, Bagheri H, Nalousi AM, Nazari F, Chandler SF。观赏植物基因工程研究现状及生物技术进展。Biotechnol放置2016;34:1073 - 90。GydF4y2Ba
- 6。GydF4y2Ba
王志强,王志强,王志强,等。基于转基因技术的植物花色基因工程研究进展。方法:中华医学杂志2010;589:325。GydF4y2Ba
- 7.GydF4y2Ba
Elomaa P, Uimari A, Mehto M, Albert VA, Laitinen RA, Teeri TH。花青素生物合成的激活GydF4y2Ba非洲菊矮牵牛GydF4y2Ba(Asteraceae)表明古代分散的单焦点和销售之间的保守蛋白质和蛋白质 - 启动子相互作用。植物理性。2003; 133:1831-42。GydF4y2Ba
- 8.GydF4y2Ba
张Y,Butelli e,Martin C.工业植物中的花青素生物合成。CurrOp植物BIOL。2014; 19:81-90。GydF4y2Ba
- 9.GydF4y2Ba
引用本文:田中勇,田中勇,田中勇,等。以飞燕草苷为基础的花青素积累产生的新型蓝色菊花的基因工程。acta botanica yunnanica(云南植物研究). 2013;54:1684-95。GydF4y2Ba
- 10.GydF4y2Ba
野田N,吉冈S,岸本S,中山男,Douzono男,田中Y,等人。通过花色素苷的B环的羟基化和葡糖和它的着色机理蓝色菊花的产生。SCI ADV。2017; 3:e1602785。GydF4y2Ba
- 11.GydF4y2Ba
Schwinn K,Venail J,Shang Y,Mackay S,Alm V,Butelli E等人。一小家庭的MYB-Charmatory基因控制着属性的花卉色素沉着强度和在属中的图案化GydF4y2BaAntirrhinum.GydF4y2Ba.植物细胞。2006; 18:831-51。GydF4y2Ba
- 12.GydF4y2Ba
Schwinn KE, Boase MR, Bradley JM, Lewis DH, Deroles SC, Martin CR,等。MYB和bHLH转录因子转基因增加了矮牵牛和甘草植株的花色苷着色,田间条件下矮牵牛表型显著增强。植物科学学报2014;5:603。GydF4y2Ba
- 13.GydF4y2Ba
引用本文:黄志强,李志强,李志强,等。通过表达精选转录因子富集番茄果实的健康促进花青素。生物科技Nat》。2008;26:1301-8。GydF4y2Ba
- 14。GydF4y2Ba
Laitinen Ra,Ainasoja M,Broholm Sk,Teeri Th,Elomaa P.靶基因的靶基因MyB型化性化学素调节剂GydF4y2Ba非洲菊矮牵牛GydF4y2Ba.J Exp Bot。2008; 59:3691-703。GydF4y2Ba
- 15.GydF4y2Ba
Yamagishi M, Toda S, Tasaki K.在亚洲杂交百合花被片上的飞溅型斑点形成中,LhMYB12基因的新等位基因参与了GydF4y2Ba百合属植物GydF4y2Baspp)。新植醇。2014;201:1009-20。GydF4y2Ba
- 16。GydF4y2Ba
李C,邱Ĵ,杨G,黄S,在佛焰苞的有关花青素合成一个R2R3-MYB转录因子基因的阴J.分离和鉴定GydF4y2Ba安杉西亚姆GydF4y2Ba(如果短)。植物细胞代表2016;35:2151-65。GydF4y2Ba
- 17。GydF4y2Ba
陈K,刘H,娄Q,葡萄风信子的刘Y.异位表达(GydF4y2BaMuscari armeniacumGydF4y2Ba)R2R3-MYB转录因子基因,MAAN2,诱导烟草中的花青素积累。前植物SCI。2017; 8:965。GydF4y2Ba
- 18.GydF4y2Ba
谢迪,沙姆达,赖特e,wang zy,dixon ra。花青素的代谢工程通过共表达花青素还原酶和PAP1 MYB转录因子。植物J. 2006; 45:895-907。GydF4y2Ba
- 19.GydF4y2Ba
刘志强,王志强,王志强,等。PAP1转录因子促进了玫瑰花中苯丙素和萜类香味化合物的生成。新植醇。2012;195:335-45。GydF4y2Ba
- 20.GydF4y2Ba
borvitz JO, Xia Y, Blount J, Dixon RA, Lamb C. Activation tagging鉴定了一个保守的MYB苯丙类生物合成调控因子。植物细胞。2000;12:2383 - 93。GydF4y2Ba
- 21。GydF4y2Ba
娄q,王l,刘h,刘玉,葡萄风信子花中的花青素概况。分子。2017年; 22:688。GydF4y2Ba
- 22。GydF4y2Ba
森S,浅野S,在花花青素和花青素的小林H.分析GydF4y2Ba穆斯卡里GydF4y2Ba新泻大学农学院学报2002;55:13-8。GydF4y2Ba
- 23。GydF4y2Ba
娄q,刘y,qi y,jiao s,tian f,姜l,王Y.转录组测序和代谢物分析揭示了Delphinidin代谢在葡萄葫芦中的作用。J Exp Bot。2014; 65:3157-64。GydF4y2Ba
- 24。GydF4y2Ba
齐默尔曼IM, Heim MA, Weisshaar B, Uhrig JF。全面的识别GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba与R / B样BHLH蛋白相互作用的MYB转录因子。工厂J. 2004; 40:22-34。GydF4y2Ba
- 25。GydF4y2Ba
Singh R,低E-TL,OOI LC-L,Ong-Abdullah M,Nookiah R,Ting N-C等。油棕virescens基因控制果子颜色并编码R2R3-MYB。NAT Communce。2014; 5:4106。GydF4y2Ba
- 26。GydF4y2Ba
Schwinn Ke,Ngo H,Kenel F,Brummell da,Albert NW,McCallum Ja,等。洋葱 (GydF4y2Ba洋葱GydF4y2Bal .)MYB1基因调控花青素的生物合成。前面。植物科学。2016;7:1865。GydF4y2Ba
- 27。GydF4y2Ba
李QF,他JX。BZR1与Hy5相互作用,以介导芸苔类固醇和光控的子叶开口GydF4y2Ba拟南芥GydF4y2Ba在黑暗中。莫尔植物。2016; 9:113-25。GydF4y2Ba
- 28.GydF4y2Ba
谢晓波,李松,张福峰,赵军,陈永春,赵强,等。bHLH转录因子MdbHLH3促进苹果花色苷的积累和果实颜色的响应低温。《植物细胞环境》2012;35:1884-97。GydF4y2Ba
- 29.GydF4y2Ba
徐W,Dubos C,Lepiniec L. myB-BHLH-WDR复合物对类黄酮生物合成的转录控制。趋势植物SCI。2015; 20:176-85。GydF4y2Ba
- 30.GydF4y2Ba
李c,秋j,丁l,黄m,黄s,杨g,yin j.Anthocyanin生物合成调控Dhmyb2和dhbhlh1GydF4y2Ba石斛兰GydF4y2Ba杂交花瓣。植物理性生物化学。2017; 112:335-45。GydF4y2Ba
- 31。GydF4y2Ba
中图卡,佐藤,高桥,山村,西原等。龙胆草中udp -葡萄糖:花青素5- o -糖基转移酶基因的克隆与鉴定。J Exp Bot. 2008; 59:1241-52。GydF4y2Ba
- 32。GydF4y2Ba
Bai Y,Pattanaik S,Patra B,Werkman Jr,谢Ch,携带烟草的黄化类基本螺旋升温器,NTAN1A和NTAN1B,烟草的起源于两颗祖先并在功能上有效。Planta。2011; 234:363。GydF4y2Ba
- 33.GydF4y2Ba
Baudry A,Heim Ma,DubReucq B,Caboche M,Weisshaar B,Lepiniec L. TT2,TT8和TTG1协同讲解Banyuls和Pronyonyanidin生物合成的表达GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba.植物j . 2004; 39:366 - 80。GydF4y2Ba
- 34.GydF4y2Ba
关键词:矮牵牛,AN2, R2R3-MYB基因,花青素,花被斑,亚洲杂交百合植物生理学杂志。2010;51:463-74。GydF4y2Ba
- 35.GydF4y2Ba
赵志尧,叶家伟。MYB基因的差异表达(GydF4y2Baogmyb1.GydF4y2Ba)确定花组织中的颜色图案化GydF4y2Baoncidium.GydF4y2BaGower Ramsey。植物mol biol。2008; 66:379-88。GydF4y2Ba
- 36.GydF4y2Ba
徐春春,陈媛媛,蔡文昌,陈文华,陈华华。三种R2R3-MYB转录因子调节不同的花色素沉着模式GydF4y2Ba蝴蝶兰属GydF4y2BaSPP。植物理性。2015; 168:175-91。GydF4y2Ba
- 37.GydF4y2Ba
对葡萄MYB R2R3亚家族的分析揭示了扩大的葡萄酒质量相关分支和保守的基因结构组织GydF4y2Bavitis.GydF4y2Ba和GydF4y2Ba拟南芥GydF4y2Ba基因组。BMC植物BIOL。2008; 8:83。GydF4y2Ba
- 38。GydF4y2Ba
伐木归堆A,Machemer K,布劳恩EL,Grotewold E.进化和MYB和的bHLH植物转录因子的比较分析。植物杂志2011; 66(1):94-116。GydF4y2Ba
- 39。GydF4y2Ba
Stracke R,Werber M,Weisshaar B. R2R3-MyB基因家庭GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba.CurrOp植物BIOL。2001; 4(5):447-56。GydF4y2Ba
- 40.GydF4y2Ba
陈建平,张建平。MYB抑制剂在植物中对苯丙氨酸代谢的调控作用。植物学报,2019;24(3):275-89。GydF4y2Ba
- 41.GydF4y2Ba
调控花青素色素沉着的调控基因在植物物种中是功能保守的,并具有不同的目标基因集。植物细胞。1993;5:1497 - 512。GydF4y2Ba
- 42.GydF4y2Ba
Kiferle C, Fantini E, Bassolino L, Povero G, Spelt C, Buti S, Giuliano G, Quattrocchio F, Koes R, Perata P,等。番茄R2R3-MYB蛋白SlANT1和SlAN2蛋白活性相同。《公共科学图书馆·综合》2015;10:e0136365。GydF4y2Ba
- 43.GydF4y2Ba
Walker Ar,Lee E,Bogs J,McDavid Da,Thomas Mr,Robinson SP。白葡萄通过两个类似和相邻的调控基因的突变产生。工厂J. 2007; 49:772-85。GydF4y2Ba
- 44.GydF4y2Ba
拼写C,Quattrocchio楼分子JN,Koes R.GydF4y2Ba花青素1GydF4y2Ba矮牵牛花编码一种基本的螺旋-环-螺旋蛋白,直接激活结构花青素基因的转录。植物细胞。2000;12:1619-31。GydF4y2Ba
- 45。GydF4y2Ba
Sartkevic P,Paukstyte J,Kazanaviciutiute V,Denkovskiene E,Stanys V,Bendokas v等。甜樱桃的表达和花青素生物合成调节潜力(GydF4y2Ba李属鸟结核GydF4y2Bal .)MYB10和bHLH基因。《公共科学图书馆•综合》。2015;10:e0126991。GydF4y2Ba
- 46。GydF4y2Ba
Espley RV, Hellens RP, Putterill J, Stevenson DE, Kutty-Amma S, Allan AC.苹果果实的红色着色是由于MYB转录因子MdMYB10的活性。植物j . 2007; 49:414-27。GydF4y2Ba
- 47。GydF4y2Ba
HICHRI I,Heppel SC,Pillet J,Leon C,Czemmel S,Delrot S,Lauvergeat V,Bogs J.基本的螺旋环 - 螺旋转录因子MyC1参与了葡萄化葡萄酒的黄酮类生物合成途径的调节。莫尔植物。2010; 3:509-23。GydF4y2Ba
- 48。GydF4y2Ba
刘雪峰,尹晓荣,Allan AC, lin wang K, Shi YN, Huang YJ, Ferguson IB, Xu CJ, Chen KS。MrbHLH1和MrMYB1在烟草和杨梅花青素生物合成基因调控中的作用(GydF4y2BaMyrica Rubra.GydF4y2Ba)在花青素生物合成中。植物细胞组织org。2013; 115(3):285-98。GydF4y2Ba
- 49。GydF4y2Ba
Dooner HK,Robbins TP,Jorgensen Ra。花青素生物合成的遗传与发育控制。年度Rev Genet。1991年; 25:173-99。GydF4y2Ba
- 50。GydF4y2Ba
徐伟,王志强,王志强,等。MYB-bHLH-WDR复合物及其靶点的综合分析揭示了类黄酮转录调控网络的复杂性和稳稳性GydF4y2Ba拟南芥GydF4y2Ba种子。新植醇。2014;202:132-44。GydF4y2Ba
- 51。GydF4y2Ba
Feyissa DN,Lovdal T,Olsen Km,Slimestad R,Lillo C.内源GL3,但不是EGL3,基因是由氮耗尽诱导的花青素积累所必需的GydF4y2Ba拟南芥GydF4y2Ba玫瑰叶子。足底。2009;230:747-54。GydF4y2Ba
- 52。GydF4y2Ba
Ludqig SR,Bowen B,Beach L,Wessler SR。一种监管基因作为玉米转化的新型可见标志物。科学。1990年; 247(4941):449-50。GydF4y2Ba
- 53。GydF4y2Ba
通过B-Peru和mPAP1转录因子在花特异启动子控制下的同时表达提高花的颜色。国际分子生物学杂志。2018;19:309。GydF4y2Ba
- 54。GydF4y2Ba
Pattanaik S,Kong Q,Zaitlin D,Werkman JR,谢Ch,Patra B,Yuan L.来自烟草的花组织特异性R2R3 MYB调节剂的分离和功能性。Planta。2010; 231(5):1061-76。GydF4y2Ba
- 55。GydF4y2Ba
黄W,Khaldun AB,LV H,Du L,张C,王Y. Zhocyanin生物合成途径R2R3-MYB调节剂的分离和功能性表征GydF4y2Ba淫羊藿sagittatumGydF4y2Ba.植物细胞代表2016;35:883-94。GydF4y2Ba
- 56。GydF4y2Ba
Tamura K,SteCher G,Peterson D,Filipski A,Kumar S. Mega6:分子进化遗传学分析6.0版。mol Biol Evol。2013; 30:2725-9。GydF4y2Ba
- 57。GydF4y2Ba
柳SD,赵YH,辛J.GydF4y2Ba拟南芥GydF4y2Ba叶片原生质体:一种用于瞬态基因表达分析的通用细胞系统。NAT PROTOC。2007; 2:1565-72。GydF4y2Ba
- 58.GydF4y2Ba
Palapol Y,Ketsa S,Lin-Wang K,Ferguson IB,Allan AC。MYB转录因子调节山鹅肠的花青素生物合成(GydF4y2BaGarcinia mangostana.GydF4y2BaL.)果实在成熟期间。Planta。2009; 229:1323-34。GydF4y2Ba
- 59.GydF4y2Ba
尹XR,Allan Ac,Chen Ks,Ferguson IB。Kiwifruit EIL和ERF基因参与调节果实成熟。植物理性。2010; 153:1280-92。GydF4y2Ba
- 60.GydF4y2Ba
Horsch RB。一种将基因转入植物的简单而通用的方法。科学。1985;227(4691):1229 - 31所示。GydF4y2Ba
- 61.GydF4y2Ba
戚艳,娄强,李华,岳军,刘艳,王艳。云南双色花发育的解剖与生化研究GydF4y2BaMuscari Latifolium.GydF4y2Ba.原生质。2013; 250:1273-81。GydF4y2Ba
致谢GydF4y2Ba
我们感谢姚文孔对显微分析的支持,也感谢爱思唯尔的WebShop编辑服务对语言的编辑。GydF4y2Ba
资金GydF4y2Ba
基金资助:国家自然科学基金项目(no . 31471905);国家自然科学基金项目(no . 31170652);陕西省自然科学基础研究计划项目(no . 2017JQ3019)。资助机构在设计、收集、分析、解释数据或撰写手稿方面没有作用。GydF4y2Ba
作者信息GydF4y2Ba
从属关系GydF4y2Ba
贡献GydF4y2Ba
yl构思了这项研究。KC和LD进行了实验。HL参与了实验的部分。KC分析了数据并写了稿件。所有作者都阅读并批准了手稿。GydF4y2Ba
通讯作者GydF4y2Ba
道德声明GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
不适用。GydF4y2Ba
同意出版GydF4y2Ba
不适用。GydF4y2Ba
相互竞争的利益GydF4y2Ba
两位作者宣称他们没有相互竞争的利益。GydF4y2Ba
额外的信息GydF4y2Ba
出版商的注意事项GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
附加文件GydF4y2Ba
附加文件1:GydF4y2Ba
图S1。GydF4y2BaMaMybA的转录激活能力。将转入pGBKT7/MaMybA载体的酵母(阳性对照(pGBKT7-53 + pGADT7-T)和阴性对照(pGBKT7))分别培养在SD/-Trp培养基中,SD/-Trp培养基中添加40 mg mLGydF4y2Ba- 1GydF4y2BaX-α-GAL,和SD / -TRP介质加入40mg mLGydF4y2Ba- 1GydF4y2BaX-α-GAL和200ng mlGydF4y2Ba- 1GydF4y2Ba阿坝。多克斯(273 kb)GydF4y2Ba
附加文件2:GydF4y2Ba
图S2。GydF4y2Ba推导的氨基酸序列的对准和系统发育分析GydF4y2Bamabhlh1.GydF4y2Ba和其他与其他植物的黄酮类生物合成相关的碱性螺旋环 - 螺旋(BHLH)蛋白。GydF4y2Ba一种GydF4y2Ba从其他植物物种中由MabhlH1和其他BHLH蛋白推导的部分氨基酸的序列比对。通过粗体黑线的对准表示,MyB-Interaction和BHLH DNA装订区域。GydF4y2BaB.GydF4y2Ba从其他植物中由MabhlH1和其他BHLH蛋白推导的整个氨基酸序列的系统发育分析。使用Mega 6.0软件产生最大似然性系统。节点旁边的数字指示从1000复制中的引导值。从Genbank数据库中检索不同植物物种的BHLH蛋白序列,他们的GenBank登录号如下:GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba: AtTT8 (NP_1927202), AtEGL3 (NP_0011853021), AtGL3 (NP_0013327061), AtMYC1 (AEE818881);GydF4y2Ba矮牵牛织布达GydF4y2BaPhJAF13 (AAC394551)和PhAN1 (AAG259281);GydF4y2Ba尼科尼亚塔哈瓦姆GydF4y2Ba:NTAN1A(AEE92571)和NTAN1B(AEE92581);GydF4y2BaAntirrhinum Majus.GydF4y2Ba:Amdelila(AAA326631);GydF4y2Ba非洲菊矮牵牛GydF4y2Ba:GMYC1(CAA076151);GydF4y2Bavitis ViniferaGydF4y2Ba:VVMYC1(ACC686851)和VVMYCA1(ABM923323);GydF4y2Ba马吕斯有明显GydF4y2Ba:MDBHLH3(ADL365971)和MDBHLH33(ABB844741);GydF4y2BaMyrica Rubra.GydF4y2Ba: MrbHLH1 (AGO583721);GydF4y2BaPerilla frutescens.GydF4y2Ba:PFMYC-RP(BAA75513);GydF4y2BaBrassica Rapa.GydF4y2Ba:BRTT8(AEA032811);GydF4y2BaMedicago Truncatula.GydF4y2Ba: MtTT8 (AKN796061);GydF4y2Ba莲花japonicus.GydF4y2Ba: LjTT8 (BAH288811);GydF4y2Ba大丽花pinnataGydF4y2Ba: DvIVS (BAJ335151);GydF4y2BaIpomoea nil.GydF4y2Ba:InbHLH1(BAE943931)和InbHLH2(BAE943941);GydF4y2Ba草莓属×ananassaGydF4y2Ba:FabhlH3(AFL024631)和FabhlH33(AFL024651);GydF4y2Ba碧桃GydF4y2Ba: PpbHLH3 (AIE575081);GydF4y2Ba李属鸟结核GydF4y2Ba:PabhlH3(AJB284811)和PabhlH33(AJB284841);GydF4y2Ba荔枝中华人员GydF4y2Ba: LcbHLH3 (APP941241)、LcbHLH1 (APP941221)、LcbHLH2 (APP941231);GydF4y2Ba百合属植物GydF4y2Ba杂交:LHBHLH1(BAE200571)和LHBHLH2(BAE200581);GydF4y2BaZea Mays.GydF4y2Ba: ZmLC (NP_0011053391);GydF4y2Ba石斛兰GydF4y2Ba杂交:DHBHLH1(AQS798531);GydF4y2Ba龙胆trifloraGydF4y2Ba:GTBHLH1(BAH033871)。GydF4y2BaCGydF4y2Ba表达谱的GydF4y2Bamabhlh1.GydF4y2Ba在不同的组织中GydF4y2BaMuscari armeniacumGydF4y2Ba.GydF4y2BaMaactin.GydF4y2Ba是参考基因。误差栏表示平均结果的标准偏差(SD)。(DocX 1686 KB)GydF4y2Ba
附加文件3:GydF4y2Ba
图S3。GydF4y2BaMabHLH1的亚细胞定位和转录激活能力。GydF4y2Ba一种GydF4y2Bamabhlh1的亚细胞定位。MABHLH1-GFP的瞬态共同表达与ATHY5-MCHERRYGydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba叶肉原生质体显示MabHLH1和AtHY5共同定位于细胞核。酒吧:10μm。GydF4y2BaB.GydF4y2BaMabhlH1的转录激活能力。用阳性对照(PGBKT7-53 + PGADT7-T)和阴性对照(PGBKT7)和阴性对照(PGBKT7)和PGBKT7 / mabhlH1载体转化的酵母,SD / -TRP介质,SD / -TRP介质,40mg mLGydF4y2Ba- 1GydF4y2BaX-α-gal, SD/-Trp培养基加40 mg mLGydF4y2Ba- 1GydF4y2BaX-α-GAL和200ng mlGydF4y2Ba- 1GydF4y2Ba阿坝。阳性对照和pGBKT7/MabHLH1表现出蓝色酵母斑块,而阴性对照在SD/-Trp + 40 mg mL培养基中没有生长GydF4y2Ba- 1GydF4y2BaX-α-gal和200ng / ml aba。(docx 280 kB)GydF4y2Ba
附加文件4:GydF4y2Ba
图S4。GydF4y2Ba另外2个对照株系OE-,叶片和花冠花青素组成分析GydF4y2Ba马南GydF4y2Ba和OE -GydF4y2BaMamyba.GydF4y2Ba烟草。花青素提取物的高效液相色谱分析。根据序列中的色谱峰,标准是Delphinidin 3- rutinoside,Cyanidin 3- rutinoside,和Pelargonidin 3- rutinoside(从左到右)。(Docx 228 KB)GydF4y2Ba
附加文件5:GydF4y2Ba
图S5。GydF4y2Ba花青素-3-芦丁苷的质谱和结构模式。多克斯(153 kb)GydF4y2Ba
附加文件6:GydF4y2Ba
图S6。GydF4y2Ba对照OE-叶片组织中花青素的组织学定位GydF4y2Ba马南GydF4y2Ba和OE -GydF4y2BaMamyba.GydF4y2Ba烟草。基因型是控制(GydF4y2Ba广告GydF4y2Ba), OE -GydF4y2Ba马南GydF4y2Ba(GydF4y2Ba超高频GydF4y2Ba)和OE-GydF4y2BaMamyba.GydF4y2Ba(GydF4y2BaI-L.GydF4y2Ba);背面表皮(GydF4y2Ba一种GydF4y2Ba那GydF4y2BaE.GydF4y2Ba, 和GydF4y2Ba一世GydF4y2Ba),毛状体(GydF4y2BaB.GydF4y2Ba那GydF4y2BaFGydF4y2Ba, 和GydF4y2BajGydF4y2Ba),通过叶片的横截面(GydF4y2BaCGydF4y2Ba那GydF4y2BaGGydF4y2Ba, 和GydF4y2BaK.GydF4y2Ba)和叶静脉(GydF4y2BaD.GydF4y2Ba那GydF4y2BaHGydF4y2Ba, 和GydF4y2BaL.GydF4y2Ba).ep,表皮;hy,皮下的;tr,毛状体;pa,薄壁组织;页,柱状薄壁组织;圣,气孔;sp,海绵组织;弗吉尼亚州,维管束。酒吧:100μm。 (DOCX 550 kb)
附加文件7:GydF4y2Ba
图S7。GydF4y2Ba扫描电子显微镜图像在不同烟草基因型中的叶片和花冠曲面表面细胞。叶子(GydF4y2Ba一种GydF4y2Ba-GydF4y2BaCGydF4y2Ba)和花冠(GydF4y2BaD-F.GydF4y2Ba)显示对照的近轴表面细胞(GydF4y2Ba一种GydF4y2Ba那GydF4y2BaD.GydF4y2Ba), OE -GydF4y2Ba马南GydF4y2Ba(GydF4y2BaB.GydF4y2Ba那GydF4y2BaE.GydF4y2Ba)和OE-GydF4y2BaMamyba.GydF4y2Ba(GydF4y2BaCGydF4y2Ba那GydF4y2BaFGydF4y2Ba)烟草。多克斯(145 kb)GydF4y2Ba
额外的文件8:GydF4y2Ba
表S1。GydF4y2Ba本研究使用的引物。(多克斯22 kb)GydF4y2Ba
权利和权限GydF4y2Ba
开放获取GydF4y2Ba本文遵循知识共享署名4.0国际许可协议(GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)除非另有说明,否则适用于本文中提供的数据。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
陈坤,杜丽丽,刘海峰。GydF4y2Baet al。GydF4y2Ba葡萄风信子R2R3-MYB菌株MaMybA与MaAN2不同,能使烟草产生强烈的品红花青素色素。GydF4y2BaBMC植物BIOL.GydF4y2Ba19,GydF4y2Ba390(2019)。https://doi.org/10.1186/s12870-019-1999-0.GydF4y2Ba
已收到GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
DOIGydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-019-1999-0.GydF4y2Ba
关键字GydF4y2Ba
- 花青素生物合成GydF4y2Ba
- 花色GydF4y2Ba
- 单焦植物GydF4y2Ba
- R2R3-MYB.GydF4y2Ba
- 转录条例GydF4y2Ba
- 转基因烟草GydF4y2Ba