摘要
背景
高温是番茄主要的非生物胁迫之一,严重影响番茄产量和品质。鉴定高温胁迫响应基因和培育耐热品种是解决这一问题的有效途径。然而,番茄耐热性数量性状位点(QTL)的精细定位和HSR基因的鉴定却鲜有报道。本文采用相对电导率(REC)、叶绿素含量(CC)和最大光化学量子效率(Fv/ F米),以及表型指数、热损伤指数(HII),结合传统QTL分析和QTL-seq技术,全面检测番茄幼苗的耐热QTL。此外,我们将QTL作图结果与RNA-seq集成,以识别主要QTL中的关键HSR基因。
结果
共检测到5个主要qtl:qHII-1-1,qHII-1-2,qHII-1-3,qHII-2-1而且qCC-1-5(qREC-1-3).qHII-1-1,qHII-1-2而且qHII-1-3分别位于1号染色体的1.43、1.17和1.19 Mb之间,而qHII-2-1位于2号染色体上1.87 Mb的区间。常规QTL作图与QTL-seq观察到的位置一致。qCC-1-5而且qREC-1-3通过常规QTL定位,CC和REC分别定位在同一位置。虽然qCC-1-5在所有耐热qtl中,其表型变异(16.48%)和正向加性效应(0.22)最高。为了研究番茄主要qtl中与耐热性相关的基因,我们进行了RNA-seq分析,得到了4个候选基因(SlCathB2 SlGST slbc5而且SlARG1通过DEG分析、qRT-PCR筛选和生物学功能分析,最终在主要qtl中检测到与耐热性相关的基因。
结论
综上所述,本研究表明,将传统QTL作图、QTL-seq分析和RNA-seq相结合,可以快速识别出目标复杂性状的主要QTL内的候选基因,取代精细作图过程,大大缩短了育种过程,提高了育种效率。研究结果对高铁基因的精细定位和鉴定以及耐热育种具有重要的应用价值。
背景
番茄(茄属植物lycopersicum)是一种重要的园艺作物,它嗜热但不能耐受高温。白天和夜间生长的最佳温度分别为25-33°C和15-20°C [1].环境温度过高会抑制番茄的生长发育,从而降低产量和品质[2].植物的耐热性受环境、管理措施、特别是基因型的影响[3.].因此,解决这一问题最根本的方法是鉴定HSR基因,培育耐热品种[4].
番茄耐热性是一种数量性状,定量性状位点(quantitative trait locus, QTL)定位是识别番茄耐热性相关基因的有效途径[5].耐热性QTL分析的关键是精确的表型[6].许多研究使用各种参数评估了番茄的耐热性,例如表型指数[7]、生理生化应激指标[8,9],以及显微观察指数[10].表型指标是直接反映热损伤程度的直接诊断工具[11].例如,热损伤指数(HII)是番茄幼苗在高温胁迫下热损伤程度的首选指标[12].生理指标对高温胁迫的响应快于形态变化。例如,膜损伤是热损伤的主要症状,耐热性与电解质泄漏率呈正相关;通常,相对电导率(REC)被用来评估耐热性[13,14].高温胁迫抑制叶绿素生物合成[15];因此,叶绿素含量(CC)可作为高温胁迫的有效评价指标。光系统II (PSII)是电子传递链中最不稳定的组成部分[16].光系统II (PSII)活性在高温胁迫下的抑制导致可变叶绿素荧光降低,最大光化学量子效率(Fv/ F米)的光系统II (PSII),是植物在高温胁迫下最敏感的叶绿素荧光参数之一,可用于耐热性评价[17].因此,本研究采用基于形态的HII和REC、CC、F 3个生理指标对番茄分离群体幼苗的耐热性进行了评价v/ F米.
在番茄中发现了一些与耐热性相关的qtl [18,19,20.,21].然而,由于使用的群体较少,遗传图谱不够密集,许多耐热qtl覆盖面积大,候选基因数量多[22].因此,鉴定耐热性的主要qtl和关键基因需要精细化作图,但精细化作图需要构建高级作图群和精细化遗传图谱,费时费力[23].随着新一代测序(NGS)技术的快速发展,基于高通量测序的QTL作图得到了迅速发展,通过测序完成了区间作图和候选基因鉴定。更广泛适用的策略可用于识别控制粒长和重量的主要qtl [24]、黄瓜提早开花时间[25]和鹰嘴豆的开花时间[26].这些研究表明,QTL-seq是一种快速、有效的方法,可以识别目标基因主要QTL所在的基因组区域。这种QTL作图方法虽然方便,可以缩小QTL区域的大小,但也存在许多局限性,如测序深度和生物信息分析的方法等,会影响基因检测的准确性,并且很难通过全基因组测序的QTL作图(QTL-seq)找到解释大量表型变异的主要QTL,特别是农艺数量性状的QTL [27].为了克服这些局限性,本研究拟结合传统QTL分析和QTL-seq技术检测番茄耐热QTL。该策略已应用于快速、准确地鉴定黄瓜花期相关的主要qtl和候选基因[25],鹰嘴豆粒重1000粒[28]和大豆株高[29],但尚未用于鉴定番茄耐热性相关的qtl和候选基因。
当获得主要耐热qtl时,下一步是识别qtl中的功能基因。因此,提取有利于阐明高温胁迫机制和通过基因工程提高番茄耐热性的HSR基因具有重要意义。常规的精细定位方法可用于目标基因鉴定[30.,31,32].然而,精细映射主要依赖于重组事件。对于重组频率低甚至完全抑制重组的区域,无法进一步鉴定候选基因[33].此外,精细的映射是繁琐和耗时的。因此,我们可以使用QTL作图与RNA-seq相结合的策略,而不是精细作图来快速检测主要QTL背后的目标基因。例如,研究人员将QTL作图和RNA-seq结合起来,以确定油菜荚果数的候选基因(芸苔属植物显著l .) [34,即基因PmSGD与小麦白粉病有关[35]和控制辣椒素含量的基因辣椒[36],但将该方法应用于番茄HSR基因的研究尚未见报道。
在对67个番茄热胁迫基因型进行筛选的基础上,利用Fv/ F米[37],选择热敏感基因型LA1698和耐热基因型LA2093构建定位群体。我们能够可靠地检测到具有高表型变异的重叠qtl,这些高表型变异解释了与耐热相关的生理指标,包括REC、CC和Fv/ F米通过传统的QTL定位和F2由热敏感基因型LA1698和耐热基因型LA2093的杂交而来。利用RNA-seq技术,对番茄传统QTL定位与QTL-seq分析结果进行对比分析,在重叠的主要QTL中发现了一些与高温胁迫有关的关键候选基因。然后通过qRT-PCR和生物学功能分析进一步筛选关键耐热候选基因。因此,本研究的主要目的如下:
- (1)
以检测番茄幼苗的主要耐热qtl
- (2)
并在主要qtl中鉴定高温胁迫响应基因。
我们利用QTL定位和RNA-seq技术鉴定高铁基因,并讨论了基因精细定位的方法。本研究不仅对番茄耐热性改良育种具有指导作用,而且为揭示番茄耐热性的分子调控机制奠定了理论基础。
结果
番茄耐热性相关生理性状的常规QTL定位
相对电导率(REC)、叶绿素含量(CC)和最大光化学量子效率(Fv/ F米光系统II (PSII)在亲本系和F2人口。相关统计数据见表1.REC, CC和Fv/ F米在两个亲本系间表现出显著差异。治疗后,REC、CC、Fv/ F米LA1698的含量分别为0.61、2.49 (mg/g)和0.72。REC, CC和Fv/ F米LA2093的含量分别为0.45、2.98 (mg/g)和0.77。CC和Fv/ F米的REC显著高于LA2093,而LA1698的REC显著高于LA2093。CC和F的平均值v/ F米F的2群体分别为2.81 (mg/g)和0.68,接近中亲本,平均EC为0.63,高于热敏亲本。F2植物超出了两个亲本系,表明这些性状的越界遗传(表1).所有三个性状均表现为连续且基本正态分布(附加文件)12:图S1),证实了该番茄群体的数量性质,可用于QTL作图分析。
筛选的516个SSR标记中,有146个在亲本系间存在多态性,多态性水平为28.25%。在筛选的236个InDel标记中,67个(28.39%)具有多态性。在213个多态标记中,有137个与144个F2植物。结果遗传图谱的统计信息在附加文件中给出1:表S1,并在附加文件中直观说明13:图S2该连锁图谱包含12个连锁群中的137个位点,对应于12条番茄染色体。该图谱全长1503.82 cM,平均标记间隔为10.98 cM。8号染色体的标记数量最多,共有16个;9号和12号染色体的标记最少(7个);其他染色体的标记数在9 ~ 15个之间。总的来说,标记分布均匀,适合QTL定位分析。
利用从F2QTL分析采用Inclusive Composite Interval Mapping (ICIM)程序(http://www.isbreeding.net).当LOD阈值≥2.5时,在热胁迫环境中共检测到12个与番茄生理性状相关的qtl(表2 - 4)2;额外的文件13:图S2)。在染色体1、2、3、9和12上鉴定出7个REC qtl,占表型方差的1.04-6.70%。最显著的QTL (qREC-1-1)与标记物相关W299而且SL20134_408i,占表型变异的6.7%,LOD评分为11.59。qREC-9-1而且qREC-12-17个qtl对REC有正向加性基因效应,分别解释了2.14%和5.70%的表型变异,表明2个提高耐热性qtl的增效基因来自耐热亲本LA2093。在染色体1 (qCC-1-4而且qCC-1-5)及2 (qCC-2-2).3个qtl的表型方差分别为1.71、16.48和4.86%。其中,qCC-1-5,由SSR134而且C01M86371在所有检测到的耐热qtl中,该qtl解释的表型变异最多(16.48%),且具有正向加性效应(0.22),具有潜在的育种应用价值,值得进一步研究。Fv/ F米与5号染色体和12号染色体上的两个qtl与侧翼标记相连SSR13,SSR115,SSRD74而且LeOH301分别解释了6.94%和8.80%的表型变异。的加性效应qFv/ F米5 - 1而且qFv/ F米12 - 2分别为0.18和0.03。传统QTL作图检测到的12个QTL中,6个QTL的加性效应为正,其余QTL的加性效应为负。正加性效应表明,耐热亲本LA2093的等位基因有助于提高耐热性。
利用QTL-seq技术鉴定番茄热伤指数控制qtl
热损伤表型在200华氏度2通过观察真叶和全株的生长状况,发现高温胁迫处理48 h后植株有显著差异。极耐热菌株没有表现出明显的热损伤症状,极耐热菌株枯萎死亡(图。1a). F2种群的热害程度分为5个等级2用0-4的量表对人群进行视觉评分(图2)。1b).作图个体热损伤指数连续变化明显,与数量性状的遗传特征一致(附加文件)14:图S3)。
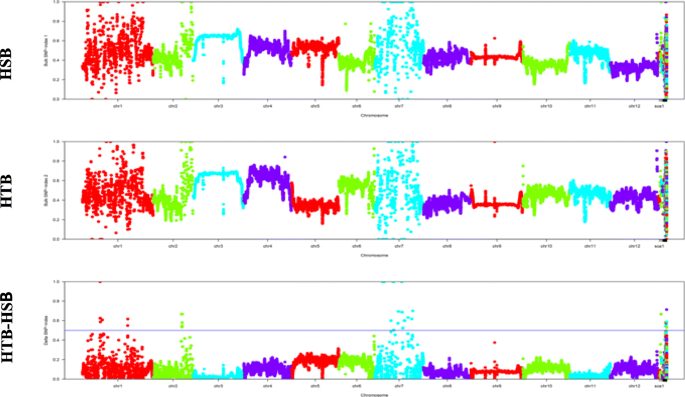
两种亲本基因型以及HSB和HTB的高通量测序结果分别为48,383,616、42,900,716、85307,408和83,673,715条高质量短序列(长度为100 bp),覆盖参考基因组的88.60-89.46%。采用GATK中的最佳实践方法检测snp [38],在亲本和散装样品中分别鉴定出3,521,275-5,840,665个snp2:表S2;额外的文件3.:表S3)。计算区分LA1698和HSB与LA2093和HTB的每个识别SNP的SNP指数。使用10 kb滑动窗口计算HSB和HTB在1 mb基因组间隔内的平均SNP指数,并绘制12个番茄染色体,然后在两个极端大样本之间计算Δ(SNP指数)(图2)。2).按照QTL-seq分析中SNP-index估计的原则,在染色体1、2和7上鉴定出12个基因组区域(总长度为18.21 Mb),统计置信度为P< 0.01,阈值> 0.50003.).在1号染色体上鉴定出3个耐热qtl (qHII-1-1,qHII-1-2,qHII-1-3),在第2染色体上仅检测到1个QTL (qHII-2-1).7号染色体上鉴定的qtl数量最多,为8个(10.08 Mb ~ 52.20 Mb)。我们指定了这些qtlqHII-7-1, qHII-7-2, qHII-7-3, qHII-7-4, qHII-7-5, qHII-7-6, qHII-7-7和qHII-7-8.QTL-seq检测到的qtl均在1 ~ 2 Mb范围内,含有大量候选基因;因此,很难直接筛选候选基因。
来自QTL-seq分析的HSB、HTB和∆(snp指数)图的snp指数图。x轴为番茄12条染色体的位置(Mb), y轴为HSB (Heat-sensitive bulk)、HTB (heat - tolerance bulk)和HTB-HSB的SNP-index (ΔSNP-index)。SNP-index基于1 Mb物理间隔和10 kb滑动窗口估算。使用无QTL零假设下的统计置信区间(P< 0.01),绘制Δ(SNP-index)图。HSB和HTB的SNP-index分别接近0和1,Δ(SNP-index)在置信值0.5以上(显著性水平P < 0.01),在第1、2和7染色体上鉴定了12个qtl(间隔1 ~ 2mb)。
确定控制耐热性的主要qtl
在本研究中,采用传统QTL作图和新的QTL-seq分析来探索耐热QTL。通过综合比较分析两种方法的结果,进一步筛选确定主要耐热QTL和基因,可显著提高主要QTL和基因挖掘的准确性和有效性。
耐热QTLqREC-1-1用于常规QTL分析,在1号染色体上发现了最接近的侧翼标记W299,SL20134_408i,物理分布范围为24.10 ~ 80.54 Mb。QTL-seq结果与传统QTL作图结果的一致性显示了三个耐热QTL (qHII-1-1,qHII-1-2,qHII-1-3)在1号染色体上。的平均SNP指数qHII-1-1,qHII-1-2,qHII-1-3HTB的SNP指数分别为0.97、1、0.6,最高为1,HSB相应区域的SNP指数平均值分别为0.38、0.40、0.15,最低为0。HTB库SNP指数越接近1,HSB库SNP指数越接近0,QTL区间的置信度越高。的物理位置qHII-1-1,qHII-1-2,qHII-1-3分别为23.80-25.23 Mb、26.83-28.00 Mb和62.33-63.52 Mb(表3.);这些QTL被纳入常规QTL分析结果中(图2)。3.).qREC-1-1传统QTL作图检测到的耐热QTL中,LOD值最高(11.59),是最显著的QTL。
qCC-2-2在2号染色体上有侧翼标记吗SSR96而且C02M4005采用常规QTL分析。LOD值和表型变异解释分别为3.52和4.86%,对应的物理位置为39.71 ~ 40.00 Mb。该QTL作图结果与QTL-seq分析结果一致,支持一个主要的QTL位点,qHII-2-1在染色体2上38.98-40.85 Mb的基因组区耐热性(图5)。3.).在该区域,HTB池中三种InDel变异的SNP指数为1,HSB池中平均SNP指数为0.42,最低SNP指数为0.333.).
基于以上结果,qHII-1-1,qHII-1-2,qHII-1-3而且qHII-2-1QTL-seq分析检测到的,也包含在传统QTL作图结果中,且与传统QTL作图结果基本一致。此外,在QTL-seq分析中,这些QTL的SNP指数在HTB池中接近1,在HSB池中接近0,常规QTL分析中的LOD值较高。因此,这些一致性qtl具有较高的可信度。通过QTL-seq分析,在7号染色体上也检测到8个耐热QTL,但在常规QTL作图中未检测到,故不考虑。
此外,qREC-1-3而且qCC-1-5与侧翼标记定位在1号染色体上相同的区域(81.64 ~ 86.37 Mb)SSR134-C01M86371而且qCC-1-5在所有常规QTL检测到的耐热QTL中,该QTL解释表型变异最多(16.48%),且具有正向加性效应(0.22),表明该QTL与耐热密切相关,值得进行基因挖掘。传统QTL作图和QTL-seq的对比结果证实了番茄耐热性调控的主要QTL的存在:qHII-1-1,qHII-1-2,qHII-1-3,qHII-2 -1,qCC-1-5(qREC-1-3).
HSR基因的转录组分析
为了研究番茄耐热性相关基因,在40°C高温胁迫下采集0 h(正常条件下作为对照)和4 h的样品,利用BGISEQ-500测序平台进行RNA-seq分析。测序平均产生6.79 Gb的数据,样本与参考基因组的平均比例为93.66%(附加文件)4:表S4)。共检测到23458个表达基因,其中已知基因22612个,预测新基因846个。共鉴定出14,639个新转录本,其中11,739个属于新的异构体,857个属于新的蛋白质编码转录本,其余2077个属于长链非编码RNA(附加文件)5:表S5)。
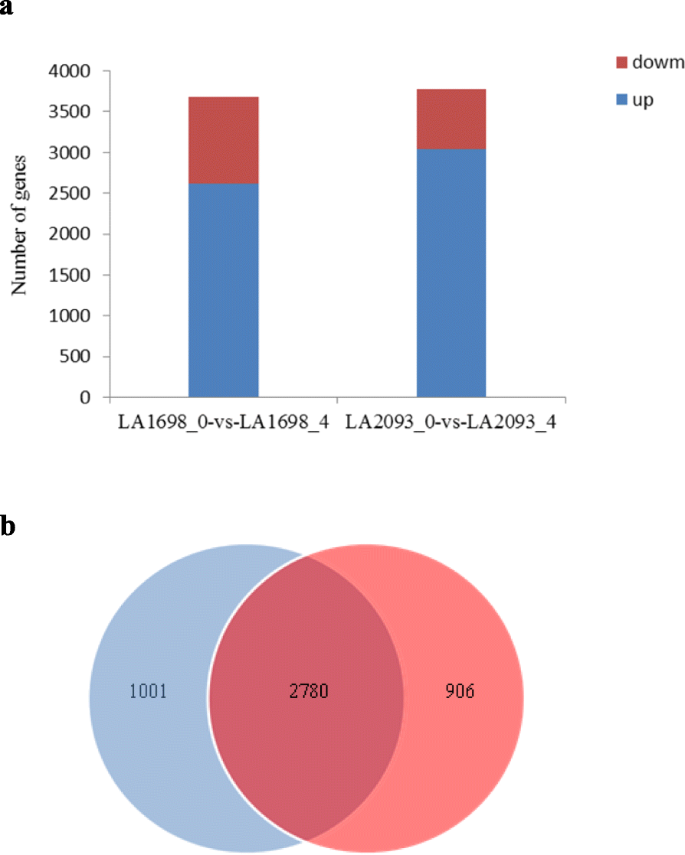
高温胁迫4 h后,LA1698和LA2093中分别鉴定出3686和3781个deg(折叠变化≥2或≤- 2,P值≤0.001)。LA1698有2616个基因上调,1070个基因下调,LA2093有3030个基因上调,751个基因下调。4a).亲本共表达2780个基因,其中906个基因仅在热敏亲本LA1698中表达,1001个基因仅在耐热基因型LA2093中表达(图2)。4b).差异表达基因见附加文件6:表S6,附加文件7:表S7和附加文件8:表S8。
为了验证RNA测序结果,在两个亲本之间选取了2个主要qtl中的耐热性下调基因和6个上调基因以及4个下调的deg进行qRT-PCR分析。的肌动蛋白基因作为内部对照。如附加文件所示15:图S4, qRT-PCR验证结果与RNA-seq结果的上调和下调趋势一致,说明RNA-seq结果可靠。
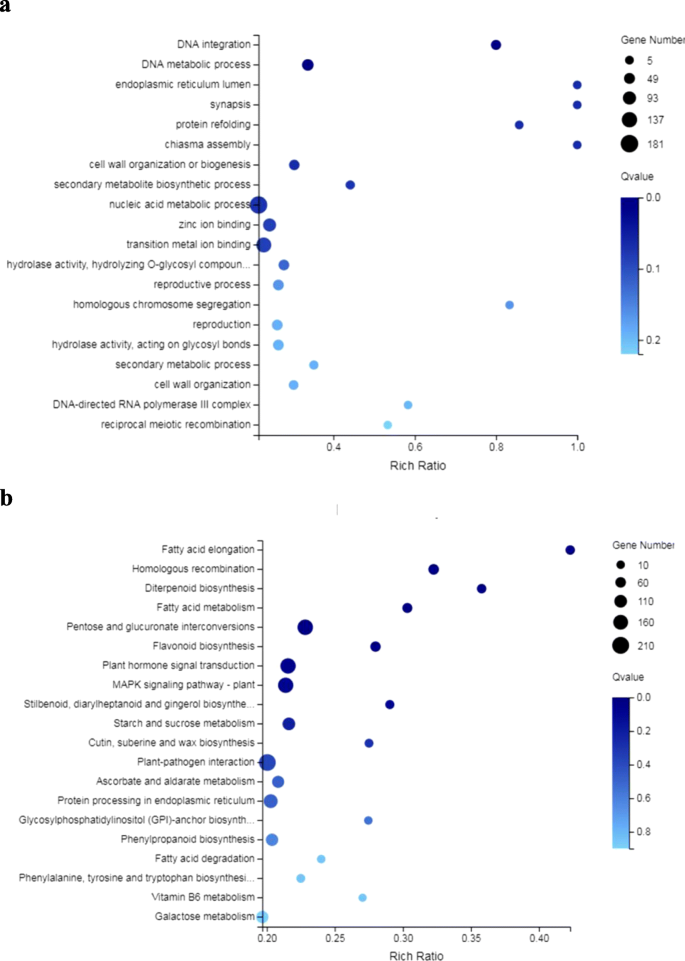
对差异表达基因(DEGs)进行功能注释,分析其基因本体论(GO),并将其映射到京都基因和基因组百科(KEGG)通路,评估其功能富集程度。GO功能标注表明,DEGs参与了一系列生物学过程,具体如下:生物调节,细胞过程,代谢过程而且对刺激的反应.deg也是细胞,细胞器而且膜.此外,deg还有以下活动:转录调控,催化,绑定而且转运体(附加文件16:图S5a)。GO富集分析表明,DEGs主要参与其中DNA整合,DNA代谢过程,核酸代谢过程,锌离子结合而且高温应力下过渡金属离子结合(无花果。5a). KEGG通路分析表明,涉及DEGs的主要通路如下:信号转导,复制和修复,碳水化合物代谢,环境适应(附加文件16:图S5b)。KEGG富集分析表明戊糖和葡萄糖醛酸酯相互转化而且植物激素信号转导,丝裂原活化蛋白激酶(MAPK)信号通路,淀粉和蔗糖代谢,脂肪酸代谢在高温胁迫下显著富集(图;5b)。
主要qtl中候选基因的鉴定
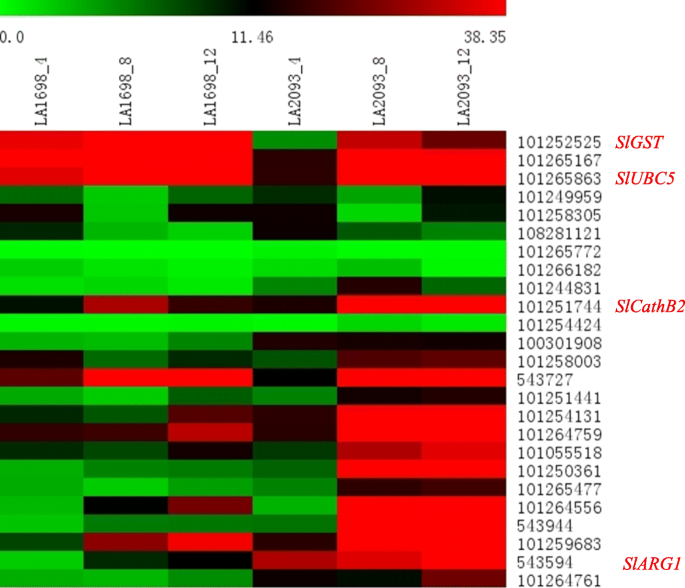
将传统QTL定位与QTL-seq分析结合RNA-seq分析结果进行比较,发现了调控番茄耐热性的候选基因,在主要QTL中共发现了91个基因qHII-1-1,qHII-1-2,qHII-1-3,qHII-2-1而且qCC-1-5(qREC-1-3)(附加文件9:表S9)。利用MapChart 2.3软件对主要QTL区域内的DEGs分布进行基因定位(图2)。3.).deg的数量最多,为43个qCC-1-5,只有一个差异表达基因在qHII-1-1.然后从91个deg中筛选出25个高表达水平的基因(选择标准为3个重复的样本的平均表达量> 5),通过qRT-PCR分析进一步筛选候选基因。将LA1698和LA2093样品经40℃高温处理4、8和12 h(以正常条件下的植株为对照)分离得到的RNA用25个基因引物进行qRT-PCR扩增。具体引物从数据库中获得(http://biodb.swu.edu.cn/qprimerdb)由Lu等人提供。[39],引物序列见附加文件10:表S10。结果显示,耐热LA2093基因型的大部分基因表达水平高于热敏LA1698基因型,且8 h和12 h的基因表达水平普遍高于4 h(图2)。6),表明基因表达随着高温处理时间的推移而增加。根据25个基因的qRT-PCR分析进行显著性差异检验(附加文件17:图S6),筛选出两个亲本在高温处理后4、8、12 h存在差异表达的基因,筛选出至少两个时间点存在差异表达的基因作为两个亲本后续生物学功能分析的候选基因。筛选到12个候选基因。结合GO和KEGG功能分析,进一步从12个候选基因中筛选出4个基因(附加文件11表S11):组织蛋白酶b样蛋白酶2(SlCathB2),谷胱甘肽s-转移酶zeta类亚型X1(SlGST),泛素偶联酶e2 - 23kda(SlUBC5),精氨酸酶1(SlARG1).对应的基因ID号为101251744年,101252525年,101265863年,543944年,分别。
对25个主要qtl的表达进行热图分析。顶部用颜色标度表示基因在不同时间和亲本的平均对数信号表达值,其中绿色、黑色和红色分别表示低、中、高表达水平。用于表达谱分析的样本和基因显示在热图的顶部和右侧。以亲本基因0 h表达量为对照肌动蛋白作为qRT-PCR分析的内源性对照。qRT-PCR法通过3个独立的生物重复和3个技术重复计算基因的表达水平。在亲本中检测到12个在高温胁迫下表现出明显差异的候选基因。4个基因(基因ID号分别为:101252525,101265863年,101251744年,543944年)结合GO和KEGG功能分析,从12个候选基因中进一步筛选:SlGST,SlUBC5,SlCathB2,SlARG1
讨论
通过与耐热性相关的多个生理指标对番茄幼苗耐热性进行综合评价
高温应激可引起一系列生理生化反应[40,41].例如,在40°C的高温应力下,叶片的REC增大。热敏系LA1698的REC高于耐热系LA2093。高温胁迫下光合参数的变化是植物耐热性的重要指标。类囊体片层中的光化学反应和叶绿体间质中的碳代谢已被证明是对高温胁迫的初始反应。因此,REC, CC和Fv/ F米能有效反映高温胁迫对细胞膜、叶绿体和PSII的损伤程度。在本研究中,与植物耐热性密切相关的三个生理指标(REC、CC和Fv/ F米)测定亲本和F2人口。结果表明,REC、CC和Fv/ F米高温处理24 h后,两亲本间差异显著,F2种群,与数量性状的预期一致。这些结果表明,REC、CC和Fv/ F米能有效反映番茄品种在人工模拟高胁迫下的耐热性。与田间自然高温相比,人工模拟高温胁迫的微环境可以被精确控制,后一种方法的性状识别更准确,适合苗期高温处理。以往的研究也表明,REC, CC和Fv/ F米人工模拟高温应力下的评价与野外夏季自然高温下的评价相似[14,42].
3项生理指标(REC、CC和Fv/ F米)用于绘制耐热qtl。其中7个qtl,包括与REC相关的qtl (qREC-1-1, qREC-1-2, qrec -3,而且qREC-2-1)及CC (qCC-1-4 qCC-1-5,而且qCC-2-2),在染色体1和2上共定位。REC和Fv/ F米与12号染色体上的一个QTL相关。1号染色体上一致的QTL,qCC-1-5(qREC-1-3),在所有检测到的耐热qtl中解释表型变异最多(16.48%),且具有正向加性效应(0.22),说明多指标综合应用可能有利于检测重要qtl [20.].某一指标的qtl作用可能较小,但与其他指标结合后,qtl的作用可能更显著,其背后的基因可能发挥多效性作用。这些重要的qtl或基因可以快速有效地用于育种,从而缩短育种过程。研究中使用的三个与耐热有关的生理指标代表了不同的生理过程;但3个指标均检测到一致的qtl,这可能是由于多效性,也可能是指标间正相关的结果。这些生理指标可能具有相同或相似的关键调控基因或响应高温应激的途径。以往的研究利用番茄和其他作物的幼苗生理指标检测了大量耐热性qtl.徐等。[19]通过测定番茄质膜透性,获得了一个与番茄耐热性相关的SSR和RAPD标记,分别位于第3和第7连锁基团上。Talukder等人。[43]在小麦热胁迫后用CC定位了8个qtl。布萨尔等人[44]利用叶绿素含量和叶绿素荧光参数,在重组自交系(RIL)群体中分别鉴定了17和23个小麦耐热性相关qtl。这些结果表明,利用目标性状相关的生理指标进行qtl定位是可行的。包括耐热性在内的大部分性状是由多基因控制的复杂数量性状,受多种因素的影响。单一指标评价数量性状的局限性是主要的;因此,采用多种合适的生理指标有助于综合鉴定耐热性状和qtl。
传统QTL作图与QTL-seq相结合,可高效快速地识别与耐热性相关的主要QTL
高通量全基因组QTL-seq策略已应用于多种作物的主要QTL鉴定,但在番茄耐热QTL定位中的应用尚未见报道。与传统的精细定位方法相比,利用QTL-seq方法检测目标性状的主要qtl耗时短、工作量小。然而,通过QTL-seq很难确定解释大量表型变异的主要qtl,特别是数量农艺性状的qtl。27].因此,为了高效、准确地检测番茄苗期耐热性相关QTL,本研究采用传统QTL作图和QTL-seq技术,以F为序列,对番茄耐热性相关的主要QTL进行了鉴定2人口的映射。在染色体1、2、3、5、7、9和12上共检测到24个耐热qtl。Grilli等人[18]和徐等。[21]在番茄1号染色体和7号染色体上分别检测到耐热qtl。徐等。[19]和林等人。[20.]还鉴定出了其他一些负责番茄耐热性的qtl,但所鉴定的标记和连锁基团并没有固定在染色体上,阻碍了这些发现的更广泛应用。在我们的研究中,qHII-1-1(23.8 - -25.23 Mb),qHII-1-2(26.83-28.00 Mb)及qHII-1-3(62.33-63.52 Mb),经QTL-seq鉴定qREC-1-1(24.10 ~ 80.54 Mb)的QTL。也就是说,利用QTL-seq技术将一个传统QTL作图检测到的区域较大的QTL细分为三个较小的QTL。QTL-seq鉴定的qtl基因组间隔为1 ~ 2 Mb。这反映了QTL-seq相对于传统QTL作图在高分辨率基因组作图以及随后对包含主要性状相关QTL的目标候选基因组区域进行精细作图方面的潜在优势。我们的QTL-seq分析检测到一个QTL,qHII-2-1在与QTL重叠的第2染色体上有38.98 ~ 40.85 MbqCC-2-2(39.71 ~ 40.00 Mb)。在传统的QTL分析中,qREC-1-3而且qCC-1-5被映射到相同的区域(SSR134-C01M86371)在染色体1上,以及qCC-1-5在所有检测到的耐热qtl中,解释了最多的表型变异(16.48%),并具有正向加性效应(0.22)。这些重叠的qtl可能代表一个或多个主要的耐热qtl,这些qtl具有潜在的应用价值。这表明了传统QTL映射方法与QTL-seq方法的一致性。当然,两种QTL作图方法检测到的部分QTL位于不同的区域。例如,QTL-seq在7号染色体上发现了8个QTL,而传统的QTL作图没有检测到。同样,在第3、5、9和12号染色体上检测到5个耐热相关的qtl,但在QTL-seq分析中未观察到这一结果。这种差异可能不仅是由于两种方法具有特异性和互补性,而且可能是由于QTL定位中生理指标和综合形态指标的使用存在差异。通过结合表型和生理指标、传统QTL分析和新的QTL-seq策略,共检测到5个主要QTL:qHII-1-1, qHII-1-2, qHII-1-3,qHII-2-1而且qCC-1-5(qREC-1-3).qHII-1-1,qHII-1-2而且qHII-1-3分别位于1号染色体的1.43、1.17和1.19 Mb之间,而qHII-2-1位于2号染色体上1.87 Mb的区间。常规QTL定位与QTL-seq定位结果一致。虽然qCC-1-5(qREC-1-3)在QTL-seq分析中未检测到,qCC-1-5而且qREC-1-3常规QTL作图根据不同生理指标定位在同一位置;表型变异解释(16.48%)和正向加性效应(0.22)qCC-1-5结果表明,传统QTL作图与QTL-seq技术相结合的策略能够快速、高效地检测出主要的QTL相关性状,特别是遗传基础复杂的数量性状QTL。两种映射方法可以相互补充、相互验证,充分挖掘目标性状的qtl。
RNA-seq鉴定了主要qtl中的候选基因
虽然QTL作图与RNA测序相结合的策略已应用于油菜、小麦、辣椒等作物的相关基因鉴定[34,35,36],该策略在揭示番茄HSR基因方面的应用尚未见报道。为了在主要QTL区域内识别候选基因,我们对LA1698和LA2093进行了RNA-seq,揭示了一些可能与番茄耐热性有关的关键基因。与热敏基因型LA1698相比,耐热亲本LA2093上调基因多,下调基因少,说明耐热基因型对高温胁迫的响应主要基于基因的正向调控,而热敏基因型对高温胁迫的响应主要基于基因的下调。在亲本中共鉴定出2780个共表达基因,反映了栽培番茄和醋栗番茄共有的HSR基因。红醋栗番茄特异耐热基因数量高于栽培番茄,说明野生红醋栗番茄比栽培番茄具有更多的HSR基因,这些基因可能部分解释了红醋栗番茄与栽培番茄耐热分子差异。KEGG富集分析表明戊糖和葡萄糖醛酸酯相互转化而且植物激素信号转导,MAPK信号通路,淀粉和蔗糖代谢,脂肪酸代谢在高温胁迫下显著富集,已被证实与高温下的高温应力响应有关,且植物激素信号转导和MAPK信号通路都与高温应力信号有关[45,46,47,48].
我们的实验通过RNA-seq分析发现了25个在主要耐热区域高表达的deg,并通过qRT-PCR和生物学功能分析进一步筛选了25个deg。最后,我们发现了4个与耐热性相关的候选基因,分别是:SlCathB2,SlGST,SlUBC5而且SlARG1.SlCathB2位于qHII-2-1,而其余3个基因是在qCC-1-5这表明QTL作图与RNA-seq相结合比传统的精细作图过程更有利于快速识别主要QTL内与目标性状相关的候选基因,为目标基因的快速作图提供了一种方法。此外,之前的一项研究表明,使用这种策略可以生成高分辨率的基因图谱[49].利用主要qtl的侧翼标记进行基因工程和标记辅助选择育种,可快速提高作物的耐热性。
本研究鉴定了4个HSR候选基因SlCathB2(组织蛋白酶b样蛋白酶2)属于肽酶C1A家族,具有肽酶活性。目前,大多数研究SlCathB2都是在动物身上进行的,三CathB同源基因(AtCathB1,AtCathB2而且AtCathB3)已在该模式植物中被鉴定出来拟南芥[50].蔡等人。51的下调表明AtCathB2减少活性氧(ROS)积累和内质网应激诱导的PCD (ERSID)响应非生物胁迫。SlGST(谷胱甘肽s-转移酶zeta类异构体X1),属于谷胱甘肽转移酶家族,已被发现在降低外来物质毒性、跨膜转运、保护细胞免受氧化损伤、维持代谢和应对各种非生物应激等方面发挥重要作用[52].当植物受到胁迫,如高盐,干旱,和重金属,表达销售税增强,可有效去除活性氧,保护植物细胞膜结构和蛋白质活性[53].SlUBC5(泛素偶联酶e2 - 23kda)是泛素连接酶超家族的一部分,具有将泛素分子转移到靶蛋白的功能。泛素化在DNA损伤修复、转录调控和细胞死亡等生物学过程中具有重要作用[54].泛素结合酶E2在应对生物压力方面起着重要作用[55]、渗透胁迫[56]、干旱胁迫[57]和盐胁迫[58].SlARG1(精氨酸酶1)属于脲酶基因家族,具有与Mn离子结合的特殊位点。到目前为止,大多数研究都是关于两者之间的关系精氨酸酶和植物胁迫反应,其中大多数研究集中在多胺和一氧化氮(NO)代谢途径的调控[59].多胺和NO作为信号分子调控植物发育及一系列生物和非生物胁迫反应[60,61),而精氨酸酶通过调控上游多胺和NO代谢途径的反应,控制植物体内多胺和NO含量,间接调控植物发育及对生物和非生物胁迫的响应[62].Siddappa等人。[63]发现香菜的精氨酸含量在生物和非生物胁迫下显著增加。
结论
综上所述,本研究表明,将传统QTL作图与利用不同生理和表型指标的QTL-seq分析相结合,可以快速、高效、准确地检测出目标性状的主要QTL,将QTL作图与RNA-seq数据相结合,可以快速识别出复杂性状的主要QTL中的候选基因。利用传统的QTL作图、QTL-seq分析和RNA-seq,采用QTL作图和候选基因鉴定的策略,可以取代精细作图的过程,大大简化QTL作图和目标基因鉴定的过程,为缩短育种过程、提高育种效率奠定基础。本研究结合传统QTL作图和QTL-seq分析,首次检测到5个控制番茄耐热性的主要QTL,并将这些方法与RNA-seq结合,得到4个候选基因(SlCathB2 SlGST slbc5而且SlARG1)在主要qtl中确定了耐热性。一旦功能验证,候选基因可以作为潜在的候选基因进行标记辅助遗传改良,以提高番茄的耐热性和产量。
方法
绘制种群的植物材料和构造
在此基础上,利用Fv/ F米[37]、易受热的栽培番茄(Lycopersicon esculentum)基因型LA1698和耐热醋栗番茄(Lycopersicon pimpinellifolium)基因型为LA2093,高温应激反应对比明显。本研究中使用的两个品系的种子均来自番茄遗传资源中心(TGRC, University of California, CA, US)。F2种群由单个自花授粉的F1由LA1698(母本)和LA2093(父本)杂交而成。传统QTL作图和QTL-seq分析所使用的群体分别为144和200 F2苗,分别。
常规QTL作图
采用传统的QTL作图方法,确定了番茄耐热相关生理性状的QTL数量和位置。两个亲本系和F1和F2本研究采用人群。种子发芽前,在水浴中用50-55°C的热水处理30分钟,并不断搅拌,以减少病毒污染。水冷却后将种子浸泡3小时,用去离子水清洗3次,然后用20 mL去离子水放入培养皿中7-8小时。随后,种子在28°C的生长室中发芽。种子萌发后,用商业有机培养基(珍珠岩:蛭石:绿化土= 1:1:2,中国镇江兴农有机肥公司)播种于72孔的栓子中,置于光照培养箱(东南仪器,RDN-560E-4,中国宁波),昼夜温度为25°C,夜间温度为18°C,光周期为12 h/12 h(昼夜),360 μmol m−2年代−1光合有效辐射和75%的相对湿度。种植后15天,亲本,F1(每株12株)和个体F2将生长均匀的幼苗(共144株)移栽到直径11 cm ×高9 cm的营养碗中,碗中填充相同的商业有机培养基。移栽的幼苗在相同的生长室中,条件相同。当幼苗有5片真叶和1片心叶时(移栽后12天),将生长室温度提高到昼夜40℃,其他参数保持不变。处理24 h后,采集各植株叶片样品,分析其相对电导率(REC)、叶绿素含量(CC)和最大光化学量子效率(Fv/ F米)。父结点和F的所有参数1植物鉴定分为3个生物重复,每个重复4株幼苗;F2确定单株植物的种群,每株植物测量三次。对于每个参数,收集3个重复的数据,并使用平均值进行QTL分析。取每株顶部数起的第2、3、4片叶片,测定REC、CC、Fv/ Fm。相对电导率的测定基于Washburn方法[64],按Haboudane等方法测定叶绿素含量[65],测量Fv/ F米遵循Bredahl等人的方案。[66].
使用DNA提取试剂盒(Takara,上海,中国)从幼苗顶部附近的幼叶组织中提取所有测试幼苗的基因组DNA。SSR和InDel引物由四普晶生物公司(北京,中国)商业合成,从Sol基因组网络(胡志明市,http://solgenomics.net/)数据库、番茄SBM及Marker数据库(http://www.kazusa.or.jp/tomato/)或以前出版的刊物[67,68].利用QTL IciMapping 3.0构建遗传图谱并进行QTL定位。利用从F2QTL分析采用ICIM (Inclusive Composite Interval Mapping)程序(http://www.isbreeding.net), LOD阈值≥2.5。
QTL-seq分析
本实验采用QTL-seq技术检测热损伤指数qtl。用于定位和鉴定HII的个体和亲本基因型以上述相同的方式培养。当幼苗长出5片真叶和1片心叶时(移栽后12 d), 200 F2选择生长状态相同的亲本基因型的个体,F2个体编号从1到200,每株植株顶部的第4片叶子被收集并储存在−80°C超低温冰箱中,用于后续亲本和极端池QTL-seq分析。然后,在其他参数不变的情况下,将生长室温度提高到白天40℃/晚上40℃。治疗48 h后测定HII。HII的测定参照Yin等方法。[69].
在QTL-seq研究中,假设10%的群体表现出极端性状,根据单株选择率筛选出耐热和热敏作图个体各20个,代表HII正态频率分布曲线的两个极端端点。然后根据相应数量选取热处理前保存的叶片样品。20个极耐热和20个极热敏F2单株及亲本送往明治生物公司(上海,中国)http://www.majorbio.com/)进行QTL-seq分析,亲本测序深度为10倍,两个极端池的测序深度为20倍。从各20个耐热和热敏测标个体的叶片中分离出的高质量基因组DNA按等比(量)聚合,分别构成一个HTB(耐热散装)样品和一个HSB(热敏散装)样品。使用Illumina HiSeq™平台构建Illumina PE150测序文库(读取长度:300 bp)并单独测序。在>中,95%的样本中Q-score为30的原始数据被认为是高质量的。从两个bulk中筛选得到的高质量的干净数据和亲本基因型与SL2.50(https://www.ncbi.nlm.nih.gov/assembly/GCF_000188115.3)使用Burrows-Wheeler比对(BWA)工具的参考基因组[70].然后,我们获得序列的位置属性,即BAM文件。关贸总协定最佳实践流程[38]修改BAM文件,检测SNP和小InDel标记。选择阅读深度为> 2x的分子标记进行BSA相关性分析,采用滑动窗口法计算全基因组SNP指数以剔除假阳性qtl [71].
SNP指数和∆(SNP指数),遵循Illa等人推荐的参数。[72],用于鉴定与番茄耐热性相关的候选基因组区域。SNP指数是含有与参考序列不同SNP的reads的比例,通过计算HTB和HSB样本的SNP指数差得到Δ(SNP指数)。基于包含来自LA1698和LA2093基因组片段的整个短读,SNP指数被测量为“0”或“1”。使用滑动窗口分析计算了12个番茄染色体上snp的平均ΔSNP指数,窗口大小为1 mb,增量为10 kb。绘制HTB池和HSB池的SNP-指数图,以及相应的Δ(SNP指数)图,以生成SNP指数图。在无qtl的零假设下,我们计算了读深度为99%的Δ(SNP指数)的统计置信区间。
RNA-seq分析
为了鉴定高温胁迫下番茄的HSR基因,对热敏(LA1698)和耐热(LA2093)植株进行了RNA-seq分析。亲本基因型按上述方法培养至5片真叶和1片心叶(移栽后12天)。选择生长均匀的植株(5片真叶和1片心叶)进行40°C日间/40°C夜间高温胁迫处理,其他参数保持不变。从每个植株顶部位置计数的第2和第3片叶子,经过0、1、4、8、12和24 h的高温处理后,快速收集并保存在−80℃下。第二叶通过测定热相关生理指标确定转录组测序的最佳时间点,第三叶用于RNA-seq和实时定量PCR (qRT-PCR)。每个时间点采用3个生物重复。为减少个体差异造成的抽样误差,每个重复取5个混合样本。同一株植物不用于重复采样。通过测定和分析两个亲本各时间点与耐热性相关的生理指标(附加文件)18:图S7),我们发现抗坏血酸还原酶(APX)、谷胱甘肽还原酶(GR)、过氧化物酶(POD)、超氧化物歧化酶(SOD)、可溶性蛋白水平和PSII最大光化学量子效率(Fv/ F米而过氧化氢(H2O2)和丙二醛(MDA)含量在高温处理4 h后均低于其他时间点。因此,对处理0 h(正常条件下作为对照的植物)和4 h的样品进行测序。每个时间点使用3个生物重复,共计12个样本用于测序。
RNA-seq由华大基因生物有限公司(武汉,中国)完成。http://www.genomics.cn/).从亲本叶片中提取RNA,用合格的RNA样本构建cDNA文库。各cDNA文库测序在BGISEQ-500平台上进行。用SOAPnuke软件从测序后获得的原始读数中过滤低质量、有联合污染或未知碱基(N)含量高的序列[73].所有过滤干净的读取都映射到SL2.50(https://www.ncbi.nlm.nih.gov/assembly/GCF_000188115.3)番茄参考基因组HISAT;然后,进行新的转录本预测、SNP和InDel鉴定以及基因检测的差异剪接[74].将具有编码蛋白潜能的新转录本加入到参比序列中,形成完整的参比序列,利用RSEM计算每个样本的基因表达量[75].最后,将不同样本间差异表达基因检测为折叠变化≥2或≤- 2,aP-value≤0.001 [76],并通过基因本体论(GO)和京都基因与基因组百科全书(KEGG)数据库进一步分析这些deg,以评估其功能富集程度。
实时定量PCR
对用于RNA-seq实验的三个重复样本进行qRT-PCR,评估RNA-seq结果的质量,并对高温处理0、4、8或12 h的样本进行进一步筛选候选基因。所有试验设3个生物重复和3个技术重复。采用TRIzol试剂(Invitrogen, CA, USA)提取总RNA,采用ABI(中国上海)SYBR®Select Master Mix(2倍)试剂盒和Eppendorf real-time PCR仪(德国汉堡)进行qRT-PCR分析。
数据和材料的可用性
在这项研究中产生或分析的所有数据都包括在这篇发表的文章及其补充信息文件中。本研究的所有RNA测序数据已提交给NCBI序列读取档案(SRA),登录号为SAMN12591987 (https://www.ncbi.nlm.nih.gov/biosample/12591987), samn12591988 (https://www.ncbi.nlm.nih.gov/biosample/12591988), samn12591989 (https://www.ncbi.nlm.nih.gov/biosample/12591989),以及SAMN12591990 (https://www.ncbi.nlm.nih.gov/biosample/12591990).
缩写
- APX型:
-
抗坏血酸还原酶
- 答:
-
叶绿素含量
- 度:
-
差异表达基因
- Fv/ F米:
-
最大光化学量子效率
- 走:
-
基因本体论
- 格:
-
谷胱甘肽还原酶
- H2O2:
-
过氧化氢
- 他:
-
热损伤指数
- HSB:
-
热敏性散装
- 高铁:
-
高温逆境应答
- HTB:
-
的耐热散装
- ICIM:
-
包含复合区间映射
- KEGG:
-
京都基因与基因组百科全书
- 格林:
-
连锁群
- MAPK:
-
丝裂原激活蛋白激酶
- MDA:
-
丙二醛
- 门店:
-
新一代测序
- 没有:
-
一氧化氮
- 圆荚体:
-
过氧化物酶
- PSII:
-
光系统II
- 存在:
-
实时定量PCR
- QTL:
-
数量性状位点
- QTL-seq:
-
数量性状位点序列
- 矩形:
-
相对导电性
- RNA-seq:
-
RNA序列
- RT:
-
逆转录酶
- SlARG1:
-
精氨酸酶1
- SlCathB2:
-
组织蛋白酶b样蛋白酶2
- SlGST:
-
谷胱甘肽s-转移酶zeta类亚型X1
- SlUBC5:
-
泛素偶联酶e2 - 23kda
- SOD:
-
超氧化物歧化酶
- TGRC:
-
番茄遗传资源中心
参考文献
- 1.
卡梅乔D, Rodríguez P,莫拉莱斯MA,戴尔阿米科JM,托雷西拉斯A. Alarcã3.N JJ。高温对两个不同热易感性番茄品种光合活性的影响。中国植物科学,2005;
- 2.
王志刚,王志刚,王志刚。植物耐热性研究进展。环境科学学报,2007;
- 3.
Martin MM, Olesen JE, Porter JR.丹麦冬小麦适应气候变化的基因型、环境和管理(GxExM)分析。农业气象。2014;187:1-13。
- 4.
大滨N,佐藤H, Shinozaki K,山口SK.植物高温胁迫响应的转录调控网络。植物科学进展,2017;22:53。
- 5.
植物育种综述。入:编辑Janick J。改良菜豆品质和种子品质的育种蛋白质59,卷1。霍博肯:威利;2011.59 - 102页。
- 6.
Cobb JN, Declerck G, Greenberg A, Clark R, McCouch S.下一代表型:增强我们对基因型-表型关系及其与作物改良相关性的理解的要求和策略。理论应用,2013;126:867-87。
- 7.
周晓阳,罗瑾,李建勇,李文华,吴海波。耐热性丝瓜Acutangula幼苗及其对高温胁迫的生理反应。J Trop Subtrop机器人(中文)。2017; 25:357 - 69。
- 8.
Siddiqui MH, Alamri SA, Al-Khaishany MYY, Al-Qutami MA, Ali HM, Khan MN。一氧化氮和钙诱导番茄生理生化变化(茄属植物lycopersicuml)植物在高温胁迫下。环境科学学报。2017;26:1663-72。
- 9.
周睿,孔林,吴震,Rosenqvist E,王勇,赵磊。番茄在干旱、高温及其组合下的生理响应及其恢复。物理植物。2018;165:144-54。
- 10.
李文杰,李文杰,李文杰,等。番茄耐热性状的遗传分析(茄属植物lycopersicuml .)。国际植物学报2017;30:397-402。
- 11.
吴立军,张建峰。高温胁迫对番茄幼苗生长及生理指标的影响北霍提语(汉语)。2013; 23:19-22。
- 12.
闵少林,向志伟,雅玲,刘玉珍,韩亚平,广伟。6个番茄品种耐热性的鉴定。北霍提语(汉语)。2012; 21:5-7。
- 13.
Rmond PA, Bjortman O, Stashelin LA。叶绿体膜上超分子复合物的解离:光合器官热损伤的一种表现。生物化学学报,1980;6(3):433 - 442。
- 14.
许娟,李丽娟,李丽娟。高温胁迫对番茄营养和繁殖性能的影响及性状相关性分析(茄属植物lycopersicum).Euphytica。2017;213:156。
- 15.
张志刚,张志刚,张志刚。番茄部分基因型的生理反应(Lycopersicon esculentuml)的高温应力。中国农业科学,2013;9:723-32。
- 16.
高温下番茄的生长、开花和结实。农业科学,1968;16:71-6。
- 17.
Poudyal D, Rosenqvist E, Ottosen CO.用Fv/ F米在田间热胁迫下保持高产量。植物功能生物学,2018;46:44-55。
- 18.
Grilli GVG, Braz LT, Lemos EGM。番茄耐坐果性的AFLP标记QTL鉴定。作物育种与应用。2007;7:234-41。
- 19.
徐晓霞,王德民,康春春,李建峰,等。植物学报(中文)。2008; 35:47-52。
- 20.
林克华,魏丽丽,陈红梅,肖峰。高温条件下影响番茄果实相关性状的数量性状位点。Euphytica。2010;174:119-35。
- 21.
徐娟,Driedonks N, Rutten MJM, Vriezen WH, Boer GJD, Rieu I.番茄生殖性状耐热性的数量性状位点定位(茄属植物lycopersicum).Mol Breed. 2017;37:58。
- 22.
李丽娟,王丽娟,王丽娟,王丽娟。野生番茄生殖耐热性的自然变异研究。Euphytica。2018;214:67。
- 23.
Marcela VZ, Vosman B, Geest HVD, Bovy A, Heusden AWV。基因组学时代的番茄育种:来自SNP阵列的见解。BMC Genomics. 2013;14:354。
- 24.
秦毅斌,程鹏,程玉春,冯勇,黄东,黄天祥,宋新军,应建忠。QTL-seq利用近等基因法鉴定了水稻籽粒长度和重量的一个主要QTL2人口。水稻科学,2018;25:21 - 31。
- 25.
陆海峰,林涛,Joël K,王帅,齐俊杰,周强,孙俊杰,张志华,翁永强。QTL-seq鉴定了一个位于黄瓜开花位点附近的早花QTL。理论应用,2014;127:1491。
- 26.
Rishi S, Upadhyaya HD, Rajendra K, Anurag D, Udita B, Shimray PW, Tripathi S, Bharadwaj C, Tyagi AK, Parida SK.多重QTL-seq策略描述了鹰嘴豆开花时间的潜在基因组位点。植物科学,2017;8:1105。
- 27.
魏求出。黄瓜果实长度QTL定位及候选基因筛选。毕业论文:南京农业大学;2016.
- 28.
Das S, Upadhyaya HD, Bajaj D, Kujur A, Badoni S, Laxmi KV, Tripathi S, Gowda CL, Sharma S, Singh S, Tyagi AK, Parida SK.利用QTL-seq快速描述鹰嘴豆主要性状相关QTL的潜在候选基因。DNA Res. 2015; 22:193-203。
- 29.
张旭,王伟,郭宁,张勇,邢慧。利用QTL-seq和连锁图谱精细定位野生大豆大株高等位基因。BMC基因组学。2018;19:226。
- 30.
杨XH。番茄黄曲叶病毒抗性基因的精细定位Ty-2番茄的第11号染色体(茄属植物lycopersicum)和不同抗性基因的影响。毕业论文:中国农业科学院;2012.
- 31.
肖宁。东乡野生稻苗期主要耐寒QTL的精细定位与克隆。毕业论文:扬州大学;2015.
- 32.
王YY。开花时间基因的定位克隆QNE1并分析其与E1通路相关的功能机制。毕业论文:中国科学院大学(已发表);2018.
- 33.
卢荣荣,周春生,宋国良。高通量测序技术和正向遗传学方法在基因定位中的研究进展。Hereditas(中国)。2015; 37:765 - 76。
- 34.
叶娟。油菜荚果数变异的QTL定位与RNA测序综合分析(芸苔属植物显著l .)。毕业论文:中国农业科学院;2016.
- 35.
徐旭,李强,马震,范军,周勇。白粉病抗性基因的分子定位pmsgd中国的小麦长种shangeda使用RNA-seq和大量分离分析。Mol Breed. 2018;38:23。
- 36.
朴敏,李俊华,韩坤,张松,韩俊,林俊华,郑继伟,姜bc。辣椒果皮中辣椒素生物合成的主要QTL和候选基因辣椒通过QTL-seq和RNA-seq揭示。理论应用,2018;132:515-29。
- 37.
周瑞,余旭,Kjær KH, Rosenqvist E, Ottosen C,吴哲。番茄高温胁迫下Fv/Fm基因型的筛选与验证,揭示耐高温生理机制。环境科学技术。2015;18(1):1 - 11。
- 38.
McKenna A, Hanna M, Banks E, Sivachenko A, Cibulskis K, Kernytsky A, Garimella K, Altshuler D, Gabriel S, Daly M, DePristo MA。基因组分析工具包:用于分析下一代DNA测序数据的地图还原框架。细胞基因基因组,2010;20:1297-303。
- 39.
卢坤,李涛,何涛,常伟,张锐,刘敏,于敏,范勇,马娟,孙伟,曲春,刘玲,李楠,梁颖,王锐,钱伟,唐志,徐旭,雷斌,张凯,李娟。qPrimerDB: 147种生物基于热力学的基因特异性qPCR引物数据库。核酸研究,2018;46:D1229-36。
- 40.
Jha UC, Bohra A, Singh NP。作物高温胁迫的性质、影响及提高耐热性的综合育种策略。中国植物育种学报。2014;33(3):679 - 701。
- 41.
德里东克斯N, Rieu I, Vriezen WH。植物在营养和生殖阶段耐热性的选育。植物再生,2016;29:1-13。
- 42.
罗茜拉,苏贝迪,杜维勒,夏尔马。光化学效率和SPAD值作为小麦斑点病和末端高温胁迫组合选择的间接选择标准。中国植物学报。2010;38(4):344 - 344。
- 43.
Talukder SK, Babar MA, Vijayalakshmi K, Poland J, Prasad PVV, Bowden R, Fritz A.小麦耐热性相关性状QTL定位(小麦l .)。BMC Genet 2014; 15:1-13。
- 44.
Bhusal N, Sharma P, Sareen S, Sarial AK。高温胁迫下小麦叶绿素含量和叶绿素荧光的qtl定位生物植物,2018;62:721-31。
- 45.
基于通路和网络的候选基因分析揭示高粱的串扰和特异性(高粱二色的(l)Moench)对干旱及其共存压力的反应。前热内。2018;9:557。
- 46.
在生育发育阶段ABA代谢和转运对低温和高温胁迫的转录反应拟南芥.中国植物科学,2012;39(2):344 - 344。
- 47.
赵超,王鹏,司涛,徐春春,王林,扎耶德,于珍,朱勇,董杰,陶华,朱建科。映射激酶级联通过调节调节冷反应ice1蛋白质的稳定性。Dev Cell. 2017;43:618。
- 48.
丁红,何俊,吴勇,吴旭,葛超,王勇,钟山,Peiter E,梁娟,徐伟。番茄丝裂原活化蛋白激酶slmpk1是作为一个负调节高温应力响应。植物物理,2018。https://doi.org/10.1104/pp.18.00067.
- 49.
Ramirez-Gonzalez RH, Segovia V, Bird N, Fenwick P, Holdgate S, Berry S, Jack P, Caccamo M, Uauy C. RNA-Seq批量分离分析可用于六倍体小麦育种的高分辨率遗传标记的鉴定。中国生物技术学报(英文版);2015;
- 50.
Andreas P, Ana C, Drazen P, Teresa R, Melanie P, Bettina M, Daniel M, Lisa N, Martin LB, Patrick G, Oliver S, Chris O, Marko N, Lukas M拟南芥是具有离散的内肽酶和羧二肽酶活性的密切相关的酶。生物化学,2018。https://doi.org/10.1515/hsz.2018.0186.
- 51.
蔡玉梅,于军,葛艳,mionov A, Gallois P.两种caspase-3样活性蛋白酶组织蛋白酶B和蛋白酶体拮抗er应激诱导的程序性细胞死亡拟南芥.新植物,2017;218:1143-55。
- 52.
康明斯I, Dixon DP, Freitag PS, Skipsey M, Edwards R.植物谷胱甘肽转移酶在异种生物解毒中的多重作用。药物Metab Rev. 2011;43:15。
- 53.
邢欣。番茄谷胱甘肽s转移酶基因的合成(Lycopersicon esculentumM.)和基因功能。毕业论文:山西农业大学;2015.
- 54.
张YQ。E3泛素连接酶的功能解剖SINA1在番茄。毕业论文:华中农业大学;2017.
- 55.
Jeon EH, Pak JH, Kim MJ, Kim HJ, Shin shh, Lee JH, Kim DH, Oh JS, Oh BJ, Jung HW, Chung YS。野生水稻泛素偶联酶基因的异位表达,Ogubc1,可抵抗紫外线b辐射及葡萄球菌感染拟南芥.生物物理学报。2012;427:9 9 - 14。
- 56.
C恩淑,张卫克,AS贤,池sk,宋秀春,李志杰。过度的vrubc1,一种绿豆E2泛素偶联酶,增强植物的渗透胁迫耐受性拟南芥.科学通报。2013;8:e66056。
- 57.
周佳,常瑞珍,邱丽娟。大豆泛素偶联酶基因的过表达GmUBC2通过调节非生物胁迫响应基因表达,增强植物的耐旱和耐盐性拟南芥.植物分子生物学杂志,2010;
- 58.
崔峰,刘玲,赵强,张震,李强,林波,吴勇,唐松,谢强。拟南芥泛素结合酶UBC32是油菜素类固醇介导的盐胁迫耐受性中起作用的erad成分。《植物科学》2012;24:23 - 44。
- 59.
张XX。精氨酸酶基因功能分析(AtArgah1, AtArgah2)以及对盐胁迫和氮源的反应。毕业论文:东北林业大学;2014.
- 60.
Tun NN, Catarina TS, Begum T, Silveira V, Handro W, Segal ELF, Scherer GEF。多胺可诱导一氧化氮(NO)的快速生物合成拟南芥幼苗。植物细胞物理学报。2006;47:346-54。
- 61.
杨华,金海杰,陈辉,陆勇,陆晓霞,王成昌,周碧。活性氧和一氧化氮诱导残叶衰老及相关基因的表达谱荔枝.Hortic Res. 2018;5:23。
- 62.
Brauc S, Vooght ED, Claeys M, Geuns JMC,属M, Höfte G. Angenon。精氨酸酶在拟南芥影响对灰霉病的防御反应。植物学报。2012;14:39-45。
- 63.
Siddappa S, Basrur V, Vittal RR, Marathe GK。香菜中一种非典型植物l-精氨酸酶的生化和功能特征(Coriandrum sativaml .)。中国生物医学杂志。2018;18:844 - 56。
- 64.
沃什伯恩电子战。电解电导率的测量。一、电导电池的设计理论。化学学报2002;11:2431-60。
- 65.
王晓明,王晓明,张晓明,王晓明。基于植被指数的植物叶绿素含量预测方法及其在精准农业中的应用。遥感与环境学报,2002;
- 66.
Bredahl L, Ropoulsen H, Mikkelsen TN.降低环境UV-B辐射在高北极地区增加Fv/ F米并降低气孔导度和内部CO2浓度在Salix arctica。南极北极阿尔卑斯山Res. 2004; 36:364-9。
- 67.
潘颖。油菜萌发期和苗期耐盐QTL定位茄属植物pimpinellifolium利用AB-QTL分析和开发耐盐种质。毕业论文:中国农业科学院;2009.
- 68.
通VG。番茄InDel标记的开发及2.2号房室号的精细定位。毕业论文:中国农业科学院;2016.
- 69.
尹小刚,罗庆霞,王文琴,张勇,潘红华,杨庆峰,尹世林。番茄耐热性鉴定方法的研究。西南农科院(中文)。2001; 14:62-5。
- 70.
李华,杜斌。基于钻穴-轮变换的快速精确短读对准。生物信息学。2009;25:1754-60。
- 71.
Abe A, Kosugi S, Yoshida K, Natsume S, Takagi H, Kanzaki H, Matsumura H, Yoshida K, Mitsuoka C, Tamiru M, Innan H, Cano L, Kamoun S, Terauchi R.利用Mutmap测序水稻的农学重要位点。生物技术学报。2012;30:174-8。
- 72.
Illa BE, Houten JV, Huang Z, Knaap EVD。利用QTL-seq快速可靠地鉴定番茄果实重量和室数位点。应用理论,2015;128:1329-42。
- 73.
公鸡PJA,田CJ,后藤N,豪雅ML,大米PM。sanger fastq文件格式的序列质量评分,和solexa/illumina fastq变体。核酸研究,2010;38:1767-71。
- 74.
Kim D, Langmead B, Salzberg SL. HISAT:低内存需求的快速拼接对齐器。南京大学学报(自然科学版),2015;
- 75.
李B,杜威CN。RSEM:从RNA-Seq数据中精确的转录物定量,有或没有参考基因组。生物信息学。2011;12:323。
- 76.
王磊,冯志,王旭,王霞,张旭。一种利用RNA-seq数据识别差异表达基因的包。生物信息学。2010;26:136-8。
致谢
不适用。
资金
本文得到江苏省高校重点学科建设项目(PAPD)、国家自然科学基金青年基金(31701924)和中央高校基本科研业务费专项资金(KYZZ201809, KJQN201814)的资助。植物处理和样品采集由中央高校基本科研业务费项目(KYZZ201909)资助。资助者只提供了实验费用和出版费用。然而,实验设计和数据收集和分析是由贡献作者管理的。
作者信息
从属关系
贡献
ZW, JQW和FLJ设计了实验。JQW进行了实验并分析了数据。JQW撰写了这篇论文。ZW, JQW, FLJ, YQW, MTS, XPS, YZZ, LY对论文进行了修改。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
附加文件
附加文件1:
表S1。本研究开发的连锁图谱统计。(docx16kb)
附加文件2:
表S2。QTL-seq中来自极端池和亲本的测序数据的统计和评估。(docx16kb)
附加文件3:
表S3。极端池和父母的比较结果具有参考意义SL 2.50在QTL-seq。(docx15kb)
附加文件4:
表S4。测序数据的统计和基因组与参考文献的比较SL 2.50在RNA-seq。(docx16kb)
附加文件5:
表S5。RNA-seq概述。(docx15kb)
附加文件6:
表S6。RNA-seq中父母的公开deg。(xlsx974 kb)
附加文件7:
表S7。RNA-seq中LA1698的特异性DEGs。(xlsx27kb)
附加文件8:
表S8。RNA-seq中LA2093的特异性DEGs。(xlsx319 kb) (xlsx319 kb)
附加文件9:
表S9。在主要qtl中检测到DEGs。(xlsx416 kb) (xlsx44 kb)
附加文件10:
表S10。用于实时qRT-PCR的引物。(docx17 kb)
附加文件11:
表S11。通过RNA-seq和qRT-PCR对12个候选基因进行GO和KEGG分析。(xlsx11.0 kb) (xlsx11kb)
附加文件12:
图S1.3个耐热性相关生理指标的频率分布2人口。(docx685 kb)
附加文件13:
图S2.番茄耐热性遗传连锁图谱及qtl位置(docx476 kb)
附加文件14:
图S3.热损伤指数在F2人口。(docx71 kb)
附加文件15:
图S4.qRT-PCR与RNA-seq相对表达量的比较。(docx284kb)
附加文件16:
图S5.GO (a)和KEGG (b) deg的分类。(docx92 kb)
附加文件17:
图S6.25个候选基因在亲本4、8、12 h的相对表达量分析。(docx207kb)
附加文件18:
图S7.RNA-seq时间点的筛选。(docx408kb)
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
文俊,蒋飞,翁勇。et al。通过传统QTL作图、QTL-seq和RNA-seq鉴定番茄耐热QTL和高温胁迫响应基因。BMC植物生物学19日,398(2019)。https://doi.org/10.1186/s12870-019-2008-3
收到了:
接受:
发表:
关键字
- 番茄
- QTL-seq
- RNA-seq
- 耐热性