- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
葡萄藤的耐旱性;gydF4y2Ba葡萄属champiniigydF4y2Ba简历。Ramsey,与更高的光合作用和更高的脱落酸生物合成和信号传导的转录组反应有关gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba、物品编号:gydF4y2Ba55gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
葡萄是一种重要的经济作物,其产量和果实质量受气候变化的影响很大。不同地区的耐旱性差异很大gydF4y2Ba葡萄属gydF4y2Ba物种。其中一些品种被用作砧木,以提高非生物和生物的抗逆性。在这项研究中,我们研究了四种不同耐旱性基因型对水分亏缺的生理和转录组反应:Ramsey (gydF4y2Ba葡萄属champiniigydF4y2Ba)、Riparia Gloire (gydF4y2Ba葡萄属锐利gydF4y2Ba)、赤霞珠(gydF4y2Ba葡萄gydF4y2Ba),及SC2 (gydF4y2Ba葡萄树x葡萄树gydF4y2Ba)。gydF4y2Ba
结果gydF4y2Ba
与其他三种基因型相比,拉姆齐的耐旱性更强。在同等水分亏缺水平下,拉姆齐的气孔导度和光合作用均保持较高水平。我们确定了特定的和共同的转录组反应共享的四个不同的gydF4y2Ba葡萄属gydF4y2Ba利用RNA测序分析。加权基因共表达分析确定了ABA生物合成和信号基因的水分亏缺核心基因集。gydF4y2BaNCED3gydF4y2Ba,gydF4y2BaRD29BgydF4y2Ba和gydF4y2BaABI1gydF4y2Ba作为潜在的中枢基因。水分亏缺显著增加了许多脱落酸代谢和信号基因的转录丰度,以及与脂质代谢、半乳糖醇合成酶和MIP家族蛋白相关的基因。与其他基因型相比,Ramsey基因型在较小的水分亏缺情况下产生了这种反应,并且转录物丰度更高。一些水通道蛋白基因对拉姆齐叶片水分亏缺表现出不同的和独特的反应。拉姆齐根中参与半胱氨酸生物合成和代谢的基因组成性较高;因此,将影响ABA生物合成的已知因子的基因表达与该基因型的联系起来gydF4y2BaNCED3gydF4y2Ba转录丰度。gydF4y2Ba
结论gydF4y2Ba
在同等水分亏缺条件下,耐干旱的拉姆齐品种的光合作用高于其他三种葡萄品种。拉姆齐对缺水反应更灵敏;它的转录组在较小的缺水条件下有反应,而其他基因型在更严重的缺水条件下才有反应。所有基因型都有一个共同的核心基因网络响应水分亏缺,包括ABA代谢和信号。在这项工作中确定的基因簇和子网络代表了探索和更好地理解耐旱分子机制的有趣基因列表。gydF4y2Ba
背景gydF4y2Ba
水分亏缺对作物生长和产量有负面影响[j]。gydF4y2Ba1gydF4y2Ba]并影响作物品质性状[gydF4y2Ba2gydF4y2Ba]。植物进化出适应机制来应对缺水。它们可以(i)以较短的作物周期逃避旱涝,(ii)避免旱涝(减少蒸腾/增加水分吸收),(iii)维持生长或(iv)通过生存机制抵御严重的旱涝条件[gydF4y2Ba3.gydF4y2Ba]。在葡萄栽培中,季节性干旱结合大气和土壤的约束,对产量、葡萄浆果的感官特性和随后的葡萄酒品质有很大的影响[gydF4y2Ba4gydF4y2Ba]。葡萄藤通常被认为是一种抗旱物种[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba]。然而,存在较大的变异性gydF4y2Ba葡萄属gydF4y2Ba物种对这种适应策略的看法不一,从等水(悲观),在土壤含水量下降时控制水分流失到各向异性(乐观),在相同的WD条件下维持气孔孔径和光合作用,导致叶片水势下降[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba]。这种分类并不严格,主要取决于WD的持续时间和强度,以及环境条件[gydF4y2Ba7gydF4y2Ba]。在葡萄园中,可以通过使用砧木来提高耐旱性[gydF4y2Ba8gydF4y2Ba]。其中一些gydF4y2Ba葡萄属gydF4y2Ba物种促进生长gydF4y2Ba葡萄gydF4y2Ba半干旱和干旱气候条件下的接穗品种[gydF4y2Ba4gydF4y2Ba]。葡萄藤是研究抗旱性的一个很好的植物模型,因为这些物种之间存在很大的遗传变异,而且葡萄藤是一种有价值的水果作物[gydF4y2Ba9gydF4y2Ba]。gydF4y2Ba
葡萄的气孔控制依赖于水力和化学信号[j]gydF4y2Ba10gydF4y2Ba]。然而,描述这两个过程的相对重要性的综合模型仍有待研究。Tombesi等。[gydF4y2Ba11gydF4y2Ba]表明,即时反应依赖于水力机制,而蒸腾的长期调节涉及脱落酸(ABA)。rosssdeutsch等。[gydF4y2Ba12gydF4y2Ba]进一步证实了ABA的重要性,并强调了ABA介导的葡萄基因型在WD条件下的遗传背景分离[gydF4y2Ba12gydF4y2Ba]。最近定义的干旱响应基因子网络确定了ABA信号因子的优势作用[gydF4y2Ba13gydF4y2Ba]。最近的一份报告表明,ABA对葡萄叶片水力传导的作用取决于植物的等水行为[gydF4y2Ba14gydF4y2Ba]。这进一步强调了遗传背景对aba介导的葡萄对WD反应的影响。gydF4y2Ba
ABA代谢和信号通路已被很好地表征。ABA属于萜类代谢产物,其生物合成主要依赖于9 -顺式环氧类胡萝卜素双加氧酶(NCED)酶的活性[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba]。除了产生外,分解代谢也是ABA稳态的重要过程。ABA可以以ABA-葡萄糖酯(ABA- ge)的无活性形式储存,并通过葡萄糖苷酶活性迅速重新激活[gydF4y2Ba18gydF4y2Ba]。ABA降解是由ABA-8 ' -羟化酶引发的[gydF4y2Ba17gydF4y2Ba]。有趣的是,ABA分解物被认为参与了ABA的长期反应[gydF4y2Ba19gydF4y2Ba]。核心信号通路已被很好地描述[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba]。ABA信号涉及一个复杂的调控网络,包括大量的蛋白质[gydF4y2Ba23gydF4y2Ba]。gydF4y2Ba
根据遗传背景的不同,ABA通路的调控可能在不同的植物中有所不同gydF4y2Ba葡萄属gydF4y2Ba基因型及其对抗旱性差异的影响。然而,ABA并不是影响植物对WD响应的唯一因素。事实上,感知干旱胁迫相关信号并将其传递给茎部的能力也至关重要,并可能依赖于其他几个关键因素,如水力信号、pH值、离子、小肽和其他激素[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba]。为了研究干旱敏感型和耐旱型葡萄的生理和分子机制差异,选择了4个基因型:gydF4y2Ba葡萄属锐利gydF4y2Ba;RG),已知对干旱敏感[gydF4y2Ba29gydF4y2Ba]、赤霞珠(gydF4y2Ba葡萄gydF4y2Ba;CS)和Ramsey (gydF4y2Ba葡萄属chamipiniigydF4y2Ba;RM),被描述为耐旱[gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba]。最后一种基因型SC2 (SC)原产于南内华达州;这是一种混合gydF4y2Ba葡萄gydF4y2Ba和gydF4y2Ba葡萄属girdianagydF4y2Ba由安德鲁·沃克博士在沙漠中发现的(个人交流)。在不同树龄、不同生长条件的葡萄上进行WD和恢复试验。生理测量与转录组学研究相结合,以深入了解四种不同选择的WD条件下参与生理过程的分子因子gydF4y2Ba葡萄属gydF4y2Ba物种。主要目标是(gydF4y2Ba我gydF4y2Ba),以识别不同的生理反应gydF4y2Ba葡萄属gydF4y2Ba基因型从干旱敏感型到耐旱型不等,以及(gydF4y2Ba2gydF4y2Ba),将这四种植物的转录组反应与抗旱性联系起来,以深入了解所涉及的生理和分子机制。gydF4y2Ba
结果gydF4y2Ba
在大盆中,中等WD条件下,RM的光合作用更高,维持时间更长gydF4y2Ba
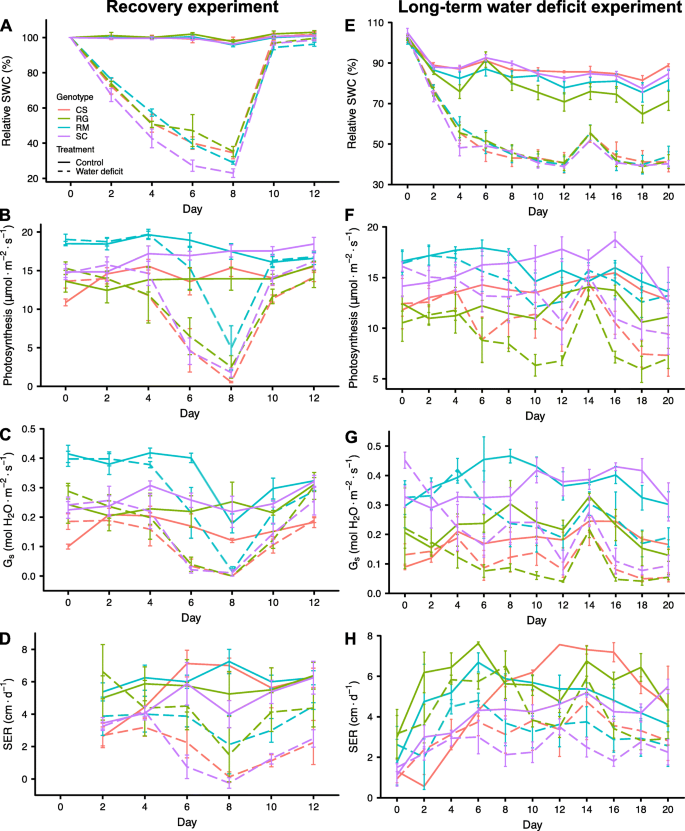
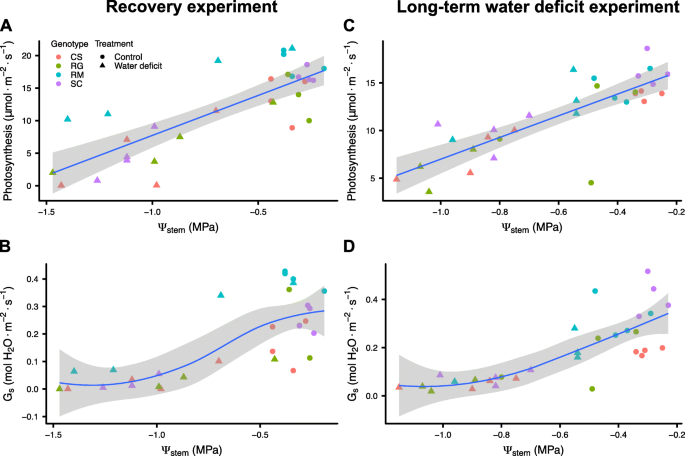
WD实验使用四种不同的葡萄基因型进行,这些基因型具有不同的耐旱性;Cabernet Sauvignon (CS), Riparia Gloire (RG), Ramsey (RM)和SC2,一种来自南内华达州沙漠(SC)的本地杂交品种。在我们的温室条件下,使用至少一年的葡萄藤进行了两种不同的WD实验,以阐明这些基因型的生理反应及其对中度WD的相对耐受性。均匀的葡萄藤用中粒沙在大盆栽中种植。对照每天灌溉,WD通过停止灌溉和让花盆在温室中自然干燥来实施。所有基因型的WD处理相对平等;所有基因型的相对土壤含水量(RSWC)都有相似的下降,但SC除外,直到第8天,当wd处理的葡萄藤重新浇水时,其下降速度略快(图2)。gydF4y2Ba1gydF4y2Baa).茎水势在第6天显著降低(附加文件)gydF4y2Ba1gydF4y2Ba),从控制值- 0.4 MPa到WD值- 1.0 MPa,变化约0.6 MPa。WD显著降低了成熟叶片的光合作用(图2)。gydF4y2Ba1gydF4y2Bab)第6天,RM(附加文件)除外gydF4y2Ba2gydF4y2Ba),两天后显著下降。所有基因型的气孔导度在第6天显著降低(图2)。gydF4y2Ba1gydF4y2Bac、附加文件gydF4y2Ba2gydF4y2Ba)。而CS、RG和SC的气孔导度均接近于0 mol HgydF4y2Ba2gydF4y2BaO mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba而RM在约0.2 mol H时保持升高gydF4y2Ba2gydF4y2BaO mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba。此外,有趣的是,即使在RM中气孔导度几乎为零的情况下,也可以观察到光合作用(图2)。gydF4y2Ba1gydF4y2Bab和c,第8天)。光合作用的抑制与水势的下降呈线性关系(图2)。gydF4y2Ba2gydF4y2BaA,线性模型rgydF4y2Ba2gydF4y2Ba= 0.64, p值= 6.600 e-08);气孔导度响应呈曲线状(图2)。gydF4y2Ba2gydF4y2BaB,三次模型rgydF4y2Ba2gydF4y2Ba= 0.61, p值= 1.20e-05)。同样值得注意的是,在4个实验藤中,RM较高的光合作用和气孔导度对应于较高的茎水势(图2)。gydF4y2Ba2gydF4y2BaA和b)。gydF4y2Ba
四种葡萄一至三年的生理测量gydF4y2Ba葡萄属gydF4y2Ba恢复和WD实验中的基因型。gydF4y2Ba一个gydF4y2Ba),gydF4y2BaegydF4y2Ba)土壤相对含水量(相对SWC);gydF4y2BabgydF4y2Ba),gydF4y2BafgydF4y2Ba)光合作用,gydF4y2BacgydF4y2Ba),gydF4y2BaggydF4y2Ba)气孔导度gydF4y2Ba年代gydF4y2Ba),gydF4y2BadgydF4y2Ba),gydF4y2BahgydF4y2Ba)的茎伸长率(SER),在两个试验期间每隔两天测量一次。第一个实验包括在8天内进行WD治疗,然后进行恢复(gydF4y2Ba一个gydF4y2Ba-gydF4y2BadgydF4y2Ba)。第二个试验是在20天的时间里,以50%的RSWC对受胁迫的葡萄进行WD处理(gydF4y2BaegydF4y2Ba-gydF4y2BahgydF4y2Ba)。红、绿、蓝、紫分别代表CS、RG、RM、SC。数据均为均值±SE, n = 4株盆栽葡萄藤(长期盆栽试验中,WD组RG采用3株盆栽葡萄藤处理除外)gydF4y2Ba
四种生理测量之间的关系gydF4y2Ba葡萄属gydF4y2Ba在恢复和WD实验中进行基因型分析。gydF4y2Ba一个gydF4y2Ba),gydF4y2BacgydF4y2Ba)光合作用与茎水势的关系。gydF4y2BabgydF4y2Ba),gydF4y2BadgydF4y2Ba)气孔导度与茎水势的关系。第一个实验包括在8天内进行WD治疗,然后进行恢复(gydF4y2Ba一个gydF4y2Ba-gydF4y2BabgydF4y2Ba)。第二个试验是在20天的时间里,以50%的RSWC对受胁迫的葡萄进行WD处理(gydF4y2BacgydF4y2Ba-gydF4y2BadgydF4y2Ba)。红、绿、蓝、紫分别代表CS、RG、RM、SC。数据由四个单独的盆栽葡萄藤表示(除了RG在WD处理中使用三个单独的盆栽葡萄藤)gydF4y2Ba
茎伸长率(SER)是在修剪后的茎/藤顶端附近的单个新兴侧枝上测量的(详见材料和方法)。所有其他侧枝均被切除。WD可抑制SER,尤其是第8天的CS和SC(图2)。gydF4y2Ba1gydF4y2Bad、附加文件gydF4y2Ba2gydF4y2Ba)。在第8天重新浇水,使其达到100% RSWC, 4天后所有基因型的光合作用和气孔导度完全恢复。但复水2 d后,RM恢复得比SC更充分,SC恢复得比CS和RG更充分。一般来说,一个侧枝的SER测量值比其他测量值变化更大(图2)。gydF4y2Ba1gydF4y2Bad).这部分是由于我们无法控制所有基因型的所有葡萄藤在完全相同的时间或发育阶段开始第10个侧芽的出现。从休眠期萌发的新芽有一个生长滞后期。成熟的枝条比新生的枝条长得快。最后,幼芽赶上来,以同样的速度生长。第8天,RM对SER的抑制作用较弱,而其他三种基因型对SER的抑制作用要大得多。RG的SER显著高于CS和SC,后者的生长几乎完全停止。RG、CS和SC的侧枝部分叶片在第6天开始枯萎,而RM则没有。在第8天,4株经wd处理的CS藤中有3株的侧茎尖坏死。gydF4y2Ba
为了进一步研究中度WD的影响,在第二个大锅试验中,葡萄藤在恒定RSWC下暴露于更长的胁迫持续时间。葡萄藤生长三周,除第13天浇水至60% RSWC外,wd处理的葡萄藤每天保持50% RSWC。根据第1个试验,WD处理的葡萄植株的RSWC在WD处理第4天达到了50%(图2)。gydF4y2Ba1gydF4y2Bae)。将葡萄藤维持在50% RSWC时,光合作用下降较慢(图2)。gydF4y2Ba1gydF4y2BaF)与第一次实验相比。在WD处理的第12天,所有基因型的气孔导度都显著降低(图2)。gydF4y2Ba1gydF4y2Bag和附加文件gydF4y2Ba3.gydF4y2Ba)。在第14天,在水分有效性略有增加后,所有wd处理的葡萄植株的光合作用和气孔导度都恢复到接近对照值。在第15天恢复到50% RSWC后,4个基因型中有3个基因型的光合作用和气孔导度水平在第16天显著降低。值得注意的是,RM没有观察到这种下降,在实验的剩余时间里,对照和wd处理的葡萄藤之间没有显著差异(图2)。gydF4y2Ba1gydF4y2Baf和g,附加文件gydF4y2Ba3.gydF4y2Ba),尽管RSWC(图。gydF4y2Ba1gydF4y2BaE)被减少到与其他三个相同的程度gydF4y2Ba葡萄属gydF4y2Ba基因型。在WD的最后一天,RM的光合作用最高,远远大于SC,大于CS或RG。这一排名与第一次WD试验的注水恢复响应排名一致。第18天测定茎部水势(附加文件)gydF4y2Ba4gydF4y2BaA). WD处理的RM的茎水势高于其他WD处理的基因型。与之前的实验一样,光合作用(图2)gydF4y2Ba2gydF4y2BaC,线性模型rgydF4y2Ba2gydF4y2Ba= 0.67, p值= 2.22e-08)与气孔导度趋于线性相关(图22)。gydF4y2Ba2gydF4y2BaD,三次模型,rgydF4y2Ba2gydF4y2Ba= 0.63, p值= 5.310e-06)与茎部水势呈曲线相关。在同等RSWC条件下,4个RM藤中有3个保持了比其他基因型更高的茎水势。在试验结束时测量葡萄藤根系的水力导电性(附加文件gydF4y2Ba4gydF4y2BaB). WD显著降低了根系导电性,但在不同基因型(附加文件中基因型x处理的相互作用)之间,这种影响没有显著差异gydF4y2Ba4gydF4y2BaB)。gydF4y2Ba
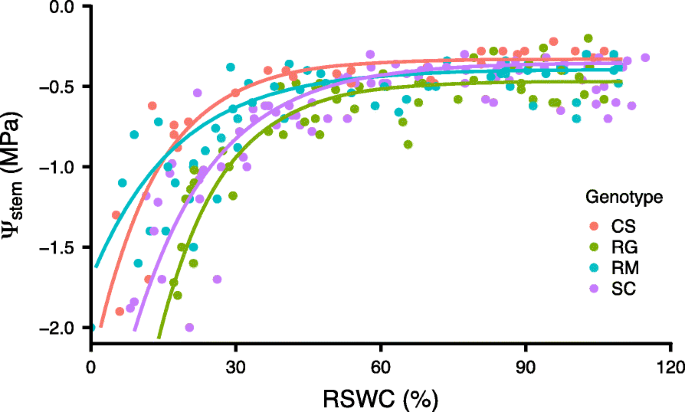
为了跟进这些观察结果,将小根插枝种在小盆里的沙子中,并让其自然干燥。在每个基因型的不同RSWC下测定茎水势,以确定茎水势与RSWC的关系(图2)。gydF4y2Ba3.gydF4y2Ba)。随着RSWC在100 ~ 50%之间的下降,茎干水势呈极轻微的线性下降。当RSWC达到30%时,茎干水势随RSWC的降低而迅速下降。差异不大,但相对于RG, RM在较低RSWC下的快速期趋于下降,在同等RSWC下保持较高的茎水势。请注意,类似的反应也发生在大罐中,但RSWC更高(数据未显示)。综上所述,三个WD试验的结果表明,在同等WD (RSWC)水平下,RM能够保持比其他基因型更高的光合作用,从而耐受土壤WD。gydF4y2Ba
差异表达基因(DEGs)在中重度WD小盆中被鉴定出来gydF4y2Ba
另外在小盆中进行了两次有根扦插的WD试验。一种是在中度水分侵蚀下进行的(详见下文),另一种是在相同的小盆中使用较大的植株,以产生更快和更严重的水分侵蚀(附加文件)gydF4y2Ba5gydF4y2Ba)。第一个中等WD小盆栽试验的藤蔓被用于广泛的转录组学研究,将在下面进行更详细的讨论。在第一次试验中鉴定出特定的deg,采用第二次重度应激小罐试验进行验证。gydF4y2Ba
中度WD基因型间基因表达差异明显gydF4y2Ba
1个月大的插枝进行灌水(100% RSWC,对照)或不灌水(中度WD)两周。WD速率适中,因为有根的插条小,因此蒸腾水分比大植株慢。中度WD处理1周和2周后,分别收获对照和WD处理葡萄的根和叶。WD处理1周和2周后,茎秆水势略有下降(- 0.49±0.04 MPa至- 0.82±0.06 MPa);平均值±SE (n = 7个个体))。对照葡萄藤在1周和2周后分别保持较高的水势(- 0.26±0.02至- 0.32 MPa±0.02);平均值±SE (n = 7个个体))。从1周和2周的样本中提取总RNA,用于RNA测序(RNA- seq)和转录物丰度定量(有关数据处理和定量的更多详细信息,请参见材料和方法)。gydF4y2Ba
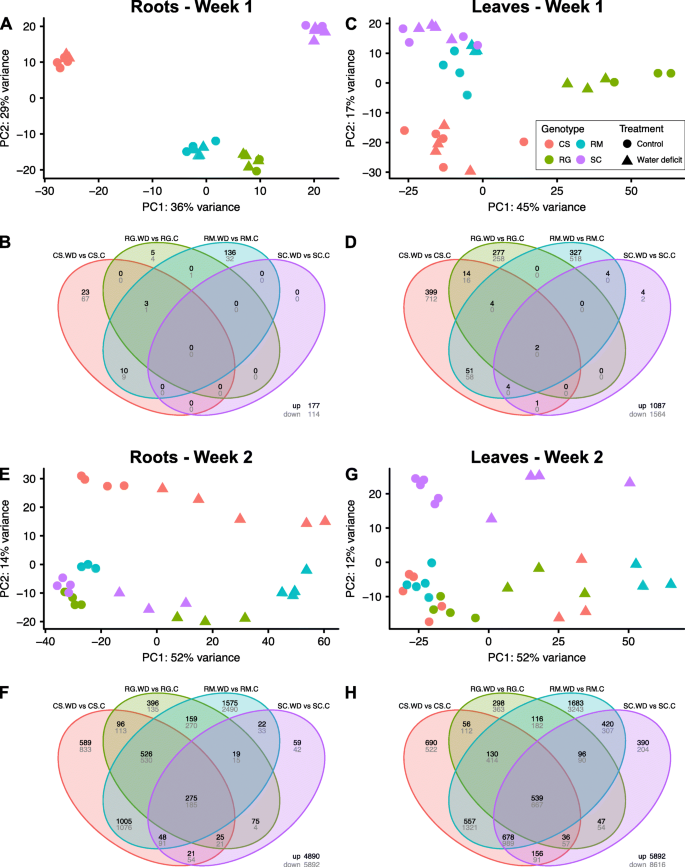
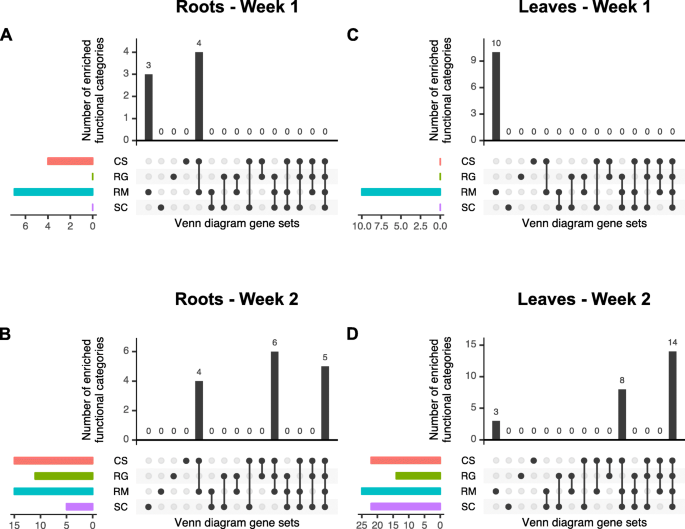
利用主成分分析(PCA),第1周根样品的转录本可以通过基因型紧密分离(图2)。gydF4y2Ba4gydF4y2Baa),这种分组模式与叶片相似(图2)。gydF4y2Ba4gydF4y2Bac).第1周和第2周,根中差异表达基因总数(假发现率调整p值< 0.05)分别为291个和10714个,芽中差异表达基因总数分别为2604个和14264个(另附文件)gydF4y2Ba6gydF4y2Ba)。这些deg的维恩图支持基因型和WD处理之间存在不同转录组谱的结论。治疗1周后,4种基因型之间的deg很少共享(第1周;无花果。gydF4y2Ba4gydF4y2Bab和d)。此外,叶片中的deg含量约为根的9倍,这与之前的观察结果一致[gydF4y2Ba32gydF4y2Ba]。与其他两个基因型(RG和SC)相比,CS和RM中存在更多的deg,表明转录反应更敏感,发生在更高的RSWC和茎水势下。WD第二周后,样本的协变比第1周大得多(图2)。gydF4y2Ba4gydF4y2Bae和g)。在根系中,CS样品与其他三种物种的差异更大(图2)。gydF4y2Ba4gydF4y2Bae)而在叶片中,SC是最明显的(图2)。gydF4y2Ba4gydF4y2Bag).有趣的是,PCA表示表明对RM的WD响应更强或更明显,突出表现为明显的样本分离。与第一周相比,第二周对WD的反应引发的deg数量明显增加(图2)。gydF4y2Ba4gydF4y2Baf, h)。在所有基因型中,叶片的deg数量都高于根。对于这两个器官,RM的deg更多,其次是CS,然后是RG和SC。总之,这些结果表明,在治疗一周后,根据基因型有明确的分离,但在第二周后,WD是样品分离的主要因素。gydF4y2Ba
主成分分析和差异表达分析结果综述。gydF4y2Ba一个gydF4y2Ba),gydF4y2BacgydF4y2Ba),gydF4y2BaegydF4y2Ba),gydF4y2BaggydF4y2Ba)分别在处理第一周和第二周后从根或叶中收集的样品的PCA表示。红、绿、蓝、紫分别代表CS、RG、RM、SC。圆圈和三角形分别代表控制和干旱处理。gydF4y2BabgydF4y2Ba),gydF4y2BadgydF4y2Ba),gydF4y2BafgydF4y2Ba),gydF4y2BahgydF4y2Ba)干旱葡萄树与对照葡萄树之间的温氏度图。用于区分基因型的颜色代码与用于pca的颜色代码相同gydF4y2Ba
功能类别的富集揭示了耐旱物种对中度WD的早期转录组反应和两周后的共同核心反应gydF4y2Ba
利用基因本体(gene ontology, GOs)和BIN编码(BIN code, BIN)进行基因集富集分析,分析由维恩图表示分离的不同基因集。WD第一周后,在根中检测到少量deg,几乎只在CS和RM中检测到(图2)。gydF4y2Ba4gydF4y2Bab).为了快速概述已知由WD诱导的功能类别,与ABA、对水分剥夺的反应和半乳糖醇合成酶相关的富集功能类别的数量之和如图所示。gydF4y2Ba5gydF4y2Ba(关于所使用的功能类别的详细信息可以在附加文件中找到gydF4y2Ba7gydF4y2Ba)。在无花果。gydF4y2Ba5gydF4y2Baa,可以观察到,代表WD反应的这些功能类别中有三个仅在RM中富集,而另外四个在RM和CS中富集。总的来说,RM显示出更丰富的功能类别(7个)。事实上,对于该基因型,与WD反应相关的bin和GOs都被富集(附加文件)gydF4y2Ba8gydF4y2Ba和gydF4y2Ba9gydF4y2Ba;基因列表3,条件R1)在前5个富集的GOs和半乳糖醇合成酶中显著过度代表水分剥夺和ABA相关的GOs。另一个BIN代码对应于金属处理(附加文件)gydF4y2Ba9gydF4y2Ba,基因列表3,条件R1)。经过一周的处理后,RM和CS叶片中同样的功能类别得到了丰富,并伴有与铁蛋白基因有关的铁离子隔离和铁离子稳态相关的GOs(附加文件)gydF4y2Ba8gydF4y2Ba和gydF4y2Ba9gydF4y2Ba;基因列表11,条件L1)。正如预期的那样,在处理第二周后,所有基因型共享的基因集都与富含ABA和半乳糖醇合成酶的bin的WD以及对水/水剥夺的反应和对ABA的反应有关(附加文件)gydF4y2Ba8gydF4y2Ba和gydF4y2Ba9gydF4y2Ba;基因列表16,R2状态)。有趣的是,这些类别是除SC外所有基因型根共有基因集中最丰富的gogydF4y2Ba8gydF4y2Ba,基因列表15,条件R2)。特别是在CS中,富集分析显示涉及脂质代谢和次级代谢的基因过多,包括苯丙类和类黄酮类(附加文件)gydF4y2Ba9gydF4y2Ba,基因列表9,条件R2)。肉桂酸相关的氧化石墨烯类别仅在CS中富集gydF4y2Ba8gydF4y2Ba,基因列表9,条件R2)含有已知催化单脂醇生物合成途径最后一步的肉桂醇脱氢酶基因[gydF4y2Ba33gydF4y2Ba]。在RM中,最富集的go与细胞骨架(更准确地说是微管)以及组蛋白H3甲基化有关(附加文件)gydF4y2Ba8gydF4y2Ba,基因列表3,条件R2)。它们也在与RG共同的基因集中富集,细胞动力学过程在最富集的GO类别中(附加文件)gydF4y2Ba8gydF4y2Ba,基因列表7,条件R2)。gydF4y2Ba
与WD反应相关的丰富功能类别之和。对从图3的维恩图中提取的GO和BIN代码列表进行富集分析。gydF4y2Ba2gydF4y2Ba。表示与ABA、缺水反应和半乳糖醇合成酶相关的富集功能类别的数量总和。垂直条形图显示了不同Venn基因集的这些丰富功能类别的数量。彩色横条形图显示了每个基因型富集功能类别的总数。红、绿、蓝、紫分别代表CS、RG、RM、SC。(有关所使用的功能类别的详细信息可在附加文件中找到gydF4y2Ba7gydF4y2Ba)gydF4y2Ba
在叶片中,经过一周处理后,RM特异性地富集了与wd相关的功能类别(另附文件)gydF4y2Ba8gydF4y2Ba和gydF4y2Ba9gydF4y2Ba;基因列表3,条件L1)。第二周后,所有基因型的半乳糖醇合成酶、ABA和脂质代谢类别均增加(附加文件)gydF4y2Ba8gydF4y2Ba和gydF4y2Ba9gydF4y2Ba;基因列表16,状态L2)。在CS中,类黄酮、ABA和脂肪酸相关基因富集(附加文件)gydF4y2Ba9gydF4y2Ba(基因列表9,条件L2)。类黄酮和色素的生物合成过程、ABA和对紫外线的反应等基因在CS和SC共享的基因集中富集(附加文件)gydF4y2Ba8gydF4y2Ba和gydF4y2Ba9gydF4y2Ba;基因列表10,条件L2)。总之,基因集富集分析显示,这四种基因型具有共同的核心WD反应。该核心WD响应包括根部ABA生物合成/信号传导和MYB转录因子(TFs),叶片脂质代谢和非生物胁迫(热),以及所有基因型中两个器官的半乳糖醇合成酶相关功能类别。此外,在干旱耐旱性较高的物种RM中,与干旱相关的功能类别在干旱一周后特异性丰富。gydF4y2Ba
aba相关的deg在RM中被诱导得更早、更强gydF4y2Ba
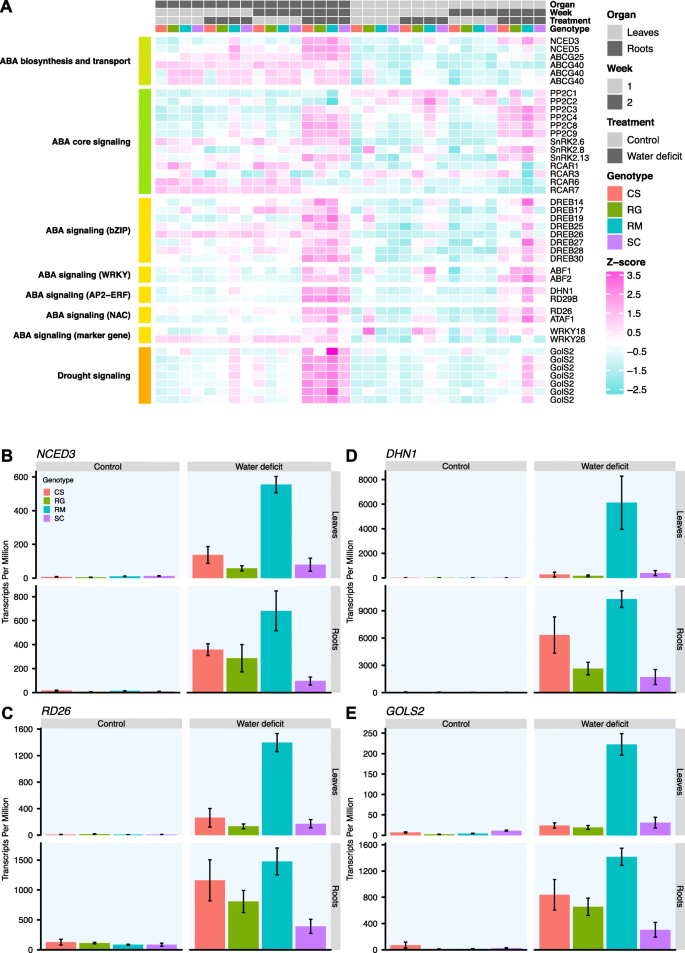
aba相关基因是较好的干旱胁迫标记。在第7天(第1周),WD与对照葡萄藤中发现了DEGs(图2)。gydF4y2Ba6gydF4y2Baa和附加文件gydF4y2Ba10gydF4y2Ba)仅对RM具有显著性。其中,参与ABA生物合成的基因,即gydF4y2BaNCED3gydF4y2Ba和gydF4y2BaNCED5,gydF4y2Ba根部WD诱导;gydF4y2BaNCED3gydF4y2Ba在树叶中也有一个DEG。这种ABA生物合成基因的调控伴随着gydF4y2BaPP2C9gydF4y2Ba(一种参与ABA信号传导的蛋白磷酸酶2C)在两个RM wd处理的器官中。在wd处理的叶片中,ABA受体的转录丰度,gydF4y2BaRCAR7,gydF4y2Ba而aba诱导的蛋白激酶基因gydF4y2BaSnRK2.13gydF4y2Ba是增加了。再经过一周的WD(第2周),转录本丰度为gydF4y2BaNCED3gydF4y2Ba在所有基因型的两个器官中均增加,RM中明显高于其他基因型(图2)。gydF4y2Ba6gydF4y2Bab).表达水平较低时,gydF4y2BaNCED5gydF4y2Ba在所有基因型中,经wd处理的根均较高,但仅在RM的wd叶片中较高。ABA转运基因的转录丰度gydF4y2BaAtp结合转运体盒g 25gydF4y2Ba(gydF4y2BaABCG25gydF4y2Ba)在处理过的根(SC除外)和处理过的叶(图2)中含量较高。gydF4y2Ba6gydF4y2Baa、附加文件gydF4y2Ba10gydF4y2Ba)。ABA受体调控组分(RCARs)基因表达量在WD作用下明显降低gydF4y2Ba10gydF4y2Ba)。在树叶中,转录丰富gydF4y2BaRCAR1gydF4y2Ba,gydF4y2BaRCAR3gydF4y2Ba,gydF4y2BaRCAR6gydF4y2BaRM(附加文件?gydF4y2Ba10gydF4y2Ba)。对于所有这些基因,除wd处理过的叶片外,wd处理过的根样品的平均表达量高于wd处理过的叶片gydF4y2BaRCAR6,gydF4y2Ba表现出类似的表达模式(图2)。gydF4y2Ba6gydF4y2Baa).的基因表达gydF4y2BaPP2C1gydF4y2Ba和gydF4y2BaPP2C2gydF4y2Ba分别在wd处理的根和叶中降低,仅在RM(附加文件?gydF4y2Ba10gydF4y2Ba)。的转录丰度gydF4y2BaPP2C3gydF4y2Ba,gydF4y2BaPP2C4gydF4y2Ba,gydF4y2BaPP2C8gydF4y2Ba和gydF4y2BaPP2C9gydF4y2Ba在两个器官的四个wd处理基因型中,除了gydF4y2BaPP2C4gydF4y2Ba在SC wd处理的叶片中。在这两个器官中,gydF4y2BaPP2C8gydF4y2Ba和gydF4y2BaPP2C9gydF4y2Ba四种基因型中平均表达量最高的两种pp2c在RM叶片中的表达量显著更高(附加文件gydF4y2Ba10gydF4y2Ba)。的表达式gydF4y2Basnf1相关蛋白激酶gydF4y2Ba(gydF4y2BaSnRK2gydF4y2Ba)基因也被显著修饰,转录物积累gydF4y2BaSnRK2gydF4y2Ba。gydF4y2Ba6gydF4y2Ba在RM的根和叶中gydF4y2BaSnRK2.8gydF4y2Ba除SC外在根中差异表达,除RG外在叶中差异表达。的转录丰度gydF4y2BaSnRK2.13gydF4y2Ba在所有基因型中,WD均增加了两个器官。综上所述,这些结果表明,与其他基因型相比,ABA通路相关基因的转录调控对发生在相同RSWC上的RM更为敏感。此外,即使该代谢途径的几个基因在WD的第二周后在其他基因型中有显著的差异表达,在同等RSWC下,RM的表达差异仍然特别明显。gydF4y2Ba
四种基因型中aba相关基因表达对水分亏缺的响应。gydF4y2Ba一个gydF4y2Ba)不同条件下aba相关基因表达的热图。对于每种情况(器官x周x处理x基因型),计算平均TPM值并转换log2。这些表达值在热图上表示为z分数(每个基因计算),并从绿松石(低值)到粉红色(高值)着色。基因按过程或蛋白家族聚集在左侧。在热图的顶部,一个图表分别用浅灰色和深灰色的叶子和根来标识不同的条件;第1周和第2周分别为浅灰色和深灰色;对照和干旱处理分别为浅灰色和深灰色;基因型CS、RG、RM和SC分别为红色、绿色、蓝色和紫色。的表达谱gydF4y2BaNCED3gydF4y2Ba(gydF4y2BabgydF4y2Ba),gydF4y2BaRD26gydF4y2Ba(gydF4y2BacgydF4y2Ba),gydF4y2BaDHN1gydF4y2Ba(gydF4y2BadgydF4y2Ba),gydF4y2BaGOLS2gydF4y2Ba(gydF4y2BaegydF4y2Ba)治疗两周后。叶片(上行)和根(下行)的对照(左列)和WD处理的葡萄藤(右列)的表达量以每百万转录本表示,平均值±SE, n = 3 - 5个单个葡萄藤。基因型以颜色标示,如热图(gydF4y2Ba一个gydF4y2Ba)gydF4y2Ba
aba信号转录因子基因的转录反应gydF4y2Ba
abre结合因子(ABFs)等aba信号转导因子的转录丰度被WD修饰(图2)。gydF4y2Ba6gydF4y2Baa和附加文件gydF4y2Ba10gydF4y2Ba)。在第7天,转录本丰度gydF4y2BaABF1gydF4y2Ba和gydF4y2Ba—ABF2gydF4y2Ba仅在RM叶中含量较高。一些WRKY tf,gydF4y2BaWRKY18gydF4y2Ba和gydF4y2BaWRKY26,gydF4y2Ba用相同的表达模式进行修饰。治疗的第二周触发了更多tf的转录调节。而gydF4y2Ba—ABF2gydF4y2Ba转录物丰度在所有基因型的两个器官中都较高,这只适用于gydF4y2BaABF1gydF4y2Ba在CS和SC根中以及除叶片中的SC外的所有基因型中(附加文件gydF4y2Ba10gydF4y2Ba)。的转录丰度gydF4y2BaWRKY18gydF4y2Ba仅在RM根中增加。此外,许多aptala2 -乙烯响应因子(AP2-ERF) TFs的表达也受到影响。在根系脱水反应元素结合(DREB) TFs中发现的大多数deg都是RM所特有的gydF4y2BaDREB19gydF4y2Ba和gydF4y2BaDREB30,gydF4y2Ba这也是CS和RG的deg(附加文件gydF4y2Ba10gydF4y2Ba);在叶片中也观察到类似的趋势。基因表达在RM中一直较高,特别是对于gydF4y2BaDREB14gydF4y2Ba,gydF4y2BaDREB17gydF4y2Ba,gydF4y2BaDREB25gydF4y2Ba,gydF4y2BaDREB26gydF4y2Ba,gydF4y2BaDREB27gydF4y2Ba和gydF4y2BaDREB28gydF4y2Ba。NAC DOMAIN CONTAINING (NAC) tf表现出类似的反应,诱导表达gydF4y2Ba对干燥有反应gydF4y2Ba(gydF4y2BaRD26gydF4y2Ba),gydF4y2Ba拟南芥活化因子1gydF4y2Ba(gydF4y2BaATAF1gydF4y2Ba)gydF4y2Ba,gydF4y2Ba特别是在RM(图2)。gydF4y2Ba6gydF4y2Bac).其他aba标记基因明显是高度诱导的deggydF4y2BaRD29BgydF4y2Ba和gydF4y2BaDEHYDRIN 1gydF4y2Ba(gydF4y2BaDHN1gydF4y2Ba)。有趣的是,表达式gydF4y2BaDHN1gydF4y2Ba在RM器官中被强烈诱导,根部的转录本每百万(TPM)值超过10,000,叶片中的平均表达量至少是其他基因型的16倍(图2)。gydF4y2Ba6gydF4y2Bad).正如预期的那样,WD处理还影响了与干旱反应有关的几个基因。在第二周,他们大多数是deg。然而,gydF4y2Ba半乳糖醇合成酶gydF4y2Ba(gydF4y2BaGOLS2gydF4y2Ba)基因表达在第7天特异性增高。治疗第二周触发转录积累gydF4y2BaGOLS2gydF4y2Ba在大多数基因型的两个器官中,具有较高的RM增加(图2)。gydF4y2Ba6gydF4y2Bae和附加文件gydF4y2Ba10gydF4y2Ba)。gydF4y2Ba
这些结果证实,ABA生物合成基因在RM中的高表达伴随着ABA信号基因的高转录积累。在1个月的插枝上观察到的这些结果也在5周的葡萄藤上观察到,这些葡萄藤在处理一周后经历了更强的胁迫(茎水势约为- 1.5 MPa)(附加文件)gydF4y2Ba5gydF4y2Ba)。采用RT-qPCR进行基因表达谱分析gydF4y2BaNCED3gydF4y2Ba和gydF4y2BaDHN1gydF4y2Ba(附加文件gydF4y2Ba11gydF4y2Ba)。在治疗两周后的RNA-Seq结果中,这两个基因在RM中对WD的反应中表现出强烈的上调。最近的拟南芥同源物gydF4y2BaDHN1gydF4y2Ba是已知的ABA标记,gydF4y2Ba拉布18岁gydF4y2Ba(gydF4y2BaRAB18gydF4y2Ba),gydF4y2Ba脱氢0 1gydF4y2Ba(gydF4y2BaXERO1gydF4y2Ba)。有趣的是,的表达式gydF4y2BaNCED3gydF4y2Ba在RM根和RM和CS叶片(附加文件gydF4y2Ba11gydF4y2Ba一个)。gydF4y2BaDHN1gydF4y2Ba该基因型对WD (Additional file)的响应也在RM根中特异性诱导表达,且在叶片中的表达显著增强gydF4y2Ba11gydF4y2BaB)而这些植物处于相同的RSWC(附加文件gydF4y2Ba5gydF4y2BaA)。这些结果再次证实,aba相关的基因网络似乎在RM中受到WD的动态调控。gydF4y2Ba
主要内在蛋白(MIPs)在WD葡萄中存在差异表达gydF4y2Ba
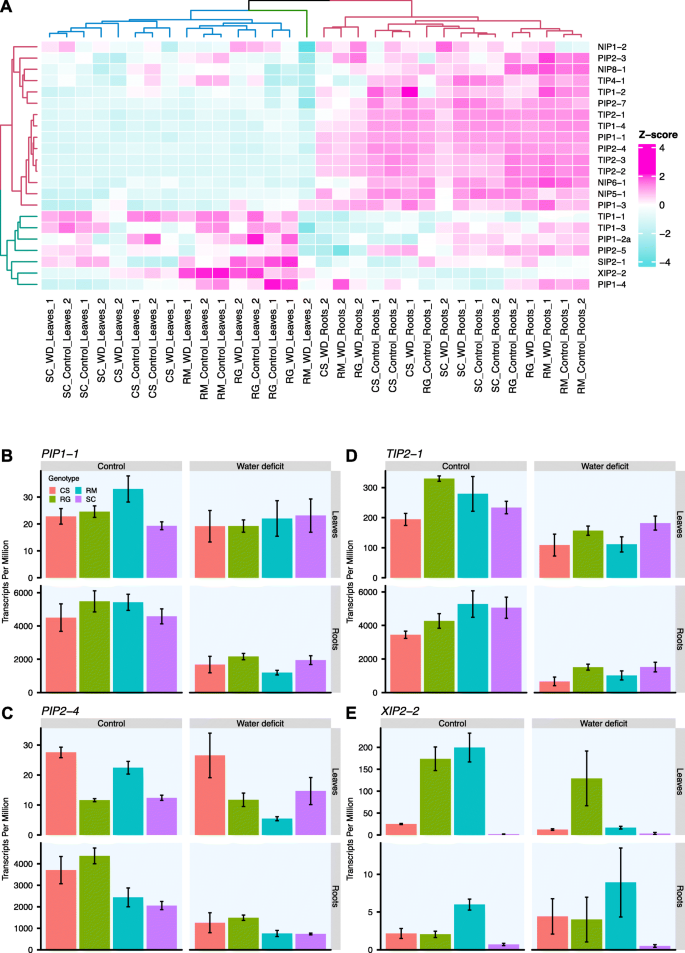
促进水和小分子跨膜运输的MIP家族蛋白在葡萄藤中有29个成员。gydF4y2Ba34gydF4y2Ba]。对表达的MIP基因进行聚类分析,结果显示MIP基因在器官上有明显的分离,两个主要群体呈现相反的表达模式;有些基因在根中高表达,在叶中低表达,反之亦然(图2)。gydF4y2Ba7gydF4y2Baa).第三个簇代表第2周进行RM的wd处理的叶片样本,其中大多数MIP基因的转录丰度较低。在所有gydF4y2Ba葡萄属gydF4y2BaMIPs,只有gydF4y2Ba质膜内在蛋白1-3gydF4y2Ba(gydF4y2BaPIP1-3gydF4y2Ba)相对于对照植株(附加文件gydF4y2Ba12gydF4y2Ba);在第2周,SC和RM的WD叶中含量显著增加。只有两个度,gydF4y2BaPIP1-2agydF4y2Ba和gydF4y2Ba张力质体内在蛋白1-3gydF4y2Ba(gydF4y2BaTIP1-3gydF4y2Ba),在第7天,WD显著降低了RM叶片的抗氧化能力。在pip中,应该注意的是gydF4y2BaPIP1-1gydF4y2Ba表达量最高,似乎是根特异性的,TPM的平均表达量至少是叶片的100倍(图2)。gydF4y2Ba7gydF4y2Bab)。gydF4y2BaPIP2-4gydF4y2Ba在所有基因型中,根中的基因表达量也很高,WD处理后基因表达量降低(图2)。gydF4y2Ba7gydF4y2Bac和附加文件gydF4y2Ba12gydF4y2Ba)。gydF4y2BaPIP2-5gydF4y2Ba除了SC基因的表达量下降不显著外,其他基因的表达量相似。有趣的是,这两个基因以及gydF4y2BaPIP2-7gydF4y2Ba结果表明,WD只在RM叶片中表达量减少。在这些TIPs中,gydF4y2BaTIP2-1gydF4y2Ba(无花果。gydF4y2Ba7gydF4y2Bad)和gydF4y2BaTIP1-4gydF4y2Ba表达量最高,特别是在根中,除SC外,WD对所有基因型的表达量都有显著降低(附加文件gydF4y2Ba12gydF4y2Ba)。最后,gydF4y2BaX内在蛋白2-2gydF4y2Ba(gydF4y2BaXIP2-2gydF4y2Ba)的表达主要在RM器官中检测到,大部分在叶片中检测到(图2)。gydF4y2Ba7gydF4y2Bae).在对照和WD处理下,RG均能诱导其表达,而在RM叶片中则被WD显著抑制,CS和SC均未检测到。gydF4y2Ba
水分亏缺对四种基因型mip相关基因表达的影响。gydF4y2Ba一个gydF4y2Ba) MIP家族成员的聚类。热图表示MIP家族基因的转录物丰度,log2转换后的TPM值表示为每个基因计算的z分数,从低到高的绿松石色到粉红色。树状图被着色以区分主要的簇。通过去除75%以上的样本中log2TPM < 1的基因来选择表达基因。的表达谱gydF4y2BaPIP1-1gydF4y2Ba(gydF4y2BabgydF4y2Ba),gydF4y2BaPIP2-4gydF4y2Ba(gydF4y2BacgydF4y2Ba),gydF4y2BaTIP2-4gydF4y2Ba(gydF4y2BadgydF4y2Ba),gydF4y2BaXIP2-2gydF4y2Ba(gydF4y2BaegydF4y2Ba)治疗两周后。叶片(上行)和根(下行)的对照(左列)和WD处理的葡萄藤(右列)的表达量以每百万转录本表示,平均值±SE, n = 3 - 5个单个葡萄藤。基因型CS、RG、RM和SC分别用红色、绿色、蓝色和紫色表示gydF4y2Ba
ABA生物合成和脂质代谢是响应WD的常见途径gydF4y2Ba
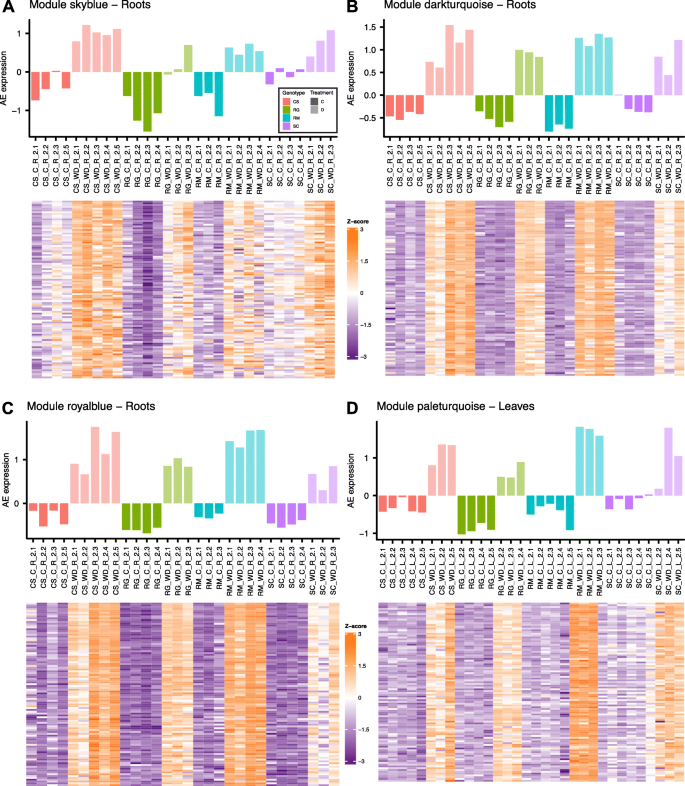
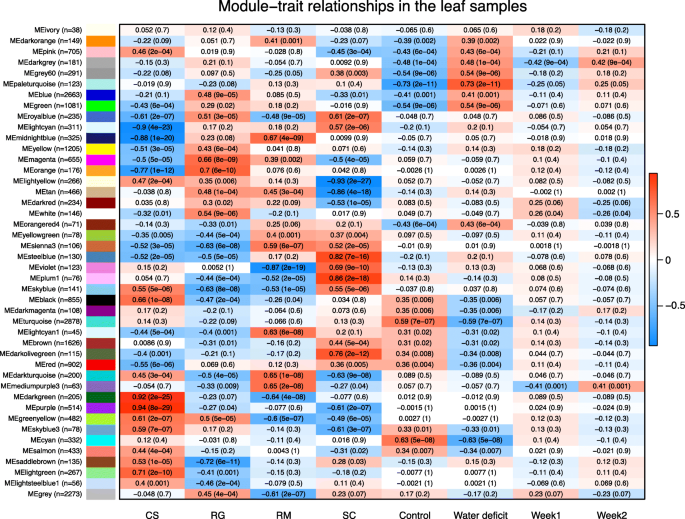
在对WD的响应中,在四种葡萄基因型中有过多的基因被转录调控。为了确定与所有四种干旱反应相关的基因gydF4y2Ba葡萄属gydF4y2Ba为了确定潜在的物种特异性基因亚网络,我们分别对两个器官进行加权基因共表达网络分析(WGCNA),以更好地定义模块(如基因簇)。在根中,鉴定出58个不同的模块(图2)。gydF4y2Ba8gydF4y2Ba)。为了确定给定基因与特定模块的关系,计算了其表达谱与模块特征基因之间的相关性gydF4y2Ba13gydF4y2Ba)。模块特征基因是一种人工基因,被认为是模块中基因表达模式的代表[gydF4y2Ba35gydF4y2Ba]。根据与模块特征基因的相关性,从每个模块中提取相关性最高的前100个基因,并对GO功能类别进行富集分析(附加文件)gydF4y2Ba14gydF4y2Ba)。其中14个模块与WD呈正相关,10个模块与WD呈负相关,p值< 0.05。大多数正相关模块在对水剥夺GO类的响应中富集(附加文件)gydF4y2Ba14gydF4y2Ba)。负相关模块的基因集富集分析显示,与生长调控相关的许多过程都富集。三个主要模块与WD的正相关程度最高(Pearson相关系数>.6)(图2)。gydF4y2Ba8gydF4y2Ba):天蓝色(图。gydF4y2Ba9gydF4y2Baa),深绿松石色(图2)gydF4y2Ba9gydF4y2Bab)和宝蓝色(图2)。gydF4y2Ba9gydF4y2Bac)。这些模块中连接最多的前100个基因在整个样本中呈现出紧密保守的表达模式(图3中的热图)。gydF4y2Ba9gydF4y2Ba)。skyblue模块在缺水反应、酸性化学反应和脂质代谢相关基因中富集;与干旱敏感型RG呈负相关,WD处理后特征基因平均表达量较低(图2)。gydF4y2Ba9gydF4y2Baa).在该模块中最相关的前150个基因中,基因同源物编码甘油-3-磷酸酰基转移酶(GPAT7)、3-酮酰基辅酶a -合成酶1 (KCS1)、GDSL-MOTIF酯酶/酰基转移酶/脂肪酶样(GDSL-like)、脂转移样蛋白VAS (VAS)、β -酮酰基还原酶1 (KCR1)、脂肪酸去饱和酶5 (ADS3)、细胞色素P450家族86亚家族86多肽1 (CYP86A1)、casp样蛋白1D1 (CASPL 1D1)、GPAT4、酰基活化酶3 (AAE3)、鉴定出磺基喹啉二酰基甘油1 (SQD1)、SQD2。对暗绿松石模块的基因集富集分析表明,该模块与缺水、ABA和半乳糖醇合成酶类别有关。gydF4y2BaRD29BgydF4y2BaLTI65是该模块中连接最多的基因,是aba诱导的标记基因。在该模块中其他高度关联的基因(前100个)中,还有几个与aba相关的基因,如gydF4y2BaDHN1gydF4y2Ba,gydF4y2Ba高度aba诱导pp2c基因2gydF4y2Ba(gydF4y2Ba还gydF4y2Ba),gydF4y2Ba1 .不敏感的gydF4y2Ba(gydF4y2BaABI1gydF4y2Ba也被称为gydF4y2BaPP2C4gydF4y2Ba),gydF4y2Ba—ABF2gydF4y2Ba,gydF4y2BaDREB2AgydF4y2Ba,gydF4y2BaNCED3gydF4y2Ba和gydF4y2BaCYP707A2gydF4y2Ba。值得注意的是,与WD正相关的浅黄色模块也是一个基因簇,其枢纽基因(与该模块连接最多的基因)是一个含NAC结构域的蛋白。gydF4y2BaRD26 / NAC072gydF4y2Ba。在该模块中还发现了其他aba相关基因。深绿松石模块的丰富功能类别代表了WD响应(图2)。gydF4y2Ba9gydF4y2Bab).与royalblue模块高度连接的基因也与ABA密切相关(图2)。gydF4y2Ba9gydF4y2Bac和附加文件gydF4y2Ba14gydF4y2Ba)。gydF4y2BaABI1gydF4y2Ba在皇家蓝模块中联系最紧密的基因是否紧随其后gydF4y2Ba晚期胚胎发生丰富gydF4y2Ba(gydF4y2BaLEA7gydF4y2Ba),gydF4y2BaNCED3gydF4y2Ba和gydF4y2BaGOLS2gydF4y2Ba(在前5个联系最紧密的基因中)。thistle2模块与WD显著相关,热反应基因过多。事实上,在这个模块中连接的前25个基因包括21个与热休克蛋白(HSPs)相对应的基因,以及两个假定的同源基因gydF4y2BaAtGOLS1gydF4y2Ba一种是UBX结构域蛋白,另一种是未知蛋白。该模块中富集的氧化石墨烯种类包括对ABA的反应、对醇的反应和对脂质的反应。skyblue3模块与RM呈正相关,与SC负相关,该模块富含半胱氨酸生物合成、丝氨酸和谷胱甘肽代谢。关于半胱氨酸和ABA生物合成的最新发现[gydF4y2Ba28gydF4y2Ba],值得注意的是,在该模块中连接最多的基因(前30个)中,例如,有一个基因被推定为编码agydF4y2Ba丝氨酸乙酰转移酶gydF4y2Ba(gydF4y2BaSAT3gydF4y2Ba),已知催化从丝氨酸合成半胱氨酸的第一步(附加文件gydF4y2Ba15gydF4y2Ba)。它在RM根中的表达量高于其他基因型,且RM对WD的表达差异较大。gydF4y2Ba
WGCNA模块中的基因表达。根模块“skyblue”的特征基因平均表达式(gydF4y2Ba一个gydF4y2Ba)、“深绿松石”(gydF4y2BabgydF4y2Ba)、“royalblue”(gydF4y2BacgydF4y2Ba),而叶片模组“paleturquoise”(gydF4y2BadgydF4y2Ba)治疗两周后。样本用列表示。红、绿、蓝、紫分别代表CS、RG、RM、SC。纯色和半透明色对应于控制(gydF4y2BacgydF4y2Ba)和水分亏缺(WD)处理。较低的热图表示每个基因的z分数,使用模块中连接最多的前100个基因的log2转换TPM值计算(橙色表示高表达,紫色表示低表达)。gydF4y2Ba
叶片样本的WGCNA提供了对WD转录组反应的额外见解(图2)。gydF4y2Ba10gydF4y2Ba和其他文件gydF4y2Ba16gydF4y2Ba和gydF4y2Ba17gydF4y2Ba)。与WD呈正相关模块有8个,负相关模块有10个。总的来说,响应缺水、ABA和脂质基因的正相关模块富集,而光合、生长、质体和细胞壁组织基因的负相关模块富集。叶片中的古绿松石模块(图1)gydF4y2Ba9gydF4y2Bad)与WD呈正相关。像根一样,一些aba相关基因如gydF4y2BaNCED3gydF4y2Ba,gydF4y2BaPP2CgydF4y2Ba,gydF4y2BaABI2gydF4y2Ba,gydF4y2Ba—ABF2gydF4y2Ba,gydF4y2BaRD22gydF4y2Ba和gydF4y2BaGOLS2gydF4y2Ba在该基因簇内相关性最高的前100个基因中,深灰色模块的叶片中聚集了几个HSPs。gydF4y2Ba
在四种基因型中,与WD共同核心反应相关的强deg在RM中反应更强gydF4y2Ba
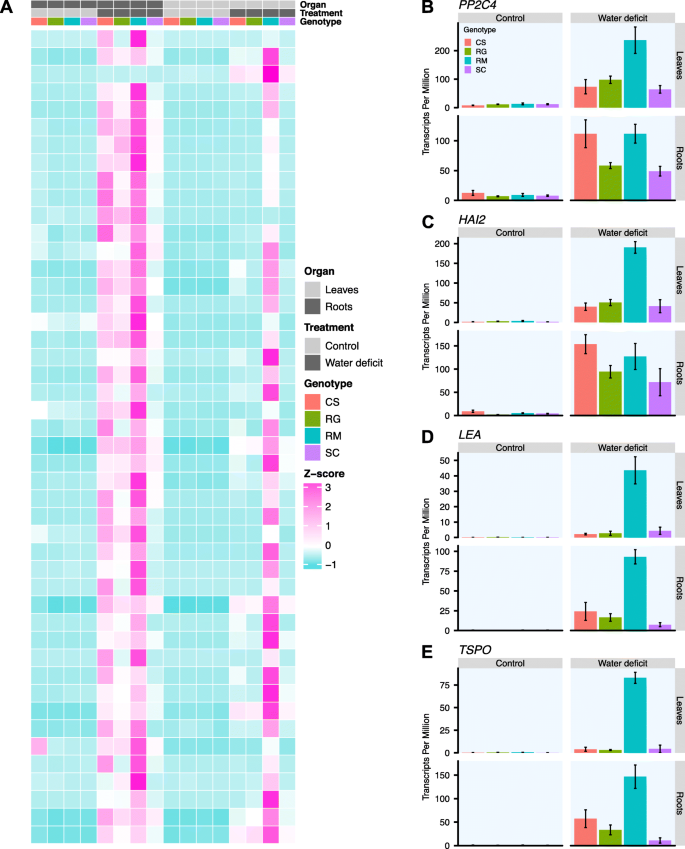
对于每个基因型,我们选择了一组在根和叶中被WD强烈上调的deg(在两个器官中显示出响应WD的LFC bbb40)。仅在治疗的第二周检测到这些deg, RG, SC, CS和RM分别为19,20,36,143 deg。然后对这些基因列表进行筛选,以检测在给定基因型中比其他三种基因型更容易诱导的表达基因。经过这一步,在CS中只检测到一个基因,但由于观察到该基因的生物学变异性,很难得出任何结论;筛选后,RG和SC没有基因残留,唯一显著的基因列表与含有46个DEGs的RM基因型相对应。WD处理两周后,这些基因在根和叶(LFC bbbb4)中均被强烈诱导,且表达量显著高于其他三种基因型(图2)。gydF4y2Ba11gydF4y2Baa).其中一些基因在响应WD时包含在四个基因型共有的核心基因集中,但相对于RM,它们在茎部的诱导程度要低得多,或者在其他三个基因型中根本不表达。基因集富集分析发现,对水分亏缺的反应和ABA是该基因集最富集的功能类别(数据未显示),包括gydF4y2BaPP2C4gydF4y2Ba(gydF4y2BaABI1gydF4y2Ba)(图。gydF4y2Ba11gydF4y2Bab)和gydF4y2Ba还gydF4y2Ba参与ABA信号传导(图2)gydF4y2Ba11gydF4y2Bac).此外gydF4y2BaLEAgydF4y2Ba和一个gydF4y2BaTspo相关蛋白gydF4y2Ba(gydF4y2BaTSPOgydF4y2Ba)基因已知参与对ABA的反应(图2)。gydF4y2Ba11gydF4y2BaD和e)在这个基因集中。其他几个已知参与WD反应的基因也包括在这个列表中(附加文件)gydF4y2Ba18gydF4y2Ba)以及大量功能未知的基因。而且,之前已经证明gydF4y2BaABI5gydF4y2Ba与RG相比,另一种ABA和脱水应答转录因子的表达受到快速和严重脱水的诱导,尤其是在RM叶片中[gydF4y2Ba12gydF4y2Ba]。有趣的是,一个编码早期蛋氨酸标记6蛋白(GEA6)的基因(gydF4y2BaVIT_13s0067g01240gydF4y2Ba),已知由ABI5与其启动子直接结合而激活,也在该基因集中发现。该基因的表达仅受WD的强烈诱导。这进一步证实了……的潜在重要性gydF4y2BaABI5gydF4y2Ba在抗旱方面。总之,这些结果表明,WD诱导了RM叶片中更强的转录组修饰。即使四种基因型在根系中的表达水平相同,RM在叶片中对干旱相关基因的表达也显著高于WD。因为RM是4个品种中最耐旱的gydF4y2Ba葡萄属gydF4y2Ba基因型研究表明,这些响应WD潜在的根到茎信号的基因可能显著参与其抗旱性。gydF4y2Ba
在RM处理2周后,WD诱导的DEGs在根和叶中的表达谱。gydF4y2Ba一个gydF4y2Ba)治疗两周后不同情况下基因表达的热图。对于每种情况(器官x治疗x基因型),计算平均TPM值并转换log2。这些表达值在热图上表示为z分数(每个基因计算),并从绿松石(低值)到粉红色(高值)着色。在热图的顶部,分别用浅灰色和深灰色标识叶片和根系的不同条件,用浅灰色和深灰色标识对照和水分亏缺处理,用红色、绿色、蓝色和紫色标识CS、RG、RM和SC基因型。的表达谱gydF4y2BaPP2C4gydF4y2Ba(gydF4y2BabgydF4y2Ba),gydF4y2Ba还gydF4y2Ba(gydF4y2BacgydF4y2Ba),gydF4y2BaLEAgydF4y2Ba(gydF4y2BadgydF4y2Ba),gydF4y2BaTSPOgydF4y2Ba(gydF4y2BaegydF4y2Ba)治疗两周后。叶片(第一行)和根(第二行)的对照(左列)和WD处理的葡萄藤(右列)中的表达以转录本每百万(TPM)表示,平均值±SE, n = 3 - 5个单独的葡萄藤。不同的基因型使用与热图相同的颜色代码表示(gydF4y2Ba一个gydF4y2Ba)gydF4y2Ba
讨论gydF4y2Ba
RM有不同的生理和分子策略来应对WDgydF4y2Ba
在本研究的温室条件下,我们确定与其他三种葡萄基因型相比,RM对WD的耐受性最强。在大型盆栽中生长的老植株中,与抗旱能力相关的主要因素是在抗旱期间维持较高的气孔导度和光合作用。RM使其气孔开放的时间更长,并保持较高的光合作用速率。在另一项研究中,更高的气孔导度也与更高的RM耐旱性有关[gydF4y2Ba30.gydF4y2Ba]。切除WD后,RM恢复得更快,对随后的脱水更加不敏感。这些生理反应可能改善了其相对于RG的能量状态,RG是本实验中最干旱敏感的基因型。关于茎干水势,唯一设计用于测量该特性与锅RSWC相关的实验如图所示。gydF4y2Ba3.gydF4y2Ba。为了更好地捕捉低RSWC(从50%到0%)下茎水势下降过程中潜在的基因型差异,需要进行更多的重复试验;已知植物的等水性与其耐旱性直接相关。本文中包括的其他实验不允许对该参数作进一步的结论,因为植物要么在茎水势下降之前收获,要么在茎水势下降之后收获。已知RM的生根深度更深[gydF4y2Ba30.gydF4y2Ba]和较小的叶子[gydF4y2Ba36gydF4y2Ba]与RG相比,RG可能有助于藤内较高的水分状态,从而使这种光合作用策略在这些条件下取得成功。较高的能量状态也有助于促进根系生长。在小盆中生长的幼嫩植株中,RM有更大的转录组反应,包括已知影响水分关系的ABA和mip相关基因。RM更高gydF4y2BaNCED3gydF4y2Ba转录物丰度对WD的响应,可能是幼藤叶片中较高的ABA浓度。gydF4y2BaNCED3gydF4y2Ba表达对半胱氨酸浓度敏感[gydF4y2Ba28gydF4y2Ba这一点在RM中也得到了加强。这项研究[gydF4y2Ba28gydF4y2Ba表明有多种因素(硫酸盐、半胱氨酸等)可通过ABA生物合成影响气孔导度;然而,ABA仍被认为是WD期间的主要调节因子。在之前的一项研究中[gydF4y2Ba36gydF4y2Ba], RG的气孔导度对快速脱水的敏感性远高于RM,但两种植物对施用ABA的敏感性相似。气孔对ABA的敏感性是否随WD时间的延长而变化还有待研究。在这些葡萄上进行的RNA-Seq和RT-qPCR均显示,与WD反应相关的基因同样强烈上调,而在RM中表现得更为明显。这表明当土壤含水量限制时,该基因型的转录组调控更为动态。RM可能更适应WD,因为它是在美国南部德克萨斯州炎热干燥的气候中进化而来的,而RG是在美国东北部凉爽潮湿的气候中进化而来的。总之,值得注意的是,RM较强的耐旱性与发育阶段的多种机制有关。事实上,在生长的早期阶段,RM是对WD最敏感的基因型,与其他三种基因型相比,表现出更强的转录组调节。此外,在较老的葡萄树中,这种基因型进化出了独特的适应策略,使其具有更高的耐旱性。gydF4y2Ba
ABA的生物合成和信号转导是葡萄对WD的核心响应gydF4y2Ba
转录组学分析显示,在四种葡萄基因型中,许多基因的转录丰度随WD的变化而增加或减少(图2)。gydF4y2Ba4gydF4y2Ba)。然而,应该注意的是,所有物种的读数都与gydF4y2Ba葡萄gydF4y2Ba参考基因组[gydF4y2Ba37gydF4y2Ba]。如果reads与各自的基因组或每个物种特有的从头转录组组装对齐,可能会观察到基因型之间更强的区别。这种策略可能需要比目前研究中使用的测序深度更深的测序深度。另一个需要注意的问题是基因复制。事实上,一个基因的高转录物丰度可以用特定基因组中强烈的基因复制来解释。正如预期的那样,deg主要与水分剥夺反应和对ABA的反应有关。除了gydF4y2Ba数控gydF4y2Ba(ABA生物合成)基因,ABA核心信号通路的关键参与者如gydF4y2BaPP2CsgydF4y2Ba,gydF4y2BaSnRK2sgydF4y2Ba和gydF4y2Ba沛富gydF4y2Ba在所有基因型中均被WD处理显著调节(图2)。gydF4y2Ba6gydF4y2Baa和附加文件gydF4y2Ba10gydF4y2Ba)。对这四个人的转录组进行了广泛的分析gydF4y2Ba葡萄属gydF4y2Ba使用WGCNA的物种证实了差异表达分析结果,确定了基因型之间的保守基因模块,这些基因型似乎在对缺水的反应中起着至关重要的作用(图2)。gydF4y2Ba8gydF4y2Ba)。在根部,aba相关模块暗绿松石和宝蓝色确定了两个中心基因,gydF4y2BaRD29BgydF4y2Ba和gydF4y2BaABI1gydF4y2Ba,分别是这些模块中联系最紧密的基因。gydF4y2BaRD29BgydF4y2Ba被描述为干旱转录记忆反应的重要参与者[gydF4y2Ba37gydF4y2Ba反复干旱胁迫强烈促进了这种基因表达诱导。在多年生植物中,记忆应激因子似乎更加不可或缺,因为它们需要适应多年来的重复压力[gydF4y2Ba38gydF4y2Ba]。此外,这种机制的表观遗传性质加强了其理解的相关性gydF4y2Ba葡萄属gydF4y2Ba抗旱基因型变异[gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba]。此外,研究表明,在葡萄的生命周期中,以前暴露于WD会影响其气孔孔径的调节[gydF4y2Ba41gydF4y2Ba]。gydF4y2BaABI1gydF4y2Ba编码一种负调控ABA信号的PP2C磷酸酶[gydF4y2Ba42gydF4y2Ba]。它是royalblue模块中关联度最高的基因(Pearson相关系数0.984),紧随其后的是其他重要的ABA和干旱相关基因,包括gydF4y2BaNCED3gydF4y2Ba(0.974)。有趣的是,我们发现ABA通路中积极和消极的参与者都是密切相关的。这表明这一途径受到非常严格的调控。该模块似乎代表了aba依赖性干旱响应的调控核心集群gydF4y2Ba葡萄属gydF4y2Ba。的强相关性gydF4y2Ba硝酸盐转运蛋白1/肽转运蛋白家族6.4gydF4y2Ba(gydF4y2BaNPF6.4gydF4y2Ba),其对干旱的强烈基因表达诱导表明其可能参与ABA运输,如前面描述的NPF4.6 [gydF4y2Ba43gydF4y2Ba]。的最近邻gydF4y2BaAtNPF4.6gydF4y2Ba在黑皮诺基因组中gydF4y2BaVIT_01s0026g01570gydF4y2Ba和gydF4y2BaVIT_17s0000g05640gydF4y2Ba;然而,他们的表达谱与gydF4y2BaNCED3gydF4y2Ba与的两个同源词相反gydF4y2BaNPF6.4gydF4y2Ba(gydF4y2BaVIT_02s0087g00580gydF4y2Ba和gydF4y2BaVIT_12s0059g01240gydF4y2Ba)。skyblue模块也与WD显著相关,对该模块高关联基因的分析表明,该模块与脂质代谢有关。它代表了一个有希望的集群来探索参与脂质屏障形成的基因,如脂质沉积过程,这是耐旱性的一个重要特征[gydF4y2Ba44gydF4y2Ba]。gydF4y2Ba
ABA在抗旱中的抗氧化作用gydF4y2Ba
除了调节气孔导度外,ABA在脱水反应中还具有多种作用。ABA调节种子萌发、细胞和器官生长、能量代谢以及抗氧化剂和渗透保护剂的产生[gydF4y2Ba19gydF4y2Ba,gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba]。例如,半乳糖醇合成酶的转录物丰度对WD有高度反应[gydF4y2Ba47gydF4y2Ba]及ABA [gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba]。在实验室或田间种植的植物中,半乳糖醇合成酶的过度表达导致耐旱性显著提高,从而提高产量[gydF4y2Ba47gydF4y2Ba,gydF4y2Ba49gydF4y2Ba]。据认为,这些酶的下游产物(棉子糖家族低聚糖)作为抗氧化剂和渗透保护剂,使叶片具有更好的光化学效率[gydF4y2Ba47gydF4y2Ba]。的表达式gydF4y2BaNCEDsgydF4y2Ba半乳糖醇合成酶在RM中对WD反应强烈,表达水平较高。此外,参与谷胱甘肽代谢的基因组成性表达在RM中较高。抗坏血酸-谷胱甘肽循环作为抗氧化防御是非常重要的[gydF4y2Ba50gydF4y2Ba]。gydF4y2Ba
MIPs对WD的响应gydF4y2Ba
水通道蛋白(aquaporins, AQPs)属于MIP家族,在水分运输中起着重要作用,是研究抗旱性基因型变异的良好候选者。此外,ABA似乎影响了一些AQPs的转录丰度和活性[gydF4y2Ba51gydF4y2Ba]。AQPs被认为在环境胁迫条件下维持水分稳态中起关键作用[gydF4y2Ba52gydF4y2Ba,gydF4y2Ba53gydF4y2Ba]。编码AQPs的基因在干旱胁迫下的表达模式尚不明确。虽然一些研究表明AQPs的上调促进了WD期间的水分输送,但其他研究人员强调其下调是为了阻止水分的过度流失[gydF4y2Ba54gydF4y2Ba]。这突出了AQP基因表达和WD反应的可变性,这取决于细胞组织、器官或基因型以及WD的严重程度和持续时间。经过12天的WD处理,拟南芥中大部分AQP基因的表达减少,这可能是为了减少通过细胞膜的水分流动,避免叶片肿胀的进一步丧失[gydF4y2Ba55gydF4y2Ba]。四种MIP编码基因的基因表达分析gydF4y2Ba葡萄属gydF4y2Ba不同物种对WD的响应也显示出类似的模式,RM叶片数量大幅减少(图2)。gydF4y2Ba7gydF4y2Ba)。在根系中,经过两周WD处理后,基因型之间的反应趋于相似,与充分浇水的葡萄藤相比,表达量减少。这表明RM更有效地调节活性aqp以维持水分稳态,这可能有助于其更高的茎水势和耐旱性。虽然这些基因在四种基因型的根系中都有表达,但RM对茎部的响应似乎更强,这表明从根系(干旱感知发生的地方)到茎部(蒸腾和光合作用的调节发生的地方)之间的沟通更有效和敏感。这假定地表根系开始脱水,并在茎的水分状况发生任何明显变化之前向茎发送信号。gydF4y2Ba
根系到茎的长距离信号传导是干旱胁迫的关键机制gydF4y2Ba
砧木在接穗对缺水的适应中起着关键作用。gydF4y2Ba56gydF4y2Ba]。然而,允许砧木应对水分胁迫以支持产生接穗的浆果的和谐生长的机制仍然在很大程度上是未知的。Takahashi等人,[gydF4y2Ba57gydF4y2Ba]最近描述了一种响应WD控制气孔孔径的远程机制。干旱胁迫在根系感知诱导表达gydF4y2BaClavata3 /胚胎周围区相关gydF4y2Ba(gydF4y2BaCLE25gydF4y2Ba)根源的[gydF4y2Ba57gydF4y2Ba]。CLE25肽被运送到叶片,在那里它们几乎不被任何分生系统1和3 (BAM1和3)受体样激酶感知。这种长距离多肽运输通过诱导NCED3诱导ABA水平增加并触发气孔关闭。的最近的同源基因gydF4y2BaCLE25gydF4y2Ba(gydF4y2BaVIT_01s0026g01090gydF4y2Ba),gydF4y2BaBAM1gydF4y2Ba(gydF4y2BaVIT_00s1353g00010gydF4y2Ba),gydF4y2BaBAM3gydF4y2Ba(gydF4y2BaVIT_01s0010g00330gydF4y2Ba)在任何一种植物的根和芽中均未被WD诱导gydF4y2Ba葡萄属gydF4y2Ba我们研究中的基因型(数据未显示)。在拟南芥中,诱导gydF4y2BaCLE25gydF4y2Ba脱水3 h后观察[gydF4y2Ba57gydF4y2Ba]。这种快速的分子反应可能已经在WD胁迫7天和14天后收获的葡萄根部发生,然后在转录组水平上不再检测到。gydF4y2Ba
其他最近的研究结果表明,WD增加木质部中的硫酸盐浓度[gydF4y2Ba28gydF4y2Ba,gydF4y2Ba58gydF4y2Ba,gydF4y2Ba59gydF4y2Ba],然后诱导半胱氨酸生物合成的增加,导致gydF4y2BaNCED3gydF4y2Ba表达,ABA生物合成和气孔关闭增加[gydF4y2Ba28gydF4y2Ba]。我们的研究表明,半胱氨酸生物合成可能在RM的根部增加,这可能是增加的原因gydF4y2BaNCED3gydF4y2Ba转录丰度对WD的响应。gydF4y2Ba
根到茎的长距离信号是一个复杂的通信系统,涉及植物生长的几个关键过程[gydF4y2Ba60gydF4y2Ba]。在葡萄藤中有证据表明,在观察到的转录物丰度变化之前,根信号就发生了,以响应逐渐的WD;蛋白质组学分析显示,在茎伸长率、气孔导度和光合作用下降之前,茎尖(包括未成熟叶)中与光合作用和抗氧化防御相关的蛋白质丰度增加[gydF4y2Ba61gydF4y2Ba]。gydF4y2Ba
在本研究中,与之前观察到的一样,在叶片中观察到更强烈的反应,涉及许多与胁迫和ABA相关的deg [gydF4y2Ba12gydF4y2Ba,gydF4y2Ba32gydF4y2Ba]。检测到的一组deg显示,WD在根和叶中的表达均显著增加,而RM叶片中的转录物丰度显著高于其他三种基因型。有趣的是,图中所示的四种基因型中有许多与ABA相关并参与对WD共同核心反应的基因。gydF4y2Ba6gydF4y2Ba都包含在这个基因列表中。其他几个已知的受干旱调控的基因也被包括在内gydF4y2Ba18gydF4y2Ba)。许多基因,包括枢纽基因,与暗绿松石和宝蓝色模块高度相关,WGCNA基因簇与根系WD处理显著相关(图2)。gydF4y2Ba8gydF4y2Ba),存在于该基因组中,如gydF4y2BaPP2C4gydF4y2Ba(gydF4y2BaABI1gydF4y2Ba), royalblue模块的枢纽基因(图2)。gydF4y2Ba11gydF4y2Bab、附加文件gydF4y2Ba13gydF4y2Ba和gydF4y2Ba18gydF4y2Ba)。此外,有趣的是,经过两周WD处理后,RM叶片中编码MIPs的特定基因在这种情况下表现出强烈的下调(图2)。gydF4y2Ba7gydF4y2Ba)。在这些基因中,gydF4y2BaPIP2-7gydF4y2Ba仅在RM中表现出强烈的下调。与此同时,基因gydF4y2BaTSPOgydF4y2Ba在相同条件下被发现特别强烈地诱导(图2)。gydF4y2Ba11gydF4y2Bae).这种负相关性在蛋白质水平上是已知的,通过涉及TSPO的AQPs调节机制,PIP2-7丰度降低[gydF4y2Ba62gydF4y2Ba]。总之,这些观察结果表明,RM的感知或敏感性比其他更明显gydF4y2Ba葡萄属gydF4y2Ba基因型。该基因型的根转录组修饰与茎部强烈的转录调控密切相关,这可能是其耐旱性较高的原因之一。gydF4y2Ba
结论gydF4y2Ba
本研究的WD实验与前人的研究结果一致,RM的耐旱性强于其他三种gydF4y2Ba葡萄属gydF4y2Ba基因型。RM比其他基因型更强的抗旱性与同等水分条件下更高的气孔导度和光合作用有关。WGCNA鉴定出与WD应答相关的基因子网络,包括ABA生物合成和信号子网络、脂质代谢、抗氧化防御、aqp和热休克蛋白。RM的耐旱性与ABA生物合成和信号基因的早期和增强表达对WD的敏感性相关。AQP表达的降低也可能与叶片抗旱性有关。对WD的更高耐受性还包括RM更高的光合作用,这可能有助于长期的能源供应。WD RM中光合作用的改善可能与更高的茎水势和aba表达增加有关gydF4y2BaGOLS2gydF4y2Ba允许提高抗氧化防御和随后提高叶片的光化学效率。gydF4y2Ba
方法gydF4y2Ba
植物材料和生长条件gydF4y2Ba
每个实验研究4种基因型;gydF4y2Ba葡萄gydF4y2Ba简历。赤霞珠8号克隆(CS);gydF4y2Ba葡萄属锐利gydF4y2Ba(RG),gydF4y2Ba葡萄属champiniigydF4y2Ba(RM)和agydF4y2Ba葡萄gydF4y2BaxgydF4y2BagirdianagydF4y2Ba混合(SC)。最初的无性繁殖葡萄藤是由安德鲁·沃克博士和加州大学戴维斯分校的植物服务基金会提供的,并在我们自己的玻璃温室中不断繁殖。在21 ~ 26℃、20 ~ 50%的相对湿度和1200 μmol / m的白天平均光照条件下栽培gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba。补充光使用1000 W高压钠灯,维持16 h的光照和8 h的暗循环。选择各基因型的1 ~ 3年生葡萄藤,在12 L罐中种植,从罐底到罐顶土壤质量相等,分别用0.5 kg粘土球、0.5 kg烧结粘土和13.3 kg中砂进行修剪。用Cramer 's全营养液(1.5 mM Ca (NO)gydF4y2Ba3.gydF4y2Ba)gydF4y2Ba2gydF4y2Ba4 hgydF4y2Ba2gydF4y2BaO;2mm KNOgydF4y2Ba3.gydF4y2Ba;0.6 mM Mg (SOgydF4y2Ba4gydF4y2Ba), 7小时gydF4y2Ba2gydF4y2BaO;1mm KHgydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba;1.5 mM CaClgydF4y2Ba2gydF4y2Ba2 hgydF4y2Ba2gydF4y2BaO;36 μM Fe (Sprint 330);1 μM MnSOgydF4y2Ba4gydF4y2BaHgydF4y2Ba2gydF4y2BaO;0.5 μM CuSOgydF4y2Ba4gydF4y2Ba5 hgydF4y2Ba2gydF4y2BaO;20 μM ZnSOgydF4y2Ba4gydF4y2Ba7小时gydF4y2Ba2gydF4y2BaO;20 μm hgydF4y2Ba3.gydF4y2Ba薄gydF4y2Ba3.gydF4y2Ba;0.01 μm (nh)gydF4y2Ba4gydF4y2Ba)gydF4y2Ba6gydF4y2Ba莫gydF4y2Ba7gydF4y2BaOgydF4y2Ba24gydF4y2Ba4 hgydF4y2Ba2gydF4y2Ba在实验开始前每周两次。每根藤的一根枝条被修剪成一根直立的枝条,绑在木桩上。除去茎尖,只留下10片叶片。除第10节生长的1个腋窝茎外,侧芽均被切除。其他出现的侧枝都被切除了。这使得每根藤的叶面积相对相似,从而能够在WD试验期间统一控制蒸腾和RSWC。在其他利用较小的藤蔓和盆栽的试验中,四种不同基因型的单节插条以珍珠岩/蛭石1/1的混合生根。将有根的插枝移栽到0.96升的花盆中,盆中装有80克粘土,并用1公斤中砂进行处理。在实验开始前,他们用全营养液浇灌了至少四周。用于RNA-Seq的植物用Gibeaut 's溶液灌溉[gydF4y2Ba63gydF4y2Ba]。gydF4y2Ba
WD实验,生理测量和样品收集gydF4y2Ba
每次试验前,称量盆栽,然后浇水,使其达到100%田间土壤相对含水量(RSWC)。100% RSWC被定义为在饱和灌溉两小时后,当多余的水被重力除去时,单个花盆的重量。每个花盆都用铝箔覆盖,以减少土壤蒸发。试验以1 ~ 3岁的植株为对照,采用100% RSWC条件,每天称重,添加营养液补充水分,放置13天。另一组葡萄藤进行缺水处理,让花盆自然干燥,然后在第8天重新浇水,以达到100%的RSWC。在第二个试验中,一组老化的葡萄藤作为对照,在100% RSWC下保持3周,而另一组葡萄藤自然干燥,直到达到50% RSWC,然后保持在50% RSWC下进行水分亏缺处理。罐子每天称重。每隔2天测量茎长。采用400 μmol s的便携式光合系统(LiCOR型号6400XT, Lincoln, NE, USA)测定光合作用和气孔导度gydF4y2Ba−1gydF4y2Ba流速:400 μmol molgydF4y2Ba−1gydF4y2Ba参考公司gydF4y2Ba2gydF4y2Ba27℃,PAR 1000 μmol mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba。茎水势用植物水分状态控制台(土壤湿度设备公司,CA, USA)压力室测量,测量前将切除的叶子用塑料密封袋覆盖,并用铝箔覆盖2小时。实验结束时,葡萄藤的根系水力导电性测量结果如前所述[gydF4y2Ba64gydF4y2Ba]。简单地说,使用四室扩展器(PSM Instrument Company, Albany, OR, USA)同时研究了四种基因型的根系。根的水力导电性是通过压力-流量关系来计算的,利用连接在茎上的纱布收集渗出液(至少在2分钟后获得稳态流量),压力增量为0.05 MPa,直到最终压力为0.25 MPa。RNA-Seq样本是在每个基因型的幼芽扦插上进行的单独实验中收集的。葡萄藤被分成两组,一组保持100% RSWC,另一组自然干燥两周。在第7天和第14天,从两种处理中收集叶片(不带叶柄)和整个根系,每个基因型收集3到5个单独的葡萄藤,作为实验重复(处理一周后,对照条件下的RG根除外,由于样品丢失和RNA-Seq预处理分析,只有两个实验重复)。样品立即冷冻在液氮中,保存在- 80°C。gydF4y2Ba
RNA提取、文库制备及测序gydF4y2Ba
用十六烷基三甲基溴化铵(CTAB)法从地面样品中提取总RNA [gydF4y2Ba65gydF4y2Ba]并用Spectrum plant total RNA kit (Sigma)按照制造商的说明进行纯化。总RNA用RNAse-free DNAse I (Qiagen)处理,用Nanodrop分光光度计(Thermo Scientific Nanodrop 2000a) A260吸光度定量。等份的RNA样品被送到内华达州基因组学中心,在Agilent 2100生物分析仪上使用植物RNA纳米测定法评估RNA质量,并使用Ribogreen定量系统更精确地测定数量。样品被送到俄克拉何马州医学研究基金会基因组学中心,使用Illumina NextSeq技术进行测序。gydF4y2Ba
RNA-Seq数据预处理gydF4y2Ba
使用Trimmomatic v0.36从单端75bp原始读数中移除Illumina适配器。gydF4y2Ba66gydF4y2Ba]。采用Phred质量评分最低5分的方法,在前端、后端和四碱基滑动窗口对reads进行质量修剪,最小修剪长度为36bp。在修剪前后使用FastQC v0.11.5软件评估每个样本的文库质量[gydF4y2Ba67gydF4y2Ba]。过滤后的reads与V1葡萄基因组对齐[gydF4y2Ba37gydF4y2Ba使用HISAT2 v2.0.5 [gydF4y2Ba68gydF4y2Ba]与“下游转录组分析”输出设置。每个基因的计数是用subread工具集的featurets v1.5.1获得的[gydF4y2Ba69gydF4y2Ba],每个被注释的基因总结一次唯一对齐的reads。与多个基因组位置对齐的读取和与多个基因特征的位置映射的读取不被计算在内。gydF4y2Ba
差异表达分析及功能分类富集gydF4y2Ba
R包DESeq2 [gydF4y2Ba70gydF4y2Ba]采用以下阈值对差异表达基因(deg)进行鉴定:假发现率(False Discovery Rate, FDR)校正p值< 0.05。为了选择受WD强烈诱导的基因,我们选择了叶片和根中均有log fold change (LFC) > 4的基因。从这些集合中,表达的基因被过滤掉所有样本中平均TPM低于20的基因。然后在基因型之间进行比较,以检测和提取在给定基因型中显著诱导的基因。使用R包topGO进行基因本体(GO)富集[gydF4y2Ba71gydF4y2Ba]。经Fisher检验后,经FDR校正p值> 0.01的功能类别被过滤以作进一步分析。利用墨卡托4 (gydF4y2Bahttp://plabipd.de/portal/mercator-ii-alpha-version-gydF4y2Ba,最后访问日期为2017年9月29日),并使用Fisher检验进行富集分析。经Bonferroni 's调整p值> 0.05和富集≤1的富集功能类别被过滤以作进一步分析。使用R软件包ComplexHeatmap v1.18.0绘制表达式热图[gydF4y2Ba72gydF4y2Ba],扩展[gydF4y2Ba73gydF4y2Ba],圈[gydF4y2Ba74gydF4y2Ba]。对于热图的聚类分析,距离由z分数计算,使用R函数dist和“欧几里得”距离法。使用“complete”方法对这些距离使用R函数hclust进行分层聚类。使用R软件包UpSetR [gydF4y2Ba75gydF4y2Ba]。所有其他的图都是使用R包ggplot2 [gydF4y2Ba76gydF4y2Ba]。gydF4y2Ba
共表达网络分析gydF4y2Ba
利用WGCNA R包(v1.63)构建基因共表达网络[gydF4y2Ba35gydF4y2Ba,gydF4y2Ba77gydF4y2Ba]使用每个器官的所有库,叶子(60)和根(57)。在此分析之前,在所有文库中以最小阈值为20计数去除低表达基因。在根和叶中分别获得了21,216和21,542个满足上述阈值的基因。计数数据使用R包DESeq2的variancestilizingtransformation函数进行转换。结果计数集用于网络构建和模块检测,使用函数blockwiseModules。简单地说,通过计算两个器官的双权重中值相关性提高到8的幂β来创建邻接矩阵(使用pickSoftThreshold函数估计软阈值以确保适合无尺度拓扑网络),并将maxPoutliers参数设置为0.05。随后的拓扑重叠矩阵(TOM)用于模块检测,使用dynamictreeccut算法,最小模块大小为30,分支合并切割高度为0.25。模块特征基因用于评价所得到的模块(根58个,叶44个)与性状(基因型、处理、收获时间)之间的关联。gydF4y2Ba
RT-qPCRgydF4y2Ba
利用iScript逆转录混合物将总RNA逆转录为cDNA进行RT-qPCR (Bio-Rad)。根据制造商建议,使用iTaq通用SYBR绿色超混液在CFX96 Touch Real-Time PCR检测系统(Bio-Rad)上进行定量PCR反应。归一化相对数量根据Hellemans等人的方法确定。[gydF4y2Ba78gydF4y2Ba使用参考基因gydF4y2BaGAPDHgydF4y2Ba和gydF4y2BaACT7gydF4y2Ba。相对量是相对于给定基因的平均表达量的表达值。归一化相对数量(NRQs)是每个样本相对于内参基因几何平均值的相对数量。取生物样本nrq平均值计算平均值。引物序列在附加文件中列出gydF4y2Ba19gydF4y2Ba。gydF4y2Ba
统计分析gydF4y2Ba
所有统计分析均采用R软件进行[gydF4y2Ba79gydF4y2Ba]。对于两个平均值之间的比较,使用Wilcoxon非参数检验。对于两个以上平均值的比较,采用双因素方差分析。当参数检验的假设不符合(例如非正态)时,在使用pgirmess R包中的函数kruskalmc进行非参数Kruskal-Wallis检验后进行多重比较检验[gydF4y2Ba80gydF4y2Ba]。表示多次比较之间显著差异的字母是使用multicompview R包中的multicompleters函数获得的[gydF4y2Ba81gydF4y2Ba]。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
RNA-Seq数据存储在Sequence Read Archive (SRA)数据库中,登录号为PRJNA516950。gydF4y2Ba
缩写gydF4y2Ba
- AAE3:gydF4y2Ba
-
酰基活化酶3gydF4y2Ba
- 阿坝:gydF4y2Ba
-
脱落酸gydF4y2Ba
- ABA-GE:gydF4y2Ba
-
ABA-glucose酯gydF4y2Ba
- ABCG:gydF4y2Ba
-
ATP结合盒GgydF4y2Ba
- 沛富:gydF4y2Ba
-
ABRE-BINDING因素gydF4y2Ba
- ABI:gydF4y2Ba
-
阿坝INSENSISTIVEgydF4y2Ba
- ADS3:gydF4y2Ba
-
脂肪酸去饱和酶gydF4y2Ba
- AP2-ERF:gydF4y2Ba
-
无瓣草-乙烯响应因子gydF4y2Ba
- AQP:gydF4y2Ba
-
水通道蛋白gydF4y2Ba
- ATAF1:gydF4y2Ba
-
拟南芥活化因子1gydF4y2Ba
- BAM:gydF4y2Ba
-
几乎没有分生组织gydF4y2Ba
- 本:gydF4y2Ba
-
本代码gydF4y2Ba
- CASPL 1 d1:gydF4y2Ba
-
半胱甘肽样蛋白1d1gydF4y2Ba
- 继续教育:gydF4y2Ba
-
CLAVATA3 / EMBRYO-SURROUNDING REGION-RELATEDgydF4y2Ba
- CS:gydF4y2Ba
-
赤霞珠gydF4y2Ba
- CTAB:gydF4y2Ba
-
Cetyltrimethylammonium溴化gydF4y2Ba
- CYP:gydF4y2Ba
-
细胞色素P450gydF4y2Ba
- 度:gydF4y2Ba
-
差异表达基因gydF4y2Ba
- DHN1:gydF4y2Ba
-
DEHYDRIN 1gydF4y2Ba
- 含有DREB:gydF4y2Ba
-
脱水反应元件结合gydF4y2Ba
- 罗斯福:gydF4y2Ba
-
错误发现率gydF4y2Ba
- GDSL:gydF4y2Ba
-
GDSL-MOTIF酯酶/酰基转移酶/脂肪酶gydF4y2Ba
- GEA6:gydF4y2Ba
-
早期蛋氨酸标记6蛋白gydF4y2Ba
- 走:gydF4y2Ba
-
基因本体论gydF4y2Ba
- 高尔:gydF4y2Ba
-
GALACTINOL合酶gydF4y2Ba
- GPAT:gydF4y2Ba
-
GLYCEROL-3-PHOSPHATE酰基转移酶gydF4y2Ba
- 还:gydF4y2Ba
-
高度aba诱导pp2c基因2gydF4y2Ba
- HSP:gydF4y2Ba
-
热休克蛋白gydF4y2Ba
- 九:gydF4y2Ba
-
BETA-KETOACYL还原酶gydF4y2Ba
- ;:gydF4y2Ba
-
3-KETOACYL-COA-SYNTHASEgydF4y2Ba
- 李:gydF4y2Ba
-
晚期胚胎发育丰富gydF4y2Ba
- 利物浦:gydF4y2Ba
-
测井褶皱变化gydF4y2Ba
- MIP:gydF4y2Ba
-
主要内在蛋白gydF4y2Ba
- 南京:gydF4y2Ba
-
Nac域gydF4y2Ba
- nc:gydF4y2Ba
-
Nine-cis-epoxycarotenoid加双氧酶gydF4y2Ba
- NPF:gydF4y2Ba
-
硝酸盐转运蛋白1/肽转运蛋白家族gydF4y2Ba
- 主成分分析:gydF4y2Ba
-
主成分分析gydF4y2Ba
- 皮普:gydF4y2Ba
-
质膜固有蛋白gydF4y2Ba
- PP2C:gydF4y2Ba
-
蛋白磷酸酶2CgydF4y2Ba
- RAB:gydF4y2Ba
-
RAB GTPASEgydF4y2Ba
- RCAR:gydF4y2Ba
-
aba受体的调控成分gydF4y2Ba
- 理查德·道金斯:gydF4y2Ba
-
对干燥有反应gydF4y2Ba
- 鲁柏:gydF4y2Ba
-
锐利地荣誉赞不绝口gydF4y2Ba
- RM:gydF4y2Ba
-
拉姆齐gydF4y2Ba
- RNA-Seq:gydF4y2Ba
-
RNA序列gydF4y2Ba
- RSWC:gydF4y2Ba
-
相对土壤含水量gydF4y2Ba
- RT-qPCR:gydF4y2Ba
-
逆转录定量聚合酶链反应gydF4y2Ba
- 坐:gydF4y2Ba
-
丝氨酸乙酰转移酶gydF4y2Ba
- SC:gydF4y2Ba
-
星际2gydF4y2Ba
- 爵士:gydF4y2Ba
-
芽伸长率gydF4y2Ba
- SNRK:gydF4y2Ba
-
snf1相关蛋白激酶gydF4y2Ba
- 序列图:gydF4y2Ba
-
SULFOQUINOVOSYLDIACYLGLYCEROLgydF4y2Ba
- TF:gydF4y2Ba
-
转录因子gydF4y2Ba
- 提示:gydF4y2Ba
-
张力质体固有蛋白gydF4y2Ba
- 汤姆:gydF4y2Ba
-
拓扑重叠矩阵gydF4y2Ba
- TPM:gydF4y2Ba
-
每百万份转录数gydF4y2Ba
- TSPO:gydF4y2Ba
-
Tspo相关蛋白gydF4y2Ba
- 血管:gydF4y2Ba
-
脂质转移样蛋白输精管gydF4y2Ba
- WD:gydF4y2Ba
-
水分亏缺gydF4y2Ba
- WGCNA:gydF4y2Ba
-
加权基因共表达网络分析gydF4y2Ba
- 鑫元鸿:gydF4y2Ba
-
DEHYDRIN鑫元鸿gydF4y2Ba
- XIP:gydF4y2Ba
-
X内在蛋白gydF4y2Ba
参考文献gydF4y2Ba
Fahad S, Bajwa AA, Nazir U, Anjum SA, Farooq A, Zohaib A, Sadia S, Nasim W, Adkins S, Saud S等:干旱和热胁迫下作物生产的响应和管理方案。植物科学,2017,8:1147。gydF4y2Ba
李建军,李建军,李建军,等。干旱胁迫对作物品质的影响。见:水资源胁迫与作物:可持续的方法。编辑:艾哈迈德P;2016: 375 - 92。gydF4y2Ba
植物对缺水的耐受性:物理极限和进步的可能性。[j] .地球科学进展,2005,37(1):57-67。gydF4y2Ba
Chaves MM, Zarrouk O, Francisco R, Costa JM, Santos T, Regalado AP, Rodrigues ML, Lopes CM。亏缺灌溉下的葡萄藤:生理和分子数据提示。植物学报;2010;105(5):661-76。gydF4y2Ba
舒尔茨的人力资源。水力学结构的差异解释了两种葡萄品种在干旱时期的近等水和各向异性行为。植物学报,2003;26(8):1393 - 1394。gydF4y2Ba
李建军,李建军,李建军,李建军,等。干旱胁迫下葡萄器官发育和功能的变化及其生理和非水力相互作用研究进展。植物学报;2010;37(2):98-116。gydF4y2Ba
何志强,何志强,何志强,等。各向异性:植物与环境的相互作用,而不是简单的水力特性。植物科学动态;2018;23(2):112-20。gydF4y2Ba
张丽,margaret E, Rossdeutsch L, Ollat N, Gambetta GA。葡萄砧木对接穗生长和抗旱性的影响。植物生理学理论与实验。2016;28(2):143-57。gydF4y2Ba
FAOSTAT [gydF4y2Bahttp://www.fao.org/home/engydF4y2Ba]。gydF4y2Ba
康斯托克JP。控制气孔导度和蒸腾的水力和化学信号。植物学报(英文版);2002;32(3):393 - 398。gydF4y2Ba
Tombesi S, Nardini A, Frioni T, Soccolini M, Zadra C, Farinelli D, Poni S, Palliotti A.干旱胁迫下葡萄气孔关闭的水力信号诱导和ABA维持。科学报告2015;5:12449。gydF4y2Ba
李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,等。葡萄植株水分亏缺基因的遗传背景分析。植物学报,2016,16(1):91。gydF4y2Ba
霍珀DW, Ghan R, Schlauch KA, Cramer GR.叶片脱水响应的转录组网络分析鉴定了抗旱性不同的葡萄品种ABA和乙烯信号中心的高度连接。植物学报;2016;16(1):344。gydF4y2Ba
引用本文:Coupel-Ledru A, Tyerman SD, Masclef D, Lebon E, Christophe A, Edwards EJ, Simonneau T.脱落酸对葡萄叶片水力导度的影响。植物生理学报;2017;37(3):1221 - 1234。gydF4y2Ba
李志强,李志强,李志强。SnapShot:脱落酸信号。细胞。2017;171(7):1708。gydF4y2Ba
芬克尔斯坦R.脱落酸的合成和响应,卷11:拟南芥书;2013.p . e0166。gydF4y2Ba
王晓明,王晓明。脱落酸的生物合成与分解代谢。植物生态学报;2009;31(1):1 - 6。gydF4y2Ba
李KH,朴霍奇金淋巴瘤,Kim H-Y崔SM,江F,哈W,黄,夸克JM,李I j,黄即通过应激激活葡糖苷酶聚合迅速增加活跃的脱落酸池。细胞。2006;126(6):1109 - 20。gydF4y2Ba
翁建军,叶敏,李斌,Noel JP。激素代谢和信号网络的共同进化扩展了植物的适应性。细胞。2016;166(4):881 - 93。gydF4y2Ba
周建军,周建军,周建军,周建军,周建军,等。脱落酸:核心信号网络的出现。植物学报;2010;31(1):651-79。gydF4y2Ba
杨建军,李建军,李建军,等。植物对非生物胁迫的响应机制。编辑:Pandey GK逆境下植物激素信号转导机制研究2017:173 - 96。gydF4y2Ba
胡伯德,李建军,李建军,李建军。早期脱落酸信号转导机制:新发现的成分和新出现的问题。基因工程学报;2010;24(6):1695-708。gydF4y2Ba
Lumba S, Toh S, Handfield LF, Swan M, Liu R, youjy, Cutler SR, Subramaniam R, Provart N, Moses A,等。一个中尺度脱落酸激素相互作用组揭示了拟南芥的动态信号景观。发育细胞;2014;29(3):360-72。gydF4y2Ba
Joshi R, Wani SH, Singh B, Bohra A, Dar ZA, Lone AA, Pareek A, Singla-Pareek SL.转录因子与植物对干旱胁迫的响应。植物科学进展,2016;7(7):1029。gydF4y2Ba
杨建军,张建军,张建军,等。植物渗透胁迫对aba信号的影响。植物科学进展,2014;21(1):1 - 9。gydF4y2Ba
Schachtman DP, Goodger JQ。干旱条件下根到梢的化学信号。植物科学动态,2008;13(6):281-7。gydF4y2Ba
李建军,张建军,张建军,等。植物根系缺水信号的研究进展。植物学报,2007;32(1):367 - 367。gydF4y2Ba
Batool S, Uslu VV, Rajab H, Ahmad N, Waadt R, Geiger D, Malagoli M, Xiang CB, Hedrich R, Rennenberg H,等。硫酸盐与半胱氨酸结合,触发ABA的产生和气孔关闭。植物学报,2018;30(12):2973-87。gydF4y2Ba
Padgett-Johnson M, Williams LE, Walker MA。加州灌溉和非灌溉条件下生长的17种葡萄的水分关系、气体交换和营养生长。园艺学报(英文版);2003;32(2):369 - 376。gydF4y2Ba
Fort K, Fraga J, Grossi D, Walker MA。四种葡萄砧木抗旱性的早期测定。园艺学报,2017;42(1):36-46。gydF4y2Ba
Heinitz CC, Fort K, Walker MA。发展抗旱、耐盐的葡萄砧木。见:国际园艺科学学会(ISHS)。比利时鲁汶;2015.305 - 12页。gydF4y2Ba
谢军,刘建军,李建军,李建军,李建军,李建军。茎部的转录组反应对水分亏缺比根更敏感gydF4y2Ba葡萄属锐利gydF4y2Ba(Michx)。植物学报,2019;19(1):72。gydF4y2Ba
刘强,罗丽,郑丽。木质素在植物中的生物合成及其生物学功能。国际分子科学学报,2018;19(2):335。gydF4y2Ba
王德杰,张磊,梅林1,Castellarin SD, Gambetta GA。葡萄主要内在蛋白基因家族的结构与转录调控。生物医学工程学报,2018;19(1):248。gydF4y2Ba
王志强,王志强。一种加权相关网络分析方法。生物信息学报,2008;9(5)。gydF4y2Ba
霍珀DW, Ghan R, Cramer GR.快速脱水叶片分析揭示葡萄基因型的气孔响应差异。园艺研究,2014;1:2。gydF4y2Ba
jillon O, auury JM, Noel B, Policriti A, Clepet C, Casagrande A, Choisne N, Aubourg S, Vitulo N, Jubin C,等。葡萄藤基因组序列表明,在主要被子植物门祖先六倍体化。大自然。2007;449(7161):463 - 8。gydF4y2Ba
Virlouvet L, Ding Y, Fujii H, Avramova Z, Fromm M.水稻连续脱水胁迫下ABA信号对转录记忆的影响。植物学报,2014;79(1):150-61。gydF4y2Ba
李建平,李建平,李建平,等。植物环境胁迫记忆机制的研究进展。生物学报,2017;18(1):124。gydF4y2Ba
张建军,张建军,张建军,张建军。重新考虑植物记忆:逆境恢复、RNA周转和表观遗传学之间的交叉点。科学进展,2016;2(2):e1501340。gydF4y2Ba
汤贝西,李春华,李春华,等。干旱胁迫对植物行为的影响。植物科学进展(英文版);2018;39(5):591 - 591。gydF4y2Ba
Gosti F, Beaudoin N, Serizet C, Webb AAR, Vartanian N, Giraudat J. ABI1蛋白磷酸酶2C的负调控因子。植物细胞1999;11(10):1897。gydF4y2Ba
李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军。美国科学院学报;2012;109(24):9653 - 58。gydF4y2Ba
王晓明,王晓明,王晓明,等。拟南芥、大麦和水稻根系的转运障碍研究进展。植物生理学报,2018;22:75 - 83。gydF4y2Ba
Yoshida T, Mogami J, Yamaguchi-Shinozaki K.组学方法对植物脱落酸信号网络的定义。植物生理学报;2015;56(6):1043-52。gydF4y2Ba
王晓明,王晓明,王晓明,等。抗氧化酶在烟草细胞中的表达及其对高渗透胁迫的响应。植物科学学报;2009;33(1):379 - 379。gydF4y2Ba
Selvaraj MG, Ishizaki T, Valencia M, Ogawa S, Dedicova B, Ogata T, Yoshiwara K, Maruyama K, Kusano M, Saito K,等。拟南芥半乳糖醇合成酶基因的过表达提高了转基因水稻的抗旱性,提高了田间产量。植物学报,2017;15(11):1465-77。gydF4y2Ba
李建军,李建军,李建军,等。植物糖代谢机制的研究进展。科学通报,2008;3(12):e3935。gydF4y2Ba
田志刚,王志刚,王志刚,王志刚,王志刚。半乳糖醇合成酶基因在拟南芥抗旱和抗寒胁迫中的作用。植物学报,2002;29(4):417-26。gydF4y2Ba
Foyer CH, Noctor G.抗坏血酸和谷胱甘肽:氧化还原中枢的心脏。植物生理学报;2011;32(1):1 - 8。gydF4y2Ba
Chaumont F, Tyerman SD。水通道蛋白:控制植物水分关系的高度调控通道。植物生理学报(英文版);2014(4):1616 - 1618。gydF4y2Ba
刘建军,刘建军,刘建军。逆境下植物水通道蛋白的调控。生物工程学报,2018;31(1):4。gydF4y2Ba
莫瑞尔·C,布尔西克·Y, Luu D-T, Santoni V, Shahzad Z, Verdoucq L.植物水通道蛋白的研究。中国生物医学工程学报(英文版);2015;35(4):444 - 444。gydF4y2Ba
李建军,李建军,李建军,李建军,李建军,李建军,等。水通道蛋白在水稻抗旱性研究中的应用。中国生物医学工程学报(英文版);2017;39(1):444 - 444。gydF4y2Ba
Alexandersson E, Fraysse L, Sjövall-Larsen S, Gustavsson S, Fellert M, Karlsson M, Johanson U, Kjellbom P.水通道蛋白全基因家族表达与干旱胁迫的调控。植物学报;2009;29(3):559 - 564。gydF4y2Ba
Ollat N, Peccoux A, Papura D, Esmenjaud D, marguerite E, Tandonnet J-P, Bordenave L, Cookson SJ, Barrieu F, rosssdeutsch LgydF4y2Ba等gydF4y2Ba:砧木作为适应环境的一个组成部分。见:变化环境中的葡萄藤:分子和生态生理学的视角gydF4y2Ba。gydF4y2Ba编辑格罗斯H,查韦斯MM,吉尔HM,德尔洛特S,卷1。英国奇切斯特:威利·布莱克威尔;2016: 68 - 108。gydF4y2Ba
高桥峰,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军。大自然。2018;556(7700):235 - 8。gydF4y2Ba
Ernst L, Goodger JQD, Alvarez S, Marsh EL, Berla B, Lockhart E, Jung J, Li P, Bohnert HJ, Schachtman DP。硫酸盐作为木质部传递的化学信号,先于ABA生物合成基因在玉米根系中的表达。植物学报;2010;31(12):395 - 395。gydF4y2Ba
Goodger JQD, Schachtman DP。重新审视ABA作为水分胁迫下根系产生的主要远距离信号的作用。植物学报,2010;5(10):1298-301。gydF4y2Ba
高德华,王晓华,王晓华,等。开花植物茎-根交流功能的研究进展。生物通报,2017;27(17):973 - 978。gydF4y2Ba
Cramer GR, Van Sluyter SC, Hopper DW, Pascovici D, Keighley T, Haynes PA。蛋白质组学分析表明,在抑制葡萄的生长和光合作用之前,代谢发生了巨大的变化(gydF4y2Ba葡萄gydF4y2BaL.)对水分亏缺的反应。植物生理学报;2013;31(1):349。gydF4y2Ba
Hachez C, Veljanovski V, Reinhardt H, Guillaumot D, Vanhee C, Chaumont F, Batoko H.拟南芥非生物胁迫诱导的tspo相关蛋白通过蛋白相互作用和自噬降解降低水通道蛋白PIP2的细胞表面表达7。植物学报,2014;26(12):4974。gydF4y2Ba
李建军,李建军,李建军,等。水培法对拟南芥生物量的影响。植物生理学报(英文版);2009;31(2):317 - 319。gydF4y2Ba
Barrios-Masias FH, knipper T, McElrone AJ。葡萄砧木对水分胁迫的不同反应与细根水力生理和分化的调节有关。植物学报,2015;66(19):6069-78。gydF4y2Ba
Tattersall EAR, Ergul A, AlKayal F, DeLuc L, Cushman JC, Cramer GR.葡萄叶片优质RNA分离方法比较。中国葡萄酒学学报(英文版);2005;37(4):344。gydF4y2Ba
Bolger AM, Lohse M, Usadel B. Trimmomatic:一种用于Illumina序列数据的灵活修剪器。生物信息学。2014;30(15):2114 - 20。gydF4y2Ba
FastQC:高通量序列数据的质量控制工具;2014.gydF4y2Ba
李建军,李建军,李建军,等。一种低内存要求的快速拼接对准器。自然方法;2015;12(4):357-60。gydF4y2Ba
廖勇,史伟。特征计数:一种高效的基因组特征序列分配程序。生物信息学。2014;30(7):923 - 30。gydF4y2Ba
Love MI, Huber W, Anders S.使用DESeq2对RNA-seq数据的折叠变化和离散度进行调节估计。中国生物医学工程学报;2014;31(6):1145 - 1145。gydF4y2Ba
Alexa A, Rahnenfuhrer J. topGO:基因本体的富集分析2016.gydF4y2Ba
顾忠,Eils R, Schlesner M.复杂的热图揭示了多维基因组数据的模式和相关性。生物信息学。2016;32(18):2847 - 9。gydF4y2Ba
一个用于可视化、调整和比较分层聚类树的R包。生物信息学,2015,31(22):3718 - 20。gydF4y2Ba
顾志强,顾丽丽,张建军,等。基于循环可视化的生物信息学研究进展[j] .生物信息学报,2014,30(9):1245 - 1245。gydF4y2Ba
Conway JR, Lex A, Gehlenborg N. UpSetR:用于交叉集及其属性可视化的R包。生物信息学。2017;33(18):2938 - 40。gydF4y2Ba
Wickham H. ggplo2:用于数据分析的优雅图形。纽约:斯普林格出版社;2016.gydF4y2Ba
张建军,张建军。基于快速R函数的聚类分析。统计软件学报,2012;46(11):1-17。gydF4y2Ba
王晓明,王晓明,王晓明,等。qBase相对定量框架及实时定量PCR数据的自动分析。中国生物医学工程学报,2007;8(2):419。gydF4y2Ba
R核心团队。R:用于统计计算的语言和环境。维也纳,奥地利:R统计计算基金会;2018.gydF4y2Ba
基于gis的生态系统空间分析与数据挖掘[j] .吉林大学学报(自然科学版)。2018。gydF4y2Ba
李建军,张建军,李建军,《基于多数据集的数据分析》,2015。gydF4y2Ba
致谢gydF4y2Ba
作者感谢实验室所有本科生成员的技术援助,Felipe Barrios-Masias博士为水力传导率测量提供了设备,Andrew Walker博士为这些实验提供了原始种质。gydF4y2Ba
资金gydF4y2Ba
这项RNA测序得到了美国农业部国家食品和农业研究所Hatch项目1015139的支持,部分数据处理得到了美国国家卫生研究院国家普通医学科学研究所(GM103440)的资助。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
GRC, RG和NC设计了实验。GRC, RG, HT和NC收获的植物材料。GRC进行了大盆试验。HT测量了根系的水力传导率。RG进行了小锅中度WD试验。用HT提取RNA进行RNA测序,用NC提取RNA进行RT-qPCR。AD对所有RNA样品进行了纯化,用于RNA- seq,并在小罐实验中进行了RSWC与茎的水势测量。NC进行了小罐剧烈WD试验。采用NC进行cDNA和RT-qPCR检测。Reads预处理,与参考基因组比对和计数步骤由RT和KS完成。 NC processed and analyzed the data and wrote the body of the paper. All authors reviewed, edited and approved the final version of the manuscript.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们没有竞争利益。Grant R. Cramer是本刊编辑委员会成员(部分编辑)。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
b施普林格《自然》杂志对已出版的地图和机构的管辖权要求保持中立。gydF4y2Ba
附加文件gydF4y2Ba
附加文件1:gydF4y2Ba
四茎水势gydF4y2Ba葡萄属gydF4y2Ba恢复实验期间的物种。(PDF 63kb)gydF4y2Ba
附加文件2:gydF4y2Ba
第6天和第8天WD恢复实验统计。(XLSX 13kb)gydF4y2Ba
附加文件3:gydF4y2Ba
长期WD实验第12天至第20天的统计。(xlsx22kb)gydF4y2Ba
附加文件4:gydF4y2Ba
四种水关系的测量gydF4y2Ba葡萄属gydF4y2Ba长期WD维持在50% RSWC的物种。(PDF 77kb)gydF4y2Ba
附加文件5:gydF4y2Ba
四种小盆栽繁殖藤的生理测量gydF4y2Ba葡萄属gydF4y2Ba基因型对严重WD的反应。(PDF 127kb)gydF4y2Ba
附加文件6:gydF4y2Ba
各基因型、器官和周的差异表达分析结果。(XLSX 27292kb)gydF4y2Ba
附加文件7:gydF4y2Ba
代表对WD响应的功能类别。(XLSX 10kb)gydF4y2Ba
附加文件8:gydF4y2Ba
Venn基因表中生物过程类的基因本体富集分析。(XLSX 307kb)gydF4y2Ba
附加文件9:gydF4y2Ba
Venn基因表的BIN代码富集分析。(xlsx99kb)gydF4y2Ba
附加文件10:gydF4y2Ba
各器官x周x基因型组合干旱处理与对照葡萄ABA相关基因的DEA和TPM值比较。(XLSX 97kb)gydF4y2Ba
附加文件11:gydF4y2Ba
归一化相对数量(RT-qPCRgydF4y2BaNCED3gydF4y2Ba和gydF4y2BaDHN1gydF4y2Ba幼种藤对WD的响应。(PDF 79kb)gydF4y2Ba
附加文件12:gydF4y2Ba
MIP家族基因的DEA和TPM值来自干旱处理和对照葡萄各器官x周x基因型组合的比较结果。(xlsx62kb)gydF4y2Ba
附加文件13:gydF4y2Ba
根样本中基因模块的隶属关系。(XLSX 45939kb)gydF4y2Ba
附加文件14:gydF4y2Ba
摘要WGCNA模块在根。(xlsx36kb)gydF4y2Ba
附加文件15:gydF4y2Ba
基因表达谱gydF4y2BaSAT3gydF4y2Ba高度连接到根WGCNA模块skyblue3。(PDF 69kb)gydF4y2Ba
附加文件16:gydF4y2Ba
叶片样品中基因模块的隶属性。(XLSX 34506kb)gydF4y2Ba
附加文件17:gydF4y2Ba
叶片中WGCNA模块的总结。(XLSX 29kb)gydF4y2Ba
附加文件18:gydF4y2Ba
小麦根部和茎部受WD强烈诱导的基因。(XLSX 30kb)gydF4y2Ba
附加文件19:gydF4y2Ba
引物列表。(XLSX 9kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),它允许在任何媒体上不受限制地使用、分发和复制,前提是您要适当地注明原作者和来源,提供到知识共享许可协议的链接,并注明是否进行了修改。创作共用公共领域免责声明(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Cochetel, n.n, Ghan, R., Toups, H.S.gydF4y2Baet al。gydF4y2Ba葡萄藤的耐旱性;gydF4y2Ba葡萄属champiniigydF4y2Ba简历。Ramsey,与更高的光合作用和更高的脱落酸生物合成和信号传导的转录组反应有关。gydF4y2BaBMC Plant BiolgydF4y2Ba20.gydF4y2Ba55(2020)。https://doi.org/10.1186/s12870-019-2012-7gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-019-2012-7gydF4y2Ba
关键字gydF4y2Ba
- 脱落酸gydF4y2Ba
- 干旱gydF4y2Ba
- Galactinol合成酶gydF4y2Ba
- 小道消息gydF4y2Ba
- 转录组gydF4y2Ba
- 葡萄属gydF4y2Ba
- 水分亏缺gydF4y2Ba