摘要
背景
为了限制葡萄葡萄酒的霜霉病疾病和减少对化学治疗的需要的影响,有效的策略可能正在培养和野生植物中恢复自适应抗性特征诉酿酒用葡萄种质.考虑到二苯乙烯是植物抗毒素中最重要的一类vitaceae在9个葡萄基因型中,分析了人工感染卵菌后二苯乙烯合酶基因家族所有功能成员的组成表达和转录激活Plasmopara viticola,疾病的因果因子。此外,在相同的基因型中,我们分析了编码两种转录因子的基因的表达,其中依赖于斯蒂替酯基因的转录调节,即VVMYB14和VVMYB15Chalcone合成酶编码的基因。
结果
霜霉病的发病率和严重程度从零到高的葡萄基因型考虑,是低到中度的一个亚组诉酿酒用葡萄基因型。二苯乙烯合酶基因的组成表达及其转录激活程度如下p . viticola接种似乎与发力相反,在感染时发出疾病症状。以镜面方式p . viticola接种所有酮合酶基因表达上调的易感基因型葡萄和抗病品种下调。所带来的感染p . viticola似乎引起了不同的二苯乙烯合酶基因亚群的协调和顺序的转录激活,每个基因亚群可能由一个不同的和特定的MYB转录因子调控。
结论
目前的结果表明,斯蒂宝生物合成的诱导可能导致葡萄霉素霜霉病的基础免疫力,从而代表培养和野生的自适应抗性特征诉酿酒用葡萄种质。在早期阶段p . viticola感染,可能发生黄酮和芪的生物合成之间的拮抗相互作用,其结果可能决定随后的疾病症状程度。需要进一步的研究来破译抗抗体串扰中涉及抗拮抗性串扰之间的可能调节机制,以抗抗性和易感基因型之间的抗性和敏感的基因型之间p . viticola.
背景
欧洲葡萄虫(vitis Vinifera L.)是种植最广泛的植物之一,其经济重要性体现在全球近750万公顷的种植面积上[1].西班牙、中国、法国和意大利是葡萄园面积最大的国家[1].栽培葡萄品种受到不同破坏性疾病的大大影响,其中剧烈霉菌中间可以被认为是温和的温度,高湿度和丰富的春天降雨中的栽培区域中最严重的疾病[2].
葡萄霜霉病发生的原因是。Plasmopara viticola(伯克。Curt。)Berl。et De Toni (PV)是一种生物营养义务卵菌,为了完成其生命周期,必须从宿主的活细胞中获取营养。这种病原体在19世纪偶然地从北美传入法国,并迅速蔓延到整个欧洲[3.].它感染植物的所有绿色部分,在有利的天气条件下,造成葡萄产量的大量损失[4].通过感染花序和束和定性衰减,通过引起植物的早期脱落来引起定量损失的损害可以通过感染花序和束来导致定量损失。5,6].
病原体的潜在危害,与农艺法对抗它的低功效相结合,需要定期施用杀菌剂。然而,由于人类健康风险和对环境的负面影响,所以化学品的密集使用变得越来越受限制[7].欧洲指令2009/128 / EC为实现杀虫剂可持续使用的社区行动建立了一个框架。这种指令的关键特征之一是每个成员国应制定和采用其国家行动计划,并建立量化目标,目标,措施和时间表,以降低农药对人类健康和环境的风险和影响。此外,该指令鼓励开发和引入综合害虫管理和替代方法或技术,以减少对杀虫剂使用的依赖。
为了限制植物病害的影响,并减少需要重现化学治疗,最有效的策略是采用抗植物材料。在PV-的情况下,诉酿酒用葡萄病理系统,这是通过交叉来实现的诉酿酒用葡萄与美国野生物种,如V. Riparia,V. Labrusca,V. Aestivis和诉? ?其抵抗力在其原产地与病原体共同进化[8].第一代杂交种获得了一年多的世纪前,由于他们的令人不愉快的狡猾的香气,来自美国的令人不愉快的狐狸香气,这是不合适的高品质葡萄酒的生产葡萄属物种,特别是诉出发[8].然而,在许多回复循环之后,最后一代育种品种具有来自美国物种的抗性和来自美国物种的理想性状诉酿酒用葡萄[9].
针对PV的另一种策略是恢复自适应抗性性状诉酿酒用葡萄种质,包括栽培的(诉酿酒用葡萄亚普。酿酒用葡萄)和野生(诉酿酒用葡萄亚普。S.ylvestris)亚种,最初从西亚传到欧洲[10.].实际上,最近的几项研究,在现场或受控环境中运行,指出培养诉酿酒用葡萄品种(11.,12.,13.,14.,15.,16.,17.],包括从单一品种获得的克隆[18.],以及诉酿酒用葡萄野生加入[19.,20.[表现出对PV的不同程度的易感性。
意大利诉酿酒用葡萄种质包括几种或局部品种,其对生物应力的抵抗程度以及葡萄栽培和卵子学特征,仍然未知。详细分析了对PV的易变性以及潜在的遗传和分子防御机制的可变性可以简化育种计划,并允许选择用于可持续生产的高质量葡萄酒的抗性葡萄园。
当vitaceae,二苯乙烯是植物抗毒素中最重要的一类,它们在应对各种环境挑战时积累,包括病原体的攻击[21.,22.,23.].导致斯蒂芬的生物合成途径是一般苯丙烷型途径的侧枝,可以被认为是类黄酮途径的延伸[24.].二苯乙烯化合物生物合成的关键酶是二苯乙烯合成酶(STSs),它们竞争相同的底物(p-coumaroyl -CoA和肉桂酰辅酶A)与查耳酮合酶(CHSS),黄酮类化合物的生物合成的关键酶[25.].
与二苯乙烯可能参与植物对病原体的反应相一致,已有研究表明,葡萄中编码STS的基因表达在PV感染后被强烈诱导[26.,27.,28.].上调的STS基因和其他植物防御基因已被认为是葡萄贝瑞开发过程中对病原体的组成态防御促进[29.].
结果表明这一点STS基因的发育调控和诱导往往是通过分析病原体的感染而获得的STS基因作为一个群体。的确,诠释了诉酿酒用葡萄基因组[30.,31.]可以识别最多48个推定vvsts.基因序列,其中至少32个编码全长蛋白[26.,32.].存在多个STS葡萄基因组中的基因表明,一方面,STS介导的途径在对环境挑战的适应方面的突出作用,以及在另一方面,调查每个人的具体监管STS基因回应它们。
在以前的五个研究期间诉酿酒用葡萄我们发现,不同品种的葡萄对PV的抗性程度存在差异,这可能归因于二苯乙烯化合物产量的差异[5,16.].为了深化我们对上述植物材料中这种差分反应的理解,我们在此分析了所有功能成员的时间表达模式vvsts.在人工PV接种后72 h内对基因家族的影响。此外,基因编码的两个转录因子参与了转录调控STS基因,即VVMYB14和VVMYB15[33.]以及那些编码的Chalcone合成酶(VVCHS.),在这里也被考虑。为了完成对PV的不同反应序列,并评估实验接种的有效性,我们在本次比较中还包括了对霜霉病敏感程度为预先已知的“参考”葡萄品种:即,两个杂交品种,即“伊莎贝拉”和“Solaris”,固有地抗PV(见上文),和一个PV敏感品种,即“Chasselas”。此外,为了寻找在栽培葡萄种质之外也能发现的抗性性状,我们在这里评估了一个当地野生种质对PV的响应诉酿酒用葡萄亚普。Sylvestris..
结果
霜霉病的发病率和严重程度在选定的葡萄基因型组中从零到高不等
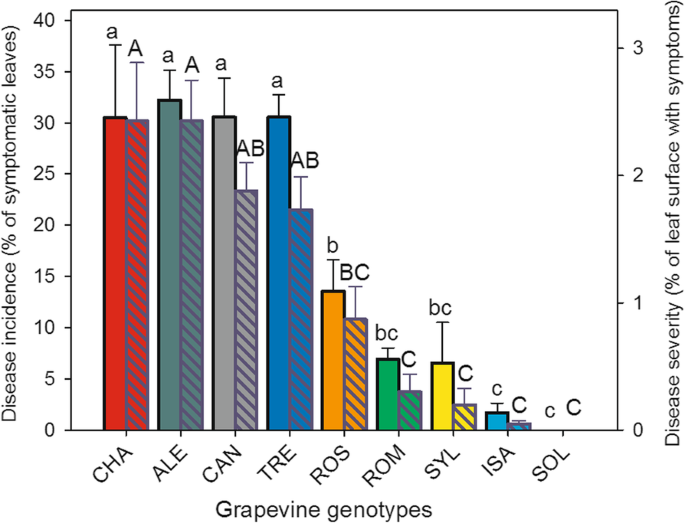
在图中。1,葡萄胺基因型根据光伏接种后7天的柔软霉菌可见症状的发病率和严重程度排序。易感品种“chasselas”(Chasselas“(cha)是最受感染的基因型之一,而在易感性排名的相对结束时,各种各样的品种”Solaris“(sol)没有显示出叶子上的任何孢子区域,并且表现出褐变坏死的斑点(附加文件4:图S1),已经在PV感染的某些耐药葡萄基因型中描述过敏反应症状[12.,34.,35.].五名意大利人的发病率存在差异诉酿酒用葡萄品种(图1,普通条形图):“实体化”(啤酒),“Trebbiano Toscano”(TRE)和“Canaiolo Nero”(Can)显示每个植物的症状叶片百分比,与“Rossetto”(ROS)和“Romanesco”(ROM)。令人毛骨悚然的霉菌发病率在野生葡萄加入(诉酿酒用葡萄亚普。Sylvestris.,SYL)是在一方面考虑的基因型组中最低的基因型中最低,并且在培养中最不敏感诉酿酒用葡萄另一方面,对第一代杂交种“伊莎贝拉”(ISA)(图。1即使没有免疫,也被证实对PV具有高度抗性。
疾病发病率(平条,左轴,小写字母)和严重程度(模式条,右轴,大写字母)的平均值在九种不同的情况下评估vitis Vinifera接种后7天的基因型Plasmopara viticola.柱状图代表平均值的标准误差。根据Tukey的测试,不同的字母表示显著差异(p≤0.05)。葡萄基因型:CHA = Chasselas, ALE = Aleatico, CAN=Canaiolo nero, TRE = Trebbiano toscano, ROS = Rossetto, ROM = Romanesco, SYL = accession of诉酿酒用葡萄亚普。Sylvestris,ISA = Isabella, SOL = Solaris
评估疾病严重程度(图。1,图案条)证实了在被认为的葡萄品种中对霜霉病的不同程度的易感性,ROS和ROM是最抗拒的诉酿酒用葡萄子群。在后者和SYL中,疾病严重程度似乎与内在抗性杂种ISA和SOL一样低(图。1图案栏)。
在进行何种型嘲弄接种的九种基因型的对照植物中没有观察到柔软的霉菌症状(数据未显示)。
在概要的症状基础上,参见图1中的结果。1允许将葡萄藤基因型分为三个不同的组:i)那些高度敏感的PV,代表诉酿酒用葡萄品种cha,ale,can和tre,ii)适度易感,包括诉酿酒用葡萄ROS和ROM,以及V.Sylvestris.加入(SYL)和III)抗性ISA和溶胶杂种;必须强调的是,Solaris非常免疫。
基因序列鉴定及表达分析引物的合成
斯蒂替斯合酶(STS)基因
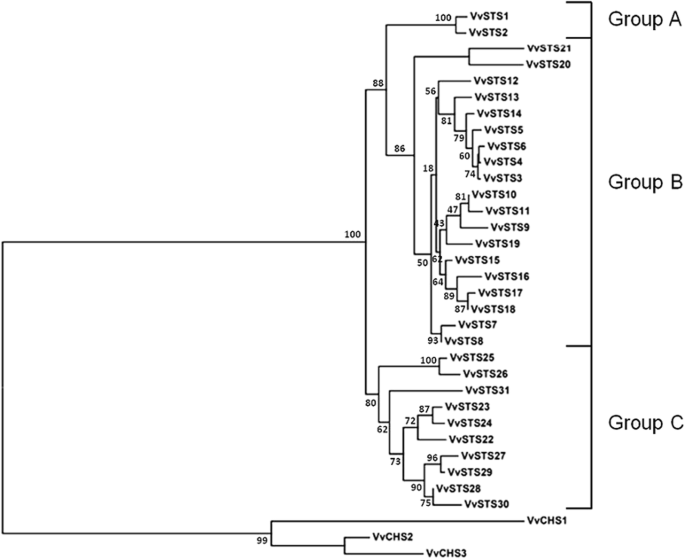
通过在NCBI数据库中的搜索,我们确定了31种功能STS基因的诉酿酒用葡萄全长1179 bp的ORF编码392个氨基酸的蛋白质(附加文件1:表S1)。31确定STS基因被命名VVSTS1-31在它们的染色体位置的基础上。VVSTS1 / 2.位于10号染色体上,而其余的29号染色体(VvSTS3-31)在染色体16的中央和远端区域中形成两个不同的簇(附加文件1:表S1)。基于在NCBI数据库中鉴定的核苷酸和氨基酸序列的系统发育分析和比较,并且先前在葡萄基因组中表征的核酸序列[27.],可以将31个基因分配给葡萄的三个系统发育基团vvsts.族分裂(图。2).在31个功能性的vvsts.NCBI数据库中确定的基因,两个(VvSTS1和VvSTS2),属于一个组,19(VVSTS3-21)到B组,和10(VVSTS22-31)到C组(图。2).当vvsts.位于染色体16的两个不同的簇基因显示相似性的高水平的在其编码区(89和99%之间的核苷酸同一性),这表明它们可能是由节段性和串联重复出现的事件发生在vitaceae谱系,从其他dicots分离后[27.,32.].类似地,两者核苷酸序列的对准vvsts.位于染色体10上的基因在其编码区之间显示了99%的同一性。
由于复杂性vvsts.基因家族和大多数成员之间的高度保护(见上文),仅识别出31个基因中的八个,即VVSTS12,VVSTS13,VVSTS14,VVSTS15,VVSTS19,VVSTS20,VVSTS21和VVSTS31,物有可能设计,从在3'末端区域中检测到的差异,特异性引物进行表达分析(附加文件1:表S2)。其余23个基因设计了9对保守引物(在附加文件中以星号表示)1表S2),每个序列从2到4个非常相似的序列(称为VvSTS1 / 2,VvSTS3 / 4,VvSTS5 / 6,VvSTS7 / 8,VvSTS9-11,VvSTS16-18,VvSTS22-24,VvSTS25 / 26,和VvSTS27-30在以下)。
查尔酮合成酶(CHS)基因
NCBI数据库中的搜索允许我们识别五个功能CHS基因的诉酿酒用葡萄基因组,其中两个被命名VVCHS2.和VVCHS3.位于14染色体中,剩下的三个中的每一个都位于明显的染色体中:VVCHS1.在5号染色体,vvchs4.在染色体3和VVCHS5.在染色体15中(附加文件1:表S3)。设计特异性引物分析各基因的表达VVCHS.基因(附加文件1:表S3)。
MYB转录因素
编码两种MYB转录因子的基因的表达,即VVMYB14和VVMYB15,已知参与的转录调控vvsts.基因响应生物和非生物胁迫[33.],这里被考虑在这里。已知的核苷酸序列VVMYB14(VIT_07s0005g03340)和VVMYB15(VIT_05S0049G01020)[33.使用NCBI数据库中的BLAST算法执行搜索。然后,使用相应的mRNA Refseq序列用于为两个基因中的每一个设计特异性引物(附加文件1:表S4)。
之前大多数芪合成酶基因的表达水平p . viticola接种呈负相关的倾向发展在感染霜霉病明显症状
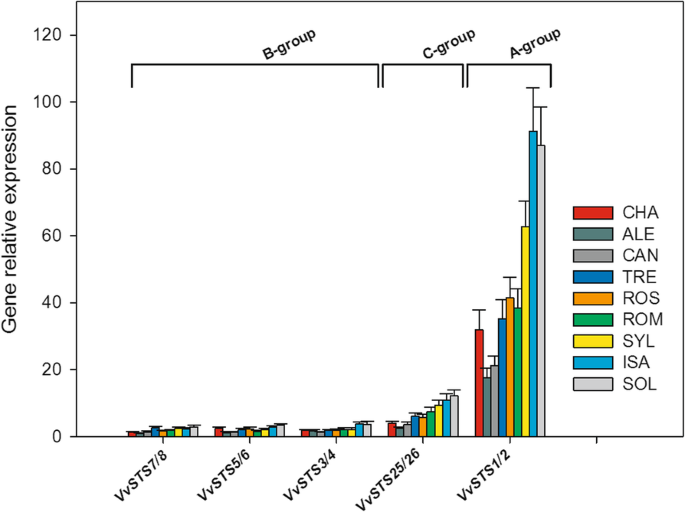
数字3.显示三种系统发育组的所选成员的相对表达vvsts.在光伏接种之前收集的葡萄基因型的叶子中的基因家族,而图。4介绍了观察到的不同葡萄基因型的组成表达的每一个或组vvsts.基因被认为是。数字3.提出证据,无论考虑的葡萄基因型,在三个系统发育组的成员之间发现了充分和显著的差异vvsts.基因家庭在本构表达方面。特别是,A组基因(VvSTS1/2)显示转录水平为5-10倍,分别比C和B组的成员高10-20倍(图。3.).
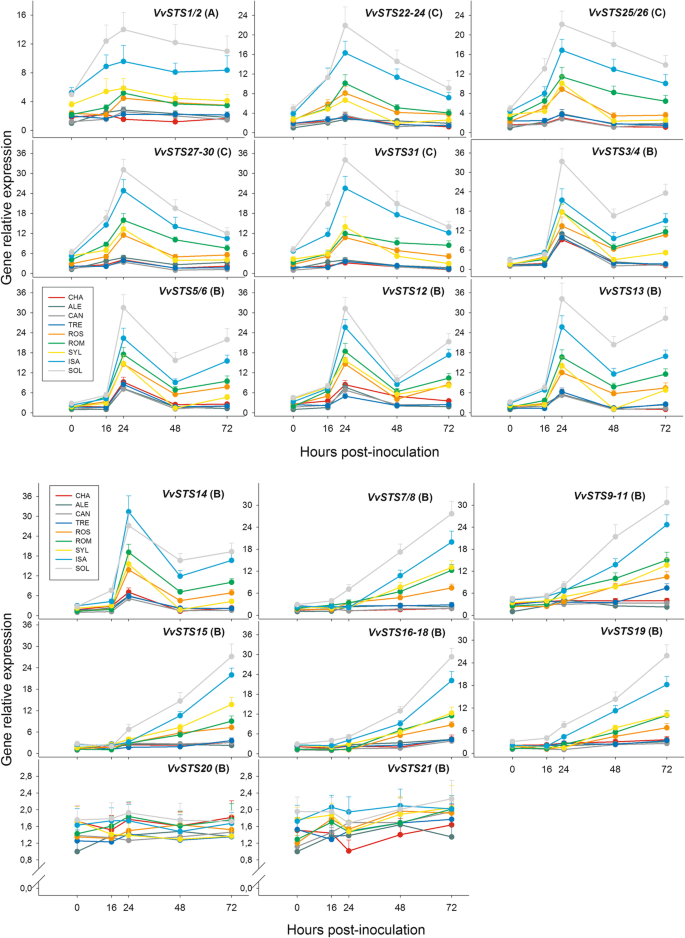
组的相对表达水平avitis Vinifera二苯乙烯合酶基因家族成员(VVSTS1 / 2.)和图1的九个葡萄基因型的叶片中的组C和B的选定成员。1接种前收集Plasmopara viticola.使用两种参考基因的几何平均值标准化每个基因的表达数据VVEF1α.和VvSAND.相对表达水平的不同vvsts.基因被称为校准剂,设定为值1,其由基因在九个基因型中的基因表示(VVSTS7 / 8.在cv。aleatico,啤酒)。每个报告的值是三种生物重复的平均值±SD,每次分析它们的三种生物重复。葡萄基因型:CHA = Chasselas, ALE = Aleatico, CAN=Canaiolo nero, TRE = Trebbiano toscano, ROS = Rossetto, ROM = Romanesco, SYL = accession of诉酿酒用葡萄亚普。Sylvestris,ISA = Isabella, SOL = Solaris
整套的相对表达水平vitis Vinifera二苯乙烯合成酶基因(vvsts.)在图1的九个葡萄基因型的叶子中。1接种前收集Plasmopara viticola.表示每个基因所属的系统发育组的字母在括号中给出。对于每个基因,通过在九种基因型中的最低值设定1的值来计算相对表达水平。归一化并且如图样品复制。3..根据Tukey的测试,不同的字母表示显著差异(p≤0.01)。葡萄基因型:CHA = Chasselas, ALE = Aleatico, CAN=Canaiolo nero, TRE = Trebbiano toscano, ROS = Rossetto, ROM = Romanesco, SYL = accession of诉酿酒用葡萄亚普。Sylvestris,ISA = Isabella, SOL = Solaris
数字4结果表明,不同基因型间的结构表达差异较大vvsts.基因,对于A和C进化群体的成员大多明显。它也表明,至少对于A和C组,的相对表达水平vvsts.PV接种前的基因与此后观察到的柔软霉菌的抗性度/敏感程度(比较图。4和图。1).事实上,相对而言,A和C基因的转录量在SOL、ISA和SYL中较高,在ROM、ROS、TRE和CHA中处于中间水平,而在CAN和ALE中非常低。然而,值得注意的是,在第一组基因型中,A和C基因的转录水平几乎总是在SOL和ISA中显著高于SYL,而在中等表达水平的品种中,A和C基因的转录水平几乎总是显著高于SYL诉酿酒用葡萄品种ROM显示出比两个PV易感品种和ALE显着较高量的转录物量(图。4).
至于B组vvsts.基因担心,九个基因型中的组成型表达的差异小于A和C基因。然而,溶胶和ISA杂种中B基因的组成型表达最常显着高于剩余基因型中的(图。4).另一方面,几个B基因的组成性表达水平(如VVSTS3 / 4.,VVSTS13,VVSTS14和VVSTS15)在六个中被检测到诉酿酒用葡萄品种。9个基因型间B基因差异不显著VVSTS20和VVSTS21被认为是(图。4).
构成表达的表达STS模拟接种植株的基因与pv接种植株的基因相同(数据未显示)。
遵循p . viticola接种时,芪合酶基因显示转录积累的不同时间分布,其范围是正比于不同葡萄基因型组成型表达
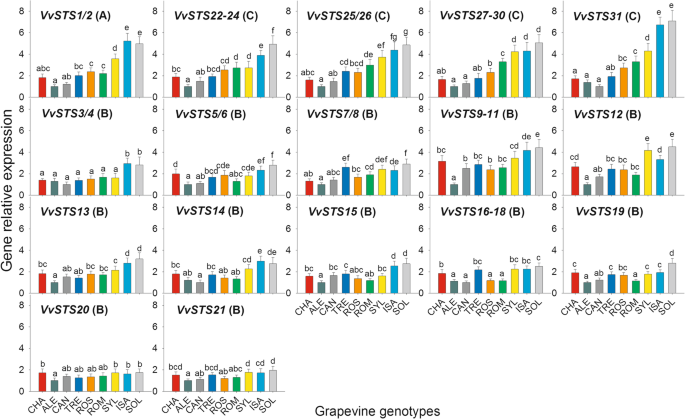
数字5和附加文件2表S6显示了各组分的转录时间进程vvsts.接种后的基因家庭高达72小时(HPI)p . viticola.附加文件5:图S2以热图的形式显示了基因表达的时间历程。很明显,vvsts.属于三个系统发育基因组的成员在用PV接种后差异调节,并且对于每个基因,九个葡萄基因型中存在九种葡萄转录物量的充分和显着差异。在72小时观察期间,在其中鉴定了至少五种不同类型的转录物累积时间概况vvsts.基因家族响应PV接种(图。5和附加文件5:图S2)。对于所识别的每个表达时间谱,其形状在九个葡萄基因型中几乎相同,尽管时间依赖性变化的程度在它们中急剧不同。下面详细描述了观察到的五个时间档。
整套的相对表达水平vitis Vinifera二苯乙烯合成酶基因(vvsts.)在图1的九个葡萄基因型的叶子中。1接种后收集到72小时p . viticola.表示每个基因所属的系统发育组的字母在括号中给出。对于每个基因,相对表达水平通过在每个所考虑的五个时间点的九个基因型中的最低值设定为1的值来计算。归一化并且如图样品复制。3..对于每个基因,在额外文件中报告了九个葡萄基因型的差异和五次取样时间之间的统计评估2:表S6。葡萄基因型:CHA = Chasselas, ALE = Aleatico, CAN=Canaiolo nero, TRE = Trebbiano toscano, ROS = Rossetto, ROM = Romanesco, SYL = accession of诉酿酒用葡萄亚普。Sylvestris,ISA = Isabella, SOL = Solaris
第一种时间谱,仅包含属于系统发育的两个基因的唯一基因,即VvSTS1/2,在16和24 HPI后表现出显着且逐渐增加,然后在此后进行平坦或略微降低的趋势(图。5和附加文件5:图S2)。在这里比较的九个葡萄基因型中,最高水平的转录激活VVSTS1 / 2.响应于溶胶和ISA杂种检测到病原体(图。5和附加文件2:表S6),如上所述(图。4),同一基因型也表现出最高水平的组成表达。在两个杂交体中,pv诱导的转录激活VVSTS1 / 2.与0 HPI相比,24 HPI的24小时大约高出三到四倍,其在观察期结束(72 HPI)中保持的差异。对于SYL基因型,其也显示出相对高的组成型表达VVSTS1 / 2.(图。4),与溶胶和ISA相比,24hPI的转录水平的增加较小,因此在感染后收集的所有叶样样品中检测到的转录物的量始终明显低于两个杂种(图.5和附加文件2:表S6)。其中的亚组诉酿酒用葡萄品种,最高级别的诱导VVSTS1 / 2.响应于PV检测到ROS和ROM,其中24hPI的转录物的量比0 HPI的转录物的数量约为2倍。在这两个品种感染后收集的所有叶样样品中的转录水平明显高于其余四个诉酿酒用葡萄品种和基本上类似于SYL加入的物种。没有或可忽略的时间依赖于表达的变化VVSTS1 / 2.被检测到剩余的组件诉酿酒用葡萄基因型亚组,即CHA,ALE,CAN和TRE(图。5和附加文件2:表S6)。
第二种时间分布,不包括c组基因,即VVSTS22-24,VVSTS25 / 56,VVSTS27-30,和VVSTS31.(图。5和附加文件5:图S2),在16 hpi和24 hpi之后出现了快速而大幅度的增长,随后出现了强烈的下降趋势。同样(见前面的时间曲线),在SOL和ISA杂交体中检测到对病原体的最高诱导水平(图。5和附加文件2:表S6)。在这两种基因型中,转录激活峰值强度(24 hpi)大约是0 hpi的4到8倍,在观察期结束时,差异降低到2到3倍(72 hpi)。在两个杂交种之后,第三个最敏感的葡萄基因型组仍然包括ROM、ROS和SYL,其转录水平在24 hpi水平上的提高不如SOL和ISA水平(比0 hpi水平高1.5-2倍)。72 hpi后,在这三个基因型中,相对于0 hpi的转录激活差异从零到两倍不等。上述c基因的表达没有或可以忽略不计的时间依赖性变化在其余成分中检测到诉酿酒用葡萄亚组,即cha,ale,can和tre(图。5和附加文件2:表S6)。
第三种类型的时间分布是由VVSTS3 / 4.,VVSTS5 / 6.,VVSTS12,VVSTS13,和VVSTS14基因基于其蛋白质产品的高序列同一性,在B组基因内的不同亚组中簇(图。2).这种时间曲线显示出后16和24 HPI迅速和大量的增加,随后在48 HPI强烈降低,并且在某些葡萄基因型,在72 HPI(图新增加。5和附加文件5:图S2)。再次(见上文),在24hPI下检测到的转录物的量显着是两个杂种中最高的,特别是在溶胶(比0 HPI高约10倍)。在溶胶和ISA中,尽管在48 HPI观察到的表达水平降低,但转录物的量始终始终显着高于剩余基因型的数量,并且在72hPi中显着增加(图。5和附加文件2:表S6)。在六诉酿酒用葡萄在24 hpi和72 hpi诱导水平最高的品种中,检测到了ROS和ROM,这表明,在对病原菌的响应中,它们之间的时间表达模式相似,并且与SYL的时间表达模式相似(图2)。5和附加文件2:表S6)。最后,值得注意的是剩下的四个诉酿酒用葡萄品种,即CHA, ALE, CAN和TRE,虽然在24 hpi时显示了转录水平的峰值,但在48-72 hpi期间没有产生新的增加,与所有其他基因型一样(图2)。5和附加文件2:表S6)。
第四种类型的时间剖面显示,从16到24 hpi开始,转录本呈线性和稳定的积累。这种类型的时间剖面是由VVSTS7 / 8.,VVSTS9-11,VVSTS15,VVSTS16-18和VVSTS19基因(图5和附加文件5(图S2),根据系统发育分析,在b组基因中形成了另一个不同的亚群(图S2)。2).对于这种类型的时间分布的,三组基因型的可以被识别的基础上,响应于PV(图转录积累。5和附加文件2:表S6)。第一组包括两个杂种溶胶和ISA,其显示PV感染进展期间的最高转录物积累(16-72 HPI);值得注意的是,在前者中PV诱导的转录激活总是比后一种杂交在前者中的转录活化。第二组包括诉酿酒用葡萄ROM和ROS的变化,以及SYL的加入,表现为转录产物的中间积累;对于上述的每一个基因,ROM和SYL的转录量显著高于ROS(图2)。5和附加文件2:表S6)。第三组包括剩下的四个诉酿酒用葡萄品种,其中上述B-基因的诱导水平非常低,甚至是零(图。5和附加文件2:表S6)。
最后,两个b基因在pv接种后没有显著的表达变化VVSTS20和VVSTS21,在九种葡萄基因型中没有发现显着或生物学相关的差异(图。5和附加文件2:表S6)。
不变的时间表达STS在模拟接种的植物中观察到了基因(数据未显示)。
遵循p . viticola接种后,VvMYB14和VvMYB15转录因子的编码基因表现出不同的转录本积累时间曲线,每一个都反映了b组二苯乙烯合酶基因的不同亚群
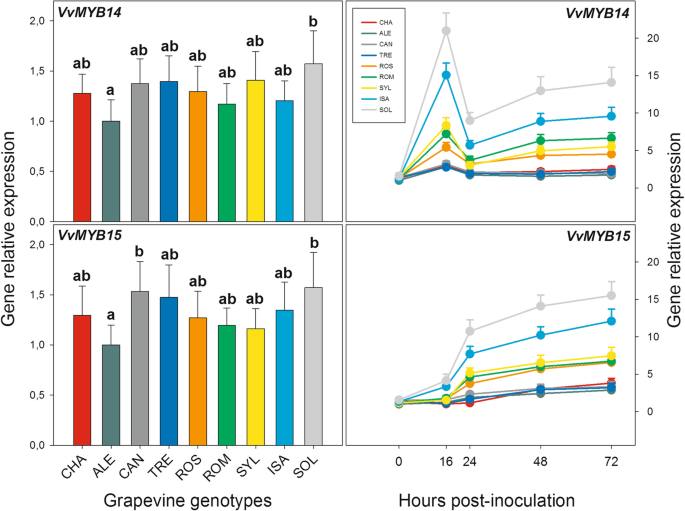
数字6和附加文件3.表S7显示了两种转录因子(TFs)编码基因VvMYB14和VvMYB15在PV接种后的组成表达水平(0 hpi)和转录时间历程,已知参与了STS基因[33.].在PV-感染之前,两种TFS的组成型表达在九种葡萄基因型中没有显着或生物学上相关的差异(图。6,左侧面板)。在PV接种之后,对于两个TFS观察到转录物积累的明显时间谱(图。6,对面板)。对于每个TF, 9个葡萄基因型之间的时间剖面形状是相似的,尽管它们之间在转录激活程度上有很大的差异。当与那些转录应该被调节的基因相比,每个TF反映了之前描述的b组的时间分布vvsts.基因。特别是,VVMYB14时间分布是形状到的相似VVSTS3 / 4.,VVSTS5 / 6.,VVSTS12,VVSTS13和VVSTS14基因(比较图。6,右面板,图。5;请参阅第三次profile的描述vvsts.结果在结果前一部分中的基因,除了先前发生的转录物积累的峰值,即16 HPI而不是24 HPI。类似于上述B-STS基因,最初的积累VVMYB14在SOL和ISA中转录本(16 hpi)显著升高(分别为0 hpi时的14和12倍),两者处于中间水平诉酿酒用葡萄品种ROS和ROM,以及SYL加入(约5至7倍高于0 HPI),其余四个相对较低诉酿酒用葡萄品种,即CHA,TRE,CAN和ALE(比0 HPI高约2-3倍;图。6和附加文件3.:表S7)。在24 hpi水平下降后,所有基因型的转录量都出现了新的增加,但仅在SOL和ISA中,在SYL、ROS和ROM中,转录量的增加幅度较小(图)。6).
编码两转录因子的基因的相对基因表达水平VVMYB14和VVMYB15在图的九大葡萄基因型的叶子。1在接种之前收集Plasmopara viticola(left panels) or up to 72 h after inoculation (right panels). For each gene, relative expression levels were calculated by setting a value of 1 for the lowest value among the nine genotypes in each of the five time points considered. Normalization and sample replication as in Fig.3..对于左侧面板,不同的字母根据TUKEY的测试表示显着差异(p≤0.01)。在右边的面板中,九种葡萄基因型之间的差异和五种采样次数之间的差异的统计评估报告在附加文件中3.: S7表。葡萄基因型:CHA = Chasselas, ALE = Aleatico, CAN=Canaiolo nero, TRE = Trebbiano toscano, ROS = Rossetto, ROM = Romanesco, SYL = accession of诉酿酒用葡萄亚普。Sylvestris,ISA = Isabella, SOL = Solaris
时间表表达概况VVMYB15在发现光伏接种后镜像VVSTS7 / 8.,VVSTS9-11,VVSTS15,VVSTS16-18和VVSTS19基因(比较图。6,右面板,图。5;请参阅第四次配置文件的描述vvsts.基因在前一节的结果]。从PV接种后的第一个阶段(16-24 hpi)到72 hpi,这种时间分布特征是转录本的稳定积累。类似于VVMYB14(见上文),检查VVMYB15时间谱允许识别三组基因型,这可以基于响应于PV积累的转录物的量而彼此区分。第一组包括溶胶和ISA杂种,其在感染的不同阶段期间表现出转录物的最高水平(分别比0 HPI在72分别高出12和15倍)。第二组,由此代表诉酿酒用葡萄品种ROM和ROS以及SYL加入,表明转录物的中间积累(72 HPI高约6-7倍,而不是0 dpi)。最后,第三组包括剩下的四个诉酿酒用葡萄品种,即CHA, TRE, CAN和ALE,其中的诱导水平VVMYB15相对而言,对PV的反应非常低,在72 hpi时大约是0 hpi时的2-3倍(图2)。6和附加文件3.:表S7)。
不变的时间表达MYB在模拟接种的植物中观察到了基因(数据未显示)。
遵循p . viticola接种后,查尔酮合成酶基因在敏感型葡萄植株中表达上调,在抗性型葡萄植株中表达下调
在大肠杆菌中发现的5个编码CHS的基因诉酿酒用葡萄基因组(见上文),vvchs4.和VVCHS5.这里没有进一步考虑,因为它们的转录本水平非常低,甚至在研究的植物材料中没有(数据未显示)。
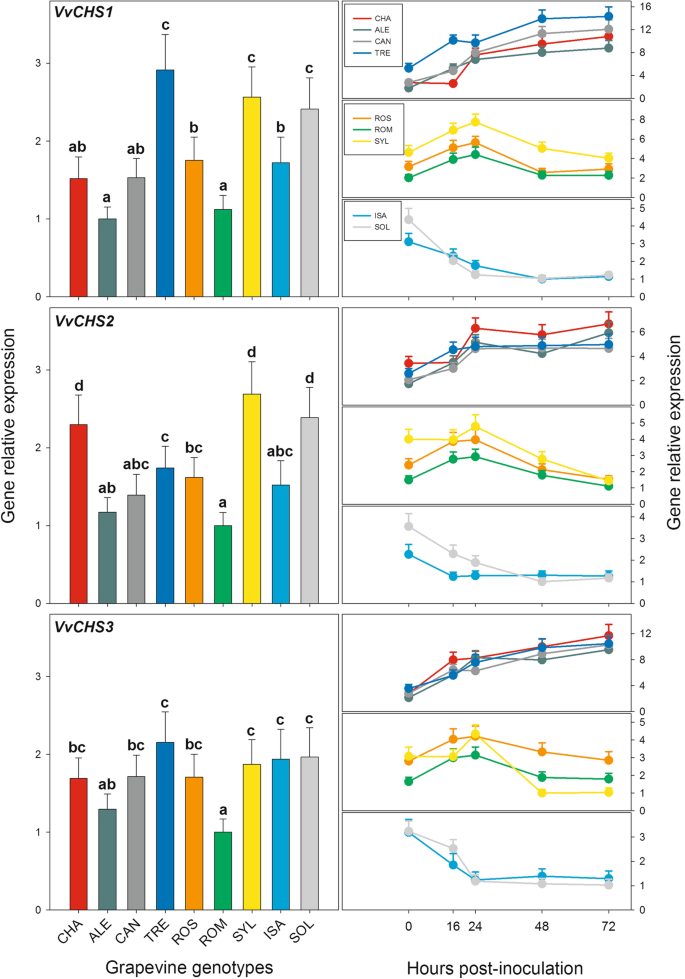
数字7和附加文件3.表S8显示了PV接种后的组成型表达水平(0 hpi)和转录时间历程VVCHS1.,VVCHS2.,和VVCHS3.基因。在本文表达式中发现了显着差异VVCHS.所考虑的葡萄基因型(图。7,左侧面板),然而,与之相反vvsts.A和C组的基因(见图。4和1),在PV感染时,似乎没有与不同的典范有关,以发展剧本霉菌症状。事实上,就是这样VVCHS1.与考虑的其他基因型相比,TRE,SOL和SYL的转录物量显着较高,同时VVCHS2.,在溶胶,CHA和SYL中检测到最高的转录水平。最后,关于VVCHS3.,PV接种前不同基因型中发现的差异小于其他两个VVCHS.与所考虑的其他基因型相比,基因,即使溶胶,SYL和TRE中的转录物的数量较高。
相对表达水平vitis ViniferaChalcone合成酶基因(VVCHS.)在图1的九个葡萄基因型的叶子中。1在接种之前收集Plasmopara viticola(left panels) or up to 72 h after inoculation (right panels). For each gene, relative expression levels were calculated by setting a value of 1 for the lowest value among the nine genotypes in each of the five time points considered. Normalization and sample replication as in Fig.3..左图中,根据Tukey’s检验,不同字母表示差异显著(p≤0.01)。在右边的面板中,九种葡萄基因型之间的差异和五种采样次数之间的差异的统计评估报告在附加文件中3.:表S8。葡萄基因型:CHA = Chasselas, ALE = Aleatico, CAN=Canaiolo nero, TRE = Trebbiano toscano, ROS = Rossetto, ROM = Romanesco, SYL = accession of诉酿酒用葡萄亚普。Sylvestris,ISA = Isabella, SOL = Solaris
PV接种后,观察到三种类型的时间分布VVCHS.基因(图7(右图),允许区分尽可能多的葡萄基因型组。在高度敏感人群中诉酿酒用葡萄品种Tre,Can,Ale和Cha,所有的转录水平VVCHS.基因,无论0 HPI的组成型差异如何,从感染的初始阶段(16-24 hPI)向后稳定,显着增加,达到72hPi的最大值(图。7,右面板和附加文件3.:表S8)。在适度易受血糖基因型的时间概况中,即SYL,ROM和ROS,而是转录水平的一般和显着增加,直到24 HPI,然后在接下来的48小时内的转录物量快速减少(而是7,右面板和附加文件3.:表S8)。在溶胶和ISA杂交种中,光伏接种导致从感染早期阶段(16-24 HPI)开始的转录物积累的稳定和显着降低,表明在两个柔软的霉菌基因型中的转录中的转录VVCHS.基因响应于病原体(图迅速并几乎完全抑制。7,右面板和附加文件3.:表S8)。
不变的时间表达CHS在模拟接种的植物中观察到了基因(数据未显示)。
讨论
组成型和/或病原体诱导的柔软性抗性性状可在栽培和野生植物中找到诉酿酒用葡萄种质
虽然诉酿酒用葡萄种质被认为是高度敏感的霜霉病[36.],以往的研究表明易感性是种内差异确实存在[11.,12.,13.,14.,15.,16.,17.[因此,支持本构和/或诱导的防御机制可以差异有效诉酿酒用葡萄限制疾病发展的品种[37.,38.].这里报道的结果表明,倾向于接受光伏感染的态度基本上变化诉酿酒用葡萄传统品种种植于意大利,是ROM和ROS明显高于ALE,CAN和TRE的影响较小。在相同的植物材料我们的前期工作[5,16.提示叶片形态特征和二苯乙烯产量可能参与了对霜霉病抗性较弱的品种的限制。从SYL野生种质获得的结果可以看出,在栽培外也存在对PV的适应性抗性性状诉酿酒用葡萄种质。在这种情况下,最近在广泛的收藏中进行了分析诉酿酒用葡萄亚普。Sylvestris.代表仍存在于德国仍存在欧洲野葡萄的遗传变异性的遗传变异,揭示了许多基因型对几种葡萄疾病的耐受性良好,包括柔软的霉菌和粉末状霉菌(erysiphe necator.),它们都是150年前从北美引进的[19.,39.].
提高二苯乙烯合酶基因的组成水平和它们的有力的转录激活p . viticola感染可能有助于提高对葡萄霜霉病的基础免疫力
植物免疫由两个水平组成:进化古老的基础免疫力由更有效和特定的第二级防御互补,这通常不会在病原体和宿主工厂之间的长臂竞争而发展[39.].自培养的葡萄(诉酿酒用葡萄亚普。vinifera.)它的野生祖先(诉酿酒用葡萄亚普。Sylvestris.)不是与PV一起进化的,它们是无害的宿主,与北美野生物种不同葡萄属,缺乏对阵柔软的霉菌的有效第二层先天免疫。某些基因型的事实诉酿酒用葡萄本研究显示对PV较低水平的易感性可能是由于更有效的基础免疫。
请记住,斯蒂芬作为重要的植物嗜盐素,代表了葡萄树中基底免疫的核心要素,然后观察到的差异在本构型表达中vvsts.研究表明,二苯乙烯的生物合成可能是成功抵御病原菌的关键。
在未感染的野生物种的未感染叶片中,对葡萄霉素疾病的组成型抗葡萄牙疾病与沉重的抗微生物化合物(例如肌醇,咖啡酸和斯蒂芬)有关的抗菌化合物[40,41.].还通过与压力和防御有关的基因的高水平表达,包括组成型抗性,包括STS基因,在耐葡萄藤,相比于未接种易感葡萄藤[观察到的更低的表达水平40,41.,42.,43.,44.].相对高的本构vvsts.因此,在这里观察到的抗性和中度易感葡萄植株叶片中的表达,特别是在A和C基因的情况下,可能对特定基因型早期中断或限制后续感染的能力具有预测价值p . viticola.
我们的结果也表明,对于几乎所有的功能vvsts.基因和在所有葡萄基因型中,PV接种后的前72小时内转录激活程度与易感性相反,因此可以反映和预防症状发展程度。至于B集团STS基因是关注的,我们的结果证实了Vannozzi等人的先前发现。[26.]据报道,斯蒂尔比途径的生物合成能力的增加响应于不同的生物和非生物胁迫,包括柔软的霉菌疾病,可以主要由B组贡献vvsts.家庭成员。
这里对群体特定的时间表达模式进行了剖析vvsts.响应PV接种的基因家族可能有助于解释以前的研究结果vvsts.在生物或非生物胁迫下的整体表达(即使用Northern blot检测或带有通用和可能高度保守引物的PCR) [45.,46.,47.,48.,49.].在这样的研究中,其实是时机vvsts.经常观察到响应不同应力的总转录物积累是双相的形状,这导致了一些作者来假设vvsts.基因家族成员可能会被分成两组,其中一月初表示,与mRNA的快速降解,和其他表达以后,拥有较为稳定的mRNA [45.].
Grapevine中斯蒂替斯合酶基因家族的基因组分析表明感染带来的感染p . viticola引发统一和序贯转录的不同基因子集的转录激活,每个亚组可以通过不同和特异性的MYB转录因子来调节
我们的结果表明vvsts.A和C组内的基因可能响应其性质和/或时序与激活B基因的性质和/或定时的转录信号。反过来,我们在这里展示即使在相同的B组基因内,PV接种后可以识别出两个明显可区分的转录时间谱,表明该转录调节的不同机制/定时的累积。
近年来的几种证据表明,两种R2R3型V-MYEL髓霉菌病病毒癌基因同源物(MYB)TFS指定为VVMYB14和VVVMYB15,参与葡萄葡萄酒中斯蒂尔贝烯生物合成的转录调控[33.,48.,49.,50.].这些tf严格地与certain共同表达vvsts.生物和非生物胁迫下的叶组织中的基因(UV-C辐照,伤害和霜霉病感染)和在成熟期间健康发展浆果的皮肤和种子[33.,50.]。因为我们在两者的本文表达中发现九种葡萄基因型中没有发现VVMYB14和VVMYB15,我们发现的不同之处在于vvsts.不能用上述两个tf的活性来解释。也就是说,相对较高的本构表达vvsts.在某些葡萄基因型中检测到的基因可能受TFs的调控,而不是受VvMYB14和VvMYB15的调控。事实上,Wong等人最近进行了一项面向系统的分析[50.]表示对此的作用VVMYB13基因,这是仍然无表的最接近的同源物VVMYB15,在非胁迫条件下调节叶片中的斯蒂尔贝烯生物合成。还建议其他TFS,例如Wrkys,NAC和ARF2,其与某些合作vvsts.二苯乙烯诱导激素激活的基因,可能参与了二苯乙烯生物合成的调控[48.,51.].显然,需要进一步的研究来确定在非应激条件下调控植物组织中二苯乙烯生物合成的VvMYB13和/或其他转录因子是否可能是构成性表达差异的原因vvsts.基因类型。
另一方面,我们的结果强烈建议VVMYB14和VVMYB15参与调节B组的表达vvsts.基因响应PV,从而证实了HOLL等人的发现。[33.[但是,添加每个上述TFS可能专门用于B基因的不同子集。它还值得注意的是,在光伏接种之后,转录激活VVMYB14,但不是说的VVMYB15,在其假定的b基因靶点(24 hpi)初始诱导之前(16 hpi)。
综上所述,PV接种诱导了9个葡萄基因型中不同亚群的协调和顺序的转录激活vvsts.根据所考虑的基因型,其程度与观察到的典格,高,中等或低或低的程度成反比。一旦确立了感染的基因型,就会产生柔软的霉菌症状。既有时间和不同模式的时间vvsts.对病原菌的过表达可能是由不同的转录因子协调的,其中vmyb14和vmyb15对PV的激活似乎与它们各自的激活严格伴随STS目标,它们应该以高度具体的方式互动。
观察到的差异VvMYBs表达式响应于PV提示询问关于其自身转录上游的应力信号。在这方面,提出了茉莉酸 - ,水杨酸和乙烯介导的信号传导途径以发挥作用[51.,52.,53.,54.,55.].的确,Duan等人[49.]证明了STS之间的可诱导性V.Sylvestris.基因型的差异主要与基因型的差异有关VVMYB14转录物积聚,并显示茉莉酸介导的信号传导,但不是水杨酸盐介导的信号传导涉及VVMYB14转录激活。然而,激素介导的二苯乙烯生物合成调控的确切机制以及涉及的转录因子尚不清楚。
在早期阶段p . viticola感染,出现了黄酮酚和斯蒂替斯生物合成之间的拮抗相互作用,其结果可以确定随后的发病率和严重程度的柔软霉菌症状
CAPON合成酶(CHSS),负责丘氨酮的生物合成的关键酶及其衍生物(黄酮醇,原花青素和花螺蛋白)与STSS共用高度的结构和功能性同源性,如两种酶都竞争相同的基材所示[56.].对于三个中的每一个VVCHS.在此分析的基因,我们发现九种基因型中的组成型表达水平的显着差异。但是,与之相反vvstss.,本构表达的这种差异与对PV的不同水平的抗性/易感性无关。而且,再次相反vvsts.在发现九种葡萄基因型之间的显着差异,不仅在水平方面,而且在时间模式方面,关于VVCHS.PV接种后的转录物积累。寻找相似之处和差异,三个清晰可区分VVCHS.鉴定了时间谱,每个曲线代表一组葡萄基因型。特别地,三种基因型基团如此鉴定密切地反映了已经基于疾病症状的发病和严重程度鉴定的高中低光伏易感组(见上文)。但是,以相反的镜面方式尊重vvsts.在美国,PV接种诱导了这三种基因显著且持续的过度表达VVCHS.这些基因型中的基因最容易受到霜霉病的影响,而抗性最强的基因则恰恰相反,vvchss.甚至下调。
显然,结果报告的结果表明了导致斯蒂芬和黄酮类化合物合成的代谢途径之间的相互作用,其结果影响疾病发病率和严重程度。在葡萄细胞中存在这两种途径之间的串扰存在的证据来自不同组织的基因表达分析在各种发育阶段诉酿酒用葡萄品种Corvina, Vannozzi et al. [26.].组织中STSs表达水平一般较低,如茎,芽,嫩叶,脊柱在坐果和发展浆果,表现出较高的组成型表达CHS基因。相反,表达了CHS基因在组织中被抑制STS基因被主动转录,即根,参加叶子,成熟的轴和炎热的浆果。最重要的是,这些同样的作者报告说,除了组成型表达之外,彼此之间的相互拮抗作用的图片vvsts.和VVCHS.当用UV-C暴露或光伏接种挑战葡萄叶或PV接种时出现了基因家庭。事实上,压力处理都导致戏剧性增加vvsts.转录,而表达VVCHS.基因受到强烈抑制[26.].连贯的是,我们的结果表明,在覆盖了覆盖了对柔软霉菌的全部易感性范围的葡萄基因型中,Flavonol生物合成和斯蒂尔贝烯生物合成之间的拮抗关系可能存在拮抗关系。归纳VVCHS.对PV反应的基因,在最敏感的人群中观察到诉酿酒用葡萄品种,以及由此产生的黄酮类化合物在感染早期阶段的积累,可能会阻碍有效防御机制的激活,从而使植物更容易出现疾病症状。相比之下,总的抑制CHS抗性基因型的转录有利于诱导vvsts.基因和随后的斯蒂芬的积累,已知在防御反应对几种病原真菌的反应中起重要作用,包括柔软的霉菌[25.,27.].为进一步支持上述概念,在较不容易诉酿酒用葡萄基因型,即罗、ROS和西尔维,躺在中间高度敏感和耐药之间的葡萄藤、PV接种似乎引起早期类黄酮途径的激活,但是之后迅速关闭,以便phenylpropanoid对对称二苯代乙烯生物合成途径可以令人信服地转移。
结论
在目前的工作中,分析了葡萄二苯乙烯合酶基因家族的每个成员在人工接种前和72小时后的表达p . viticola,霜霉病疾病的因果因子。作为植物材料,我们使用了一组包含栽培和野生的葡萄曲目诉酿酒用葡萄基因型,预期是天生易感的,以及杂交之间诉酿酒用葡萄和美国的葡萄属被认为是天生具有抗性的物种。7天后进行的植物病理学评估表明,在比较的葡萄品种中,霜霉病症状的发生率和严重程度从高到无,在一个亚组中从低到中度诉酿酒用葡萄基因型。
在所检查的所有葡萄基因型中,发现本构型表达以及在病原体接种后很快将芪合合酶基因的转录激活的程度与疾病症状的发生率和严重程度成反比。所带来的感染p . viticola似乎引起了不同的二苯乙烯合酶基因亚群的协调和顺序的转录激活,每个基因亚群可能由一个不同的和特定的MYB转录因子调控。综上所述,本研究结果提示二苯乙烯生物合成的诱导可能有助于提高葡萄对霜霉病的基础免疫力,因此它可能是栽培和野生葡萄都应寻找的适应性抗性性状诉酿酒用葡萄种质。
同时对查尔酮合酶基因的时间表达模式的分析表明,在早期阶段p . viticola感染类黄酮和斯蒂尔贝烯生物合成之间的拮抗相互作用可能会发生,其结果可能会确定随后的毛霉症状的发生率和严重程度。需要进一步详细的研究来证实代谢途径之间的拮抗串扰的存在,这导致抗脂合酶的合成抗性和易感基因型的抗性和黄酮类化合物p . viticola,以及破译其可能的调节机制。
方法
植物材料
五诉酿酒用葡萄亚普。vinifera.在本研究中使用了各种品种,其中一些有助于生产受保护的原产地(PDO)和受保护的地理标志(PGI)葡萄酒,在本研究中使用:黑色刚毛“炼金术”(Ale)和“Canaiolo Nero”(CAN), and white berried “Romanesco”, “Trebbiano toscano” (TRE) and “Trebbiano giallo”, here referred to by using its official synonym, i.e. “Rossetto” (ROS). Previous ampelographic description and DNA analysis confirmed the correct identification of the five varieties [57.].选择这5个葡萄品种是因为它们对霜霉病的抗性水平不同,此前在田间和对照环境中观察到[5,16.].此外,诉酿酒用葡萄亚普。Sylvestris.在Monti Cimini地区(Viterbo, Italy)收集的栽培葡萄的野生祖先(SYL)被纳入本研究,因为越来越多的人对将其作为有用性状引入该亚种的来源感兴趣。vinifera.[19.,20.,39.].柔和的mildew-susceptible诉酿酒用葡萄品种“Chasselas”(Cha),第一代杂交“伊莎贝拉”(ISA)(V. labrusca x V. Vinifera),而且三种品种“solaris”(sol)['merzling'×('saperavi severneyi'x'muscat ottonel')],由美国物种中的多次回复,V.Amurensis.和诉酿酒用葡萄[58.],这两个已知对PV有抗性的基因型被纳入本研究,作为“参考”基因型,以验证人工PV感染的有效性。
评估耐抗性程度p . viticola受控条件下
从木质切屑获得的每个葡萄基因型的两岁盆栽植物用于受控条件下的PV接种试验。每次有三个芽的植物在6.5罐罐中生长,填充有2:1的商业泥炭和浮石混合物,温室在22±2°C和75±5%相对空气湿度下,在16小时的光周期惠特下自然的日光补充有高压金属卤化物灯(奥斯德德德国)。当光学活性辐射降至900μmolm的光合助熔剂密度以下时,施加补充系统- 2 s- 1.在生长期间,植物经常浇水。
在十个开发的叶片阶段,通过喷洒1×10的水性悬浮液接种每种基因型的十五个植物5PV Zoosporangia ml.- 1在轴向叶面上。接种物是从天然感染的植物中获得的,显示剧本霉菌症状,并保持在易感葡萄品种'Malvasia del Lazio'上。通过仅用蒸馏水喷洒叶片来获得每种基因型的十五型麦片接种植物。然后,将嘲弄接种的植物与PV接种的植物保持分离,并在相同的环境条件下生长。
在接种后7 d (dpi)测定9种葡萄基因型对PV的抗性程度。对于每个基因型,所有接种PV的植株都用于测量疾病发病率(以症状叶片占总叶片的百分比表示)和疾病严重程度(以症状叶片表面占总叶片表面的百分比表示)。根据Cadle-Davidson提出的方法计算[13.].通过单向ANOVA评估九种基因型中的两种参数的手段之间观察到的差异的统计学意义,然后是Tukey的测试(p≤0.05)。在分析之前将百分比转化为ArcSine-Square Root。
数据库分析和鉴定靶基因和内参基因
这些感兴趣的基因序列来自NCBI(国家生物技术信息中心)参考序列数据库,该数据库为每个基因组已测序的物种提供了一套全面的、非冗余的、注释良好的序列(RefSeq),包括基因组DNA、转录本和蛋白质。利用两种不同的策略识别STS和CHS合酶的基因参考序列。首先,现有的葡萄STS和CHS cDNA序列[26.,32.,59.]分别在NCBI参考序列数据库的BLAST搜索利用。进一步的搜索,使用词语“芪合酶”和“查耳酮合成酶”作为查询项在携带在诉酿酒用葡萄基因组视图页面。
通过使用对应于标识符VIT_07S0005G03340和VIT_05S0049G01020的基因的已知序列来鉴定两个转录因子VVVMYB14和VVMYB15的参考序列。33.]在PN40024基因型的12x V1基因组组装中。
分别检索每个基因的NCBI mRNA和RefSeq蛋白序列(附加文件)1:表S1, S3和S4)。通过在Interpro、Simple Modular Architecture Research Tool (SMART)、Pfam hidden Markov models (HMMs)和conservative Domains Database (CDD)数据库中分别检测RefSeq蛋白序列,确定识别序列的身份。以RefSeq mRNA序列为模板,确定特异性引物进行表达分析(附加文件)1:表S2-S4)。
最初,在不同应力条件下显示出不同葡萄组织中稳定表达的七种候选基因[60.,61.,62.,63.选择识别最合适的参考基因/基因。确定的候选参考基因编码了以下蛋白质:EF1-α伸长系数(VVEF1α.),砂蛋白质(VvSAND),甘油醛-3-磷酸脱氢酶(VvGAPDH),60s核糖体蛋白L18(Vv60SRP),Actin7(Vvact7.), ubiquinol-cytochromec还原酶复合伴侣(vvuqcc.)和V型质子ATP酶16 KDA proteolipid亚基(VVVATP16)(附加文件1:表S5)。以相应的mRNA RefSeq为模板,设计特异性引物进行表达分析(附加文件)1:表S5)。
系统发育分析
识别的VVSTS推导出蛋白质的多序列对齐(附加文件1:表S1)由Clustalx版本1.83进行[64.],使用GONNET系列作为蛋白重矩阵和参数设定为10间隙开放罚款,0.2间隙延伸罚分,阴性矩阵和发散序列延迟30%。三个CHS蛋白对应于VVCHS1(XP_002264019.1),VVCHS2(NP_001267879.1)和VVCHS3(NP_001268064.1)(附加文件1:表S3)也包括在分析中。用邻近的方法产生一个无根过的系统发育树[65.]使用MEGA7软件[66.].进化距离以每个位点的氨基酸替换数来衡量,使用JTT矩阵法计算。站点间的速率变化采用gamma分布(形状参数= 1)建模。用1000个重复的自举法测试了得到的树的可靠性。
基因表达分析
接种PV 0、16、24、48和72 h后,分别从接种和模拟接种的单株植株顶端5节和6节取样3片均匀、明显健康的叶片。在每次取样时,都使用一种不同的、以前未被接触过的单独植物。摘除后立即用液氮冷冻,在−80℃保存至RNA提取。总RNA提取和cDNA合成参照Paolacci等[67.].
如Paolacci等人所述进行定量RT-PCR分析。[67.[包括三种生物重复,其衍生自三种不同的RNA提取物,RT和QRT-PCR在考虑的五种不同点的每个基因型中的三个单独的植物;此外,对于每种生物重复,评估了三种技术复制。
专为目标和参考基因设计了特定的引物对(附加文件1:使用信标设计器6的软件如Paolacci等人所述(Stratagene公司,拉霍亚,CA)表S2-S5)。[67.].仅通过熔化曲线分析(没有非特异性产品或引物 - 二聚体伪像)并显示90%至110%的效率,仅产生尖峰对2选择对高于0.995的标准曲线计算的值(测定系数)用于表达靶和参考基因。
原来C.t值用delta-C转换成相对的量t公式,Q = EΔct.,其中E为引物对用于扩增某一特定基因的效率(100% = 2),ΔCt是具有最低C中的样品之间的差异t数据集和Ct有问题的样本的价值。仅在比较三个系统发育组的所选成员的相对表达水平的情况下vvsts.在接种前采集9种葡萄叶片基因型p . viticola(图。3.),用于转换c的公式t相对数量的值是q = 2Δct..这种假设是由所考虑的基因的扩增效率约为相同的问题,范围为96至100%。
7个候选内参基因的表达稳定性1:表S5)由软件程序兑换评估[68.,如Paolacci等人所述[67.].奈奎格提出的两种基因的最佳组合是VVEF1α和VVSAND,其稳定性得分显着低于单独进行的最稳定的基因(VVEF1α),表明比使用单一最稳定的基因进行的更精确的归一化。因此,利益基因的表达数据使用两种参考基因VVEF1α和VVSAND的几何平均值标准化,并且其归一化相对值提供为平均值±SD。根据Genorm用户手册(Genorm手册,2008年7月8日)计算归一化表达水平的SDS。在不同五个时间点和特定时间点的不同基因型中对相同基因型的差异的统计学意义通过单向ANOVA进行了单向评估Tukey的测试(p≤0.01)。
数据和材料的可用性
本研究中产生或分析的所有数据均包含在本文及其补充信息文件中。
缩写
- CHS:
-
Chalcone合成酶
- NCBI:
-
国家生物技术信息中心
- PV:
-
Plasmopara viticola
- SD:
-
标准偏差
- STS:
-
斯蒂芬合成酶
- TF:
-
转录因子
参考资料
- 1。
OIV:国际藤蔓和葡萄酒组织,世界活泼栽培的统计报告。2018年,http://www.oiv.com..
- 2。
葡萄霜霉病初发感染预警系统的评价。工厂说。2010;94:709-16。
- 3.
葡萄的疾病和寄生虫,第1卷。蒙彼利埃:小恶魔Paysan du Midi;1997.
- 4。
yu y,张y,yin l,lu J.宿主模式Plasmopara viticola葡萄感染。植物病理学。2012; 102:1094-101。
- 5。
作者简介:马格洛,马格洛,马格洛,马格洛,马格洛,马格洛Plasmopara viticola并反应LATIUM(意大利中的低铜盐浓度)。Acta Hortic。2007; 754:373-8。
- 6。
Toffolatti SL, Maddalena G, Salomoni D, Maghradze D, Bianco PA, Failla O.耐霜霉剂的证据Plasmopara viticola在格鲁吉亚vitis Vinifera种质。葡萄。2016;55:121-8。
- 7。
Pertot i,Caffi I,Rossi V,Mugnai L,Hoffmann C,Grando Ms,Gary C,Lafond D,Duso C,Therery D,Mazzoni V,Anfora G.对降低农药使用的植物保护工具对葡萄和葡萄园的批判性综述在葡萄栽培中实施IPM的新观点。作物科。2017; 97:70-84。
- 8。
Eibach R,TöpferR.传统葡萄养殖技术。在:reynolds a,编辑。葡萄酒行业的葡萄养殖计划。剑桥:elestvier;2015. p。3-22。
- 9。
DI Gaspero G,Foria S.分子葡萄培养技术。在:reynolds a,编辑。葡萄酒行业的葡萄养殖计划。剑桥:elestvier;2015. p。23-37。
- 10。
Zohary D,Horf M.在旧世界的植物驯化。在:西亚,欧洲和尼罗河谷的起源和传播。牛津:牛津大学出版社;2000年。
- 11.
Boso S,MartžnezMc,Uger S,Kassemeyer HH。不同CV霜霉病对霜霉病的评价。albariño克隆。血管。2006; 45:23-7。
- 12.
Boso S,Kassemeyer HH。欧洲葡萄栽培品种对霜霉病的不同易感性。血管。2008; 47:39-49。
- 13。
内部和之间的变异葡萄属SPP。对于叶状霉菌病原体的含叶状抗性Plasmopara viticola.植物DIS。2008; 92:1577-84。
- 14。
Alonso-Villaverde V,Boso S,Santiago JL,Gago P,Martinez MC。“albariño”中气孔的可变性(vitis ViniferaL.)克隆及其与柔软霉菌易感性的关系。血管。2011; 50:45-6。
- 15.
Boso S,Alonso-Villaverde V,Gago P,Santiago JL,MartžnezMC。44葡萄藤的易感性(vitis Viniferal)品种的霜霉病在田间。Aust J Grape Wine Res. 2011; 17:394-400。
- 16。
Paolocci M, Muganu M, Alonso-Villaverde V, Gindro K.叶片形态特征和二苯乙烯产量对霜霉病抗性有不同的影响vitis Vinifera在意大利种植的品种。血管。2014; 53:155-61。
- 17。
Boso S,Alonso-Villaverde V,Gago P,Santiago JL,MartžnezMC。对霜霉病的易感性(Plasmopara viticola)不同葡萄属品种。作物科。2014; 63:26-35。
- 18。
De Macedo BastoGonçalvesMivz,巴伐利福州L,Civardi S,法拉利F.之间的相互作用Plasmopara viticola十个赤霞珠无性系叶片和浆果的感染和二苯乙烯合成。葡萄。2011;50:119-22。
- 19。
TISCH C,Nick P,Kortekamp A.救援被救出:欧洲野葡萄作为抗真菌疾病的抗性遗传资源。第七届国际研讨会的诉讼程序在Gapevine Downy和Payminy Mildew,6月30日 - 2014年7月4日,Vitoria-Gasteiz,2014:61-2。ISBN:978-84-7821-827-1。
- 20。
Schröder S, Kortekamp A, Heene E, Daumann J, Valea I, Nick P.作物的野生亲缘作为遗传资源-以欧洲野生葡萄为例。中国植物科学(英文版)2015;95:905-12
- 21。
langcake p,pryce rj。经白藜芦醇的生产vitis Vinifera和其他植物对感染或损伤的反应。植物生理学与植物病理学。1976;9:77-86。
- 22。
白粉病诱导易感葡萄转录组的防御定向重编程,而非抗性葡萄。植物杂志。2008;146:236-49。
- 23.
陈志强,王志强,王志强,等。诱导子、葡萄栽培因子和酿酒工艺对葡萄和葡萄酒中白藜芦醇和二苯乙烯的影响。Mini-Rev Med Chem. 2012; 12:1366-81。
- 24.
二苯乙烯在葡萄抗白粉病中的作用。植物病理学杂志。2008;72:128-33。
- 25.
Jeandet P,Sbaghi M,Bessis R,Meunier P.斯蒂尔比(白藜芦醇)合成在葡萄浆果皮中的硅霉素含量的潜在关系。血管。1995年; 34:91-4。
- 26.
Vannozzi A,Dry IB,Fasoli M,Zenoni S,Lucchin M. Grapevine Stilebene合酶多胶家族的基因组分析:基因组组织和生物和非生物应激的表达谱。BMC植物BIOL。2012; 12:130。
- 27.
Malacarne G,Vrhovsek U,Zulini L,Cestaro A,Stefanini M,Mattivi F,Moser C.耐受Plasmopara viticola在葡萄植株中,分离群体与二苯乙烯类物质的积累和特定的宿主转录反应有关。BMC Plant Biol. 2011;11:114。
- 28.
Li X,Wu J,Yin L,Zhang Y,Qu J,Lu J.比较转录组分析揭示了与防御相关的基因和粪便霉变的途径血管血管血管小道消息。植物理性生物化学。2015; 95:1-14。
- 29.
Ali MB,Howard S,Chen S,Wang Y,Yu O,Kovacs Lg,秋W.浆果皮肤开发Norton葡萄:转录调节和黄酮类化合物的不同模式。BMC植物BIOL。2011; 11:7。
- 30.
jillon O, Aury JM, Noel B, Policriti A, Clepet C, Casagrande A, et al.;葡萄基因组序列表明主要被子植物门的祖先六倍体化。大自然。2007;449:463-7。
- 31。
Velasco R,Zharkikh A,Troggio M,Cartwright Da,Cestaro A,Pruss D,Pindo M等。杂合葡萄葡萄园基因组的高质量共识序列。Plos一个。2007; 2:E1326。
- 32。
葡萄中二苯乙烯合酶基因家族的结构、功能和进化分析植物杂志。2012;160:1407-19。
- 33。
Höll J, Vannozzi A, Czemmel S, D’onofrio C, Walker AR, Rausch T,等。R2R3-MYB转录因子MYB14和MYB15调控二苯乙烯的生物合成vitis Vinifera.植物细胞。2013;25:4135-49。
- 34。
Kortekamp A,Zyprian E.表征Plasmopara.- 使用体外植物葡萄树的影响。J植物理性。2003; 160:1393-400。
- 35。
Unger S, Büche C, Boso S, Kassemeyer HH。两种不同葡萄基因型的定殖过程Plasmopara viticola表明兼容和不兼容的宿主-病原体相互作用。植物病理学。2007;97:780-6。
- 36。
Polesani M,Bortesi L,Ferrarini A,Zamboni A,Fasoli M,Zadra C,等。一般和物种特异性转录对易感中的柔软霉菌感染的反应(vitis Vinifera)和抵抗(五,河岸)葡萄藤的物种。BMC基因组学。2010;11:117。
- 37。
Gindro K,Pezet R,Viret O.组织学研究两者的反应vitis Vinifera品种(抗性和易感)Plasmopara viticola感染。植物理性生物化学。2003; 41:846-53。
- 38。
Gindro K,Spring JL,Pezet R,Richter H,Viroet O.目标和早期选择抗葡萄种类的组织学和生化标准Plasmopara viticola.葡萄。2006;45:191-6。
- 39。
段志强,张志强,张志强,等。二苯乙烯代谢的遗传多样性血管Sylvestris..J Exp Bot。2015; 66:3243-57。
- 40。
Figueiredo A, Fortes AM, Ferreira S, Sebastiana M, Choi YH, Sousa L,等。葡萄的转录和代谢分析(vitis ViniferaL.)留下衰老可能对抗病原真菌的先天性抵抗力。J Exp Bot。2008; 59:3371-81。
- 41。
石Ĵ,何男,曹Ĵ,王H,丁Ĵ,焦Y,等人。在葡萄的发展阶段白藜芦醇和二苯乙烯合成酶基因家族之间的潜在关系的比较分析(葡萄属quinquangularis和vitis Vinifera).植物生理与生物化学。2014;74:24-32。
- 42。
关键词:葡萄叶片,防御相关基因,接种宿主,非宿主植物生理与生物化学。2006;44:58-67。
- 43。
Fung RWM,邱WP,SU YC,Schachtman DP,Huppert K,Fekete C,Kovacs LG。葡萄种类的基因表达变异vitis Viniferal .,葡萄-金樱子。遗传学RESOUR作物EVOL。2007; 54:1541年至1553年。
- 44。
Dai R,Ge H,Howard S,秋W.斯蒂替斯合酶基因的转录表达在北顿和赤霞珠葡萄葡萄树粉状霉菌的作用和差异。植物SCI。2012; 97:70-6。
- 45。
Wiese W,Vornam B,Krause E,Kindl H.结构组织和位于13kb葡萄DNA片段的三个斯莱特合成酶基因的结构组织和差异表达。植物mol biol。1994年; 26:667-77。
- 46。
陈志强,陈志强,陈志强,等。生物和非生物抗毒素诱导子对葡萄叶片白藜芦醇和二苯乙烯合成酶mRNA表达的影响。阿米尔J Enol vittic . 2004; 55:60-4。
- 47.
王W,Tang K,Yang Hr,Wen PF,张P,王HL,黄WD。白藜芦醇和芪合成酶在幼葡萄植物中的分布(vitis Viniferal .简历。赤霞珠(Cabernet sauvignon)和UV-C对其积累的影响。植物生理与生物化学。2010;48:142-52。
- 48.
方L,侯Y,王L,Xin H,王N,Li S. MyB14,STS直接活化剂,与两种葡萄品种中的白莓皮肤中白藜芦醇含量变化有关。植物细胞代表2014; 33:1629-40。
- 49.
段d,费S,梅尔茨P,伯格斯Ĵ,黎曼男,葡萄转录因子MYB14的尼克P.一个祖先等位基因促进植物防御。J Exp Bot。2016年67:1795-804。
- 50。
王志强,王志强,王志强,等。对葡萄R2R3-MYB转录因子家族的系统分析揭示了对二苯乙烯积累调控的新见解。DNA研究》2016;23:451 - 66。
- 51。
Almagro L, Carbonell-Bejerano P, Belchì-Navarro S, Bru R, Martìnez-Zapater JM, Lijavetzky D, Pedreno MA。解剖诱导子的转录反应vitis Vinifera细胞。《公共科学图书馆•综合》。2014;9:e109777。
- 52。
Belhadj A,Telef Ng,Cluzet SP,Bouscaut Jrm,Corio-Costet MF,MérillonJM。Ethephon在葡萄树中对erysiphe Necator引发了保护。JAgric Food Chem。2008; 56:5781-7。
- 53。
Belhadj A, Telef N, signe C, Cluzet S, Barrieu F, Hamdi S, Mérillon JM。茉莉酸甲酯与碳水化合物联用对葡萄细胞PR蛋白基因表达、二苯乙烯和花青素积累的影响植物生理与生物化学。2008;46:493-9。
- 54。
Vezzulli S,Civardi S,Ferrari F,BAVARESCO L.茉莉酸甲酯作为栽培葡萄植物中白藜芦醇合成的触发。Am j enol vitic。2007; 58:530-3。
- 55。
Kiselev KV, Tyunin AP, Karetin YA。水杨酸诱导了VaSTS1、VaSTS2和VaSTS10基因甲基化模式的改变血管血管血管Rupr。细胞培养。植物细胞代表2015;34:311-20。
- 56。
Austin MB, Noel JPIII型聚酮合酶查尔酮合酶超家族。Nat Prod众议员2003;20:79-110。
- 57。
Muganu M,Dangl G,Aradhya M,Frediani M,Scossa A,Stope E.托斯西亚地区(Latium,意大利)的局部葡萄树的ampelographic和DNA表征。Am j enol vitic。2009; 60:110-5。
- 58。
适合有机栽培的抗真菌葡萄品种。瑞士Weinz。2002;110:20。
- 59。
goto-yamamoto n,wan gh,masaki k,kobayashi s。三种Chalcone合成酶基因的结构和转录葡萄树(vitis Vinifera).植物SCI。2002; 162:867-72。
- 60.
GAMM M,Heloir MC,Kelloniemi J,Poinssot B,Wendehenne D,Adrian M.适用于葡萄葡萄酒中QRT-PCR的参考基因的鉴定和研究参与活体苯丙烯合成的基因的表达。Mol Genet基因组学。2011; 285:273-85。
- 61.
Monteiro F,Sebastiana M,PAIS MS,Figueiredo A.参考基因选择和验证对易感和抗性柔软霉菌感染的早期反应vitis Vinifera品种。Plos一个。2013; 8:E72998。
- 62.
陈志强,陈志强,陈志强,等。葡萄果实实时RT-PCR内参基因的克隆与表达分析。BMC Plant Biol. 2006;6:27。
- 63。
Selim M,Legay S,Berkelmann-Lohnertz B,Langen G,Kogel Kh,Evers D.鉴定葡萄灌注霉病疫苗系统中实时RT-PCR标准化的合适参考基因。植物细胞代表2012; 31:205-16。
- 64。
Thompson JD, Gibson TJ, Plewniak F, Jeanmougin F, Higgins DG。CLUSTAL_X窗口接口:由质量分析工具辅助的多序列比对的灵活策略。核酸Res. 1997; 25:4876-82。
- 65。
王志强,王志强。基于遗传算法的系统发育树重建方法。生物化学学报1987;4:406-25。
- 66。
Kumar S,SteCher G,Tamura K. Mega7:用于更大数据集的分子进化遗传学分析版本7.0。mol Biol Evol。2016; 33:1870-4。
- 67。
Paolacci AR, Catarcione G, Ederli L, Zadra C, Pasqualini S, Badiani M, Musetti R, Santi S, Ciaffi M.茉莉酸介导的防御反应,不同于水杨酸介导的反应,参与了葡萄树黑树病的恢复。BMC Plant Biol. 2017;17:118。
- 68。
实时定量RT-PCR数据的归一化:一种基于模型的方差估计方法,用于识别适合归一化的基因,应用于膀胱癌和结肠癌数据集。实用癌症杂志2004;64:5245-50。
确认
不适用。
资金
本研究部分由LaTium地区的Filas项目“Migliora”资助。资金机构为研究项目提供了财务支持,但没有参与研究的设计,在收集,分析和解释数据以及写作稿件中。
作者信息
隶属关系
贡献
ARP进行了基因鉴定、系统发育分析和表达分析;EA和VB参与基因鉴定和系统发育分析;MP进行了植物病理学工作;MM设计了实验,指导了植物病理学的工作,并参与了手稿的撰写;MB对作品有贡献,并对稿件进行了修改;MC设计了实验,参与了表达分析,并撰写了手稿。所有作者阅读并批准了最终的手稿。
通讯作者
伦理宣言
伦理批准和同意参与
本研究中包含的九种葡萄化基因型不需要用于研究目的的许可,因为它们由托斯西亚大学拥有,并在同一所大学的实验领域保存。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
附加信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:
表S1。vitis Vinifera二苯乙烯合酶基因序列编码(vvsts.)在国家生物技术信息中心(NCBI)数据库中确定。表S2。本研究中用于表达分析的引物对列表vitis Vinifera斯蒂替斯合成酶(vvsts.)基因。表S3。vitis Vinifera基因序列编码的查耳酮合酶(VVCHS.),用于合成用于表达分析的寡核苷酸。表S4。vitis Vinifera编码与二苯乙烯合酶启动子特异性相互作用的VvMYB14和VvMYB15转录因子的基因序列,在NCBI数据库中鉴定并用于合成用于表达分析的寡核苷酸。表S5。vitis ViniferaNCBI数据库中鉴定的候选内参基因编码基因序列,用于合成寡核苷酸,用于qRT-PCR分析中表达数据的标准化。(多克斯30 kb)
附加文件2:
表S6。斯蒂尔比合酶相对表达水平的差异(单向ANOVA之后的单向ANOVA的统计评估(vvsts.)在九种不同葡萄基因型(Gen,基因型缩略词,参见主要文本)的叶片中的基因,从接种(接种后,HPI后的小时)后,有16,24,48和72小时Plasmopara viticola.对于每个二苯乙烯合酶基因,上图为每个葡萄基因型5次采样的均值±SD的统计学差异;下面板显示了9个葡萄基因型在每个采样时间的均值±SD的统计差异。不同的字母表示在统计学上有显著差异p< 0.01;在选择的概率阈值上没有统计学意义。(多克斯59 kb)
附加文件3:
表S7。的MYB转录因子的基因的相对表达水平之间的差异(单向ANOVA,随后通过Tukey检验)统计评估(VVMYB14和VVMYB15)在九个不同的叶子vitis Vinifera在接种后0、16、24、48和72 h(接种后数小时,HPI),基因型(Gen,基因型首字母缩写,见正文)Plasmopara viticola.对于每种MYB转录因子基因,上图显示了每个葡萄基因型的五个采样时间中平均值±SD的统计差;下面板显示了9个葡萄基因型在每个采样时间的均值±SD的统计差异。不同的字母表示在统计学上有显著差异p< 0.01;在选择的概率阈值上没有统计学意义。表S8。统计评价查尔酮合酶基因相对表达量的差异(单因素方差分析及Tukey检验)(VvCHS1-3)在九种不同葡萄基因型(Gen,用于基因型缩略词,参见文本)的叶片,在0,16,24,48和72小时内(接种后,接种,HPI)的72小时Plasmopara viticola.对于每个查尔酮合成酶基因,上表显示了每个葡萄基因型5次采样次数间的均值±SD的统计学差异;下面板显示了9个葡萄基因型在每个采样时间的均值±SD的统计差异。不同的字母表示在统计学上有显著差异p< 0.01;在选择的概率阈值上没有统计学意义。(多克斯28 kb)
附加文件4:
图S1。葡萄杂交种Solaris叶片在接种后7天出现过敏反应Plasmopara viticola。(TIFF 2066 KB)
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
CIAFFI,M.,Paolacci,A.R.,Paolocci,M。et al。对霜霉病差异敏感的葡萄种质中二苯乙烯合酶的转录调控。BMC植物BIOL.19,404(2019)。https://doi.org/10.1186/s12870-019-2014-5
收到:
接受:
发表:
关键字
- Chalcone合成酶
- 霜霉病的易感性
- 葡萄种质资源
- MYB14和MYB15
- 植物病原体相互作用
- Plasmopara viticola
- 斯蒂芬合成酶
- vitis Viniferal