摘要
背景
叶片衰老是一种复杂的过程,由多种遗传和环境变量控制。在向日葵中,叶片衰老突然跟踪过度开发,从而限制了植物在谷物填充过程中保持其绿叶面积的能力,随后对作物产量的强烈影响。最近,我们通过生理学,细胞学和分子方法进行了一系列对比的向日葵近交系对叶衰老的进展。在这里,我们使用RNA-SEQ提出了大规模的转录组分析及其与两种对比的向日葵自交系,R453和B481-6(分别早期和延迟衰老)的代谢谱集成,目的是鉴定与叶片衰老相关的代谢途径。
结果
基因表达谱揭示R453更高数量的差异表达的基因,以及,更高的表达水平,在这一行中的衰老程序的早期活化的证据。与糖和营养循环相关联的代谢途径的线之间被差异调节。此外,我们确定作为在共表达网络集线器的转录因子;一些以前报告为模式植物衰老相关的基因,但许多新的候选基因。
结论
了解作物中衰老过程的发病和进展,并对这些新候选基因的鉴定可能对不同的管理策略来说,这可能对减轻衰老的影响对作物产量的影响。候选基因的功能表征将有助于开发用于育种作物产量的生物技术应用的分子工具。
背景
衰老是叶发育的细胞死亡之前的最后阶段,还由多个遗传和环境变量来控制一个复杂的过程。一旦衰老程序被触发时,发生高度调控的基因表达的变化,从而导致在叶片代谢深刻的变化[1那2那3.那4.].
衰老是植物发育的活性阶段,涉及调节降解和重组过程,这在过早诱导时可以减少作物产量[5.].一年生植物,包括我们的许多谷物和油料作物,在生殖阶段接近尾声时经历了一个视觉过程,伴随着从叶子到种子发育的营养再循环[1].
向日葵是全球最重要的石油作物之一。叶片衰老的延迟与籽粒产量直接相关,主要是由于生殖阶段期间的光合作用[6.那7.那8.那9.].
近二十年来,由于广泛的互补作用,叶片衰老的研究取得了很大进展组学通过整体表型学方法研究这一复杂现象的技术[10].最近,Kim等人[11]对使用多OMICS技术获得的叶片衰老研究进行了修订,突出了该分析的重要性,解决了关于此过程的未解决问题。
最近的努力是指涉及生理,转录和代谢型材的栽培向日葵的功能基因组学工具现在可以获得[12那13那14那15那16那17那18那19那20.].
也就是说,在模型植物物种拟南芥中的叶片上进行了衰老研究的主要目标。然而,在其他器官和/或其他物种中衰老的知识功能和调节机制,特别是农业相关的作物,仍然有限[10].
基因表达分析已经在自然和诱导衰老期间进行,利用近期下一代测序(NGS)和转录组分析的近期进展[21那22那23].
最近,利用综合代谢组学和转录组学方法,Li等[24,研究了从衰老的叶片中再动员营养物质到烟草中的沉积组织。在本研究中,与三羧酸循环相关的代谢途径以及糖、氨基酸和脂肪酸的相关代谢上调。这一结果强调了能量代谢是叶片衰老过程中的一个相关途径。
在我们之前的研究中,我们应用了微阵列技术[16]在商业向日葵杂种中研究叶片衰老进展,分析系统生物学方法中的转录组和代谢型材[19那25].该结果允许鉴定此作物中涉及叶片衰老计划的几种候选基因。
考虑到向日葵育种的近交系着近交系的重要性和需要,我们最近通过生理学,细胞学和分子方法进行了对叶片衰老进展的对比向日葵线的选择[20.].在这项研究中,我们确定和特点从INTA关联映射人口的两个最对比自交系相对于叶片衰老[26[r453和B481-6,分别显示早期和延迟的衰老表型。这些进步,伴随着最近释放了向日葵基因组[27,通过将大规模转录组分析与对照向日葵自交系的代谢谱结合起来,使我们能够将目前的工作提升到系统生物学水平。在目前的研究中,我们确定了与向日葵叶片衰老相关的两种代谢途径,以及代表作物育种有用候选基因的假定转录因子。
结果
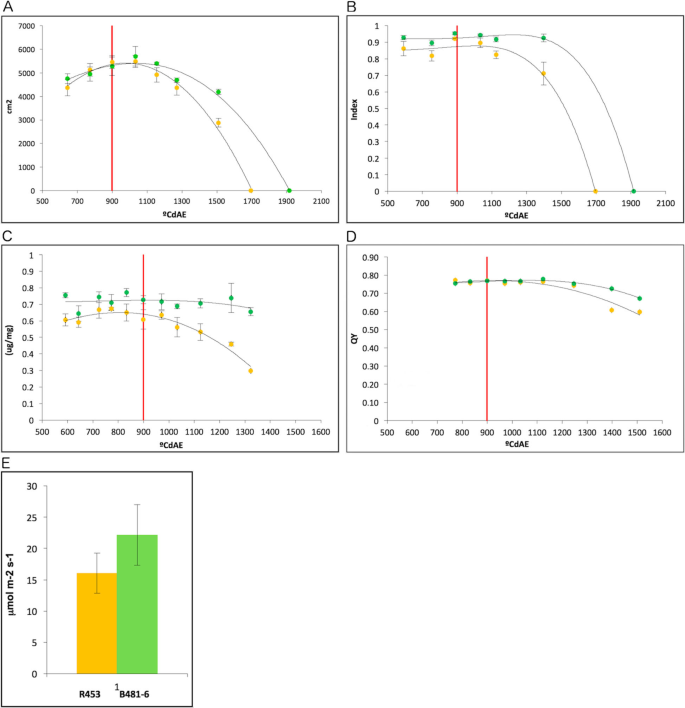
通过生理测量来评估不同品系间衰老进程的差异。绿叶面积(GLA)在开花期100°Cd(1000°CdAE)前也有相似的变化。此时,早衰系R453的GLA急剧下降,在1700°CdAE时达到零,而晚衰系B481-6则呈现出逐渐衰老的过程,仅在1900°CdAE时达到绝对衰老(图481 - 6)。1一种)。此外,在冠层水平上,B481-6线显示出最大拦截辐射指数,而在1500°CDAE,而在R453中,在波纹化后开始截止辐射迅速减少(图。1b)。
两个株系结构相似,开花时间相同(899°CdAE),平均每株有25片叶子。为了进行分子分析,我们选择从植株底部到顶部编号为15的叶片。直到开花期,叶片叶绿素含量基本一致。此时,R453的叶绿素含量开始下降,而B481-6的叶绿素含量稳定在0.7 μg/mg左右(图4)。1c).光系统II的量子产量效率在叶片发育过程中也发生了类似的演变,在早衰系中开花后下降幅度较大(图2)。1d)。花后十二天,光合活性在叶15(图进行测定。1e).虽然没有显著差异,但B481-6比R453表现出更高的光合活性趋势,这与衰老程序的延迟有关。
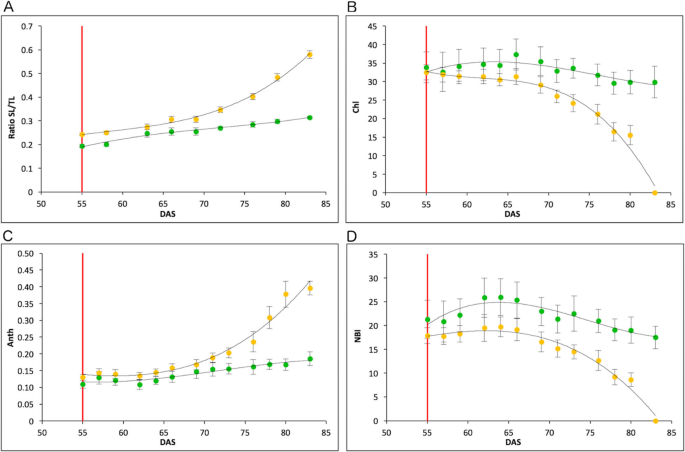
目的在于在不同的环境中表征两条线,我们在法国在内拉 - 图卢兹的Heliaphene平台进行了表型实验[28].在本实验中,两个品系开花后的差异与之前的结果相似。衰老叶/总叶比值R453较早地增加,而B481-6保持不变,衰老速度较慢(图4)。2一种)。我们还测量叶绿素,花青素和叶片15氮平衡指数(NBI)(Dualex科学+)。Regarding the chlorophyll index, R453 line presented a strong decrease 10 days after anthesis and reached zero 28 days after anthesis. At this time point, leaf 15 in B481–6 maintained higher levels of chlorophyll, close to the maximum (Fig.2b)。这一种nthocyanin index increased during leaf senescence in both lines showing a similar rate until 15 days after anthesis. At this time point, anthocyanin content rapidly increased in R453 but only slowly in B481–6 (Fig.2C)。在开花前的氮平衡指数在该观点出现最多10天,在此时,NBI在R453中的速率下降比B481-6更高的速率,即使在性化学后30天仍然保持稳定(图。2d)。
RNA-seq分析
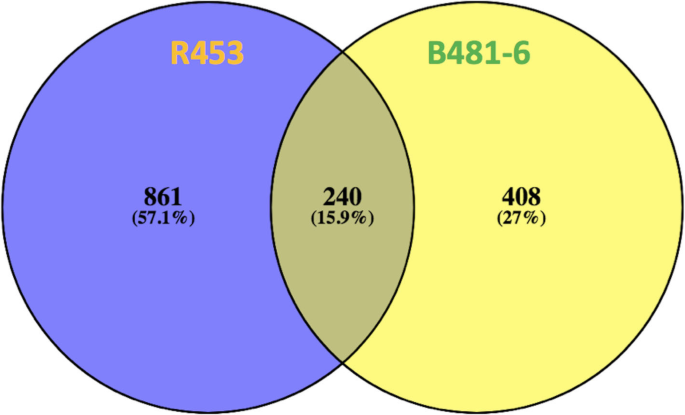
为了评价开花诱导的叶片衰老程序的差异,进行了差异表达分析。结果表明,早衰系和晚衰系开花后与开花期差异表达基因分别为1101和648个。此外,我们比较了这些基因列表,发现两个品系共有240个基因。此外,共有861个基因仅在R453中有差异表达,408个基因仅在B481-6中有差异表达(图)。3.).两条线共享的240个基因显示相同的表达模式,尽管它们中的大多数呈现出早期衰老线(R453)的更高折叠变化。关于仅在R453中差异表达的基因,我们发现与转运蛋白家族,细胞壁和脂质降解,蛋白质降解和氧化还原性稳态有关的基因的表达水平较高,但与细胞周期,RNA转录,次生代谢和基因有关的基因的表达水平与毒素代谢和大分子合成有关。同时,仅在B481-6中差异表达的基因列表显示出与热休克蛋白,光信号,信号传导受体激酶,生物和非生物应激响应,生物和非生物应激响应以及与运输相关的基因的低表达水平相关的基因表达水平更高的基因表达水平脂质代谢(附加文件3.:表S1)。
初级代谢产物分析
采用气相色谱-质谱联用(GC-MS)检测了71种代谢物,包括不同的氨基酸、有机酸、糖和糖醇(附文件)4.:表S2)。在这两行中,碳水化合物和三羧酸循环的中间水平在花期后衰老期间降低(附加文件1:图S1)。赖氨酸、脯氨酸、芳香氨基酸(色氨酸、酪氨酸和苯丙氨酸)和支链氨基酸(异亮氨酸和缬氨酸)以及部分氨基酸衍生物在衰老过程中增加。天冬酰胺-一种与养分循环相关的代谢物-水平在早期衰老系的叶子衰老期间增加(附加文件1:图S1a)。
综合分析
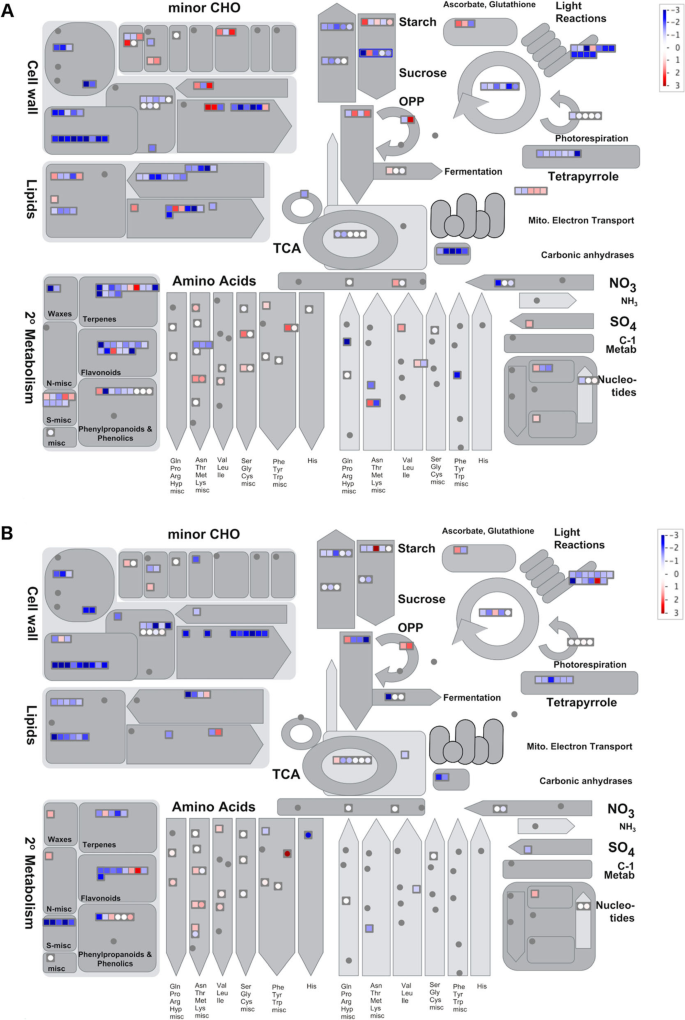
Mapman分析[29,以整合转录组和代谢数据,并比较两个品系花后衰老的进化。当比较叶片衰老过程中最严重的生物过程时,我们发现光合作用和光呼吸、细胞壁修饰、淀粉和蔗糖合成相关基因和代谢产物的下调(图2)。4.).而最相关的分解代谢过程的基因的保持在延迟衰老线更低的表达水平,早期衰老线显示出与糖和淀粉降解相关的基因的上调。同时,与细胞壁和脂质降解,并与相关的营养循环氨基酸的合成相关的基因的基因表现出衰老程序的初叶子衰老线的早期激活。
转录因子分析
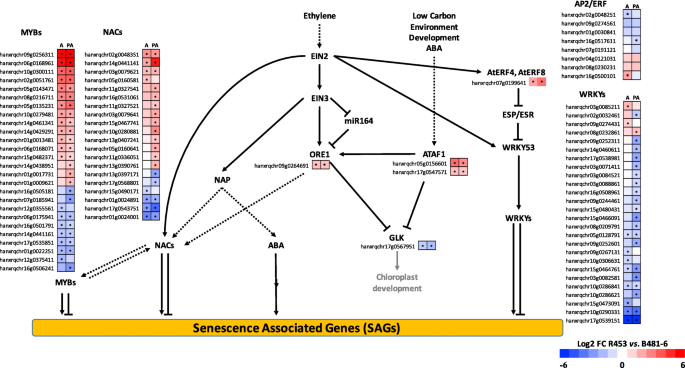
转录因子(TFS)是用代谢组科和全局转录组方法鉴定的不同生物学过程的关键调节因子。乙烯信号传导途径和属于NAC,MYB和WRKY系列的TFS已被广泛报告为许多不同植物物种中的衰老相关,并构成明显的候选基因,专注于并识别叶片衰老监管网络[18那30.那31那32那33].在这项工作中,我们比较了向日葵基因组中R453和B481-6注释的所有家族转录因子在花期和花后的表达水平,以识别品系之间的差异。乙烯信号通路的成员ORE1和ATAF1在R453上调相比,B481-6在两个时间点,而GLK,一个由这些NACs成员负调控的基因被下调(图。5.).这些基因的下游通路涉及许多不同的NAC、MYB和WRKY转录因子。在这个分析中,我们发现在差异表达分析中检测到显著差异的大多数NAC和MYB转录因子在早期衰老系中上调(而且大多是很大程度上的)。相比之下,大多数WRKY转录因子在该线中下调(图。5.).
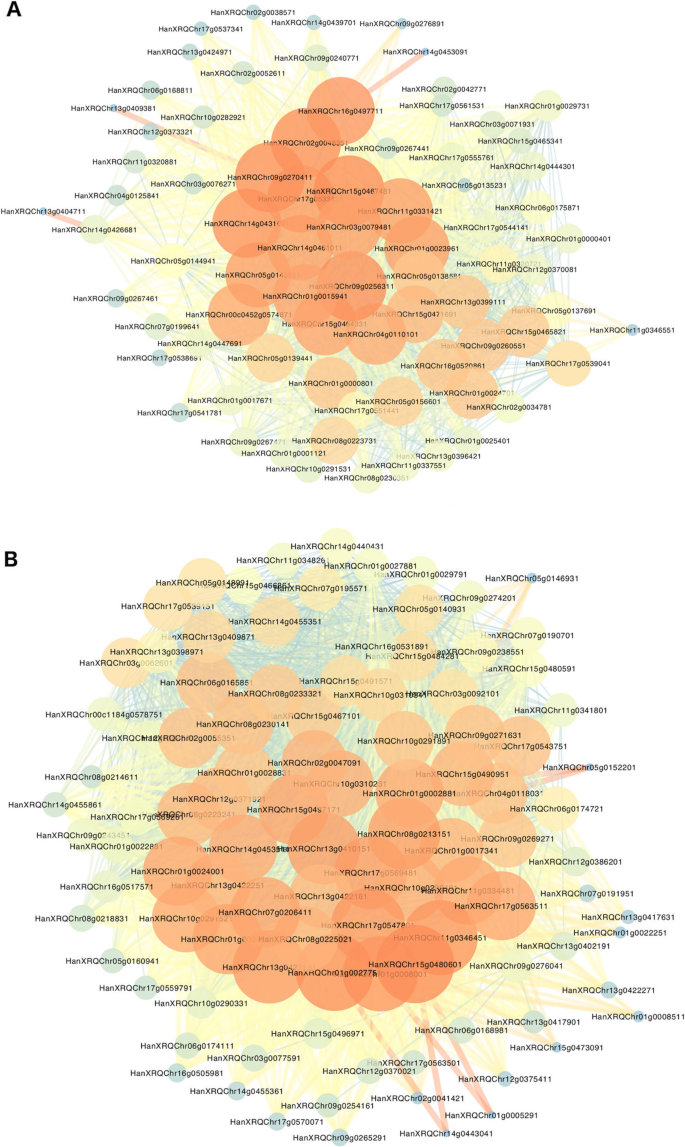
为了找到在叶片衰老相关的早期发育中起主要调控作用的中心基因,我们进行了WGCNA分析,聚焦于开花时差异表达的转录因子R453和B481-6 (Log2倍变化> 2或<−2)。为了便于可视化,我们生成了两种不同的网络,即上调集线器和下调集线器(图1)。6.a和b)学位参数 - 定义为与其他网络基因的连接强度之和 - 用于识别中心基因。上调后的网络显示79个节点和1373条边;25个基因被报道为位点度大于50度。大多数在早衰系中表达水平较高,与来自NAC MYB和WD40-like家族的TFs相对应(附加文件)5.:表S3)。下行网络包含102个节点和3014条边;36个基因被报道为突变点,突变度大于80度。这些基因大部分在花期早衰系中表达水平较低(而在晚衰系中表达水平较高),表现最多的家族为bHLH、C2H2、NAC和CCHC (Zn)家族(Additional file)5.:表S3)。
讨论
在不同的作物,叶子衰老的延迟可能对谷物产量通过维持光合叶面积在生殖阶段产生重要的影响[5.].在向日葵中,这一过程是至关重要的,因为目前的杂交品种在开花后无法保持绿叶面积[6.那7.].作物衰老过程的研究是复杂的,因为有几个层次的时间和空间动态以及不同的生物和非生物胁迫[10].因此,与生理表型相关联的多OMIC方法的整合似乎是必要的,以便对衰老的复杂现象进行解剖[10那11].
在几种不同的作物中,衰老是在开花后在整个植株中诱导的,并受生殖结构发育的控制[5.那34].在这项研究中,我们在开花后的叶片衰老中表现了两条向日葵近交系对比,并进行了转录组和代谢组分析,以了解该过程的代谢途径,目的是鉴定遗传途径适用于作物改善。
两行,R453,和B481-6,呈现类似的架构和物候直至开花期,相同的开花时间和平均每株植物25个树叶。如先前我们报道组在这些线路的主要差异与叶片衰老开花后的进展[20.].在这项工作中,我们在两个不同的环境中进行了表型分析,以评估这些差异的稳健性。两种试验结果与R453开花后衰老过程提前激活相似,这条线表明衰老叶片/总叶片比例提前升高,花青素指数提前升高,叶绿素和氮平衡指数提前降低。(无花果。1和2).
叶片衰老的特征是一个活跃的遗传重编程过程,涉及许多基因、代谢物和激素连接多个信号通路。在这项工作中,利用RNA-seq方法,我们发现在开花后和开花取样时间,早期衰老系中差异表达的基因几乎是开花后取样时间的两倍。此外,当我们比较两个品系共享的基因列表时,几乎所有的基因在R453中都显示出更高(或更低)倍的变化。此外,与脂质和蛋白质降解相关的基因以及与营养物质循环相关的基因也被上调,这表明该品系的衰老程序被提前激活(图)。3.和额外的文件3.:表S1)。
衰老的首要症状之一是光合作用速率下降。开花后,光合作用相关基因的表达量在两个品系中均有所下降,早衰品系中表达量较低。同样地,在开花后12天的光合活性的测量显示,在延迟衰老系(图。1e)。
在不同作物中,协调的养分循环对保证种子生长和影响其质量和数量至关重要。代谢分析显示,在向日葵叶片衰老过程中,糖和三羧酸循环代谢物减少,而且这种减少在早期衰老系也更强烈(补充文件)1:图S1)。此前,我们小组使用向日葵杂交品种VDH487 (Advanta种子)也报道了类似的结果[19].源库关系主要受糖[35那36[特别是向日葵对糖作为石油合成底物具有高要求。与糖和淀粉降解相关的基因,以及与细胞壁和脂质降解相关的一些基因,在早期调味率的早期出生的发后,在发生分解代谢过程的增加(图。4.).
人们普遍认为谷氨酰胺和天冬酰胺是参与营养物质循环的主要氨基酸[37那38那39].这些氨基酸在不同器官之间介导氮气和碳传输,是木质和韧皮中最丰富的氨基酸[37那39那40].在早期调整线中的开仓后发现天冬酰胺水平的积累(附加文件1:图S1A),证明在此行中的活性营养物重定位过程。该生产线B481-6没有显示在评估时间点的任何差异(附加文件1:图S1B)。相比之下,在两条线的叶片衰老期间检测到低水平的谷氨酰胺。在向日葵,Agüera等人。[41]表明天冬酰胺和在衰老叶片氮供应下的增加,在较低的程度,谷氨酰胺。源库关系和养分循环是作物改良的重要任务。叶位置和时间采样可能会影响代谢物浓度和使用时间分辨代谢组学分析,可能有必要了解向日葵养分循环了深入的研究。然而,尽管稳态代谢产物分析并不完全代表叶代谢易位通量,这个结果可以预期从所造成的源库过渡两者的磁通量变化和代谢变化导致[38].在叶片衰老期间观察到氨基酸含量的增加,并且在早期的参赛症中更加明显。这涉及在Manivannan等人报告的干旱胁迫响应期间观察到这些化合物的增加。[42]和最近Fernandez等。那[43提示氨基酸含量诱导可能是发育性衰老和干旱诱导衰老的共同机制。
为了了解这些过程是如何在基因调控水平上控制的,我们还研究了相应组织中的基因表达修饰。特别是乙烯信号通路和与此通路相关的转录因子作为触发和/或控制衰老过程不同通路的关键因子已被广泛报道[30.那44那45].因此,NAC TF家族拥有潜在的衰老控制候选基因。在拟南芥中,受乙烯调控的NAC TFs ORE1作为不同植物物种的衰老诱导物已被广泛研究[46那47那48].在向日葵中,我们之前报道过该基因作为作物叶片衰老的生物标志物。最近,Rauf等人[49表明ORE1也受到ATAF1的正调控,两种转录因子都抑制了叶绿体发育和维持所需的Golden2-like (GLKs)基因的表达。在本研究中,我们发现了向日葵的同源基因ORE1和ATAF1在早衰系中,甚至在开花期也有较高的表达量。5.).此外,GLK基因下调表现出在此行中,甚至在指示衰老途径在过早活化,或者也许,开花。
超过30个NAC基因显示出在拟南芥中天然叶片衰老期间的增强表达[21那31].在这里,我们报道了23个NAC TFS在波动和后性出平坦的两条线之间差异表达,其中大多数在早期的衰老线上上调(图。5.).关于叶片衰老过程中差异表达的转录因子,已有报道称AP2/ERF、WRKY和MYB家族在叶片衰老通路中起核心作用[32那33那45那50那51那52那53那54那55].在这些家庭中,MYB TFS显示出线之间的最高差异,其中大部分在早期的衰老线上上调。尽管在叶片衰老期间表现出差异表达,但只有少数该家庭的成员已经在功能上报告触发衰老[33那52那56].考虑到WRKY转录因子家族,大部分转录因子在早衰系中下调,可能有部分转录因子负调控衰老程序。向日葵的同源基因WRKY70.(HanXRQChr09g0252311)被发现在延迟衰老线(R453下调)(图中被上调。5.).该TF与WRKY54被报道为衰老过程的负调控因子,并可能与WRKY53密切相关,参与整合内部和环境因素的调控网络,调控叶片衰老的发生和进程[32那57].
在农业作物中,不同的共表达网络分析方法被用于推断基因功能,为理解生物过程提供了强有力的工具[58].其目的,以确定转录因子毂如向日葵衰老基因调控网络的主要调节剂,我们进行了加权基因共表达网络分析。我们确定了在花期时间(图中的早期衰老线25个上调转录因子毂。6.a).两个NAC tf被检测为枢纽,HanXRQChr02g0048351和hanxrqchr05g0156601,具有高序列相似性ANAC082和ANAC02 / ATAF1。最近,Kim等人[59[报告了一种NAC TFS网络,负调节拟南芥叶片衰老。在本研究中,作为“NAC Troika”的ANAC017,ANAC082和ANAC090被报告为叶片衰老的负调节剂,显示出早期叶片衰老期间基因表达的增加。作者表明,在叶片衰老期间,阳性和阴性衰老调节基因均上调,这可能会调节衰老阶段过程的开始和进展。ATAF1,脱落酸活化TF那先前据报道,与涉及ORE1的信号通路的上游调节有关,激活其表达并抑制表达Golden2-like (GLKs)基因直接与其启动子结合,这对于叶绿体开发和维护是必需的[49那60].
有趣的是,在上调的网络中发现了7个wd40样基因(图)。6.a和附加文件5.:表S3)。所述WD40域通过作为在蜂窝网络集线器[发挥的范围生物学过程的核心作用61].所述WD40结构域蛋白用作在许多不同的蛋白质复合物或蛋白质-DNA复合物在非常多样的细胞过程[适配器62].然而,人们只研究了其中的少数几个。以苹果为例,MdATG18awd40重复自噬相关基因,在响应叶片衰老和非生物胁迫中发挥作用,提示自噬机制调控[63].我们的研究结果表明WD40-like家族可能在向日葵衰老通路的不同方面发挥核心作用。
这hanxrqchr09g0256311.基因,其中有大量的共表达网络中的连接的,具有高的序列相似性MYC4(一个TF的bHLH家族)。MYC4被认定为JAZ阻遏的一个目标在调节JA依赖性转录响应与操作MYC2(费尔南德斯-Calvo等人,2011; Niu等人,2011)。最近,Yu等人。[64]报道了JAZ7通过抑制MYC2/MYC3/MYC4负调控暗诱导的叶片衰老。
关于下调的TFS,在本研究中,我们发现36个基因报告为在早期衰老线下调的枢纽基因(图。6.B和附加文件5.:表S3)。其中,检测到3种NAC TFS,HanXRQChr01g0024891那hanxrqchr01g0024001,和HanXRQChr17g0543751,具有高序列相似性ANAC087,ANAC047和ANAC036分别。ANAC087和ANAC047最近被报道被“NAC三驾”ANAC090调控,该基因通过直接与它们的启动子结合负调控叶片衰老[59].在我们的研究中,向日葵的基因同源,以ANAC090(hanxrqchr13g0397171)被发现在花期后在早期衰老线(图被下调。5.).ANAC087(与ANAC046一起)也被报道在拟南芥根尖脱落期间和之后调节拟南芥根尖和侧根帽细胞程序性死亡的不同方面[65].这ANAC047基因以独立于ein3的方式激活[30.],但ANAC047在叶片衰老中的作用尚未确定[45].
发现锌指蛋白在下调网络中是作用集线器(附加文件5.:表S3)。张等人。[66]鉴定了1012个小麦衰老诱导基因,报道了WRKY和锌指转录因子在叶片衰老早期的重要作用。
值得注意的是,许多不同的TFS被报告为网络中的集线器,提供了建议一个非常复杂的监管过程的证据。多OMICS数据的集成是为了解决有关叶片衰老等复杂性状的未解决问题所必需的。特别是在诸如向日葵等作物中,其中大多数用于单个基因的功能分析的分子工具,例如转基因或现场导向的诱变,这种方法是确定协调并发下令的分子原理的关键在叶片衰老期间在生物事件中转移[11].
结论
综上所述,在本研究中,我们比较了叶片衰老过程中发生的生理、代谢和转录变化。开花开始后,两个株系的物候结构相似,但衰老进程存在差异。这些差异在非常不同的环境中也得到了证实。与糖和营养物质循环相关的代谢途径在两个品系中都有不同的调控。此外,基因表达谱显示,早衰系的基因数量较多,表达量也较高,表明该系的衰老程序提前激活。此外,WGCNA分析报告了大量的TFs作为共表达网络的枢纽;其中一些在不同物种中作为衰老相关基因被报道过,但其中许多仍有待进一步研究。
了解作物衰老过程的发生和进展将有助于制定不同的管理策略,以减轻衰老的影响,以及在生物学和经济上具有重要意义的籽粒灌浆过程。为了开发生物技术应用于作物产量育种的分子工具,本研究鉴定的候选基因目录仍有待于在功能水平上进一步描述。
方法
植物材料和实验条件
该试验是在2014 - 15生长季期间在Castelar生物技术研究所的大田条件下进行的。之前选择的对照自交系R453(早衰)和B481-6(晚衰)[20.],属于INTA向日葵育种计划,INTA曼弗雷迪向日葵种质资源收集,使用。植物在植物7.2 /米播种2.Leaves were sampled periodically, and frozen immediately in liquid nitrogen and stored at − 80 °C until processing. For all the analysis, three biological replicates were used (plots), each one consisted of three randomly selected plants from each plot. Diseases, weeds as well as insects and bird were adequately controlled. Soil fertility assured maximum yields under non-limiting water conditions and soil water was maintained by irrigation. Transcriptomic and metabolic profiles were performed using the 15th leaf (numbered from the bottom to the top of the plant) at two developmental stages, anthesis and post-anthesis time (12 days after anthesis). Time was expressed on a thermal time basis by daily integration of air temperature with a threshold temperature of 6 °C. Also, plant emergence was considered as thermal time origin (°CDAE:℃,出苗后),如先前建议的向日葵[67].为了测试这些对比的自交系是否能够在不同环境下重现叶片衰老的差异,我们在2017年生长季在法国图卢兹LIPM - INRA Heliaphene平台上进行了表型分析。
生理测量
在实验期间评估了不同的生理和表型测量:
用乙醇化学萃取法测定叶绿素含量。取基质50 mg,用1.5 ml 95%乙醇(v / v)黑暗孵育24 h,直至所有色素完全溶解。用96孔分光光度计测定每个样品的吸光度,计算叶绿素含量为[68]:
无损测量周期性地三个随机选择的植物从每个图进行(n= 9)。叶面积的演化计算如Casadebaig等[69]:
L =叶长度和W =最大宽度= 0.684,b = 0.736, =−8.860加元。
利用荧光仪FluorPen FP 100 (Photon Systems Instruments)和辐射棒ACCUPAR LP-80 (METER Environment)对冠层的辐射截取进行了周期性测量。同样,在开花后12天,使用LI-COR LI-6400XT便携式光合作用系统(Instrumentalia S.A.)对光合活性进行了测量。
使用Heliaphen平台[28[我们对总叶片数,衰老比的总叶片数和时间与开花率进行了测量。此外,使用双重科学+(Force-A,France)定期在叶15上定量叶绿素和花青素含量以及氮平衡指数(NBI)。
转录组分析
RNA分离、定量和质量控制
在收集时,叶片立即在液氮中冷冻并储存在-80°C直至加工。根据制造商的说明书(罗氏,布宜诺斯艾利斯,阿根廷),使用停车,高质量的总RNA从100毫克冷冻组织中分离出来。使用DNase I(阿根廷)在室温下用DNA酶I处理20分钟后消除基因组DNA。使用Qubit荧光计(阿根廷,阿根廷)测量RNA浓度。通过片段分析仪(美国先进的分析技术,美国)测定总RNA的纯度和完整性。
RNA-seq化验
使用试剂盒TruSeq strand mRNA Technology (Illumina)构建RNA库。所有的图书馆都是根据阿根廷财团Tecnologías Genómicas (CATG)的标准质量控制进行评估的。每个文库对端测序(2 × 100 pb),深度为2000万reads [70使用HiSeq-1500 (Illumina) (NCBI - SRA accession: PRJNA525834)。
reads的质量控制使用FastQC进行评估,使用trim_galore进行修剪或过滤。读取与参考基因组对齐[27使用Bowtie2软件的参数:全局对齐和保留所有多映射读取。在获得所有读取映射文件(BAM文件)后,我们使用eXpress软件对所有转录本的所有计数进行重新估计,该软件使用EM方法估计多个映射读取。为了进行计数的统计分析,我们使用了有效计数,这是在测序实验中从该靶点生成的估计片段数,并对片段和长度偏差进行了调整。使用DESeq软件包进行统计和差异基因表达分析[71]在R.
qPCR方法验证RNAseq
评价所选基因的表达与伸长因子-1α(EF-1α)进行评价,其先前已经选择作为表达叶片衰老实验的参考基因[72](附加文件2:图S2)。使用Primer3软件设计了特定的引物对[73,在默认参数下。
对于每个样本,500ng的RNA经DNase处理,并根据制造商的说明书使用随机六聚体引物进行逆转录(上标III第一链合成系统,阿根廷布宜诺斯艾利斯,Invitrogen公司),如之前在《向日葵》杂志上报道的[18].qPCR使用FastStart Universal SYBR Green Master Mix(罗氏应用科学)在ABI StepOne热循环仪(应用生物系统)中进行。利用LinRegPCR检测扩增效率和Ct值[74].使用fgStatistic软件计算基因相对表达[75根据先前公开的算法] [76].
代谢分析
GC-TOF-MS分析
根据Roessner-Tunali等人的研究,代谢物的提取是通过提取亲脂性和极性化合物进行的[77]与适应于向日葵组织[15].样品经衍生后,进样(1 μl)至GC-TOF-MS系统(LECO Corporation, St. Joseph, Michigan, USA)。色谱柱为30 m SPB-50,内径0.25 mm,膜厚0.25 lm (Supelco, Bellefonte, CA, USA)。分别设置注入温度为230℃、界面温度为250℃、离子源温度为200℃。载气为He,以恒定的流量比1ml .m−1.色谱图和光谱使用ChromaTOF (LECO Corporation, St. Joseph, Míchigan, USA)和TagFinder [78].将离子光谱与GOLM代谢数据库进行比较(http://gmd.mpimp-golm.mpg.de/).代谢产物水平归一化为新鲜体重和内控利比妥。代谢物水平的变化计算为相对于对照条件的fold-change。
转录组和代谢整合
MapMan分析
Mapman软件[29]被用来整合转录组和代谢特征。向日葵转录[27通过Mercator注释管道进行注释[79在Mapman中用作图书馆。
表达比截断为log2倍变化大于或小于2(−2),且与ap- 低于0.05。生成的数据表用于Mapman分析。
加权基因共表达网络分析(WGCNA)
WGCNA使用Langfelder和Horvath所描述的WGCNA R包(v1.63)进行[80].表达式的值(DESeq行规范化)38775年的过滤和冗余基因用于构造网络使用以下设置:权力= 5,minModuleSize = 50, mergeCutHeight = 0.2, maxBlockSize = 40000, deepSplit = 2, reassignThreshold−6和minKMEtoStay = 0.3, = 1 e networkType =“签署”,TOMType =“签署”。网络模块与代谢物水平和差异表达的转录因子相关。使用exportNetworkToCytoscape函数(边缘权重阈值> = 0.4)导出了所有21个模块的网络,给出了一个由9538个节点和9,247,259条边组成的网络。从该网络中筛选出449个不同品系在花期差异表达的转录因子,其中449个基因中有322个存在于该网络中,形成了一个由322个节点和16785条边组成的网络。在使用Cytoscape可视化之前,使用Log2倍变化> 2或<−2的上调和下调基因列表进一步过滤该网络[81].
可用性数据和材料
本研究期间生成或分析的所有数据都包含在此已发布的文章中及其附加文件中。RNASEQ数据可在NCBI - SRA Risciverion:Prjna525834。
缩写
- CdAE:
-
ç天出苗后
- GC-TOF-MS:
-
气相色谱-飞行时间-质谱
- GLA:
-
绿色叶面积
- GLKs:
-
Golden2-like基因
- NBI:
-
氮平衡指数
- 门店:
-
下一代测序
- 三羧酸循环:
-
三羧酸循环
- TFS:
-
转录因素
- WGCNA:
-
加权基因共表达网络分析
参考
- 1.
Buchanan-Wollaston V, Earl S, Harrison E, Mathas E, Navabpour S, Page T,等。叶片衰老的分子分析——基因组学方法。生物技术学报2003;1:3-22。https://doi.org/10.1046/j.1467-7652.2003.00004.x.
- 2.
郭颖,蔡志强,甘志强。拟南芥叶片衰老的转录组研究。植物学报2004;27:521-49。https://doi.org/10.1111/j.1365-3040.2003.01158.x..
- 3.
Gepstein S, Sabehi G, Carp M-J, Hajouj T, Nesher MFO, Yariv I,等。叶片衰老相关基因的大规模鉴定。植物j . 2003; 36:629-42。https://doi.org/10.1046/j.1365-313x.2003.01908.x..
- 4.
林波,金海杰,南赫。叶片衰老。植物学报2007;58:115-36。
- 5.
格雷格森PL,Culetic A,Boschian L,Krupinska K.植物衰老与作物产量。植物mol biol。2013; 82:603-22。https://doi.org/10.1007/s11103-013-0013-8.
- 6.
Dosio GAA,AguirrezábalLAN,安德拉德FH,佩雷拉VR,Aguirrezabal LAN,安德拉德FH,等人。种子饱满和石油生产两种向日葵杂种期间太阳辐射截获。农作物科学。2000; 40:1637至1644年。
- 7.
aguirzabal LAN, Lavaud Y, Dosio GAA, Izquierdo NG, Andrade FH, González LM。种子灌浆过程中截获的太阳辐射决定了向日葵每颗种子的重量和油的浓度。作物科学。2003;161:152 - 61。
- 8.
Moschen S,Gialdi Ail,Paniego N,Fernandez P,Heinz Ra。向日葵叶衰老:复杂的遗传过程,具有对作物生产的经济影响。在:衰老 - 生理或病理学:Intech;2017年。https://doi.org/10.5772/intechopen.68588.
- 9.
Moschen S,Radonic LM,Ehrenbolger GF,费尔南德斯P,LIA V,Paniego NB,等人。功能基因组学和转基因应用到向日葵育种:阿里瓦斯JI,编辑。向日葵:生长发育,环境影响和虫害/疾病。纽约:新星科学出版社;2014. p。131-64。
- 10.
综合多组学技术和生理表型在整体表型学方法中研究模型和作物的衰老。J Exp Bot. 2018; 69:825-44。https://doi.org/10.1093/jxb/erx333.
- 11.
Kim J,Woo HR,NAM HG。对系统理解叶片衰老:叶片衰老研究的综合多OMICS视角。莫尔植物。2016; 9:813-25。https://doi.org/10.1016/j.molp.2016.04.017.
- 12.
Fernandez P, Paniego N, Lew S, Hopp HE, Heinz RA。向日葵est在富集器官特异性cDNA文库中的差异表达BMC基因组学。2003;4。https://doi.org/10.1186/1471-2164-4-40.
- 13.
Paniego N,亨氏RA,费尔南德斯P,它俩P,Nishinakamasu V,霍普HE。向日葵。在:科尔C,主编。基因图谱和分子育种植物。柏林海德堡:施普林格出版社;2007. p。153-77。
- 14.
Fernandez P,Di RJ,Fernandez L,Hopp He,Paniego N,Heinz Ra,等。基于cDNA微阵列分析的向日葵反应中参与向日葵响应的候选基因的转录组鉴定。BMC植物BIOL。2008; 8:1-18。
- 15.
李志强,李志强,李志强,等。向日葵基因型的代谢谱与菌核病感染的对比反应。植物化学,2010;71:70 - 80。https://doi.org/10.1016/j.phytochem.2009.09.018.
- 16.
费尔南德斯P,索里亚男,布莱萨d,DiRienzoĴ,Moschen S,里瓦罗拉M等人。发展,表征和栽培向日葵的实验验证(向日葵L.)基因表达的寡核苷酸微阵列。Plos一个。2012; 7:1-11。
- 17.
费尔南德斯P,Moschen S,Paniego N,亨氏RA。功能主义研究叶片衰老的向日葵。在:永田T,编辑。衰老:克罗地亚:英达开放获取出版;2012. p。69-88。
- 18.
Moschen S, Bengoa Luoni S, Paniego NB, Hopp HE, Dosio GAA, Fernandez P,等。栽培向日葵叶片衰老相关候选基因的鉴定。《公共科学图书馆•综合》。2014;9:e104379。https://doi.org/10.1371/journal.pone.0104379.
- 19.
Moschen S,本戈亚罗妮S,狄Rienzo大街JA,卡洛MM德尔P,Tohge T,渡边M等人。集成转录和代谢组学分析,了解自然的向日葵叶片衰老。植物生物技术J. 2016; 14:719-34。
- 20.
LópezGialdiAi,Moschen S,VillánCS,LópezFernándezMP,Maldonado S,Paniego N等人。对照对比向日葵基因型对早期叶片衰老过程的鉴定与表征(Helianthus Annuus L.)。植物SCI。2016; 250:40-50。
- 21.
Breeze E,Harrisona E,MChattiea S,Hughesa L,Hickmana R,Hilla C等人。拟南芥叶片期间转录物的高分辨率时间谱揭示了过程和调节的明显年表。植物细胞。2011; 23:873-94。
- 22.
布坎南-沃拉斯顿V,页T,哈里森E,微风E,廉PO,南HG,等人。比较转录组分析揭示了在基因表达和在拟南芥的发育和暗/饥饿诱导的衰老之间显著差异信号通路。植物杂志2005; 42:567-85。https://doi.org/10.1111/j.1365-313X.2005.02399.x.
- 23.
郭Y,甘S-S。敛散在由叶衰老和衰老27促激素,病理和环境胁迫处理诱导的基因表达概况。植物细胞环境。2012; 35:644-55。https://doi.org/10.1111/j.1365-3040.2011.02442.x.
- 24.
李伟,张洪,李旭,张飞,刘超,杜勇,等。综合代谢组学和转录组学分析揭示了烟草叶片衰老过程中养分的再动员事件。Sci众议员2017;7:12126。https://doi.org/10.1038/s41598-017-11615-0..
- 25.
通过整合转录组和代谢组学数据,研究向日葵叶片衰老过程的网络和生物特征分析。BMC生物信息学。2016;17:174。https://doi.org/10.1186/s12859-016-1045-2.
- 26。
菲利皮巴莱CV,Aguirre的N,Rivas的JG,ZubrzyckiĴ,布拉A,科尔德d,等。群体结构和使用SSR和SNP标记的向日葵关联作图群体的遗传多样性表征。BMC植物BIOL。2015; 15:52。https://doi.org/10.1186/s12870-014-0360-x.
- 27。
Badouin H,GouzyĴ,Grassa CJ,穆拉特女,斯塔顿SE,Cottret L,等人。向日葵的基因组提供了深入了解油代谢,开花和演化Asterid。自然。2017; 546:148-52。
- 28。
Gosseau F,Blanchet N,VarèsD,汉堡P,Campergue D,Colombet C等人。Heliaphen,一个户外高吞吐量表型平台,用于遗传研究和作物建模。前植物SCI。2019; 9:1908。https://doi.org/10.3389/fpls.2018.01908.
- 29。
引用本文:王志强,王志强,王志强,等。MAPMAN:一个用户驱动的工具,用于在代谢途径和其他生物过程的图表上显示基因组数据集。植物j . 2004; 37:914-39。https://doi.org/10.1111/j.1365-313X.2004.02016.x.
- 30.
金海杰,洪胜,金永文,李毅华,Jun JH, Phee B-K,等。乙烯- insensitive2介导的拟南芥衰老相关NAC转录因子的基因调控级联J Exp Bot. 2014; 65:4023-36。https://doi.org/10.1093/jxb/eru112.
- 31.
Kim HJ, Nam HG, Lim PO。NAC转录因子在叶片衰老中的调控网络。植物生物学杂志。2016;33:48-56。https://doi.org/10.1016/j.pbi.2016.06.002.
- 32.
李建军,李建军,李建军,等。WRKY54和WRKY70对拟南芥叶片衰老的负调控作用。J Exp Bot. 2012; 63:2667-79。https://doi.org/10.1093/jxb/Err450.
- 33.
Jaradat MR, Feurtado JA, Huang D, Lu Y, Cutler AJ。AtMYBR1/AtMYB44转录因子在ABA信号、逆境响应和叶片衰老中的多重作用。BMC Plant Biol. 2013;13:192。https://doi.org/10.1186/1471-2229-13-192.
- 34.
戴维斯PJ,甘S.迈向monocarpic植物衰老的集成图。Russ J植物理体。2012; 59:467-78。https://doi.org/10.1134/S102144371204005X.
- 35.
Balibrea拉拉ME,冈萨雷斯加西亚M-C,法蒂玛T,Ehness R,李TK,Proels R,等人。胞转化是衰老的细胞分裂素介导的延迟的一个基本组成部分。植物细胞。2004; 16:1276年至1287年。https://doi.org/10.1105/TPC.018929.
- 36.
Roitsch T, González M-C。植物转化酶的功能和调节:甜的感觉。植物科学进展。2004;9:606-13。https://doi.org/10.1016/j.tplants.2004.10.009.
- 37.
天冬酰胺和其他氮化合物在植物体内的运输和代谢。在:Miflin B,编辑。植物的生化:全面论述。第五届。纽约;伦敦;1980. p。569-608。
- 38.
王志强,王志强,王志强,等。拟南芥发育衰老过程中初级、次级和脂质代谢的时空变化分析植物杂志。2013;162:1290 - 310。https://doi.org/10.1104/pp.113.217380.
- 39.
天冬酰胺和其他氮化合物在植物体内的运输和代谢。适用于:氨基酸及其衍生物。一个全面的论述。Miflin B,编辑器。纽约:爱思唯尔出版社;1980. p。569-608。
- 40。
陈志强,陈志强。韧皮部分泌物技术在豌豆氨基酸转运研究中的应用。植物杂志。1981;68:750-4http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=425975&tool=pmcentrez&rendertype=abstract.2014年5月26日
- 41。
Agüera,Cabello P,De La Haba P.叶片衰老通过低氮营养在向日葵(Helianthus Annuus)植物中。physiol植物。2010; 138:256-67。https://doi.org/10.1111/j.1399-3054.2009.01336.x.
- 42。
马尼万南P,贾里尔CA,桑卡尔B,Kishorekumar A,Somasundaram R,Lakshmanan GMA等。增长,生物化学修饰和脯氨酸代谢向日葵L.作为诱发干旱胁迫。胶体冲浪B生物界面。2007; 59:141-9。https://doi.org/10.1016/j.colsurfb.2007.05.002.
- 43。
Fernandez O,Urrutia M,Berton T,Bernillon S,Deborde C,Jacob D等。向日葵叶的代谢物表征允许用最小一组代谢标志物来区分基因型基或应激水平。代谢组学。2019; 15:56。https://doi.org/10.1007/s11306-019-1515-4.
- 44。
Koyama T,Nii H,Mitsuda N,Ohta M,Kitajima S,Ohme-Takagi M等。涉及II类亚乙基反应因子转录阻遏物的监管级联在叶片衰老的进展中运行。植物理性。2013; 162:991-1005。https://doi.org/10.1104/pp.113.218115.
- 45.
乙烯和转录因子在叶片衰老开始的调控小山T的角色。前植物SCI。2014; 5:650。https://doi.org/10.3389/fpls.2014.00650.
- 46.
金JH,佑HR,金Ĵ,林PO,李IC,彩SH,等人。在拟南芥中涉及的miR164年龄依赖性细胞死亡的三叉前馈调节。科学。2009; 323:1053-7。https://doi.org/10.1126/science.1166386.
- 47.
Balazadeh S, Siddiqui H, Allu AD, Matallana-Ramirez LP, Caldana C, Mehrnia M, et al.;盐促衰老过程中NAC转录因子ANAC092/AtNAC2/ORE1调控的基因调控网络植物j . 2010; 62:250 - 64。https://doi.org/10.1111/j.1365-313X.2010.04151.x.
- 48.
Matallana-Ramirez LP,RAUF M,GARAGE-BARHOM S,Dortay H,Xue G-PP,Dröge-Laser W等人。NAC转录因子ORE1和衰老诱导的双官能核酸酶1(BFN1)构成拟南芥的调节级联。莫尔植物。2013; 1:1-34。https://doi.org/10.1093/mp/sst012.
- 49.
Rauf M, Arif M, Dortay H, Matallana-Ramírez LP, Waters MT, Gil Nam H,等。ORE1通过拮抗g2样转录来平衡叶片衰老和维持。EMBO众议员2013;14:382-8。https://doi.org/10.1038/embor.2013.24.
- 50。
Balazadeh S,Riaño-pachóndm,Mueller-roeber B.调节rapiancopsis叶片衰老的转录因子。植物BIOL。2008; 10(提供。1:63-75。https://doi.org/10.1111/j.1438-8677.2008.00088.x.
- 51。
胡HR,金HJ,南HG,林PO。植物叶片衰老和死亡 - 被控制的多层和影响在一般时效规定。J Cell SCI。2013; 126(PT21):4823-33。https://doi.org/10.1242/jcs.109116.
- 52。
张旭,鞠慧伟,郑敏生,黄鹏,安世杰,金世忠。在拟南芥中,r - r型myb样转录因子AtMYBL参与促进叶片衰老和调控非生物胁迫反应。植物生理学杂志。2011;52:138-48。https://doi.org/10.1093/pcp/pcq180.
- 53。
王志强,王志强,王志强,等。WRKY53转录因子在拟南芥叶片衰老过程中的作用。植物学报,2012,37(6):659 - 663。中国农业科学(英文版)。https://doi.org/10.1007/s11103-005-2142-1.
- 54.
Zentgraf U,Laun T,Miao Y. Wrky53在蔓延的叶片衰老期间Wrky53的复杂调节。EUR JBelt Biol。2010; 89:133-7。https://doi.org/10.1016/j.ejcb.2009.10.014.
- 55.
Guo Y,Gan S. AtmyB2通过抑制拟南芥的后期发展阶段的细胞素介导的分支来调节整株衰老。植物理性。2011; 156:1612-9。https://doi.org/10.1104/pp.111.177022.
- 56.
安巴瓦特,沙玛,亚达夫NR,亚达夫RC。MYB转录因子基因作为植物反应的调控因子:综述。植物学报。2013;19:307-21。https://doi.org/10.1007/s12298-013-0179-1.
- 57.
Ulker B,沙希德穆赫塔尔男,Somssich IE。拟南芥WRKY70转录因子既影响植物衰老和国防信号通路。Planta。2007; 226:125-37。https://doi.org/10.1007/S00425-006-0474-00..
- 58.
Schaefer RJ, Michno J-M, Myers CL。利用基因共表达网络阐明农业物种的基因功能。生物物理学报。2016。https://doi.org/10.1016/j.bbagrm.2016.07.016.
- 59.
Kim Hj,Park J-H,Kim J,Kim Jj,Hong S,Kim J等人。时间不断发展的遗传网络揭示了一种NAC Troika,其负调节拟南芥叶片衰老。Proc Natl Acad Sci U S A. 2018; 115:E4930-9。https://doi.org/10.1073/pnas.1721523115.
- 60.
Garapati P,薛G-P,Munné博世S,在拟南芥Balazadeh S.转录因子ATAF1通过键叶绿体维护和衰老转录级联直接调节促进衰老。植物理性。2015; 168:1122至1139年。https://doi.org/10.1104/pp.15.00567.
- 61.
Stirnimann CU,Petsalaki E,罗素RB,穆勒CW。WD40蛋白质推进蜂窝网络。趋势Biochem SCI。2010; 35:565-74。https://doi.org/10.1016/j.tibs.2010.04.003.
- 62。
徐超,闵建军。WD40结构域蛋白的结构与功能。蛋白质细胞。2011;2:202-14。https://doi.org/10.1007/s13238-011-1018-1.
- 63。
王鹏,孙旭东,王宁,马飞。苹果叶片自噬相关基因MdATG18a的分离与鉴定。Sci Hortic(阿姆斯特丹)。2014; 165:51 - 61。https://doi.org/10.1016/J.SCIENTA.2013.10.038.
- 64。
于军,张勇,狄春,张强,张凯,王超,等。JAZ7负调控暗诱导的拟南芥叶片衰老。J Exp Bot. 2016; 67:751-62。https://doi.org/10.1093/jxb/erv487.
- 65。
斯曼男,安德拉德博诺R,Skorzinski N,Cubria收音机男,德冬季楼Parizot B,等人。ANAC087和ANAC046控制在拟南芥小柱程序性细胞死亡和侧根盖的不同的方面。植物细胞。2018; 30(9):2197-213。https://doi.org/10.1105/tpc.18.00293.
- 66。
张强,夏超,张丽,董超,刘旭东,孔晓霞。小麦叶片早衰突变体的转录组分析。国际分子生物学杂志。2018;19:782。https://doi.org/10.3390/ijms19030782.
- 67。
Kiniry JR, Blanchet R, Williams JR, Texier V, Jones K, Cabelguenne M. Sunflower使用EPIC和ALMANAC模型进行模拟。《F Crop》1992;30:403-23。
- 68。
Lichtenthaler香港。叶绿素和类胡萝卜素:光合生物膜的颜料。方法酶。1987; 148:350-82。https://doi.org/10.1016/0076-6879(87)48036-1.
- 69.
关键词:土壤水分亏缺,向日葵,叶片扩张,蒸腾,阈值Eur J Agron. 2008; 28:46 - 54。https://doi.org/10.1016/J.EJA.2008.02.001.
- 70.
RNA-Seq:转录组学的革命性工具。Nat Rev Genet, 2009; 10:57-63。https://doi.org/10.1038/nrg2484.
- 71.
Anders S,Huber W.序列计数数据的差异表达分析。基因组Biol。2010; 11:R106。https://doi.org/10.1186/gb-2010-11-10-R106.
- 72。
Fernandez P,Di Rienzo Ja,Moschen S,Dosio Ga,Aguirrezabal La,Hopp He,等。向日葵叶片衰老转录分析中QPCR参考基因预测方法和生物学验证的比较。植物细胞代表2011; 30:63-74。https://doi.org/10.1007/s00299-010-0944-3.
- 73。
Rozen S, Skaletsky HJ。为一般用户和生物学程序员的WWW入门3。生物信息学方法与研究进展http://www.ncbi.nlm.nih.gov/pubmed/10547847.
- 74。
Ruijter JM,Ramakers C,Hoogaars WM,Karlen Y,Bakker O,Van Den Hoff MJ,等。扩增效率:在定量PCR数据分析中连接基线和偏差。核酸RES。2009; 37:E45。https://doi.org/10.1093/nar/gkp045.
- 75。
迪里恩佐贾。FGSTATISTIS:Facultad de Ciencias Agropecuarias,Universidad Na;2009年。http://sites.google.com/site/fgstatistics
- 76。
pfaffl mw。实时RT-PCR中相对量化的新数学模型。核酸RES。2001; 29:E45。
- 77。
Roessner-Tunali U,Hegemann B,Lytovchenko A,Carrari F,Bruedigam C,Granot D等人。转基因番茄植物过表达六酮酶的代谢谱揭示了己糖磷酸化的影响在果实发育过程中减少。植物理性。2003; 133:84-99。https://doi.org/10.1104/pp.103.023572.
- 78.
Lueedemann A,Strassburg K,Erban A,Kopka J. Tagfinder用于气相色谱 - 质谱(GC-MS)基于代谢物分析实验的定量分析。生物信息学。2008; 24:732-7。https://doi.org/10.1093/bioinformatics/btn023.
- 79.
刘志强,王志强,王志强,等。墨卡托:一个快速和简单的网络服务器,用于植物序列数据的基因组规模功能注释。植物学报。2014;37:1250-8。https://doi.org/10.1111/pce.12231.
- 80。
加权相关网络分析的R包。BMC生物信息学。2008;9:559。https://doi.org/10.1186/1471-2105-9-559..
- 81。
王金涛,王金涛,王金涛,等。Cytoscape:一个整合生物分子相互作用网络模型的软件环境。基因组研究》2003;13:2498 - 504。https://doi.org/10.1101/gr.1239303.
致谢
我们感谢Julia Sabio y Garcia博士对这份手稿的批判性阅读。
资金
本研究由INTA PE 1131022,1131043资助;ANPCyT Préstamo BID PICT 2012-0390;皮克特人2014 - 0175;PIP conicet PIP 11220120100262co;居里夫人IRSES项目DEANN (PIRSES-GA-2013-612583);日出和Heliasen计划。资助机构提供了财政支持,但没有参与研究的设计、数据的收集、解释或分析以及手稿的撰写。
作者信息
从属关系
贡献
SM、NP、PF和RAH设计了实验。SM、JM、SN、SA、FA、SBL和NB进行了实验。SM, JH, MR进行数据分析。SM, ARF, NBL, NP, PF和RAH在所有作者的输入下撰写了手稿。所有作者都已阅读并批准了最终稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
附加信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:图S1。
使用Mapman代谢轮廓视图。的(a)R453线和(b)B481-6线。颜色强度对应于在对数刻度的表达比(红色:上调,蓝色:下调)的花后对开花的每一行。
附加文件2:图S2。
qPCR方法验证RNAseq。利用延伸因子1α (HaEF1α)作为内参基因,对所选基因(根据Heliagene XRQ Genome Portal中的鉴定编号命名)的花后和花后的表达水平进行对数级(log2)分析。绿色条对应B481-6线,橙色条对应R453线。
附加文件3:表S1。
早衰系和晚衰系花后和花后基因的差异表达。
附加文件4:表S2。
早衰系和晚衰系的花后和花后代谢物分布。
附加文件5:表S3。
通过WGCNA分析选择的表达水平和TFS上调的程度。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Moschen,S.,诺,J.,尼科西亚,S.et al。用系统生物学方法探索两种向日葵线的基因网络,叶片衰老表型。BMC植物杂志19,446(2019)。https://doi.org/10.1186/s12870-019-2021-6
收到了:
公认:
发表:
关键字
- 向日葵
- 叶片衰老
- 候选基因
- 功能基因组学
- 系统生物学