摘要
背景
氮气(n)营养显着影响茶叶中质量相关化合物的代谢和积累(茶树l .)。短期抑制N代谢对茶根和叶的生理和分子机制目前尚不清楚。
结果
在本研究中,我们用一种特殊的谷氨酰胺合成酶(GS)抑制剂,蛋氨酸亚砜亚胺(MSX),对茶树进行短时间(30 min),研究N代谢抑制对质量相关化合物转录组和代谢组的影响。结果表明,MSX处理显著抑制了茶根和茶叶中GS的活性,两种组织均对GS的抑制表现出敏感的代谢反应。在茶叶中,茶氨酸的水解随茶氨酸和游离铵含量的增加而降低。其他氨基酸的生物合成均受到抑制,含N脂质的含量下降,表明短期抑制GS降低了茶叶中N的利用率。GS抑制后糖酵解和三羧酸(TCA)循环相关代谢产物积累,而mx处理组甘氨酸、丝氨酸、异亮氨酸、苏氨酸、亮氨酸和缬氨酸等氨基酸含量下降。我们推测氨基酸的生物合成受到糖酵解和三羧酸循环的反馈影响。
结论
总的来说,我们的数据表明,茶树的GS抑制导致氨基酸和脂类代谢途径的重编程。
背景
谷氨酰胺合成酶(GS, EC 6.3.1.2)是GS-谷氨酰胺-2-氧戊二酸氨基转移酶(GS- gogat)途径中的关键酶,它要么在根吸收铵后立即同化铵,要么在根或叶中硝酸盐被还原为亚硝酸盐后同化铵[1].除了GS-GOGAT途径在N同化中的基本作用外,GS-GOGAT途径的产物还作为信号或前体进一步调节植物的初级和次级代谢。谷氨酸通过转氨酶或转氨酶的作用与其他氨基酸结合,是GS-GOGAT循环的净产物[2,3.].特定氨基酸作为所有含氮有机分子的前体,如蛋白质、叶绿素、细胞色素/光敏色素、次级代谢物和核酸[3.].在茶树中,茶叶中游离氨基酸的总量占干重的1-5%,每一种氨基酸都为冲泡的茶提供了独特的风味和/或香气[4,5].此外,大量含氮酰胺、色素和次生代谢物决定了茶叶的品质[4].因此,GS在茶的初级和次级代谢以及茶品质的形成中是必不可少的[6,7].
GS除了在N同化中发挥作用外,还影响下游代谢。在水稻(栽培稻l .)OsGS1; 1突变体和野生型水稻在糖、氨基酸、三羧酸(TCA)循环产物和次级代谢产物的代谢谱上表现出数量差异[8].这表明,当氮源为铵态氮或硝态氮时,GS在协调植物的整体代谢网络中起着重要的作用。
脂质是主要的亚细胞组分,对环境提示敏感,包括n个地位[9].几十年来,研究人员已经表明N状态会影响脂质的重塑[10,11].在拟南芥,N限制导致半乳糖脂和叶绿素的协调分解,致氯化合物的特异性脂肪酸phytyl酯的沉积和叶绿体的塑料流动[10].最近,Liu等人[11]报道了氮素利用率影响茶树成熟叶和新梢的脂质代谢。因为脂类决定了冲泡茶的味道和香气[12[茶叶植物中Gs活性与脂质代谢之间的关系的调查具有很大的兴趣。
茶树是热带和亚热带国家最重要的经济作物之一[13].氮肥的施用对茶叶的产量和品质至关重要。茶叶中与质量相关的代谢物(如氨基酸、儿茶素、咖啡因、脂质等)受氮肥施用水平和形式的显著影响。游离氨基酸的浓度,特别是茶氨酸,主要在根中合成,然后运输到叶子,在氨水喂养的茶树中要比在硝酸盐喂养的茶树中高得多[14].大部分儿茶素和咖啡因是在茶树叶子中产生的,它们的含量在这2 N形式中是不同的[14,15].在长期使用下,施氮量也会影响脂类的生物合成,脂类被认为是产生风味和香气化合物的原因[11].通过对茶树的转录组分析,鉴定了几个对不同施氮水平和施氮形式的氮利用基因;AMT,NRT.,AQP基因是氮吸收的关键,而GS.和GOGAT基因对氮同化很重要[16,17].以往有关茶树施氮处理的研究通常持续较长时间[14,16,18].长期限制施氮会对茶树造成严重的伤害,抑制茶树生长和茶叶褪绿[18].因此,这些研究没有明确地解释了在N个同化受到限制时在通常生长的茶叶植物中代谢物生物合成的调节过程。否则,N施加在植物上的效果可以在分钟内识别[19].有报道称,茶氨酸、儿茶素和咖啡因三种主要质量相关成分的生物合成途径均在30 min内受到硝酸盐和铵信号的调控,这与这两种N形态在茶树中长时间培养处理不同[15].GS是调节植物氮素同化的关键酶;蛋氨酸亚砜亚胺(MSX)抑制GS 30 min,不仅影响代谢基因的转录水平,还影响代谢物含量[20.,21.].因此,与长期施氮处理相比,短期MSX处理限制了氮素的同化,而不造成氮素的缺乏。了解短期施氮对茶树品质的影响,有助于揭示茶树品质相关代谢产物的代谢规律,为进一步了解茶树品质的发展提供依据。
在这项研究中,我们研究了MSX特定GS抑制剂对茶叶植物中质量相关化合物,即氨基酸和脂质的代谢的影响。为了确定GS抑制对转录组和代谢物重编程的影响,我们进行了用或没有MSX处理的茶叶植物根和叶子的代谢分析和RNA-SEQ分析。我们的研究提供了进一步的见解,进一步了解N同化的机制及其在茶度质量形成过程中的监管。
结果
MSX降低了茶根和茶叶中GS的活性
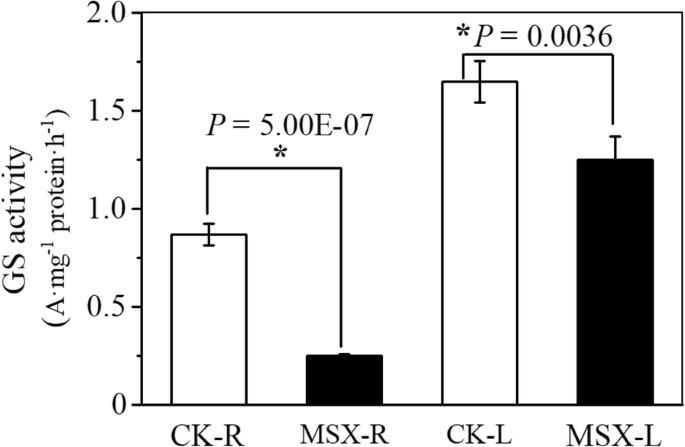
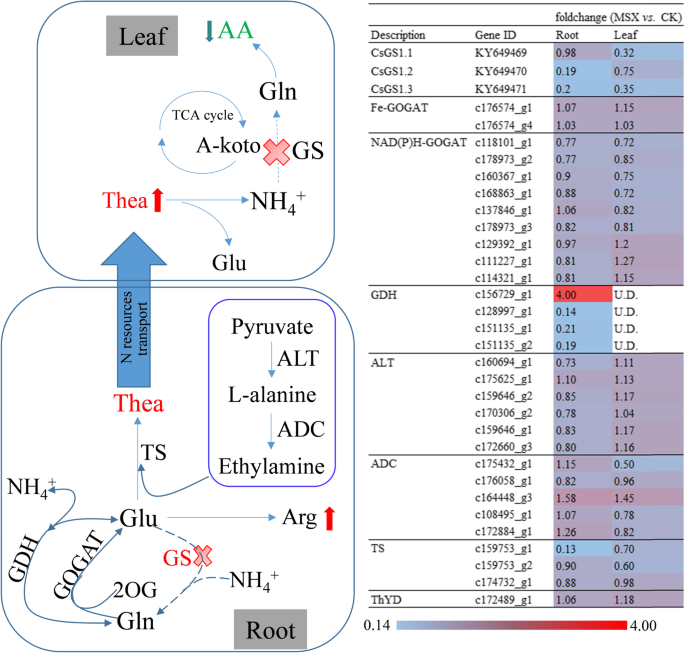
MSX是一种特异的GS抑制剂,已被证明能在30分钟内阻断高等植物中氨向氨基酸的同化[20.,22.,23.].为检测MSX对茶树GS活性的抑制作用,分别在茶树上添加或不添加MSX 30 min。与对照相比,msx处理的茶树根系中GS活性降低了71.1%,叶片中GS活性降低了24%。1).说明MSX对茶树中GS活性有一定的抑制作用。
茶根和叶片对MSX的总体转录组反应
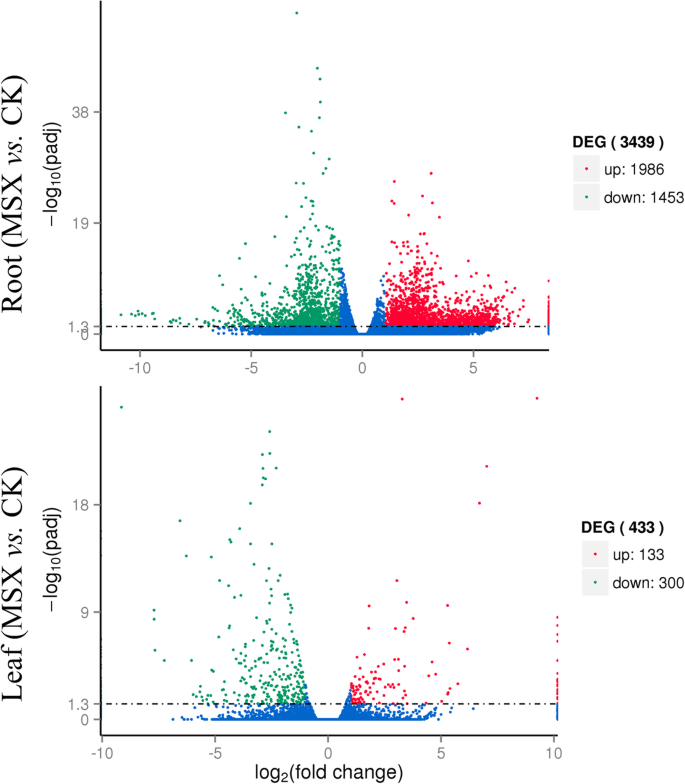
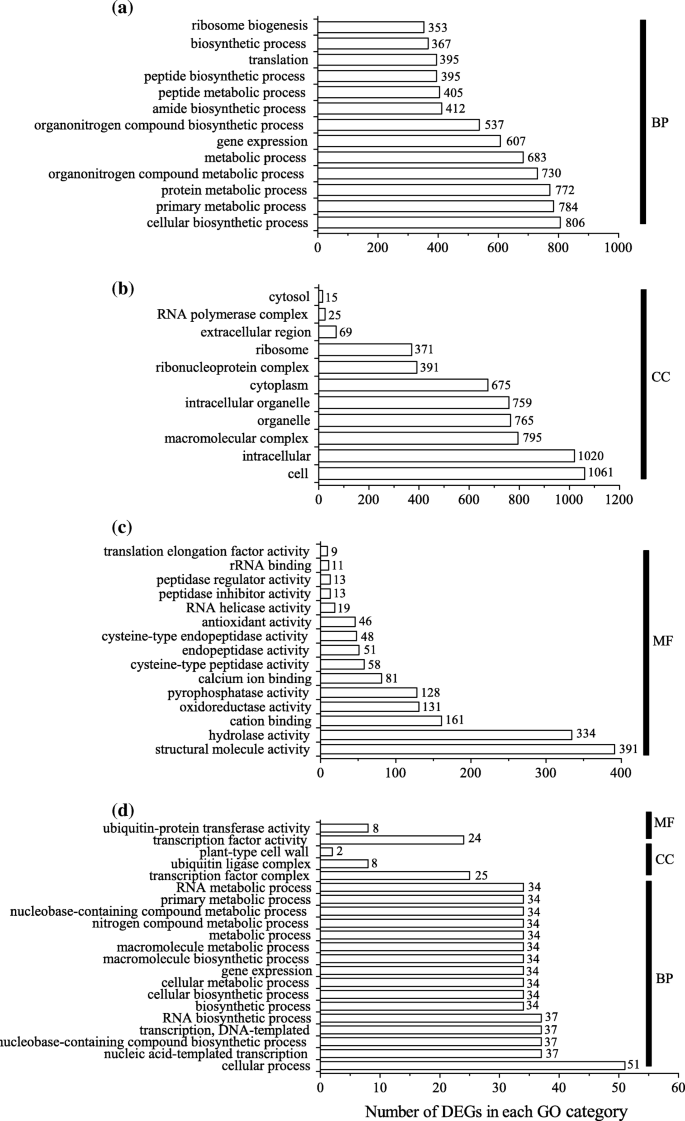
Illumina测序,所有生物重复的样本产生的清晰阅读范围从45 × 106到63×106(附加文件1:表S1)。使用Trinity Software生成326,169 Unigenes的清洁读取从清洁读取(附加文件2:表S2)。在根中,对照和MSX处理组差异表达的unigenes达3439个(差异表达百分比为1.05%),其中上调表达的有1986个,下调表达的有1453个(图2)。2,附加文件3.:表S3)。在叶片中,仅有433个基因(差异表达ungenes的比例为0.45%)差异表达,其中上调基因133个,下调基因300个。2,附加文件4:表S4)。为了深入了解这些deg的功能类别,我们将GO类别分配给根和叶中的所有deg(图2)。3.,附加文件5:表S5和附加文件6:表S6)。在根中,细胞生物合成过程(MSX vs. CK 806 DEGs)、初级代谢过程(784)、蛋白质代谢过程(772)和有机氮化合物代谢过程(730)是生物过程的主导类别(图)。3.a).细胞(1061)和细胞内(1020)是细胞组分中的主要术语(图1)。3.b).根据分子功能的GO项,大多数deg似乎与结构分子活性(391)和水解酶活性(334)有关(图。3.c).在茶叶中,分别标注了2个术语和3个术语的分子功能和细胞成分(图。3.d).在生物过程中排名最高的类别是细胞过程(注释了51个DEGs)(图。3.d).此外,还应用KEGG富集的DEGs来分析直接抑制GS影响的主要代谢途径(附加文件)7:表S7,附加文件8:表S8)。尽管433 deg(附加文件4(表S4)叶片中识别的3439个DEGs不能分配给特定的KEGG通路,而根中则不能分配给特定的KEGG通路3.:表S3)被分配到64个代谢途径(附加文件9:表S9)。改变最多的途径聚类为遗传信息处理、碳水化合物代谢、氨基酸代谢和脂质代谢的KEGG类(附加文件)9:表S9)。
MSX治疗会影响茶叶和叶中的氨基酸生物合成
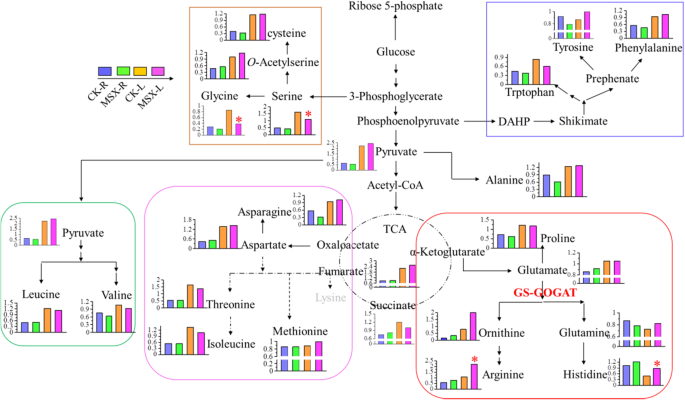
游离氨基酸是茶叶中的风味和香气来源化合物[12].为了在N同化过程中揭示由于GS直接抑制而揭示氨基酸的总代谢变化,通过气相色谱 - 质谱(GC-MS)进行初级代谢分析。来自MSX和CK组共识别了总共155个初级代谢物(附加文件10表S10),变化显著的初级代谢物列于表中1(根和叶的代谢物含量分别为4.52%和12.26%)。氨基酸的生物合成途径[24.[MSX处理后的20种蛋白质含氨基酸的变化如图2所示。4.GS-GOGAT循环下游直接合成的谷氨酰胺、组氨酸、鸟氨酸和精氨酸的含量在msx处理的叶片中高于对照叶片(图2)。4红色框)。在天冬氨酸家族的5种氨基酸中,苏氨酸和异亮氨酸在msx处理下的含量低于对照,但与对照根相比差异不显著。天冬酰胺、天门冬氨酸和蛋氨酸的含量在MSX处理后没有变化(图。4,紫色框架);获得类似的结果对亮氨酸和缬氨酸(图。4绿色框)。MSX抑制GS后,根中酪氨酸和苯丙氨酸水平均下降,而叶中酪氨酸和苯丙氨酸水平略有上升(图2)。4蓝框)。MSX处理后,根中丙氨酸含量较低,叶中丙氨酸含量基本不变;丙氨酸生物合成底物丙酮酸的含量也表现出相同的趋势(图2)。4).与对照组相比,msx处理茶树根和叶中甘氨酸和丝氨酸含量均降低(图2)。4,黄色框)。
为了确认高通量法获得的氨基酸的变化,对部分氨基酸进行了靶向定量分析。除酪氨酸和茶氨酸外,msx处理叶片中13种游离氨基酸的含量均显著低于对照(表1)2).与对照叶片相比,msx处理叶片中缬氨酸、天冬氨酸和赖氨酸含量降低了约27%,丝氨酸、丙氨酸、半胱氨酸和苏氨酸含量降低了32 ~ 36%。msx处理叶片中氨基酸减少最显著的是亮氨酸和苯丙氨酸,分别减少了45%和64%(表1)2).谷氨酸和Theanine是检测到最丰富的游离氨基酸。有趣的是,MSX处理植物中的Theanine的含量高于对照植物,而MSX治疗后谷氨酸的含量略微降低(表2).丝氨酸、苏氨酸、酪氨酸、缬氨酸、丙氨酸、组氨酸、亮氨酸和精氨酸的变化趋势与气相色谱-质谱法一致。
MSX降低茶叶中的茶氨酸水解
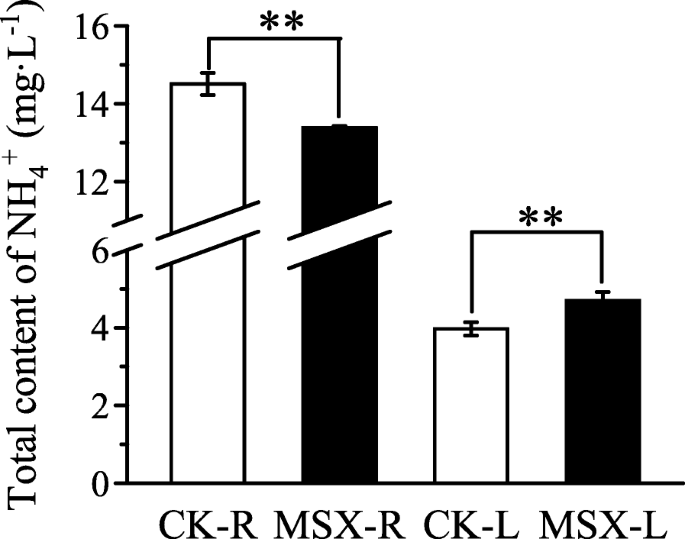
Theanine,也称为L-γ-谷氨酰胺乙胺和N5-乙基-1-谷氨酰胺,是茶厂的特殊非蛋白质氨基酸[25.,26.].有趣的是,在本研究中,MSX处理后茶叶中茶氨酸水平升高,而主要氨基酸成分均下降(表)2).为了更好地了解茶氨酸代谢的调控机制,我们对茶氨酸代谢相关基因进行了分析。5).茶氨酸主要在根中合成,然后转运到叶中。在根中,茶氨酸的生物合成分为两步:谷氨酰胺合成和乙胺合成。与NAD(P)H-GOGAT相关的谷氨酰胺合成基因在MSX处理后大多受到抑制(图)。5).此外,在MSX处理后,根中除c156729_g1增加4倍外,其余未在叶片中表达的谷氨酸脱氢酶(GDH)编码基因c128997_g1、c151135_g1、c151135_g2均下调。乙胺合成的第二步由丙氨酸转氨酶(ALT)和精氨酸脱羧酶(ADC)催化;而ALTMSX处理后根中基因受到抑制,ADC基因表达呈现出对比模式(图。5).尽管茶氨酸独特的肉汤或美味(鲜味)的味道,但据报道茶氨酸也参与了N的储存或运输,以一种无毒的形式[27.].Theanine水解的产品用于葡萄糖,酚类和氨基酸代谢。铵是其水解产物之一。为了揭示茶叶在叶子中增加并考虑其整体代谢过程的原因,测量了茶叶植物的总免疫含量。结果表明,MSX治疗后,铵的总含量减少,但叶片显着增加(图。6).我们假设茶氨酸水解受氨反馈影响;GS抑制引起的铵态氮增加导致茶氨酸水解减少。
用MSX处理的含N和中性脂质的含量和中性脂质的含量降低
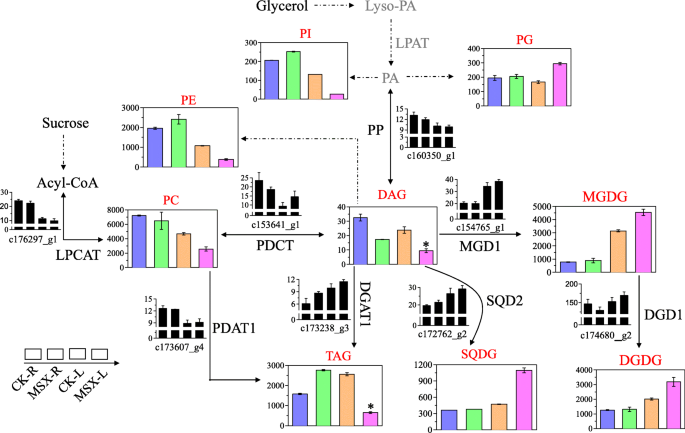
据报道,脂质重塑具有与N状况相关和味道/香气来源化合物的形成[11].Oliveira和Coruzzi [28.]有报道称,GS的代谢调节与根组织中碳骨架相对于氨基酸积累的相对丰度有关。脂类是植物碳骨架的一大部分。因此,我们研究了MSX处理对脂质含量和脂质生物合成相关基因表达的影响。从这项研究中鉴定了125种脂类(附加文件)11:表S11)和表格中的显着改变的脂质列于表中3.(根、叶脂质变化显著的百分比分别为23.2%和21.6%)。数字5显示脂质的主要生物合成途径。与对照叶相比,MSX处理的叶片中含含N型磷脂,磷脂酰胆碱(PC)和磷脂酰乙醇胺(PE)的含量下降(图。7).溶磷脂酰胆碱酰基转移酶基因的表达c176297_g1),参与PC的生物合成,在msx处理的植物中也比对照减少。以甘油二酯(DAG)为前驱体,可以合成PC和PE。我们的转录组数据显示,编码二酰基甘油胆碱磷酸转移酶(PDCT;MSX处理后,根系中c153641_g1)表达下调,叶片中c153641_g1)表达上调;然而,在MSX处理后未检测到PE生物合成相关基因的表达(图。7).磷脂的另一成员磷脂酰肌醇(PI)也表现出与PE相同的趋势。
蛋氨酸亚砜亚胺(MSX)对脂质代谢变化的影响。从左到右分别为对照根(CK-R)、msx处理根(MSX-R)、对照叶(CK-L)和msx处理叶(MSX-L)的样品。黑色条形代表基因的转录水平,彩色条形代表脂类含量。各脂类的含量取该脂类内物种的总和。星号表示MSX组与CK组差异有统计学意义(*P< 0.05)。PP,磷酸酯磷酸酶(EC 3.1.3.4);LPCAT,溶血磷脂酰胆碱酰基转移酶(EC 2.3.1.23);PDCT,二酰基甘油胆碱磷酸转移酶(EC 2.7.8.2);PDAT1,磷脂二酰甘油酰基转移酶1 (EC 2.3.1.158);DGAT1,甘油o -酰基转移酶1 (EC: 2.3.1.20);MGD1, MGDG合成酶1 (EC 2.4.1.46);DGD1,双半乳糖二酰基甘油合成酶1 (EC 2.4.1.241);磺基喹诺酮转移酶(EC 2.4.1.-)
据报道,单乳糖基二酰基甘油(MGDG)、二乳糖基二酰基甘油(DGDG)、磺基喹啉基二酰基甘油(SQDG)和磷脂酰甘油(PG)是组成叶绿体膜的四种独特脂质[29.].在目前的作品中,当MSX治疗受到N同化时,叶片中的这四种脂质化合物的含量均增加;然而,它们的水平在根中没有变化(图。7).的表达MGD1(c154765_g1),DGD1(c174680_g2)和SQD2(C172762_G2)分别负责MGDG,DGDG和SQDG的生物合成的基因,其呈脂质的含量相同的趋势(图。7).
DAG是中性脂类之一,在MSX处理下,根和叶中DAG含量均降低(图2)。7).采用磷酸酯磷酸酶(PP)催化磷脂酸(PA)合成DAG。经MSX处理后,编码PP的unigene (c160350_g1)的转录水平降低(图2)。7).三酰基甘油(标签),另一种中性脂质,其含量在MSX处理的植物的根部增加并在叶子中降低。通过双酰基甘油O-酰基转移酶1(DGAT1)或磷脂二酰基甘油酰基转移酶1(PDAT1)的作用,从DAG或PC从DAG或PC合成标签。在MSX处理的植物中,对DGAT1的UNIGENE(C173238_G3)上调,而PDAT1编码的UNIGENE(C173607_G4)在根系中没有变化,并且用MSX处理的叶片略有增加(图。7).
MSX处理后茶叶中儿茶素含量降低
儿茶素是茶叶碳代谢的关键代谢产物,并确定茶度质量[30.].与对照叶片相比,msx处理叶片中没食子儿茶素(GC)、表没食子儿茶素(EGC)和儿茶素(C)亚型含量显著降低,而没食子儿茶素没食子儿茶素没食子酸酯(GCG)、没食子儿茶素没食子酸酯(EGCG)、没食子儿茶素没食子酸酯(ECG)和儿茶素没食子酸酯(CG)含量仅轻微降低。与对照相比,msx处理叶片中表儿茶素(EC)含量略有增加4).这些结果表明,通过抑制GS活性改变N代谢过程,影响茶树碳代谢。
讨论
在不造成茶树氮素缺乏的情况下,研究茶树中GS的短期抑制作用有助于了解茶质化合物的代谢。茶园施氮多发生在土壤而非叶面;大部分氮以铵(尿素水解)的形式提供,铵在茶根中被吸收[31.,32.,33.,34.].因此,通过营养液施用特定的GS抑制剂msx,先抑制根对N的吸收,再抑制对茶叶的影响。这一方法在以前的模式植物研究中也被采用拟南芥,其中MSX也通过不在叶片表面的营养液施用,以抑制N同化[22.].在茶根上施用MSX对根GS的影响强于叶GS(图2)。1)也表明茶根吸收了大部分氮。
msx处理和对照植物之间氨基酸水平的变化与以往长期N处理试验中报道的不同[14,30.],特别是茶氨酸,其水平在抑制GS活性后下降(表2).此外,Liu等人[35.[]报道了不同茶树组织和品种间茶氨酸生物合成和水解相关基因的转录谱,其发现和见解与我们的研究完全不同。GDH和GS均可参与铵态氮同化[36.].分析国民幸福指数基因表达(图。5)和游离氨含量(图。6)提示GS抑制增强了国民幸福指数在茶树根系中,能维持铵态氮同化和茶氨酸的生物合成,并降低了GS在茶叶中的再利用功能,增加了游离铵的积累(图2)。6).这也解释了为什么谷氨酰胺水平在茶根中不受直接影响,而在茶叶中受直接影响的原因1,图。4).茶树是一种喜铵的植物[14,15,31.,32.,33.,34.].高等植物中游离铵含量有一种平衡[37.,38.].在苯丙氨酸解氨酶催化下,茶氨酸水解和儿茶素生物合成的第一步以及光呼吸都能产生氨[18,35.].铵和谷氨酸是茶氨酸水解的直接产物[35.].释放的氨被GS- gogat途径再次同化,而GS活性抑制导致氨积累[37.].茶叶中铵和茶叶含量增量的另一种可能的解释(图。6、表2),如果水解受控于产物的反馈,则可能降低了茶氨酸的水解。另一方面,经MSX处理的茶叶中苯丙氨酸含量也有所增加(表1)1)虽然一些儿茶素的内容减少了(表4),表明苯丙素代谢产生的铵也减少了,以维持铵的相对平衡,而GS对铵的再利用受到了抑制。
在氨基酸生物合成上游的代谢产物中,GS抑制后糖酵解和TCA循环相关的代谢产物增加(表)1),而与对照组相比,mx处理组的甘氨酸、丝氨酸、异亮氨酸、苏氨酸、亮氨酸、缬氨酸等氨基酸含量降低(图。4).我们推测糖酵解和TCA循环影响反馈回路中氨基酸的生物合成。Theanine是茶中的主要N含量分子[25.,39.].在本研究中,茶氨酸水解减少(图。5)导致N的再利用效率降低,导致GS抑制后其他氨基酸含量下降(图2)。4、表2).
游离氨基酸是茶树中含氮化合物的重要组成部分,它不仅决定着茶叶的品质,而且对人体有益。越来越多的证据表明,氨基酸的生物合成受到茶树N状态的影响[14,30.].茶根吸收N后,谷氨酰胺、茶氨酸、精氨酸、天冬氨酸和谷氨酸是木质部汁液中最丰富的氨基酸[27.].在此,我们发现MSX对GS活性的抑制导致20种蛋白质原性氨基酸含量的特征变化(图。2).丝氨酸的生物合成以谷氨酸为底物;因此,其在叶片中的含量也降低了(图。4).氨基酸浓度随施氮量的增加而增加,丰富的施氮量促进了碳通量向氨基酸的偏移[30.].因此,氨基酸和儿茶素(代表C状态)的水平受到N个地位的管辖。在该研究中,MSX治疗在茶叶植物的根和叶中引起GS活性显着降低(图。1).除非蛋白性氨基酸茶氨酸外,本研究检测到的12种游离氨基酸的生物合成均受到了抑制,儿茶素的生物合成也受到了MSX的抑制(表)2和表4).这些结果表明,在分子和代谢水平上,GS可能在调控C和N代谢中发挥作用。在拟南芥中,C和氨基酸相互调节GS.[28.].抑制GS活性后氨基酸和儿茶素含量降低,表明GS对C和氨基酸代谢具有反馈调节作用。
大多数氨基酸都是植物次生代谢的氮源。在茶树中,茶氨酸被茶氨酸水解酶水解后,也作为N资源进入下游途径,如酚代谢[25.,35.].在本研究中,MSX处理叶片中茶氨酸含量增加(表1),随游离铵含量增加(图。6).考虑到茶氨酸的生物合成、运输和降解过程(图。5),我们推测,GS抑制降低了茶氨酸从根部运输到叶片后的水解。这一推测得到了茶树叶片中游离氨基酸生物合成减少的支持(图。6).铵不仅是茶氨酸降解的产物,也是儿茶素生物合成的产物[40].儿茶素是一种黄烷-3醇,在苯丙素代谢的第一步产生。经MSX处理后,部分儿茶素亚型如GC、EGC和C含量显著降低,而其他亚型含量仅略有降低;而经MSX处理后EC含量增加(表1)4),进一步解释了叶片中游离铵含量增加的原因。因此,GS抑制导致茶树中氨基酸和儿茶素等与茶品质相关的化合物的重塑。
脂质是生物膜的主要成分,在植物中具有多种功能。MGDG、DGDG、SQDG和PG是叶绿体类囊体膜中主要的甘油脂组分。这些脂类对于维持叶绿体的功能至关重要,不仅因为它们占光合膜的很大一部分,而且因为它们组装在光合机制中,因此直接参与光合过程[41.].在这里,我们发现抑制GS活性增加了叶片中MGDG、DGDG、SQDG和PG的含量,并且这种增加是伴随着基因表达水平的增加而增加的(图2)。7)。这些结果表明了光合作用对GS抑制的适应性。高德等[10]已经报道过拟南芥缺氮对MGDG、DGDG等半乳糖脂组成有影响,前者降低,后者增加。然而,在我们的研究中,治疗条件是不同的。在24 h内抑制GS活性既不会损害植株的生长性能,也不会导致植株缺氮[21.].在本研究中,我们将GS抑制剂MSX短时间(30 min)处理茶树,以抑制N代谢,同时避免N缺乏[22.].因此,我们的研究中对GS的短期抑制和其他研究中N缺乏导致的N代谢不良具有一定的调控网络,DGDG及其相关基因的变化在这两种处理中均表现为增加。否则,还需要更多的研究来揭示GS抑制下光合作用脂类代谢的调控网络。
植物中的大部分脂质由含N的磷脂化合物表示。在本作工作中,在抑制GS活性时,含N含脂质化合物PC和PE的含量下降(图。7),表明GS抑制后茶树氮素利用率降低。也有报道称,植物中氮的再利用对碳水化合物和蛋白质的代谢有着深远的影响[42.].其他脂类化合物,包括PI、DAG和TAG的含量也因GS活性被抑制而发生显著变化(图2)。7).茶叶植物幼叶中标签含量的变化与先前的研究一致,这报告了幼叶中的N限制导致标签的低积累[11].在这项研究中,磷脂,糖脂,和中性脂质GS抑制后叶改变,这N个状态在植物改变水平影响脂质形态[42.].我们的发现与植物重塑C-N平衡以维持其生长性能和新陈代谢的观点一致[43.].
结论
在本研究中,我们确定了GS活性对茶树转录组变化的影响。结合代谢谱分析,进一步阐明了GS活性对茶树两种主要风味和香气来源化合物(游离氨基酸和脂类)生物合成的贡献。对茶树中GS的抑制导致代谢途径的重编程,进而影响茶叶品质的形成。因此,我们的研究结果为茶树(一种喜铵植物)响应GS活性被抑制的代谢途径提供了新的见解。
方法
植物材料及处理
从中国农业科学院茶叶研究所所属茶园中采集国家发布的市售无性系“龙井43”的根插枝;收集这些材料不需要许可。“龙井43”一年生的根插枝首先在稀释营养液中预培养1个月,以保持幼嫩茶树的生长,特别是根系,如前所述[15].随后将插枝移栽到含4.5 L全效营养液的花盆中(每盆8株),待1周后开始试验处理。1周后,将茶树移栽于不含或含0.1 mmol/L MSX (sigma 5379)的相同新鲜营养液中,抑制茶树对N的吸收作用30 min [[20.,22.,23.,44.,45.];MSX未治疗的茶叶厂用作对照(CK)。每次治疗使用三个盆,每壶罐被认为是生物学重复。为了使单个茶叶植物引起的偏差,将新的杨氏叶和吸收来自同一锅的8个植物的吸收根部分别作为一个生物重复的样品池混合在一起。在MSX或对照处理30分钟后,在液氮中迅速冷冻并在液氮中迅速冷冻,并储存在-80°C的生理,转录组和代谢物分析后进行对根和叶进行。
本研究使用的全效营养液含有以下常量营养素(mmol/L):(NH4)2所以4(1.0), Ca(没有3.)2(0.5), KH2阿宝4(0.1), K2所以4(0.5), MgSO4(0.4),CACL2(0.3)和微量元素(μmol/L): H3.薄3.(10), MnSO4(1.5), ZnSO4(1.0), CuSO4(0.2),(NH4)6莫7O24.(0.07)和Fe-EDTA(6.3)。所有营养液的pH用H连续滴定至5.02所以4和氢氧化钠。所有试验均在环境控制的生长室内进行,条件为:日/夜温度26°C/22°C,相对湿度70%,光照14 h /暗光10 h, 200 μmol m- 2年代- 1光强度。
GS活性的测定
为了测定总GS活性,每个冷冻样品用球磨机(M301 Retsch,德国)将100 mg研磨成细粉。根据Magalhaes和Huber [46.稍作修改。简单地说,样品在提取缓冲液(50 mmol/L Tris-HCl [pH 8.0], 2 mmol/L MgSO)中均质44 mmol/L二硫苏糖醇和0.4 mmol/L蔗糖)。植物提取物13000 g(4℃)离心25 min,分析各提取物上清液,测定可溶性蛋白含量[47.和GS活性。上清液在反应缓冲液(100 mmol/L Tris-HCl, 80 mmol/L MgSO)中孵育后测定GS活性4, 20 mmol/L谷氨酸钠,80 mM NH2OH, 20 mmol/L半胱氨酸,2 mmol/L EGTA和40 mmol/L ATP), 37℃,30min [46.,48.].然后,含有0.2mol / L TCA,0.37mol / L FECL的静止溶液3.加入0.6 mol/L HCl;用分光光度计记录上清液在540 nm处的吸光度。GS的比活性用mg的吸光度(A)表示- 1蛋白质·h- 1.
RNA制备、文库构建、转录组组装及数据处理
使用Trizol试剂(Invitrogen公司,美国)从所有生物重复(每个处理3个生物重复)中分离总RNA。RNA定量和鉴定后,按照Illumina®(NEB,美国)的NEBNext®Ultra™RNA library Prep Kit手册,使用每个样本1.5 μg RNA构建cDNA文库。测序在Illumina Hiseq平台(诺福金生物信息学技术有限公司,北京)进行,并生成配对端序列。
通过去除具有模糊核苷酸的低质量读数来获得高质量的读取(清洁读数),并从原始读取中过滤衔接序列。通过使用min_kmer_cov设置为2的三位一体来完成转录组组件,并使用trinity使用trinity设置为2,并且所有其他参数设置默认[49.].使用NCBI非冗余核苷酸序列(NT),NCBI非冗余蛋白序列(NR),蛋白质(Kog / Cog),蛋白质(PFAM)簇的簇进行所得unigenes的功能诠释。手动注释和审查的蛋白质序列数据库(Swiss-prot),基因本体(Go),以及Kegg Ortholog(KO)[50.].此外,所有获得的unigenes均采用最新的全面注释茶树基因组(山茶(Camellia sinensis)变种)(茶树CSS改进基因注释版本2,发布日期:2019-01-18)[51.,52.].
对每个样本,采用RSEM计算基因表达水平[53.].应用DESeq R包(1.10.1)分析处理组(MSX)与对照组(CK)的差异表达基因(DEGs)。DESeq提供了使用基于负二项分布的模型来确定数字基因表达数据中的差异表达的统计例程。由此产生的P使用Benjamini和Hochberg的方法来控制错误发现率(FDR)。在这项研究中,应用了三个生物重复,因此基因与调整PDESEQ发现的 - Value(p adj)<0.05被分配为差异表达。p adj是一个调整的p-Value,考虑到FDR。当我们从小样本集中测量数千(例如基因表达水平)时,需要施加FDR(例如,例如,几个人)。P值为0.05意味着我们愿意接受5%的所有测试将是误报。0.05的FDR调整的P值(AKA A Q值)意味着我们愿意接受5%的测试,发现统计学意义(例如,P值)将是误报。当我们在同一样本进行多次测试时,需要这种调整。基于Goseq R包的Wallenius非中央超几何分布用于DEG的富集分析[54.].通过使用京都基因和基因组百科全书(KEGG)注释将DEGs分配到代谢途径,进一步完成了对DEGs的生物学解释。所有转录组数据已提交至NCBI Sequence Read Archive (SRA)数据库,登录号为SRR5992801(发布日期31/08/2018)。
代谢组学和脂质组学的GC/LC-MS分析
根据Giavalisco等人的方法提取代谢产物[55.].新鲜样品首先被冻干,然后送到马克斯·普朗克分子植物生理学研究所(MPIMP),在那里进行测量。简单地说,50mg叶子样品(25mg根样品)在1ml MTBE缓冲液中均质,在轨道摇床上4°C孵育10分钟,然后在超声波浴中再孵育10分钟。加入0.5 ml uplc级甲醇:水1:3后,在台式离心机(Eppendorf)中在4℃下旋转匀浆5分钟。甲醇:水的加入导致相分离,提供含有脂类的上层有机相,含有极性和半极性代谢物的下层水相。
用偶联的Agilent Technologies气相色谱(GC)测量用于初级代谢物的样品,其偶联至LeCo Pegasus HT质谱仪,其由电子碰撞电离源(EI)和飞行时间(TOF)质量分析仪组成。在从色谱图中提取后,将数据处理,对齐,过滤和注释为Giavalisco等。[55.)描述。每个代谢物的重要性由学生的评估t-测试 (P < 0.05) and FDR (q-value < 0.05). FDRs were calculated in a hierarchical way according to the metabolite groups.
使用Waters ACQUITY反相超高效液相色谱(RP-UPLC)与thermofisher萃取质谱仪(由电喷雾电离源(ESI)和Orbitrap质谱分析仪组成)耦合测定脂质样品。根据Liu等人完成峰值标注和数据处理[11].将电喷雾正、负两种模式检测的脂类化合物结合后,应用R软件进行数据归一化。首先,我们从原始色谱强度计算每个脂类化合物的变异系数。其次,除去标签外,使用变异率低于50%的化合物的强度对数据集中的所有脂类进行归一化。根据每个类的内容,计算给定类内的种的总和。统计分析使用学生的t-测试 (P< 0.05),以鉴定MSX组和CK组间脂类的显著变化。采用学生t检验和FDR鉴定MSX组和CK组间显著变化的脂类种类。
儿茶素和游离氨基酸的测定
用75%甲醇和0.1%甲酸在室温下超声15 min提取样品中的儿茶素。提取液经0.22 μm聚四氟乙烯过滤器过滤后进行测量。采用反相高效液相色谱(HPLC)系统对儿茶素进行定量,使用C18反相色谱柱(250 × 4.6 mm i.d, Phenomenex, Torrance, CA,USA),如前面所述[56.].使用AccQ Tag柱(3.9 × 150 mm),采用高效液相色谱法分析游离氨基酸,衍生化后使用AccQFluor试剂试剂盒(Waters Corporation)进行荧光检测,根据制造商手册[14].
组织铵测量
组织铵的测量方法由Weatherburn描述[57.].将0.5g将每个样品在5ml硫酸溶液(0.3mm)中均化,以提取茶样品的铵。将匀浆在20000g(4℃)离心20分钟后,将0.2ml上清液转移到10ml离心管中,然后加入4.9ml酚溶液(含0.5%w / w硝酸钠)和4.9 ml alkaline sodium hypochlorite solution (5 g NaOH dissolved in 52.5 g/L sodium hypochlorite solution), and mixed. Absorbance of the mixture at 625 nm was recorded in a spectrophotometer. Ammonium content was calculated based on the standard curve, which was generated using ammonium sulfate solution.
学生的t-测试 (P< 0.05)进行GS活性和铵含量的统计分析。
数据和材料的可用性
本研究中产生或分析的所有数据均包含在本文及其补充信息文件中。
缩写
- 阿拉巴马州:
-
丙氨酸
- Asp:
-
Asparate
- C:
-
儿茶素
- 重心:
-
儿茶素没食子酸盐
- 半胱氨酸:
-
半胱氨酸
- DAG:
-
甘油二酯
- 度:
-
差异表达基因
- DGAT1:
-
二酰基甘油O-酰基转移酶1
- DGDG:
-
Digalactosyl甘油二酯
- 电子商务:
-
epicatechin.
- 心电图:
-
表儿茶素没食子酸盐
- EGC:
-
儿茶素
- EGCG:
-
儿茶素没食子酸盐
- GC:
-
儿茶素
- GC:
-
气相色谱法
- GCG:
-
GallocateChin Gallate.
- Glu:
-
谷氨酸
- 走:
-
基因本体论
- GOGAT:
-
Glutamine-2-oxoglutarate amidotransferase
- g:
-
谷氨酰胺合成酶
- KEGG:
-
京都基因和基因组百科全书
- 低浓缩铀:
-
亮氨酸
- LYS:
-
赖氨酸
- 满足:
-
甲硫氨酸
- MGDG:
-
单烷酰基二十六甘油
- MSX:
-
蛋氨酸sulfoximine
- 护士:
-
氮气
- PA:
-
磷脂酸
- PC:
-
磷脂酰胆碱
- PDAT1:
-
磷脂二氨基甘油酰基转移酶1
- PDCT:
-
二酰基甘油cholinephosphotransferase
- 体育:
-
磷脂酰乙醇胺
- 答:
-
Phosphatidylglycerol
- PHE:
-
苯丙氨酸
- PI:
-
磷脂酰肌醇
- 页:
-
Phosphatidate磷酸酶
- 爵士:
-
丝氨酸
- SQDG:
-
Sulphoquinovosyl甘油二酯
- 标签:
-
三酰基甘油
- Thea:
-
Theemine.
- 刺:
-
苏氨酸
- 酪氨酸:
-
酪粉
- 瓦尔:
-
缬氨酸
参考
- 1.
Thomsen HC,Eriksson D,Møller是Schjoerring JK。细胞溶质谷氨酰胺合成酶:改善作物氮气使用效率的靶标?趋势植物SCI。2014; 19(10):656-63。
- 2。
Forde BG, Lea PJ。植物中的谷氨酸:代谢、调节和信号转导。J Exp Biol. 2007; 58:2339-58。
- 3.
伯纳德SM,Habash DZ。胞质谷氨酰胺合成酶在氮素同化和再循环中的重要性。新植物。2009; 182:608-20。
- 4.
张Q,阮J.茶:分析与品尝。在:Caballero B,Finglas Pm,Tellráf,编辑。食物和健康百科全书。牛津:学术;2016. p。256-67。
- 5。
综合转录组和代谢分析揭示了游离氨基酸代谢的新思路华吉纳茶品种。植物学报。2017;8:291。
- 6。
植物氮素同化及其调控:一个复杂的缺失片段之谜。植物学报。2015;25:115-22。
- 7。
拟南芥GS1催化谷氨酰胺合成的动力学研究14N /15n和溶剂同位素效应。植物理性生物生物。2016; 108:203-11。
- 8。
Kusano M, Tabuchi M, Fukushima A, Funayama K, Diaz C, Kobayashi M, Hayashi N, Tsuchiya YN, Takahashi H, Kamata A, Yamaya T, Saito K.代谢组学数据揭示了细胞内谷氨酰胺合成酶1;1在协调水稻代谢平衡中的关键作用。植物j . 2011; 66:456 - 66。
- 9。
李别松,王志强,王志强。脂类化合物的化学结构、生物合成和工业应用。中村,李-贝森,编辑。植物和藻类发育中的脂类。瑞士:施普林格国际出版公司;2016. p。1–20.
- 10.
Gaude N, Brehelin C, Tischendorf G, Kessler F, Dormann P.缺氮影响拟南芥半乳糖脂的组成和基因表达,导致脂肪酸phytyl酯的积累。植物j . 2007; 49:729-39。
- 11.
Liu MY, Burgos A, Ma L, Zhang Q, Tang D, ruj .脂质组学分析揭示氮肥对茶树脂质代谢的影响(茶树l .)。BMC Plant Biol. 2017;17:165。
- 12.
何CT,郑X,李姆。茶香气形成。食物SCI人类健康。2015; 4:9-27。
- 13。
陈玲,周志新,杨宇军。茶树遗传改良与育种(茶树)在中国:从个体选择到杂交和分子育种。Euphytica。2007; 154(1-2):239-48。
- 14。
阮建勇,王志强,王志强,等。根区pH、氮素形态和浓度对绿茶品质相关组分积累的影响。中国农业科学。2007;87:1505-16。
- 15.
Liu MY, Burgos A, Zhang Q, Tang D, Shi Y, Ma L, Yi X, ruj . analysis of transcriptome profiles and selected metabolites揭示NH的代谢反应4+也没有3.−作为茶厂的信号分子(茶树l .)。Sci Hortic。2017;218:293 - 303。
- 16。
茶树氮素利用基因的转录组和代谢产物分析茶树).Sci众议员2017;7:1693。
- 17。
杨Y,王F,WAN Q,RNA J.使用RNA-SEQ的转录组分析显示氮形式在茶中主要次生代谢物生物合成的影响(茶树) 植物。Acta physiol植物。2018; 40:127。
- 18。
黄鹤,姚琦,夏娥,高LZ。代谢组织和转录组学分析揭示了氮素对茶叶幼苗(Camellia Sinensis L.)的黄酮类化合物和氨基酸积累的影响。JAgric Food Chem。2018; 66:9828-38。
- 19。
徐光华,范晓瑞,米勒AJ。植物氮素同化与利用效率。植物学报2012;63:153-82。
- 20.
Patterson K, Cakmak T, Cooper A, Lager I, Rasmusson AG, Escobar MA。不同的信号通路和转录组响应标记区分铵和硝酸盐供应的植物。植物学报。2010;33(9):1486-501。
- 21.
phosphinothricin抑制谷氨酰胺合成酶导致根瘤转录组重编程Medicago truncatula.微生物与植物的互动。2012;25:976-92。
- 22.
Gutiérrezra,Stokes Tl,Thum K,Xu X,obertello M,Katari Ms,Tanurdzic M,Dean A,Nero DC,McClung Cr,Coruzzi Gm。系统方法识别由主时钟控制基因调节的有机氮响应基因网络CCA1.Proc Natl Acad Sci U S A. 2008; 105(12):4939-44。
- 23.
张振华,王文敏,管春玉,刘强,荣晓明,韩亚林,彭建伟,廖强,于宇,宋海霞。氮素再分配对酶活性的响应机制及对氮素利用效率的影响芸苔属植物显著在生长后期。植物学报。2014;46(5):1789-95。
- 24.
Coruzzi G,最后R,Dudareva N,Amrhein N.氨基酸。在:Buchanan BB, Gruissem W, Jones RL,编辑。植物生物化学和分子生物学。Wiley:美国植物生物学家协会;2015. p。289-336。
- 25.
邓文伟,王志强,王志强,等。茶氨酸(γ-乙基氨基- l -谷氨酸)在水稻幼苗中的生物合成茶树.Phytochem。2008;1(2):115 - 9。
- 26.
Mu WM,Zhang T,Jiang B. L-Theanine的生物生产概述。Biotechnol adv。2015; 33:335-42。
- 27.
Oh K, Kato T, Xu HL。氮同化在茶树木质部导管中的运输4+- n,没有3.−-N。踏板。2008; 18(2):222-6。
- 28.
碳和氨基酸相互调节拟南芥中谷氨酰胺合成酶的表达。植物杂志。1999;121:301-9。
- 29.
Shimojima M,Ohta H,Nakamura Y.生物合成和叶绿体脂质的功能。在:Wada H,Murata N,编辑。光合作用中的脂质:必要和监管功能。荷兰:Springer;2009.33-55。
- 30.
关键词:氮供应,碳氮分配,氨基酸,儿茶素引用本文:茶树(l)o . Kuntze]植物。植物医学杂志。2010;12(5):724 - 34。
- 31.
石垣。铵态氮与硝态氮对茶树生长的影响。JARQ。1974; 8:101-5。
- 32.
陈志强,陈志强,陈志强,等。15n -硝态氮的吸收、转运和同化15茶叶中的n -铵(茶树L.)植物。土壤SCI植物NUTR。1998; 44(4):647-54。
- 33.
杨云云,李晓华,Ratcliffe RG,阮建勇。茶树根系对铵态氮和硝态氮的吸收和同化特征。acta botanica yunnanica(云南植物研究). 2013;60(1):91-9。
- 34.
阮玲,魏凯,王琳琳,陈辉,张飞,吴玲,白PX,张传聪. NH的特征4+也没有3.−茶中的助熔剂(茶树)根的扫描离子选择电极技术。Sci众议员2016;6:38370。
- 35.
Liu ZW, Wu ZJ, Li H, Wang YX, Zhuang J. l -茶氨酸含量及其相关基因表达:不同茶树间茶氨酸生物合成和水解的新认识(茶树组织和品种。植物学报,2017;
- 36.
Terce´-Laforgue T, Bedu M, Dargel-Grafin C, Dubois F, Gibon Y, Restivo FM, Hirel B.解析植物谷氨酸脱氢酶的作用:II。植物单独或同时过表达这两个酶亚基的生理特性。植物生理学报。2013;54(10):1635-47。
- 37。
Britto dt,克朗萨克勒HJ。NH.4+高等植物的毒性:一篇评论。植物生理学报。2002;29(4):537 - 541。
- 38。
刘颖,Wirén NV.铵态氮对植物生理和形态的响应。J Exp Bot. 2017;68(10): 2581-92。
- 39。
Kito M,Kokura H,Izaki J,Sasaoka K. Theanine,茶植物中儿茶素甘油蛋白核的前兆。植物化学。1968; 75(4):4。
- 40.
Singh S, Lewis NG, Towers GHN。甘薯块茎中苯丙素代谢过程中氮的循环利用acta botanica sinica(植物学报),1998;
- 41.
Ohlrogge J, Browse J, Jaworski J, Chris S. Lipids。在:Buchanan BB, Gruissem W, Jones RL,编辑。植物生物化学和分子生物学。Wiley:美国植物生物学家协会;2015. p。33.7–400.
- 42.
Narasimhan R,Wang G,Li M,Roth M,Welti R,Wang X.在氮气缺乏和旋转术后大豆叶片和根部磷脂种类的差异变化。植物化学。2013; 96:81-91。
- 43.
利用数量遗传学分析碳氮代谢和碳氮互作。Photosynth杂志2005;83:251 - 63。
- 44.
甲硫胺对谷氨酰胺合成酶抑制作用的研究。物化学,1969;8(3):1066 - 75。
- 45.
谷氨酰胺合成酶抑制剂l -蛋氨酸- dl -硫亚胺对单细胞藻藻中铵态氮和硝酸盐代谢的影响杂志。1982;54:47-51。
- 46.
氮形态和pH控制对不同植物铵态氮同化的影响。肥料研究》1989;21:1-6。
- 47.
利用蛋白质结合原理的一种快速、灵敏的微量蛋白质定量方法。学生物化学肛门。1976;72:248-54。
- 48.
Husted S, Mattsson M, Mollers C, Wallbraun M, Schjoerring j。Photorespiratory NH4+野生型和反义油菜叶片谷氨酰胺合成酶2的生产。植物杂志。2002;130:989 - 98。
- 49.
Grabherr Mg,Haas Bj,Yassour M,Levin JZ,Thompson Da,Amit I,Adiconis X,Fan L,Raychowdhury R,Zeng Q,Chen Z,Mauceli E,Hacohen N,Gnirke A,Rhind N,Di Palma FW,BirrenB,Nusbaum C,Lindblad-ToH K,Friedman N,Regev A. Trinity:在RNA-SEQ数据中重建无基因组的全长转录组。NAT BIOTECHNOL。2011; 29(7):644-52。
- 50.
Altschul SF, Gish W, Miller W, Myers EW, Lipman DJ。基本的局部对齐搜索工具。中华医学会昆虫学分会。
- 51.
王魏CL,杨H,某人,赵J,刘C,高LP,夏嗯,陆Y,大YL、她GB,太阳J,曹HS,通W,高Q,李YY,邓WW,江泽民XL,王WZ,陈问张SH,李HJ,吴莱托,王P,李PH值,CY,郑财政年度,剑JB,黄B,山D,毫米,方CB,曰Y,李FD,李DX,魏年代,汉族B,江泽民CJ,阴Y,夏T,张ZZ, Bennetzen杰,赵SC,Wan XC。拟制的基因组序列茶树var。中国提供进入茶基因组和茶品质的演变的见解。Proc Natl Acad Sci U S A. 2018; 115(18):4151-8。
- 52.
夏海华,李福德,童伟,李鹏飞,吴强,赵宏杰,葛瑞华,李丽萍,李媛媛,张泽忠,魏春林,万晓春。茶树信息档案:一个全面的茶树基因组学和生物信息学平台。生物技术学报。2019。https://doi.org/10.1111/pbi.13111.
- 53.
RSEM:有或没有参考基因组的RNA-Seq数据的准确转录本定量。BMC Bioinf。2011;12(1):323。
- 54.
Young MD, Wakefield MJ, Smyth GK, Oshlack A. RNA-seq的基因本体论分析:考虑选择偏差。基因组医学杂志。2010;11:R14。
- 55.
Giavalisco P,Li Y,Matthes A,Eckhardt A,Hubberten HM,Hesse H,Segu S,Hummel J,Kohl K,Willmitzer L.元素配方用脂质和亲苯代代谢物使用13C,15N和34.S同位素标记,结合高分辨率质谱分析。植物j . 2011; 68:364 - 76。
- 56.
张强,刘敏,阮军。代谢组学分析揭示了黄酮类化合物在光敏茶叶中的代谢和功能作用。BMC Plant Biol. 2017;17:64。
- 57.
Weatherburn兆瓦。苯酚-次氯酸盐反应测定氨。肛门化学1967;39(8):971 - 4。
致谢
谢谢,扩展到Lothar Willmitzer博士的支持。他支持测量代谢物和脂质。我们还要感谢ÄnneMichaelis在Max Planck分子植物生理学研究所测量代谢物中的技术援助。此外,在统计分析中,致谢于在香港科技大学的转录组数据和潍川宇教授的帮助下,致谢于华中农业大学的玉渊丁。
资金
中国天然科学基金(第31700614号),中国农业科学院通过农业科学创新项目(CAAS-ASTIP-2017-Tricaas);中国浙江省自然科学基金(LQ15C150004)和中国农业部通过专门的中国农业研究系统基金(汽车19)。资助机构在研究和收集,分析和解释的设计中没有发挥作用,并在编写手稿中,但只是提供财政支持。
作者信息
从属关系
贡献
MYL进行了大部分的研究,分析了数据并撰写了手稿;DT测定游离铵含量和GS活性;YS测定游离氨基酸含量;LM测定儿茶素含量;YL为MYL和QZ提供代谢物分析的技术帮助;QZ分析了初级代谢物谱,并对手稿进行了修改;JR构思了研究并最终定稿。所有作者阅读并批准了手稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
额外的文件1:
表S1。利用Illumina HiSeq对添加或不添加蛋氨酸(MSX)的茶树转录组数据进行了总结。
额外的文件2:
表S2。转录组数据和茶树ungenes的从头组装结果。
额外的文件3:
表S3。研究了甲硫氨酸亚砜亚胺(MSX)处理茶树根系中差异表达基因(DEGs)与未处理(对照)茶树根系中的差异表达基因(DEGs)。
额外的文件4:
表S4。甲硫氨酸亚磺酰胺(MSX)叶片中的差异表达基因(DEGS)处理和未处理(对照)植物。
额外的文件5:
表S5。MSX处理与未处理茶根差异表达基因的GO富集分析
额外的文件6:
表S6。MSX处理茶叶与未处理茶叶中差异表达基因的GO富集分析
额外的文件7:
表S7。MSX与CK组茶根差异表达基因的KEGG富集
额外的文件8:
表S8。MSX与CK组茶叶差异表达基因的KEGG富集
额外的文件9:
表S9。与未处理(对照)植物的根相比,在甲硫氨酸亚磺酰昔亚胺(MSX)处理的茶叶植物的根中,在甲硫氨酸磺酰胺(MSX)处理的茶叶中的浓缩浓缩分析。
额外的文件10:
表S10。本研究发现的155种主要代谢物。
额外的文件11:
表S11。本研究鉴定的125种脂类化合物列表以及蛋氨酸亚砜亚胺处理组(MSX)和对照组(CK)各脂类的变化倍数。
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
刘,我的。,Tang, D., Shi, Y.等等。短期抑制谷氨酰胺合成酶导致茶树根和叶中氨基酸和脂质代谢的重编程(茶树l .)。BMC植物BIOL.19,425(2019)。https://doi.org/10.1186/s12870-019-2027-0
收到了:
接受:
发表:
关键词
- 谷氨酰胺合成酶
- 蛋氨酸sulfoximine
- 质量相关的化合物
- 氨基酸
- 脂质
- 茶树