- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发布:gydF4y2Ba
一个gydF4y2BaLIL3 CHLP.gydF4y2Ba只积累香叶酰叶绿素的双突变体在水稻中表现出一种致死表型gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba19gydF4y2Ba文章编号:gydF4y2Ba456.gydF4y2Ba(gydF4y2Ba2019gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
植基残基是叶绿素(Chl)和生育酚的常见侧链。香叶酰香叶酰还原酶(GGR),由gydF4y2BaCHLPgydF4y2Ba基因,是植物生物合成的原因。提出了蛋白质LIL3的光收获,以拟南芥中GGR和蛋白氯化物氧化酶氧化酶的稳定性所必需的。gydF4y2Ba
结果gydF4y2Ba
在本研究中,我们分离到一个黄绿色叶片突变体,gydF4y2Ba6370sgydF4y2Ba,以大米(gydF4y2Ba栽培稻gydF4y2Ba).突变体累积大多数CHL,用不饱和的甲苯基硅酸酐侧链,并通过整个生长期显示黄绿叶表型。抑制了叶绿体的发育,以及每株植物和每穗尖的主要农艺性状,尤其是生产性穗的数量,显着降低gydF4y2Ba6370sgydF4y2Ba.突变体对光照和生育酚缺乏敏感,叶片和籽粒生育三烯醇含量无明显变化。基于图谱的克隆和互补实验表明,该基因上存在一个点突变gydF4y2BaOsLIL3gydF4y2Ba基因解释了突变表型gydF4y2Ba6370sgydF4y2Ba.gydF4y2BaOsLIL3gydF4y2Ba主要在绿色组织中表达,其编码蛋白以叶绿体为靶点。此外,gydF4y2Ba637年502 y ygydF4y2Ba(gydF4y2BaLIL3 CHLP.gydF4y2Ba)双突变体只积累香叶酰香叶酰Chl,在三叶期表现致死。gydF4y2Ba
结论gydF4y2Ba
我们确定了这一点gydF4y2BaOsLIL3gydF4y2Ba基因通过地图为基础的克隆方法。同时,我们证明Oslil3对OSGGR的功能极为重要,并且通过Geranylgeranyl链的叶绿素叶绿素的完全替代物可能是植物在水稻中的生存率致命。gydF4y2Ba
背景gydF4y2Ba
叶绿素(CHL)是光合色素的主要成分,它来自叶绿素(克隆)和植物二磷酸(Phytyl-PP)的酯化[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba].维生素E,包括生育酚和生育三烯醇,是一种有效的抗氧化剂,一般认为是由均质酸(HGA)和phytyl-PP或香叶酰香叶酰二磷酸(GGPP)缩合而成。生育酚含有一个植基链,而生育三烯醇含有香叶酰香叶酰链[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba].Chls和生育酚含有一种常见的植基残基。Chls的植基链来源于GGPP的还原,而生育酚的植基链来源于GGPP的还原或Chl的降解[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba].香叶酰香叶酰还原酶(GGR)既能还原香叶酰香叶酰Chl (ChlgydF4y2BaGGgydF4y2Ba)转化为phytyl Chl (ChlgydF4y2BaPHY.gydF4y2Ba)或将GGPP降低至phytyl-PP,以提供CHL,生育酚和植物醌生物合成的植物残基[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].很多gydF4y2BaCHLPgydF4y2Ba编码GGR的基因已在光合细菌中被鉴定[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba]和高等植物[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba].在蓝藻,gydF4y2Ba集胞藻属gydF4y2Basp. PCC 6803gydF4y2BaΔchlPgydF4y2Ba突变体只积累ChlgydF4y2BaGGgydF4y2Ba一个gydF4y2Ba和少量的α-生育三烯醇,并在缺乏葡萄糖的情况下显示致死表型[gydF4y2Ba16gydF4y2Ba].在水稻(gydF4y2Ba栽培稻gydF4y2Ba), 二gydF4y2BachlpgydF4y2Ba突变体,gydF4y2Balyl1gydF4y2Ba和gydF4y2Ba507sgydF4y2Ba,据报道。它们表现出类似的黄绿叶表型和CHL组合物,其中,除了phytyl chl(chlgydF4y2BaPHY.gydF4y2Ba),大多数Chl与未完全还原的侧链共轭,包括ChlgydF4y2BaGGgydF4y2Ba,二氢香叶酰香叶酰Chl (ChlgydF4y2BaDHGGgydF4y2Ba)和四氢香叶酰香叶酰Chl (ChlgydF4y2BaTHGGgydF4y2Ba) [gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba].gydF4y2Ba
光捕获复合物(LHC)蛋白构成光系统I (PSI)和光系统II (PS II)的主要外天线蛋白复合物。典型的LHC蛋白有三个跨膜螺旋,其中一个或两个代表LHC基元,因为它们包括潜在的chl结合位点[gydF4y2Ba17gydF4y2Ba].LHC样蛋白(LIL)包含一到四个跨膜结构域,并共享一个或两个LHC基序。与大型强子对撞机不同,LIL似乎并不参与光收集[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba].到目前为止,在陆生植物和绿藻以及蓝藻中已经鉴定出了许多LIL蛋白,包括单螺旋蛋白(OHPs),也称为强光诱导蛋白(HLIPs)、双螺旋应力增强蛋白(SEPs)、三螺旋早期光诱导蛋白(ELIPs)和四螺旋PsbS蛋白[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba].在拟南芥中,共鉴定了10个LIL蛋白。其中,SEP1、SEP2、LIL3:1和LIL3:2属于双螺旋LIL蛋白。SEP1和SEP2是应力诱导的[gydF4y2Ba23gydF4y2Ba].LIL3:1和LIL3:2调节Chl和生育酚生物合成[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba].gydF4y2Ba
LIL3蛋白首次从脱黄化大麦(gydF4y2BaHordeum Vulgare.gydF4y2Ba)幼苗[gydF4y2Ba29gydF4y2Ba].在拟南芥中,有两个gydF4y2BaLIL3gydF4y2Ba基因拷贝,gydF4y2BaLIL3:1gydF4y2Ba和gydF4y2BaLIL3:2gydF4y2Ba.两个都gydF4y2BaLIL3:1gydF4y2Ba和gydF4y2BaLIL3:2gydF4y2Ba转座子插入突变体累积了侧链不完全减少的侧链的少量CHL,并从野生型那些中表现出嵌合表型。然而gydF4y2BaLIL3:1 LIL3:2gydF4y2Ba双突变体叶片呈黄绿色,生长速度缓慢,积累了大部分ChlgydF4y2BaGGgydF4y2Ba的背影,gydF4y2BaDHGGgydF4y2Ba,排名gydF4y2BaTHGGgydF4y2Ba, α-生育酚缺乏。LIL3被认为通过稳定GGR参与了Chl和生育酚的植基链的形成[gydF4y2Ba18gydF4y2Ba].然而,没有gydF4y2Balil3gydF4y2Ba到目前为止,在单子叶植物中已经鉴定出突变体。gydF4y2Ba
在我们的研究中,我们分离到一个黄绿色叶片突变体gydF4y2Ba6370sgydF4y2Ba在水稻中,以不饱和侧链积累Chls。与野生型相比,野生型主要农艺性状显著降低,叶片和籽粒生育酚含量显著降低gydF4y2Ba6370sgydF4y2Ba.基于地图的克隆和互补实验表明突变表型gydF4y2Ba6370sgydF4y2Ba是点突变的结果吗gydF4y2BaOsLIL3gydF4y2Ba(gydF4y2Baloc_os02g03330.gydF4y2Ba基因。gydF4y2BaOsLIL3gydF4y2Ba主要在绿色组织中表达,其编码的蛋白质局部局限于叶绿体。此外,gydF4y2Ba637年502 y ygydF4y2Ba双突变体专门累积CHLgydF4y2BaGGgydF4y2Ba并在三叶阶段表现出致死性,表明由大壬基酰基链的CHL植物侧链完全替代植物在水稻中的生存可能是致命的。gydF4y2Ba
结果gydF4y2Ba
分离和表征gydF4y2Ba6370sgydF4y2Ba突变体gydF4y2Ba
在之前的研究中,我们分离了黄绿叶突变体gydF4y2Ba507sgydF4y2Ba从gydF4y2Ba粳稻gydF4y2Ba品种Nipponbare (NP)积累了侧链不饱和的Chls,是由位点突变导致G206S取代的氨基酸gydF4y2Baoschlp.gydF4y2Ba(gydF4y2BaLOC_Os02g51080gydF4y2Ba)基因gydF4y2Ba15gydF4y2Ba].在这里,我们获得了一个新的突变体gydF4y2Ba6370sgydF4y2Ba从gydF4y2Ba粳稻gydF4y2BaZH11通过EMS诱变,其中大多数CHL与不饱和侧链以及少量CHLgydF4y2BaPHY.gydF4y2Ba(约10%的CHLgydF4y2BaPHY.gydF4y2Ba在野生类型)(附加文件gydF4y2Ba1gydF4y2Ba:图S1)。的gydF4y2Ba6370sgydF4y2Ba突变体在整个生长过程中表现为黄绿色叶片,生长速度非常慢。叶鞘里的嫩叶依然是绿色的gydF4y2Ba6370sgydF4y2Ba,但在几天内迅速变黄(图。gydF4y2Ba1gydF4y2Ba).尽管与野生型ZH11相比延迟了19天,gydF4y2Ba6370sgydF4y2Ba主要农艺性状的戏剧性下降。例如,虽然野生型植物平均为7.2的生产性圆锥,gydF4y2Ba6370sgydF4y2Ba植物只有一到最多三个,减少了84.7%。其他农艺性状株高、穗长、没有。每穗颖花数、结实率和千粒重分别下降38.6、28.2、80.7、42.7和33.8%gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
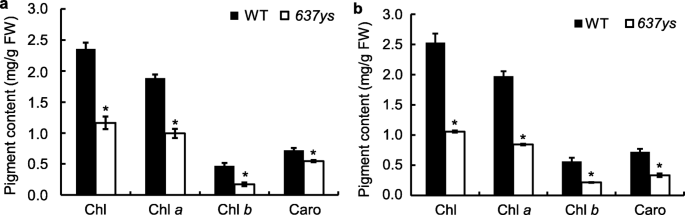
量化…的突变表型gydF4y2Ba6370sgydF4y2Ba,测定了叶片中光合色素的含量gydF4y2Ba6370sgydF4y2Ba幼苗和标题阶段的ZH11植物。总CHL,CHL的量gydF4y2Ba一个gydF4y2Ba的背影,gydF4y2BabgydF4y2Ba,卡罗进来了gydF4y2Ba6370sgydF4y2Ba与野生型相比,分别显著降低50.6 ~ 58.2%、47.4 ~ 57.3%、63.4 ~ 61.4%和24.0 ~ 53.4%(图2)。gydF4y2Ba2gydF4y2Ba).这些结果表明,黄绿叶表型是由于其光合色素的水平降低。gydF4y2Ba
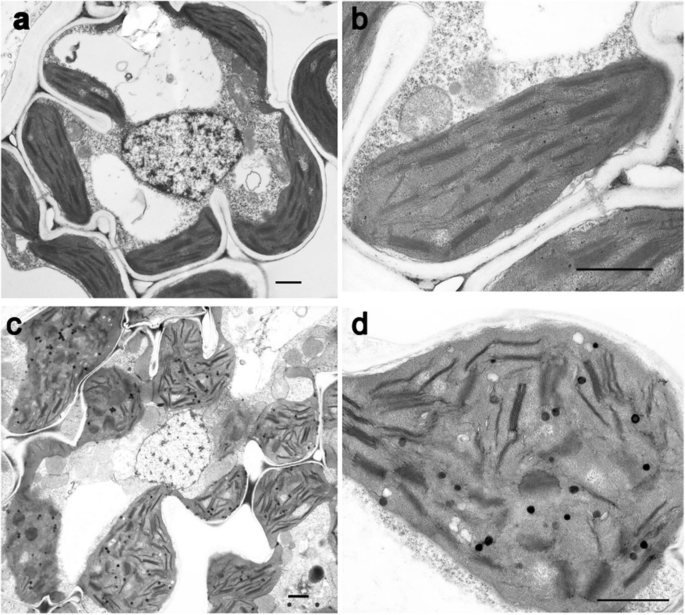
探讨光合色素含量的降低是否影响叶绿体的发育gydF4y2Ba6370sgydF4y2Ba在透射电镜下观察叶绿体的超微结构。野生型叶绿体中存在大量由基质片层连接的发育良好的基粒片层组成的基粒堆叠(图2)。gydF4y2Ba3.gydF4y2Baa,b)。然而,叶绿体肿胀gydF4y2Ba6370s。gydF4y2Ba即使有基粒堆叠存在,基粒片层间距也比野生型小,呈无序排列。间质密度降低,嗜锇小珠出现gydF4y2Ba6370sgydF4y2Ba(无花果。gydF4y2Ba3.gydF4y2Bac, d).这些结果揭示了叶绿体的发育受到抑制gydF4y2Ba6370sgydF4y2Ba突变体。gydF4y2Ba
的敏感性gydF4y2Ba6370sgydF4y2Ba突变体对温度和光强度gydF4y2Ba
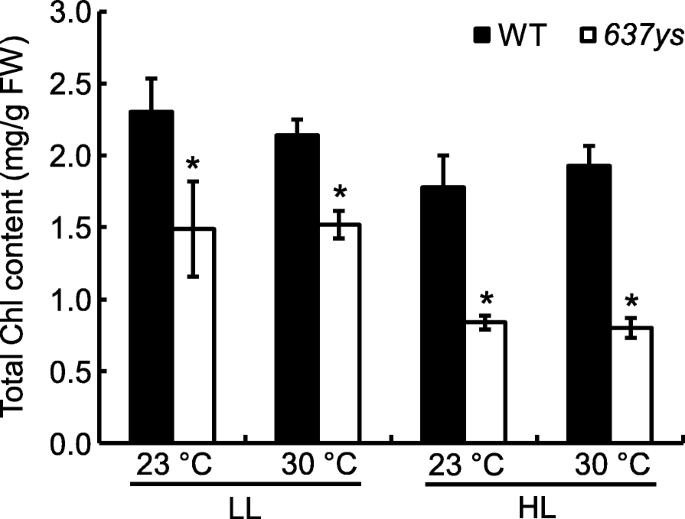
为了研究突变体的表型是否依赖于温度gydF4y2Ba6370sgydF4y2Ba在生长室中生长的野生型植物分别被两种不同的温度条件(恒定23°C和30°C)处理。因此,gydF4y2Ba6370sgydF4y2Ba在不同温度条件下生长的突变体表现出难以区分的叶色表型gydF4y2Ba2gydF4y2Ba图S2 a1, a2)。与野生型相比,Chl含量显著降低,但低温与高温无明显差异,与野生型相似(图2)。gydF4y2Ba4gydF4y2Ba;额外的文件gydF4y2Ba3.gydF4y2BaS1:表;额外的文件gydF4y2Ba4gydF4y2Ba:表S2)。这些数据表明gydF4y2Ba6370sgydF4y2Ba与温度无关。gydF4y2Ba
累积CHL的所有突变体具有不饱和侧链的敏感性对光强度的敏感性[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba].相应的,的表型gydF4y2Ba6370sgydF4y2Ba弱光突变体(80 μmol mgydF4y2Ba−2gydF4y2Ba s−1gydF4y2Ba)和强光(300 μmol m .gydF4y2Ba−2gydF4y2Ba s−1gydF4y2Ba)也受到调查。该突变体在强光条件下表现为黄绿色叶片表型gydF4y2Ba2gydF4y2Ba:图S2 a1-b2)。同时,与弱光条件下相比,Chl含量显著下降,而野生型Chl含量保持相对稳定(图2)。gydF4y2Ba4gydF4y2Ba;额外的文件gydF4y2Ba5gydF4y2Ba:表S3)。这些数据表明gydF4y2Ba6370sgydF4y2Ba取决于光的强度。gydF4y2Ba
叶片和谷物中维生素E含量分析gydF4y2Ba
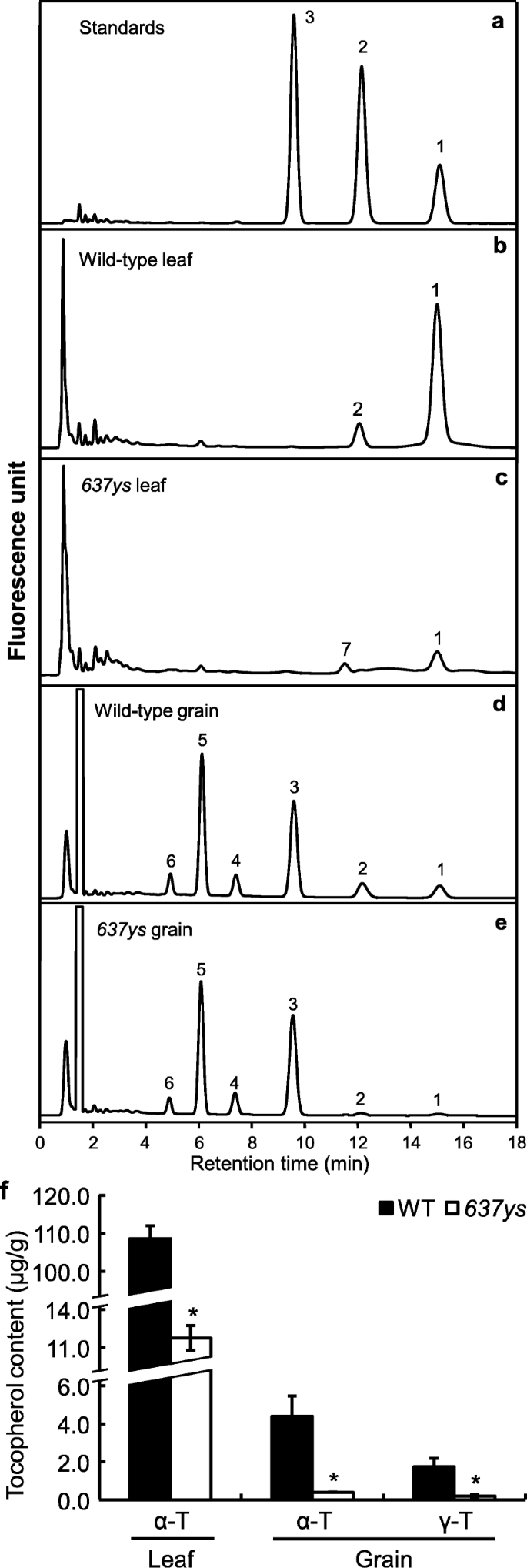
生育酚和生育三烯醇构成维生素egydF4y2BaPHY.gydF4y2Ba和生育酚,GGPP形成CHL的侧链gydF4y2BaGGgydF4y2Ba和tocotrienolsgydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba].由于CHL的积累,不饱和侧链gydF4y2Ba6370sgydF4y2Ba突变体,研究维生素E的组成是否受到影响,我们分析了叶片和谷物中的生育酚和Tocotrienol组合物gydF4y2Ba6370sgydF4y2Ba和野生型ZH11。在叶片中,维生素E的HPLC图谱显示野生型的α-生育酚含量较高,而野生型的α-生育酚的洗脱峰较高gydF4y2Ba6370sgydF4y2Ba明显低于野生型,且显著降低89.2%(图1)。gydF4y2Ba5gydF4y2BaB,C;无花果。gydF4y2Ba5gydF4y2Baf).同时,在野生型叶片中检测到少量γ-生育酚(图中峰2)。gydF4y2Ba5gydF4y2BaB),但不是在gydF4y2Ba6370sgydF4y2Ba突变体。值得注意的是,有一个小峰(图中峰7)。gydF4y2Ba5gydF4y2BaC),其保留时间比野生型γ-生育酚峰少0.5 min,检测到gydF4y2Ba6370sgydF4y2Ba突变体。我们推测gydF4y2Ba6370sgydF4y2Ba可能是γ-生育酚的异构体[gydF4y2Ba4gydF4y2Ba].此外,叶片中的TOCOTRINOL在野生类型中几乎不可检测到gydF4y2Ba6370sgydF4y2Ba突变体(图。gydF4y2Ba5gydF4y2Bab, c).在谷物中,HPLC分析表明gydF4y2Ba6370sgydF4y2Ba突变体的α-生育酚和γ-生育酚含量分别下降了90.9和89.7%(图中峰1和峰2)。gydF4y2Ba5gydF4y2Bad,e;无花果。gydF4y2Ba5gydF4y2Baf),但与ZH11相当的生育三烯醇水平(图5d, e中的4、5和6峰;图5 f;额外的文件gydF4y2Ba6gydF4y2Ba:图S3) [gydF4y2Ba4gydF4y2Ba,gydF4y2Ba14gydF4y2Ba].这些结果表明,生育酚缺乏,但不影响生育三烯醇的积累gydF4y2Ba6370sgydF4y2Ba.gydF4y2Ba
大豆叶片和谷物中维生素E含量的分析gydF4y2Ba6370sgydF4y2Ba.洗脱曲面的生育酚标准(gydF4y2Ba一个gydF4y2Ba),野生型Z11叶片的生育酚(gydF4y2BabgydF4y2Ba),gydF4y2Ba6370sgydF4y2Ba(gydF4y2BacgydF4y2Ba)、生育酚和生育三烯醇在ZH11 (gydF4y2BadgydF4y2Ba),gydF4y2Ba6370sgydF4y2Ba(gydF4y2BaegydF4y2Ba通过荧光在290nm和330nm处发射的荧光检测到。Z11和Z11的叶片和谷物中的生育酚含量gydF4y2Ba6370sgydF4y2Ba(gydF4y2BafgydF4y2Ba),采用生育酚标准进行定量。α- t,α生育酚;γ- t,γ生育酚。将相同体积的α-生育酚、γ-生育酚和δ-生育酚在相同浓度下进行池积制备生育酚标准品。峰1和峰2代表α-生育酚和γ-生育酚;峰3为δ-生育酚,在水稻中不存在,作为对照。峰4,5和6分别代表α-生育三烯醇、γ-生育三烯醇和δ-生育三烯醇。峰7可能是γ-生育酚的同分异构体。误差棒代表三个独立的生物重复的标准误差。星号表示统计上的显著差异(与学生的gydF4y2BatgydF4y2Ba试验)与野生型比较gydF4y2BaPgydF4y2Ba< 0.01gydF4y2Ba
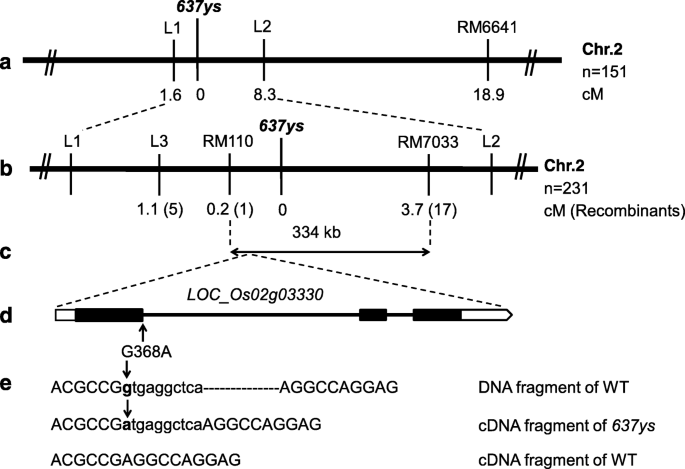
基于映射的克隆gydF4y2Ba6370sgydF4y2Ba突变基因gydF4y2Ba
我们走过gydF4y2Ba6370sgydF4y2Ba与gydF4y2Ba507sgydF4y2Ba(gydF4y2BachlpgydF4y2Ba)突变体,得到FgydF4y2Ba1gydF4y2Ba植株均表现正常的绿色表型,表明gydF4y2Ba6370sgydF4y2Ba和gydF4y2Ba507sgydF4y2Ba突变基因不是等位基因。为了转基地分析gydF4y2Ba6370sgydF4y2Ba突变,我们穿过gydF4y2Ba6370sgydF4y2Ba以野生型ZH11和普通绿色为主gydF4y2Ba籼稻gydF4y2Ba品种G46B。所有结果为fgydF4y2Ba1gydF4y2Ba植株呈现正常的绿色表型。叶色表型gydF4y2Ba2gydF4y2Ba以3:1的比例分离的种群gydF4y2Ba2gydF4y2Ba < χ2gydF4y2Ba0.05gydF4y2Ba= 3.84,gydF4y2BaPgydF4y2Ba> 0.05),表明黄绿色叶片表型是由单个隐性基因决定的gydF4y2Ba6370sgydF4y2Ba.gydF4y2Ba
接下来,fgydF4y2Ba2gydF4y2Ba来自交叉之间的人口gydF4y2Ba6370sgydF4y2BaG46B是为了映射而构造的。初步作图结果表明gydF4y2Ba6370sgydF4y2Ba将该位点与第2染色体短臂上的SSR标记RM6641连接,然后使用2个SSR标记和3个InDel标记(附加文件)gydF4y2Ba7gydF4y2Ba:表S4)定位gydF4y2Ba6370sgydF4y2Ba在RM110和RM7033 SSR标记之间334kb的区域内,SSR标记的长度分别为0.2和3.7 cM。gydF4y2Ba6gydF4y2Baa, b).在该区域内,我们进一步开发了8个InDel和SSR标记,但它们之间没有多态性gydF4y2Ba6370sgydF4y2Ba和G46B。gydF4y2Ba
基于映射的克隆gydF4y2Ba6370sgydF4y2Ba轨迹。gydF4y2Ba一个gydF4y2Ba的gydF4y2Ba6370sgydF4y2Ba位点定位于2号染色体短臂(chr2)上InDel标记L1和L2之间的区域。gydF4y2BabgydF4y2Ba的gydF4y2Ba6370sgydF4y2Ba利用231 F对SSR标记RM110和RM7033进行分析,将该位点缩小到RM110和RM7033之间gydF4y2Ba2gydF4y2Ba植物。gydF4y2BacgydF4y2Ba334 kb区域包含62个推测基因。gydF4y2BadgydF4y2Ba候选人gydF4y2Baloc_os02g03330.gydF4y2Ba基因由三个外显子和两个内含子组成,G-to-A替换发生在第一个内含子的第一个核苷酸处gydF4y2Ba6370sgydF4y2Ba突变体,其编码区域的位置368。gydF4y2BaegydF4y2Ba插入10 bp的内含子序列gydF4y2BaOsLIL3gydF4y2Ba在gydF4y2Ba6370sgydF4y2Ba突变体。内含子和外显子的序列分别显示在较低和大写gydF4y2Ba
尽管根据水稻基因组注释计划(gydF4y2Bahttp://rice.plantbiology.msu.edu/annotation_pseudo_current.shtmlgydF4y2Ba),遗传距离gydF4y2Ba6370sgydF4y2Ba位点和RM110比位点和RM110之间短得多gydF4y2Ba6370sgydF4y2Ba和RM7033,这表明gydF4y2Ba6370sgydF4y2Ba位点应接近RM110(图。gydF4y2Ba6gydF4y2Bab,c)。因此,我们在基于注释和目标和氯的RM110开始在该区域中分析该区域的基因(gydF4y2Bahttp://www.cbs.dtu.dk/services/TargetP/;gydF4y2Bahttp://www.cbs.dtu.dk/services/ChloroP/gydF4y2Ba) [gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba].特别有趣的是,我们发现了一种基因,gydF4y2Baloc_os02g03330.gydF4y2Ba,它们分别编码具有57和58%的蛋白质的蛋白质,分别在拟南芥中的LIL3:1和LIL3:2的蛋白质(图。gydF4y2Ba6gydF4y2Bad)。gydF4y2BaLIL3:1 LIL3:2gydF4y2Ba拟南芥双突变体积累ChlgydF4y2BaGGgydF4y2Ba的背影,gydF4y2BaDHGGgydF4y2Ba,排名gydF4y2BaTHGGgydF4y2Ba,显示相似的表型gydF4y2Ba6370sgydF4y2Ba突变体(gydF4y2Ba18gydF4y2Ba].然后我们测序从中提取的DNAgydF4y2Ba6370sgydF4y2Ba结果显示,该基因的368位发生了G-to-A替换(图2)。gydF4y2Ba6gydF4y2Bad).此外,我们测定了gydF4y2Baloc_os02g03330.gydF4y2Ba在gydF4y2Ba6370sgydF4y2Ba突变和ZH11。序列比对显示,取代发生在DNA序列中第一个内含子的第一个核苷酸处gydF4y2Baloc_os02g03330.gydF4y2Ba,导致该基因cDNA序列插入10个bp-内含子序列gydF4y2Ba6370sgydF4y2Ba突变体(图。gydF4y2Ba6gydF4y2Bae)。从而读取框架偏移gydF4y2Baloc_os02g03330.gydF4y2Ba导致其编码的蛋白在gydF4y2Ba6370sgydF4y2Ba(附加文件gydF4y2Ba8gydF4y2Ba:图S4a)。因此,gydF4y2Baloc_os02g03330.gydF4y2Ba被认为是候选基因gydF4y2Ba6370sgydF4y2Ba突变,并指定为gydF4y2BaOsLIL3。gydF4y2Ba
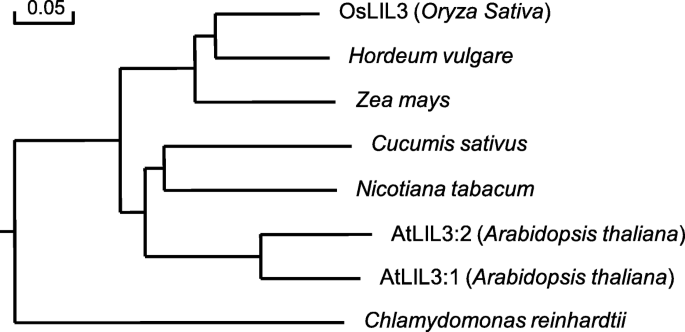
通过对水稻基因组数据库的搜索,我们发现gydF4y2BaOsLIL3gydF4y2Ba是一个单拷贝基因。DNA序列与cDNA序列比对显示gydF4y2BaOsLIL3gydF4y2Ba有三个外显子和两个内含子及其全长的基因组序列和cDNA分别为2384bp和753 bp。编码的蛋白质gydF4y2BaOsLIL3gydF4y2Ba包含250个氨基酸,其分子量为27.6kDa。Oslil3在N-末端含有44个氨基酸的预测叶绿体过渡肽(附加文件gydF4y2Ba8gydF4y2Ba:图S4)[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba].结构预测程序TMHMM和HMMTOP(gydF4y2Bahttp://www.cbs.dtu.dk/services/TMHMM/;gydF4y2Bahttp://www.enzim.hu/hmmtop/html/submit.html.gydF4y2Ba) [gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba表明有两个跨膜螺旋,其中OsLIL3蛋白的第一个螺旋包含了保守的LHC基序(Additional filegydF4y2Ba9gydF4y2Ba:图S5)。通过对OsLIL3及其同源物在不同物种中的多重比对,发现OsLIL3与其在单子叶植物大麦(gydF4y2BaHordeum Vulgare.gydF4y2Ba)和玉米(gydF4y2Ba玉米gydF4y2Ba)和双子叶植物黄瓜(gydF4y2BaCucumis巨大成功gydF4y2Ba)及烟草(gydF4y2Ba尼科尼亚塔哈瓦姆gydF4y2Ba),分别为72,72,70和63%。系统发育分析表明,奥斯兰3与来自大麦和玉米的同源物相关的奥斯兰菌素比其他物种的同源物(图。gydF4y2Ba7gydF4y2Ba).gydF4y2Ba
OsLIL3及其同源物的系统发育树。使用百分比标识的根树基于与程序DNAMAN生成的多序列比对。比例尺表示每个站点的替代百分比。各蛋白序列的GenBank登录号如下:gydF4y2Ba栽培稻gydF4y2Baoslil3(loc_os02g03330);gydF4y2BaHordeum Vulgare.gydF4y2Ba(BAJ88054.1);gydF4y2Ba玉米gydF4y2Ba(NP_001167647.1);gydF4y2BaCucumis巨大成功gydF4y2Ba(XP_004147237.1);gydF4y2Ba尼科尼亚塔哈瓦姆gydF4y2Ba(XP_016470950.1);gydF4y2Ba拟南芥蒂利亚纳gydF4y2BaATLIL3:1(NP_567532.1,AT4G17600)和ATLIL3:2(NP_199522.2,AT5G47110);gydF4y2Ba衣藻reinhardtiigydF4y2Ba(XP_001699421.1)gydF4y2Ba
互补gydF4y2Ba6370sgydF4y2Ba突变体gydF4y2Ba
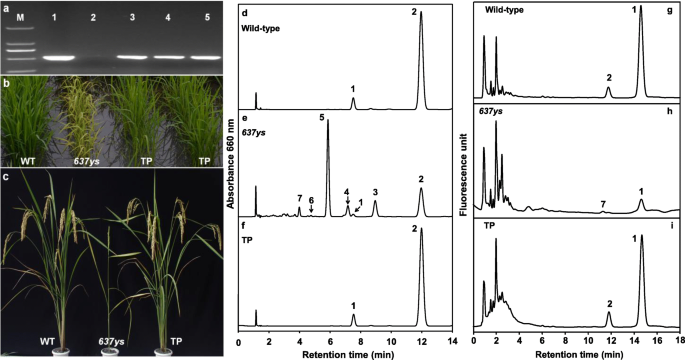
来证实突变gydF4y2BaOsLIL3gydF4y2Ba引起黄绿色叶片的表型gydF4y2Ba6370sgydF4y2Ba突变体,我们进行了互补试验。构建pC2300 -gydF4y2BaOsLIL3gydF4y2Ba携带gydF4y2BaOsLIL3gydF4y2Ba由大米gydF4y2Baactin1.gydF4y2Ba通过插入全长cDNA来产生启动子gydF4y2BaOsLIL3gydF4y2Ba到pCAMBIA2300向量。然后最终的结构被转换成gydF4y2Ba6370sgydF4y2Ba突变体介导的gydF4y2Ba农杆菌属gydF4y2Ba11个转基因株系经鉴定为转基因阳性植株,均恢复正常绿色(图2)。gydF4y2Ba8gydF4y2Baa - c)。此外,我们还测定了这些阳性谱线中的Chl组成。如图所示。gydF4y2Ba8gydF4y2BaD-F,阳性转基因系仅累积CHLgydF4y2BaPHY.gydF4y2Ba而不是与不饱和的天竺葵侧链缀合的CHL。同时,它们达到野生型叶片的生育酚水平(图。gydF4y2Ba8gydF4y2Bag-i)。这些数据表明了gydF4y2BaOsLIL3gydF4y2Ba基因救出了CHL的缺乏gydF4y2BaPHY.gydF4y2Ba与生育酚gydF4y2Ba6370sgydF4y2Ba,我们得出结论,突变表型gydF4y2Ba6370sgydF4y2Ba是由于单碱基对突变吗gydF4y2BaOsLIL3gydF4y2Ba基因。gydF4y2Ba
互补gydF4y2Ba6370sgydF4y2Ba突变与gydF4y2BaOsLIL3gydF4y2Ba基因。gydF4y2Ba一个gydF4y2Ba转基因植物的PCR鉴定。M, DL 2000标记;1, pC2300 -gydF4y2BaOsLIL3gydF4y2Ba质粒(积极的控制);2,gydF4y2Ba6370sgydF4y2Ba(阴性对照);3-5,阳性转基因植物。gydF4y2BabgydF4y2Ba和gydF4y2BacgydF4y2Ba野生型的表型,gydF4y2Ba6370sgydF4y2Ba和pcr阳性的转基因植株(TP),分别在苗期和灌浆期。gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba和gydF4y2BafgydF4y2BaWT叶片中Chl的洗脱谱,gydF4y2Ba637y.gydF4y2Ba并且分别在660nm处检测幼苗阶段的TP。峰值2,3,4和5代表CHLgydF4y2BaPHY.gydF4y2Ba一个gydF4y2Ba的背影,gydF4y2BaTHGGgydF4y2Ba一个gydF4y2Ba的背影,gydF4y2BaDHGGgydF4y2Ba一个gydF4y2Ba,排名gydF4y2BaGGgydF4y2Ba一个gydF4y2Ba,分别。峰1,6和7代表ChlgydF4y2BaPHY.gydF4y2BabgydF4y2Ba的背影,gydF4y2BaDHGGgydF4y2BabgydF4y2Ba,排名gydF4y2BaGGgydF4y2BabgydF4y2Ba,分别。丙酮中洗脱曲线的吸收光谱与附加文件中的吸收光谱相同gydF4y2Ba1gydF4y2Ba:图S1c和d。gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba和gydF4y2Ba我gydF4y2BaWT叶片中生育酚的洗脱图谱gydF4y2Ba6370sgydF4y2Ba在290 nm激发和330 nm发射的荧光条件下,分别测定了苗期磷含量。峰1和峰2分别代表α-生育酚和γ-生育酚,峰7可能是γ-生育酚的同分异构体gydF4y2Ba
oslil3蛋白的亚细胞定位gydF4y2Ba
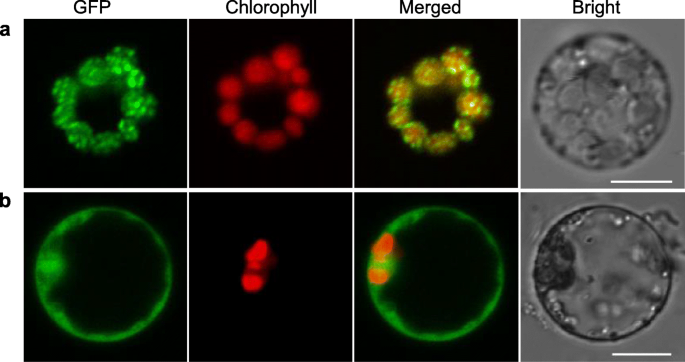
通过TargetP和ChloroP预测OsLIL3含有一个n端有44个氨基酸残基的叶绿体过境肽(附加文件gydF4y2Ba8gydF4y2Ba:图S4)[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba].为了证明这一预测,我们产生表达奥斯兰3-绿色荧光蛋白(GFP)融合蛋白的构建体,PCAMBIA2300-35 S-gydF4y2BaOsLIL3gydF4y2Ba-gydF4y2Ba绿色荧光蛋白gydF4y2Ba转化水稻原生质体的最终结构和pcambia2300 - 35s -gydF4y2Ba绿色荧光蛋白gydF4y2Ba(作为对照)分别在激光扫描共聚焦显微镜下观察转化的原生质体。根据目标预期和氯的预期,奥斯林3-GFP融合蛋白的绿色荧光与叶绿体中的CHL的红色自发荧光重叠,而GFP本身均在整个细胞上表达(图。gydF4y2Ba9gydF4y2Ba).这些数据提供了强有力的证据,证明OsLIL3是叶绿体靶向。gydF4y2Ba
表达模式的gydF4y2BaOsLIL3gydF4y2Ba基因gydF4y2Ba
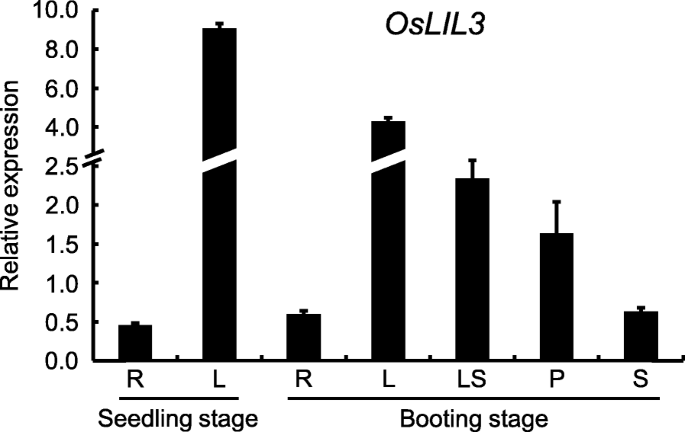
去调查gydF4y2BaOsLIL3gydF4y2Ba通过qRT-PCR分析其在不同组织中的转录水平,包括苗期的根和叶片,苗期和孕穗期的茎、叶片、叶鞘和幼穗。结果表明gydF4y2BaOsLIL3gydF4y2Ba在不同组织中有差异表达。其中,叶片的转录量最高,其次是叶鞘和幼嫩穗,而茎和根的转录量相对较低。gydF4y2Ba10gydF4y2Ba).结果表明gydF4y2BaOsLIL3gydF4y2Ba主要表达在绿色组织中。gydF4y2Ba
光合作用和Chl合成基因的苗期表达分析gydF4y2Ba
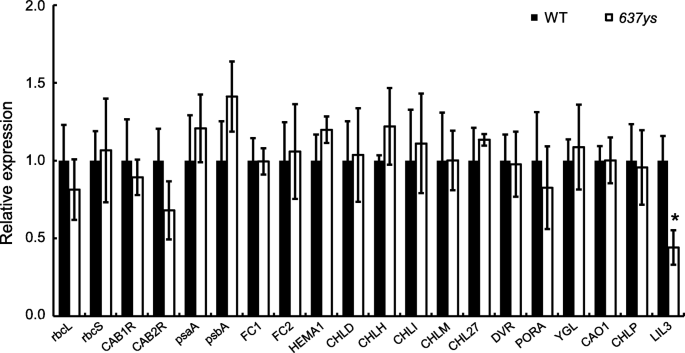
因为Chl的组成在gydF4y2Ba6370sgydF4y2Ba为了研究光合作用和Chl合成相关基因的表达是否受到影响,我们检测了19个相关基因的转录水平gydF4y2BaOsLIL3gydF4y2Ba在苗期gydF4y2Ba6370sgydF4y2Ba.在这些基因中,有6个基因与光合作用有关[gydF4y2Ba35gydF4y2Ba),包括gydF4y2Ba:gydF4y2Ba和gydF4y2Ba红细胞表面gydF4y2Ba(Rubisco大亚基和小亚基分别),gydF4y2BaCAB1RgydF4y2Ba和gydF4y2BaCAB2RgydF4y2Ba(排名gydF4y2Ba一个gydF4y2Ba/gydF4y2BabgydF4y2Ba-结合蛋白PS II),gydF4y2BaPSAAgydF4y2Ba和gydF4y2BaPSBA.gydF4y2Ba(两个反应中心多肽)。两个基因与血红素分支有关,包括gydF4y2BaFC1gydF4y2Ba和gydF4y2BaFC2gydF4y2Ba(螯合铁酶1和2)[gydF4y2Ba36gydF4y2Ba].11个基因编码参与Chl生物合成的酶,包括gydF4y2BaHEMA1gydF4y2Ba(谷氨酸 - TRNA还原酶),gydF4y2BachgydF4y2Ba,gydF4y2BaHgydF4y2Ba和gydF4y2Ba我gydF4y2Ba(d,h和mg chelatase的亚基),gydF4y2BaCHLMgydF4y2Ba(Mg-原激卟啉IX甲基转移酶),gydF4y2BaCHL27gydF4y2Ba(Mg-原卟啉IX单甲基酯环酶),gydF4y2BaDVR.gydF4y2Ba(二乙烯还原酶),gydF4y2BaPORAgydF4y2Ba(原叶绿素酸脂氧化还原酶),gydF4y2Baoschlp.gydF4y2Ba,gydF4y2BaYGLgydF4y2Ba(gydF4y2BaCHLGgydF4y2Ba,chl合成酶),和gydF4y2BaCAO1gydF4y2Ba(叶绿素a加氧酶)[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba].然而,除了gydF4y2BaOsLIL3gydF4y2Ba在gydF4y2Ba6370sgydF4y2Ba突变体,发现未检测到其他基因的转录水平的显着变化。有趣的是,表达了gydF4y2Baoschlp.gydF4y2Ba在gydF4y2Ba6370sgydF4y2Ba(无花果。gydF4y2Ba11gydF4y2Ba).结果表明,奥斯洛尔3的功能缺陷不影响上述光合作用和血红素合成基因的转录水平,这与来自的光合作用和血红素合成一致gydF4y2BaLIL3:1gydF4y2Ba和gydF4y2BaLIL3:2gydF4y2Ba单一突变体和gydF4y2BaLIL3:1 LIL3:2gydF4y2Ba双突变体(gydF4y2Ba20.gydF4y2Ba].gydF4y2Ba
表型和Chl组成gydF4y2Ba502ys 637ys.gydF4y2Ba双突变体gydF4y2Ba
两个都gydF4y2Ba6370sgydF4y2Ba和gydF4y2Ba507sgydF4y2Ba累积CHL,具有不饱和侧链并在生育酚中缺点[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba].进一步探讨两者之间的联系gydF4y2Baoschlp.gydF4y2Ba和gydF4y2BaOsLIL3gydF4y2Ba在水稻Chl phytyl生物合成中,我们产生了纯合子gydF4y2Ba637年502 y ygydF4y2Ba双重突变体gydF4y2Ba507sgydF4y2Ba突变与gydF4y2Ba6370sgydF4y2Ba突变体。在自然阳光条件下,所有FgydF4y2Ba1gydF4y2Ba植株呈现正常的绿色表型。然后,FgydF4y2Ba2gydF4y2Ba苗期植株表现出四种表型分化:正常绿色植株、相似黄绿色植株gydF4y2Ba507sgydF4y2Ba,黄色植物类似于gydF4y2Ba6370sgydF4y2Ba,最终确认为更严重的黄色和较小的植物gydF4y2Ba637年502 y ygydF4y2Ba通过对突变位点的测序实现双突变gydF4y2Baoschlp.gydF4y2Ba在gydF4y2Ba507sgydF4y2Ba和gydF4y2BaOsLIL3gydF4y2Ba在gydF4y2Ba6370sgydF4y2Ba(无花果。gydF4y2Ba12gydF4y2Ba).为了避免与其他比双突变体强的植物争夺光gydF4y2Ba2gydF4y2Ba人口中,只有gydF4y2Ba637年502 y ygydF4y2Ba双突变株保留在土壤中。不像gydF4y2Ba507sgydF4y2Ba或gydF4y2Ba6370sgydF4y2Ba(无花果。gydF4y2Ba13gydF4y2Bab,c),只有chlgydF4y2BaGGgydF4y2Ba一个gydF4y2Ba和排名gydF4y2BaGGgydF4y2BabgydF4y2Ba被完全积累,没有chlgydF4y2BaDHGGgydF4y2Ba的背影,gydF4y2BaTHGGgydF4y2Ba,或chl.gydF4y2BaPHY.gydF4y2Ba通过HPLC可检测到双突变体中的(图。gydF4y2Ba13gydF4y2Bad)。为了研究双突变体中的叶绿体显影,我们还观察到透射电子显微镜下叶绿体的超微结构。相比gydF4y2Ba6370sgydF4y2Ba和gydF4y2Ba507sgydF4y2Ba(无花果。gydF4y2Ba3.gydF4y2Ba) [gydF4y2Ba15gydF4y2Ba,很少有开发良好的grana栈存在于双突变(附加文件gydF4y2Ba10gydF4y2Ba:图S6)。不幸的是,双突变体全部在三叶阶段死亡(图。gydF4y2Ba12gydF4y2Ba).此外,我们还调查了gydF4y2Ba637年502 y ygydF4y2Ba双突变体在23°C恒定的弱光下生长,得到了类似的结果,只积累ChlgydF4y2BaGGgydF4y2Ba和三叶期的致死表型(附加文件gydF4y2Ba11gydF4y2Ba:图S7)。这些结果表明,完全没有CHLgydF4y2BaPHY.gydF4y2Ba或仅存在ChlgydF4y2BaGGgydF4y2Ba在双突变体中可能对水稻幼苗致命。gydF4y2Ba
野生型Chl组成分析gydF4y2Ba6370sgydF4y2Ba突变体,突变体gydF4y2Ba507sgydF4y2Ba突变体和gydF4y2Ba637年502 y ygydF4y2Ba双突变体(DM)。Chls在野生型Zh11和Nipponbare中的洗脱曲线(gydF4y2Ba一个gydF4y2Ba),gydF4y2Ba6370sgydF4y2Ba(gydF4y2BabgydF4y2Ba),gydF4y2Ba507sgydF4y2Ba(gydF4y2BacgydF4y2Ba)及DM (gydF4y2BadgydF4y2Ba)在660 nm处进行高效液相色谱检测。峰值2,3,4和5代表CHLgydF4y2BaPHY.gydF4y2Ba一个gydF4y2Ba的背影,gydF4y2BaTHGGgydF4y2Ba一个gydF4y2Ba的背影,gydF4y2BaDHGGgydF4y2Ba一个gydF4y2Ba,排名gydF4y2BaGGgydF4y2Ba一个gydF4y2Ba,分别。峰1,6和7代表ChlgydF4y2BaPHY.gydF4y2BabgydF4y2Ba的背影,gydF4y2BaDHGGgydF4y2BabgydF4y2Ba,排名gydF4y2BaGGgydF4y2BabgydF4y2Ba,分别。丙酮中洗脱曲线的吸收光谱与附加文件中的吸收光谱相同gydF4y2Ba1gydF4y2Ba:图S1C和D.gydF4y2Ba
讨论gydF4y2Ba
首先将LIL3蛋白质从去硫化大麦幼苗中从颜料结合络合物中分离出[gydF4y2Ba29gydF4y2Ba].拟南芥基因组中有两个gydF4y2BaLIL3gydF4y2Ba基因拷贝,gydF4y2BaLIL3:1gydF4y2Ba和gydF4y2BaLIL3:2gydF4y2Ba.两个都gydF4y2BaLIL3:1gydF4y2Ba和gydF4y2BaLIL3:2gydF4y2Ba转座子插入突变体积累了大部分的ChlgydF4y2BaPHY.gydF4y2Ba以及少量侧链未完全还原的Chls [gydF4y2Ba18gydF4y2Ba].但是,没有gydF4y2Balil3gydF4y2Ba在单子叶植物中发现了突变体。在我们的研究中,我们分离了一个黄绿色叶子突变体,gydF4y2Ba6370s,gydF4y2Ba在水稻中,积累少量CHLgydF4y2BaPHY.gydF4y2Ba和大多数具有不饱和侧链的CHL。基于地图的克隆和互补实验表明突变表型gydF4y2Ba6370sgydF4y2Ba是单一核苷酸替代的结果gydF4y2BaOsLIL3gydF4y2Ba(gydF4y2Baloc_os02g03330.gydF4y2Ba)基因,与gydF4y2BaLIL3gydF4y2Ba在拟南芥。gydF4y2BaOsLIL3gydF4y2Ba为单拷贝基因,主要表达于绿色组织中。它编码的蛋白质位于叶绿体中。因此,我们成功地识别了gydF4y2BaLIL3gydF4y2Ba通过基于地图的克隆方法在水稻中的基因。gydF4y2Ba
在拟南芥,gydF4y2BaLIL3:1gydF4y2Ba敲击和gydF4y2BaLIL3:2gydF4y2Ba零突变体从野生类型中显示出脱节的表型,但是gydF4y2BaLIL3:1 LIL3:2gydF4y2Ba双突变体叶片呈黄绿色,生长速度慢gydF4y2Balil3gydF4y2Ba单突变体和野生型植物。96%的CHL分子gydF4y2BaLIL3:1 LIL3:2gydF4y2Ba双突变体与未完全还原的侧链结合,而α-生育酚几乎检测不到。这些结果表明,LIL3:1和LIL3:2蛋白具有重叠功能,是Chl和生育酚植基残基完全生物合成所必需的[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba].在gydF4y2Ba6370sgydF4y2Ba突变体,单核苷酸替换发生gydF4y2BaOsLIL3gydF4y2Ba,导致cDNA序列插入10个bp,翻译提前终止。突变体的Oslil3蛋白含有133个氨基酸,没有跨膜螺旋。在去除叶绿体转运肽中的44个氨基酸后,预测剩余的早熟蛋白含有78个野生型和11个新氨基酸(附加文件)gydF4y2Ba8gydF4y2Ba:图S4a)。的gydF4y2Ba6370sgydF4y2Ba突变体表现为黄绿色叶片表型,生长速度极慢,叶绿体发育受阻。相应的,gydF4y2Ba6370sgydF4y2Ba突变体积累了约10%的ChlgydF4y2BaPHY.gydF4y2Ba在叶片和11.8和9.1%的叶片和颗粒中的11.8%和9.1%,相当于野生类型的叶片(附加文件gydF4y2Ba1gydF4y2Ba:图S1;无花果。gydF4y2Ba5gydF4y2Bac,e,f)。这些数据表明,突变醇溶溶蛋白的功能可能不会被完全废除,因此N-末端的剩余78个氨基酸仍然可以有助于GGR反应,或GGRgydF4y2Ba6370sgydF4y2Ba表现出低水平的活性,没有LIL3蛋白。综上所述,这些数据表明lhc样蛋白LIL3在Chl和生育酚的phytyl生物合成中起着关键作用。gydF4y2Ba
拟南芥中LIL3蛋白与GGR直接互作,是GGR稳定积累所必需的[gydF4y2Ba18gydF4y2Ba].Takahashi等人[gydF4y2Ba40gydF4y2Ba结合了LIL3的跨膜结构域到GGR,并在gydF4y2BaLIL3:1 LIL3:2gydF4y2Ba双突变体缺乏LIL3蛋白质。结果,转基因植物恢复了植物合成活性,并部分拯救了CHL的缺乏gydF4y2BaPHY.gydF4y2Ba,提示拟南芥LIL3通过LHC基序将GGR锚定在细胞膜上,从而参与了GGR反应。在水稻,gydF4y2BachlpgydF4y2Ba突变体gydF4y2Balyl1gydF4y2Ba有报道称,Chl在叶片中以不饱和侧链积累,生育酚缺陷,对光强敏感[gydF4y2Ba14gydF4y2Ba].直到最近,OsLIL3也被证实与OsGGR相互作用[gydF4y2Ba41gydF4y2Ba].在本研究中,gydF4y2Ba507sgydF4y2Ba对突变体进行了较为全面的研究,并与之进行了比较分析gydF4y2Ba6370sgydF4y2Ba.gydF4y2Ba6370sgydF4y2Ba表现出与gydF4y2Ba507sgydF4y2Ba,包括对温度和光强的敏感性(图。gydF4y2Ba4gydF4y2Ba;额外的文件gydF4y2Ba12gydF4y2Ba:图S8),叶片和籽粒中生育酚和生育三烯醇的组成(图S8)。gydF4y2Ba5gydF4y2Ba;额外的文件gydF4y2Ba13gydF4y2Ba图S9),以及18个参与光合作用和Chl合成的基因的表达变化(图S9)。gydF4y2Ba11gydF4y2Ba;额外的文件gydF4y2Ba14gydF4y2Ba:图S10)。此外,gydF4y2BaOsLIL3gydF4y2Ba和gydF4y2Baoschlp.gydF4y2Ba基因表现出一致的表达模式(图。gydF4y2Ba10gydF4y2Ba;额外的文件gydF4y2Ba15gydF4y2Ba:图S11)。缺乏大量的chlgydF4y2BaPHY.gydF4y2Ba与生育酚gydF4y2Ba6370sgydF4y2Ba,这些数据表明,OsLIL3对OsGGR的功能极其重要。最近,Hey等人[gydF4y2Ba20.gydF4y2Ba]表明,拟南芥LIL3也可直接与原叶绿素内酯氧化还原酶(POR)相互作用,而LIL3缺失的拟南芥表现出大量的POR损失,表明LIL3对POR的稳定性还有其他作用。LIL3在Chl生物合成中的多功能性揭示了其在植物生长发育中的重要作用。gydF4y2Ba
Chl由两个基团组成,一个氯环和一个酰基链。它的氯环吸收光能,而将Chls整合到叶绿体类囊体膜的疏水区域则需要phytyl链[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba42gydF4y2Ba].当然,背影gydF4y2BaGGgydF4y2Ba在去黄光剂期间在高等植物的牙石坯中瞬间能够检测到[gydF4y2Ba43gydF4y2Ba].表达反义的转基因烟草gydF4y2BachlPgydF4y2Ba-RNA显示CHL和生育酚水平降低,积累了大量的CHLgydF4y2BaGGgydF4y2Ba在叶子中,显示延迟增长率[gydF4y2Ba9gydF4y2Ba].水稻突变体M134和M249的Chl含量分别为3.4和1.4%gydF4y2BaPHY.gydF4y2Ba在45 μmol m的弱光下gydF4y2Ba−2gydF4y2Ba s−1gydF4y2Ba,幼苗在自然阳光下生长约2周后死亡。然而,突变体幼苗在弱光条件下至少可以存活2个月[gydF4y2Ba30.gydF4y2Ba].类似地,gydF4y2Balyl1-2gydF4y2Ba突变体优先积累ChlgydF4y2BaGGgydF4y2Ba,生长非常缓慢,在转移到自然阳光下后死亡[gydF4y2Ba14gydF4y2Ba].在本研究中gydF4y2Ba6370sgydF4y2Ba突变体积累的不饱和侧链Chls比突变体多gydF4y2Ba507sgydF4y2Ba突变体中,由于单氨基酸替换(Gly替换Ser), GGR应该仍然活跃,相应的,表现出更严重的表型(表gydF4y2Ba1gydF4y2Ba;无花果。gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba12gydF4y2Ba) [gydF4y2Ba15gydF4y2Ba].此外,gydF4y2Ba637年502 y ygydF4y2Ba双突变体(gydF4y2BaLIL3 CHLP.gydF4y2Ba)显示比单突变体更严重的严重表型,并排除CHL的独占积累gydF4y2BaGGgydF4y2Ba.因此,它不仅在自然阳光下死亡(无花果。gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba),但也在生长室内弱光条件下(附加文件gydF4y2Ba11gydF4y2Ba:图S7)。这些数据表明chlgydF4y2BaPHY.gydF4y2Ba对植物生长和开发至关重要,并且通过香菜烷基链的叶绿素浮球的完全替代含有植物在水稻中的存活率致命。gydF4y2Ba
结论gydF4y2Ba
在这项研究中,我们确定了gydF4y2BaOsLIL3gydF4y2Ba基因通过地图为基础的克隆方法。同时,我们证明Oslil3对OSGGR的功能极为重要,并且通过Geranylgeranyl链的叶绿素叶绿素的完全替代物可能是植物在水稻中的生存率致命。gydF4y2Ba
方法gydF4y2Ba
植物材料gydF4y2Ba
本研究使用的植物材料原产自我们实验室。黄绿色的突变体,gydF4y2Ba6370sgydF4y2Ba和gydF4y2Ba507sgydF4y2Ba,是从常用的gydF4y2Ba粳稻gydF4y2Ba通过甲磺酸乙酯(EMS)诱变,分别是中华11(Zh11)和NipphaRe(NP)品种。FgydF4y2Ba2gydF4y2Ba人口被交叉构建用于映射gydF4y2Ba6370sgydF4y2Ba与普通绿色gydF4y2Ba籼稻gydF4y2Ba品种Gang 46B (G46B)。的gydF4y2Ba637年502 y ygydF4y2Ba通过杂交获得双突变体gydF4y2Ba6370sgydF4y2Ba和gydF4y2Ba507sgydF4y2Ba并排序fgydF4y2Ba2gydF4y2Ba利用引物设置5 ' - aaagtgaagtcccaagcg -3 '和5 ' - CTAATCATGCTCCACCGA-3 ', 5 ' - ACATAATTCAGCACCACATG-3 '和5 ' - acacccagccgtagaagt -3 '检测突变位点gydF4y2BaOsLIL3gydF4y2Ba在gydF4y2Ba6370sgydF4y2Ba和gydF4y2Baoschlp.gydF4y2Ba在gydF4y2Ba507sgydF4y2Ba,分别。在中国成都市文江区四川农业大学实验领域的普通水稻生长季节种植稻米材料[gydF4y2Ba44gydF4y2Ba].对于温度处理,在恒定的23℃(低温)或30℃(高温)下,将幼苗种植在生长室中,12小时,在恒定的23℃(低温)或30℃(高温)中。对于光强度处理,幼苗在具有12小时的生长室中培养(80μmolmgydF4y2Ba−2gydF4y2Ba s−1gydF4y2Ba)/ 12小时或高光的12小时(300μmolmgydF4y2Ba−2gydF4y2Ba s−1gydF4y2Ba)/12小时恒温黑暗。gydF4y2Ba
颜料的分析gydF4y2Ba
用80%丙酮从0.2 g鲜叶中提取色素,4℃黑暗孵育48 h。利用紫外-1700紫外可见分光光度计(Shi-madzu)在663 nm、646 nm和470 nm处测定了Chl和类胡萝卜素(Caro)等光合色素的含量,并采用Lichtenthaler和Wellburn [gydF4y2Ba45gydF4y2Ba].gydF4y2Ba
用100%丙酮从新鲜水稻叶片组织中提取Chl,以7197 g (Eppendorf 5430R;7830转/分钟)。上清液经0.22 μm膜过滤,C18色谱柱(Eclipse XDB-C18, 4.6 mm i.d × 150 mm, 5 μm;安捷伦科技公司)。流动相为含甲醇、乙腈和丙酮的溶剂(1:3:1 v:v:v),流速为1.0 mL mingydF4y2Ba−1gydF4y2Ba摄氏40度[gydF4y2Ba46gydF4y2Ba].在660 nm处监测洗脱图谱。gydF4y2Ba
透射电镜分析gydF4y2Ba
野生型ZH11叶片完全展开gydF4y2Ba6370sgydF4y2Ba突变体是在自然种植季节的三叶期田间收获的幼苗。第二个叶子gydF4y2Ba637年502 y ygydF4y2Ba当第三叶开始从鞘中出现时,收获双突变体。叶片切片处理及叶绿体超微结构的观察跟随Wang等人描述的方法。[gydF4y2Ba38gydF4y2Ba].gydF4y2Ba
生育酚和Tocotrienols分析gydF4y2Ba
根据Zhang等人报道的方法,从0.1 g新鲜叶片组织中提取叶片中的生育酚[gydF4y2Ba47gydF4y2Ba略作修改。取新鲜叶片组织0.1 g,在液氮中研磨,再加入600 μL甲醇:氯仿(2:1 v:v),在黑暗中孵育1 h。加氯仿200 μL, H 360 μLgydF4y2Ba2gydF4y2BaO,旋混30 s, 3000rpm离心。收集有机层,在NgydF4y2Ba2gydF4y2Ba气体。干渣用300 μL乙醇溶解,0.22 μm膜过滤后进行高效液相色谱分析。gydF4y2Ba
根据Panfili等人报道的方法提取谷物中的生育酚和生育三烯醇[gydF4y2Ba48gydF4y2Ba略作修改。2 g糙米粉在50毫升皂化管与混合10毫升乙醇,5毫升的焦棓酸(60 g / L), 2毫升的氯化钠(10 g / L),在70°C水浴孵化了5分钟,然后加入1毫升的氢氧化钾(500 g / L)。将试管置于70°C水浴中,皂化时每5-10分钟混合一次。70℃碱性消化30 min后,冰浴冷却,加入预冷氯化钠10 mL (10 g/L)。然后用15 mL的正己烷/乙酸乙酯(4:1 v/v)萃取悬浮液三次以上。收集有机层,在NgydF4y2Ba2gydF4y2Ba干渣溶解于600 μL乙醇中,0.22 μm膜过滤后进行高效液相色谱分析。提取前在每个样品中加入大米中不存在的δ-生育酚标准品10 μg作为内标[gydF4y2Ba49gydF4y2Ba].gydF4y2Ba
采用高效液相色谱法从Agilent 1260中分离得到化合物。C18色谱柱(Eclipse XDB-C18, 4.6 mm i.d. × 150 mm, 5 μm;使用安捷伦)。流动相为甲醇/HgydF4y2Ba2gydF4y2BaO (95:1 V/V),流速1.5 mL/min,温度30°C [gydF4y2Ba4gydF4y2Ba,gydF4y2Ba14gydF4y2Ba].在290 nm的激发波长和330 nm的发射波长下对所有峰进行荧光检测。注射量为20 μL。采用α-、γ-和δ-生育酚标准(Sigma)进行定量分析。gydF4y2Ba
标记的发展gydF4y2Ba
SSR标记信息来源于Gramene数据库(gydF4y2Bahttp://archive.gramene.org/markers/microsat/gydF4y2Ba),根据McCouch等人构建的SSR连锁图谱[gydF4y2Ba50gydF4y2Ba].通过BLAST检索国家生物技术信息中心数据库(gydF4y2Bahttp://www.ncbi.nlm.nih.gov/blast/gydF4y2Ba),序列差异包括15 ~ 100 bp的插入/缺失(InDel)gydF4y2Ba粳稻gydF4y2Ba品种NP和gydF4y2Ba籼稻gydF4y2Ba以9311品种为材料,利用Primer 5.0软件设计标记进行精细定位。gydF4y2Ba
序列分析gydF4y2Ba
OsLIL3及其同源物的DNA和氨基酸序列从GenBank (gydF4y2Bahttp://www.ncbi.nlm.nih.gov.gydF4y2Ba)通过爆炸。叶绿体过渡肽的预测由靶标和氯(氯)进行(gydF4y2Bahttp://www.cbs.dtu.dk/services/TargetP/;gydF4y2Bahttp://www.cbs.dtu.dk/services/ChloroP/gydF4y2Ba) [gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba].采用DNAMAN 6.0版本(Lynnon Biosoft)进行多序列比对和系统发育分析。gydF4y2Ba
互补分析gydF4y2Ba6370sgydF4y2Ba突变体gydF4y2Ba
对于互补测定,全长cDNA序列(753 bp)gydF4y2BaOsLIL3gydF4y2Ba(gydF4y2Baloc_os02g03330.gydF4y2Ba),利用引物5 ' -GGGTCTAGAATGGCCATGGCGACCTCC-3 '和5 ' - ctctgcagctattttcttgggctgagag -3 ',从野生型ZH11的cDNA中扩增出gydF4y2BaXbagydF4y2BaI站点和agydF4y2Ba太平洋标准时间gydF4y2Ba我的网站,分别。经过酶处理后gydF4y2BaXbagydF4y2Ba我和gydF4y2Ba太平洋标准时间gydF4y2BaI,将扩增片段插入到二元载体pCAMBIA2300中,构建PC2300-gydF4y2BaOsLIL3gydF4y2Ba的推动下gydF4y2Ba肌动蛋白1gydF4y2Ba启动子。pC2300 -gydF4y2BaOsLIL3gydF4y2Ba质粒转化为gydF4y2Ba6370sgydF4y2Ba由gydF4y2Ba农杆菌肿瘤术gydF4y2Ba应变EHA105。利用引物5 ' -AAGTTCCGGGACTCGAGG-3 '和5 ' -GCGATCATAGGCGTCTCG-3 '确认转基因植株为阳性植株gydF4y2BaOsLIL3gydF4y2Ba基因和pCAMBIA2300载体。gydF4y2Ba
OsLIL3蛋白的亚细胞定位gydF4y2Ba
的全长cDNA序列gydF4y2BaOsLIL3gydF4y2Ba引物5’- ggggaattcatggccatggcgacctcc -3’和5’- cttctagagtatttgggctgagagag -3’扩增ZH11的cDNAgydF4y2BaBAMgydF4y2BaH I位点在5 '端和gydF4y2BaXbagydF4y2BaI位于3 '末端gydF4y2BaOsLIL3gydF4y2Ba基因分别。扩增后,将片段引入PC2300-35S-GFP载体中。生成的构造PC2300-35S-gydF4y2BaOsLIL3gydF4y2Ba-GFP随后转化为野生型原生质体,pC2300-35S-GFP作为对照,遵循前面描述的协议[gydF4y2Ba51gydF4y2Ba].转化后的原生质体悬浮液在黑暗中培养过夜,然后在激光扫描共聚焦显微镜(尼康A1)下观察。gydF4y2Ba
存在分析gydF4y2Ba
大米样本是从早上7点到8点采集的。采用RNA分离试剂盒(Vazyme)从水稻根、叶、叶鞘、幼穗和茎中提取总RNA。用反转录试剂盒(Vazyme)从总RNA (2 μg)中逆转录第一链cDNA。采用CFX96 real-time PCR系统(Bio-Rad)扩增,每引物0.1 μM,总体积10 μL, 1 × SYBR green PCR master mix (Vazyme)。反应条件为:95°C 3 min,然后95°C 10 s, 55°C 30 s循环40次。每个样品混合了3株以上的植物。对于每个样品,在三个生物学重复上分别进行三个技术重复。的gydF4y2Ba肌动蛋白1gydF4y2Ba基因被选择作为内部控制因子。2gydF4y2Ba——ΔΔCTgydF4y2Ba方法计算基因表达的相对变化。学生的gydF4y2BatgydF4y2Ba测试用于统计分析。所有QRT-PCR引物集都在附加文件中列出gydF4y2Ba16gydF4y2Ba:表S5。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
本研究过程中产生或分析的所有数据均包含在本发表的文章及其补充信息文件中。gydF4y2Ba
缩写gydF4y2Ba
- 排名:gydF4y2Ba
-
叶绿素gydF4y2Ba
- 的背影gydF4y2BaDHGGgydF4y2Ba:gydF4y2Ba
-
二氢烷基甲苯基叶绿素gydF4y2Ba
- 的背影gydF4y2BaGGgydF4y2Ba:gydF4y2Ba
-
香酰基甲苯基叶绿素gydF4y2Ba
- 的背影gydF4y2BaPHY.gydF4y2Ba:gydF4y2Ba
-
植基叶绿素gydF4y2Ba
- 的背影gydF4y2BaTHGGgydF4y2Ba:gydF4y2Ba
-
tetrahydrogeranylgeranyl叶绿素gydF4y2Ba
- GGPP:gydF4y2Ba
-
天竺葵二磷酸二磷酸酯gydF4y2Ba
- 应用GGR:gydF4y2Ba
-
Geranylgeranyl还原酶gydF4y2Ba
- 大型强子对撞机:gydF4y2Ba
-
聚光复杂gydF4y2Ba
- 李尔:gydF4y2Ba
-
聚光像蛋白质gydF4y2Ba
- Phytyl-PP:gydF4y2Ba
-
Phytyl焦磷酸盐gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
acta optica sinica, 2017, 37(3): 457 - 462。2月。2003;555(1):40-4。gydF4y2Ba
- 2.gydF4y2Ba
吴ZM,张X,何B,刁立,盛股,王JL等。叶绿素生物合成中叶绿素酯化受损的叶绿素缺乏水稻突变体。植物理性。2007; 145(1):29-40。gydF4y2Ba
- 3.gydF4y2Ba
加入eb,hall se,ripp kg,ganzke ts,hitz wd,coughlan sj。植物中维生素E生物合成的代谢重新设计及抗氧化含量增加。NAT BIOTECHNOL。2003; 21(9):1082-7。gydF4y2Ba
- 4.gydF4y2Ba
杨维,加入,猎人SC,张海,汉捷,博格文化,等。维生素E生物合成:单子叶同源异酸盐酸甲酰基转移酶的功能表征。工厂J1111; 65(2):206-17。gydF4y2Ba
- 5.gydF4y2Ba
黄志强,王志强,王志强,等。脂质生物合成的代谢区隔。中国生物化学杂志,1998;31:413 - 7。gydF4y2Ba
- 6.gydF4y2Ba
ischebeck t,Zbierzak Am,Kanwischer M,Dormann P.植物植物代谢的救赎途径gydF4y2Ba拟南芥gydF4y2Ba.生物化学学报。2006;281(5):2470-7。gydF4y2Ba
- 7.gydF4y2Ba
Valentin HE, Lincoln K, Moshiri F, Jensen PK, Qi QG, Venkatesh TV,等。的gydF4y2BaArabidopsis维生素E途径Gene5-1gydF4y2Ba突变体揭示了叶绿醇激酶在种子生育酚生物合成中的关键作用。植物细胞。2006;18(1):212 - 24。gydF4y2Ba
- 8.gydF4y2Ba
VOM DORP K,Holzl G,Plohmann C,Eisenhut M,Abraham M,Weber APM等。从叶绿素降解中植物的重新化对于生育酚合成和拟南芥生长至关重要。植物细胞。2015; 27(10):2846-59。gydF4y2Ba
- 9.gydF4y2Ba
Tanaka R, Oster U, Kruse E, Rüdiger W, Grimm B.在表达香叶酰香叶酰还原酶反义RNA的转基因烟草植株中,香叶酰香叶酰还原酶活性降低导致叶绿素和生育酚的损失,并导致部分香叶酰香叶酰化叶绿素。植物杂志。1999;120:695 - 704。gydF4y2Ba
- 10.gydF4y2Ba
王世杰,王世杰,王世杰,王世杰。细菌叶绿素a生物合成终末步骤的分子遗传分析gydF4y2BaRhodobacter capsulatusgydF4y2Ba菌株合成酸甲酰苯酯化的抗菌胆胰胆油的菌株gydF4y2Ba一个gydF4y2Ba.生物化学。1994;33:12763-8。gydF4y2Ba
- 11.gydF4y2Ba
Addlesee HA, Gibson LCD, Jensen PE, Hunter CN。叶绿素生物合成基因的克隆、测序及功能定位,gydF4y2BaCHZP.gydF4y2Ba的,gydF4y2Ba集胞藻属gydF4y2BaPCC6803 sp。2月。1996;389:126-30。gydF4y2Ba
- 12.gydF4y2Ba
Addlsee Ha,Hunter CN。甲苯基烷基 - 菌氯苯基还原酶基因的物理映射和功能分配,gydF4y2Ba摘要通过gydF4y2Ba的,gydF4y2Ba乳头杆菌sphaeroides.gydF4y2Ba.J细菌。1999年; 181:7248-55。gydF4y2Ba
- 13.gydF4y2Ba
咀嚼agm,frigaard nu,bryant da。鉴定gydF4y2Ba摘要通过gydF4y2Ba基因,编码天竺葵烷基还原酶gydF4y2Ba氯丘蒿荚膜gydF4y2Ba.J Bacteriol。2008;190(2):747 - 9。gydF4y2Ba
- 14.gydF4y2Ba
周勇,龚志勇,杨志峰,袁勇,朱建勇,王明,等。突变的gydF4y2Ba光诱导的黄叶1gydF4y2Ba该基因编码香叶酰香叶酰还原酶,影响水稻叶绿素生物合成和光敏感性。《公共科学图书馆•综合》。2013;8 (9):e75299。gydF4y2Ba
- 15.gydF4y2Ba
王培,李春明,王勇,黄锐,孙春成,徐志军,等。水稻叶绿素合成香叶酰香叶酰还原酶基因的鉴定。施普林格+。2014;3:20 1。gydF4y2Ba
- 16.gydF4y2Ba
Synechocystis sp. PCC 6803中香叶酰香叶酰还原酶(ChlP)基因的失活。生物物理学报。2005;1706:195-203。gydF4y2Ba
- 17.gydF4y2Ba
Klimmek F,SjödinA,Noutsos C,Leister D,Jansson S.丰富,很少表达gydF4y2BaLHC.gydF4y2Ba蛋白质基因在植物中表现出不同的调控模式。植物杂志。2006;140(3):793 - 804。gydF4y2Ba
- 18.gydF4y2Ba
田中平,罗思巴特,高桥,柴田,等。LIL3是一种类似于光收获的蛋白质,在叶绿素和生育酚的生物合成中起重要作用。中国科学院院刊2010;107(38):16721-5。gydF4y2Ba
- 19.gydF4y2Ba
Lohscheider JN,Rojas-Stutz MC,Rothbart M,Andersson U,Funck D,Mendgen K,等。改变了LIL3同种型的水平gydF4y2Ba拟南芥gydF4y2Ba导致色素-蛋白组装和叶绿素合成紊乱,褪绿表型和光合性能受损。植物学报。2015;38(10):2115-27。gydF4y2Ba
- 20。gydF4y2Ba
王鹏,李志强,王鹏,等。LIL3是一种光收集复合蛋白,连接萜类和四吡咯的生物合成gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba.植物杂志。2017;174(2):1037 - 50。gydF4y2Ba
- 21。gydF4y2Ba
单螺旋蛋白2 (OHP2)是OHP1和组装因子hc244的稳定性所必需的,并且在功能上与PSII生物发生有关。植物杂志。2018;177(4):1453 - 72。gydF4y2Ba
- 22。gydF4y2Ba
Myouga F,Takahashi K,Tanaka R,Nagata N,Kiss AZ,Funk C等人。光照稳定积累需要一螺旋蛋白1(OHP1)的光收获的家庭。植物理性。2018; 176(3):2277-91。gydF4y2Ba
- 23。gydF4y2Ba
Heddad M,Adamska I. Light Regress-Crougupted两螺旋蛋白gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba与叶绿素相关gydF4y2Ba一个gydF4y2Ba/gydF4y2BabgydF4y2Ba- 缠结基因家族。Proc Natl Acad SCI U S A. 2000; 97:3741-6。gydF4y2Ba
- 24。gydF4y2Ba
李Xp,björkmano,shih c,grossman ar,rosenquist m,jansson s等人。一种颜料结合蛋白,用于调节光合光收获。自然。2000; 403(6768):391-5。gydF4y2Ba
- 25。gydF4y2Ba
李雪平,罗森博格V,荣赫。PsbS是光合作用中的非光化学猝灭位点吗?中国生物医学工程学报。2005;56(411):375-82。gydF4y2Ba
- 26。gydF4y2Ba
Tzvetkova-Chevolleau T,Franck F,Alawady Ae,Dall'osto L,Carriere F,Bassi R等。光应激诱导的蛋白质ELIP2是叶绿素合成的调节剂gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba.植物J. 2007; 50(5):795-809。gydF4y2Ba
- 27。gydF4y2Ba
sobotka r,tichy m,wilde a,猎人cn。FromChelatase的羧基末端结构域的功能分配gydF4y2Ba集胞藻属gydF4y2BaPCC 6803: CAB结构域起调控作用,II区是催化作用的关键。植物杂志。2011;155(4):1735 - 47岁。gydF4y2Ba
- 28。gydF4y2Ba
赵立,程dm,huang xh,chen m,dall'osto l,xing jl等。在维护光合成分中的光学聚合物样蛋白质gydF4y2Ba衣藻gydF4y2Ba.植物杂志。2017;174(4):2419 - 33所示。gydF4y2Ba
- 29.gydF4y2Ba
Reisinger v,Plöscherm,Eichacker La。LIL3在DEETION期间将作为叶绿素结合蛋白质复合物组合。费用。2008; 582(10):1547-51。gydF4y2Ba
- 30.gydF4y2Ba
柴田,田志刚,田志刚,田志刚。水稻叶绿素醇侧链氢化过程中叶绿素形成和光合活性的变化。acta botanica sinica(云南植物学报),2004;33(3):593-600。gydF4y2Ba
- 31。gydF4y2Ba
Emanuelsson o,Nielsen H,von Heijne G.Chlorop,一种基于神经网络的方法,用于预测Chorloplast过境肽及其切割位点。蛋白质SCI。1999年; 8:978-84。gydF4y2Ba
- 32。gydF4y2Ba
Emanuelsson O, Brunak S, von Heijne G, Nielsen H.使用TargetP, SignalP和相关工具定位细胞中的蛋白。Nat Protoc。2007;2:953 - 71。gydF4y2Ba
- 33。gydF4y2Ba
Krogh A, Larsson B, von Heijne G, Sonnhammer ELL。用隐马尔可夫模型预测跨膜蛋白质拓扑结构:在全基因组中的应用。中华医学杂志。2001;305(3):567-80。gydF4y2Ba
- 34.gydF4y2Ba
Tusnády GE, Simon I. HMMTOP跨膜拓扑预测服务器。生物信息学。2001;17(9):849 - 50。gydF4y2Ba
- 35.gydF4y2Ba
苏宁,胡明莉,吴德兴,吴福强,费桂兰,兰宇,等。水稻五萜肽重复蛋白的破坏会导致苗期特有的白化表型,并将其用于提高杂交水稻生产中的种子纯度。植物杂志。2012;159(1):227 - 38。gydF4y2Ba
- 36.gydF4y2Ba
Inagaki n,Kinoshita K,Kagawa T,Tanaka A,Ueno O,Shimada H,等。Phytochrome B通过转录调节调解叶绿素生物合成的调节gydF4y2BaChlHgydF4y2Ba和gydF4y2BaGUN4gydF4y2Ba在水稻幼苗。《公共科学图书馆•综合》。2015;10 (8):e0135408。gydF4y2Ba
- 37.gydF4y2Ba
李S,金JH,刘ES, Lee CH, Hirochika H, An ggydF4y2Ba叶绿素A氧酶gydF4y2Ba基因在水稻。植物学报。2005;57(6):805-18。gydF4y2Ba
- 38.gydF4y2Ba
王普瑞,高建新,万春梅,张峰涛,徐志军,黄晓强,等。二乙烯基叶绿素(ide)gydF4y2Ba一个gydF4y2Ba可转化为单乙烯基叶绿素(ide)gydF4y2Ba一个gydF4y2Ba通过水稻中的二乙烯基还原酶。植物理性。2010; 153(3):994-1003。gydF4y2Ba
- 39.gydF4y2Ba
Sakuraba Y,Rahman Ml,Cho,Kim Ys,Koh HJ,Yoo Sc等。米饭gydF4y2Ba褪色的绿叶gydF4y2Ba基因座编码原叶绿素氧化还原酶B,在强光条件下是叶绿素合成所必需的。植物j . 2013; 74(1): 122 - 33所示。gydF4y2Ba
- 40。gydF4y2Ba
Takahashi K,Takabayashi A,Tanaka A,Tanaka R.对光收获蛋白3(LIL3)的功能分析及其光收获叶绿素结合基序gydF4y2Ba拟南芥gydF4y2Ba.中国生物医学工程学报。2014;29(2):987-99。gydF4y2Ba
- 41。gydF4y2Ba
周飞,王春英,古腾森,姜磊,张鹏,张东斌,等。香叶酰香叶酰二磷酸合酶的招募蛋白控制水稻叶绿素生物合成代谢通量。中国科学(d辑:地球科学)2017;gydF4y2Ba
- 42。gydF4y2Ba
王志强,王志强。植物中四吡啶类化合物的合成。植物学报2007;58:321-46。gydF4y2Ba
- 43。gydF4y2Ba
Liljenberg C.用Geranylgeraniol作为酯化醇的叶片叶片中叶片叶片的表征和性质。physiol植物。1974; 32:208-13。gydF4y2Ba
- 44。gydF4y2Ba
王勇,钟鹏,张学勇,刘建强,张春英,杨晓荣,等。gydF4y2BaGRA78gydF4y2Ba水稻幼苗期叶绿体发育与s -硫代半胱氨酸合酶的编码有关。植物科学。2019;280:321-9。gydF4y2Ba
- 45。gydF4y2Ba
Lichtenthaler HK,Wellburn Ar。总类胡萝卜素和叶绿素的测定gydF4y2Ba一个gydF4y2Ba和gydF4y2BabgydF4y2Ba叶提取物在不同溶剂中的含量。生物化学学报1983;603:591-2。gydF4y2Ba
- 46。gydF4y2Ba
Nakanishi H, Nozue H, Suzuki K, Kaneko Y, Taguchi G, Hayashida ngydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba突变体gydF4y2BaPCB2.gydF4y2Ba积累二乙烯基叶绿素。植物生理学报。2005;46(3):467-73。gydF4y2Ba
- 47。gydF4y2Ba
张伟,刘廷强,任国强,周永明,Cahoon EB,等。叶绿素降解:拟南芥种子中与生育酚生物合成相关的叶绿醇水解酶仍然缺失。植物杂志。2014;166(1):70 - 9。gydF4y2Ba
- 48。gydF4y2Ba
高效液相色谱法测定谷物中生育酚和生育三烯醇的含量。食品化学学报2003;51:3940-4。gydF4y2Ba
- 49。gydF4y2Ba
海涅曼RJB,徐Z,高伯JS。水稻(Oryza sativa L.)亚种中生育酚、生育三烯醇和γ-谷zanol的含量。谷物化学2008;85:243-7。gydF4y2Ba
- 50.gydF4y2Ba
徐玉波,王志强,王志强,等。2240个水稻SSR新标记的开发与定位(gydF4y2Ba栽培稻gydF4y2Bal .)。DNA研究》2002;9:199 - 207。gydF4y2Ba
- 51.gydF4y2Ba
张勇,苏军,段胜,敖勇,戴军,刘军,等。水稻绿色组织原生质体瞬时基因表达和光/叶绿体相关过程研究的高效系统。工厂方法。2011;7(1):30。gydF4y2Ba
致谢gydF4y2Ba
我们感谢Chengscai Chu教授,从中国科学院遗传和发育生物学研究所,请求PCAMBIA2300和PCAMBIA2300-35 S-gydF4y2Ba绿色荧光蛋白gydF4y2Ba向量。gydF4y2Ba
资金gydF4y2Ba
该工作得到了中国国家自然科学基金(91735303)的支持,以及中国的国家重点研发计划(2017YFD0100201)。融资组织在研究和收集,分析和解释方面没有在数据的设计中和写作稿件的作用。gydF4y2Ba
作者信息gydF4y2Ba
隶属关系gydF4y2Ba
贡献gydF4y2Ba
CL进行了大部分的研究。XL、NL和KZ进行光强敏感性测定。JP、JG、QW和CC进行叶绿素测定。在一些野外实验中,由和CS辅助。CL和PW分析了实验数据并起草了手稿。PW和XD设计实验,监督研究,修改手稿。所有作者阅读并批准了手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版物gydF4y2Ba
不适用。gydF4y2Ba
利益争夺gydF4y2Ba
两位作者宣称他们没有相互竞争的利益。gydF4y2Ba
附加信息gydF4y2Ba
出版商的注意事项gydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
叶绿素组成gydF4y2Ba6370sgydF4y2Ba突变体及其野生型ZH11。gydF4y2Ba(一种)gydF4y2Ba和gydF4y2Ba(b)gydF4y2Ba用高效液相色谱在660 nm处检测洗脱图谱。gydF4y2Ba(C)gydF4y2Ba丙酮中峰1,6和7的吸收光谱。gydF4y2Ba(d)gydF4y2Ba丙酮中峰2,3,4和5的吸收光谱。峰值2,3,4和5代表CHLgydF4y2BaPHY.gydF4y2Ba一个gydF4y2Ba的背影,gydF4y2BaTHGGgydF4y2Ba一个gydF4y2Ba的背影,gydF4y2BaDHGGgydF4y2Ba一个gydF4y2Ba,排名gydF4y2BaGGgydF4y2Ba一个gydF4y2Ba,分别。峰1、6和7代表ChlgydF4y2BaPHY.gydF4y2BabgydF4y2Ba的背影,gydF4y2BaDHGGgydF4y2BabgydF4y2Ba,排名gydF4y2BaGGgydF4y2BabgydF4y2Ba,分别。(PDF 420 KB)gydF4y2Ba
附加文件2:图S2。gydF4y2Ba
恒温(23℃或30℃)弱光(LL)或强光(HL)条件下生长室内3周龄幼苗的表型比较gydF4y2Ba(a1)gydF4y2Ba,gydF4y2Ba(a2)gydF4y2Ba,gydF4y2Ba(b1)gydF4y2Ba, 和gydF4y2Ba(b2)gydF4y2BaZH11和ZH11的表型gydF4y2Ba6370sgydF4y2Ba在23°C / L1,30℃/ LL,23℃/ HL和30℃/ HL下,分别为30℃/ LL。gydF4y2Ba(c1)gydF4y2Ba,gydF4y2Ba(c2)gydF4y2Ba,gydF4y2Ba(D1)gydF4y2Ba, 和gydF4y2Ba(D2)gydF4y2BaNP和gydF4y2Ba507sgydF4y2Ba在23°C / L1,30℃/ LL,23℃/ HL和30℃/ HL下,分别为30℃/ LL。(PDF 487 KB)gydF4y2Ba
附加文件3:表S1。gydF4y2Ba
叶片色素含量的变化gydF4y2Ba6370sgydF4y2Ba和gydF4y2Ba507sgydF4y2Ba突变体及其野生型Zh11和Nipponbare在不同的温度和光强治疗中,以mg g鲜重gydF4y2Ba−1gydF4y2Ba(PDF 253 kb)gydF4y2Ba
附加文件4:表S2。gydF4y2Ba
红叶中色素含量的比较gydF4y2Ba6370sgydF4y2Ba和gydF4y2Ba507sgydF4y2Ba不同温度处理的突变体及其野生型ZH11和日本晴的鲜重gydF4y2Ba−1gydF4y2Ba(PDF 421 kb)gydF4y2Ba
附加文件5:表S3。gydF4y2Ba
红叶中色素含量的比较gydF4y2Ba6370sgydF4y2Ba和gydF4y2Ba507sgydF4y2Ba不同光强处理的突变体及其野生型ZH11和日本晴的鲜重gydF4y2Ba−1gydF4y2Ba(PDF 421 kb)gydF4y2Ba
附加文件6:图S3。gydF4y2Ba
研究了ZH11 (WT)和ZH11颗粒中生育三烯醇的峰面积gydF4y2Ba6370sgydF4y2Ba.α-T3、γ-T3和δ-T3分别代表α-生育三烯醇、γ-生育三烯醇和δ-生育三烯醇。(PDF 440 kb)gydF4y2Ba
附加文件7:表S4。gydF4y2Ba
用于映射的插入/删除(InDel)标记gydF4y2Ba6370sgydF4y2Ba轨迹。(PDF 232 kb)gydF4y2Ba
附加文件8:图S4。gydF4y2Ba
OsLIL3及其同系物的序列比对。相同的残留物用黑色框起来,相似的残留物(≥75%相同)用灰色突出显示。黑色下划线表示推测的叶绿体信号肽,红色箭头表示突变位点gydF4y2Ba6370sgydF4y2Ba,绿色下划线表示HMMTOP预测的跨膜螺旋。蓝框显示的是基于LHC基序的LHC基序。红框显示了突变的Oslil3蛋白中的11个新氨基酸。各蛋白序列的GenBank登录号如图所示。gydF4y2Ba5gydF4y2Ba.(PDF 482 kb)gydF4y2Ba
附加文件9:图S5。gydF4y2Ba
预测了OsLIL3 (LOC_Os02g03330)的跨膜结构域。(PDF 201 kb)gydF4y2Ba
附加文件10:图S6。gydF4y2Ba
叶肉细胞的超微结构gydF4y2Ba(一种)gydF4y2Ba和叶绿体gydF4y2Ba(b)gydF4y2Ba在gydF4y2Ba637年502 y ygydF4y2Ba双突变体。柱= 1 μm。(PDF 563 kb)gydF4y2Ba
附加文件11:图S7。gydF4y2Ba
野生型Zh11和Nipponbare(NP)的表型比较和CHL成分分析,gydF4y2Ba6370sgydF4y2Ba突变体,突变体gydF4y2Ba507sgydF4y2Ba突变体和gydF4y2Ba637年502 y ygydF4y2Ba双突变体(DM)在三叶期生长在生长室内,在恒定的23°C的弱光下。gydF4y2Ba(一种)gydF4y2Ba表型的比较。gydF4y2Ba(b)gydF4y2Ba,gydF4y2Ba(C)gydF4y2Ba,gydF4y2Ba(d)gydF4y2Ba和gydF4y2Ba(e)gydF4y2Ba野生型Chls的洗脱图谱,gydF4y2Ba6370sgydF4y2Ba,gydF4y2Ba507sgydF4y2Ba分别和DM。峰值2,3,4和5代表CHLgydF4y2BaPHY.gydF4y2Ba一个gydF4y2Ba的背影,gydF4y2BaTHGGgydF4y2Ba一个gydF4y2Ba的背影,gydF4y2BaDHGGgydF4y2Ba一个gydF4y2Ba,排名gydF4y2BaGGgydF4y2Ba一个gydF4y2Ba,分别。峰1,6和7代表ChlgydF4y2BaPHY.gydF4y2BabgydF4y2Ba的背影,gydF4y2BaDHGGgydF4y2BabgydF4y2Ba,排名gydF4y2BaGGgydF4y2BabgydF4y2Ba,分别。丙酮中洗脱曲线的吸收光谱与那些相同gydF4y2Ba图S1C.gydF4y2Ba和gydF4y2BadgydF4y2Ba.(PDF 546 kb)gydF4y2Ba
附加文件12:图S8。gydF4y2Ba
总Chl含量gydF4y2Ba507sgydF4y2Ba其在低光(L1)或高光(HL)下生长的野生型(WT),在恒温(23℃或30℃)中,以Mg G鲜重gydF4y2Ba−1gydF4y2Ba.数据以平均值±SD表示。误差棒代表三个独立的生物重复的标准偏差。星号表示与野生型在gydF4y2BaPgydF4y2Ba< 0.01。(PDF 560 kb)gydF4y2Ba
附加文件13:图S9gydF4y2Ba
大豆叶片和谷物中维生素E含量的分析gydF4y2Ba507sgydF4y2Ba.生育酚标准的洗脱谱gydF4y2Ba(一种)gydF4y2Ba,野生型日本晴叶片中的生育酚含量gydF4y2Ba(b)gydF4y2Ba和gydF4y2Ba507sgydF4y2Ba(C)gydF4y2Ba,日本晴谷物中的生育酚和生育三烯醇gydF4y2Ba(d)gydF4y2Ba和gydF4y2Ba507sgydF4y2Ba(e)gydF4y2Ba采用290 nm激发和330 nm发射的荧光检测。gydF4y2Ba(F)gydF4y2Ba日本晴叶片和籽粒中生育酚的含量gydF4y2Ba507sgydF4y2Ba通过使用生育酚标准进行量化。gydF4y2Ba(g)gydF4y2BaNipponbare(WT)谷物中Tocotrienols的峰面积和gydF4y2Ba507sgydF4y2Ba.α- t,α生育酚;γ- t,γ生育酚。生育酚标准品的制备如下图所示。gydF4y2Ba5gydF4y2Ba.α-T3、γ-T3和δ-T3分别代表α-生育三烯醇、γ-生育三烯醇和δ-生育三烯醇。峰1和峰2代表α-生育酚和γ-生育酚;峰3为δ-生育酚,在水稻中不存在,作为对照。峰4,5和6分别代表α-生育三烯醇、γ-生育三烯醇和δ-生育三烯醇。峰7可能是γ-生育酚的同分异构体。误差棒代表三个独立的生物重复的标准误差。星号表示与野生型在gydF4y2BaPgydF4y2Ba< 0.01。(PDF 758 KB)gydF4y2Ba
附加文件14:图S10。gydF4y2Ba
植物光合作用和Chl生物合成相关基因的表达分析gydF4y2Ba507sgydF4y2Ba.gydF4y2Ba肌动蛋白1gydF4y2Ba被扩增为内部参考。野生类型中每个基因的表达水平设定为1.0,以及其中gydF4y2Ba6370sgydF4y2Ba和gydF4y2Ba507sgydF4y2Ba相应地计算突变体。误差棒代表三个独立的生物重复的标准误差。星号表示与野生类型相比的统计学上有显着差异gydF4y2BaPgydF4y2Ba< 0.05。(PDF 591 kb)gydF4y2Ba
附加文件15:图S11。gydF4y2Ba
的表达模式gydF4y2Baoschlp.gydF4y2Ba基因。表达水平是通过在稻田中生长的根(R),叶片(L),叶护套(LS),胰岛(P)和茎的叶片(L),茎状护套(P)和茎的表达水平测定。转录物的水平被标准化为米饭gydF4y2Ba肌动蛋白1gydF4y2Ba基因作为内部控制。误差棒代表三个独立的生物重复的标准误差。(PDF 569 KB)gydF4y2Ba
附加文件16:表S5。gydF4y2Ba
RT-PCR的引物。(PDF 277 kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除非另有说明,否则适用于本文中提供的数据。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
李,C.,Liu,X.,Pan,J.gydF4y2Baet al。gydF4y2Ba一个gydF4y2BaLIL3 CHLP.gydF4y2Ba双突变体具有独特的天竺葵叶绿素叶绿素在水稻中显示出一种致命的表型。gydF4y2BaBMC植物杂志gydF4y2Ba19,gydF4y2Ba456(2019)。https://doi.org/10.1186/s12870-019-2028-z.gydF4y2Ba
已收到gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
迪伊gydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-019-2028-z.gydF4y2Ba
关键字gydF4y2Ba
- 叶绿素生物合成gydF4y2Ba
- Geranylgeranyl还原酶gydF4y2Ba
- 叶片突变体gydF4y2Ba
- 聚光像蛋白质gydF4y2Ba
- LIL3gydF4y2Ba基因gydF4y2Ba
- 植基残留gydF4y2Ba
- 大米(gydF4y2Ba栽培稻gydF4y2Ba)gydF4y2Ba
- 生育酚生物合成gydF4y2Ba