摘要
背景
多液素桥接因子1 s(MBF1S.)是转录的共同活化剂家族的成员,这些家族涉及植物生长,发育和应力反应。但是,很少有人知道Solanum Lycopersicum MBF1(SlMBF1)基因家族。
结果
共有五个SlMBF1基于番茄参考基因组鉴定基因,将这些基因映射到五条染色体。所有SLMBF1蛋白质高度保守,具有典型的MBF1结构域和螺旋转螺旋_3结构域。此外,启动子区域SlMBF1基因具有各种应激和激素响应性顺式调节元件。鼓励,这SlMBF1在不同组织中以不同的表达谱表达基因,并对各种应激和激素治疗作出反应。生物学功能SLMBF1C.通过在番茄中过表达进一步鉴定,转基因番茄品系对Botrytis cinerea(b .灰质).另外,在转基因植物中改变了水杨酸(SA) - ,茉莉酸(Ja) - ,介导的防御相关基因的表达模式 - 和乙烯(et)介导的防御相关基因。
结论
我们的综合分析提供了澄清进化关系的宝贵信息SlMBF1成员及其在不同组织和不同应力下的表达模式。过度表达SLMBF1C.减少了番茄的抵抗力b .灰质通过增强sa介导的信号通路的基因表达,抑制JA/ et介导的信号通路。这些结果将有助于进一步研究转录共激活因子家族的功能。
背景
在所有生物复杂的生物过程中,转录调控是基因组信息表达的关键步骤。转录共激活因子是基因表达的重要组成部分,通过与转录因子和/或其他调控元件和基础转录机制相互作用发挥作用[1].多丙烯蛋白桥接因子1(MBF1)蛋白质是转录共激活剂家族的成员,在真核生物中高度保守。MBF1通过桥接调节转录因子和塔塔盒结合蛋白介断下游基因的转录激活[2].MBF1蛋白由一个n端结构域、一个保守的螺旋-turn-helix (HTH)结构域和一个短的c端组成[3.].Hth域对维持MBF1的功能活动至关重要[4.].
一些MBF1.基因已经在植物中被发现,并被证明参与植物的生长、发育和逆境反应。例如,拟南芥有三个MBF1.已发现这些基因的基因和这些基因的表达水平被各种类型的非生物和生物应激诱导[2那5.那6.].拟南芥植物过度表现Arabidopsis Thaliana MBF1A(atmbf1a.)表现出对盐胁迫和病原体感染的耐受性较高,并且它们显示出对葡萄糖的过敏性表型[7.].过度表达ATMBF1C.可以提高对高温的耐受性拟南芥[8.那9.].异位表达葡萄属狐狸XV.Vinifera MBF1在拟南芥增加耐旱性[10]和异位表达Triticum Aestivum MBF1C.改良水稻的耐热性[11].但是,不是所有的MBF1.基因是增强植物对环境胁迫耐受性的正调控因子。例如,Capsicum Annuum MBF1.-overexpressing拟南芥品系的叶子较大,但对冷和盐胁迫很敏感[12].
番茄是世界上种植最广泛的蔬菜作物之一,也是研究基因功能的关键模式植物[13].然而,番茄的产量受到植物病原的严重制约Botrytis cinerea(b .灰质).虽然的功能SlER24是MBF1家庭成员,已经表征和证明在番茄种子萌发中发挥着重要作用[14,这些基因的功能除了SlER24据报道很少。在我们的研究中,为了探索基因数量SlMBF1家庭在番茄中,在番茄基因组数据库中进行了系统分析。共鉴定了总共五种SLMBF1蛋白质。系统发育结果和基序分析表明,SLMBF1家族高度保守。此外,对启动子反应元素的分析及表达剖析SLMBF1S.显示出对各种激素和压力的显著反应。并在番茄中获得了转基因株系。过度表达SLMBF1C.降低了番茄的抗性b .灰质,建议SLMBF1C.用作番茄抗性的负调节器b .灰质.总体而言,本研究为进一步研究奠定了基础MBF1.基因,及其在番茄中的特质改善。
结果
识别和染色体位置SlMBF1番茄中的基因
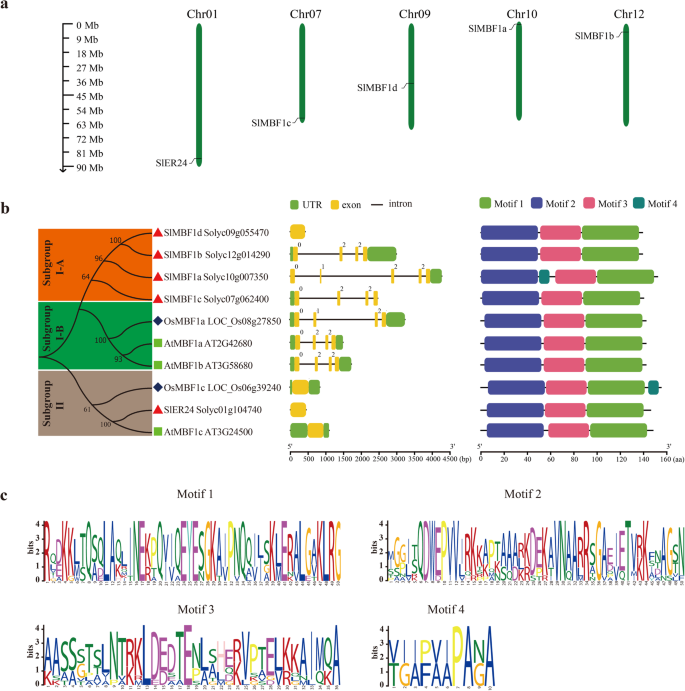
确定推定MBF1.番茄基因组中的基因,我们使用了三个拟南芥MBF1蛋白序列和保守的MBF1和HTH_3域作为使用BLASTP程序搜索番茄基因组数据库的查询(附加文件3.:表S3)。使用默认参数获得总共五种推定的SLMBF1蛋白。然后,通过SMART和CD搜索确认了保守的MBF1和HTH_3域的存在。如Sanchez-Ballesta等。[15),四个SlMBF1基因命名SLMBF1A到C和SlER24,以及新确认的SlMBF1基因被命名为SLMBF1D..
分子特性分析表明,这些SLMBF1蛋白显示了类似的长度(SLMBF1A,SLMBF1B,SLMBF1D和146个氨基酸的SLER24)的相似长度(139个氨基酸)。五个SLMBF1蛋白的预测分子量范围为15.272(SLMBF1B)至16.033(SLER24)道尔顿(DA)。预测的PI值范围从9.95(SLMBF1A和SLMBF1D)到10.11(SLER24)。总结了这些SLMBF1蛋白的基因ID和基因组位置(附加文件1:表S1)。通过分析从番茄基因组数据库获得的基因组定位信息,这五个SlMBF1基因分别定位在番茄第1、7、9、10、12号染色体上(图1)。1。一种)。
系统发育分析,基因结构和保守的主题SlMBF1基因
利用5个SlMBF1、3个AtMBF1和2个OsMBF1蛋白的全序列进行蛋白序列比对和系统发育分析(图)。1b)。这些MBF1蛋白被定义为其他相应的植物MBF1子组的成员[16].在这两个亚组中,子组I由四个SLMBF1,一个OSMBF1和两个ATMBF1蛋白组成,并且由一个OSMBF1,一个SLMBF1和一个ATMBF1蛋白组成的子组II。由于这三种物种之间的进化差异,子组I可以进一步分为两组,子组I-A和子组I-B。其中,子组I-A包括仅四种番茄SLMBF1蛋白质和亚组I-B包括一个OSMBF1和两个ATMBF1蛋白。
基因结构分析MBF1.来自番茄的家庭基因,拟南芥进行了水稻,结果与系统发育树分析一致。如图1所示。1B,外显子的数量SlMBF1那ATMBF1和osmbf1.基因范围从一到五个外显子范围。我们发现,两个亚组,亚组II和亚组I-B具有相似的内部外显子结构(图。1b)。这三名成员,osmbf1c.那SlER24和ATMBF1C.,在亚组II中包含一个外星人和成员,osmbf1a.那atmbf1a.和ATMBF1B.,在子组I-B四个外显子。但是,在亚组I-A中,SLMBF1B.和SLMBF1C.包含四个外显子,而SLMBF1A五个外显子和SLMBF1D.一个外显子(图。1b)。
进行MBF1蛋白的基序分析,并鉴定了四个不同的基序(图。1B;C和附加文件2:表S2)。在所有MBF1蛋白中鉴定为MBF1结构域的MOTIF 2和3,其是MBF1结构域,以及HTH_3结构域的基序1。有趣的是,基序4仅在SLMBF1A和OSMBF1C蛋白中鉴定。因此,在这三种模型植物中MBF1蛋白的类似主题分布可以促进MBF1s的功能的预测。
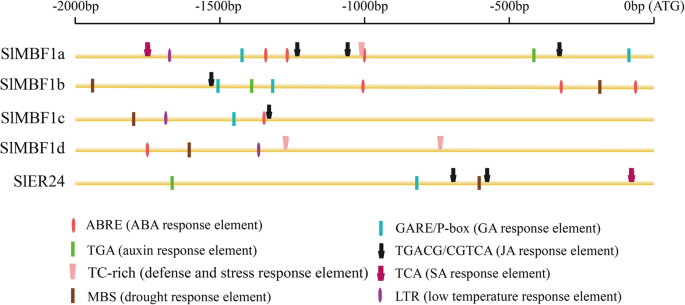
的启动子中潜在的顺式元素SlMBF1基因
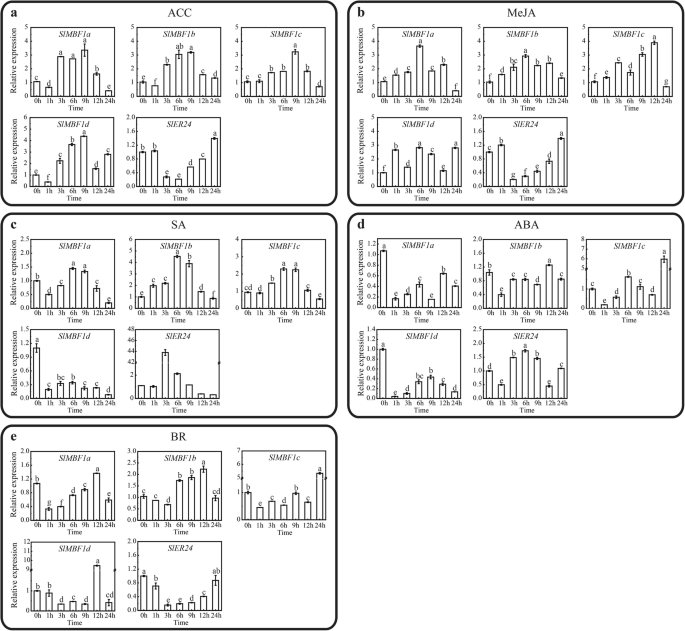
先前的研究表明,许多MBF1.基因在发育过程中发挥监管作用和对植物环境胁迫的耐受性。预测SLMBF1基因的推定功能,2.0 kB启动子区域SlMBF1分离基因使用植物护理数据库分析潜在的顺式元素(图。2),并预测了许多与压力响应性和植物激素有关的元素。如图1所示。2,启动子SlMBF1基因含有许多应力元件:干旱响应元件,低温响应元件和防御和应力响应元件。此外,还发现了包括吸收酸(ABA)响应元件,赤霉素(GA)响应元件,甘蔗酸(MEJA)响应元件,水杨酸(SA)响应元件和生长素响应元件的激素响应元件。SlMBF1启动子。这些结果表明五个SlMBF1基因可能在对几种激素和各种压力的反应中起重要作用。
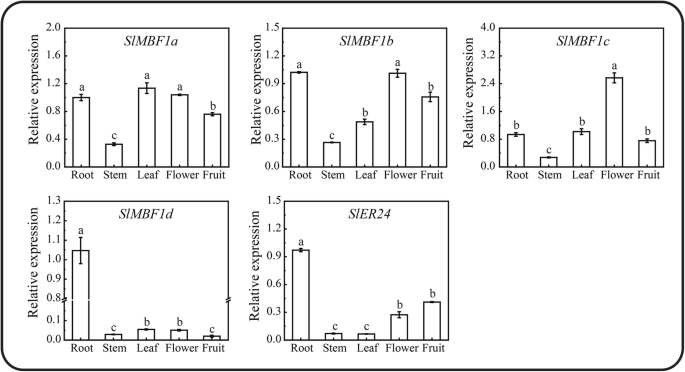
表达模式的SlMBF1不同组织中的基因
了解番茄的潜在功能SlMBF1基因,这五个表达模式SlMBF1利用qRT-PCR技术检测番茄根、茎、叶、花和成熟果实等不同器官的基因。如图1所示。3.,所有的SlMBF1在这五种组织中检测到基因。表达SLMBF1A那SLMBF1B.和SLMBF1C.在大多数组织中含量相对较高,但是SLMBF1D.在所有组织中表达水平相对较低。SlER24在根、茎和叶中表达量相对较低,而在果实和花中表达量相对较高。
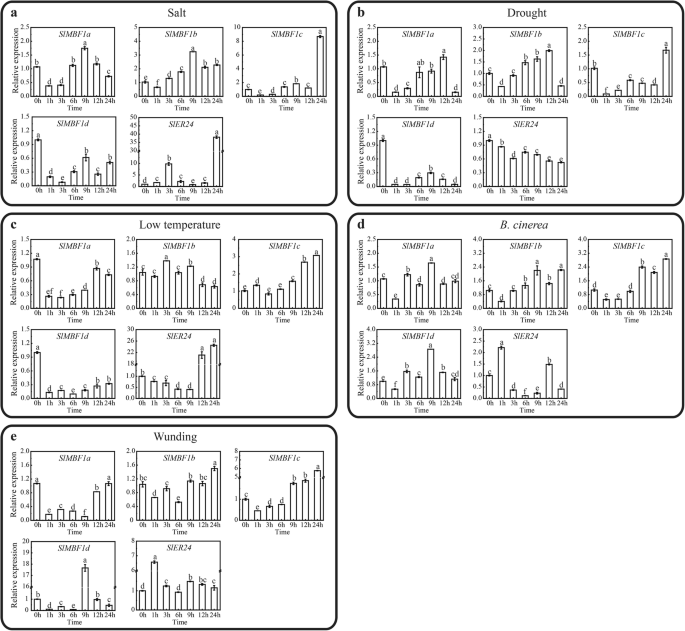
表达式模式SlMBF1不同应力和不同植物激素条件下的基因
探索这五个SlMBF1基因对番茄中的生物和非生物胁迫作出反应,我们检查了表达模式SlMBF1不同胁迫条件下的基因,包括盐,干旱,低温,b .灰质使用QRT-PCR伤害(图。4.).不出所料,大部分SlMBF1基因对不同的压力处理有反应。例如,SLMBF1C.在所有压力处理的晚期诱导(图。4.).表达水平SlER24在盐和低温条件的晚期上升(图。4.a,c)。表达水平SLMBF1A最初下调然后上调,然后在干旱的晚期下调b .灰质条件(图。4.B,D)。而且,SLMBF1B.显示相同的表达趋势SLMBF1A在干旱条件下(图。4.C)。
进一步研究这五个SlMBF1在番茄中,我们还检测了对植物激素响应的基因的表达模式SlMBF1不同激素治疗的基因,包括使用QRT-PCR的1-氨基环丙烷-1-羧酸(ACC),水杨酸(SA),亚氨基甲酸(MEJA),脱落酸(ABA)和芸苔类化合物(BR)(图.5.).如图1所示。5., 大部分的SlMBF1基因对不同的激素作出反应。例如,表达水平SLMBF1A和SLMBF1C.最初上调,然后在ACC和Meja条件下的晚期下调。相比之下,表达水平SLMBF1A最初被诱导在ACC和Meja条件下的晚期压抑。某些SlMBF1在SA,ABA和BR条件下也诱导基因(图。5.C,D,E)。
易感性SLMBF1C.过度抑制线到b .灰质
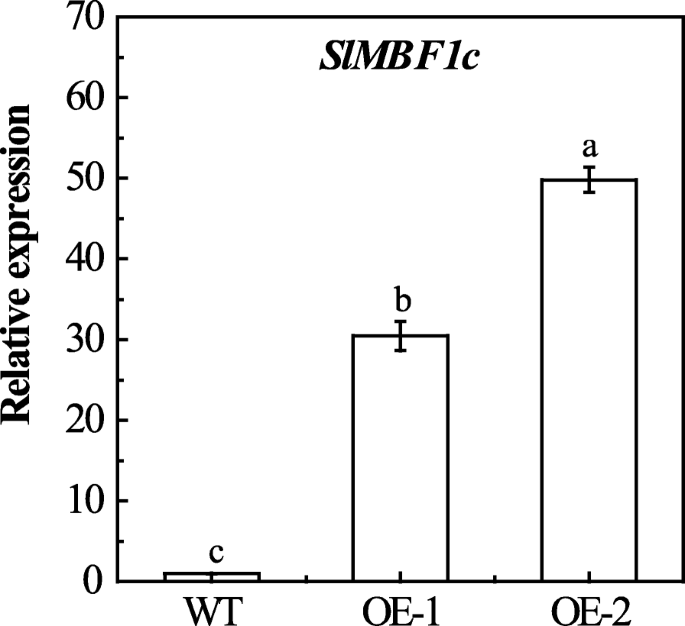
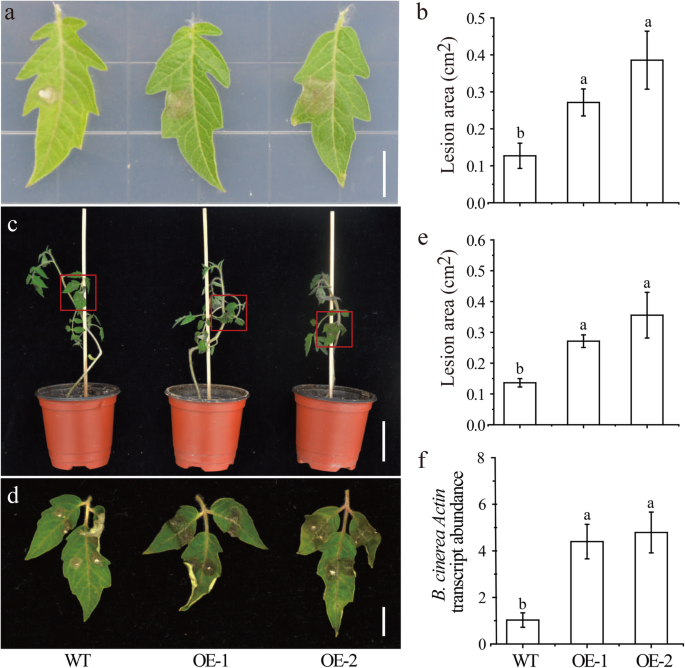
调查函数SLMBF1C.在辩护响应b .灰质,我们生成的35S :: SLMBF1C.通过农杆菌介导的方法转基因番茄植物(OE)。使用Kanamycin作为选择标记和基因组PCR检测,选择两个独立和纯合的T3转基因系以进一步测定。这两个OE线显示出显着更高的表达水平SLMBF1C.比WT植物(图。6.).然后,我们研究了从5周龄OE和WT幼苗的叶子的反应b .灰质使用Du等人之前描述的方法,2017 [17].如图1所示。7.a和b,感染后b .灰质,与wt相比,OE叶片显示出显着更大的坏死病变。此外,我们还进行了全植物接种实验。类似地,OE植物显示敏感的表型,与WT相比,感染后b .灰质(图。7.c, d, e)B. Cinerea actin.与WT相比,OE植物中的显着增加(图。7.F)。所有人都在一起,这些结果表明番茄SLMBF1C.是响应的负调节因子b .灰质感染。
SLMBF1C.调节与防御相关基因的表达
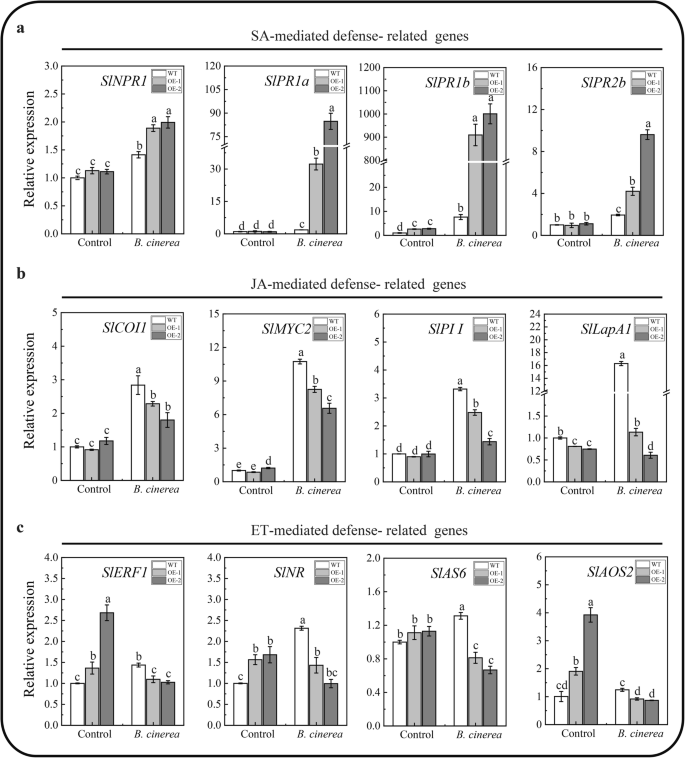
为了探索信号传导途径,我们分析并比较了SA信号相关基因的相对表达的变化非行为的致病相关1(SLNPR1)及致病相关基因(slpr1a.那SLPR1B.和SLPR2B.)、JA信号转导相关基因冠状素不敏感1(SLCOI1.),Myelocytomatosis致癌基因2(SlMYC2),蛋白酶抑制剂I.(SLPI I.) 和亮氨酸氨基肽酶A1(SlLapA1)和ET信号相关的基因乙烯反应因子1(SLERF1.),乙烯受体(SLNR.),ACC合成酶6.(斯拉克6.) 和联烯氧化物合成酶2(SlAOS2)感染前和感染后b .灰质使用QRT-PCR。如图1所示。8.,感染前的转录水平SLNPR1那slpr1a.那SLPR2B.那SLCOI1.那SLPI I.和斯拉克6.与野生型相比,OE株系的转录水平无显著差异SLPR1B.那SLERF1.那SLNR.那SlAOS2略微增加和转录水平SlLapA1在OE线中略有下降。感染后b .灰质, SA信号通路相关基因的转录水平(SLNPR1那slpr1a.那SLPR1B.和SLPR2B.与WT相比,在两个OE线中显着升高(图。8.然而,在感染后b .灰质,JA信号传导相关基因的表达水平(SLCOI1.那SlMYC2那SLPII.和SlLapA1)和与信号传导相关的基因(SLERF1.那SLNR.那斯拉克6.和SlAOS2)与野生型相比,在两个OE系中显著降低(图。8.B和C)。这些结果表明过表达SLMBF1C.在番茄中可以在感染时压制JA / ET介导的信号通路b .灰质.
讨论
随着更多物种的基因组完全测序,许多监管基因家族如MYB [18], bHLH [19]和wrky [20.的转录因子家族,已经被确认。除了这些转录因子家族,还有转录共激活因子家族,如MBF1s。的研究MBF1.基因主要集中在植物生长,发展和压力反应的调节拟南芥[2那7.那8.].尽管在2007年,Sanchez-Ballesta等人确定了四个MBF1.番茄中的基因并分析其结构,组织特异性表达和果实发展过程中对乙烯处理的反应[15] 2012年完成的番茄基因组序列提供了更多信息,用于鉴定该基因家族[13].在这里,五个番茄MBF1.基于完成的番茄基因组鉴定并确认基因(图。1一种)。同时,进行了更精确和综合的生物信息学分析(包括染色体位置,系统发育分析,基因结构,促进剂中的保守基序和CIS-元素)。值得注意的是,我们在基因结构中发现了五个外显子SLMBF1A,但桑切斯巴斯塔等。只发现了四个外显子。在不同组织中这些基因的综合表达水平,对不同应力的反应(盐,干旱,低温,b .灰质还检测到伤口和伤口)和不同的植物激素条件(ACC,Meja,Sa,ABA和BR)(图。4.和5.).更重要的是,我们确定了生物学功能SLMBF1C.对番茄抗性产生负面调节b .灰质(图。6.那7.和8.).
过度表达SLMBF1C.降低了对b .灰质.一种野生型和野生型的响应SLMBF1C-OE.植物叶到b .灰质在培养皿中的2 dpi感染(秤棒,1厘米)。B.叶片上显示的病变区域的定量(一种).C和 (D.)野生型和野生型植物的反应SLMBF1C-OE.到b .灰质在2 DPI(分别为5厘米和1厘米)的感染。E.叶片上显示的病变区域的定量(C).F相对转录本丰度B. Cinerea actin.在感染的叶子中,从整个植物接种实验在2 dpi。从5周龄番茄植物中脱离的叶片用5μl孢子悬浮液发现(106.孢子/ ml)。结果(B.),E.和 (F)表示为平均值±SD;N来自不同植物的六片叶子。不同的字母表示处理之间有显著差异(P.< 0.05)
在这项研究中,有五个MBF1.基因分别分布在番茄的5条染色体上。1一种)。与三个相比MBF1S.在拟南芥[2]和两者MBF1S.在米饭中,数量MBF1S.在番茄中更大,这意味着扩张MBF1S.在番茄。系统发育分析将这10个MBF1蛋白分为两个主要分支(图)。1b),与先前描述相同[16].一个分支包含子群I-A和B,另一个分支包含子群II(图2)。1b)。结果表明,番茄中这些MBF1蛋白有两种不同的进化方向,拟南芥和米饭。重要的是,子组I-A唯一包括四种MBF1蛋白,但不包括任何拟南芥或米mbf1蛋白质(图。1b),这意味着这个亚组丢失了拟南芥和米饭,在最后一个共同的祖先分歧后在番茄中获得。此外,基因结构分析显示亚组I-B和亚组II中的内外部外显子结构,但不在亚组I-A中(图。1B.),建议在番茄的亚组I-A中发生内含子插入和损失的进化动态MBF1.基因。之前的研究表明,酵母MBF1.突变体完全/部分救出MBF1.来自人,蚕和蚕的基因拟南芥[2那21.,揭示了。的功能MBF1.基因是高度保守的。在本研究中,motif分析显示这些MBF1蛋白具有相似的motif组成模式,并且都具有MBF1和HTH_3结构域(图2)。1b),这意味着番茄中Mbf1蛋白的功能,拟南芥而大米可能也是类似的,而且是保守的。
不同组织,应力和植物激素的表达模式分析通常用于预测植物生长,发育和应激反应中基因的潜在功能。通过表达模式分析,我们发现所有的SLMBF1S.基因在五种组织中表达,大多数在花和叶中具有更高的表达(图。3.).此外,在这五个的启动子区域中发现了GA响应元素SlMBF1基因和IAA反应元件也在启动子区域SLMBF1A那SLMBF1B.和SlER24(图。2).这些结果表明SLMBF1S.可能参与植物生长和发展。除了植物生长和发展中的作用还[14],MBF1.基因还参与对非生物和生物应激的反应,例如盐,干旱,温度和病原体[5.那6.那7.那8.那9.那10那11那12].实际上,在这些启动子地区发现了几种与压力相关的元素(干旱,低温,ABA,防御和压力,JA和SA反应元素)SLMBF1S.(图。2).此外,SlMBF1基因被非生物和生物应力诱导(例如盐,干旱,冷和b .灰质通过相关的荷尔蒙(例如ABA,SA,JA和ACC)(图。4.和5.).这些结果表明了这些结果SlMBF1基因参与了应激反应,其功能类似于MBF1S.来自其他物种[7.那8.那9.那10那11那12].
番茄是一个重要的经济和蔬菜作物。然而,b .灰质严重限制番茄的产量[22.].在本研究中,表达SLMBF1C.被显着诱导b .灰质伤人和防御信令相关的激素(图。4.和5.).此外,还发现了几种防御相关元素在启动子SLMBF1C.(图。2).而且,过表达atmbf1a.基因拟南芥赋予感染下的抗性增加b .灰质[7.].为了澄清功能SLMBF1C.在防御反应中,番茄植物过表达SLMBF1C.是生成的。令我们惊讶的是,与野生型相比,转基因株系在感染b .灰质(图。6.).找到SLMBF1C.调节抵抗力b .灰质与其功能不同拟南芥同族体。这种现象可能是由于进化上的差异SLMBF1C.和atmbf1a., 因为SLMBF1C.属于子组I-A,但是atmbf1a.在系统发育树中亚组I-B(图。1b)。
之前的研究表明b .灰质可以激活SA信号通路,以促进其植物的致病性[23.那24.].同时,植物可以激活JA/ et介导的防御反应b .灰质感染(23.那25.那26.].然而,SA信号通路可以对抗植物中的JA / ET信号通路来抵抗b .灰质感染(23.那25.].在我们的研究中,只有在控制条件下SLPR1B.在OE系中,SA信号通路的表达量略高于WT,但低于WTb .灰质感染,所有SLNPR1那slpr1a.那SLPR1B.和SLPR2B.在OE线上显着上调(图。8.一种)。而且,过表达SLMBF1C.进一步促进SA信号通路基因的表达水平,特别是slpr1a.和B.(图。8.相反,在控制条件下,只有SlLapA1在OE系中JA信号通路的表达量较WT略低;但在b .灰质感染,所有SLCOI1.那SlMYC2那SLPI I.和SlLapA1在OE线上显着下调(图。8.b)。这些结果表明,通过高度活化的SA信号通路严重抑制了受感染的OE线路中的JA介导的防御反应b .灰质感染(图。8.b)[26.].此外,虽然在控制条件下,ET介导的防御基因(SLERF1.那SLNR.那斯拉克6.和SlAOS2)与WT相比,在OE线中显示出更高的表达(图。8.c),所有这些基因在感染的OE线中显着下调,表明感染的OE线中的ET信号通路也大大抑制了高活化的SA信号传导(图。8.综上所述,这些结果阐明了SLMBF1C.- 由于强烈激活的SA途径展示了敏感的表型,致拮抗JA / ET介导的防御反应b .灰质感染。
NPR1.不仅是SA信号传导的主调节器,还通过抑制JA信号基因,SA和JA之间的拮抗作用中的关键调节器pi i.[23.那27.].实际上,表达水平SLNPR1增加了SLPI I.在受感染的OE线中压抑(图。8.a - b),表明SLMBF1C.可以激活SLNPR1镇压SLPI I.在受感染的OE系中这一结果与之前的研究一致[26.].但是,在我们的研究中,表达水平slpr1a.和SLPR1B.比较增加比SLNPR1在受感染的OE线条中,和SlLapA1比它更大地减少SLPI I.(图。8.A-B)。因此,澄清如何是有趣的slpr1a.和SLPR1B.以及是否slpr1a.和/或SLPR1B.是抑制的新关键调节器SlLapA1在SA和JA信号传导途径之间的对立面SLMBF1C.在番茄下被过度表达b .灰质未来研究的压力状况。
结论
在这项研究中,有五个SlMBF1基因包括SLMBF1D.在番茄基因组中鉴定并确认了新发现。系统发育树,基因结构和蛋白质基序的分析表明,MBF1蛋白在番茄中保守,拟南芥和米饭并在番茄中扩张。启动子中的顺式元素,组织特异性表达模式和对应力和激素的反应表明SLMBF1S.可能参与了番茄植株的生长发育和胁迫反应。最后,转基因实验表明SLMBF1C.对番茄抗性产生负面调节b .灰质通过增强sa信号基因和抑制JA/ et介导的基因。
方法
鉴定MBF1.番茄中的基因
识别SlMBF1来自整个番茄基因组的基因家族成员,三个ATMBF1蛋白被用作BLASTP搜索的查询序列,E-VALLE为10- 10.针对预测的番茄蛋白。此外,来自PFAM数据库的MBF1(PF08523.9)和HTH_3(PF01381.21)的隐马尔可夫模型(HMM)配置文件(http://pfam.janelia.org.)也被应用为查询来搜索MBF1.番茄基因组数据库的基因(http://solgenomics.net;itag版本3.20)。为了鉴定保守的结构域,由于MBF1(PF08523.9)和HTH_3(PF01381.21)域使用PFAM数据库和智能数据库(http://smart.embl-heidelberg.de.).
代表模型植物中的MBF1蛋白拟南芥和米饭从中下载拟南芥信息资源数据库(https://www.arabidopsis.org.)及水稻基因组注释计划数据库(http://rice.plantbiology.msu.edu/).
系统发育分析
通过Clustal W(1.81版,居民软件,欧洲分子生物学实验室,海德堡,德国,Heidelberg。)构建多个序列对准。)默认参数[28.].使用五个SLMBF1,Thress ATMBF1和两种OSMBF1蛋白的全序列使用Mega V7.0构建系统发育树[29.].采用Neighbor-Joining方法,参数如下:Poisson校正、两两删除和bootstrap(1000次;随机种子)[30.].
促进区的物理性质,染色体定位,基因结构,保守的基因识别和反应元素分析
利用ExPASy服务器的Compute pI/Mw工具(http://web.expasy.org/compute_pi/)[31.].从番茄基因组数据库中下载染色体位置和基因结构信息。使用MEME数据库(http://meme-suite.org/)[32.].另外,使用PlantCare数据库进行分析启动子区域中的响应元件(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)[33.].MapChart 2.30软件可视化染色体位置[34.].启动子区域的基因结构、保守基序和响应元件通过GSDS Server 2.0 (http://gsds.cbi.pku.edu.cn/).
植物材料和生长条件
番茄 (茄属植物lycopersicumL. cv ' SN1 ' [35.在光照16 h(28°C)/暗8 h(22°C)光周期(18.5 μmol m .- 2 s- 1).为所有类型的治疗方法使用了四周的番茄幼苗。
不同的压力和激素治疗
在盐和干旱胁迫处理试验中,将4周龄的番茄植株转移到含有半强度Hoagland营养液的10 L容器中,并在该体系中维持一周,然后添加NaCl (150 mM)和聚乙二醇8000(20%),如前所述[36.].将番茄植物转移到培养箱中,在4℃下冷处理。用止血钳压幼苗叶子以进行伤口处理。接种番茄植物b .灰质(B05.10)如前所述执行[17那23.那37.],微不足道的修改。用单个5μl液滴发现幼苗叶子b .灰质孢子悬架(106.孢子/ ml)用于病原体处理。对于激素处理,用ACC(100μm),SA(2mM),Meja(100μm),ABA(100μm)和Br(200μm)喷雾幼苗叶子。收集来自不同番茄植物的叶子,用于QRT-PCR分析。
RNA分离和实时荧光定量PCR分析
根据制造商的说明,用TRIzol Reagent (Invitrogen, Carlsbad, CA, USA)从番茄叶片中提取总RNA。根据制造商的说明,第一链cDNA由一微克总RNA合成,使用逆转录酶系统(Thermo,北京,中国)。使用SYBR Mixture (Juheme)和Applied Biosystems公司的7500 real-time PCR系统(Applied Biosystems)进行反应。PCR检测参数如下:95℃30 s;95°C 30 s, 60°C 15 s, 72°C 15 s共40个循环。qRT-PCR分析中使用的引物均列于附加文件中4.:表S4,其中部分来自以前的研究[24.那38.那39.那40].番茄Actin2基因用作内部对照。结果使用2计算−ΔΔCt方法(41.].所有QRT-PCR测定均以三种生物重复进行,每种生物复制有三种技术复制。
载体建设和植物改造
用于构造过表达SLMBF1C.向量,整个SLMBF1C.利用引物SlMBF1c-F: TATCACAAGACTGGGAGC和SlMBF1c-R: GTCGTACTACTAGAGGCA扩增其编码序列。然后用酶切法对扩增产物进行消化XbaI和kpni.在35s启动子的控制下,位点并插入PBI121向量中。这35 s: SlMBF1c通过电孔法将构建的番茄转化到农杆菌菌株LBA4404中,农杆菌介导的番茄转化遵循Fillatti等人描述的方法[42.].
统计分析
除OE株系表型分析中来自6个生物学重复的标准差外,其余表达水平的误差柱均为3个技术重复的标准差。显著性水平分析采用学生的显著性水平T.- 最低p <0.05使用Excel 2010 (Microsoft Cooperation, Washington, NJ, USA)。
数据和材料的可用性
支持结果的数据包含在文章及其附加文件中。其他相关材料可在合理的请求上获得相应的作者。
缩写
- AA:
-
氨基酸
- 阿巴:
-
脱落酸
- ACC:
-
1-Amino cyclopropane-1-carboxylic酸
- ATMBF1:
-
拟南芥多素蛋白桥接因子1
- b .灰质:
-
Botrytis cinere.一种
- BR:
-
芸苔类固醇
- 达:
-
道尔顿
- 是:
-
茉莉酸
- MBF1:
-
多素蛋白桥接因子1
- 兆:
-
分子进化遗传学分析
- 惩罚:
-
茉莉酸甲酯
- NJ:
-
邻接
- OE:
-
超表达
- OSMBF1:
-
奥雅萨苜蓿多素蛋白桥接因子1
- pI:
-
蛋白质等电点
- SA:
-
水杨酸
- SLMBF1:
-
茄属植物lycopersicum多素蛋白桥接因子1
参考
- 1.
Naar Am,柠檬Bd,Tjian R.转录转录络合物。annu rev biochem。2001; 70:475-501。
- 2。
Tsuda K,Yamazaki K.三个亚型的结构和表达分析拟南芥MBF1基因。BBA-BioMembranes。2004; 1680(1):1-10。
- 3.
王Y,Wei X,Huang J,Wei J.修改和功能适应MBF1.基因家族在脱盐的真菌中Endocarpon pusillum在环境压力下。SCI批准。2017; 7(1):16333。
- 4.
Ozaki J,Takemaru Ki,Ikegami T,Mishima M,Ueda H,Hirose S,Kabe Y,Handa H,Shirakawa M.核心结构域的鉴定和转录共粘膜MBF1的二级结构。基因细胞。2010; 4(7):415-24。
- 5。
ARCE DP,Godoy AV,Tsuda K,Yamazaki K,Valle Em,Iglesias MJ,Di Mauro MF,Casalongue Ca.分析一个拟南芥三重敲除突变体揭示了MBF1.基因在氧化胁迫条件下。J植物理性。2010; 167(3):194-200。
- 6。
Suzuki N,Sejima H,Tam R,Schlauch K,Mittler R.鉴定MBF1.热响应调节子的拟南芥.工厂J1111; 66(5):844-51。
- 7.
Kim MJ,Lim GH,Kim Es,Ko CB,杨肯,济宏ja,李麦卡,金cs。非生物和生物应激耐受性拟南芥overexpressing的多碳素桥接因子1A(MBF1A)转录共存基因。Biochem Bioph Res Co. 2007; 354(2):440-6。
- 8.
Suzuki N,Bajad S,Shuman J,Shulaev V,Mittler R.转录共振器MBF1C.是热能的关键调节器拟南芥.J Biol Chem。2008; 283(14):9269-75。
- 9.
Suzuki N,Rizhsky L,Liang H,Shuman J,Shulaev V,Mittler R.增强了表达转录共膜多液素桥接因子1C的转基因植物中的环境胁迫的耐受性。植物理性。2005; 139(3):1313-22。
- 10.
燕Q,侯H,歌手SD,Yan X,Guo R.葡萄vvmbf1.基因在转基因中提高了干旱胁迫耐受性拟南芥.acta botanica yunnanica(云南植物研究). 2014;118(3):571 - 582。
- 11.
秦东,王芳,耿旭,张玲,姚艳,倪震,彭华,孙强。热应激反应的过度表达TAMBF1C.小麦(小麦L.)多素蛋白桥接因子,赋予酵母和水稻的耐热性。植物mol biol。2015; 87(1-2):31-45。
- 12.
郭WL,陈里,杜Xh,张z,尹yx,锣zh,王玉。对转基因的非生物胁迫的耐受性降低拟南芥过度表达A.Capsicum Annuum MultiProtein桥接因子1.BMC植物BIOL。2014; 14(1):138。
- 13。
Consortium TTG。番茄基因组序列提供了肉质果实演化的见解。自然。2012; 485(7400):635-41。
- 14。
Hommel M,Khalil-ahmad Q,Jaimes-Miranda F,Mila I,Pouzet C,LatchéA,Pech JC,Bouzayen M,Regad F.转录共激活剂的嵌合基因的过度表达MBF1.融合到EAR抑制子基序引起发育改变拟南芥和番茄。植物科学。2008;175(1):168 - 77。
- 15.
Sanchez-Ballesta MT,Hommel M,Jaimes-Miranda F,Tournier B,Zegzouti H,Mila I,LatchéA,Pech JC,Bouzayen M,Regad F.番茄的特征SL-MBF1转录共觉器基因家族。植物乙烯研究进展:第7届植物激素乙烯国际研讨会的诉讼。2007:369-75。
- 16。
Tsuda K, Tsuji T, Hirose S,山崎K-i。三种具有不同表达谱的拟南芥MBF1同源物作为转录辅助激活物发挥作用。植物生理学报。2004;45(2):225-31。
- 17。
杜米,赵杰,dtw t,刘y,邓l,杨t,zhai q,吴f,黄z,周m。MYC2策略调节番茄中茉莉族介导的植物免疫的分层转录级联。植物细胞。2017; 29(8):1883-906。
- 18.
赵鹏,李强,李军,王磊,任志强。水稻R2R3MYB家族的全基因组鉴定与鉴定茄属植物lycopersicum.Mol Gen Genomics。2014; 289(6):1183-207。
- 19.
毛泽东,董Q,李C,刘C,MA F.基因组鉴定与苹果BHLH转录因子的鉴定与表征,响应干旱和盐胁迫的表达分析。前植物SCI。2017; 8:480。
- 20。
谢t,陈c,李c,刘继,刘c,他y y。全基因组调查怀疑菠萝基因家族:发展与压力期间的演变和表达概况。BMC基因组学。2018; 19(1):490。
- 21。
Takemaru Ki,Li FQ,Ueda H,Hirose S.多季蛋白桥接因子1(MBF1)是一种进化保护的转录共同诱变剂,其连接调节因子和塔塔元素结合蛋白。pnas。1997年; 94(14):7251-6。
- 22。
Dean R,Van Kan Ja,Pretlorius Za,Hammond-Kosack Ke,Di Pietro A,Scmu Pd,Rudd JJ,Dickman M,Kahmann R,Ellis J等人。分子植物病理学的前10名真菌病原体。莫尔植物途径。2012; 13(4):414-30。
- 23。
El Oirdi M,El Rahman Ta,Rigano L,El Hadrami A,Rodriguez MC,Daayf F,Vojnov A,Bouarab K.Botrytis cinerea操纵免疫途径之间的拮抗作用,促进番茄疾病的发展。植物细胞。2011;23(6):2405 - 21所示。
- 24。
Veronese P,Nakagami H,Bluhm B,Abuqamar S,Chen X,Salmeron J,Dietrich Ra,Hirt H,Mengiste T.膜锚定的Botrytis诱导的Kinase1起到不同的角色拟南芥对坏死营养和生物营养病原体的抗性。植物细胞。2006;18(1):257 - 73。
- 25。
Glazebrook J.防御生物营养和坏死性病原体的对比机制。Annu Rev phytopathol。2005; 43(1):205-27。
- 26。
MR . Grant, Jones JDG。激素(dis)的和谐塑造植物的健康和疾病。科学。2009;324(5928):750 - 2。
- 27。
koonneef a,pieterse cmj。在防御信令中交叉谈话。植物理性。2008; 146(3):839。
- 28。
Thompson JD, Higgins DG, Gibson TJ。CLUSTAL W:通过序列加权、特定位置间隙惩罚和权重矩阵选择来提高累进序列比对的灵敏度。核酸学报1994;22(22):4673-80。
- 29。
Kumar S,SteCher G,Tamura K. Mega7:用于更大数据集的分子进化遗传学分析版本7.0。mol Biol Evol。2016; 33(7):1870-4。
- 30.
孙H,庞B,闫J,王T,王L,陈C,李琦,仁Z.综合分析黄瓜胃酸盐素氧化酶家族基因及功能表征csga20ox1在根系发育中拟南芥.中华医学杂志。2018;19(10):3135。
- 31.
Wilkins Mr,Gasteiger E,Bairoch A,Sanchez JC,Williams KL,Appel Rd,Hochstrasser DF。扩展服务器中的蛋白质识别和分析工具。方法Mol Biol。1999; 112(112):531-52。
- 32.
Bailey TL,Nadya W,Chris M,Li WW。MEME:发现和分析DNA和蛋白质序列图案。核酸重新。2006; 34:369-73。
- 33.
Magali L,Patrice D,Gert T,Kathleen M,Yves M,Yves Vdp,Pierre R,Stephane R. Plantcare,植物CIS作用调节元件的数据库和用于启动子序列的硅分析的工具的门户网站。核酸RES。2002; 30(1):325-7。
- 34.
Voorrips RE. MapChart:图形化表达连锁图和qtl的软件。J在这里。2002;93(1):77 - 8。
- 35.
王少森,孙晨,刘泽忠,史庆华,姚应祥,尤彩霞,郝玉杰。苹果的异位表达mhgai2基因带来了西红柿的GA - 不敏感表型。acta physiol植物。2012; 34(6):2369-77。
- 36。
Hichri I,Muhovski Y,Zizkova E,Dobrev Pi,Franco-Zorrilla JM,Solano R,Lopez-Vidriero I,Motyka V,Lutts S.该茄属植物lycopersicum锌Finger2半胱氨酸-2/组氨酸-2抑制因子样转录因子调控番茄的发育和耐盐性拟南芥.植物杂志。2014;164(4):1967 - 90。
- 37。
杨流华,张庆哲,韦嘉宁,李淑玉,魏宝,霍婷婷,闵敏敏,沈佳强,柯乐,李昌宝。番茄在植物中的作用脂氧合酶D伤诱导茉莉酸酯的生物合成及植物对虫性草食动物的免疫。公共科学图书馆麝猫。2013;9 (12):e1003964。
- 38。
张H,Hu Z,Lei C,Zheng C,Wang J,Shao S,Li X,Xia X,Cai X,Zhou J.一种植物植物素肽通过细胞溶质Ca引发毒素依赖性免疫力2+在番茄中的信号传导。植物细胞。2018; 30(3):652-67。
- 39。
张y,李d,张h,洪y,黄l,liu s,li x,u阳z,宋f。番茄组蛋白H2b单体素酶Slhub1和Slhub2有助于抗病抗性Botrytis cinerea通过调节SA-和JA/ et信号通路的平衡。植物学报。2015;15(1):1 - 20。
- 40。
徐旭,廖CJ。番茄PEPR1 Ortholog受体样Kinase1调节对Systemin,病症性真菌和昆虫草食的反应。植物细胞。2018; 30(9):2214-29。
- 41。
Livak KJ, Schmittgen TD。利用实时荧光定量PCR技术分析相关基因表达数据-ΔΔCT.方法。方法。2001;25:402-8。
- 42。
Fillatti JJ,Kiser J,Rose R,Comai L.使用二进制将草甘膦耐受基因的高效转移到番茄中根癌土壤杆菌向量。生物科技Nat》。1987;5(7):726 - 30。
致谢
我们感谢山东农业大学农业学院九海赵教授,提供b .灰质(B05.10)。我们还感谢山东农业大学园艺科学与工程学院清华史教授,用于提供番茄(茄属植物lycopersicumL. CV'SN1')种子。
资金
国家自然科学基金项目(no . 31672170, no . 31872950);山东省自然科学基金项目(no . JQ201309);山东省“双顶尖”项目(no . SYL2017YSTD06);资金在研究设计、数据分析和手稿准备中没有发挥作用。
作者信息
隶属关系
贡献
ZR设计了实验。XZ执行了大部分实验。LC有助于质粒结构。ZX涉及接种的分析b .灰质.XZ分析了数据并撰写了手稿。ZR对手稿进行了修改。所有作者都已阅读并批准本手稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
两位作者宣称他们没有相互竞争的利益。
附加信息
出版商的注意
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:表S1。
分子特性SlMBF1基因家庭在番茄。
附加文件2:表S2。
十个保守的图案序列和比特评分意味着来自番茄的所有MBF1蛋白的信息内容,拟南芥和米饭。
附加文件3:表S3。
五种番茄MBF1蛋白的保守域信息。
附加文件4:表S4。
用于QRT-PCR的引物。
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
张,X.,徐,Z.,陈,L.等等。多素桥桥接因子1家族基因综合分析SLMBF1C.负调节阻力Botrytis cinerea在番茄。BMC植物BIOL.19,437(2019)。https://doi.org/10.1186/s12870-019-2029-y
收到了:
公认:
发表:
关键词
- 番茄
- MBF1.
- 表达式模式
- SLMBF1C.
- Botrytis cinerea