摘要
背景
研究表明HSP20.(热休克蛋白20)基因在调节植物生长,发育和应力反应中起重要作用。但是,葡萄HSP20.基因家族尚未得到很好的研究。
结果
总共48VvHSP20通过系统发育分析和亚细胞定位,将其划分为11个亚家族(CI、CII、CIII、CV、CVI、CVII、MI、MII、ER、CP和PX/Po)。进一步的结构分析表明VvHSP20基因(93.8%)没有内含子或仅内含子,而基于系统发育树聚集在一起的基因具有类似的基序和进化保守的结构。HSP20S共享保守的α结晶域(ACD),ACD域的不同组分表明了VVHSP20S的功能多样性。此外,48VvHSP20基因分布在12条葡萄染色体上,其中绝大多数分布在染色体上VvHSP20基因位于染色体的近端或远端。染色体作图显示有四组VvHSP20将基因鉴定为串联复制基因。植物激素响应,非生物和生物应激响应性,以及植物发育相关的顺式元素被鉴定出来独联体- VvHSP20s调控元件分析。的表达式概况VvHSP20s基因(VVHSP20-1,11,14,17,18,19,20.,24,25,28,31,39,42岁的和43)在过氧化氢后的RNA-SEQ和QRT-PCR分析之间的基本相似(H.2O2)治疗。结果表明VvHSP20s受到的调控2O2果实发育过程中的处理。VvHSP20s基因确实参与了葡萄果实的发育,其转录水平的差异可能是进化过程中功能分化的结果。
结论
我们的结果提供了有关基因进化关系的宝贵信息VvHSP20家庭,对未来的研究功能特征有助于VvHSP20葡萄的基因。
背景
作为世界上最重要的栽培水果作物之一,葡萄具有高的经济价值。“kyoho”是一种四倍体间隙的杂种和中期成熟的葡萄品种,来自之间的交叉葡萄x葡萄属出发,这在中国广泛培育。我们以前的“kyoho”的研究表明过氧化氢(H2O2)治疗可以促进'kyoho'葡萄的早期成熟,导致它比对照提前20天提升[1,2].其他关于番茄的研究[3.]和梨[4也证明了H2O2与果实发育有关。H2O2是热信号通路的早期组成部分,是热休克蛋白20 (heat shock protein 20, HSP20)合成激活的必要条件[5].此外,响应HSP20s到H.2O2在番茄和大米中也发现了H2O2诱导线粒体的表达HSP22和叶绿体HSP26.分别为(6,7].有研究表明,HSP21能够保护PSII免受氧化胁迫,促进果实成熟过程中的颜色变化,并在果实成熟过程中叶绿体向色素母细胞的转化中发挥关键作用[8].
在高温胁迫下,热休克蛋白的表达被激活或增加。根据分子量和序列同源性,HSPs可分为5个家族,分别为HSP100、HSP90、HSP70、HSP60和HSP20 [9,10].其中HSP20蛋白分子量在15 ~ 42 kDa之间,属于小分子量的HSP20蛋白。在某些植物组织中,热休克蛋白20s占热休克蛋白的最大比例[9].HSP20S具有典型的保守结构域,称为α-结晶结构域(ACD),其含有保守的80-100氨基酸序列,紧凑的β-股结构和两个保守区域(CRS):Cr I,β2,β3,β4和β5;和β7,β8,β9和β6环的Cr II [11].HSP20s可以防止由环境压力引起的蛋白质损伤,并帮助它们折叠或降解[12,13].因此,HSP20S是细胞分子伴侣的重要部分。
在植物中,HSP20.基因参与了许多发育过程和对非生物压力的反应[14,15].在高温胁迫下,HSP20s能够阻止热变性蛋白的聚集和不可逆变性,保证其他蛋白在高温下能够正常发挥功能,为提高植物器官的耐热性提供了有力的依据。HSP20s已被证明位于线粒体、细胞质和内质网中[16].
的数量HSP20.植物中的基因大约是动物的四倍。17].例如,19,35,39,42,44,51个成员HSP20.基因家族分别在拟南芥中进行研究(拟南芥蒂利亚纳)[11),辣椒(Capsicum Annuum.L.)[18)、大米(奥雅萨苜蓿)[19)、西红柿(Solanum lycopersicum)[20.)、西瓜(Citrullus lanatus.L.)[21]和大豆(甘氨酸最大)[22].到目前为止,HSP20.葡萄中的基因家族成员尚未确定。因此,本研究旨在阐明葡萄的组成,基因结构,进化和表达HSP20.基因家族,试图表征结构和功能特征,并建立进一步利用植物HSP的基础。
结果
全基因组的识别VvHSP20葡萄基因家族
总计61VvHSP20通过隐马尔可夫模型(HMM)分析获得基因。通过将蛋白质序列提交给CDD,PFAM和智能数据库来确认ACD结构域的存在。没有典型的ACD结构域的序列被丢弃。在除去超过15-42kDa之外的分子量之后,总共保留48个序列并确认为葡萄Hsp20。关于这些HSP20S的物理化学性质的详细信息列于表中1.VVHSP20蛋白的长度从136(VVHSP20-47和VVHSP20-48)变化至365个氨基酸(VVHSP20-41);VVHSP20S的分子量为15.27kDa(VVHSP20-30)至40.59kDa(VVHSP20-41)。VVHSP20S的预测PI值范围为4.68(VVHSP20-41)至9.48(VVHSP20-20)。
系统发育分析VvHSP20基因
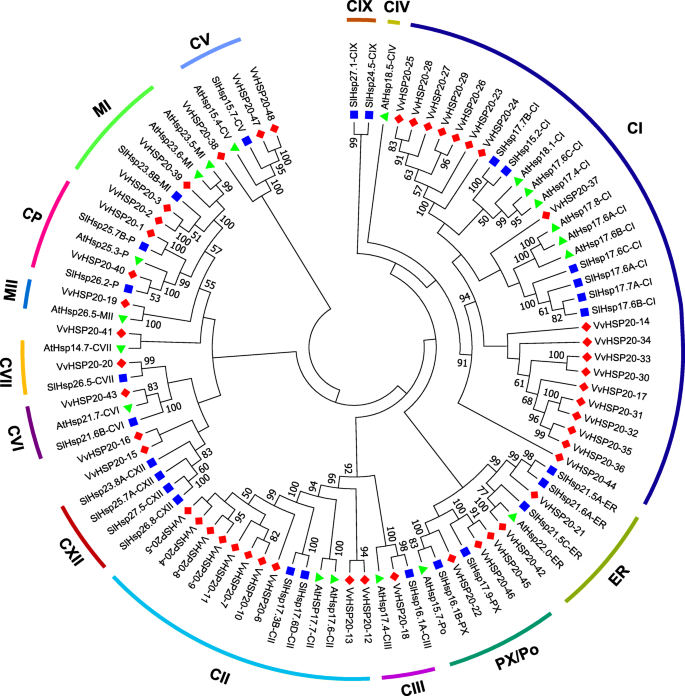
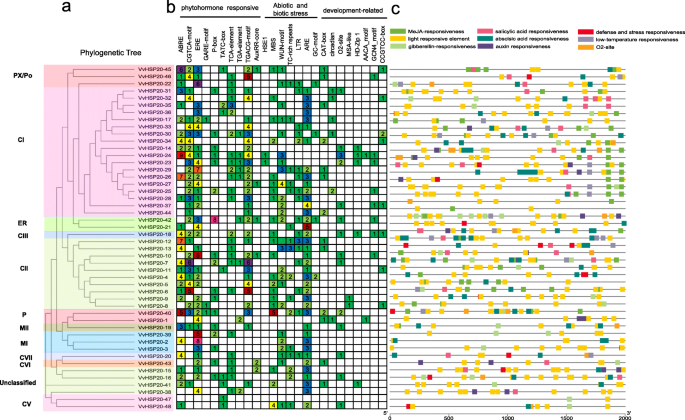
通过对葡萄、拟南芥、番茄(图2)中HSP20的氨基酸序列进行比对,构建了无根Neighbor-Joining (NJ)系统发育树。1).在系统发育树中评估总共来自拟南芥,26个来自番茄的序列和48个葡萄的序列。根据系统发育和亚细胞定位分析,将葡萄Hsp20蛋白分为11个亚壳(CI,C 1,CIII,CV,CVI,CVII,MI,MII,ER,CP和PX / PO)(图。1、表1).葡萄亚科的聚类与亚细胞定位基本一致,即同一簇内的蛋白质位于同一亚细胞位置。其中HSP20 6个亚家族(CI-CVI)、MTI和MTII亚家族、CP、ER和PX /Po分别定位于细胞质/细胞核、线粒体、叶绿体、内质网和过氧化物酶体。93个HSP20s被分为14个不同的亚家族,除了未分类的VvHSP20s (VvHSP20-15、VvHSP20-16、VvHSP20-38和VvHSP20-41),这些亚家族的亚细胞定位无法通过在线工具Protcomp预测。44株vhsp20s中有33株属于CI-CVII型,提示细胞质可能是植物HSP20s的主要功能位点。
VVHSP20S的氨基酸序列和基因结构的表征
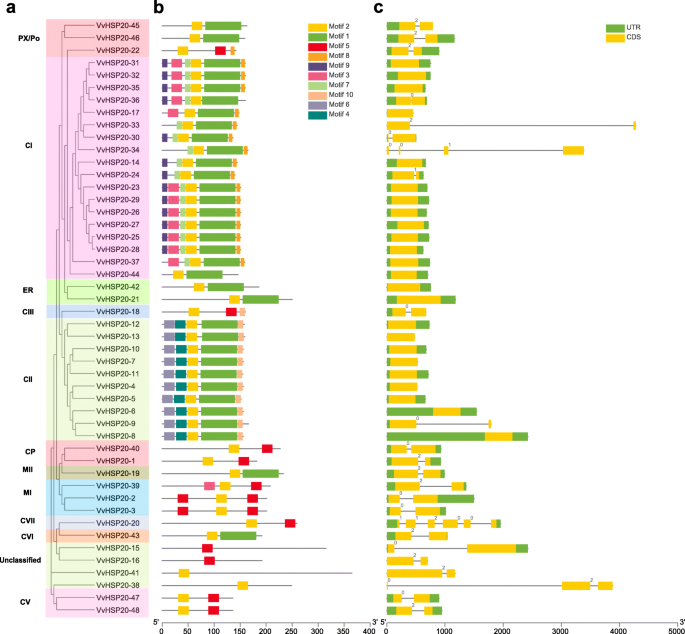
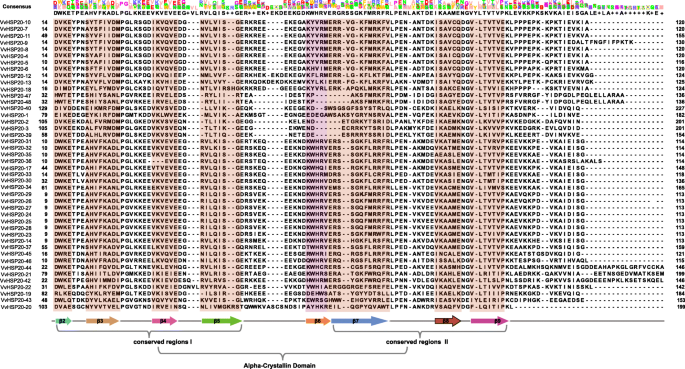
如图所示。2a, 48例VvHSP20s分为11个亚组,除未分类的HSP20 (VvHSP20-15、VvHSP20-16、VvHSP20-38、VvHSP20-41)外。经MEME网站鉴定,VvHSP20蛋白的10个保守基序列于表中2.这些保守基序的长度范围为6至60个氨基酸(图。2B,表格2).ACD由两个保守区域,β2,β3和β4的CRI和β7,β8和β9的CRI,由可变长度亲水区β6环分开(图。3.).vvhsp20 - 2,3,39,40,47和48缺乏β6环。VvHSP20-36缺乏β链。ACD结构域的不同组成说明了vhsp20s之间的功能多样性。系统发育树中同组的VvHSP20蛋白具有相同的motif,表明它们具有高度的保守性。
接下来,我们分析了基因结构,以便更好地理解HSP20s。在VvHSP20s24个基因(50.0%)无内含子,21个基因(43.8%)有1个内含子。VvHSP20-38(2内含子),VvHSP20-34(3个内含子),VVHSP20-20(5个内含子)有两个或更多内含子(图。2c).同一亚群的基因具有相同的内含子阶段,这表明该结构在进化过程中相当保守。
染色体定位与基因复制VvHSP20
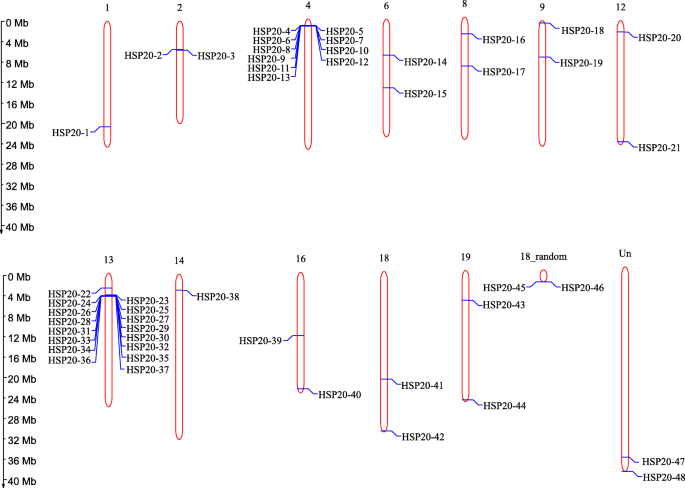
48.VvHSP20基因分布在12条葡萄染色体上。4).大部分的VvHSP20基因存在于染色体4(10个基因)和染色体13(16个基因)上,而剩余的10个染色体中的每一个具有一个或两个基因。串联和节段性重复均导致进化过程中基因家族的生产。因此,潜在的重复事件VvHSP20基因进行了分析。总共有四组VvHSP20基因(VVHSP20-2,3.;VVHSP20-4,5,6,7,8,9,10,11;VvHSP20-23, 24,25,26,27,28,29,30.,31,32,33,35,36和VvHSP20-47,48)被鉴定为串联重复基因(附加文件1:图S1)。此外,没有一个基因被认为是节段复制的产物。基于以上结果,我们推断串联复制在膨胀中起着重要的作用VvHSP20家庭在葡萄。
顺式元素的分析VvHSP20基因启动子
以了解顺式调节元件的可能作用VvHSP20,启动子序列(包含 - 2000bp的翻译开始站点上游)为48VvHSP20基因被提交到PlantCARE中检测顺式元件。鉴定出3类顺式元件,包括植物激素响应型、非生物和生物胁迫响应型以及植物发育相关顺式元件,如图所示。5.在三类顺式元素中,植物激素响应类别占最高比例。在该类别中,顺式作用元件广泛存在于启动子区中,包括促进响应(TGA元素和辅助核心),吉培素响应元件(GaRE-MOTIF,P盒和TATC盒),乙烯 -响应(ERE),MEJA响应(TGACG-MOTIF和CGTCA-MOTIF),脱落酸响应(ABRE)和水杨酸响应(TCA元素)。在这些元素中,ABRE和ERE占植物激素响应类别的最大部分。在非生物和生物应激响应类别中,应力响应相关的顺式元素,如HSE1(热应力),WUN主题(伤口响应元件),富含TC的重复(应力响应),LTR(低温响应)),是(厌氧诱导),并检测GC-MOTIF(缺氧)。在最后一个类别中,植物开发相关的元素,包括营商表达(CCGTCC盒和猫盒),昼夜节律,玉米蛋白代谢调节(O2-位点),细胞周期调节(MSA样),拨肉豆蔻培养细胞的分化(HD-ZIP 1)和endosperm表达式(AACA_MOTIF和GCN4_MOTIF)被识别出来。此外,大部分VvHSP20基因具有W box和MYB结合位点,包括ccaat -box。
的表达模式VvHSP20s回应h2O2治疗
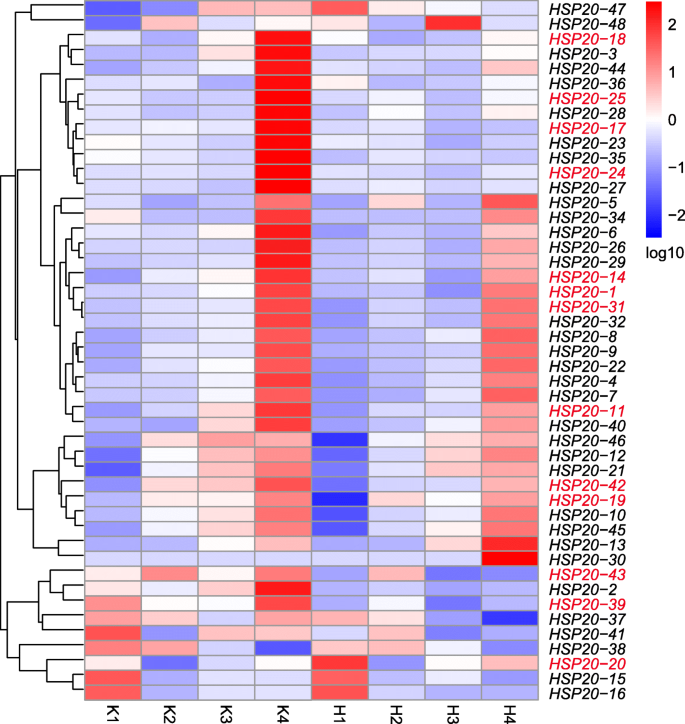
基因表达与功能之间有着密切的关系。确定…的功能VvHSP20s以葡萄为例,热图为47VvHSP20利用对照和H的RNA-Seq数据中的FPKM值构建基因2O2-处理过的‘巨穗’浆果(图。6,采样周期见材料与方法及表格3.).的表达水平HSP20-33在果实发育过程中,RNA-Seq值极低且无法检测到。大多数VvHSP20s在治疗后,尤其是第四期,出现了下调。然而,在一些基因中也观察到相反的趋势,包括HSP20-13,HSP20-20, 和HSP20-30.这些结果表明VvHSP20基因回应h2O2治疗,反应机制不同VvHSP20基因H2O2是不同的。
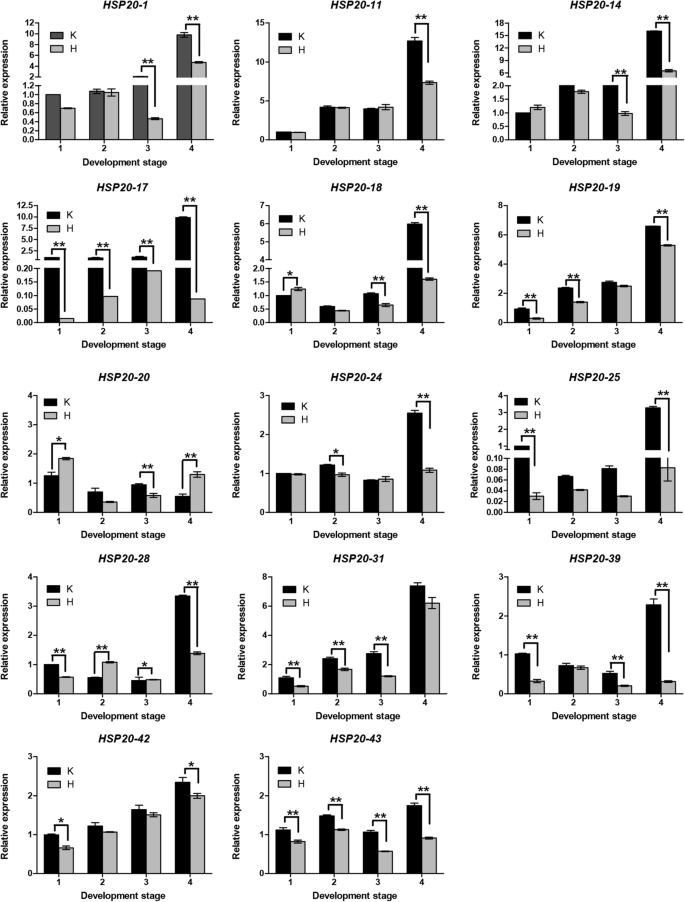
基于来自RNA-SEQ分析的基因表达水平的统计学意义及来自系统发育分析的基因簇的分配,14差异表达VvHSP20通过qRT-PCR对对照和H2O2治疗(图。7).与RNA-Seq数据一致,大多数基因在治疗后表达水平下降。除了HSP20-31,其余13个基因的相对表达量在第4期出现极显著的下调。值得注意的是VVHSP20-17和VVHSP20-25治疗后几乎没有表达。在串联重复基因组中显示了类似的表达模式(VVHSP20-25和VVHSP20-28).相似的表达模式表明,双链复制VvHSP20基因具有类似的功能和结构。CI子组的成员(VVHSP20-24,VVHSP20-25,VVHSP20-28, 和VvHSP20-31)治疗后具有类似的表达模式,这表明它们具有相似的功能响应H.2O2治疗。
aba相关基因对H2O2治疗
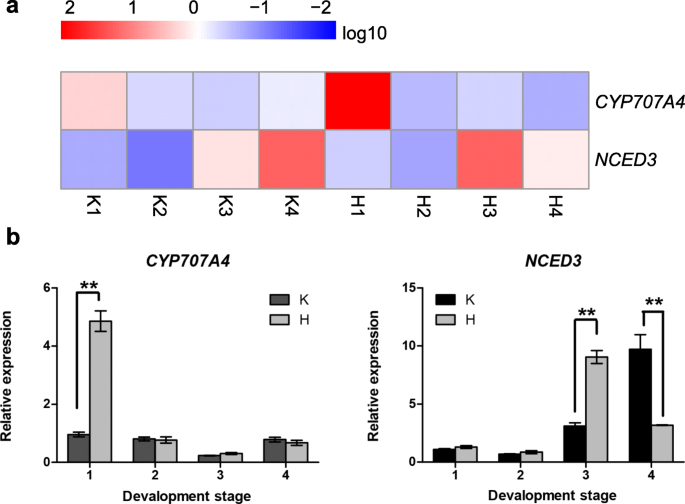
众所周知,ABA在葡萄中起着重要的作用[23,24].在前一项研究中[1], H2O2结果表明,处理能促进巨穗早熟果实的成熟。为进一步探讨ABA在这一过程中的作用,采用RNA-Seq和qRT-PCR检测ABA相关基因的表达分析。如图所示。8, ABA合成相关基因的表达模式(nced3.)和降解相关基因(CYP707A4H2O2治疗。与控制相比,表达水平nced3.在春季(H3期)达到最高,在春季(H4期)下降。相反,表达水平的高低CYP707A4基因在处理后迅速增加,在回春时达到最低水平。aba相关基因表达量的变化提示H2O2可以通过控制ABA分解代谢和生物合成来调节水果开发。
讨论
众所周知,果实成熟是由活性氧(ROS)的形成和抗氧化酶解毒之间的平衡调节的[25,26].ROS通过超氧阴离子(O2.-)和过氧化氢(H2O2)在果实成熟时[3.].H2O2不仅是一种应激诱导因子,也是一种信号分子。活性氧生成和去除之间的不平衡会导致需氧生物的氧化应激[27,28].关于H的研究2O2信号转导已经确定了一些由H2O2水平(29,30.].H.2O2-诱导基因,HSPs与防御或应激反应有关[5].然而,H2O2HSP20在葡萄浆果发育中的作用尚不清楚。因此,对这一问题进行了初步研究。
HSP20蛋白作为分子伴侣在植物生长发育中起着重要作用,抑制或减少胁迫下变性蛋白的不可逆聚集[14,15].虽然HSP20s以atp无关的方式阻止非天然蛋白的聚集和稳定[17,而HSP20s自身不能重新折叠非原生蛋白。Pea Hsp18.1必须与hsp70系统一起工作,以重新折叠热修饰蛋白[31].近年来,由于全基因组序列的可用性,HSP20家族已从植物中鉴定出来,如拟南芥[11], 番茄 [32)、大米(19]和大豆[22].然而,葡萄中的HSP20家族几乎没有研究。
通过综合方法来检测葡萄中的HSP20S,48个推定VvHSP20基因被确定。这些基因被分为11个亚群(CI、CII、CIII、CV、CVI、CVII、MI、MII、ER、CP、PX/Po)。之前的研究表明,12HSP20.从拟南芥(CI-CVII,MI,MII,ER,CP和PX / PO)中鉴定基因亚组[11,33].同样,来自水稻的4个新的核亚群(CVIII, CIX, CX,和CXI)也被报道[9].然而,水稻的CIV、CVIII、CIX、CX和CXI等几个亚群未被鉴定VvHSP20葡萄基因。一项研究证明了文明亚组可以参与应对不同的压力条件,并且可以在发育中调节[33].在正常生长条件下,CVIII亚组的成员可能是热诱导的,而CX亚组的基因可能与特定的家务功能有关[9].有趣的是,在胡椒植物中,发现HSP20 CIV,CV,CVIII,CIX,CX和CXI亚组被发现不存在[18].此外,水稻HSP20家族缺少CIV和CVII亚群[9].因此,很容易看出基因获得和丢失事件在植物物种中广泛存在。亚群的缺失可能是由于在进化过程中基因的丢失HSP20.基因。
基因结构在多基因家族的进化中起着至关重要的作用。我们的结果表明,大多数VvHSP20无内含子或只有一个短长度内含子的基因占93.8%。植物倾向于保留没有内含子或含有较短内含子的基因[34].这与之前关于胡椒的报道一致[18]和番茄[32,其中97.14和83.33%的HSP20基因没有短内含子或只有1个短内含子。大多数VvHSP20s在CII和ER亚群中没有内含子,这与胡椒、大米和大豆的同源性一致[18,19,22[葡萄中CI组的基因结构(外显子内含子)与这些物种中的那些不同,表明内含子模式可能不会在不同物种中保存。此外,大多数VVHSP20蛋白的稳定性指数大于或等于40,表明大多数蛋白质是不稳定的。不稳定被认为是应激响应性蛋白质的共同特征,也可能反映了快速诱导VvHSP20基因(35].
热休克蛋白(heat shock proteins, HSPs)的表达在高温胁迫下被激活或增加,在这种情况下,HSP20s在保护蛋白质聚集方面发挥重要作用[14].HSP20s不仅可以被热、冷、干旱和盐度等环境胁迫诱导,还可以被胚胎发生、种子萌发和果实成熟等多种发育过程诱导[22,36,37,38].在本研究中,表达VvHSP20sH2O2在果实发育过程中处理(图7),这与我们之前的研究结果一致,即过氧化氢可以促进巨穗葡萄的早熟[1].相似地,FaHSP17.4在“凤翔”草莓的叶子和花器官中高度表达,但在水果发展期间表述逐渐下降[36].此外,HSP表达在植物的特定发育阶段诱导。Hsp20s在Zygotic胚胎组织的发育阶段高度表达,以及在水稻和番茄的花粉成熟期间[9,39].的NJJS4基因是hsp20编码基因的一种,在草莓果实(草莓属xananassa花托)在成熟时[40].II类sHSP17.4几乎在果实发育的所有阶段都有表达,并在果实成熟后期保持较高水平,而II类sHSP17.6在转捩期达到高峰,I类HSP17.7在粉红期达到较高水平[41].四个差异表达HSP20.从番茄果(大小1706)的RNA-SEQ结果中揭示了基因,这被认为在水果发育中发挥着重要作用[42].这些结果表明HSP20s与果实发育有关。
ABA在促进果实成熟中起重要作用。在非更年期葡萄浆果中,ABA被认为是触发成熟相关过程开始的主要信号,因为它在版本达到峰值,伴随着浆果软化和皮肤变色的开始[43].ABA含量由内源ABA生物合成和分解代谢的动态平衡决定[44].先前的一项研究表明,9-独联体-环氧类胡萝卜素双加氧酶(NCED)是ABA生物合成的关键酶[45]和CYP707A (ABA关键降解酶)在草莓体内ABA分解代谢中起主要作用[46,47].NCED在aba介导的信号通路中发挥重要作用[45,48].为了进一步了解葡萄发育过程中过氧化氢和ABA之间的关系,我们分析了H后的ABA合成和降解相关基因的表达2O2治疗(图。8).在这项研究中,nced3.被发现在果实发育的早期阶段表达了低表达,但在对照中迅速增加了K4阶段。然而,它在Veraison达到峰值水平,然后在H4阶段迅速下降。这与ABA在水果开发期间的变化一致,因此ABA在Veraison阶段达到峰值水平并在此之后减少[49,50].ABA分解代谢和生物合成通过反馈和前馈环密切相关,以限制果实生长所需的ABA的量,并在果实成熟前迅速增加ABA的量[47].的CYP707A4基因在H1期高度诱导,然后逐渐减少,最后在H后veraison达到最低2O2治疗。之前的研究表明fvecyp707a4a.林地草莓果实发育的早期较高[47].这可能是由于高水平的ABA抑制早期果实生长[47,过氧化氢处理后ABA降解加快。
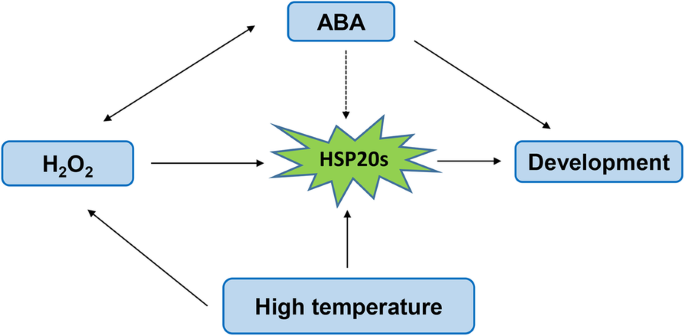
我们提出了HSP20s和ABA, H2O2果实开发和高温(图。9).在高温下,HSP20s被激活或增加[51].在我们的研究中,大多数HSP20s在h后果实开发期间受到了下调2O2治疗(图。7)和H2O2治疗促进了'kyoho'葡萄的早期成熟[1].此外,ABA在促进果实成熟中发挥着重要作用,认为ABA是触发成熟相关过程开始的主要信号。ABA的合成和代谢也受到H2O2(无花果。8).有趣的是,其他研究表明,ABA诱导H.2O2形成[52].然而,它的作用HSP20s在这个过程中,需要进一步探索。
结论
在这项研究中HSP20.全面鉴定了葡萄的基因家族。系统发育关系,基因结构,保守基序,和独联体-作用要素48VvHSP20通过RNA-Seq和qRT-PCR检测表达水平。根据系统发育树和亚细胞定位将48个HSP20分为11个亚科。的表达水平HSP20.H2O2通过qRT-PCR分析验证,为进一步的功能分析研究提供了基础HSP20.果实发育过程中的基因。最后,验证aba相关基因的表达水平。我们确认H2O2确实影响了ABA新陈代谢和表达HSP20.促进果实发育和成熟的基因。
方法
鉴定HSP20.葡萄基因组的基因
我们从Ensembl植物数据库下载了葡萄参考基因组组装和蛋白质序列(http://plants.ensembl.org/index.html.).葡萄HSP20.候选人根据HSP20 (PF00011)的HMM谱进行识别。CDD (https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)、Pfam及SMART (http://smart.embl-heidelberg.de/)用于进一步证实保守的HSP20结构域。最后,在除去HSP20的保守ACD结构域的冗余序列之后鉴定了48个HSP20S,分子量为15-42kDa。ProtParam在线工具(https://web.expasy.org/protparam/)用于预测Hsp20蛋白的物理化学性质。在线工具protcomp(http://linux1.softberry.com/)用于执行亚细胞定位预测。确定VvHSP20基因根据它们的Pseudomolecules上的位置命名[19].
系统发育分析HSP20.基因在植物
利用拟南芥和番茄的HSP20s和新鉴定的VvHSP20s的氨基酸序列进行系统发育分析。利用MEGA 7.0软件对HSP20s氨基酸序列进行多序列比对,以默认参数构建邻居连接系统发生树。
VVHSP20S的氨基酸序列和基因结构的表征
利用模因程序(4.11.2版本)鉴定了vhsp20s的保守基序。http://alternate.meme-suite.org/tools/meme),最佳基序宽度为6 ~ 200个氨基酸残基,最大失配量为10个。的结构VvHSP20利用TBtools软件鉴定了葡萄中的基因[53].
染色体定位与基因复制HSP20.基因
染色体定位信息VvHSP20基因来源于Ensembl植物数据库(http://plants.ensembl.org/index.html.),使用MapDraw V2.1工具生成染色体定位图像(http://mg2c.iask.in/mg2c_v2.0/).CAHSP20基因复制的定义基于先前的研究[54].重复事件和同步分析VvHSP20使用MCScanX(多重共线性扫描)检测基因[55]和Circos软件。
分析独联体元素在VvHSP20基因启动子
的独联体的上游2 kb启动子序列VvHSP20提交给Plantcare的基因(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)[56].
植物材料
Plant samples were collected from the farm of Henan University of Science & Technology, Luoyang, China in 2017. ‘Kyoho’ grape treated with distilled water (containing 0.03% silicon wet-77 surfactant) was naturally grown for 6 years as a control and treated twice with 300 mmol/L H2O2.第一次喷施时间为2017年花期后25 d,第二次喷施时间为35 d。开花后35天取样,待果实成熟后每10天取样一次2).此外,经过治疗的浆果在55 dpa达到了Veraison。从“kyoho”的5个个体藤中收集代表性的免疫样品。从每棵树中随机选择三十个样品,以记录水果发育的酚类数据。
RNA提取和实时荧光定量PCR (qRT-PCR)数据分析
采用RNAprep Pure Plant Kit (TIANGEN,中国北京)分离总RNA。采用HiScript®II 1st Strand cDNA Synthesis Kit (Vazyme, Nanjing China)总RNA逆转录获得cDNA。引物的VvHSP20基因由Primer Premier 5.0软件设计,并列入其他文件2S1:表。葡萄ubiquitin1基因用作参考基因[57,58],以K1表达水平为校准器。在CFX96 real-time PCR检测系统(Bio-Rad)中,使用TransStart Top Green qPCR SuperMix试剂盒(TRANSGEN, Beijing China),总体积为10 μL进行实时定量PCR。的相对表达变化VvHSP20s使用2计算基因——ΔΔCt方法,从三个独立的复制[59].采用SPSS 21.0版本,采用Duncan多重范围检验的方差分析(ANOVA)分析基因表达水平的统计学差异。
的FPKM值VvHSP20基因来自RNA-SEQ数据(加入码,SRA:PRJNA541089)。每次重复的平均FPKM值被转换为log10。Pheatmap(R包)用于产生热图。
数据和材料的可用性
在本研究中,利用葡萄基因组序列进行鉴定HSP20.基因从Enerembl植物数据库下载(http://plants.ensembl.org/index.html.).表达数据的VvHSP20从2020年5月5日起,可以通过NCBI SRA数据库以PRJNA541089的登录号访问该研究中使用的葡萄基因,因为在此之前,由于有一个补充手稿,禁止访问。在此之前,这些序列可从通信作者在合理的要求。
缩写
- 阿巴:
-
氨基酸
- ACD:
-
Alpha-crystallin域
- CRI:
-
守恒的地区我
- CRII:
-
守恒的地区二世
- HSP20S:
-
小热休克蛋白
- PSII:
-
拍照II
参考
- 1.
郭D-L,王Z-G,Li Q,Gu S-C,张G-H,yu Y-h。过氧化氢处理促进了九茶葡萄的早期成熟。Aust J葡萄酒Res。2019; 25:357-62。
- 2.
XI F-F,GUO L-L,YU Y-H,王Y,LI Q,ZHAO H-L等。“京o”与早期成熟芽突变体“凤枣”葡萄浆果开发中活性氧物种代谢的比较。植物理性生物化学。2017; 118:634-42。
- 3.
等。番茄果实成熟过程中氧化过程和抗氧化系统成分的变化。足底。2002;214:751-8。
- 4.
Chiriboga M,GinéBordonabaJ,Schotsmans W-C,LarrigaudièreC,再循环I.抗氧化储存期间的抗氧化剂潜力,响应于1-甲基环丙烯的保质期。lwt-food sci technol。2013; 51:170-6。
- 5.
Königshofer H, Tromballa H- w, Löppert H- g。高温胁迫信号在烟草BY2细胞中的早期事件涉及膜流动性的改变和过氧化氢生产的增强。植物学报2008;31:1771-80。
- 6.
Lee B-H,Lee H-S,赢得了S-H,Miyao M,Chung W-I,Kim I-J等人。水稻氧化应激叶绿体局部小型热休克蛋白的表达。基因。2000; 245:283-90。
- 7。
关键词:番茄细胞,线粒体HSP22,热休克蛋白,氧化应激,适应性反应植物j . 1998; 13:519-27。
- 8。
Neta-Sharir I,Isaacson T,Lurie S,Weiss D.番茄热休克蛋白21的双重作用:保护光源II免受奇差鲈鱼,促进水果成熟过程中的颜色变化。植物细胞。2005; 17:1829-38。
- 9。
水稻sHsp基因在胁迫和发育中的表达分析。BMC基因组学。2009;10:393 - 411。
- 10。
赵P,王德,王河,孔n,张c,杨c等。马铃薯Hsp20基因家族的全基因组分析:鉴定、基因组组织和热应激反应中的表达谱。BMC基因组学。2018; 19:1-13。
- 11.
引用本文:张志强,李志强,李志强拟南芥蒂利亚纳小热应激蛋白和含有α-晶域(ACD蛋白)的新的蛋白质系列。细胞应激伴侣。2001; 6:225-37。
- 12.
联邦人M-E,Hofmann G-e。热冲击蛋白,分子伴侣和应力反应:进化和生态生理学。Annu Rev Physiol。1999年; 61:243-82。
- 13.
华莱士E-W-J,Kear-Scott J-L,Pilipenko E-V,Schwartz M-H,Laskowski P-R,Rojek A-E等人。内源性蛋白质的可逆,特异性,活性聚集在热应激上组装。细胞。2015; 162:1286-98。
- 14.
水e-r。工厂SHSP的演化,功能,结构和表达。J Exp Bot。2013; 64:391-403。
- 15.
张志强,张志强,张志强,等。sHsps在组织胞质蛋白聚集和分解中的作用。细胞应激伴侣。2017;22:493-502。
- 16.
Mani N,Ramakrishna K,Suguna K.稻米小热休克蛋白的特征靶向不同的细胞细胞器。细胞应激伴侣。2015; 20:451-60。
- 17.
王志强,王志强,王志强,等。植物热休克蛋白的结构和功能研究进展。J Exp Bot. 1996; 47:325-38。
- 18。
郭敏,刘建军,卢建军,王华,龚震,等。辣椒CaHsp20基因家族的全基因组分析:热胁迫下的综合序列和表达谱分析植物科学学报2015;6:806。
- 19。
欧阳云,陈静,谢伟,王磊,张强。水稻Hsp20基因家族的综合序列及表达谱分析。中国农业科学(英文版)。
- 20。
于军,程勇,冯轲,阮敏,叶强,王锐,等。番茄Hsp20基因家族在生物和非生物胁迫下的全基因组鉴定和表达谱分析植物科学学报2016;7:1-14。
- 21。
他,风扇M,Sun Y,Li L.基因组 - 西瓜Hsp20s及其表达型材和亚细胞位置在应力下的基因组分析。int j mol sci。2019; 20:12。
- 22。
Lopes-Caitar V-S, de Carvalho M-C, Darben L-M, Kuwahara M-K, Nepomuceno A-L, Dias W-P,等。大豆Hsp20基因家族的全基因组分析:在非生物和生物胁迫下的综合序列、基因组组织和表达谱分析。BMC基因组学。2013;14:577 - 94。
- 23.
Sun Y,Liu Q,Xi B,Dai H.葡萄树中外源脱落酸的花青素生物合成调节研究。SCI Hortic-Amsterdam。2019; 250:294-301。
- 24.
脱落酸刺激赤霞珠葡萄果实的成熟和基因表达。功能整合基因组学。2010;10:367-81。
- 25.
果成熟突变体揭示了成熟过程中细胞代谢和氧化还原状态。原生质。2016;253:581 - 94。
- 26.
等。葡萄果实成熟的特征是皮肤中ROS的积累和脂氧合酶介导的膜过氧化。BMC Plant Biol. 2014;
- 27.
范得那比勒,卡翠恩V-D-K,达J,加吉夫I, Boonefaes T, Morsa S,等。过氧化氢诱导烟草基因表达的综合分析。中国科学院院刊2003;100:16113-8。
- 28.
Desikan R, mackeness AH。S, Hancock J-T, Neill S- j。氧化应激对拟南芥转录组的调控。植物杂志。2001;127:159 - 72。
- 29.
王林,郭勇,贾林,周胜。过氧化氢作用于一氧化氮的上游在热休克途径拟南芥幼苗。植物杂志。2014;164:2184 - 96。
- 30.
Desikan R,Clarke A,Hancock J-T,Neill S-J。H2O2激活地图激酶样酶拟南芥蒂利亚纳悬挂的文化。J Exp Bot. 1999;
- 31。
一个小的热休克蛋白与热休克蛋白70系统合作,重新激活热变性蛋白。植物杂志。2000;122:189 - 98。
- 32。
于军,程勇,冯轲,阮敏,叶强,王锐,等。番茄Hsp20基因家族在生物和非生物胁迫下的全基因组鉴定和表达谱分析植物科学学报2016;7:1-14。
- 33。
Siddique M,Gernhard S,Von Koskull-döringpP,Vierling E,Scharf K.该工厂Shsp Superfamily:拟南芥五个新成员,意外的特性。细胞应激伴侣。2008; 13:183-97。
- 34。
Mattick J-S, Gagen M-J。受控多任务基因网络的进化:内含子和其他非编码rna在复杂生物发育中的作用。生物学报2001;18:1611-30。
- 35.
Rao P-K,Roxas B-A-P,Li Q.使用杂化 - 线性离子阱 - 傅立叶傅立叶变换质谱法测定应力分枝杆菌细胞的全局蛋白质转换。肛门化学。2008; 80:396-406。
- 36.
帮派L,夏Z,卢Z,HOOCHENGZ.小型热休克蛋白的克隆与表达分析(FaHSP17.4)基因取自草莓果实(Fragaria Ananassa.).Mol Plant breeding . 2016; 14:328-36。
- 37.
wang P-S, wang P-B-K, wang P-B-K, wang P-B-K, wang J, et al. .大麦热激因子HvHsfB2c对小热激蛋白的调控作用及其在干旱胁迫响应和种子发育中的意义《公共科学图书馆•综合》。2014;9:e89125。
- 38.
Srivastava A,Gupta A-K,Datsenka T,Mattoo A-K,Avtar HK。番茄(Solanum Lycopersicum)果转录组的成熟和成熟阶段特异性调节。GM庄稼。2010; 1:237-49。
- 39.
Wehmeyer N,Vierling E.种子中的小型热休克蛋白的表达对离散的发育信号作出反应,并表明了在干燥耐受性中的一般保护作用。植物理性。2000; 122:1099-108。
- 40.
Medina-Escobar N, Cárdenas J, Muñoz-Blanco J, Caballero J- l。草莓果实成熟相关低分子量热休克蛋白mRNA的克隆及分子特征植物学报1998;36:33-42。
- 41.
丁超,王传英,Gross K-C, Smith D-L。茉莉酸甲酯和水杨酸甲酯降低番茄果实冷害和热激蛋白转录积累植物科学。2001;161:1153-9。
- 42.
ARCE D-P,KRSTICEVIC F-J,Bertolaccini M-R,Ezpeleta J,PONCE S-D,Tapia E.在番茄果实成熟过程中的小型热休克蛋白基因家族表达(RNA-SEQ)分析。ifmbe proc。2015; 49:679-82。
- 43。
吴斌辉,吴斌,罗卫东,等。浆果成熟:最近听到的小道消息。J Exp Bot. 2014; 65:4543-59。
- 44。
冷鹏,袁斌,郭永东。脱落酸在果实成熟中的作用及对非生物胁迫的响应。J Exp Bot. 2014; 65:4577-88。
- 45。
秦学强,Zeevaart J-A-D。9-顺式环氧类胡萝卜素裂解反应是水分胁迫下大豆脱落酸生物合成的关键调控步骤。美国国家科学院学报。1999; 96:15354 - 61。
- 46。
引用本文kishhiro T, Okamoto M, Nakabayashi K, Yamagishi K, Kitamura S, Asami T, et al.。的拟南芥细胞色素P450 CYP707A编码ABA 80羟化酶:ABA分解代谢的关键酶。EMBO j . 2004; 23:1647-56。
- 47.
刘博,李敏,于旭,子辉,等。ABA分解代谢和生物合成的相互连接的调节回路协调林地草莓果实的生长和成熟。中国科学院大学学报(自然科学版)2018;115:E11542-50。
- 48.
藤田y,yoshida t,yamaguchi-shinozaki k。富含血管介导的转录的ASB / ABF-SNRK2途径的关键作用,以响应植物渗透压的渗透胁迫。physiol植物。2013; 147:15-27。
- 49.
戴维斯C,BOSS P-K,罗宾逊S-P。用合成植物素的非整联果实处理绉浆,延迟成熟并改变发育调节基因的表达。植物理性。1997; 115:1155-61。
- 50.
研究了脱落酸生物合成基因的表达、脱落酸的积累与促进细胞凋亡的关系葡萄L.浆果用脱落酸催熟。Aust J Grape Wine Res. 2009; 15:195-204。
- 51.
赵鹏,王丹东,王荣强,孔宁宁,张超,杨春华,等。马铃薯Hsp20基因家族的全基因组分析:鉴定、基因组组织和热应激反应中的表达谱。BMC基因组学。2018;19:61。
- 52.
倪璐,付晓平,张辉,李旭,蔡旭,张萍萍,等。脱落酸通过H2O2并缓解Ca的抑制2+/ CAM依赖性蛋白激酶DMI3。植物细胞。2019; 31:128-52。
- 53.
TBtools是一种集成了多种生物数据处理工具和用户友好界面的生物学家工具箱。BioRxiv预印本。2018年,289660年。https://doi.org/10.1101/289660.
- 54.
李伟,陈峰,陈芳,李伟。果蝇、线虫和酵母基因组中基因重复的程度。生物化学学报2002;19:56 - 62。
- 55。
王颖,唐华,王旭东,等。MCScanX:基因共线性和共线性的检测和进化分析工具包。核酸学报2012;40:e49。
- 56。
Lescot M,DéhaisP,Thijs G,Marchal K,Moreau Y,Van de Peer Y等。Plantcare,植物数据库独联体-作用调控元件和启动子序列硅分析工具的门户。核酸学报2002;30:325-7。
- 57。
Downey M-O,Harvey J-S,Robinson S-P。Shiraz and Chardonnay葡萄浆料中黄酮醇和黄酮醇合成酶基因的表达(葡萄l .)。澳洲葡萄美酒2003;9:110-21。
- 58。
郭德龙,席芳芳,于永辉,张学勇,张国辉,钟国勇。鲜食葡萄‘巨穗’和早熟突变体‘丰早’果实发育的比较RNA-Seq分析BMC基因组学。2016;17:795 - 812。
- 59.
Schmittgen T-D,Livak K-J。用比较CT法分析实时PCR数据。NAT PROTOC。2008; 3:1101-8。
确认
我们要感谢我们实验室的所有同事,以提供有用的讨论和技术援助。我们非常感谢编辑和审稿人,以便他们对稿件的关键评估以及对稿件改进的建设性评论。
资金
基金资助:国家自然科学基金(no . 31672106);中原科技创新领军人物基金(no . 194200510007)。资助机构没有参与研究的设计、数据的收集、分析和解释以及手稿的编写。
作者信息
隶属关系
贡献
D-LG和X-RJ构思和设计实验;X-RJ进行生物信息学分析,撰写稿件草稿。X-RJ和P-YN通过qRT-PCR检测基因表达。D-LG, G-HZ和Y-HY对手稿进行了审阅和编辑。所有作者阅读并批准了最终的手稿。
通讯作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:图S1。
Syntenic之间的关系VvHSP20s基因。不同的颜色代表不同的染色体。不同颜色的线代表不同的串联复制基因。
附加文件2:表S1。
用于QRT-PCR反应的引物。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
ji,xr。,yu,yh。,ni,py。et al。小热休克蛋白的全基因组鉴定(HSP20.)基因家族及其在浆果发育过程中的表达谱。BMC植物杂志19,433(2019)。https://doi.org/10.1186/s12870-019-2031-4
已收到:
接受:
发表:
关键字
- 葡萄
- HSP20.
- 基因家族
- 基因组分析
- H2O2