摘要
背景
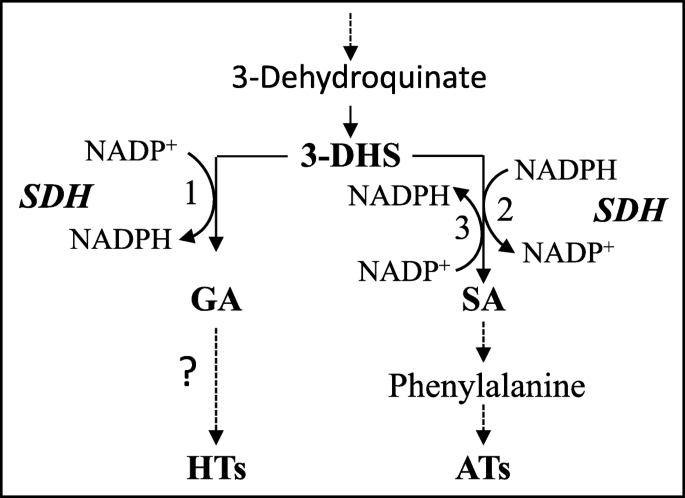
石榴的外果皮(石榴L.)具有两组具有健康有益特性的多种多酚:花青素(ATS,也影响剥离颜色);和可水解的单宁(HTS)。它们的生物合成在Shikimate途径中的3-Dehydroshikim(3-DHS)与Shikimate脱氢酶(SDH)的活性相交,其将3-DHS转化为Shikimate(在生物合成中提供前体)或无食酸(HTS的前体生物合成)使用NADPH或NADP+作为辅助因子。本研究的目的是获得更多关于规范HTS和ATS水平的因素的知识以及SDH的作用。
结果
结果表明,在阳光下的两个果实的外皮中,在33种石榴储存的外果皮中,ATS和HT的水平是负面相关的,在阳光下的两种水果中,以及由纸袋覆盖的那些。当从外果皮剥离获得的愈伤组织进行轻/暗处理和渗透胁迫时(通过不同的蔗糖浓度施加)时,结果表明,具有高蔗糖的光促进了ATS的合成,而在相同的蔗糖浓度下为黑暗促进合成HTS。验证SDH的角色,六PgSDHs(PGSDH1,PGSDH3-1,2.,PgSDH3a-1 2和PGSDH4)。的表达PGSDH1,这大概有助于莽草酸的生物合成,是在不同浓度的蔗糖相对恒定。然而,在转录水平PgSDH3s和PGSDH4与没食子酸和HTS的渗透胁迫,这显然积聚保护细胞从应力下的积累增加。
结论
结果强烈表明HTS和ATS的生物合成竞争相同的底物,3-DH,并且SDH活性不仅由NADPH / NADP调节+比例,也是由表达而来的PgSDHs。由于外果皮会影响顾客对水果消费的决定,因此这些知识可以用于开发新的遗传标记,培育具有更高水平的ATs和ht的石榴。
背景
石榴果(石榴L.)以其有益健康的特性而闻名[1]。这种促进健康的作用可归因于主要存在于果皮中的高浓度多酚,果皮中多酚的含量是可食用部分arils的300多倍,抗氧化活性是后者的40多倍[2,3.,4,5]。这些多酚作为(ROS)的活性氧的清除剂,并且与在应力有关的慢性疾病和与年龄相关的病症[减少有关2,3.,4,5,6]以前的研究表明,水解单宁(HTs)和花青素(ATs)是存在于外层果皮中的主要多酚[3.,4,5,7]。ATs是一种水溶性色素,通常导致许多水果和花朵的红色/紫色/蓝色,包括石榴假皮和果皮[3.,8]。这些化合物也在营养组织中产生,并保护植物免受环境胁迫,如渗透胁迫、干旱、紫外线照射和低温[9]。HTs是一种多酚类物质,其核心碳水化合物部分的部分或全部羟基与酚酸(如没食子酸或鞣花酸)酯化。据报道,三萜类化合物在人体中具有抗氧化、抗菌和抗癌活性[10]。在石榴中,HTs含有几种独特的化合物,包括punicalagins和punicalins的α和β异构体[11,12]。石榴皮中含有丰富的红石榴素异构体,石榴汁中50%以上的强抗氧化活性都来自红石榴素[3.,13]。它们还对健康有益,如诱导前列腺癌和甲状腺乳头状癌细胞的生长抑制和凋亡(例如,[14,15])。
ATs和ht的生物合成都与莽草酸途径有关(图。1) [8,16,17]。ATs由苯丙氨酸途径形成,苯丙氨酸是由莽草酸途径产生的芳香族氨基酸[18]。HTs生物合成始于没食子酸(GA) [16,17,19],认为是由莽草酯途径的一种酶——莽草酯脱氢酶(SDH)产生(EC 1.1.1.25) [16]。在植物中,SDH与脱氢醌酸脱水酶(DQD)结合形成双功能蛋白DQD-SDH,它催化shikimate途径中的第三(DQD)和第四(SDH)反应[20,21]。通过分析SDH的催化活性,发现在NADPH作为辅助因子存在的情况下,该酶能从3-脱氢莽草酸酯(3-DHS)中生成莽草酸酯,而在NADP存在的情况下生成GA+(无花果。1) [16]。之前的一项研究表明葡萄具有四种DQD/SDH同工酶(EC 4.2.1.10/1.1.1.25),它们与辅酶NADPH和NADP具有不同的亲和力+[22]。此外,酶活性分析表明VV.SDH1具有形成shikimate的能力,而VV.SDH3和VV.SDH4可产生GA [22]。
因此,细胞的氧化还原状态(NADPH/NADP)+3-DHS与莽草酸及其相关代谢物(如ATs)或GA及其衍生物(如HTs)的竞争分配。与这一假设一致的是,有报道称,高水平的ATs与低水平的punicalagins相关(而且反之亦然)在分析的29份石榴品种中[5]。然而,果皮中的ATs和ht并没有观察到这种相关性[5,显然是因为这些石榴的内皮和外皮是一起分析的。考虑到ATs存在于外果皮中而不存在于内果皮中,尚不清楚在石榴外果皮中是否存在ATs和HTs的负相关关系,这两种化合物都是丰富的。
本研究的目的是:(i)了解石榴外皮中ATs和ht的分布情况;(ii)研究DQD/SDH在该果段HTs和ATs积累中的作用;(iii)揭示环境条件如何影响表达DQD / SDH基因和代谢物水平在石榴的果皮外。解决这些目标是非常重要的,因为高水平的AT规范,吸引消费者购买果皮的颜色,而高水平的HTS都涉及到一些果皮的缺陷的减少,如稻壳烫伤[23,24]。这些数据还可以帮助育种者在生产具有高水平HTS和ATS的水果中。
结果
33份石榴果皮中ATs与ht呈负相关
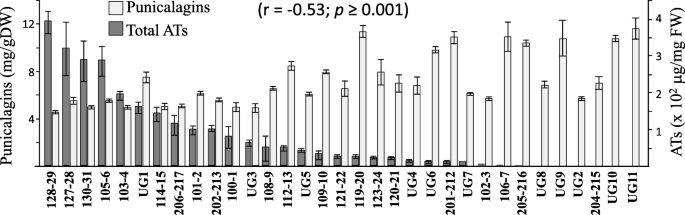
为了确定石榴果皮中HTs和ATs的水平是否存在负相关关系,我们检测了33份不同石榴果皮中总ATs和punicalagin的水平(图2)。2).其中22份样本是从Neve Ya 'ar研究中心的一个农场收集的,这些农场以前也检测过这些化合物的水平[5]。此外,还对从上加利利的一个种植场收集的11份材料(UG材料)进行了分析。用去皮机去皮后,用高效液相色谱(HPLC)法测定紫红皂苷的两种同分异构体的含量,用分光光度计分析总ATs的含量。果皮中总at含量范围为0 ~ 380 μg/ g鲜重(FW),果皮中紫红素含量范围为4.3 ~ 11.9 mg/g鲜重(图2)。2).总ATs与总紫菜素的相关分析显示显著负相关(r =−0.53;p≥0.001)。
当果皮内酯的生物合成途径受到物理抑制时,果皮内酯的含量与果皮内酯的含量呈反比关系
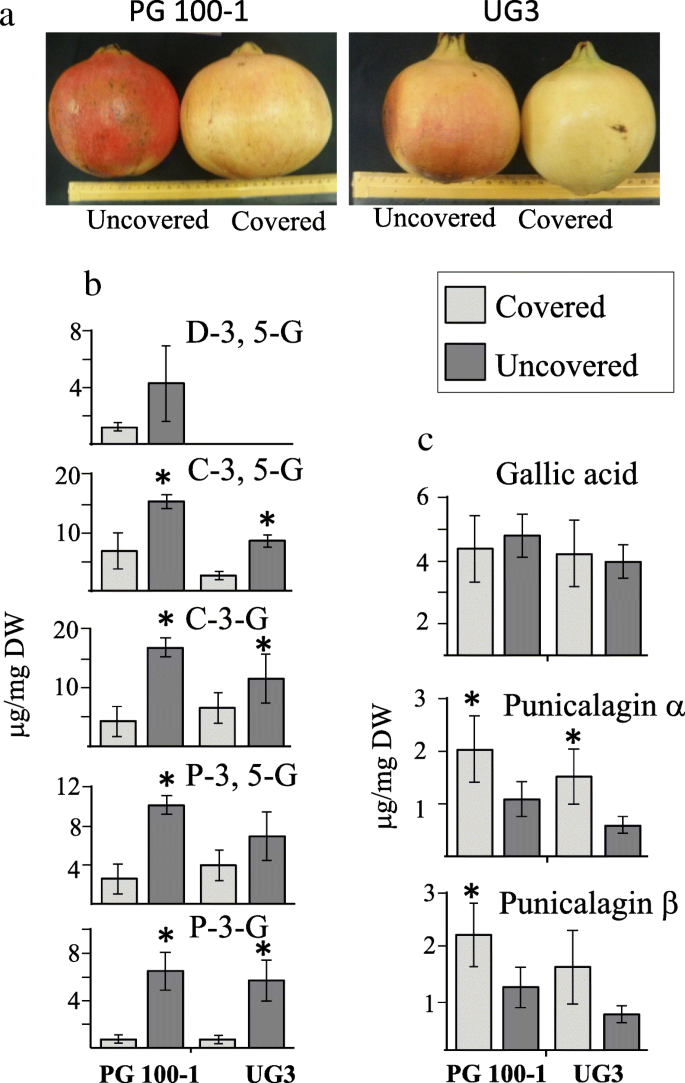
研究发现,阳光诱导果实中ATs的积累,保护果实免受光抑制和光漂白[25]。事实上,在树荫下生长的石榴果实的红色没有在树的边缘生长的那么强烈,因为树的边缘暴露在阳光下。为了研究阳光诱导AT生物合成时ATs和HTs的积累,我们测定了PG100-1和UG3(两种果皮颜色为红色的植物)果实中ATs和HTs的分布。为防止暴露在阳光下,PG100-1和UG3的7个果实用纸袋覆盖约2个月(8月1日至10月2日),另外7个大小相近的果实作为对照。所有选择的果实都位于石榴树的外冠层,在树的相似位置。
被盖水果的果皮比太阳照射的水果的红色外观要少。3.a).采用HPLC-DAD-TOF-MS对PG100-1和UG3外皮中的ATs谱进行鉴定和定量。在PG100-1和UG3中均检测到花青素3-葡萄糖苷、花青素3,5-二葡萄糖苷、天竺葵3-葡萄糖苷和天竺葵3,5-二葡萄糖苷,而在PG100-1中仅检测到飞翠素3,5-二葡萄糖苷(图1)。3.b).在PG100-1中,与对照相比,袋装水果中唯一未显著降低的AT是飞燕草苷3,5-二葡萄糖苷(图1)。3.b)。在四个检测的AT,矢车菊-3-葡萄糖苷,花青素3,5-二葡萄糖苷的水平和花葵素-3-葡萄糖苷在UG3加入显著降低。在被覆盖的水果不同于AT的在覆盖果皮缩小积累,punicalagin异构体的水平增加2至2.4倍(这是在PG100-1和微不足道统计学显著在UG3为punicalaginβ)(无花果。3.c).在这两种材料中,赤霉素的含量在日晒和覆膜的果实之间没有显著变化。3.c)。
在剥离的愈伤组织培养物中观察不同生长条件下的AT和HTS之间的逆相关
为了进一步研究ATs和ATs之间的负相关关系,以及了解非生物胁迫和不同生长条件对ATs和ATs含量的影响,我们以果皮颜色为红色的accession uug28为材料进行了外部果皮培养[26]。此培养物的优点是,它是在不脱离位于外剥离的细胞以外的其他组织接收分子信号和代谢物的分离的系统。以获得用于实验足够组织,剥离培养物生长在MS培养基3个月含有1%蔗糖的黑暗条件下[26]。随后,将约1克愈伤组织转移到添加不同浓度(1、2.5、5%或7.5%)的蔗糖的MS平板上,这些蔗糖在高浓度下会导致渗透胁迫,并将平板置于光照或黑暗中。每两周转移一次,持续75天,在黑暗条件下,在1%蔗糖中生长的愈伤组织呈现灰色,而在光照条件下生长的愈伤组织由于叶绿素积累呈现绿色3.:图S1)。在2.5%蔗糖的光下愈伤组织中观察到红色斑点和斑块,其增长5%,但在7.5%的蔗糖中减少(附加文件3.:图S1)。暗培养的愈伤组织在含1-7.5%蔗糖的培养基中呈浅灰色至深灰色(附加文件)3.:图S1)。
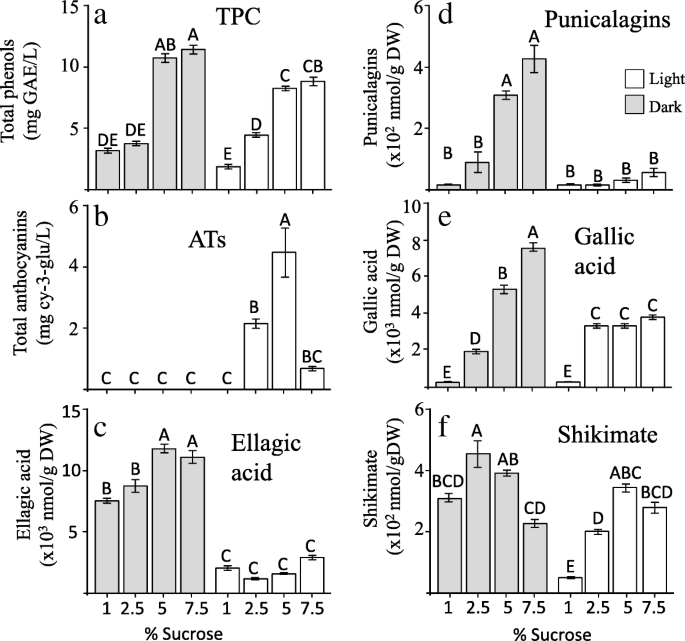
在所有处理中,以5%蔗糖处理的愈伤组织的干重最高,光照和黑暗处理的愈伤组织的干重无显著差异(附加文件)3.:图S2-S3)。由于高浓度的蔗糖导致渗透胁迫,因此我们还测量了这些样品内的水含量,并显示出水含量从2.5%蔗糖减少介质中的蔗糖增加(附加文件3.:图S3)。在黑暗和光照条件下,蔗糖浓度越高,总酚含量(TPC)的水平就越高,但在含有5和7.5%蔗糖的培养基中,TPC的水平在黑暗中显著高于在光照条件下(图2)。4a).然后使用HPLC-DAD分析苯酚图谱。该分析鉴定和定量的鞣花酸,赤霉素,莽草酸和紫红素的异构体的水平属于ht。在愈伤组织中,这些化合物和主要punicalagins的含量比在原始的表皮UG28中发现的含量低约15倍,先前也显示了来自UG25的愈伤组织[26]。结果(图。4结果表明,相对于光,黑暗增加了鞣花酸的含量,在高蔗糖水平下,也诱导了GA和punicalagins的积累。光照条件下,培养液中蔗糖浓度为1 ~ 5%时,莽草酸和ATs水平显著升高。而在黑暗条件下,当蔗糖浓度从2.5增加到7.5%时,莽草酸水平显著降低,GA、鞣花酸和紫红素水平显著升高,这强烈说明在培养基中蔗糖浓度较高时,ATs和HTs呈负相关关系。
利用HPLC-DAD- TOF-MS在光照下生长的愈伤组织中鉴定出5种不同类型的ATs,就像我们在果皮中检测到的一样(附加文件)3.:图S4)除天竺葵素3,5-二葡萄糖苷外,其他四种ATs在5%蔗糖中的含量最高,这与ATs的总含量一致。培养物中的两种主要ATs为氰基3-葡萄糖苷和氰基3,5-葡萄糖苷。这些结果表明,光/暗和蔗糖浓度显著影响SDH活性,从而确定了SDH的途径导致HTs和ATs的Y。
氨基酸水平的变化及组织培养细胞的代谢分析
为了了解不同生长条件对果皮愈伤组织代谢谱的更广泛的影响,采用GC-MS测定了来自shikimate途径的芳香族氨基酸(苯丙氨酸、酪氨酸和色氨酸)和其他氨基酸的水平。苯丙氨酸和色氨酸在1%蔗糖中浓度最高,随蔗糖浓度的增加而逐渐降低。相比之下,酪氨酸水平有增加的趋势,最高水平为5%蔗糖,主要是在光照下(附加文件3.:图S5;额外的文件2:表S1)。苯丙氨酸和色氨酸水平的降低与TPC水平的升高相反,表明这两种氨基酸在渗透胁迫下被用于各种多酚化合物的合成。
与后两种氨基酸类似,在光照和黑暗条件下,在蔗糖浓度为5和7.5%时苏氨酸、蛋氨酸和异亮氨酸水平较蔗糖浓度为1-2.5%时下降,而缬氨酸和亮氨酸水平仅在黑暗条件下下降。培养基中脯氨酸、赖氨酸、丝氨酸和丙氨酸水平随蔗糖浓度的增加而升高。与黑暗相比,后两种氨基酸的含量在光照下会增加。当培养基中蔗糖浓度为2.5和5%时,总可溶性氨基酸显著增加,且光照条件下的含量高于黑暗条件下的含量2:表S1)。
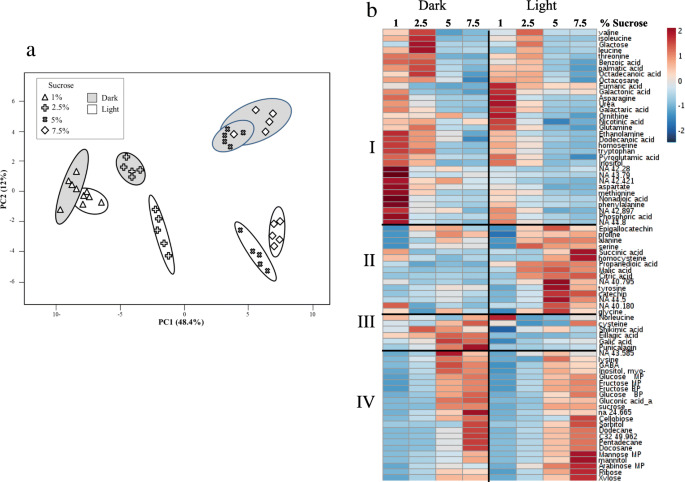
还研究了不同生长条件对其他代谢物水平的影响(附加文件)2:表S2)。GC-MS共检测到76个代谢物,其中10个代谢物尚未标注。采用主成分分析(PCA)揭示哪些因素主要影响这些代谢物的积累。培养基中暗/光与蔗糖的相互作用往往表现出明显的差异。PC1代表48.4%的方差是由培养基中的蔗糖水平引起的,而PC2代表12%的方差主要是由光照/黑暗条件引起的(图2)。5a) 这一结果意味着这些非生物胁迫对培养物的主要代谢组产生了相对强烈的影响。热图分析进一步揭示了这些代谢变化的细节。总共检测到四组代谢物(图。5b).簇I(上图)和簇IV(下图)显示了高蔗糖对代谢物水平的影响。在高蔗糖条件下,I组的代谢物含量降低,而IV组的代谢物含量升高。第一组的代谢物包括几种脂肪酸、氨基酸和糖类,而第四组的其他糖类如果糖、葡萄糖、蔗糖、阿拉伯糖和糖醇(包括山梨醇、甘露醇和肌醇)的含量较高,众所周知,这些糖的含量在渗透胁迫下会增加[27]。簇II和簇III(图。5B)表明光照/黑暗对代谢物水平的影响。聚类II的代谢物在光照条件下随着培养基中蔗糖含量的增加而增加,而聚类III的代谢物则主要在黑暗条件下随着培养基中蔗糖含量的增加而增加。集群II(无花果。5b)中的特征在于,由是三羧酸循环(TCA)的中间体,例如苹果酸盐,琥珀酸盐和柠檬酸盐的代谢物,也被认为是相关的应力,如脯氨酸,丝氨酸,丙氨酸和甘氨酸(图氨基酸。5b).簇III含有与hts相关的代谢物,如莽草酯、GA、鞣花酸和紫金花素。
对整个数据集的所有代谢物进行相关性分析表明,在渗透胁迫下趋于增加的代谢物(糖和几种氨基酸,如脯氨酸、GABA、赖氨酸、丝氨酸、丙氨酸、甘露醇和肌醇)呈正相关(附加文件)3.:图S6)。然而,它们与其他代谢物如芳香和天门冬氨酸家族氨基酸以及在低渗透胁迫下含量较高的几种氨基酸呈负相关(附加文件)3.:图S6)。
蛋白质的鉴定和表征PgSDHs在石榴
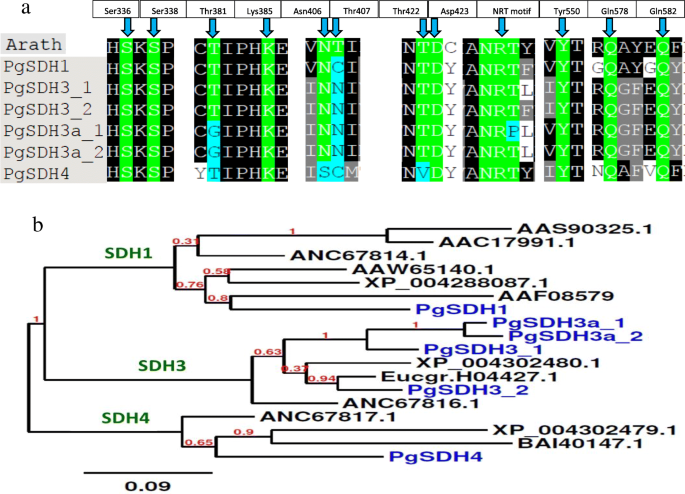
研究DQD/SDH在确定GA/HTs和ATs生物合成中的作用诉酿酒用葡萄DQD / sdh从石榴数据中确定[8,28,29,30](见在附加文件的转录序列1).SDH有五种类型诉酿酒用葡萄[22基于SDH结构域的关键氨基酸拟南芥蒂利亚纳(AtSDH [31];)。因此,与确定的氨基酸的比对分析诉酿酒用葡萄,发现在6个PgSDH中,PgSDH1和PgSDH4只有1个同工酶,PgSDH3有2个同工酶(−1和−2),另外2个PgSDHs有PgSDH3基序,以及表征PgSDH5的三个基序中的一个[22] (无花果。6一个;额外的文件1).因为VvSDH2表现出非常低的‘经典’SDH活性相比于其他VV.SDHs [22],并且由于PgSDH2的(最接近VvSDH2)将序列显著截断,PGSDH2.在本研究中没有进一步审查。
(一个)拟南芥和石榴DQD/SDHs SDH结构域关键氨基酸比较。T-Coffee试验进行蛋白比对。氨基酸的编号是基于DQD/SDH拟南芥蒂利亚纳(AtSDH;[31]). 绿色代表拟南芥蛋白质的活性位点残基。石榴序列中各个位置的相同氨基酸也以绿色突出显示;当它们不同时,将以浅蓝色亮显。(b系统发育树由PgSDHs公共数据库中有12个植物SDH序列。PgSDHs以蓝色突出显示。绿色字母所示的聚类是根据Bontpart等人提出的分类[22]。系统发育分析采用邻域连接法phylogeny.fr,每个站点0.1取代。用于该分析的序列是的诉酿酒用葡萄((22];登录号ANC67814,ANC76816,ANC67817);胡桃regia(Jr [16];加入AAW65140数量);尼科尼亚塔哈瓦姆(新界)[32]; 注册号AAS90325);Diospyros柿子(Dk, [33];加入BAI40147数量);草莓属vesca(FV,[34];登录号:XP_004302480, XP_004302479, XP_004288087);桉树sp。(例如,[35];加入Eucgr.H04427.1数量);Solanum lycopersicum(Sl)注册号AAC17991;以及拟南芥蒂利亚纳加入AAF08579数量。登录号对应于NCBI或Phytozome 12数据库
这六个序列的系统发育树显示,这些基因编码的蛋白质按预期分为三个簇(图)。6b),如前所述诉酿酒用葡萄的SDHs [22]。由于具有PGSDH3和PGSDH5基序的两个PGSDH在PGSDH3的同一群体中被分组,我们称这两个序列PGSDH3A( - 1和-2)(图。6b).对它们的蛋白质序列进行Blast和alignment分析,确实显示它们有很高的相似性(附加文件)1).例子是PgHDS3a-1,其具有89.4%的同一性,和92.7%的相似性PgSDH3-1之间的比较。
PgSDH1蛋白序列,PGSDH3.,PgSDH3a和PgSDH4与AtSDH1有65-75%的相似性,AtSDH1是植物中唯一的DQD/SDH答:芥.这三个PgSDHs类似于其相应的VvSDHs [22]。VvSDH4与PgSDH4相似性82.2%,相似性90.7%;VvSDH3与PgSDH3相似度为83.1%,相似度为91.9%;VvSDH1与PgSDH3相似度为76.4%,相似度为87.8%1).除PgSDH3-2外,所有PgSDHs的n端均不含转运肽序列,提示其在胞质中起作用,而在胞质中起作用PgSDH3-2有望定位于质体(附加文件1).
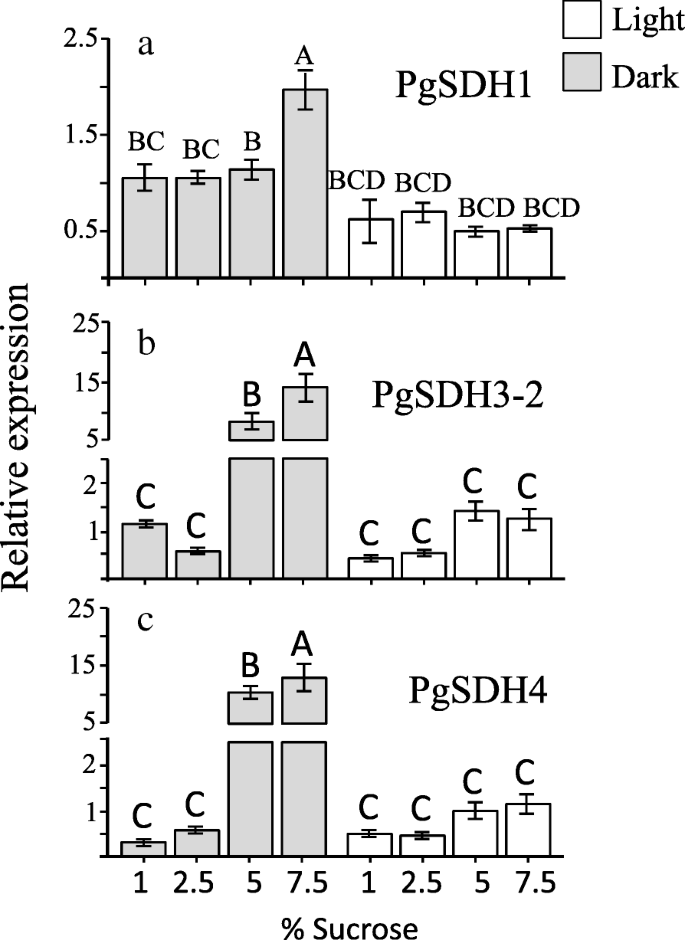
确定表达之间的关系PgSDHs以及果皮愈伤组织中HTs和ATs的水平PGSDH1,PgSDH3-2和PGSDH4采用RT-qPCR分析(图。7).RT-qPCR检测PgSDH3-1和PgSDH3a-1但只有在光/暗条件下在2.5和5%蔗糖浓度下生长的愈伤组织(附加文件3.:图S7)。表达水平PgSDH3a-2没有确定,因为它的序列非常相似PgSDH3a-1(95.7%的身份;97.3%相似度)(附加文件1),因此我们无法区分这两个同工酶,也因为我们没有这些基因的非翻译区序列。结果(图。7;额外的文件3.:图S7),表明总体上,表达水平PGSDH3,PGSDH3一个和PGSDH4有增加的趋势与培养基中增加蔗糖。这些升高5是在黑暗中显著更高和7.5%蔗糖的浓度比在光(图7).PGSDH1而在7.5%的蔗糖中,在黑暗条件下表达量最高,说明其在黑暗条件下表达量高于在光照条件下。然而,在含1 ~ 5%蔗糖的培养基中,其表达水平没有显著变化(图5)。7).在黑暗条件下,7.5%蔗糖处理的愈伤组织的表达量比1%蔗糖处理的愈伤组织的表达量高2、15和35倍PGSDH1,PgSDH3a-2和PGSDH4分别(图。7).这表明,渗透胁迫触发这些基因的表达水平,并且这种作用将得到进一步增强在黑暗中比在光。当其中的表达水平PgSDHs进行比较HTS和AT的水平,它表明PGSDH3.(− 1.,-2),PgSDH3a(−1、2), 和PGSDH4有一个相对类似的模式HTS和TPC的水平,不像PGSDH1.
讨论
本研究表明,大部分石榴果实外果皮中HTs与总at呈负相关关系。(1) 33份石榴果皮中高温温度与ATs呈负相关关系(图2)。2);(ii)在光照条件下和不光照条件下,果皮褐藻素与ATs的负相关关系(图2)。3.);(iii)在渗透胁迫下,与黑暗相比,在光照条件下生长的果皮愈伤组织中,ATs增加,GA、鞣花酸和punicalagin降低。4).除了之间HTS和ATS中的负相关,出相反的趋势是在GA和莽草酸之间在补充有2.5-7.5%蔗糖的MS培养基上黑暗中生长果皮的愈伤组织中发现。这些观察结果表明DQD / SDH的在分隔共同前体3- DHS GA合成之间(前体用于高通量筛选的生物合成)和莽草酸(的AT生物合成提供前体)中起关键作用。这也表明,生物合成途径,导致争夺他们共同的前体,3-AT的国土安全部和HTS。然而,存在除了AT的许多其他莽草酸途径衍生的代谢物,如黄酮类化合物,缩合单宁和木质素(由审查[18,21]),这可能至少部分地解释了为什么在33个物种的表皮中高温温度与ATs之间的相关性(尽管它很重要)只是p>−0.53。
尽管我们的研究结果与之前的研究一致,表明由莽草盐衍生的GA是高温合成的主要前体[16,18,22,我们不能排除其他途径也参与GA合成的可能性。推测GA可能是由紫丁香酸、木质素和ATs等多酚的中间代谢物产生的[36,37]。事实上,有人提出,在石榴叶内种皮和果皮发育的早期,GA是由紫丁香产生的,而在其他器官和这些器官的后期,GA主要是由shikimate产生的[30]。石榴中GA的合成至少有两条途径,这一发现暗示了它的重要作用。GA是在不产生ht的植物中产生的,这也暗示了它在一般植物中的额外作用。事实上,据报道GA是简单酚中最有效的抗氧化剂[36],并已被鉴定为一种由根系分泌的化感化合物,抑制相邻竞争植物的根系生长[38]。此外,GA可转化为化合物,如没食子酸-葡萄糖苷(在发育过程中用作信号)、表皮炎素和表皮炎素3- o -没食子酸酯[35]。它的水平也依赖于它的降解,因为GA被用来产生丙酮酸和草酰乙酸,这两种物质都是参与多种途径的关键成分,包括三羧酸循环[38]。研究发现,GA的含量在有盖和无盖的石榴果实中保持相对稳定(图。3.),而石榴素含量的变化表明GA在石榴外皮中也起着额外的作用,因此其含量与石榴素的负相关关系并非微不足道。
NADPH/NADP的假定来源+为PgSDH活动
之前建议NADPH / NADP之间的比率+,SDH的辅助因子规范其对GA的活动(当NADP时+(当NADPH水平高时)[16]。NADPH可通过叶绿体、细胞质和线粒体等多种途径在植物细胞中形成39,40]。维持胞质NADPH的主要途径是氧化戊糖磷酸途径(OPPP),其中NADPH在从葡萄糖-6-磷酸向6-磷酸葡糖酸内酯的转化产生,和从6-磷酸转化成核酮糖-5-磷酸.在线粒体中,NADPH可通过从线粒体柠檬酸衍生的胞质NADP-异柠檬酸脱氢酶使用碳的活性来形成,从在光叶绿体建议出口还原剂丙糖磷酸梭,并从柠檬酸阀从出口NADPH光呼吸条件下线粒体([39]及其参考文献)。在叶绿体中,NADPH来源于铁氧脱氧蛋白- nadp的反应+光合作用电子传递链最后一步的还原酶[34,38]。
在上述NADPH生成途径中,OPPP被发现在植物的胁迫反应中起主要作用[41]。OPPP可在质体和细胞质中作用。在质体中,OPPP(在黑暗中)和Calvin循环(在光明中)都产生红-4-磷酸,它与糖酵解产生的磷酸烯醇丙酮酸一起,作为莽草酸途径的前体[18]。此外,强烈提示NADP增加+主要发生在逆境中的/NADPH比值增强了OPPP活性,提供了在逆境中保护植物所必需的酚代谢物需求增加所需的前体[42,43]。我们的结果与那些研究一致。观察到在渗透胁迫下黑暗生长的愈伤组织中TPC和HTs水平升高,进一步暗示了NADP+/ NADPH比率增加,这最终导致了增强的多酚和从GA特异性高温超导合成,以保护从所述的渗透胁迫的愈伤组织。
角色PgSDH在分支点导致GA和莽莽
根据石榴数据集,六PgSDHs其中两个被称为pgsdh3a.在该酶活性位点上定义的序列中有新的氨基酸组合(基于[22,31]),而且据我们所知,还没有在其他植物的sdh中报道过。Youan et al.(2018)也报道了6个PgSDHs石榴基因组中的同工酶[29]。虽然他们没有发布序列,但它们表明三个是串联的,并且在100kb地区重复并位于果实发育过程中表达下降,与观察结果相一致,即在石榴果实期间HTS的水平也降低也减少发展 [8]。另外两个SDH基因也同时存在[29]。这些发现与他们之间的高度同一性是一致的PGSDH3.和pgsdh3a.,它们很可能是串联的。进一步的研究可以澄清这个问题。
的研究VV.SDHs表明,VV.SDH1表现出最高的SDH活动形成莽草酸,但并没有将3-国土安全部GA [22]。VV.SDH1在成熟期开始前后均有高表达,表现出相对的稳定性VV.SDH3和VV.SDH4,其在未成熟浆果组织中的表达水平明显较高[22]。相似VV.SDH1,PGSDH1表达是相对稳定的(除了在当其电平增加显著暗7.5%蔗糖)中,这表明PGSDH1可能有活性形成莽草酯,并可能使用由OPPP形成的NADPH,因为它被预测位于胞质中。
提出,植物中的Shikimate途径主要在转录水平下进行调节[20]。也有报道称莽草酯途径基因的表达对非生物和生物胁迫作出反应[43]。的确,文字记录PgSDH3-2和PGSDH4相比愈伤组织放置在1个%蔗糖(图15-增加和35倍,分别在生长的愈伤组织在7.5%蔗糖的培养基。7).这海拔发生在黑暗中,其中GA和HTS的显著较高浓度的积累,表明的活动PGSDH3.,pgsdh3a.和PGSDH4可能导致合成保护细胞免受渗透胁迫所需的酚类物质。自PgSDH3-2有质体过境肽,主要利用NADP+在黑暗中积累在质体中,而PgSDH3-1,pgsdh3a.和PGSDH4使用这种主要在压力期间积累的辅助因素[40]。
本研究的结果与其他研究一致,表明SDH组3或4的成员在草莓、桉树等ht含量高的植物中高表达,或在茶树、葡萄、柿子等植物中无糖基黄烷-3-醇高表达[22,44]。相比之下,不含SDH3和SDH4的物种,如拟南芥、烟草、番茄和橘子,不产生HTs和没食子酸单宁[22]。他们在葡萄浆果体外运动的测量确实表明了这一点VV.SDH3和VV.SDH4表现出高的GA形成活性和低的'经典' SDH形成shikimate活性[22]。此外,葡萄果实发育过程中GA和没食子苷(如没食子苷黄烷-3-醇)的形成与葡萄果实的相关表达模式是同步的VV.SDH3和VV.SDH4。此外,表达VV.葡萄毛状根中的SDH3导致GA和没食子酸单宁的增加[22]。SDH3在HTs合成中的作用最近也在一项研究中得到了证实Quercus冬青属植物[42]。该蛋白质的序列中的观察PgSDH大约82%与诉酿酒用葡萄SDHS,并且在酶的活性位点中的氨基酸残基中没有观察到差异,表明PgSDHs具有相似的活性VV.sdh。
总之,目前的研究结果均符合那些在葡萄,由此描述PGSDH1是一种更持续表达的酶,与NADPH活性形成shikimate,而PGSDH3.,pgsdh3a.和PGSDH4可以由压力诱导,并且更多地是由NADP操作的+形成GA和高温热源。此外,目前的研究结果也指出了观察到的表达水平PGSDH3.,pgsdh3a.和PGSDH4而在黑暗渗透胁迫下显著增加,是GA和HTs积累的主要调控因子,而不仅仅是NADPH/NADP+比率。
的光,暗和蔗糖浓度对HTS和AT的形成的效果
以往的研究表明,非生物胁迫会影响ATs和ht的产生和积累。例如,在强光、盐、渗透和干旱等胁迫下,ATs的水平会增加[45,46,47]。与地中海气候条件下生长的石榴相比,在炎热干燥的环境条件下生长的11种石榴果皮中HTs水平显著增加[48]。此外,研究表明,培养基中高蔗糖水平形成的渗透胁迫会影响多种植物组织培养中的多酚代谢和单宁酸的产生[49,50,51]。较高的蔗糖含量也导致愈伤组织中单宁含量较高B.玻术,Tamarix tetandra和Quercus acutissima在黑暗中生长,只有在光亮中检测到残留的高温热源[49,50,51,52,目前的研究也有报道。这些发现进一步支持了我们的结论,GA主要是在黑暗中产生的。
在这项研究中,光被发现是调节外皮中的ATs的关键刺激(图。3.)和愈伤组织(且蔗糖含量高)(图。4).另一方面,光照射和蔗糖处理均抑制愈伤组织中HTs的产生,而在相同蔗糖浓度的暗处理下,HTs水平显著积累。总之,这些研究表明,在光照或黑暗条件下的渗透胁迫组合可以显著影响ATs和ht的水平.
这些非生物条件也影响愈伤组织中其他代谢物的水平。在较高蔗糖水平下,石榴愈伤组织中苯丙氨酸和色氨酸的减少表明,它们被用作多酚在这些条件下积累的底物(图)。4a).确实,当培养基中蔗糖水平增加时,GA、鞣花酸和紫金酸的水平显著增加(图3)。4).类似的结果也报告在暴露于盐拟南芥文化。莽草酸的水平与草酸相关的代谢物一起增加诸如松柏[53,54]。此外,在强光和高温(40℃)下,葡萄浆果的细胞悬浮液中,流向苯丙素途径的代谢物如白藜芦醇及其衍生物皮苷、表没食子儿茶素和牡丹素和花青素的香豆素化形式、二氢黄酮醇苷和槲皮素-3-的含量都很高O-Glucoside [55]。
在渗透胁迫条件下,石榴愈伤组织除具有丰富的高温转运蛋白外,还表现出脯氨酸、丝氨酸、丙氨酸、总氨基酸以及几种糖和糖醇(山梨糖醇、甘露醇和肌醇)的含量增加。众所周知,这些代谢物的积累在渗透胁迫下发生,以保护植物[55,56]。三羧酸循环的中间产物含量也显著增加。这一发现与在盐中培养的拟南芥相似[53,54]。葡萄浆果在高温和光胁迫下的细胞悬浮液也显示出糖、丝氨酸、丙氨酸、脯氨酸、谷氨酸和三羧酸循环代谢物的高水平[53]。而渗透胁迫下,石榴愈伤组织中苏氨酸、蛋氨酸和异亮氨酸水平降低。已知这些氨基酸会降解为代谢产物,在压力下促进三羧酸循环以获得更多能量[57]。
结论
综上所述,本研究的结果强烈表明,HTs和ATs的生物合成会竞争相同的底物3-DHS, DQD/SDH使用3-DHS形成GA或shikimate(图)。1).DQD / SDH为shimikate和GA的相对活性不仅是由NADPH和NADP的比例调节+,也可通过表达PgSDH3, PgSDH3a和PGSDH4.高蔗糖浓度的光照促进愈伤组织中ATs的合成,而相同蔗糖浓度的黑暗促进HTs的合成。这两组代谢物都是用来保护愈伤组织免受这些非生物胁迫/条件。
我们的研究结果提供调节石榴果实的果皮外HTS和AT的水平的因素更深入的了解。The importance of the outer peels is not just attributed to the fact that the customer’s decision to consume the fruit is based on the first impression of the phenotype of the peels, mainly color and ATs content, but also to the nutritional value of pomegranate juice (that has high levels of HTs, which are usually extracted into the juice in the industries). In addition, high levels of HTs in the peels are related to less physiological defects such as husk scald [24]。本研究成果可用于开发新的遗传标记,培育同一果实中高硫代和高硫代的石榴。
材料和方法
植物材料
三十三石榴种质被选为这项研究。第二十二条这些国家的加入都是从一个农场在尼夫Ya'ar研究中心,ARO [在以色列基因库对农作物注册(IBG收集,http://igb.agri.gov.il)] [58],从以色列北部研发中心的哈瓦特哈马塔姆收集了11份。这些附属物的颜色各不相同。不同品种的果实一般在9月至11月间采收,此时果实已完全成熟。这些水果通过一辆通风汽车运送到实验室,在那里用削皮机去皮。果皮在液氮中冷冻,并保持在−80°C,以便进一步分析。在果皮组织培养方面,6月份从haffat Hamataim采集了添加号UG28的未成熟石榴果实(直径3 ~ 4cm)。
高温温度和ATs的测定
采用高效液相色谱-二极管阵列检测器(HPLC-DAD)对高温和ATs进行分析。HPLC采用UltiMate 3000系统,该系统由溶剂输送模块LG-980-02、泵LPG-3400SD、自动进样器WP53000TSL、色谱柱室TCC3000SD和检测器DAD3000 UV/vis组成。柱是Hydro-RP-C18Synergi柱,3mm×100mm,粒度=2.5μm(英国现象)。将十μl水提取物注入柱中。使用水/甲酸的梯度(99:1 v / v)(a)和乙腈(b)(sigma-Aldrich,Rehovot,以色列)以0.8ml / min的流速进行洗脱。:100%a和0%B在0,96%A和4%B的3.6分钟,85%A和15%B,22分钟,50%A和50%B,25分钟,20%A和80%B.在32分钟至35分钟至35分钟至35分钟,直至35分钟。在360nm的瞳孔中检测代谢物,280nm用于其他HTS,320nm for Ga,520nm。通过比较真实标准的保留时间和标准曲线(Sigma-Aldrich,Rehovot,以色列)来实现旁斑异构体,Ga和鞣花酸的鉴定和定量。
对于ATs测定,软件根据紫外/可见吸收光谱和ATs标准的保留时间进行峰值分配。标准库由氰基3,5-二葡糖苷和氰基3-葡萄糖苷(密苏里州圣路易斯市西格玛·奥尔德里奇)构成。这些标准中的每一个(50–100 μg/mL甲醇)单独注入,并将具有3D功能的光电二极管阵列检测器获取的数据纳入系统的ATs标准库。重复运行中保留时间的相对标准偏差在0.4–1.9%范围内。根据相应色谱峰面积计算对单个ATs进行定量校准曲线(线性,R2 = 0.99)和四种浓度(0.01、0.10、0.25和0.50)下的每种ATs的标准 μg/mL)。
测定TPC,总ATS和代谢分析
如前所述确定总酚类和总ATS [5]。如前所述,对氨基酸和其他初级代谢物进行分析[59]。
外皮组织培养
用肥皂和水清洗未成熟的石榴果实UG28,用削皮机去除彩色果皮,并将果皮分成小块(1.0±0.2 cm)2)进行切割和表面消毒,如前所述[26]将外皮段置于含有1%蔗糖和1%葡萄糖的半强度Murashige和Skoog(MS)培养基中 6-苄基氨基嘌呤(BAP)mg/L。培养物在22℃时保存在生长室中 在黑暗中摄氏度。每两周将外植体转移到新鲜培养基中培养11天 愈伤组织最初发育后,移去外植体;愈伤组织继续在同一培养基上生长,并继续每两周转移一次,持续10周 然后用1、2.5、5%或7.5%的蔗糖将愈伤组织转移到MS中,每种蔗糖浓度的一半植株在16℃下转移到光照下 h灯/8 h暗光周期,光强度为50 μmol M− 2. s− 1.[26]。
将培养物转移到新的培养基后,每两周称重一次,直到实验结束,以监测生长速度(附加文件3.:图S2)。试验结束时,测定鲜重和干重。
剥离和calli提取物
将石榴皮和外皮诱导的愈伤组织采收后,用液氮冷冻,在−80°C保存,用冻干机干燥,然后用研钵和杵磨成细粉。水提取时,将50 mg的干燥组织与蒸馏水按1:19 (v:v)的比例混合。将混合物在50°C下摇晃40分钟,然后在10,000 x g下离心20分钟,以清除组织碎片。上清液通过0.22 μm聚四氟乙烯(PTFE)过滤器过滤,转移到新的管中。
mRNA提取及逆转录定量聚合酶链反应(RT-qPCR)分析
RT-qPCR检测三种基因的表达水平PgSDH愈伤组织的基因在黑暗和光明中生长。用波谱植物总RNA试剂盒(Sigma)提取冻干愈伤组织50 mg。根据前期研究进行cDNA合成和qPCR程序[60]。为了使样本间的方差归一化,我们使用组成体核糖体蛋白S (PGRPSII.)基因作为内源性控制[7]。所呈现的值是三个生物重复的平均值,每个重复有三个技术重复。用于分析表达的引物PgSDHs和PGRPSII.显示在附加文件2:表S3。
系统发育分析
系统发育树分析由选定的脱氢脱氢酶/ shikimate脱氢酶制成。这种系统发育树是由六个构建的PgSDHs利用Clustal Omega系统发育选项,在公共数据库(NCBI)上获得12个序列。
统计分析
使用JMP 8.0版本(SAS Institute Inc., Cary, NC)对代谢物和基因表达数据进行统计分析。根据Kramer HSD-Tukey试验计算处理间的显著差异(p< 0.05)。相关性分析采用Pearson检验。系统发育树使用MAFFT版本7创建[56]使用WAG模型和1000 bootstrap。使用Clustal Omega对SDH蛋白质序列进行比对。
数据和材料的可用性
支持本文结果的数据集包含在本文及其附加文件中。
缩写
- 3-DHS:
-
3-dehydroshikimate
- ATS:
-
花青素
- 软面包卷:
-
6-benzylaminopurine
- DQD:
-
dehydroquinate脱水酶
- DW:
-
干重
- FW:
-
鲜重
- 遗传算法:
-
没食子酸
- HPLC-DAD:
-
高效液相色谱 - 二极管阵列检测器
- 高温超导:
-
hydrolysable单宁
- 女士:
-
Murashige和斯库
- OPPP:
-
磷酸戊糖氧化途径
- PCA:
-
主要成分分析
- 聚四氟乙烯:
-
聚四氟乙烯
- ROS:
-
活性氧
- RT-qPCR:
-
逆转录-定量聚合酶链反应
- SDH:
-
莽草酸脱氢酶
- TCA:
-
三羧酸循环
- TPC:
-
总酚含量
参考
- 1.
荷兰D,Bar-Ya'akov I.石榴:关于健康有益植物化学和治疗特性的方面,关于树木品种和环境。在:Yaniv Z,Dudai N,编辑。中东药用和芳香植物。荷兰:DONDRECHT SPRINGER;2014. p。225-39。
- 2.
Aviram男,沃尔科娃N,科尔曼R,德雷尔男,雷迪MK,费雷拉d,从果皮,石榴籽,和花罗森布拉特M.石榴酚醛塑料是抗动脉粥样:研究在活的有机体内在动脉粥样硬化载脂蛋白e -缺陷(E-o)小鼠和在体外在培养的巨噬细胞和上蛋白中。农业食品化学。2008;56:1148-57。
- 3.
Gil M,Tomas-Barberan Fa,Hess-Pierce B,Holcroft DM,Kader AA。石榴汁的抗氧化活性及其与酚类组成和加工的关系。Jagri食品化学。2000; 48:4581-9。
- 4.
Orgil O,Schwartz E,Baruch L,Matityahu I,Mahajna J,Amir R.石榴果实和树的不可食用器官的抗氧化和抗增殖潜力。LWT - 食品SCI技术。2014; 58:571-7。
- 5.
Tzulker R,格雷泽I,巴伊兰I,荷兰d,Aviram男,阿米尔R.抗氧化活性,多酚含量,并且在不同的果汁,并从29个不同的石榴种质制备匀浆相关化合物。Jagri食品化学。2007; 55:9559-70。
- 6.
王志强,王志强,王志强,等。植物多酚类化合物的合成及其化学性质[j]。Angew Chem Int Ed Engl. 2011; 50:586-621。
- 7.
奔Simhon Z,Judeinstein S,特拉伊宁T,Harel的-贝贾R,酒吧-Ya'akov I,Borochov-Neori H,荷兰D. A“白色”花青素少石榴(石榴L.)引起的编码区插入白花青素双加氧酶(LDOX;ANS)基因。《公共科学图书馆•综合》。2015;10:e0142777。
- 8.
Harel-Beja R, Tian L, Freilich S, Habashi R, Hamutal Borochov-Neori H, Lahav T, Trainin T, Doron-Faigenboim A, Ophir R, Bar-Ya 'akov I, et al.;石榴果皮发育过程中的基因表达和代谢谱分析揭示了花青素和紫皮苷生产之间的相互作用。Tree Gene Genom. 2019;15:109。
- 9.
关键词:番茄,霍夫曼无花青素基因,bHLH转录因子,低温诱导,发育调控《公共科学图书馆•综合》。2016;11:e0151067。
- 10
石榴预防和治疗癌症:最新进展。分子。2017;22:177。
- 11
Brighenti V,Groothuis SF,Prencipe FP,Amir R,Benvenuti S,Pellati F.代谢物指纹识别石榴L.(石榴)由高性能带有二极管阵列和电喷雾电离质谱检测的液相色谱装置多酚。ĴChromatogr A. 2017; 1480:20-31。
- 12
石榴中酚类化合物的鉴定与定量分析石榴果皮,中果皮,假种皮和不同生产的果汁。食品化学。2011;127:807-21。
- 13
石榴汁、石榴鞣花单宁和石榴红素抑制结肠癌细胞的炎症信号。农业食品化学学报2006;54:980-5。
- 14.
石榴多酚(Punicalagin)可诱导人PC-3和LNCaP细胞生长抑制和凋亡。Chemico-Biol Int。2017;274:100-6。
- 15.
关键词:甲状腺乳头状癌(BCPAP),红石榴素,DNA损伤,细胞凋亡螺母杂志2017;47:63 - 71。
- 16.
缪尔RM,Ibanez的AM,Uratsu SL,Ingham的ES,莱斯利CA,麦格拉纳汉GH,巴特拉N,戈亚尔S,约瑟夫Ĵ,Jemmis ED,等人。在细菌中没食子酸的生物合成机构(大肠杆菌)及核桃(胡桃regia).植物学报。2011;75:555-65。
- 17.
没食子酸和可水解单宁是桦树叶中由shikimate途径的中间化合物形成的。生物化学系统生态学2003;31:3-16。
- 18.
植物芳香族氨基酸的合成与代谢。植物学报。2012;63:73-105。
- 19.
王志强,王志强,王志强,等。植物中没食子酸的生物合成采用typhina:区别天然氧同位素丰度的不同途径。Phytochem.2004; 65:2809-13。
- 20。
郭杰,卡林顿Y,阿尔伯A,埃林特J.毛果杨中奎宁酸和莽草酸代谢的分子特征.生物化学杂志.2014;289:23846-58。
- 21。
PEEK J,Christendat D. Shikimate Deycrogenase系列:在保守的结构和机械框架内功能多样性。弧生物志法生物学。2015; 566:85-99。
- 22。
Bontpart T, Marlin T, Vialet S, Guiraud JL, Pinasseau L, Meudec E, Sommerer N, Cheynier V, Terrier N.两种shikimate脱氢酶VvSDH3和VvSDH4参与葡萄中没食子酸的生物合成。J Exp Bot. 2016; 67:3537-50。
- 23.
田磊。石榴果皮不同性状多样性的研究进展。Sci长的矮。2019;246:842-8。
- 24.
Matityahu我,我格雷泽,荷兰d,酒吧-Ya'akov我,本 - 阿里R,阿米尔R.总抗氧化能力和石榴壳关联到几个采后果实质量参数的总酚水平。食品BIOP TECHNOL。2013; 7:1938年至1949年。
- 25.
刘Y,Tikunov Y,Schouten Re,Marcelis LFM,Visser RGF,Bovy A. Solanaceous蔬菜中的花青素生物合成和降解机制:综述。前化学。2018; 6:52。
- 26.
陈志强,陈志强,陈志强,等。石榴皮细胞培养及其生物活性物质的研究进展。中国生物医学工程学报,vol. 32 (4): 581 - 589;2019.131 - 40页。
- 27.
陈志强,陈志强。植物抗脱水能力的分子基础研究。植物生理学杂志。1996;47:377-403。
- 28.
opir R, Sherman A, Rubinstein M, Eshed R, Sharabi Schwager M, harell - beja R, Bar-Ya 'akov I, Holland D.单核苷酸多态性标记新创石榴转录组的组装揭示了种质遗传多样性。《公共科学图书馆•综合》。2014;9:e88998。
- 29。
袁Z,方Y,张T,飞Z,汉族男,刘成,刘男,小W,张伟,吴S等人。石榴(石榴基因组提供了深入了解果实品质和胚珠发育生物学。植物生物技术学报2018;16:1363-74。
- 30。
秦g,xu c,ming r,唐h,guyot r,kramer em,胡y,yi x,qi y,xu x等。石榴(石榴基因组学和普尼卡拉金生物合成的基因组学。植物杂志,2017;91:1108–28。
- 31。
结构拟南芥脱氢喹啉酸脱水酶莽草酸脱氢酶及其在莽草酸途径中的代谢通道的意义。物化学。2006;45:7787 - 96。
- 32。
丁立军,王立军,王立军,等。烟草3-脱氢喹啉酸脱氢酶/shikimate脱氢酶基因的克隆及功能分析。J Exp Bot. 2007; 58:2053-67。
- 33。
Akagi T, Ikegami A, Suzuki Y, Yoshida J, Yamada M, Sato A, Yonemori kDiospyros柿子藤)水果。Planta。2009; 230:899-915。
- 34
Landete JM。鞣花丹宁、鞣花酸及其衍生代谢物的来源、代谢、功能与健康综述。Food Res Int. 2011; 44:1150-60。
- 35
Boulekbache-Makhlouf L,Meudec e,赤壁麦片M,Mazauric JP,Slimani S,Henry M,Cheynier V,Madani K.通过高效液相色谱二极管阵列分析酚类化合物在果实中的酚类化合物的分析桉树球液种植在阿尔及利亚。农业食品化学。2010;58:12615-24。
- 36
Itoh N, Kurokawa J, Isogai Y, Ogasawara M, Matsunaga T, Okubo T, Katsube Y.在没食子酸存在的情况下漆酶处理绿茶提取物中生成的epitheaflagallin 3- o -没食子酸酯的功能特征。农业食品化学。2017;65:10473-81。
- 37
没食子酸双加氧酶基因的特性:三个不同的环切割双加氧酶参与寡动鞘氨单胞菌SYK-6的针状酸降解。J Bac。2005;187:5067 - 74。
- 38.
王志强,王志强,王志强。微阵列表达谱分析拟南芥蒂利亚纳在荞麦中鉴定的化感物质的响应。J Exp Bot. 2008; 59:3099-109。
- 39.
Rasmusson AG, Wallstrom SV。线粒体参与控制植物细胞NAD(P)H降低水平。生物化学学报2010;38:661-6。
- 40.
Sunil B, Talla SK, Aswani V, Raghavendra AS。通过涉及细胞器间相互作用的多种代谢途径优化光合作用:以资源共享和ROS维持为基础。照片杂志2013;117:61 - 71。
- 41.
陆晓霞,黄玲,高胜,何磊,王国强。高盐胁迫下高潮间带大型藻类光系统I的循环电子流。杂志。2016;156:397 - 406。
- 42。
加利亚A,Morcuende d,Solla A,Moreno的G,普利女,通过单宁生物合成的生物应力克萨达A.规Quercus冬青属植物:落叶和疫霉、肉桂感染。杂志。2019;165:319-29。
- 43。
Karakas FP,Cingoz GS,Turker Au。氧化胁迫对常见雏菊愈伤组织酚醛组合物和抗氧化代谢的影响。AFR J Tradit Crand Abster。2016; 13:34-41。
- 44。
赫尔曼KM,韦弗LM。shikimate通路。植物生理学报1999;473 - 503。
- 45。
boulekbach - makhlouf L, Meudec E, Chibane M, Mazauric J, Slimani S, Henry M, Cheynier VKM。采用高效液相色谱二极管阵列检测质谱法分析黄芪果实中的酚类化合物桉树球液种植在阿尔及利亚。农业食品化学。2010;58:12615-24。
- 46。
Gomez-Caravaca AM, Verardo V, Toselli M, segura - cartero A, Fernandez-Gutierrez A, Caboni MF。hplc - esi - ms测定石榴汁中主要酚类化合物。农业食品化学。2013;61:5328-37。
- 47.
Miras-Avalos JM,耐特利olo DS。非生物条件下葡萄的组成:水分胁迫和盐分。植物学报2017;8:851。
- 48.
引用本文:张志强,张志强,张志强,张志强,张志强,等。环境条件影响11种石榴果实的颜色、口感和抗氧化能力。农业食品化学学报。2009;57:9197-209。
- 49.
田iguchi S, Terabayashi S, Hatano T.柽柳属植物的水解单宁。四:紫花蕙兰芽培养的快繁和鞣花单宁生产柽柳.Phytochem。2011; 72:1978至1989年。
- 50.
田中N,Shimomura K,Ishimaru K.愈伤组织培养中单宁的产生Quercus acutissima.Phytochem。1995;40:1151-4。
- 51.
Taniguchi S, Nakamura N, Nose M, Takeda S, Yabu-uchi R, Ito H, Yoshida T, Yazaki K.大环鞣花单宁低聚物的制备月见草laciniata愈伤组织的文化。Phytochem。1998;48:981-5。
- 52.
Castro AHF, Braga KQ, de Sousa FM, Coimbra CM, Chagas RCR。愈伤组织的诱导和生物活性酚类化合物的产生Byrsonima verbascifolia(l)直流。(金虎尾科)。Rev Ciên Agro. 2016; 47:143-51。
- 53。
Jin Chun H, Baek D, Cho HM, Jung HS, Jeong MS, Jung WH, Choi CW, Lee SH, Jin BJ, Park MS,等。拟南芥根悬液细胞对盐胁迫适应和有丝分裂胁迫记忆的代谢调节植物学报2018;(印刷中)。
- 54。
Kim JK,Bamba T,Harada K,Fukusaki E,Kobayashi A.时间课程代谢分析拟南芥蒂利亚纳盐胁迫处理后的细胞培养物。J Exp Bot。2007; 58:415-24。
- 55。
Ayenew B,Degu A,Manela N,Perl A,Shamir Mo,Fait A.代谢物分析和转录分析揭示了浆果衍生细胞培养对非生物胁迫的反应中的特异性。前植物SCI。2015; 6:728。
- 56。
Khalil F,RAUF S,MonNeveux P,Anwar S,IQBAL Z.向日葵渗透渗透压术后脯氨酸浓度的遗传分析。BR SCI。2016; 66:463-70。
- 57。
陈志强,陈志强。植物必需氨基酸合成与积累的调控机制。植物生物学杂志。2016;29(67):153-78。
- 58
石榴:植物学、园艺、育种。在:Hort Rev. John Wiley & Sons, Inc. 2009;127 - 191。
- 59
拟南芥中fystathionine-gamma-synthase的种子特异性表达与干旱胁迫相关的代谢和转录组反应。植物杂志。2014;166:1575 - 92。
- 60.
kaoh K, Standley DM. MAFFT多序列比对软件版本7:性能和可用性的改进。Mol Biol Evo. 2013; 30:772-80。
确认
Irit Bar-Ya 'akov帮助收集石榴果实;Rotem Harel为pgsdh3a.序列;珍妮特·科瓦柳英语编辑。
基金
本研究得到国家研究资助项目no。IS-4822-15 R来自BARD,美国-以色列两国农业研究和发展基金。这些资金用于实验成本、数据解释、写作和英语编辑。MIGAL支持出版费用。
作者信息
隶属关系
贡献
RH,YH,RD和IM进行的研究;DH,LT和RA发起的研究;DH,RD和RH进行的生物信息学分析;DH和RH收集和制备的植物材料;RA,YH,RH和LT写的稿子。所有作者都读过并批准了稿件。
作者的信息
不适用
通讯作者
道德宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1。
石榴SDH序列。(A)转录的RNA序列PgSDHs;(B) 6个pgsdh的比对分析;(C)六方之间的对齐分析PgSDHs和VV.SDHs;(D)系统之间的Blast分析PGSDH4和VV.sdh4,之间VV.SDH3和PgSDH3-2;的4种同工酶之间E.对准分析PGSDH3.和pgsdh3a..
附加文件2:表S1。
石榴皮愈伤组织可溶性氨基酸含量的研究。表S2。GC-MS代谢物数据集的石榴皮愈伤组织。值都被归到正亮氨酸内标相对峰面积。表S3。寡核苷酸用于基因的扩增和定量rt - pcr分析。
附加文件3:图S1。
在添加不同浓度蔗糖的MS板上,在光照(上板)和黑暗(下板)条件下,由加入者UG28外皮形成愈伤组织的表型。图S2。在添加不同蔗糖浓度(1、2.5、5、7.5%)的MS板上,在光照和黑暗条件下,5个时间点采集75 d的石榴皮愈伤组织鲜重。媒体每15天更换一次。所示值为4个生物重复的平均值±SD。图S3。由在补充有不同浓度蔗糖的MS板上生长的加入UG28外皮的新鲜重量,干重和含水量。将板置于光(上板)和暗(下面的面板)中,75天后进行测量。数据代表了4个生物重复的4个样本的平均值±SD。统计上显着的变化(P < 0.05, using two-way ANOVA) are identified by different letters.图S4。在添加不同浓度蔗糖的MS板上,加料后UG28外皮愈伤组织中花青素(AT)的积累。采用HPLC-DAD检测各代谢物的峰面积,并检测5种ATs。以C-3- g和c -3,5- g为标准,测定花青素单苷、二苷(C-3- g和c -3,5- g)、天皮苷单苷、二苷(P-3- g和p -3,5- g)、飞燕草苷单苷的含量。所提供的数据代表四个生物重复的平均值±SD。统计上显着的变化(P < 0.05, using two-way ANOVA) are identified by different letters.图S5。结果表明:在添加不同浓度蔗糖的MS板上生长的UG28外皮愈伤组织中3种芳香族氨基酸的含量均高于蔗糖;这些盘子被放置在光明或黑暗的条件下。数据代表了4个生物重复的4个样本的平均值±SD。有统计学意义的变化(P < 0.05,使用双向方差分析)由不同的字母识别。图S6。在添加不同浓度蔗糖的MS培养板上以及在光照或暗照条件下培养的愈伤组织中检测到76种初级代谢产物的相关矩阵和聚类分析。热图的每个平方表示一对化合物的皮尔逊相关系数。蓝色或红色的强度表示系数,如色标所示。层次聚类在聚类树中表示。图S7。逆转录-定量聚合酶链反应(RT-qPCR)分析PgSDH3-1和PgSDH3a-1在在亮或暗的2.5和5%的蔗糖浓度生长的愈伤组织。表达数据标准化为管家基因PGRPSII..这些数据以至少三次独立测量得到的平均值±标准差表示。采用单因素方差分析检验,确定差异有统计学意义(P< 0.05),用不同的字母表示。
权利和权限
开放存取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
哈巴希,R。哈查姆,R。et al。阐明莽草酸脱氢酶在控制石榴外皮花青素和可水解单宁生成中的作用。BMC植物杂志19,476(2019)。https://doi.org/10.1186/s12870-019-2042-1
已收到:
接受:
发表:
关键字
- 花青素
- Hydrolysable单宁
- 渗透压力
- 外果皮
- Peel-tissue文化
- 石榴
- Shikimate脱氢酶