摘要
背景
定量性状基因座(QTL)的鉴定和表征是朝着识别官能序列的重要性阶段,旨在为选择性育种策略制定精确标记的功能序列。在该研究中,逐序列测序(GBS)方法检测到番木瓜中的QTL调理所需的果实质量性状。
结果
为此,我们构建了包含219个单核苷酸多态性(SNP)位点的连锁图谱,覆盖10个连锁群,509厘摩根(cM)。共鉴定出7个关键品质性状的21个qtl,包括果肉甜度、单果重、果长、果宽、皮斑、果肉厚度和果实硬度。果肉甜度、果实重量、长度、宽度和硬度的几个QTL在收获年份均保持稳定,单个QTL可解释某一性状19.8%的表型变异。在可能的情况下,提出候选基因,并进一步探索其在标记辅助育种中的应用。
结论
本研究拓展了木瓜关键生理和品质性状的遗传和遗传控制的知识。候选基因和相关SNP标记为未来澳大利亚木瓜品种战略选择育种提供了宝贵资源。
背景
木瓜 (番木瓜L.)是前五大生产的热带水果作物之一,被列为抗击维生素缺乏的超级果实[24,51.].全球木瓜产量约为11.22公吨(MT),每年增长4.35%[23].在澳大利亚,木瓜是一种重要的国内新鲜水果作物,每年仅种植6500吨[24].该行业目前规模相对较小,但有很大的潜力扩大,以满足日益增长的全球市场需求。
新颖和先进的育种工具将使快速和更准确地选择关键的消费者驱动性状。因此,标记辅助选择(MAS)已被引入到其他木瓜育种项目中,以有效地培育具有所需性状的优良品种[6,64.,66.].然而,由于基因组信息的缺乏和与标记/序列相关的数量性状位点(QTL)的缺乏,这一研究进展受到了限制。
鲁棒QTL识别中的成功取决于分子标记图密度,直接影响地图分辨率,以及准确地放置定性数据。以前的地图在覆盖范围和分辨率中变化。“日出唯一”X线UH356地图包括61个随机扩增的多晶型DNA(在11个连杆组(LG)中分布超过999厘米的RAPD标记。随后的'Kapoho'X'Sunup'Ma等人的地图。[41.1498个扩增的片段长度多态性(AFLP)基因座,12Lg以上超过3294厘米。后来,Chen等人的'AU9'X'SUNUP'地图。[15]包含706个SSR标记,分布在1070 cM以上的12个LG上,其中细长果型与LG1的一个QTL相关。Blas等[5然后利用同一作图群体,构建了包含712个SSR和277个标记的14个LG和945 cM以上的作图。与此同时,Ming等人公布了木瓜“Sunup”的全基因组序列([46.];http://www.plantgdb.org/cpgdb),使物理和高密度遗传贴图的集成成为可能[79].由于木瓜栽培根内的遗传基础狭窄[52.的初步调查显示,这些SSR标记在我们选择的亲本上的多态性仅为16.67%,预计仅覆盖120个位点(未发表数据)。因此,基于单核苷酸多态性(SNP)的定位技术被引入木瓜,以加速和揭示连锁图谱的开发和复杂性状的关键基因组位置的鉴定,包括果肉甜度和其他果实品质性状。
一旦在连锁图谱中进行比对,就有可能鉴定出主导QTL和可能有助于性状表达的候选基因。功能验证的标记可以代表在选择育种策略中有用的序列。在之前的研究中,利用RAPD标记对253f居群的株高、茎粗和初花节数进行了QTL定位2植物('sunrise solo'x线UH356 [64.];)。每个性状鉴定了2 ~ 4个qtl,对株高、茎粗和初花节数的表型变异贡献率分别为42、37和30%。Blas等[6[随后鉴定了14个QTL控制果子重量,长度,宽度和形状,其表型效应范围为5-23%。这些使用219 f的群体映射到LG 2,3,7和9上2' Khaek Dum ' x Line 2H94工厂。
用于选择性育种目的的可靠标志物的鉴定与主要QTL调理有关的特征是依赖于QTL已经相关的标记的遗传稳定性。实际上,通过突变和/或选择性进化,居住在近距离QTL附近的序列可能在遗传背景中变化。此外,甚至由同一父母产生的不同群体之间的重组事件可能不会被保守,因此在基因型或种群之间不保证标志物可转移性[33,65.].因此,需要个体高密度的遗传连锁图谱来鉴定影响特定基因型果实关键品质性状的遗传位点。
高密度图是通过基因分型测序(GBS)方法生成的,用于快速和经济有效的高通量SNP标记发现[21].该方法已应用于西葫芦果实品质性状QTL的发掘[48.]和番茄[11].两项研究都发现GBS是一种高效的QTL分析和候选基因挖掘技术。利用120 F的荧光探针构建了西葫芦的遗传图谱8从西葫芦和扇贝之间的亚种间杂交(ssp。胡椒x ssp。ovifera).总共48个一致的葡萄藤,开花和果实质量特征是根据三个环境分析检测的。这些QTL分布在15 LG的33个独立位置,每个QTL从表型方差的1.5%中解释。八个稳定的QTL与叶片切口,果子形状和长度相关,夏南瓜的果实和肉颜色与其潜在的候选基因一起报告。在番茄,Celik等人。[11利用了93个个体的遗传图谱Solanum lycopersicum'tueza'和茄属植物pimpinellifolium(LA1589)的QTL定位和11个品质性状的有利等位基因的选择。共检测到影响番茄果实品质的QTL 37个,贡献率为3 ~ 47%。其中,果实重量检出3个,果肉颜色检出9个,果皮颜色检出2个,果实硬度、果实形状及含糖量各检出4个[11].
GBS技术的优点对于简化高密度图的构建并识别与番木瓜中的质量果实性状相关的QTL,这具有狭窄的遗传基础和低序列多样性速率[34,55.,67.,72].随着序列数据库中可用信息的增加,可以将GBS和候选基因方法结合起来,以加快标记辅助育种项目新标记的开发[57.].
本研究对番木瓜果实品质性状进行了连锁定位和QTL分析2从十字架'rb2'x'sunrise solo开发的人口。目的是1)确定主要遗传成分的位置,调节甜度,果子重,果子长度,果宽,皮肤祛斑,肉厚度和果实,2)识别并表征推定的甜味候选基因,以确定其潜力在未来的标记辅助选择策略中使用。
结果
序列数据和SNP发现
从亲本和226 F中共生成57.78 Gb序列数据,包括5.77亿reads2样品。在映射到Ming等人的“Sunup”参考基因组之后。[46.],共检测到44,030个snp。在过滤去除80%以上缺失数据和/或低读取深度的SNPs后,仍保留1701个高质量SNPs(3.86%)。随后,剔除重复和单形的SNPs,共1302个(2.95%),snp密度为1个/ 285.7 kb。
连锁图施工
在1302个高质量SNPs的结果子集中,总共有1153个SNPs被用来创建‘RB2’x‘Sunrise Solo’的初始地图(附加文件)4:表S3,附加文件6:图S2)。其中23个LG, 15个大调,6个小调,覆盖3096.93 cM,平均标记间距2.7 cM。882个(76.4%)标记在预期分离比(1:2:1)范围内发生偏差2人口。其中187(21.3%)偏向母本(‘RB2’),98(11.2%)偏向父本(‘Sunrise Solo’)。其余597个畸变标记均偏向杂合子基因型(附加文件)5:表S4)。
在1153个初始映射的SNP标记中,仅按预期进行271个间隔(p-Value≥0.05)并在修改联动分析后,52仍未解释。因此,最终地图由10 LG(i到x;表格中的219个SNP基因座组成1和图。1).每个LG由3 ~ 75个SNP组成,SNP长2.2 ~ 134.6 cM, SNP间的平均间距为3.5 ~ 27.6 cM。最终的地图宽度为509.7厘米,大约是最初地图的六分之一。
QTL分析
复合间隔映射,滑动窗口尺寸为10厘米,检测QTL,用于甜度,另外两次收割机内的其他水果质量特征(2016年和2017)。总共,21 QTL分布在九个LG(除了LG VIII之外)(图。1).单个QTL解释的表型变异比例为3.1 ~ 19.8%2).单个QTL对表型变异的解释率最高的是果长(19.8%),其次是果宽(19.5%)和果硬度(15.5%);水果硬度最低(3.1%,LG IX;2016年)。总体而言,2016年和2017年各性状的QTL分布在相似的图谱位置。每个性状检测到的QTL数量在2 ~ 5个位点之间。果实硬度的QTL数量最多(5个)。果肉厚度的QTL最少(2个),果肉甜度次之(3个)。果实品质性状的QTL在LG I、III、IV、VI、IX和x上的共定位证明了它们之间的关系。例如,果肉甜度QTL与果实硬度和果长QTL聚在一起。在lgix上对皮肤雀斑QTL与果实紧实度QTL进行聚类分析。 QTL for fruit size characteristics (fruit weight, length and width) and fruit firmness clustered on several LG including I, IV, VI, IX and X.
果肉、甜味和其他水果品质性状的候选基因
根据Sunup参考基因组对主要QTL区间进行注释。在果肉甜味QTL峰中检测到三个负责发育生长调控的候选基因(非典型聚(A) RNA聚合酶和kin17样蛋白(登录号:XP_021903675和XP_021907879)和蛋白跨膜转运蛋白活性(登录号:XP_021887112)7:表S5)。果实重、长、宽QTL区域包含细胞壁组织(蛋白毛状体双折射样12和脂肪酸酰胺水解酶样12)、蛋白质代谢过程(谷氨酸受体3、ist1样蛋白、脯氨酸4-羟化酶9和双功能核酸酶2)和碳水化合物代谢过程(外聚半乳糖醛酸酶和含NAC结构域蛋白41)。以前确认的番木瓜LG1上的染色体Y序列[15,41.]也是近果长QTL。在皮肤雀斑QTL中观察到两个候选基因(Ultraviolet-B receptor和抗病蛋白RGA1)。果实硬度QTL区域包含1个编码果胶分解代谢过程的候选基因(果胶乙酰酯酶12-like)和3个与转录因子活性相关的候选基因(UPF0553 protein-like、UPF0553 protein-like、UPF0553 protein-like、UPF0553 protein-like、UPF0553 protein-like)。dna定向RNA聚合酶III亚基1和myb样蛋白X)。在果肉厚度的QTL区域内,确定了木质素生物合成过程和乙烯激活信号通路的候选基因。
讨论
SNP发现
首次,逐序列(GBS)的基因分型逐图开发SNP联系地图,并鉴定番木瓜中肉甜度和其他果实品质性状的关键基因组位置。此外,与现有的参考基因组结合,几种QTL连接的SNP基因座与推定的候选基因相关。
GBS在“RB2”x“Sunrise Solo”种群中获得的SNPs的频率和数量与甜樱桃中报道的相似[25],西葫芦[48.]和番茄[11用同样的方法。然而,大多数已鉴定的SNPs(96%)被排除在图谱构建之外,导致最终连锁图谱中的SNPs数量远低于前面提到的那些。在严格筛选所有读深最小、缺失数据和可识别亲本等位基因的位点后,SNP位点的数量减少到低于其他物种的典型报道数量。在西葫芦中,Montero-Pau等人的研究[48.]透露源自GBS的验证SNP的25%(16,222个标记)。通过GBS方法在番茄中发现了大约13%的高质量SNPS(3125标记)[11].目前研究中获得的经过验证的SNP百分比的变化可归因于许多因素,包括选择限制酶和测序深度,样品文库制备,植物材料的遗传背景和数据分析条件[16,43.,71].可以通过调整多路复用水平、改变限制性内切酶的选择和增加测序深度等策略来提高群体中SNPs的捕获率[4,71].在这些因素中,GBS数据分析的条件被报道为对产生的基因型信息的数量和质量的主要影响[71].被称为SNPs的数量、缺失的数据和基因型的准确性由于分析方法的选择和用于snp定位的参考基因组而有很大的差异[4,71].在这项研究中使用的条件下,多态性的检测依赖于现有的“Sunup”参考基因组[46.],在组装旁观性方面不完整,间隙序列和基因组覆盖数(〜75%)。完全可能的是,参考基因组的质量影响SNP呼叫的过程通过无法对准具有现有参考组件的原始测序输出,并导致验证的SNP数量相对较少。在将来,父母('RB2'和'Sunrise Solo'的高覆盖基因组序列; Genbank SRA加入:Prjna507836)应用作SNP-Discovery的参考基因组,其重组剂的映射[29,30.,39].另外,如果没有高质量的参考基因组,可以考虑采用从头SNP发现方法(Catchen et al., [9,54.,60.];)。
连锁图施工
标记偏析畸变率极高(76.4%,P < 0.05), consistent with previous studies such as Blas et al. [5在‘Khaek Dum’x‘2H94’杂交群体中,有79%的标记分离畸变。同样,在“AU9”和“Sunup”杂交群体中观察到66%的分离畸变[15].分离失真的潜在原因包括基因座之间的遗传相互作用[42.],父母或重组基因型在人口,环境因素和实验误差中的主要职位[2,75,76].在这项研究中,大量的扭曲位点可能归因于一个亲代基因型的优势,识别出的母系(' RB2 ')等位基因是父系(' Sunrise Solo ')等位基因的两倍,以及缺失的基因型数据[31].
虽然最终的图谱没有Blas等人的连锁图谱那么密集[5],标记的定位和比对是稳健的,具有足够的QTL定位分辨率[19].Bielenberg等人之前已经证明了密度相似的连锁图的质量和适用性。[4利用33个SSR标记和201个SNP标记构建了一个平均标记间距为2.85 cM的遗传图谱,对桃树低温需寒性和花期的QTL进行了检测。
利用荧光原位杂交(FISH)技术和带有SSR标记的BAC克隆作为探针,开发了染色体特异性的细胞遗传学标记,并与木瓜连锁组合并[74].提出了与木瓜染色体单倍体数相对应的9个连锁群。然而,我们无法集成这些地图,因为它们之间没有共享的锚标记。原因是不同的亲本被用来构建制图群体。
果实品质性状的QTL和候选基因
QTL定位有助于分析复杂性状的遗传成分[3.].对‘RB2’בSunrise Solo’F2群体进行QTL分析,共检测到21个影响木瓜果实品质的QTL。多数性状与2 ~ 5个QTL相关,表明其多基因特性[26,45.,77].本研究检测到的21个QTL中,有10个对表型变异有> 10%的影响,被鉴定为主要QTL [69.].其中一些在两个收获年份中是稳定的,表明它们在未来的性状选择中具有研究潜力。
不同果实品质性状的QTL在多个基因组区域共定位,其他物种也有类似报道[13,80].同一位点的QTL可能包含共享和/或不同的基因,具有潜在的多效效应。研究表明,包括桃在内的其他物种的果实甜味是由多个效应较大的QTL决定的[22]和apple [26].这些位于与果实重量和大小相关的QTL附近,但等位基因效应相反,再次表明多效性活动[22,26,32].目前还需要对近等基因系进行进一步的研究,以梳理QTL,并识别可能的候选基因个体,进一步验证其与每个特定性状的关联功能。
在本研究中,对‘RB2’x‘Sunrise Solo’基因型亲本和后代群体中关键品质性状的遗传变异和可转性进行了探索,结果表明,‘RB2’x‘Sunrise Solo’基因型的果肉甜度、果实宽度和果实硬度的遗传率较高(> 60%)2:表S2)。这证实了之前描述的木瓜的果肉甜度、果肉颜色、果肉硬度、果实硬度和果实大小等几个水果性状的高遗传性[53.,63.和其他水果作物[7,58.].其余性状遗传力为低~中(30 ~ 60%),以果重遗传力最低(32%)。QTL鉴定和作图成功的可能性取决于性状的遗传力、遗传性质(显性、隐性或加性)和涉及的基因数量[1].理论上,高遗传力性状QTL的鉴定应该更容易检测,并可能解释更多的表型变异,因为它们应该较少受环境因素的影响[27].在果肉的甜度、果实的宽度和硬度方面,这个假设似乎是正确的。QTL分析清楚地确定了它们在两个收获季节的主要调控遗传位点,且可能性相对较大(11.6 ~ 19.5%)。同时,对遗传力较低或中等性状的qtl进行鉴定,也发现了对果重和果长影响较大的qtl。这些性状可能与果实宽度和果实硬度等高遗传力性状密切相关,因此,qtl在这些果实形态性状之间的聚类可能会由于所检测到的qtl的共定位而产生较大的效应量估计。与此相反,大部分与皮肤雀斑和皮肤厚度相关的QTL为次要QTL。这些现象在其他品种的果实品质QTL中很常见,反映了它们的多基因特性和环境条件的高影响[5,12,26,32].
果肉甜味是定量遗传的,许多研究揭示了多个相关qtl,包括桃、苹果和草莓等蔷薇科[22,26,38].在多个基因组位置检测肉甜度的QTLS,其效果范围(高达84%)。几个QTL与蔗糖合成酶基因有关(SUSY1)家族和一个编码液泡H +焦磷酸酶的基因,该酶催化溶质积累[22,28].目前的研究是对木瓜的首次研究,并提出果肉甜度是在“RB2”和“Sunrise Solo”之间的杂交中受多基因控制的。至少有两个基因组区域被确定,并与负责生长发育和蛋白质跨膜转运活性的基因相关。正如预期的那样,“日出独唱”(更甜的父母)的等位基因导致后代的甜味增加。第VII组甜性状相关的主效QTL,包含与SNP位点直接相连的生长发育和蛋白跨膜转运活性基因;sCT_80_454708和sCT_12_1083429需要进一步探索。应该通过更广泛的基因型靶向扩增和反向遗传学方法来评估它们的稳定性和功能关联[50.,70].
果实重量、长度和宽度的遗传治理在包括番茄在内的许多水果作物中得到了广泛的研究[40], 胡椒 [81]和甜瓜[28].因此,成员Ovate, sun和fw2.2在相关QTL中检测到基因家族[40,81].在木瓜中,果实重量和大小的QTL在F2“日出独唱”x第356行人口[64.]和' Khaek Dum ' x ' 2H94 ' [5但在目前的研究中,两者并没有关联卵形,太阳或fw2.2基因(5].相反,本研究LGI上的果实重量、长度和宽度QTL与之前与拉长果实相关的番木瓜雄性专一区非常接近。对sCT_6_2754743、sCT_6_2392635、sCT_50_1447788和sCT_6_2331252这4个SNP标记定位在这些性状的主要QTL 1 cM范围内,其功能关联有待进一步探索。
皮肤雀斑是影响木瓜果实品质的主要问题之一,其遗传基础尚不清楚。Eloisa等人[20.研究表明,木瓜果实的皮肤雀斑受天气条件、果实生长和果实含糖量的影响较大。在本研究中,皮肤雀斑QTL分析未发现皮肤雀斑与果肉甜度相关的QTL,但观察到皮肤雀斑、果实硬度、果实宽度和长度的QTL共定位。事实上,皮肤雀斑是由lgii、VI和IX上的几个次要qtl调控的(各占3.23 ~ 8.5%)。然而,这可能是由于缺少基因组覆盖和潜在的上位性相互作用,从而减少了小效应qtl的检测[62.].因此,针对本研究确定的三个位点,可能不足以改善木瓜的皮肤质量。
在番茄,葫芦和苹果中最广泛地研究了果实固体和肉厚度变化的遗传基础[13,36,68.,78].已经描述了与亚乙烯响应因子和扩张,果胶甲基酯酶和蛋白质 - 赖氨酸甲基转移酶基因家族的乙烯响应因子和肉厚度相关的大多数QTL。14,78].同样,本研究在‘RB2’x‘Sunrise Solo’定位中发现了编码果胶分解过程和乙烯激活信号通路的基因,表明这些基因在木瓜中具有类似的功能。在3 cM窗口内,对果实硬度和果肉厚度qtl的5个标记(sCT_751_466、sCT_751_404、sCT_6_237757、sCT_48_1243956、sCT_6_1666511)进行了定位。这些标记可能对未来的育种有帮助。
结论
综上所述,本研究验证了GBS技术在木瓜(F2人口“RB2”x“日出独奏”)。连续两年检测的果肉甜度、果重、宽度、长度、皮肤雀斑、硬度和果肉厚度的SNP遗传图谱和QTL以及相关的SNPs为候选基因的探索和选择性标记的开发提供了靶点区域。
方法
果实品质性状的植物材料及表型分析
亲本与226分离F2“RB2”X''Sunrise Solo'杂交的后代被种植在Mareeba,澳大利亚,并评估了两次收获的水果质量性状;2016年12月和2017年4月。实验中使用的两个父母是澳大利亚商业品种。这些由木瓜种子澳大利亚生产,他在这项科学研究中提供了他们使用的许可。根据格里菲斯大学研究委员会批准的植物议定书,植物实验在格里菲斯大学环境与科学学院进行。在每次收获时,采集来自每个植物的三种果实,并根据木瓜手册中概述的方法,针对肉甜度,果实重量,果实长度,水果宽度,果实雀斑,肉厚度和果实的定量表型数据进行测量并测量([49.],附加文件1:表S1,附加文件2:表S2,附加文件3.:图S1)。
基因分型(GBS)和SNP鉴定
使用GBS方法来检测父母和F之间的单核苷酸多态性(SNP)2基因组。为此,我们使用delaporta等人改良的CTAB协议提取gDNA [17从亲本和F2后代。用NanoDrop 1000c (Thermo Fisher Scientific, Australia)测定gDNA的质量和数量,并将其稀释至100 ng/μl。如Peterson等人所述,DNA样本在澳大利亚墨尔本的澳大利亚基因组研究机构使用基于ddrad的文库制备协议送往GBS。[56.].DNA被一种限制性内切酶(PstI和MseI)仅选择与RE站点(每个端的一次)的标签用于图书馆准备并在Illumina Hiseq2500测序平台上测序,产生100bp单端读数。父母DNA被测序,f2每次测序个体以产生SNP目录(Genbank SRA Rescription:Prjna544124)。使用堆栈软件V1.46,原始GBS读取并根据其条形码序列进行分类和分类[10].所得过滤的读取(来自每个样品的高质量序列)与木瓜参考基因组'SUNUP'变体对齐[46.]使用Bowtie2版本2.3.2 [37].
在Stacks2 v2.00beta5中使用gstacks命令进行SNP识别[10]仅在父母之间获得双位等位基因SNPS多态。随后,使用SNPSIFT v4.3p过滤SNP [61.最小读深度大于5 (DP > 5), Phred基因型质量评分大于20 (GQ > 20)。此外,SNPs的基因组位置根据‘Sunup’参考基因组确定[46.]并用于分配SNP ID。使用内部R脚本进行进一步的SNP过滤[59.].>缺失80%的基因座被丢弃。缺失基因型的归位使用LinkImputeR v1.1.1进行[47.]并导致1701个高质量的SNP基因座,用于联动地图结构。
连锁图施工
在使用OneMap R包去除复制和单数标记后构建初始连接图[44.[以5.0的差距(LOD)阈值为5.0的对数和0.25的最大重组分数(max.rf)阈值。随后,排除了连杆基团(含有少于四个基因座和任何解释标记的LG。快速链描绘(RCD)算法用于在每个LG内订购标记[18].然后,选择LG中的10个等间隔的标记以使用“make_seq”和“比较”功能来创建有序标记的框架。将剩余标记与“Order_Seq”功能添加到框架中,其中“Order_Seq”功能具有LOD 3.0的定位标记的最低阈值。然后使用“纹波”功能检查标记的组合(在四个标记的窗口大小内),以获得最终标记顺序。Kosambi映射函数估算厘米厘重(cm)的地图距离[35].
利用“select_segreg”函数去除偏离预期分离比显著的标记,构建最终的连锁图谱,其余标记再次聚类为LG,按上述顺序排序。初步及最终地图以Mapchart显示[73].R/qtl包[8用来生成用于QTL分析的输入文件。
QTL定位
使用WinQTLCART软件版本2.5进行QTL分析[75,76]首先,使用非参数kruskal-wallis测试进行单一标记分析,以单独缔合标记和特征。然后,进行间隔映射分析以在地图上定位QTL位置。选择复合间隔映射(CIM)作为灵敏度的映射方法,并为每个特征启用多个电位QTL检测。使用标准CIM模型(用于控制标记的值5的型号6的型号6和向前回归)。LOD阈值由具有显着性水平的1000个置换测试确定(p)设为0.05。分别分析了2016年和2017年两套果实品质性状数据,以评估QTL的稳定性,并检测额外的季节性QTL。LOD为> 3,表型变异贡献率为> 10%的QTL为主效QTL [69.].此外,在两个收获中出现的一个QTL被归类为“稳定”。加性效应被估计,正值表明来自“RB2”的等位基因增加了性状得分,负值表明来自“Sunrise Solo”的等位基因增加了性状得分。
关联标记和推测的候选基因的鉴定
SNP标记与QTL峰区显著相关采用95%置信区间Kruskal-Wallis检验(p≤0.05)。随后,“Sunup”参考基因组的基因注释数据库(http://www.plantgdb.org/XGDB/phplib/download.php?GDB=Cp)和国家生物技术信息中心(NCBI;https://blast.ncbi.nlm.nih.gov/blast.cgi.)及植物酵素(https:///phytozome.jgi.doe.gov/pz/portal.html.用于搜索主要QTL峰值区内所识别的标记和候选基因的位置信息。在显着的SNP位置的两侧的侧翼序列被用作对DNA数据库的Blast搜索中的查询和番木瓜ASGPBv0.4, e值≤1e−15,识别≥70%,覆盖率≥50%。与每个BLAST命中相关的基因本体(GO)术语使用GO Consortium BLAST服务器(http://www.geneontology.org.).
可用性数据和材料
在本研究期间生成的序列数据已在GenBank存储库中存放,其中包含加入码Prjna507836https://www.ncbi.nlm.nih.gov/sra/PRJNA507836和prjna544124 https://www.ncbi.nlm.nih.gov/sra/prjna544124。支持本研究结果的其他数据可在文章及其补充信息文件中获得。
缩写
- 妊娠:
-
扩增片段长度多态性
- CIM:
-
复合间隔映射
- cM:
-
厘摩
- DP:
-
最小深度阅读
- GBS:
-
一个genotyping-by-sequencing
- 走:
-
基因本体论
- GQ:
-
Phred基因型质量评分
- 格林:
-
连杆组
- LOD:
-
概率的对数
- MAS:
-
分子标记辅助选择
- QTL:
-
定量特质基因座
- RAPD:
-
随机扩增多态性DNA
- 恢复:
-
快速链描绘
- SNP:
-
单核苷酸多态性
- SSR:
-
简单序列重复
参考
- 1.
Abiola O,Angel Jm,Avner P等人。定量特质基因座的性质和识别:社区观。NAT Rev Genet。2003; 4(11):911-6。
- 2.
Alheit KV,Reif JC,Maurer HP,Hahn V,Weissmann Ea,Miedaner T,WürschumT.检测Treatione中的分离失真基因座(xTriticosecale Wittmack),基于高密度DArT标记共识遗传连锁图谱。BMC基因组学。2011;12(1):380。
- 3.
正如乔丹。数量性状位点分析在植物育种中的应用现状与展望。植物品种。2002;121(4):281 - 91。
- 4.
Bielenberg DG, Rauh B, Fan S, Gasic K, Abbott AG, Reighard GL, Okie WR, Wells CE。桃低温需求和花期的snp连锁图谱构建及QTL分析[碧桃(l)类等)。PloS one。2015; 10 (10): e0139406。
- 5。
陈志强,陈志强,陈志强,陈志强,陈志强,陈志强。一种基于AFLP标记的番木瓜高密度遗传图谱的构建。基因组。2009;52(8):716 - 25所示。
- 6。
王志强,王志强,王志强,等。影响番木瓜果实大小和形状的数量性状的遗传定位。摩尔品种。2012;29(2):457 - 66。
- 7.
Brettell Ri,Johnson Pr,Kulkarni vj,MüllerW,Bally是。通过受控授粉生产的杂交芒果中果实特征的遗传。在:VII国际芒果研讨会,卷。645;2002. p。319-26。
- 8.
布罗曼,吴赫,森Ś,邱吉尔。R/QTL:试验组合的QTL定位。生物信息学。2003;19(7):889 - 90。
- 9.
霍亨洛赫(Hohenlohe P, Cresko W, Postlethwait)。堆栈:从短读序列构建和基因分型新位点。G3:基因、基因组、遗传学。2011; 1(3): 171 - 182。
- 10.
Catchen J, Hohenlohe PA, Bassham S, Amores A, Cresko WA。人口基因组学的分析工具集。摩尔生态。2013;22(11):3124 - 40。
- 11.
Celik I,Gurbuz N,Uncu AT,Frary A,Doganlar S.基因组宽的SNP发现和QTL映射用于使用基因分型通过测序使用基因分型进行粘土基因吡啶的近交系线(Ibls)中的果实质量特征。BMC基因组学。2017; 18(1):1。
- 12.
番茄感官品质数量性状位点(qtl)遗传背景、世代和年份的稳定性应用计算机学报。2006;112(5):934-44。
- 13.
陈志强,陈志强,陈志强,等。番茄和辣椒果实大小和形状的QTL定位。植物学报,2006;54(3):191-203。
- 14.
查普曼NH, Bonnet J, Grivet L, Lynn J, Graham N, Smith R, Sun G, Walley PG, Poole M, Causse M, King GJ。番茄果实硬度相关数量性状位点的高分辨率作图揭示了与复杂组合位点相关的上位性相互作用。植物杂志。2012;159(4):1644 - 57。
- 15.
陈C, Yu问侯年代,李Y,尤斯蒂思M,斯凯尔顿RL, Veatch啊,群再保险公司Diebold L,看到J,冯Y建设sequence-tagged高密度遗传图谱的比较结构和进化基因组学在brassicales木瓜。遗传学。2007;177(4):2481 - 91。
- 16。
Davey JW, Hohenlohe PA, Etter PD, Boone JQ, Catchen JM, Blaxter ML.全基因组遗传标记的发现和下一代测序的基因分型。[j] .自然科学进展,2011;12(7):499。
- 17.
Dellaporta SL,Wood J,Hicks JB。植物DNA小型分析:II版。植物mol biol报告。1983; 1(4):19-21。
- 18.
Doerge RW光碟。通过快速链描述构建遗传图谱。中国农业科学(英文版)。
- 19.
Dole J,Weber DF。使用重组近交系检测影响重组的定量性状基因座。遗传学。2007年; 177(4):2309-19。
- 20。
Eloisa M,Reyes Q,Paull Re。在独奏番木瓜果子的皮肤雀斑。SCI Hortic。1994年; 58(1-2):31-9。
- 21.
Elshire RJ, Glaubitz JC, Sun Q, Poland JA, Kawamoto K, Buckler ES, Mitchell SE。一个强大的,简单的基因分型测序(GBS)方法的高多样性物种。《公共科学图书馆•综合》。2011;6:e19379。
- 22.
Etienne C,Rothan C,Moing A,Plomion C,Bodenes C,Svanella-Dumas L,Cosson P,Penerien V,Monet R,Dirlewanger E.糖和有机酸含量在桃中的糖和QTL [碧桃(l)类等)。Theor Appl Genet 2002; 105:145-59。
- 23.
Evans EA, Ballen FH。全球番木瓜生产、贸易和消费概况。没有出版。FE914。盖恩斯维尔:佛罗里达大学;2012.https://edis.ifas.ufl.edu/pdffiles/fe/fe91400.pdf..2018年9月30日
- 24.
FAOSTAT。作物生产。2014.http://www.fao.org/faostat/en/#data/QC.浏览全文2018年10月14日。
- 25.
Guajardo V, Solís S, Sagredo B, Gainza F, Muñoz C, Gasic K, Hinrichsen P.高密度甜樱桃(李属鸟结核L.)使用通过测序(GBS)检测的微卫星标记和SNP的链接地图。PloS one。2015; 10(5):E0127750。
- 26.
Guan Y, Peace C, Rudell D, Verma S, Evans K. qtl检测苹果个体糖和可溶性固形物含量。摩尔品种。2015;35(6):135。
- 27。
网址:Hallingbäck HR,吴海霞林木性状QTL效应的数量和大小估计。树基因基因组。2016;12:110。
- 28。
hael - beja R, Tzuri G, Portnoy V, Lotan-Pompan M, Lev S, Cohen S, Dai N, Yeselson L, Meir A, Libhaber SE, Avisar E.高度富集甜瓜品质qtl和EST标记的遗传图谱。中国科学(d辑:地球科学)2010;
- 29.
Howie B, Marchini J, Stephens M.与数千个基因组的基因型imputation。G3(贝塞斯达)。2011; 1(6): 457 - 70。
- 30.
Huang YF,波兰JA, Wight CP, Jackson EW, Tinker NA。利用基因分型测序(GBS)发现栽培燕麦的基因组。《公共科学图书馆•综合》。2014;9 (7):e102448。
- 31。
Hussain W, Baenziger PS, Belamkar V, Guttieri j, Venegas JP, Easterly A, salam A, Poland J. genetic typing- sequencing derived高密度连锁图谱及其在面包小麦旗叶性状QTL定位中的应用Sci众议员2017;7(1):16394。
- 32。
Kenis K, Keulemans J, Davey MW。苹果果实品质性状qtl的鉴定及稳定性植物基因组学。2008;4(4):647-61。
- 33.
《森林树木和水果作物的关联映射》。中国生物医学工程学报。2012;63(11):4045-60。
- 34.
Kim Ms,Moore Ph,Zee F,Fitch MM,Steiger DL,Manshardt RM,Paull Re,Drew Ra,Sekioka T,Ming R.遗传多样性番木瓜AFLP标记显示。基因组。2002;45(3):503 - 12所示。
- 35.
从重组值估算地图距离。安优生学。1944;12:172-5。
- 36.
果皮组织微结构和细胞壁多糖化学性质对不同硬度番茄株系的影响不同。采后生物技术。2013;76:83-90。
- 37.
Langmead B, Salzberg SL.快速间隙读对齐与领结2。Nat方法。2012;9(4):357。
- 38.
Lerceteau-Köhler E, Moing A, Guérin G, Renaud C, Maucourt M, Rolin D.草莓果实中糖和有机酸的QTL分析。Acta Hortic。2006;708:573-7。
- 39。
Liu H ., Bayer M ., Druka A ., Russell J ., Hackett CA ., Poland J ., Ramsay L ., Hedley PE ., Waugh R.,通过测序(GBS)对栽培大麦短aristatum-e (ari-e)位点进行基因分型评价。BMC基因组学,2014;15(1):104。
- 40.
刘杰,范艾克,丛博,唐克斯利。导致梨形番茄果实形成的一类新的调控基因。中国科学院院刊。2002;99(20):13302-6。
- 41.
Ma H,Moore Ph,Liu Z,Kim MS,Yu Q,Fitch MM,Sekioka T,Paterson Ah,Ming R.高密度连杆映射显示番木瓜中性别测定基因座的重组抑制。遗传学。2004; 166(1):419-36。
- 42。
McDaniel SF, Willis JH, Shaw AJ。连锁图谱揭示了苔藓群体间杂交分离畸变的复杂基础Ceratodon紫色.遗传学。2007; 176(4):2489-500。
- 43。
McCormack JE,HIRD SM,Zellmer AJ,Carstens BC,Brumfield Rt。下一代测序对神奇地理学和文学学的应用。mol phylocyet evol。2013; 66(2):526-38。
- 44。
Margarido GR, Souza AP, Garcia AA。OneMap:用于异交物种遗传制图的软件。Hereditas。2007;144(3):78 - 9。
- 45.
Martínez-García PJ, Parfitt DE, Ogundiwin EA, Fass J, Chan HM, Ahmad R, Lurie S, Dandekar A, Gradziel TM, Crisosto CH.桃子果实品质性状的高密度SNP定位和QTL分析(碧桃l .)。树基因组。2013;9(1):19-36。
- 46.
Ming R, Hou S, Feng Y, Yu Q, Dionne-Laporte A, Saw JH, Senin P, Wang W, Ly BV, Lewis KL, Salzberg SL.转基因热带果树木瓜基因组草案(番木瓜Linnaeus)。自然。2008; 452(7190):991。
- 47.
钱学森,王志强,王志强,王志强:基于基因型的非模式生物基因型分析。G3基因组的基因。遗传学。2015;5:2383 - 90。
- 48.
基于snp的西葫芦果实相关性状的饱和遗传图谱及其QTL分析BMC基因组学。2017;18(1):94。
- 49.
番木瓜评价手册:生产力和果实品质性状。2017.https://www.horticulture.com.au/globalassets/hort-innovation/resource-assets/pp15000-papaya-evaluation-handbook.pdf.2017年9月1日。
- 50.
利用CRISPR/Cas9系统对苹果基因组进行高效编辑。Sci众议员2016;6:31481。
- 51.
经合组织。Concensus文件关于木瓜新品种的组成考虑因素(Carica Papaya L.):重点食品和饲料营养,抗养分,毒剂和过敏原:经济合作和发展组织;2009年。https://www.oecd.org/science/biotrack/46815336.pdf.2018年10月14日访问
- 52.
Oliveira EJ, Amorim VBO, Matos ELS, Costa JL, Silva Castellen M, Pádua JG, Dantas JLL。木瓜微卫星标记多态性研究(番木瓜l .)。植物学报。2010;28(3):519-30。
- 53.
Oliveira EJ, Fraife FGA, Freitas JPX, Dantas JLL, Resende MDV。木瓜商品化杂交种F2群体分离的植株选择。作物育种应用生物技术。2012;12:191-8。
- 54。
巴黎JR,Stevens JR,Catchen JM。丢失参数空间:堆栈的路线图。方法ECOL EVOL。2017; 8(10):1360-73。
- 55。
利用微卫星标记评价加勒比海地区番木瓜遗传多样性。见:国际木瓜研讨会。吉隆坡:伊什;2005.p . 93 - 101。
- 56。
彼得森BK,Weber Jn,Kay Eh,Fisher Hs,Hoekstra他。双层摘要Radseq:一种廉价的模型和非模型物种中的Novo SNP发现和基因分型的方法。Plos一个。2012; 7(5):E37135。
- 57.
波兰JA, Rife TW。植物育种和遗传学的基因分型。植物基因组。2012;5(3):92 - 102。
- 58.
Praveen KRB, Hameedunnisa B, Sunil N, Thirupathi RM。甜瓜数量性状的方差分析(Cucumis梅洛l .)。国际微生物学杂志。2017;6(6):2277-85。
- 59.
R核心团队。统计计算的语言和环境。2017.https://www.r-project.org.2017年2月1日
- 60。
罗切特NC, Catchen JM。利用堆栈从RAD-seq短读数据获得基因型。Nat Protoc。2017;12:2640-59。
- 61.
关键词:果蝇,遗传毒性,化学突变,SnpSift abstract:麝猫。2012;35分。
- 62.
Semagn K, Bjørnstad Å, Ndjiondjop MN。植物遗传定位的原理、要求和展望。生物技术学报2006;5:2569-87。
- 63.
Silva FF, Pereira MG, Ramos HCC, Junior PCD, Pereira TNS, Viana AP, Daher RF, Ferreguetti GA。番木瓜形态农艺性状和果实品质相关遗传参数的估计。作物育种应用生物技术。2008;8:65-73。
- 64.
Sondur SN, Manshardt RM, Stiles JI。基于随机扩增多态性DNA标记的木瓜遗传连锁图谱。中国科学(d辑:地球科学)1996;93(4):547-53。
- 65.
Sorkheh K,Malysheva-Otto LV,Wirthensohn Mg,Tarkesh-Esfahani S,Martínez-GómezP.ClagageDurecilibium,遗传关联测绘和作物植物中的基因本地化。Genet mol Biol。2008; 31(4):805-14。
- 66。
番木瓜经济性状的遗传连锁定位及QTL分析番木瓜l .)。Hortscience。2004; 39(4):8880-9。
- 67。
利用随机扩增多态性DNA评价木瓜品种间的亲缘关系。应用计算机学报1993;85(6-7):697-701。
- 68。
Sun R,Chang Y,Yang F,Wang Y,Li H,Zhao Y,Chen D,Wu T,Zhang X,Han Z.使用限制性位点相关的DNA测序构建的致密SNP遗传图可以检测控制苹果果的QTLS质量。BMC基因组学。2015; 16(1):747。
- 69.
坦克斯利SD。映射多根。Annu Rev Genet。1993年; 27(1):205-33。
- 70.
田胜,姜玲,高强,张军,宗敏,张辉,任勇,郭胜,龚刚,刘芳,徐永华。西瓜CRISPR/ cas9基因的高效敲除。植物学报2017;36(3):399-406。
- 71。
Torkamaneh D, Laroche J, Belzile F.全基因组SNP从基因分型(GBS)数据调用:七个管道和两种测序技术的比较。《公共科学图书馆•综合》。2016;11 (8):e0161333。
- 72。
范德根布罗克B,布雷因P,歌德伯P,罗梅金-彼得斯E,金德特T,盖森GA。厄瓜多尔番木瓜及其野生亲缘(番木瓜科)的AFLP分析。应用电子学报2002;105(2-3):289-97。
- 73.
vooorres重新。MapChart:用于链接地图和QTL的图形演示软件。j hered。2002; 93(1):77-8。
- 74.
Wai Cm,Ming R,Moore pH,Paull Re,Yu Q.染色体特异性细胞遗传学标志的发展及番木瓜中键入碎片的合并。Trop Plant Biol。2010; 3:171-81。
- 75.
王胜,巴斯滕CJ,曾志斌。Windows QTL Cartographer 2.5。2012 a。http://statgen.ncsu.edu/qtlcart/WQTLCart.htm.2017年2月1日
- 76.
王伟,黄舒,刘勇,方忠,杨玲,华伟,袁胜,刘舒,孙军,庄明,张勇(1个大白菜高密度遗传连锁图谱的构建与分析)芸苔属植物oleraceal . var.性)。BMC基因组学,2012;13(1):523。
- 77.
吴杰,李维,李米,汗马,李Xg,陈h,尹h,张sl。使用SNP和SSR标记的高密度遗传联系地图结构和梨果实QTLS的鉴定。J Exp Bot。2014; 65(20):5771-81。
- 78。
徐旭,陆璐,朱波,徐强,齐旭,陈旭。黄瓜果实果肉厚度的SLAF-seq QTL定位。Sci众议员2015;5:15829。
- 79。
Yu Q, Tong E, Skelton RL, Bowers JE, Jones MR, Murray JE, Hou S, Guan P, Acob RA, Luo MC, Moore PH.木瓜基因组物理图谱及其基因组序列。BMC基因组学。2009;10(1):371。
- 80.
袁XJ,李谢,潘杰斯,王克,姜,李诗,邓·图库,他hl,si mx,荔枝,吴艾兹。遗传联系地图建设与QTL在黄瓜果实相关性状的位置。植物品种。2008; 127(2):180-8。
- 81.
Zygier S, Chaim AB, Efrati A, Kaluzky G, Borovsky Y, Paran I.辣椒第2和第4染色体果实大小和形状的QTL定位及其与番茄QTL的比较。应用计算机学报。2005;111(3):437-45。
致谢
我们感谢Lecker农业有限公司为澳大利亚Mareeba的田间工作提供种植设施和后勤支持。两位作者宣称他们没有相互竞争的利益。
资金
该项目由澳大利亚园艺创新有限公司(Horticulture Innovation Australia Limited)资助,使用木瓜产业税和澳大利亚政府的资金(项目编号PP15000:“提高木瓜质量的新基因靶标”)。在研究的设计、数据的收集、分析和解释以及手稿的撰写中,资助机构没有任何作用。
作者信息
从属关系
贡献
联合国和CK构思了这项研究和设计的实验;RF监督工作和IB参与数据的序列分析和解释;联合国进行实验和统计分析;联合国领先地撰写稿件;CK,IB和RF参与了它的修订。所有作者阅读并认可的终稿。
通讯作者
道德声明
伦理批准和同意参与
不适用
同意出版
不适用
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
额外的文件1:
表S1。2016年和2017年父母线果实质量特征及其F1和F2Progeny人口果实品质性状的平均值和标准偏差。该表呈现了七种水果质量特征的表型评价。
额外的文件2:
表S2。2016年和2017年各世代表型变异及各品质性状遗传力估算。
附加文件3:
图S1。父母,F1和F2种群中果实质量特征(A-G)的表型变异。平均值和中值值由黑色实线( - )和红色交叉(+)表示,分别在每个箱区域的内部。中父值由水平虚线表示。
额外的文件4:
表S3。‘RB2’x‘Sunrise Solo’F2群体初始连锁图谱综述
额外的文件5:
表S4。SNP标记和隔离概述。
额外的文件6:
图S2。“RB2”X'日出独奏的遗传图谱与QTL果实品质性状。由初始地图和最终地图产生的LG分别由LG1-LG23和I-X标记。左窗格指示每个SNP的CM中的遗传映射位置。两张地图之间的同源性在绿松石中突出显示。最终地图右侧的彩色条表示QTL位置和LOD间隔95%的信心;哪里有肉甜味(SWE) - 红色;果子重量(魏);果子长度(Len)-Green;水果宽度(Wid) - olive;皮肤祛斑(Fre)-Pink; flesh thickness (THI)-black; fruit firmness (FIR)-blue. Data from harvest year 2016 and 2017 are represented in solid and diagonal-stripe bar, respectively.
额外的文件7:
表S5。果肉甜味和其他水果品质性状的相关snp和候选基因。
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
南塔湾,美国,坎查纳-乌多姆坎,加州,美国。et al。番木瓜中甜度和其他果实品质性状的联系映射和定量特质基因座。BMC植物BIOL.19,449(2019)。https://doi.org/10.1186/s12870-019-2043-0
已收到:
接受:
发表:
关键字
- 番木瓜繁殖
- 果实品质特征
- GBS
- QTL分析
- SNP标记

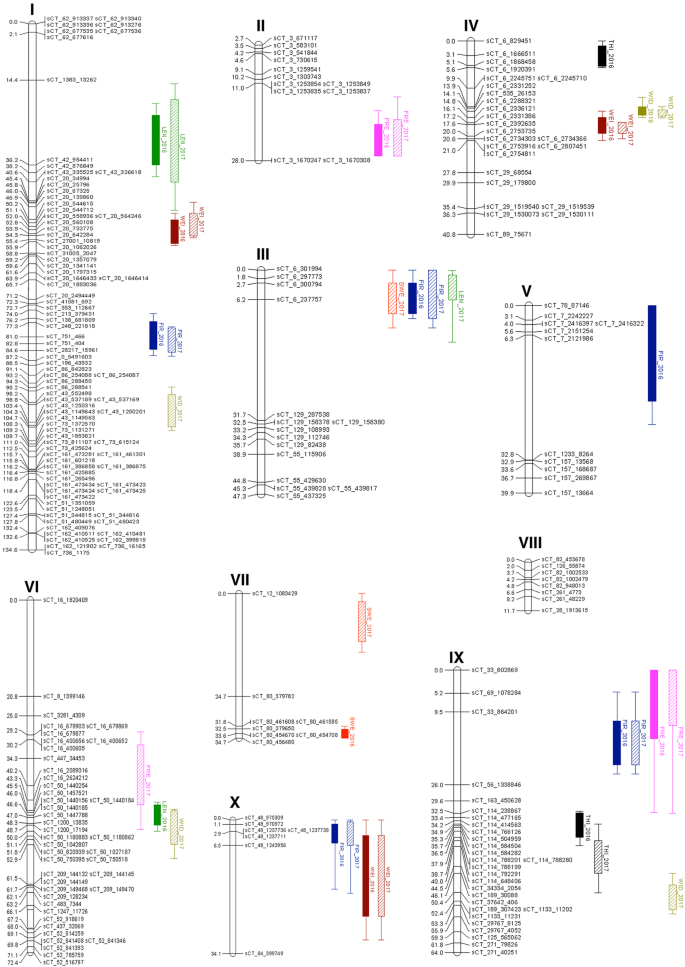
 ;水果重量(魏)布朗
;水果重量(魏)布朗 ;(莱恩)绿色水果长度
;(莱恩)绿色水果长度 ;水果宽度(WID)橄榄
;水果宽度(WID)橄榄 ;皮肤雀斑(FRE)粉红色
;皮肤雀斑(FRE)粉红色 ;肉材厚度(THI)-Black
;肉材厚度(THI)-Black ;果实硬度(FIR)-蓝色
;果实硬度(FIR)-蓝色 .2016年和2017年收获年的数据分别用实心条形和对角条形表示
.2016年和2017年收获年的数据分别用实心条形和对角条形表示