- 研究文章
- 开放获取
- 发表:
日本李子翻译起始因子eIFiso4G的沉默Prunus salicina影响易受…影响李子痘病毒(PPV)和小RNA的产生
BMC植物生物学体积19, 文章编号:440(2019年)
摘要
背景
在植物中,通过易感性编码的宿主因子(年代)基因对病毒感染是不可或缺的。抗性是通过损害或没有这些易感因素而实现的。许多年代基因已经从模型物种和作物物种中克隆,其中大多数是真核生物翻译起始复合物成员的编码,主要是eIF4E、eIF4G及其亚型。本研究的目的是探讨这些翻译起始因子在核果物种对沙尔卡(一种由沙尔卡病毒引起的疾病)敏感性中的作用李子痘病毒(PPV)。
结果
为此目的,发夹诱导基于的沉默构建体碧桃用正交实验生成Prunus salicina(日本梅)4E和4G沉默的植物根癌土壤杆菌-介导的转化和PPV的挑战。而衰减eIFiso4E转基因日本李子在我们的条件下无法再生,eIFiso4G11-,但不是eIFiso4G10 -,沉默植株对PPV表现出持久稳定的抗性。我们还研究了转基因和野生型日本李子在PPV感染后的si-和mi-RNA谱的变化,证实了新生成的小干扰(si) rna,来自于工程反向重复构建,是抗sharka的主要贡献。
结论
我们的结果表明年代翻译起始复合物亚型的基因功能是保守的李古鲁乌斯物种。我们讨论了利用RNAi沉默或功能缺失突变的不同亚型蛋白参与该复合体的可能性,以培育果树对sharka的抗性。
背景
Sharka,最严重的疾病影响石材水果物种(李古鲁乌斯SPP。),具有社会经济影响,特别是在欧洲的桃子和梅花果园的因果因子,李子痘病毒(PPV),流行。PPV被列为检疫性病原体,是农作物十大病毒之一[1]在欧洲拥有100亿多亿欧元的成本[2].它影响作物品种,如桃子、李子、杏、樱桃和杏仁,以及观赏植物和砧木品种[3.].因此,需要付出巨大的努力来识别和传递抗病种质,不幸的是,许多核果作物缺乏抗病种质,特别是桃子和日本李子[4].
在拟南芥(拟南芥),真核翻译起始因子4F复合物(eIF4F)及其亚型(eIFiso4F)被报道在病毒感染中起重要作用[5].EIF4F复合物由MRNA帽结合蛋白(EIF4E)和大型支架蛋白(EIF4G)组成。其对应于eifiso4f复合体,由Eifiso4e和Eifiso4g同种型组成。由于其在病毒感染中的重要作用,EIF4E和EIF4G翻译引发因子(和同种型)由以下称为易感性(年代)基因6].因此,在其中一个或另一个突变年代基因导致对Potyviridae, Tombusviridae, Bromoviridae, Waikaviridae科病毒的隐性抗性。的确,年代已显示拟南芥中鉴定的基因在作物种类中,包括番茄,胡椒,莴苣,大麦,马铃薯,烟草,米饭,豌豆[7,8,9,10,11,12,13,14,15,16,17,18,19].我们假设它也适用于李古鲁乌斯拟南芥的同源物年代基因。先前的一份报告描述了eIF (iso)4E宿主因子在PPV侵染拟南芥中的重要作用[20.].同样,Nicaise等人[21揭示了拟南芥的翻译无功能eifiso4g1突变体是抗PPV,但不是其eifiso4g2和EIF4G.淘汰的同行。虽然以前的研究表明,Eifiso4F复合物对于拟南芥的PPV感染是必不可少的,但从其他毒素中获得的遗传证据表明,取决于宿主植物,Poty病毒对给定的4F或ISO4F复合物具有特定要求。例如,莴苣马赛克病毒(LMV)使用eIFiso4E感染拟南芥,但需要eIF4E感染生菜[14]因为在六倍体欧洲李子中,eIFiso4E被证明与李属有对于PPV,它将表明Prunus SPP。,是eIF (iso)4F复合物对PPV感染很重要[22]。但是,eIFiso4E在李古鲁乌斯二倍体基因组(23]在沉默沉默时提出了可能的病毒抗性的可能性成本的担忧李属eIFiso4E.这一假设无法在欧洲李子中得到验证eIFiso4E沉默的植物不幸死亡(Tian L et al, personal communication)。
在此背景下,我们的研究重点是识别年代二倍体日本李对PPV的敏感基因Prunus salicina核果作物品种的遗传变异可进一步进行基因操作。我们已经证明,在日本梅花沉默Eifiso4g11.的副本李古鲁乌斯EIF4G同种型导致对M和D PPV菌株的抗性。但是,虽然我们确认PPV似乎招募了寄主EIFISO4F复合体的石头果树感染,但我们无法再生可行eIFiso4E沉默的二倍体李树。我们的研究结果表明,翻译起始因子是功能易感性因子李古鲁乌斯沉默具有冗余拷贝的同源基因会导致对PPV的稳定和持久的抗性,不会对植物发育产生不利的表型影响。
结果
基于在李古兰亚美尼亚卡(杏),我们确定了全长和功能性李古鲁乌斯直接同源为每个如果遇到基因[23,24].单位点编码与eIF4E具有高氨基酸同源性的蛋白质(Prupe.4G072600), eIFiso4E (Prupe.1G046600)和eIF4G (Prupe.2G118700)翻译开始因子。相比之下,使用BLAST分析,我们确定了两种不同的基因座为EIFISO4G,prupe.1g395100.和Prupe.7G265100以下简称为PpeIFiso4G10和PpeIFiso4G11分别为(24].在本报告中,我们针对上述5个候选基因位点进行转录后沉默,以评估其在基因沉默中的作用李古鲁乌斯真核起始因子对PPV感染的敏感性。为此,我们使用了一种基因沉默策略,通过在pBINPLUS/ARS或pHELLSGATE 12载体中克隆自互补发夹结构设计RNAi结构(图)。1一个)。
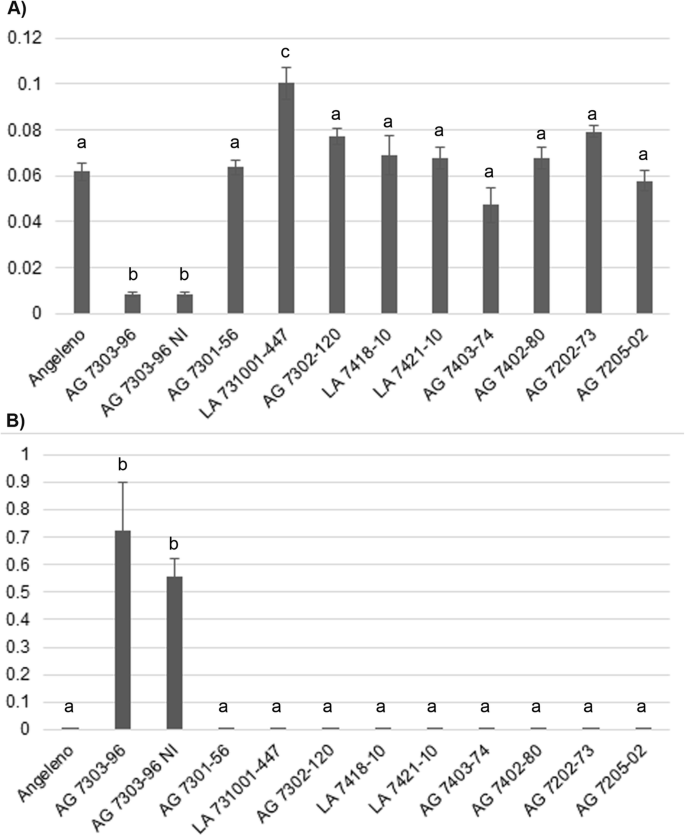
转基因日本梅花线的生产和鲨鱼抗性。一个用于日本李变换的RNAi结构的示意图表示。PCR的碎片PpeIF4E,ppeifiso4e.,PpeIF4G,PpeIFiso4G10,PpeIFiso4G11按照箭头所示的相反方向克隆。b评估对PPV感染的抗性。值表示每种转基因线的三到四个重复的平均光学密度值,用于PPV感染超过3至5个营养循环。虚线显示了健康负面控制的基础OD值('Agenteno')。AG:‘Angeleno’转基因株系;洛杉矶:“拉里·安”转基因株系。以73开头的数字被转换成pH值12-PpeIFiso4G11;74pH值12-PpeIFiso4G10;72年,pH值12-PpeIF4G53岁pBINPLUS / ARS-PpeIF4E.除NI(未感染)和PPV-D (PPV-D8和PPV-D RdF Rouge de Fournés分离株)外,所有植株都嫁接在感染PPV-M的砧木上。c无症状PpeIFiso4G11 -沉默(左)和PPV症状受感染的野生型'angeleno'(右)日本李子。右侧的易感植物显示出芽的枯萎病。dppv感染的“洛杉矶人”叶片显示褪绿症状和静脉清理的特写镜头
转基因日本李子树的世代
中描述的RNAi结构方法利用转基因技术对日本李子品种Angeleno (AG)和Larry-Ann (LA)进行了转化,并对73个转基因品种,NPTII-阳性植株,其中17株转移到法国INRA的高限制温室进行PPV抗性测试(附加文件)7:表S1)。值得注意的是,尽管Wang等人[22报道了Prunus的沉默eIFiso4E在六倍体欧洲李中,没有二倍体李转化pbinplus / ars-ppeifiso4e构造可以在我们的条件下再生。因此,这个结构从研究的其余部分中删除了。
其中的一个pH值12-PpeIFiso4G11转化植株对PPV-M和PPV-D均具有抗性
转基因日本李系最初接种了PPV-M20分离物(属于PPV-M菌株),如Decroocq等人所述[25].感染ppv的植株保持在高限制的温室中,并进行3至5个营养周期的评分。一个营养周期包括3个月的低温期和3个月的生长期,在此期间,我们对每个日本李转基因株系的3 ~ 4个技术重复进行了2次PPV系统侵染的ELISA检测。通过症状观察和血清学试验验证了所有转基因株系和对照植株对PPV感病砧木的侵染情况。当所有砧木均为PPV阳性时,采用酶联免疫吸附试验(ELISA)对转基因日本李接穗的病毒系统侵染进行检测。数字1b总结所有营养循环和技术重复的PPV抗性评分数据。在第一个冷处理周期后,所有未转化的对照植物(即‘Angeleno’和‘Larry Ann’)均为PPV阳性。只有一个转基因株系AG 7303-96在连续5个营养循环后对PPV-M的感染保持阴性(图7303-96)。1b). PPV-M感染症状如图所示。1c和d。
为检测ag7303 - 96抗性的持久性,将未侵染的转基因株系与PPV-D8或PPV-D Rouge de Fournés嫁接在砧木上。经过三个营养循环后,所有的复制都保持ppv阴性,如图所示。1B,从而证明了稳定耐用的PPV感染。PPV感染的转基因系的时间点评分,沿着三个营养循环,均显示在附加文件中1:图S1。
减少的PpeIFiso4G11在转基因日本李植株中的表达与抗PPV感染有关
通过估算每个转基因日本株系中真核起始因子编码的目标基因的相对表达量来确定RNAi结构诱导沉默的有效性和特异性(图)。2和额外的文件2:图S2)。而ag7303 - 96转基因株系则表现出明显的降低PpeIFiso4G11转录物水平(图。2),其他目标基因似乎都没有沉默(附加文件2:图S2A至C)PDK.Intron在AG 7303-96植物中但不在其他转基因中(图。2).这提出了额外文件中描绘的所有其他转基因克隆的假设7表S1是嵌合体nptII-在微繁殖期间呈阳性,但在嫁接后不呈阳性PpeIFiso4G10ag7303 - 96的转录水平也有部分下降(但不是全部)2:图S2A)。
相对表达分析PpeIFiso4G11和PDK.在转基因日本李子树叶中的内含子。采用qRT-PCR检测转录水平。所有值都被标准化为TEFII然后与野生型‘洛杉矶人’基因表达水平进行比较。误差棒代表三个重复中分析的两个生物重复的标准偏差。AG:转基因“洛杉矶”李子系;洛杉矶:转基因“拉里·安”李子线。除NI(未感染)外,所有植株都嫁接在感染PPV-M的砧木上。转基因行号与图中所示行号对应。1湾重复之间的标准偏差用竖线表示。采用R软件v. 3.2.5的Kruskal-Wallis秩和检验进行统计分析。用小写字母注意到显着不同的值(P值≤0.05)。一个qRT-PCR检测PpeIFiso4G11转基因日本李株系的转录水平。bPDK内含子在转基因日本梅花中的转录表达。注意,这里只测试pH12-ppeif4g,pH 12-ppeifiso4g10和pH12-ppeifiso4g11转化线
21和24核苷酸(nt)长分子的生产靶向MIF的中心结构域PpeIFiso4G11与PPV抗性有关
为了更好地了解易感性基因沉默防御过程,通过小RNA高通量测序检查了野生型和转基因日语李子中的siRNA和miRNA的表达谱和没有病毒感染。在此显示AG 7303-96转基因线组成型成分在21-至24-核苷酸(NT)之间的SiRNA分子在VII外显子之间进行长测PpeIFiso4G11(Prupe.7G265100)基因与最初靶向的MIF4G结构域相对应(图。3.模拟)。siRNA标记分子的数量(每百万读114601次)是3400个,比分散在各处的分子高出14456倍PpeIFiso4G10和PpeIF4G分别(附加文件)3.:图S3)。生产的生产PpeIFiso4G11-特异性siRNA也通过茎环逆转录聚合酶链反应(RT-PCR)进行双重检查(附加文件)8:表S2和附加文件4:图S4a)。
Si-和miRNA模式P. salicina ppeifiso4g11-沉默的植物。一个的积累PpeIFiso4G11-MIFAG7303-96叶中的特异性Si-RNA。(rpm)每百万读,总计数为289,133读Prupe.7G265100轨迹。b的示意图表示Prupe.7G265100李树eIFiso4G11因子的基因序列编码。序列下的罗马数字表示(I)为包含起始密码子的第一个外显子,VII对应于MIF4G结构域。c的映射PpeIFiso4G11-MIF特定的si-RNA读取pH值12-PpeIFiso4G11构造(d).e特定和共享miRNA的Venn图,无感染(Ni),PPV-M或PPV-D感染AG7303-96文库
抗和感PPV日本李树miRNA的产生模式
以上小RNA NGS数据用于分析mirna在应对病毒感染中的贡献。我们检测了野生型和转基因日本李子在病毒或模拟感染嫁接上的mirna表达谱9:表S3A-C,图。3.e,额外的文件5:图S5)。我们还通过stem-loop RT-PCR验证了少量的小RNA测序数据(附加文件)8:表S2)。有趣的是,我们找到了一个常见的病毒感染标记,miR171,它已经被证明在体内积累烟草benthamiana感染PPV [26],在感染RSV(水稻条纹病毒,[27]))和在烟草PVX(马铃薯X病毒,28])。在我们的情况下,MIR171仅在PPV感染条件下累积,无论是野生类型的'Agenteno'和InPpeIFiso4G11-silenced ag7303 - 96转基因株系。miR171表达的诱导抗性转基因线是有趣的,但我们不能排除这种可能性的易位miR171小分子从PPV-infected根茎接穗或有限但仍现有运动中的病毒颗粒抗接穗可能引发miR171归纳。用茎环RT-PCR验证了这一假设(附加文件)4图S4B),其中我们仅在感染PPV-M的接穗和砧木样品中检测到miR171。
另外两个感兴趣的小rna是miR399和miR168,它们只在接种PPV-M或PPV-D的野生型“Angeleno”中积累,在健康植物或抗ppv AG 7303-96转基因株系中从未检测到,无论是否感染(附加文件)8:表S2,附加文件9:表S3A和B)。
未感染、野生型和转基因的miRNA产生模式PpeIFiso4G11-silenced,日本李子树
在小RNA分子中,无论是在野生型“洛杉矶人”或在PpeIFiso4G11-silenced转基因行(附加文件9:表S3C和附加文件6图S6),两个mirna值得注意:miR156和miR172。这两种mirna都参与了植物发育从幼年到成年阶段的过渡,通过一个顺序的作用:miR156通过抑制下游转录因子,包括miR172,作为营养阶段的主要调控因子,miR172在过表达时促进开花[29].在我们的研究中,miR156在AG 7303-96转基因株系中积累,而miR172在未转基因的日本李株系中积累(附加文件9:表S3C)。茎环RT-PCR检测野生型“Angeleno”和AG 7303-96转基因品系的miR156和miR172,仅部分证实小RNA高通量测序。事实上,在这个验证步骤中,miR172在转基因和未转化的“洛杉矶”植物中都有积累(附加文件)8:表S2)。然而,这意味着,虽然目前在AG7303-96植物中观察到正常的营养生长,但我们将注意居住期和开花能力PpeIFiso4G11沉默转基因线。
讨论
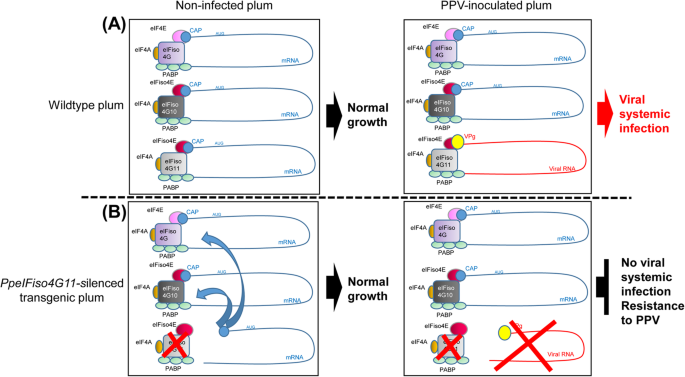
本研究建立了核果类果树持久和稳定抗沙卡的新策略。我们表明,李属翻译起始因子之一的下调eIFiso4G基因与生产相连21至24-ntPpeIFiso4G11具体的sirnas。下调PpeIFiso4G11这里的表达足以在至少五个连续的营养期和至少两种不同的病毒株PPV-M和PPV-D中包含病毒感染(参见图中提出的模型)。4).类似地,Rodríguez-Hernández等[30表明了有效的沉默Cucumis梅洛真核翻译起始因子4E基因与21- 24nt的出现有关Cm-eIF4E-衍生的小干扰rna (sirna),从而导致对四种不同病毒的抗性。在我们的案例中,它证实了之前用拟南芥或P. Domestica./ PPV病理系统假设PPV需要功能性EIFISO4E / EIFISO4G复合体(例如EIFISO4F)来感染其主体,但不是其EIF4F对应物[20.,21,22].尽管这些同源复合物在宿主蛋白翻译中存在一些功能冗余,但potyvirus显示出显著的亚型特异性,eIF4F和eIFiso4F复合物在病毒感染中通常具有不同的非重叠功能[31]因此,我们提出了核果树中PPV劫持eIFiso4F的模型,如图所示。4.
二倍体李对PPV易感的eifiso4f模型。一个在二倍体李古鲁乌斯物种中,eIF4F翻译起始复合物由与mRNA (m7Gppp)帽相互作用的eIF4E、与eIF4E和聚腺苷结合的PolyA结合蛋白(PABP)相互作用的eIF4G和eIF4A组成。另一方面,两个eIFiso4G (PpeIFiso4G10和PpeIFiso4G11)是转录的,相应的蛋白质都能够形成eIFiso4F复合物,与单个PpeIFiso4E亚型PABP和eIF4A相互作用(a,左面板)在该模型中,PPV使用的唯一eIF4G和亚型是PpeIFiso4G11。在感染PPV的非转基因野生型李子中,病毒基因组连接蛋白VPg与涉及PpeIFiso4G11的eIFiso4F复合物的相互作用导致植物敏感性(右图,红色).病毒RNA基因组用红色表示,宿主mRNA用蓝色表示。b在PpeIFiso4G11-沉默李子,宿主细胞信使rna仍在招募eIF4F或/和eIFiso4F复合物,涉及PpeIF4G和PpeIFiso4G10(B,左图),从而防止植株的异常生长。然而,由于PpeIFiso4G11因子的缺失,病毒不再能够劫持eIFiso4F复合物(B,右图)。它会导致病毒周期的失败,病毒在转译、复制和/或细胞间运动中受到损害
在拟南芥中,未观察到对植物生长的不良影响eif4e.或eifiso4E功能缺失突变体,双突变体除外[32,33表示eIF4E表单之间的功能冗余。然而,在拟南芥,eIF4E有三份,即At4g18040、At1g29690和At1g29550,而eIFiso4E映射到单个位点At5g35620 [5].相比之下,在桃中,每个亚型只有一个位点对应eif4e.基因(Prupe.4G072600为了PpeIF4E和Prupe.1G046600为了ppeifiso4e.)因此限制了同种型之间的可能互补。这可以解释我们无法再生eifiso4E沉默植物自P. Salicina是二倍体。相反,Wang等人[22]能够测试eifiso4E-沉默的欧洲李系,可能是因为该寄主的高倍性水平(六倍体)。
在作物种类中,另一个与eIF4G因子或其亚型相关的病毒抗性案例在水稻中被记录。抗RYMV (水稻黄斑驳病毒(一种Sobemovirus)的基因突变eIFiso4G[7[RTSV(水稻桐树球形病毒Sequiviridae)正在招募eIF4G翻译起始因子[12].有趣的是,如果产生截短形式的等位基因不能在纯合状态下获得,证明功能性EIF4G对于稻米的正常生长至关重要[34].
在目前的研究中,我们还检测了野生型和转基因李子中小的非编码RNA分子的产生,如miRNAs和sirna,以及它们在应对病毒感染中的贡献。事实上,过去十年的许多研究表明,植物病毒改变小RNA谱,从而影响宿主基因调控(回顾见[35,36])。在PPV-感染后,我们确定了已经与病毒感染有关的小miRNA,其中MiR171 [26].这种小RNA在ppv耐药(PpeIFiso4G11-在PPV感染的砧木上嫁接的沉默的)或敏感的(野生型)接穗。该结果表明,miR171与对sharka的敏感性/抗性无关,而是PPV感染的标记,可以从感染的、敏感的砧木转移到PPV抗性接穗。
我们还鉴定了另外两个先前与病毒感染相关的小RNA,即miR399和miR168。同样,miR399在野生型非转基因水稻植株感染RSV时高表达,但在用病毒来源的ihpRNA策略工程的抗RSV转基因株系中不表达[37].MiR168,前一个稳定剂的MiR168的稳定剂观察到类似的情况,该调节剂在野生型日本梅子中显示出具有PPV菌株的野生型(本研究),而且还在拟南芥中或者n benthamiana接种CymRSV (Cymbidum ringspot病毒) [38]因此,这两个小RNA似乎与宿主对病毒感染的易感性有关。
尽管我们证明了PpeIFiso4G11相移的siRNA是对PPV抵抗的触发,减轻了减缓的效果PpeIFiso4G11对日本李子发展的表达也受到了质疑。未观察到对植物发育特征的多效性和可见性影响PpeIFiso4G11但对ag7303 - 96转基因株系的青壮年期和开花能力仍需关注。
方法
植物材料
李子基因转移和再生实验的种子外植体“Angeleno”和“Larry Ann”来自认证的商业果园(Fundo Quilamuta、Verfrut Rapel、Rapel Valley、智利大都会区)。用于嫁接和核酸提取的桃树“GF305”由拉丰苗圃(法国瓦拉斯)生产。
同源eIF4G及其亚型基因的鉴定碧桃
拟南芥的序列信息如果遇到从TAIR (拟南芥基因组v10,http://www.arabidopsis.org)数据库,并用于对假定进行比较搜索碧桃orthologues的如果(PpeIF4G) 和eIFiso4G(ppeifiso4g.)基因在植物区系v10.1 (碧桃基因组v2.1,http://www.phytozome.net.)数据库(40].不同的副本eIFiso4G获得并命名同源物Eifiso4g10.和Eifiso4g11.根据先前的研究[24[参见GenBank成员国EU558279和EU558280]。使用ClustalW软件进行额外的序列比对[41].
李沉默结构的设计与克隆
为每个都定义了沉默片段p . persica基于RNAIWB平台描述的参数的正交基因(http://www.rnaiweb.com/rnai/sirna_design/) [42].使用寡行走预测发夹结构的稳定性和每个发夹产生的可能序列的数量(http://rna.urmc.rochester.edu/servers/oligowalk.html) [43].
桃总RNA提取
100毫克“GF305”叶片从离体桃苗中收集,冷冻在液氮中,研磨并与InviTrap Spin Plant RNA Mini Kit (Thistle Scientific, Ltd., Glasgow, UK)的提取缓冲液混合。根据制造商提供的说明,使用本工具包执行其余程序。
互补DNA(cDNA)合成和沉默臂克隆和测序
设计与目的序列互补的引物,扩增±200bp长的片段(附加文件)10:表S4)。为了限制同型(eIF4E vs eIFiso4E或eIF4G vs eIFiso4G)或/和同型(eIFiso4G10 vs eIFiso4G11)的同时沉默,我们选择了差异最大的序列来设计基因沉默结构。将限制位点添加到引物序列中,以促进目标片段的亚克隆(见附加文件)10:详细信息表S4)。
1微克总RNA用DNase I (Thermo Fisher Scientific, Waltham, Massachusetts, USA)处理,以消除基因组DNA污染。对于cDNA的合成,根据制造商的说明使用Superscript II RT系统(Thermo Fisher Scientific)。将200纳米克cDNA与1.25 U的High Fidelity PCR Enzyme Mix (Thermo Fisher Scientific)、5 μl的10X High Fidelity buffer、0.4 mM的dNTPs混合物和0.5 μM的引物混合(附加文件)10:表S4),并将最终体积调整为50 μl。根据以下热剖面,使用生态系统(美国加利福尼亚州圣地亚哥Illumina)进行扩增:1 94分钟 摄氏度;35 94℃时的变性周期 摄氏20度 s、 55℃退火 摄氏20度 s、 延长至72分钟 摄氏30度 s、 最后一个扩展名是2 72分钟 °C.扩增片段克隆到pGEM-T Easy载体(美国威斯康星州麦迪逊Promega)中,通过测序(韩国首尔Macrogen)确认,并鉴定为p . persica(Pp)eIF4E(PpeIF4E),ppeifiso4e.,PpeIF4G,PpeIFiso4G10,PpeIFiso4G11.
沉默结构
在PCR扩增靶碎片后,PpeIF4E和ppeifiso4e.被亚克隆到PDK内含子的两侧的Phannibal载体中[44],然后将含内含子的构建物转移到pSPORT2质粒(Addgene)的Not1限制性内切位点,然后进行终切生态R1欣dIII转入pBINPLUS/ARS二进制矢量[45].与此同时,PpeIF4G,PpeIFiso4G10,PpeIFiso4G11消音武器被重组成pENTR/D进入载体(赛默飞雪科学公司)。随后,将150 ng的进入载体与150 ng的pHellsgate12载体孵育[46]根据制造商的说明,在LR克隆酶II酶二酶混合(Thermo Fishific)。通过测序(宏泡)确认构建体(注意到PBINPLUS / ARS-或PHG12-取决于接受二进制载体),并鉴定为PBINPLUS / ARS-PPEIF4E,PBINPLUS / ARS-PPEIFISO4E,PBG12-PPEIF4G,PHG12-PPEIF(ISO)4G10和PHG12-PPEIF(ISO)4G11。每个所得构建体含有由单个PDK Intron分离的前向和反向取向的目标EIF基因片段,用于PBINPLUS / ARS [45]pHellsgate12的双pdk和cat内含子[46].
Prunus salicina遗传转化与再生
每个PBINPLUS / ARS-或pH 12-构建体用于改变根瘤菌辐射杆菌(Sinom。根癌土壤杆菌) GV3101应变。根据Urtubia等人的研究,电穿孔活性农杆菌细胞[47],使用基因脉冲(Bio-Rad,California,USA)和以下条件:1.25 V,400Ω和25μF。将含有每个构建体(PbinPlus / Ars或PHG12-克隆)的产生的农杆菌克隆用于'Angeleno'和'Larry Ann'成熟种子的幼杆内侧段的遗传转化[47].虽然没有使用选择剂,但按照这些作者所指示的程序诱导芽再生。没有选择条件保持2个月,直到单株形成明显。
日本李转基因株系的筛选与鉴定
采用相同的再生培养基,每2周增加卡那霉素浓度(25、50、75、100 mg/L)进行植株筛选。在卡那霉素100 mg/L作用2个月后,用PCR对耐药品系进行初步鉴定。基因组DNA (gDNA)是从T0植物的叶片样品中制备的,如[48使用改性提取缓冲液[十六烷基三甲基溴化铵(CTAB) 2% (p/v),聚乙烯吡咯烷酮(PVP) 40,000 2% (p/v)), Tris-HCl (pH 8.0) 100 mM, EDTA 25 mM, NaCl 2m,亚精胺0.05% (p/v), ß-巯基乙醇2%]。使用Bio Spec-nano计算机(Shimadzu, California, USA)对gDNA进行定量。50毫微克的gDNA用于扩增反应;作为一种控制反应李古鲁乌斯用引物TEF2_F1和TEF2_R1扩增翻译延伸因子2 (TEF2) (Prupe.4G138700),得到129 bp长的片段。为nII基因(Genebank: AJ311874.1)和引物对NPTII_F5/NPTII_R5或NPTII_int_Fw/NPTII_int_Rv相互替换,分别得到687和399 bp的片段。为根瘤菌辐射杆菌syn。农杆菌属radiobacterVirg基因(Genbank:Ng_034482.1),引物virg_fw和virg_rv产生了391 bp的片段。根据前述条件进行扩增反应[47].引物在附加文件中10:表S4。
李子痘病毒日本李转基因株系抗PPV表型分析
用PPV对每个转基因系进行三到四个重复,连续三到五个营养周期(见本研究中PPV抗性试验方案)[25])并与类似的对照组、未接种的植物(“Angeleno”和“Larry Ann”)进行比较。一株对杏树高毒力的PPV-M分离物(即PPV-M20)[25,用于第一轮PPV抗性筛选。然后用PPV-D菌株(PPV-D8和PPV-D Rouge de Fournés)的分离株检测PPV-M耐药株。PPV全身感染经ELISA验证,每个营养周期2次。光密度数据按[25].然后对3至5个连续的植物生长周期的平均OD值进行平均,最后在PPV抗性评分过程中使用的阴性对照进行标准化(未感染,' angelo '平均OD值)。
小RNA大规模测序
利用PPV-M或PPV-D感染、抗性或敏感的转基因植株进行了大量的sRNA测序。未转化的(以下称为野生型)“洛杉矶”植物被加入到分析中。所有叶片标本均在PPV试验的第三个营养循环中采集。小RNA是按照[49].图书馆和排序程序由[49]使用Miseq(Illumina)序列仪。
Si-和miRNA的鉴定和靶预测
小干扰RNA(siRNA)读取,从非转化(野生型)和转基因中获得Prunus salicina在模拟和病毒感染条件下,使用CLC Genomics Workbench软件(CLC Bio, Aarhus, Denmark)对“Angeleno”小RNA库进行分析,如[49].选择长度在21- 24 nt之间的序列,然后比对p . persica如果(Prupe.2G118700.1)和eIFiso4G编码位点(Prupe.7G265100.1 forPpeIFiso4G11和prupe.1g395100.1 for.PpeIFiso4G10).作为Montes等人建立了对模板序列的过滤读取的高罚款设置。[49].使用Microsoft Excel 2013(Microsoft,Redmond,WA,USA)和自制脚本进行进一步分析。
通过使用CLC (CLC Bio)将reads映射到miRbase数据集,从之前过滤的小RNA数据集获得Prunus miRNA物种[50].从每个实验(未感染的,+PPV-M, +PPV-D,PpeIFiso4G11沉默洛杉矶人未受感染的,PpeIFiso4G11-silenced Agenteno + PPV-M,PpeIFiso4G11-silenced Angeleno+PPV-D)被归一化,并选择显示截断> 1 read per million的分子。使用Microsoft Excel 2013 (Microsoft)和自制脚本(可根据要求提供)对miRNA数据集进行进一步比较分析。候选靶基因是通过提交选定的分子到psRNA目标服务器- 2017年发布[51].靶基因显示每个miRNA的最佳期望数,如[51使用桃参考基因组推导出来[52].
RT-qPCR分析确定eIF4E,如果和异构体mRNA表达水平的日本李转基因植物
从第三轮PPV检测中收集的PPV攻击转基因系的叶片中提取总RNA。使用oligo dT(16)引物,在使用Invitrogen/Revertaid/Ribolock逆转录酶试剂盒(酵母菌)中的Superscript II®逆转录酶进行互补DNA合成之前,使用Turbo DNaseI(Thermo Fisher Scientific)对其进行处理。量化的相对qPCRPpeIF4E,PpeIF4G,PpeIFiso4G10和PpeIFiso4G11利用LightCycler®480 SYBR Green I master和十分之一的新合成cdna在Roche Diagnostics的LightCycler 480 II机器上进行mRNA积累。的表达TEFII(Prupe.4G138700)作为内部参考。在重新测序的基础上,针对每个拷贝设计了特异性引物李古鲁乌斯翻译起始因子基因以及内参基因(附加文件)10:表S4)。循环条件和相对表达统计分析的RT-qPCR程序在其他地方有详细介绍[53].通过使用R V 3.2.5软件的kruskal-wallis测试分析概述序列核查野生型和转基因系的表达水平时统计上不同的值。
茎环逆转录聚合酶链反应(RT-PCR)检测小的非编码rna
采用末端环式RT-PCR检测NGS分析中获得的目标小RNA种。根据Castro等人的研究,茎环引物针对miRNAs和siRNA设计[54,使用“amiRNA设计器”工具中的“茎环引物设计器”选项www.fruit-tree.genomics.com,标签“Biotools”。引物序列在附加文件中呈现8:表S2。对于反应,5次营收循环中的叶样品中的总RNA被加工如Sánchez等人所示。[55].将五百纳克总RNA与1μL的每个环底漆(股份10mm)混合,并在最终反应体积为15μl的最终反应体积中为0.5μl。将混合物在65℃温育5分钟,然后在冰上冷却2分钟。将4微升5倍的第一个股线缓冲液(Thermo Fischer Scientific)与2μl0.1MDTT,0.1μL的RNase-Out(40u /μl)(Invitrogen,USA)和0.25μL的上标II逆转录酶混合(200μl/μl)(Thermo Fischer Scientific)。将混合物旋转下来,使用Eppendorf Mastercycler Nexus热循环仪(Thermo Fisher Scientific)如下施加“脉冲RT”:在16°C和30°C的60℃下的30分钟,30分钟 °C and 1 s at 50 °C. The mixture was incubated for 5 min at 85 °C. The amplified product was used as a template for a second PCR in which the Reverse primer was mixed with the corresponding Forward primer (Additional file8:表S2)。PCR条件为95℃3 min, 95℃30s, 60℃30s, 72℃30s,共35个循环。最后在72°C下拉伸5分钟。PCR产物通过琼脂糖凝胶电泳分离,使用3%低范围琼脂糖(Bio-Rad)和25 bp分子量标准(Thermo Fisher Scientific),或者使用片段分析仪自动平行毛细管电泳系统。
选择来自发夹的小干扰RNA显示NGS实验中每百万百万百万的读数,用于这些PCR检测。这些分子的命名法基于它们的相应数量的读数(附加文件8:表S2)。
可用性数据和材料
在当前研究中生成的数据集,即小RNA NGS数据(21至24 nt)可在INRA数据门户(https://data.inra.fr/)在链接下可以自由地检索:https://data.inra.fr/dataset.xhtml?persistentId=doi:10.15454/O07SXQ.
缩写
- 如果遇到:
-
真核翻译启动因子
- ELISA:
-
酶联免疫试验
- PPV:
-
李子痘病毒
- Q-RT-PCR:
-
定量逆转录聚合酶链反应
参考
- 1.
García JA, Glasa M, Cambra M, Candresse T. Plum pox virus and sharka: a model potyvirus and a major disease。植物病理学杂志。2014;15(3):226-41。
- 2.
李痘病毒及其与沙尔卡病相关的估计费用。植保通报。2006;36:202-4。
- 3.
沙尔卡流行病学与全球管理策略:多年生植物病害控制的经验教训。出自:NK VA编辑。植物病理学年度回顾,第53卷,第53卷;2015.p。357。
- 4.
李痘病毒的抗病育种。在:Ahmed Hadidi(编辑),Marina Barba(编辑),Thierry Candresse(编辑),Wilhelm Jelkmann(编辑),梨果和核果的病毒和病毒样疾病。圣保罗:APS出版社;2011.p . 401 - 406。
- 5.
翻译起始因子:植物RNA病毒感染的一个薄弱环节。植物科学进展。2006;11(1):40-4。
- 6.
翻译启动因子介导的植物对病毒的抗性;2011.
- 7.
Albar L,Bangratz-Reyser M,Hébrarde,Ndjiondjop Mn,Jones M,GhesquièreA. EIF(ISO)4G翻译引起因子赋予米饭的高阻水稻黄斑驳病毒.植物j . 2006; 47:417-26。
- 8.
Andrade M,Abe Y,Nakahara Ks,Uyeda I. Cyv-2对三叶草黄静脉病毒在豌豆中的抗性由真核激发因子4e控制。J Gen Plant Pathol。2009; 75(3):241-9。
- 9.
Bruun Rasmussen M,Moller IS,Tulinius G,Hansen JKR,Lund OS,Johansen IE.翻译起始因子4E的同一等位基因介导豌豆对两种马铃薯Y病毒的抗性。Mol植物-微生物相互作用。2007;20(9):1075-82。
- 10.
Gao Z, Johansen E, Eyers S, Thomas CL, Noel Ellis TH, Maule AJ。potyvirus的隐性抗性基因,sbm1,确定了翻译起始因子eIF4E在细胞到细胞运输中的新作用。植物j . 2004; 40(3): 376 - 85。
- 11.
Kanyuka K, Druka A, Caldwell DG, Tymon A, McCallum N, Waugh R, Adams MJ。证明大麦隐性抗病毒位点rym4与真核翻译起始因子4E基因相对应。植物病理学杂志。2005;6(4):449-58。
- 12.
Lee JH, Muhsin M, Atienza GA, Kwak DY, Kim SM, De Leon TB, Angeles ER, colquio E, Kondoh, Satoh K,等。水稻(Oryza sativa)翻译起始因子基因(eIF4G)的单核苷酸多态性与水稻tungro球形病毒抗性相关。植物与微生物学报。2010;23(1):29-38。
- 13.
NADERPOUR M,Lund OS,Larsen R,约翰逊E.来自携带BC-3的PhoSolusualusualusuals的品种培养的PotyViral抗性与突变的EIF4E等位基因的纯合出存在有关。莫尔植物途径。2010; 11(2):255-63。
- 14
Nicaise V, germanretana S, Sanjuan R, Dubrana MP, Mazier M, Maisonneuve B, Candresse T, Caranta C, Le Gall O.真核翻译起始因子4E控制莴苣对Potyvirus莴苣花叶病毒的敏感性。植物杂志。2003;132(3):1272 - 82。
- 15
Nieto C,Morales M,Orjeda G,Clepet C,Monfort A,Sturbois B,Puigdomenech P,Pitrat M,Caboche M,Dogimont C等人。EIF4E等位基因赋予甜瓜中未聚致和非聚酰胺化的RNA病毒的抵抗力。工厂J. 2006; 48(3):452-62。
- 16
Ruffel S,Dussaul MH,Palloix A,Moury B,Bendahmane A,Robaglia C,Caranta C.一种自然隐性抗性基因马铃薯Y病毒在胡椒中对应于真核引发因子4e(EIF4E)。工厂J. 2002; 32(6):1067-75。
- 17.
关键词:隐性potyvirus抗性基因第一档次番茄和胡椒是同源物吗pvr2-eif4e.基因。基因组学。2005;274:346-53。
- 18.
在普通大麦(Hordeum vulgare, L.)中,真核翻译起始因子4E具有多等位基因隐性抗Bymovirus能力。植物j . 2005; 42(6): 912 - 22所示。
- 19.
拟南芥库库病毒增殖1和2基因座编码翻译起始因子4E和4G。J微生物学报。2004;78(12):6102 - 11所示。
- 20.
利用多重抗性性状控制小PPV侵染拟南芥.植物与微生物的互动。2006;19:541-9。
- 21.
关键词:拟南芥,potyvirus, eIF4E, eIF4G,协调和选择性募集2月。2007;581(5):1041 - 6。
- 22.
王X,Kohalmi S,Svircev A,Wang A,SanfaçonH,天L.宿主因子EIF(ISO)4E基因的沉默促进了梅花李的梅花病毒抗性。Plos一个。2013; 8(1):E50627。https://doi.org/10.1371/journal.pone.0050627.
- 23.
利用杏梅痘病毒候选基因的共显性标记(SSRs)对杏梅痘病毒的主要抗性位点进行了侧写。植物基因组学。2008;4(2):359-65。
- 24.
Marandel G, Pascal T, Candresse T, Decroocq v李子痘病毒在李属davidianaP1908与真核翻译起始复合物的不同成分紧密相连。植物病理学。2009;58:425–35。
- 25.
Decroocq S, corille A, Tricon D, Babayeva S, Chague A, Eyquard JP, Karychev R, Dolgikh S, Kostritsyna T, Liu S, et al.。对驯化和野生杏的历史及其对梅痘病毒抗性的贡献的新见解。摩尔生态。2016;25(19):4712 - 29。
- 26.
Simón-Mateo C, García JA。microrna引导的处理削弱李子痘病毒复制,但病毒很容易进化以逃脱这种沉默机制。J微生物学报。2006;80(5):2429 - 36。
- 27.
杜鹏,吴建军,张建军,赵松,郑华,高光,魏磊,李玉玲。病毒感染诱导保守的微rna前体的新阶段微rna表达。公共科学图书馆Pathog。2011;7 (8):e1002176。
- 28.
AI T,张L,高Z,朱CX,郭X.靶向植物PVX和PVY抑制抑制剂的人工小罗风介导的高效病毒抵抗力。植物BIOL。2011; 13(2):304-16。
- 29。
6 .吴刚,王建伟,王建伟,韦格尔,王建伟。miR156和miR172对拟南芥发育时间的调控作用。细胞。2009;138(4):750 - 9。
- 30.
Rodriguez-Hernandez Am,Gosalvez B,Sempere Rn,Burgos L,Aranda Ma,Trunier V.Melon RNA干扰(RNAi)线致密CM-EIF4E,显示出广泛的病毒抗性。莫尔植物途径。2012; 13(7):755-63。
- 31.
Truniger V, Aranda MA。对植物病毒的隐性抗性。Adv Virus Res. 2009; 75:119-59。
- 32.
Duprat A, Caranta C, Revers F, Menand B, Browning KS, Robaglia C.拟南芥真核起始因子(iso)4E对植物生长是必需的,但对potyvirus的敏感性是必需的。植物j . 2002; 32(6): 927 - 34。
- 33.
Lellis Ad,Kasschau Kd,Whitham Sa,Carrington JC。拟南芥的易感性突变体揭示了在potyvirus感染期间EIF(ISO)4e的基本作用。Curr Biol。2002; 12(12):1046-51。
- 34.
Macovei A, Sevilla NR, Cantos C, Jonson GB, Slamet-Loedin I, Cermak T, Voytas DF, Choi IR, Chadha-Mohanty P.通过CRISPR/ cas9靶向突变产生的水稻eIF4G新等位基因表明水稻tungro球形病毒具有抗性。生物技术学报2018;16(11):1918-27。
- 35.
PVsiRNAdb:植物独家病毒衍生的小干扰rna数据库。数据库。2018;2018 (2018):bay105。
- 36.
Islam W, Qasim M, Noman A, Adnan M, Tayyab M, Farooq TH, Wei H, Wang LD. Plant microrna: front - line players against intrusion病原菌入侵。活细胞Pathog。2018;118:9-17。
- 37.
通过SiRNA介导的病毒性抗性,通过患者耐病毒抗性检测到检测到检测到转基因水稻的SiRNA和miRNA表达曲线的改变。Plos一个。2015; 10(1):E0116175。
- 38
várallyayé,válóczia,ágyiá,burgyánj,havelda z.植物病毒介导的mir168的诱导与Argonaute1积累的镇压有关。Embo J.2010; 29(20):3507-19。
- 39
在转木本多年生李子树中,长类siRNA的积累与李子痘病毒的抗性有关。植物与微生物学报。2005;18(8):794-9。
- 40.
verde i,Jenkins J,Dondini L,Micali S,Pagliarani G,Vendramin E,Paris R,Aramini V,Gazza L,Rossini L等。桃v2.0释放:高分辨率连杆映射和深度重新排列改善染色体尺度组装和恒星。BMC基因组学。2017年; 18:225。
- 41.
马拉金,黑盾G,布朗NP,陈娜R,麦格蒂根PA,麦克威廉H,瓦伦丁F,华莱士IM,威尔姆A,洛佩兹R等。Clustal W和Clustal X版本2.0。生物信息学。2007;23:2947–8。
- 42.
基于RNA干扰的siRNA设计。生物科技Nat》。2004;22:326-30。
- 43.
吕志军,马修斯DH。OligoWalk:一个利用杂交热力学的在线siRNA设计工具。核酸学报2008;36:W104-8。
- 44.
Helliwell Ca,Waterhouse Pm。发夹RNA介导的基因在植物中的构建和方法。在:酶学中的方法,Vol。392.学术出版社;2005. p。24-35。http://www.sciencedirect.com/science/article/pii/S0076687904920022
- 45.
王志强,王志强,王志强,等。基于pBINPLUS的植物转化矢量研究。生物学技术。2008年,44(6):753 - 6。
- 46.
Wesley SV, Helliwell CA, Smith NA, Wang MB, Rouse DT, Liu Q, Gooding PS, Singh SP, Abbott D, Stoutjesdijk PA,等。构建高效、高效、高通量的植物基因沉默设计。植物j . 2001; 27(6): 581 - 90。
- 47.
Urtubia C, Devia J, Castro A, Zamora P, Aguirre C, Tapia E, Barba P, Dell'Orto P, Moynihan MR, Petri C, et al.;农杆菌介导的杨梅遗传转化。植物学报2008;27(8):1333-40。
- 48.
关键词:DNA提取,DNA提取,生物信息学葡萄.Am j enol vitic。1994年; 45(1):102-6。
- 49.
Montes C,Castro A,Barba P,Rubio J,Sanchez E,Carvajal D,Aguirre C,Tapia E,Dellorto P,Decroocq V等。在梅花痘病毒挑战期间,尼古拉·宾夕法尼亚州尼古拉·施特海姆人的差分RNAi回应用发夹诱导构建体。病毒基因。2014; 49(2):325-38。
- 50。
Kozomara A,Griffiths-Jones S. Mirbase:使用深度测序数据注释高置信微大乐队。核酸RES。2014; 42(D1):D68-73。
- 51。
戴XB,庄ZH,PXC Z. PSRNATarget:植物小型RNA目标分析服务器(2017年发布)。核酸RES。2018; 46(W1):W49-54。
- 52。
戴Xb,赵px。psrnatarget:植物小型RNA目标分析服务器。核酸RES。2011; 39:W155-9。
- 53。
Poque S, Pagny G, Ouibrahim L, Chague A, Eyquard JP, Caballero M, Candresse T, Caranta C, Mariette S, Decroocq V.拟南芥(Arabidopsis thaliana) rpv1位点的等位基因变异控制着对梅子痘病毒的部分抗性。BMC Plant Biol. 2015;15:159。
- 54。
Castro Á, Quiroz D, Sánchez E, MdlÁ M, Aguirre C, Ramírez A, Montes C, Prieto H.利用重叠长引物合成人工葡萄miRNA 319e及其基因沉默研究。生物科技J》。2016;233:200-10。
- 55.
Sánchez E, Tricon D, Mora R, Quiroz D, Decroocq V, Prieto H.一种快速高效的提取日本李和其他李属植物小RNA的方法。生物工程学报。2017;30:103-9。
确认
我们感谢Thierry Mauduit用于技术援助和护理转基因植物。我们非常感谢A.G. Abbott(Univ。肯塔基州,Lexington部门的肯塔基州,Lexington),致命和英语校对的手稿和有价值的评论。
资金
这项工作得到了一个双边经济共同体-的支持Sud该项目目前由Horizon 2020欧洲MSCA RISE项目(#777794缩写:TESS)资助。卢比奥先后获得智利国际会议和法国驻智利圣地亚哥大使馆的资助。
作者信息
从属关系
贡献
VD和HP在JR的贡献下构思和设计了实验;JR、ES和DT进行实验;JR开发了RNAi结构体,获得了梅子转基因品系;CM与CA一起进行小RNA实验;ES生成mi和si-RNA数据,经HP和CA分析;JPE和AC提供试剂/材料/ELISA分析,DT提供Q-RT-PCR分析和表型分析。VD和HP写了这篇论文。所有作者阅读并批准了手稿的最终版本。
相应的作者
道德声明
伦理批准和同意参与
不适用
同意出版
不适用
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
额外的信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:图S1。
用DAS-ELISA检测野生型和转基因日本李系李子痘病毒(PPV)超过三个营养周期。值代表每个转基因株系在3个营养周期内检测PPV侵染3至4个重复的平均光密度值。AG:‘Angeleno’转基因株系;洛杉矶:“拉里·安”转基因株系。以73开头的数字被转换成pH值12-PpeIFiso4G11;74pH值12-PpeIFiso4G10和72年pH值12-PpeIF4G.除NI(未感染)和PPV-D (PPV-D8和PPV-D RdF Rouge de Fournés分离株)外,所有植株都嫁接在感染PPV-M的砧木上。
附加文件2:图S2。
相对表达分析PpeIFiso4G10(一种),PpeIF4G(B)和PpeIF4E(C)在转基因日本李树的叶子中。采用qRT-PCR检测转录水平。所有值归一化到TEFII内参基因,然后与野生型‘angelo’基因表达水平进行比较。误差棒代表三个重复中分析的两个生物重复的标准偏差。重复之间的标准偏差用竖线表示。采用R软件v. 3.2.5的Kruskal-Wallis秩和检验进行统计分析。标记相同字母的转基因和野生型日本梅株系在统计上是相同的(P价值观< 0.05). 没有明显不同的价值观PpeIF4G(B)和PpeIF4E(C)表达由Kruskal-Wallis检验证明P值≤0.05。AG:转基因“洛杉矶”李子系;洛杉矶:转基因“拉里·安”李子线。转基因行号与图中所示行号对应。1湾
附加文件3:图S3。
的积累PpeIFiso4G10(一)和PpeIF4G(C) AG7303-96转基因株特异性siRNA。(B)是代表PpeIFiso4G10和(D)PpeIF4G序列。(rpm)每百万读,总计85和20读PpeIFiso4G10和PpeIF4G位点,分别。
附加文件4:图S4。
茎环逆转录聚合酶链反应(RT-PCR)检测选定的sirna和miRNAs。(A)在ag7303 - 96转基因日本李子和桃GF305砧木中检测到转基因sirna(#6261和7361)。(B) miR171e 3p在未转化“Angeleno”和转基因AG 7303-96日本李树接穗和砧木中的表达模式。
附加文件5:图S5。
野生型、非转基因和AG7303-96转基因“Angeleno”文库中特异性和共享的miRNAs的Venn图。
附加文件6:图S6。
非感染(NI)、PPV-M或PPV-D感染野生型(非转基因)“Angeleno”文库中特异性和共享的miRNAs的维恩图。
附加文件7:表S1。
日本李转化与抗性试验综述。1的数量Prunus salicina外植体处理根癌土壤杆菌.构造对应于图2中所示的构造。1一个,除了pBINPLUS / ARS-PpeiFiso4E我们无法再生出可存活的转基因克隆。
附加文件8:表S2。
茎环逆转录聚合酶链反应(RT-PCR)检测选定的sirna和miRNAs。* Number表示每个siRNA分子从NGS中读取的数量,如图所示。3..循环底漆:小写字体表示环路中的互补残留物;粗体,斜体大写表示反向底漆的杂交位点;双带下划线的字体,残留物与小RNA杂交。正向底漆:双带下划线的字体表示与小RNA杂交的残留物。wt:非转化,野生类型'angeleno';AG7303-96:PPEIFISO4G11-沉默,转基因的'Angeleno'日本植物。
附加文件9:表S3。
野生型“Angeleno”和野生型中差异表达的miRNA物种及其靶标PpeIFiso4G11沉默转基因线。1治疗是指受PPV-M或PPV-D的未感染(Ni),植物的状态。2基因型是指野生型、未转化的梅子(' Angeleno ' NT)或AG7303-96转基因植物(这里命名)。PpeIFiso4G11沉默”)。总标准化读操作被计算为特定分子的总读操作数除以库中的总读操作数。从pSRNA软件中获得了对靶基因的期望[51].NCBI链接可以检索每个目标蛋白的身份和真实/假定的功能。A)表达差异最大的miRNA物种Prunus salicina“洛杉矶”野生型(非转基因)植物。B)表达差异最大的miRNA物种Prunus salicina“安杰里诺”PpeIFiso4G11- 植物。c)唯一表示的miRNA物种Prunus salicina野生型或洛杉矶人PpeIFiso4G11- 植物。
附加文件10:表S4。
用于生产RNAi结构物的引物列表,转基因株系的验证和相对表达分析的估计。1斜体部分为用于克隆RNAi沉默结构的限制位点的序列。2片段尺寸没有在引物中添加限制位点。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
卢比奥,Sánchez, E, Tricon, D。et al。日本李子翻译起始因子eIFiso4G的沉默Prunus salicina影响易受…影响李子痘病毒(PPV)和小RNA的产生。植物生物学19,440(2019)。https://doi.org/10.1186/s12870-019-2047-9
收到了:
接受:
发表:
关键字
- 李子
- 李树痘病
- 电阻
- RNAi.
- 易感基因
- 翻译启动因子