抽象的
背景
红花草莓属间杂交获得的一种新型观赏花(Fragaria.×蕨麻),色泽鲜艳,花期延长,果实可食。它的花颜色从浅粉色到红色不等。果实中积累的色素化合物与栽培草莓相同,但与花中积累的色素化合物不同。然而,花青素生物合成途径背后的转录事件尚未在花瓣着色中被完全描述。为了深入了解与花青素生物合成相关的调控网络,并识别关键基因,我们对粉色花草莓花瓣的转录组和代谢组进行了综合分析。
结果
红色和暗粉色花瓣主要颜料是花青素,其中花青素是主要化合物。目前还没有在白花杂交检测花青素。总共有50285非冗余个Unigenes从在三个发展阶段参与粉红色花草莓栽培品种四季红的红花瓣转录数据库获得。之间的个Unigenes发现显示显著差异表达,57用花色素苷或其它类黄酮合成,其中它们是由241个差异表达的转录因子家族的成员,如40个MYBS,47个bHLHs和41名顾问委员会调节相关联。基于与颜料化合物基因表达谱进行综合分析,在粉红色花草莓检查花着色的机理。新假说提出解释缺乏根据的转录组分析的白花草莓杂交种颜色的表型。表达模式FpDFR和FpANS不同颜色粉色草莓花青素含量积累规律的相关基因。此外,FpANS,FpBZ1和FpUGT75C1基因是导致粉色草莓杂交种白色花瓣中花青素缺失的主要因素。与此同时,竞争效应FPFL和FpDFR基因可能进一步抑制花青素的合成。
结论
这些数据对了解花瓣色素形成的分子机制具有重要意义,并将为整合新的潜在靶基因培育有价值的粉色花草莓品种提供有力的支持。
背景
草莓以其独特的香气、甜味和丰富的营养成分而闻名[1,2].作为高度重视的浆果作物之一,商业,观赏粉红色花草莓(PFS)品种已经开发出来,来自白花草莓之间的十字架(Fragaria.×ananassa杜赫)和紫花沼泽蕨(Potentilla Palustis.(l)吟游诗人。)3.].PFS是其鲜艳的色彩,长时间的开花时期和可食用水果的流行[4].它可以用来作为地面覆盖,盆栽植物,或在吊篮[5].近二十年来,世界各地已经发布了多个观赏PFS品种,如Pikan、Viva Rosa、Tarpan、Toscana、Sijihong和Xiaotaohong [6].然而,在中国,PFS的育种工作直到最近才开始进行。
花的颜色是观赏植物最重要的特征之一,受类黄酮、类胡萝卜素、甜菜碱等不同植物色素的影响[7,8].花青素是一组黄酮类化合物,是花朵的主要色素,赋予花朵从淡粉色到紫色的各种颜色。不同深浅的观赏桃花可归因于花青素(Cys),其含量在红色、粉红色和杂色花瓣中变化很大[9].花青素在植物中经由无处不和充分描述的次级代谢途径合成,如金鱼草majus,非洲菊矮牵牛,碧桃,小麦[10,11,12,13].然而,由于花色苷的结构多样性,调控不同植物种花色苷合成的分子机制尚未确定[14].
在过去的几十年里,人们已经取得了相当大的进展,以确定不同草莓果实中不同色素化合物的特征,并揭示了通过生物合成途径积累不同色素的基因和机制[15,16,17,18].草莓水果中的主要花青素衍生自Pelargonidin(PG)和Cy颗粒酮。栽培草莓中的主要颜料已被鉴定为Pelargonidin-3-葡糖苷,这将鲜红的颜色赋予容器[19,20.].有趣的是,PFS花瓣中的半菌蛋白的主要类型是Cyanidin-3-O-葡糖苷(Cy3G),与草莓果实中积累的不同21].草莓果实中花青素生物合成途径(ABP)的机制已经被研究,但对PFS中的花着色还没有相关信息。
花色变异的机制是复杂的,因为ABP通过调控网络受到多种外源性和内源性因子的紧密调控,包括多种转录因子[22,23].一旦用与花色相关的任一序列或表达差异鉴定候选基因,可用于通过高性能液相色谱法与质谱(HPLC-MS)偶联的高性能液相色谱法评估黄酮组合物的后续生物化学分析。特别地,转录物和代谢物数据集通过相关性和聚类分析组合并进一步表示为几种植物中基因和代谢物之间的连接网络,包括烟草[24],大豆[25]和甘蓝[26].通过结合化学分析和转录组分析,主要代谢途径相关Muscari已经推断出花卉色素沉着,并研究了靶向植物中颜料丧失的候选基因[27].在本研究中,我们探讨了ABP的调控网络在PFS在转录组和代谢水平的花瓣。使用Illumina测序技术进行了RNA测序对PFS花色和HPLC-MS来鉴定和定量黄酮类化合物的组合物。连接网络中的代谢产物和成绩单之间的映射,突出与花青素代谢相关的调控基因。我们的研究将提供对复杂的生理过程,并与PFS花的生物合成和花青素的调节相关的分子机制,随后的研究新的见解。
结果
全氟辛烷磺酸花瓣中着色化合物的主要分类
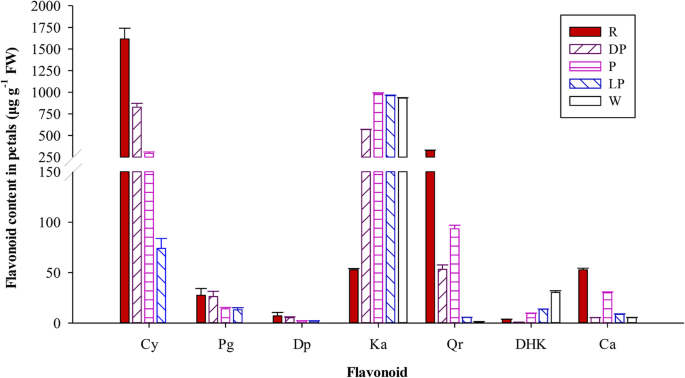
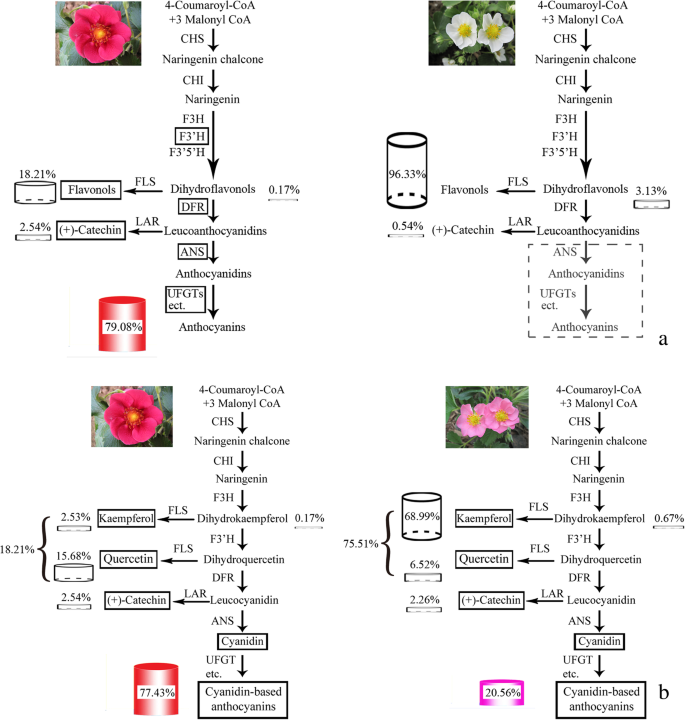
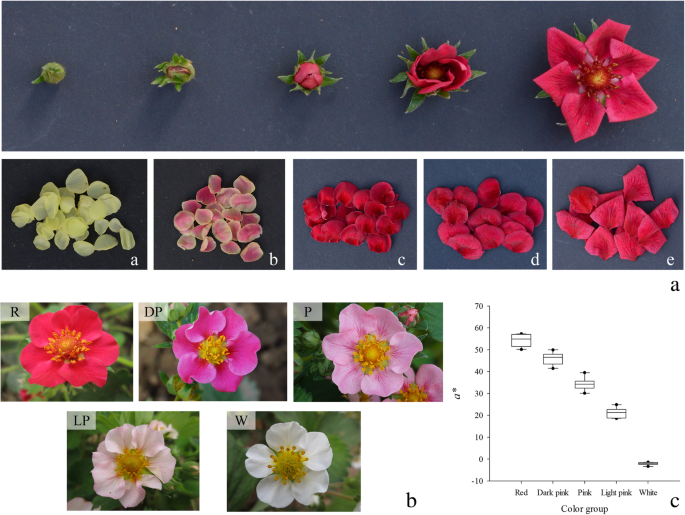
通过检测黄酮生物合成途径(FBP)在不同颜色花瓣中的分支产物,探讨其代谢规律。结果表明,红色和深粉色花瓣的主要显色成分为花青素,其中红色和深粉色花瓣中总黄酮含量分别为79.08和57.78%。随着花色的加深,花色苷含量增加,其中红色花瓣的TFL含量最高,其次是深粉色、粉色、浅粉色和白色花瓣,花色苷含量分别为1651.38、858.73、310.51、89.05和0.00 μg·g−1(表1).PFS中含有3种花青素化合物,即Cy、Pg和delphinidins (Del),其中Cy为主要花青素。红色花瓣中Cy含量最高,占TFL含量的77.43%,分别比深粉色、粉色和淡粉色花瓣高1.95、5.49和21.83倍(表)1和图1).白花杂交种中未检测到花青素。山奈酚(Ka)在粉色、淡粉色和白色花瓣中的含量基本相同,是红色花瓣的18.74倍。白花瓣中二氢山奈酚(DHK)含量最高,约占TFL含量的3.13%,浅粉色次之,而红色和深粉色花瓣中含量最低。红花草莓品种四吉红的花呈暗红色。大芽期(D)花青素(TA)含量最高,为1670.02 μg·g−1,其次为半开期(B),浓度为1613.09 μg·g−1在年轻的芽阶段(L)(额外文件)中检测到没有一种花青素1:表S1)。
RNA-Seq和组装
用Illumina Hiseq 4000测序得到的原始数据通过碱基调用转化为原始读取数据。9个文库的总碱基数为70.6 G,每个样本的总核苷酸数大于5.5 Gb(附加文件)2:表S2)。各样品Q20比值均大于98%,GC含量相对一致,约为46%。从9个数据库中分别获得了164,727个转录本和50,285个非冗余ungenes。unigenes的平均长度为548 bp, N50的平均长度为1394 bp3.:表S3)。因此,该测序数据质量高,能够满足后续分析的要求。长度为200 ~ 500 bp的unigenes有23,669个,占47.07%,500 ~ 1000 bp的unigenes有11,143个,占22.16%,1000 ~ 2000 bp的unigenes有10,846个,占21.57%,超过2000 bp的unigenes有4627个,占9.2%4:表S4)。
PFS中差异表达基因(DEGs)的鉴定
为了在九个花瓣转录域中获得基因表达模式的整个视图,使用归一化TPM值生成Pearson的距离相关矩阵(附加文件5:图S1A)。所有生物重复聚类在一起,表达谱几乎相同(R > 0.9),表明样品采集和分析方法的可靠性。3个样本间共差异表达13815个基因,3个样本共差异表达1426个基因(附加文件)5:图S1B)。有4354度的视角在PF_Z VS PF_L,其中1731个基因下调,2623个基因上调。有在PF_D和PF_L样品,其花色显著变化之间最11252度的视角,和6376个基因下调,4876个基因上调。有PF_D和PF_Z之间8919度的视角,其中5586个基因下调,3333个基因上调(附加文件5:图就是S1C)。
unigenes的功能注释
根据Nr标注结果,获得PFS数据库标注结果中出现频率最高的植物种类(前8位)(补充文件)6:图S2)F. VESCA.在注释结果中出现频率最高,共有27709条注释,占所有序列的89.46%。紧随其后的是蔷薇科的其他属,例如碧桃(1.9%),李属却已(1.03%),马吕斯有明显(0.92%)和Pyrus Bretschneideri.(0.68%)。
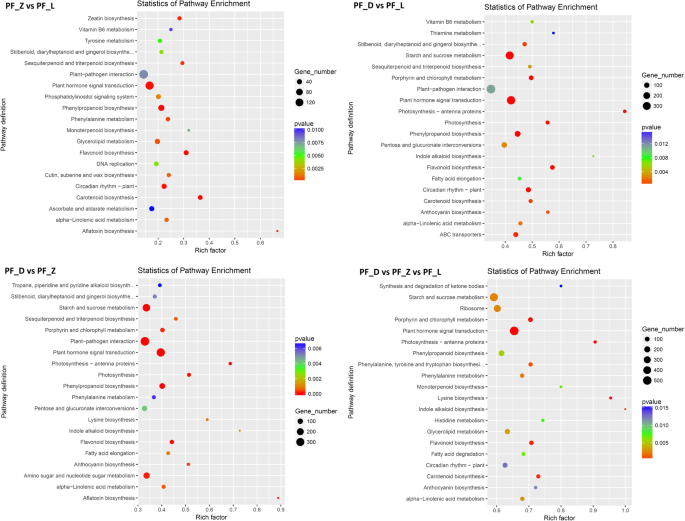
在细胞组分、分子功能和生物过程分类中,共定位到基因本体论(GO)项的24311个(48.35%)unigenes,并进一步划分为50个项。在细胞组分范畴中,PF_D vs、PF_Z vs、PF_L的DEGs主要与细胞核、细胞质和整体膜组分有关,表明所有差异表达基因的结合。在分子功能方面,大多数deg富集于分子功能、蛋白质结合和ATP结合。在生物学过程中,主要涉及转录调控、DNA模板调控和蛋白磷酸化(附文件)7:图S3)。为了鉴定花瓣发育期间的代谢途径,将7032只映射到基因和基因组(Kegg)数据库的京都百科(Kegg)数据库,并且在图2中示出了显着富集的前20keGG途径。2.其中PF_D vs、PF_Z vs、PF_L组的534个DEGs富集于植物激素信号转导通路中,表明激素可能在调控花的发育和着色中发挥了重要作用。此外,许多基因参与了苯丙类生物合成、淀粉和蔗糖代谢、氨基糖和核苷酸糖代谢的相关途径。花青素和黄酮醇是PFS中最重要的色素。因此,我们在本研究中重点研究FBP和ABP。
与ABP相关的deg
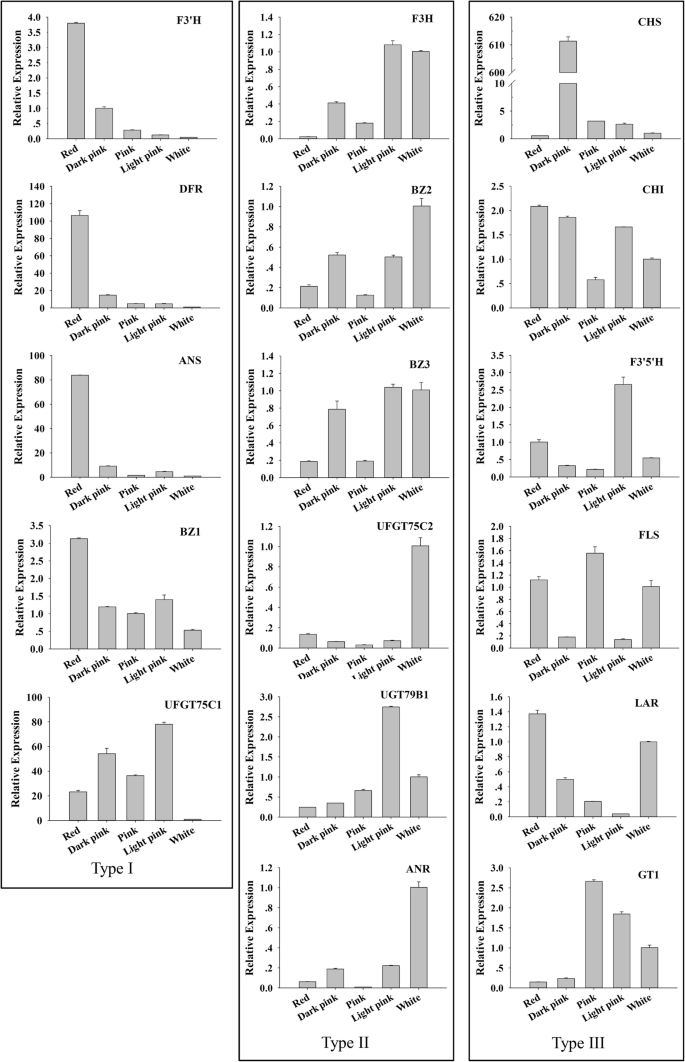
为了鉴定与花色相关的基因,从转录组数据库中确定参与ABP和FBP中涉及的所有次级代谢途径的关键基因。鉴定57只Degs与花青素生物合成,花青素改性,黄酮和黄酮化生物合成,以及黄氰基生物合成(表2).为了深入了解花瓣发育过程中与花朵颜色相关的基因的功能作用,使用Z-score归一化为TPM值绘制了一张热图(附加文件8:图S4)。所有这些Degs都表现出不同的花朵发展阶段的差异表达。在早期的花青素生物合成中,注释了编码Cholcone合酶(CHS)的三次egs,其中所有这些都在PF_D VS PF_L中上调;two DEGs encoding chalcone isomerase (CHI), five DEGs encoding flavanone 3-hydroxylase (F3H), three DEGs encoding flavonoid 3′-hydroxylase (F3’H), and four DEGs encoding flavonoid 3′, 5′-hydroxylase (F3’5’H) were annotated. In later biosynthesis, four DEGs encoding dihydroflavonol 4-reductase (DFR) and two DEGs encoding anthocyanidin synthase (ANS) were all predominantly expressed in PF_D, suggesting a key role in the regulation of petal coloration in PFS; eight DEGs encoding anthocyanidin 3-O-glucosyltransfersae (BZ1) were annotated. Several DEGs associated with anthocyanin modification were identified, such as anthocyanidin 5, 3-O-glucosyltransferas (GT1), anthocyanin 3-O-glucoside 5-O-glucosyltransferase (UFGT75C1), anthocyanidin 3-O-glucoside 2″‘-O-xylosyltransferase (UGT79B1), and cyanidin-3-O-glucoside 2″-O-glucuronosyltransferase (UGAT). In addition, five DEGs encoding flavonol synthase (FLS) were also identified.
为了验证通过RNA-SEQ获得的表达分析的可靠性,选择与花色相关的十七个基因进行QRT-PCR分析。对于所有这些基因,与转录组测序数据相比,QRT-PCR的结果几乎相同的表达模式(附加文件9:图S5)。在五种不同颜色的花瓣中检测到17个键的表达,即白色,浅粉红色,粉红色,深粉红色和红色(图。3.).根据权利要求17个的基因的qRT-PCR的结果,它们的表达模式可以被分为三组。包括在第一类型的FpF3'H,FpANS,FpDFR,FpBZ1和FpUGT75C1基因的表达量在白花中最低;其中FpF3'H,FpANS,FpDFR和FpBZ1基因表达量与花青素积累量呈相似趋势。虽然FpUGT75C1白花中基因表达量最低,其表达模式与其他颜色无直接关系。第二种类型包括FpF3H,FpBZ2,FpBZ3,FpANR,FpUGT75C2,FpUGT79B1基因。他们在白花中的表情要比在红花中的表情高。第三种类型包括FPCH,FPCHI.,FpF3的5是什么,FpLAR,FPFL,FPGT1,他们的表情在不同的花的颜色是不一致的。例如,FPCH基因在不同的花色中具有差异表达模式。的表达式FPCH在红花中基因含量最低,这可能与不同的遗传背景有关。
ABP相关转录因子(TFs)的鉴定
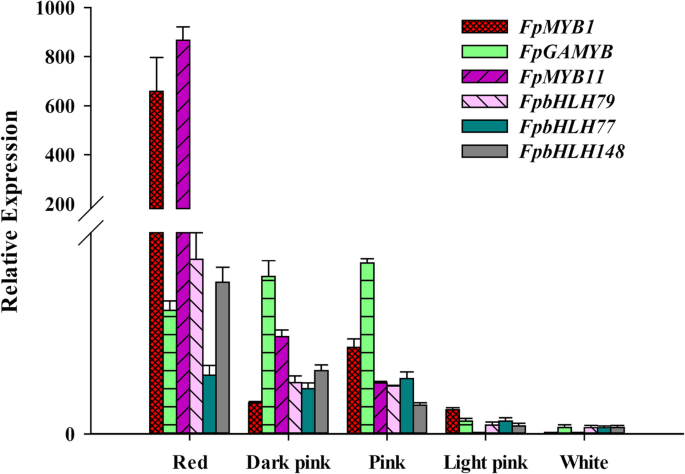
据报道,若有几个TFS在ABP中发挥重要作用。在我们的研究中,发现属于8个TF系列的241个诱导的TF编码基因在PF_D VS,PF_Z VS,PF_L等中差异表达,例如MYB(40基因),BHLH(47基因),NAC(41基因)和Wrky系列(47个基因)。在附加文件中显示了三个开发阶段中的与ABP相关的差异表达的TFS的数量10:表S5。为花青素合成屏幕键的TF,所有这些TF基因的表达表明在热图(附加文件11:图S6)。所选TFS的表达水平在发育阶段中不同。三个myb和bhlh degs(FPMYB1,FpGAMYB,FpMYB11,FpbHLH79,FpbHLH77,FpbHLH148)主要在PF_D中表达,并选择进行qRT-PCR分析。它们在红花草莓中的表达量高于在白花草莓中的表达量。4).
讨论
白花杂交种中红色缺失的原因
为探究PFS杂合花白色花瓣在转录组水平上无法积累花青素的原因,比较了FBP所有关键结构基因的表达模式和色素化合物含量。根据转录组测序和qRT-PCR结果,对其表达FpF3'H,FpDFR,FpANS,FpBZ1,FpUGT75C1随着花朵颜色的加深,红色花瓣中的基因显著增加。3.).这些基因及其相应的催化反应可能是关键基因和速度限制步骤,导致白花瓣中的花青素丧失。
首先,虽然FpF3'H基因可以有效地限制赛扬代谢分支,儿茶素(Ca)的在白色的花瓣中发现,这表明白色花瓣是由于缺乏代谢花青素下游基因。同时,DHK的在白色的花瓣含量比,在红花瓣更高8.32倍,这表明在白色的花瓣ABP受到抑制和DHK的一些量的积累(表1).第二,FpANS基因也在ABP中发挥了关键作用,其可以催化无色花青素的合成成色的花青素。如果在该位置被封闭白花瓣,则有色花青素将消失(图。5a).本实验中白色花瓣中未检测到花青素,因此FpANS基因可能是无法在白色花瓣积累花青素的关键因素。如从qRT-PCR的结果证明,该FpANS红色花瓣中的基因表达比白花瓣高100倍,在大芽发育阶段,其表达甚至高达1000倍(未发表)。第三,糖基转移酶与最终产物直接相关,合成的花青素将在其作用下转化成稳定的花青素(图。5一种)。在这项研究中,FpBZ1和FpUGT75C1在红色花瓣中显着上调,因此,它们也可能是无法积聚白花瓣中的花青素的关键因素。此外,从ABP的分支产物的角度来看,由于其他基质竞争的影响(黄酮和黄酮和黄酮代谢途径,以及原因是原酸盐代谢途径),Cy不能积累。这FPFL基因FpDFR基因可竞争的基板,和FpFLS蛋白的形成无色卡斯和栎精(QRS)的作用下。在本研究中,白色的花瓣,黄酮醇含量比红色的花瓣高2.46倍。也有人证实,二氢黄酮醇的比例转换成比黄酮苷成是白色的花朵更高。因此,可以推断的是,FpANS,FpBZ1,FpUGT75C1基因是导致白花杂交种花青素积累失败的关键因素。与此同时,竞争效应FPFL和FpDFR基因可能进一步抑制花青素的合成。
不同深浅粉红色的花朵颜色
全氟辛烷磺酸混合剂呈现出从浅粉色到红色不等的不同深浅的粉红色。通过对代谢产物和转录组数据的综合比较,分析不同花瓣颜色的代谢物水平以及不同分支途径中相应关键基因的表达情况,探讨花瓣颜色产生的原因。结果表明,不同程度的粉红色花瓣可能受到多种因素的影响。例如,在红色和粉色花瓣中,首先,Cy3G是PFS中的主要色素化合物。在颜色形成相关的代谢系统中,Cy代谢途径占主导地位,其代谢产物占TFL代谢产物的77.43%,而在粉红色花瓣中,Cy代谢产物占TFL代谢产物的22.49%。红色花瓣的Cy含量是粉色花瓣的5.49倍。5b)。FpF3'H是调节Cy代谢的关键基因,并且相对较低的生产力可能会限制红色和粉红色花瓣中CY分支的较低生产,引导到PFS杂种中的不同阴影。其次,在红色花瓣中,C C的含量分别为58.73倍,分别高于PGS和DELS含量的229倍;在粉红色的花瓣中,Cy的含量分别为20.75倍,分别高于PGS和DELS含量的155.78倍(表1).底物特异性FpDFR和FpANS基因可能是PFS花青素主要为Cy衍生物的原因,从而导致花瓣呈红色。第三,竞争效应FPFL基因也限制了Cy衍生物的生物量。如图所示。5其中,粉色花瓣中黄酮醇的总含量占TFL含量的75.51%,是红色花瓣的2.85倍。的表达上调FPFL基因,原来用于Cy流动的生物量被转化为无色的黄酮醇。不同颜色的PFS花瓣中均检测到Ca。红花和粉色花瓣中Ca含量所占比例相近,分别为2.54和2.26%,说明红花和粉色花瓣中Ca的表达FpLAR基因红花维持在粉红色的花相似的水平。因此,PFS杂种具有粉红色深浅不同可能是由于的底物特异性FpDFR和FpANS基因,以Cy衍生物为主要花青素组分。的表达式FpF3'H和FPFL基因不同,导致Cys和黄酮醇的生成比例不同,从而影响花的颜色。
PFS中与花着色相关的代谢化合物
花瓣颜色是决定PFS观赏价值的主要特征之一。类黄酮广泛存在于花卉、水果和蔬菜中,如花青素、黄酮、黄酮醇等[28].到目前为止,几条报告显示了花卉颜色和颜料组成和含量之间的关系[29,30.,31].一个百零八个荷花品种有不同的颜色是由邓等人通过检测,并在其花瓣色素的量化评估。(2013),谁检测5个花色素苷和黄酮14和黄酮醇,和这些颜料的不同品种间差异很大的内容和组合物〔32].荷花花瓣的红色与花青素含量呈正相关,其中飞燕草苷3- o -葡萄糖苷和锦葵苷3- o -葡萄糖苷含量最高。在本研究中,红色花瓣中的花青素含量显著高于黄酮醇含量。白色花瓣中黄酮醇含量最高,与淡粉色和粉色花瓣差异不显著,白色花瓣中未检测到花青素。花瓣颜色由红色变为白色,与黄酮醇含量增加、花青素含量降低一致。黄酮和黄酮醇也被报道是花瓣颜色的原因[33].然而,作用仅限于黄酮醇,作为一种辅助色素沉着,使花瓣颜色从品红变为蓝色[34,35].Du等(2018)报道花青素组成为30杜鹃物种和表明,在颜色不同群体和黄酮醇之间的辅色指数无显著差异可能不能起到着色主要作用[36].我们的研究结果表明,白色的花瓣是由于黄酮醇的显著蓄存及桃红色的阴影的关键因素是花青素的积累。然而,花青素和黄酮醇的不同比例对PFS形成粉红色的花瓣的深浅不同的影响,需要进一步研究。与花色形成的代谢调控是一个复杂的代谢途径,这是调控的几个分支代谢途径和调控因子的关键基因。这是很难获得的基因和相应的代谢物之间的绝对相关性。在花瓣花青苷的组成和含量和共颜料黄酮醇含量进行分析,以了解不同花的颜色的生化基础和以预测的遗传差异。
花着色的PFS机制
以前的一些研究已经提供了足够的证据,在草莓果实的花青素成分的分子机制,但在PFS [的花瓣没有解释色素沉着15,37,38,39].PFS果实和花中主要的花青素化合物分别为Pgs和Cys,表明ABP受空间调控[21].的ABP由复杂的转录因子,其赋予组织特异性[调节40,41,42].Matu等(2017)鉴定出三个密切相关的R2R3-MYB基因,即:Myba5,MyBa6.,MYBA7,位于染色体14中,在具有不同特异性的植物子中控制ABP [43].迄今为止,已经鉴定出参与草莓ABP的不同酶,如几个结构基因FaCHS,FaF3H,FaDFR,祝福,FaFLS,FaGT1,以及一些调控基因FaMYB1,FcMYB1,FaMYB5,FaMYB10,FabHLH33[16,17,44].最近,Hawkins等人(2016)证明了14 in染色体上的一个候选SNPFveMYB10经鉴定后,再功能上确认为负责黄色果实的几种F. VESCA.通过基因组规模分析获得的资料[45].在本研究中,在我们组装的转录组数据集中注释了62个编码40个MYB deg的注释ungenes,包括myb1.,GAMYBA4,MYB6,MYB44,MYB82,MYB11,MYB305和MYB308基因。然而,只有10人康复MYB基因可能是abp调控基因,从它们在系统发育树中的位置推断,这些unigenes大部分是转录抑制因子(未发表)。它不同于草莓果实,具有正调控基因FaMYB10没有注释。最近,通过草莓果实表达相关分析鉴定了更多的调节转录因子[46,这表明我们对这一途径的基因网络的了解仍然不完全。所有这些数据表明,在PFS的花青素合成中存在额外的调节因子。此外,越来越多的证据表明,不同的TF家族,如NAC、ARF和WRKY,参与了ABP的调控。因此,在PFS中发现和鉴定一些与花青素相关的TFs可能证实了色素沉着是一个复杂的性状,可能涉及不同的调控机制。
进一步研究结构基因的酶促性质,其调节机制和相关代谢物的含量仍然需要完全了解PFS中的ABP。在该研究中,通过转录组数据对每个结构基因发现多于一种同种型。这表明PFS中的所有检测的ABP基因都代表多烯家族,这也是其他几种物种的情况[47].Cy是PFS不同花色的主要花青素,其含量明显高于PGS和DELS含量(表1),这似乎是由更高FpF3'H基因表达比FpF3H和FpF3的5是什么基因。此外,底物的特异性FpDFR,FpANS,FpUGTCys基因与其他花青素的含量差距较大。红花瓣中花青素含量占TFL的79.1%FpDFR在竞争中,吉恩有优先权FpDFR和FPFL二氢黄酮醇。在其他园艺植物中也取得了类似的结果[48,49].Park et al.(2017)报道红洋葱鞘中Qr含量大约是Cy含量的12倍,这证实了红洋葱鞘中Qr含量的增加FPFL基因为其基质二氢核特征占主导地位[50.].推测了PFS中花瓣颜色不同的机理,白花杂交种花色苷的缺乏是其形成的原因。底层机制可能比这里描述的机制更复杂。通过鉴定基因的特征结构和通过检查转录因子,转运蛋白或miRNA的发生如何影响PFS品种的鲜花和果实,通过鉴定基因的特征结构来阐明该机制。探索花瓣着色的分子机制可能有助于应用基因工程来生产其他新颖的PFS颜色。
结论
在本研究中,我们从代谢组和转录组水平探索了PFS花瓣中ABP的调控网络。总体而言,我们鉴定了一个与花瓣着色相关的候选基因子集,包括57个与花着色相关的ABP基因和241个TFs基因。推测了PFS中花瓣颜色不同的机理,白花杂交种花色苷的缺乏是其形成的原因。本研究结果为PFS花中花青素的生物合成与调控相关的复杂生理过程和分子机制的后续研究提供了新的思路,对文献研究具有重要意义。
方法
植物材料
PFS品种四季红取自花暗红色的粉红公主×美人。根据开花程度和花瓣颜色,将其花分为5个发育阶段。6一、表3.).与显著不同花的颜色(“L”,“Z”和“d”)选择的三个发育阶段被用于转录组分析。花颜色从粉红公主漂亮美×横,从白色到红得到的杂交种显著变化,并且品种划分为以下五组:红色,深粉红色,粉红色,浅粉色,和白色(图.6b).使用Chroma Meter (CR-400 Koniea Minolta, Japan)测量所有杂交组合和亲本的新鲜花瓣颜色(图4)。6c,额外的文件1:表S1)。5组杂交组合的新鲜花瓣在花期取样,进行代谢组和qRT-PCR分析。所有样品立即用液氮冷冻,保存在−80℃,用于RNA提取和类黄酮分析。以‘L’、‘Z’和‘D’为材料,构建了9个文库,分别命名为PH_L1、PH_L2、PH_L3、PH_Z1、PH_Z2、PH_Z3、PH_D1、PH_D2和PH_D3。
花中类黄酮的测定
采用HPLC-MS分析PFS花瓣中的花青素,如前所述[21].进样液10微升进行HPLC分析。花青素的鉴定使用Agilent-1100高效液相色谱系统与LC/MSD Trap SL电喷雾离子质谱仪(Agilent 1100 LC/MSD Trap SL G2445A)耦合。高效液相色谱柱为DIKMA SpursilTMC18 (250 mm × 4.6 mm, 5 μm), C18微保护阳离子- h柱(10 mm × 4.6 mm;上海安培科学仪器有限公司,上海,中国)。流速为0.7 mL/min。流动相A和B由0.1% (v/v)三氟乙酸(TFA)在水中和0.1% (v/v)三氟乙酸(TFA)在CH中组成3.分别CN。色谱柱在25°C下以以下线性梯度洗脱:0 min, 100% A, 0%B;40分钟,50% A, 50% B;42 min, 100% A, 0% B;47 min时,A为100%,b为0%。气体(N2)温度350°C;流量:12 L/min;喷雾器压力,35psi;毛细管电压,−4500 V;毛细血管出口,200v质谱记录在m/ z100到1000之间。在530 nm处检测到花青素,在350 nm处检测到黄酮和黄酮醇,在200 ~ 800 nm处记录到紫外光谱。使用安捷伦Chemstation软件(Chemstation for LC 3D system REV. B. 01)在计算机上记录数据。03)。Cy3G、槲皮素3- o -芦丁(Rutin)、柚皮素(Nrn)、杨梅素(myricetin)、Qr、Ka、二氢杨梅素(DHM)、二氢槲皮素(DHQ)、DHK、(+)-儿茶素(Ca)、(−)-表儿茶素(Ep)作为定量标准。 The flavonoids were identified based on the HPLC retention time, elution order, UV–vis spectrum, and MS fragmentation pattern by comparison with those of the standards and published data. The content of TA and TFL was calculated using the absorbance measured at 530 nm and 350 nm, respectively. The mean values and SEs were obtained from three biological replicates.
RNA提取,文库构建和测序
使用改性的CTAB方法提取总RNA,并用无RNase -.无DNase I(Takara,DARA,中国)处理以去除基因组DNA污染。使用BioAnalyzer 2100和RNA 6000纳米Labchip试剂盒(Agilent,Ca,USA)测定总RNA量和纯度,其中rin数为> 7.0。图书馆建设和测序方法与公布的工作相同[51.].In brief, Total RNA samples of 10 μg were extracted from each development stage. Then they were subjected to isolate poly (A) mRNA with poly-T oligo-attached magnetic beads. The cDNA library was constructed in accordance with the protocol of the mRNA-Seq Sample Preparation Kit (Illumina, San Diego, USA). The paired-end sequencing was at the lc-bio (China) using an Illumina Hiseq 4000 platform.
De Novo组装,Unigene注释和差异表达分析
FASTQ格式的原始数据已存入国家生物技术信息中心(NCBI)数据库。GSE125777)。使用Cutadapt和perl脚本去除包含适配器污染、低质量碱基和不确定碱基的读取。然后使用FastQC (http://www.bioinformatics.babraham.ac.uk/projects/fastqc/)包括Q20,Q 30和GC含量的清洁数据。所有下游分析都基于清洁数据的高质量。所有九个样品的清洁数据组合用于转录组的De Novo组装,具有三位一体2.4.0 [52.].三位一体将基于共享序列含量的簇成群体。这种转录簇非常松散地称为“基因”。簇中的最长转录物被选为“基因”序列(即Unigene)。所有组装的unigenes对非冗余(NR)蛋白质数据库(http://www.ncbi.nlm.nih.gov/), (http://www.geneontology.org), SwissProt (http://www.expasy.ch/sprot/), KEGG (http://www.genome.jp/kegg/)和蛋酒(http://eggnogdb.embl.de/)使用DIAMOND的数据库,其阈值为E-value < 0.00001 [53.].使用R package edgeR筛选|log2 (foldchange)|≥1且具有统计学意义(FDR<0.05)的差异表达ungenes [54.].接下来,使用HUSE PERL脚本对差异表达的未成语重复GO和KEGG浓缩分析,并使用Hyper.Chotic测试识别出明显富集的GO术语和KEGG途径p ≤ 0.05 as a threshold [55.,56.].
基因验证和表达分析
将特定的重点置于与类黄酮生物合成中涉及的颜色相关的二次代谢,包括苯丙醇化生物合成途径(KO00940),FBP(KO00941)和ABP(KO00942)。使用PFS转录组数据库中存在的每个颜色相关基因的所有同种型使用Blastx对齐。选择一些颜色相关的关键基因和转录因子用于使用QRT-PCR的不同花颜色(红色,深色粉红色,粉红色和浅粉红色)的验证(图。6).对每个样品中的每个基因进行三种生物重复。使用改性的CTAB方法提取总RNA,并用无RNase -.无DNase I(Takara,DARA,中国)处理以去除基因组DNA污染。使用BioAnalyzer 2100和RNA 6000纳米Labchip试剂盒(Agilent,Ca,USA)测定总RNA量和纯度。使用Primescript RT试剂盒(Takara,Dian,China)合成每个样品的cDNA。使用底漆3.0软件设计引物(http://biotools.umassmate.edu/bioApps/primer3.www.cgi.)用于qRT-PCR,列于附加文件12:表S6。QRT-PCR在IQ5实时检测系统(BIO-RAD,USA)上进行Sybr Green PCR主混合物(Takara,大连,中国),并用1μLcDNA模板扩增,5μl2× SYBR Green Master Mix, and 0.5 μL of each primer (10 μmol/μL), to a final volume of 10 μL by adding water. The amplification program consisted of one cycle at 95 °C for 3 min, followed by 40 cycles of 95 °C for 30 s and 60 °C for 30 s. The strawberry 26S rRNA gene was used as the reference gene. All the data were subjected to statistical analysis using Duncan’s multiple range test (SPSS ver.17.0), and they were indicated as mean ± SE.
数据和材料的可用性
测序数据已提交给NCBI基因表达式omnibus(Geo)数据库(https://www.ncbi..nlm.nih.gov/geo/)加入编号为GSE125777。
缩写
- ABP:
-
花青素生物合成途径
- CA:
-
儿茶素
- Cy:
-
花青色素
- Cy3G:
-
花青色素3-O-glucoside
- 度:
-
差异表达基因
- 德尔:
-
Delphinidin.
- DHK:
-
Dihydrokaempferol
- DHM:
-
Dihydromyricetin
- DHQ:
-
Dihydroquercetin
- Ep:
-
epicatechin.
- FBP:
-
黄酮类化合物生物合成途径
- 走:
-
基因本体论
- HPLC-MS:
-
高性能液相色谱与质谱相耦合
- 卡:
-
山柰酚
- Kegg:
-
京都基因和基因组百科全书
- NCBI:
-
国家生物技术信息中心
- NJ:
-
邻居加入
- NR:
-
冗余蛋白质数据库
- Nrn:
-
柚苷配基
- PFS:
-
粉红色花草莓
- 答:
-
天竺葵色素
- Qr:
-
槲皮素
- 芦丁:
-
槲皮素3-O-rutinoside
- TA:
-
总花青素
- 组织:
-
三氟乙酸
- TFL:
-
总类黄酮
参考
- 1.
草莓和人类健康:抗氧化活性以外的影响。食品科学,2014;62(18):3867-76。
- 2.
侯赛因A,卡莉达P,萨尔玛ZM,Hafizur RM,阿赫桑男,伊斯兰教SN。一个园艺农场栽培草莓基因型的营养成分。食品化学。2016; 199:648-52。
- 3.
Mabberley DJ。蕨麻和Fragaria.(蔷薇科)团聚。Telopea。2002;9(4):793 - 801。
- 4.
OLBRICHT K,POHLHEIM F,EPPENDORFER A,VOGT F,袭击E.草莓作为阳台果实。Acta Hortic。2014; 1049:215-8。
- 5。
Khanizadeh S,Deschênesm,DubéC.'Rioteberry'Arnberry。Hortscience。2010; 45(10):1545-6。
- 6。
薛L,雷JJ,戴惠普。两个新的粉红色花草莓品种'西晋'和'小涛红'。Acta Hortic。2016; 1156:141-4。
- 7。
Tanaka Y,Sasaki N,Ohmiya A.植物颜料的生物合成:花青素,玻璃苷,贝甲虫和类胡萝卜素。工厂J. 2008; 54:733-49。
- 8。
两种花色品种的基因表达及色素分析美人蕉.植物生理生化。2018;127:1-10。
- 9。
程军,廖玲,周华,顾超,王玲,韩艳萍。花青素转运体的一个小indel突变导致桃花的杂色。J Exp Bot. 2015;66(22): 7227-39。
- 10.
邓XB,Bashandy H,Ainasoja M,Kontturi J,Pietiainen M,Laitinen Rae,Albert VA,Valkonen JPT,Elomaa P,Teeri Th。花青素生物合成中复制的Chalcone合酶基因的功能多样化非洲菊矮牵牛.新植醇。2014;201(4):1469 - 83。
- 11.
姜伟,刘涛,南伟,Jeewani DC,牛勇,李超,王勇,史旭,王超,王杰,李勇,高旭,王振中。两种转录因子的研究进展tappm1.和TaPpb1协同调节小麦紫色果皮花青素的生物合成。J Exp Bot. 2018;69(10): 2555-67。
- 12.
王志强,王志强,王志强,等。花色素苷生物合成的研究进展[J]金鱼草majus.植物j . 1991; 1:37-49。
- 13.
周勇,周洪,林旺,Vimolmangkang S, Espley RV, Wang L, Allan AC, Han YP。转录组分析和瞬时转化表明,一个古老的复制MYB转录因子可能是桃叶片红色的候选基因。植物学报。2014;14(1):388。
- 14.
Fujino N,Tenma N,Waki T,ITO K,Komatsuzaki Y,Sugiyama K,Yamazaki T,Yoshida S,Hatayama M,Yamashita S,Tanaka Y,Motohashi R,Denessiouk K,Takahashi S,Nakayama T.类黄酮酶之间的物理相互作用在Snapdragon和Torenia揭示了不同植物物种的类黄酮代谢组织中的多样性。植物J. 2018; 94(2):372-92。
- 15.
Aharoni A, De Vos CHR, Wein M, Sun ZK, Greco R, Kroon A, Mol JNM, O’connell AP.草莓FaMYB1转录因子抑制转基因烟草花青素和黄酮醇的积累。植物j . 2001; 28(3): 319 - 32。
- 16。
Moyano E,Portero-Robles I,Medina-Escobar N,Valpuesta V,Muñoz-Blanco J,Caballero JL。在熟化过程中,果实特定推定的二氢烷醇4-还原酶基因在草莓中差异地表达。植物理性。1998年; 117(2):711-6。
- 17。
黄酮类化合物在草莓生长发育中的两相形成(Fragaria.×ananassa)水果。中国农业科学。2006;54(4):1479-85。
- 18。
萨尔瓦A,皮门特尔P,莫亚 - 莱昂MA,卡利加里PD的类黄酮基因和花色苷含量的转录谱埃雷拉R.比较果实发育的两种植物在形态草莓chiloensisssp。chiloensis.植物化学。2010; 71(16):1839-47。
- 19。
Kosar M,Kafkas E,Paydas S,Baser KHC。草莓基因型在不同成熟阶段的酚醛组成。JAgric Food Chem。2004; 52(6):1586-9。
- 20.
阿隆索JJ, Rivas-Gonzalo JC, Santos-Buelga C.草莓花青素色素。食品科学技术。2007;40(2):374-82。
- 21.
薛升,王ZG,张宽,李YX,王静,雷JJ。花色素继承和从粉红色花和白色花草莓杂交的花青素表征。SCI Hortic。2016; 200:143-50。
- 22.
王颖,王颖,宋智,张华mybl2.通过microRNA858a和HY5的激活导致花青素生物合成途径拟南芥.摩尔。2016;9(10):1395 - 405。
- 23.
Maier A, Schrader A, Kokkelink L, Falke C, Welter B, Iniesto E, Rubio V, Uhrig JF, Hulskamp M, Hoecker U. Light和E3泛素连接酶COP1/SPA控制MYB转录因子的蛋白稳定性PAP1.和PAP2.参与花青素的积累拟南芥.植物j . 2013; 74:638-51。
- 24.
关键词:烟草,转录组,代谢组,突变体,突变体拟南芥转录因子,AtMYB12,导致对昆虫的抵抗力。植物杂志。2010;152(4):2258 - 68。
- 25.
关键词:大豆,种子贮藏蛋白,蛋白质组成,代谢组,转录组植物杂志。2011;156:330-45。
- 26.
吉梁j,金杰克,金库,金yj,公园yj,金sj,金c,Park su。转录组分析和绿色和红色羽衣甘蓝的代谢分析(Brassica oleraceavar。acephala)幼苗。食品化学。2018;241:7-13。
- 27。
娄Q,刘Y,齐YY,焦SZ,田FF,蒋丽,王YJ。转录组测序和代谢产物的分析显示,葡萄风信子花翠素的花色代谢的作用。J Exp Bot。2014; 12:3157-64。
- 28。
王安姆,李如斯,任磊,高新林,张玉刚,马正民,马德峰,罗玉华。不同肉色甘薯黄酮类化合物代谢组学比较研究(番薯甘薯(L.)林)。食品化学。2018; 260:124-34。
- 29。
Fraser LG, Seal AG, Montefiori M, McGhie TK, Tsang GK, Datson PM, Hilario E, Marsh HE, Dunn JK, Hellens RP, Davies KM, McNeilage MA, De Silva HN, Allan AC. R2R3 MYB转录因子决定红色花瓣的颜色猕猴桃(猕猴桃)混合人口。BMC基因组学。2013;14(1):28。
- 30.
Hsu Y, Tagami T, Matsunaga K, Okuyama M, Suzuki T, Noda N, Suzuki M, Shimura H. effects of rhamnosyltransferase involved in花青素修饰,花青素修饰的关键酶半边莲erinus.植物杂志2017; 89:325-37。
- 31.
李JB,桥本楼清水K,坂田Y.花青素从红色的花朵山茶花品种“Dalicha”。植物化学。2008;69(18):3166 - 71。
- 32.
邓Ĵ,陈S,尹XJ,王K,刘YL,SH李,杨PF。系统的定性和在108个莲花瓣花青素,黄酮和黄酮醇定量评估(莲属椰子)品种。食品化学。2013;139:307-12。
- 33.
贾宁,舒启宇,王林林,杜华,徐永军,刘扎。芍药品种花瓣花色苷研究着色机制。Sci Hortic。2008;117(2):167 - 73。
- 34.
Kazuma K, Noda N, Suzuki M.不同株系中与花瓣颜色相关的黄酮组成Clitoria ternatea.植物化学。2003; 64:1133-9。
- 35.
吴强,李鹏鹏,张宏军,冯春英,李少森,尹德东,田娟,徐文忠,王林林。黄酮类成分与花色变化的关系维多利亚.植物医学杂志。2018;20(4):674 - 81。
- 36.
杜H,赖L,王F,Sun W,Sun W,Zhang L,Li X,Wang L,Jiang L,Zheng Y.花红的特性30杜鹃通过花青素和黄酮醇的鉴定和数量性状。植物医学杂志。2018;20(1):121 - 9。
- 37.
邓C,戴维斯TM。二倍体草莓果实黄色(c)位点的分子鉴定:候选基因方法。应用计算机学报。2001;103(2):316-22。
- 38.
谢穆尼奥斯C,桑切斯 - 塞维利亚JF,博特利亚MA,霍夫曼T,施瓦布W,在成熟果实Valpuesta V.多酚组合物Fragaria.途径中关键基因的种类和转录分析。中国农业科学。2011;59(23):12598-604。
- 39。
Schaart Jg,Dubos C,Romero de la Fuente I,Van Houwelingen Amml,De Vos Rch,Jonker Hh,Xu WJ,Rouraboul JM,Lepiniec L,Bovy AG。鉴定及表征草莓原花青素生物合成的MYB-BHLH-WD40调节综合体(草莓属×ananassa)水果。新植醇。2013;197(2):454 - 67。
- 40.
Chagne D, lin wang K, Espley房车,中场RK,纳米,唤醒年代,Brendolise C,卡莱尔厘米,Kumar年代,De Silva N,米凯莱蒂D, Mc Ghie T,克劳赫RN,层RD, Velasco R,赫楞RP,加德纳,艾伦AC。古代复制苹果的MYB转录因子负责小说红fruit-flesh表型。植物杂志。2013;161(1):225 - 39。
- 41.
香港CC,Chen Yy,Tsai Wc,Chen Wh。三个R2R3-MYB转录因子调节不同的花卉色素沉着图案蝴蝶兰属acta botanica yunnanica(云南植物研究). 2015;42(1):1 - 5。
- 42.
Quattrocchio F,Verweij W,Kroon A,拼写的C,Mol J,Koes R.PH4的喇叭花是一种R2R3 MyB蛋白,通过与花青素途径的碱性螺旋环 - 螺旋转录因子相互作用来激活真空酸化。植物细胞。2006; 18(5):1274-91。
- 43.
马特斯JT,卡瓦利尼E,洛约拉R,Höll宾馆Ĵ,Finezzo L,达尔圣S,Vialet S,Commisso男,罗马楼舒伯特A,阿尔卡尔德JA,伯格斯Ĵ,Ageorges A,Tornielli GB,阿尔塞 - 约翰逊P. A组的位于14号染色体控制花青素合成中具有不同特异性的营养器官与浆果色度坐标比较葡萄MYBA转录因子。植物杂志2017; 91(2):220-36。
- 44.
Griesser男,霍夫曼T,Bellido ML,罗萨蒂C,芬克B,Kurtzer R,Aharoni A,谢穆尼奥斯-Blanco的Ĵ,通过花色素葡糖在成熟草莓果实下调类黄酮合成的施瓦布W.重定向。植物理性。2008; 146(4):1528至1539年。
- 45.
霍金斯C,Caruana J,Schiksnis E,Liu Z.基因组规模DNA变体分析和野生草莓中的SNP底层黄色果实的功能验证。SCI批准。2016; 6:29017。
- 46.
Pillet J,Yu HW,Chambers啊,Whitaker VM,Folta Km。用转录物与成熟草莓转录组相关网络分析鉴定候选类黄酮途径基因(Fragaria.×ananassa)水果。中国生物医学工程学报。2015;66(15):4455-67。
- 47.
Jaakola L, Määttä K, Pirttilä AM, Törrönen R, Kärenlampi S, Hohtola A.越桔果实发育过程中与花青素、原花青素和黄酮醇水平相关的花青素生物合成基因的表达。植物杂志。2002;130(2):729 - 39。
- 48.
齐藤荣,张志强,张志强,等。植物花青素合成与边缘皮果花瓣形成的关系佩妮.植物SCI。2006; 170:828-34。
- 49.
田俊,陈麦克,张继,李克,歌曲tt,张x,姚y。不同叶片二氢烷醇4-还原酶基因启动子的特征马吕斯海棠品种。Hortic水库。2017; 4:17070。
- 50.
Park S, Kim DH, Lee JY, Ha SH, Lim SH.比较分析两种黄酮醇合成酶从不同颜色的洋葱提供了了解类黄酮生物合成。食品化学。2017;65(26):5287-98。
- 51.
张C,姚X,仁H,常Ĵ,王K. RNA-Seq的揭示山核桃类黄酮合成相关基因(山核桃illinoinensis)内核。食品化学。2018;67(1):148-58。
- 52.
Grabherr MG,哈斯BJ, Yassour M,莱文生理改变,汤普森哒,阿米特我,Adiconis X,风扇L, Raychowdhury R,曾庆红QD,陈,Mauceli E, Hacohen N, Gnirke, Rhind N,迪帕尔马F, Birren BW, Nusbaum C, Lindblad-Toh K,弗里德曼N, Regev A全身没有参考基因组转录组装配从RNA-seq数据。生物科技Nat》。2011;29(7):644 - 52。
- 53.
谢志强,张志强。利用菱形快速和敏感的蛋白质比对。Nat方法。2015;12(1):59-60。
- 54.
罗宾逊MD,麦卡锡DJ,史密斯GK。轧边机:一个Bioconductor的包数字基因表达数据的差异表达分析。生物信息学。2010; 26(1):139-40。
- 55.
周T,罗X,yu c,张l,宋y,dong m,shen c.转录组分析提供了三个中几种紫杉醇生物合成相关基因的表达模式和序列相似性的见解tax物种。BMC Plant Biol. 2019;19:33。
- 56.
粉丝,陈米,东b,王,俞q,王x,轩王,王y,张某,沉玉。花芽分化的转录组分析木兰sinostellata..基因。2018;9:212。
致谢
不适用。
资金
该工作得到了中国天然科学基金(31701964),辽宁省教育部(201835-17号)和中国国家重点研发计划(No.206yfe0112400)的资金支持。资金用于设计和收集,分析和解释数据以及撰写手稿,以及在公开接入付款中。
作者信息
从属关系
贡献
LX和JW设计并完成了实验;JZ和YZ分析了转录组数据;HFW和XW在不同时期对花瓣取样,参与花青素含量的测定;CX参与qRT-PCR实验;JJL构思研究,指导实验,审稿;CFZ和YTZ设计了实验,并对该手稿的英文进行了修改。所有作者阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:表S1。
采用RNA-seq分析三个发育阶段(PF_L、PF_Z和PF_D)花瓣中总花青素和总黄酮的含量。
附加文件2:表S2。
转录组的测序和组装概述。
附加文件3:表S3。
来自九个样品的转录物或unigenes的N50。
附加文件4:表S4。
9个样本的转录本或单基因的长度。
附加文件5:图S1。
RNA-seq数据的生物信息学分析。A, PF_L、PF_Z、PF_D中基因表达的Pearson距离相关矩阵。显示PFS花瓣任意两个阶段差异表达基因重叠的维恩图。C, PF_Z与PF_L、PF_D与PF_L、PF_D与PF_Z的差异表达基因数。
附加文件6:图S2。
利用BLASTx对Nr数据库中8个最高物种的转录本进行匹配的数量和百分比。
附加文件7:图S3。
PF_L、PF_Z、PF_D的GO分类分析了其生物学过程、细胞成分和分子功能。
附加文件8:图S4。
17个颜色相关基因的qRT-PCR与RNA-Seq的基因表达相关性分析qRT-PCR的所有反应对每个样品重复3次,竖条表示标准误差。红色为qRT-PCR检测的转录本表达水平的fold changes。绿色表示高通量测序产生的折叠变化。
附加文件9:图S5。
花颜色相关基因的表达谱在热图中采用Z-score归一化和层次聚类。颜色刻度显示在顶部。蓝色表示低表情,红色表示高表情。L:幼芽期;Z,着色初期;D、大芽期。
附加文件10:表S5。
三个发展阶段与ABP相关的差异表达转录因子的数量。
附加文件11:图S6。
花青素生物合成相关转录因子表达谱Z-score归一化,在热图中分级聚类。右边显示了一个彩色刻度。绿色表示低表达,红色表示高表达。L:幼芽期;Z,着色初期;D、大芽期。
附加文件12:表S6。
用于定量RT-PCR分析的引物。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
薛磊,王军,赵军。et al。基于转录组测序和代谢产物分析的红花草莓花瓣中花青素代谢研究BMC植物BIOL.19,423(2019)。https://doi.org/10.1186/s12870-019-2048-8
收到了:
接受:
发表:
关键字
- 粉红色花草莓
- 花的颜色
- 色素沉着
- 花青色素
- 转录组分析
- 花青素生物合成途径