摘要
背景
花期是决定作物产量潜力和生态地理适应性的重要农艺性状之一。Ghd8而且Ghd7这两种主要开花基因在水稻抽穗期、株高和籽粒产量控制方面功能相似,具有较大的多效性。然而,迄今为止,这些基因在遗传和分子水平上的相互作用尚未确定。
结果
在本研究中,我们研究了遗传相互作用Ghd8而且Ghd7利用一组水稻近等基因系和天然种质资源。我们发现Ghd8在一种功能上影响了多个农艺性状Ghd7端依赖的方式.这两个功能Ghd8而且Ghd7水稻光周期敏感性的关键是由什么控制的即而且Hd3a.GHD8可与HD1、OsHAP5b形成异源三聚体复合物,激活转录Ghd7通过直接结合到启动子区域Ghd7,其中包含CCAAT-box主题。
结论
本研究结果有助于阐明该疾病的遗传和分子基础Ghd8而且Ghd7相互作用,表明Ghd8在上游行动Ghd7激活它的转录,抑制Hd3a从而影响开花时间和水稻适应。
背景
光周期敏感性(PS)被定义为植物对相对长度的明暗周期的发育反应,并赋予许多植物通过调整开花时间来适应一系列生长季节周期的能力。开花时间或抽穗期(HD)是作物最重要的农艺性状之一。根据气候变化可能开始的花期在很大程度上决定了作物的产量潜力[1].之所以观察到这一特性,是因为在各种自然条件下,籽粒产量与开花时间呈正相关[2],开花时间过早或过晚都可能导致减产。据报道,由于开花时间基因的功能缺失突变体或弱等位基因导致作物的光周期不敏感,限制了它们在特定环境条件下的分布,如高纬度地区[3.,4,5,6].
开花时间的调控机制已被广泛研究拟南芥还有大米[7,8].作为一种短日照植物,水稻(栽培稻L.)在短昼(SD)条件下开花迅速,而在长昼(LD)条件下开花较晚。据报道,在这两种条件下,有两个独立的基因通路参与调控开花时间。水稻的OsGI-Hd1-Hd3a(水稻GIGANTEA,穗期1和穗期3a)信号通路在进化上被保守为GI-CO-FT (GIGANTEA, CONSTANS,和开花位点T)通路拟南芥.在这些基因中,花素基因在下游途径的表达,如Hd3a /英国《金融时报》在决定花期方面起着重要作用。高表达Hd3a /英国《金融时报》强烈加速开花时间,下调其表达延迟或阻止开花[9,10].近年来,在水稻中发现了几种新的开花基因;他们没有骨科医生拟南芥基因组构成了水稻特异的开花途径。例如,Ghd7(粒数、株高和抽穗期7),是一组CO、CO-like和TOC1 (CCT)结构域蛋白的同源物,被鉴定为通过抑制开花的抑制因子Hd3a在LD条件下[11].Ehd1(早抽穗期1)被鉴定为水稻特有的开花信号积分器,作用于上游Hd3a[12].此外,最近发现有几个开花时间基因参与了两种主要的独立信号通路中的任何一种,甚至将它们联系起来。Ghd7.1/OsPRR37据报道,含有保守的CCT结构域抑制Ehd1而且Hd3a仅在LD条件下,但独立于即.Ghd8 / DTH8(粒数、株高和抽穗期8),编码CCAAT-box结合因子HAP3/NF-YB蛋白,被鉴定为影响开花的主要作用位点,具有LD条件下抑制开花和SD条件下通过调控促进开花的双重功能Ehd1而且Hd3a.此外,GHD8、HD1和OsHAP5/NF-YC亚基可以形成一个异源三聚体复合物,在的启动子处结合CORE元件Hd3a直接调节其表达[6].即是否有一种基因被报道与其他开花时间基因相互作用,如Hd2 / PRR37 Ghd8(DTH8 / LHD1 Hd5 / LH8),Hd6,SE5而且Ghd7[13,14,15,16,17,18,19,20.,21,22,23].其中一些相互作用在分子水平上得到了进一步的验证,显示出蛋白质-蛋白质相互作用的复杂性,以调节下游基因的表达。例如,HD1和GHD7蛋白形成复合物,特异性地与a结合独联体-调节区域Ehd1并抑制它的表达[24,25].基因间相互作用在遗传和分子水平上的揭示极大地增强了我们对花期调控网络的理解。
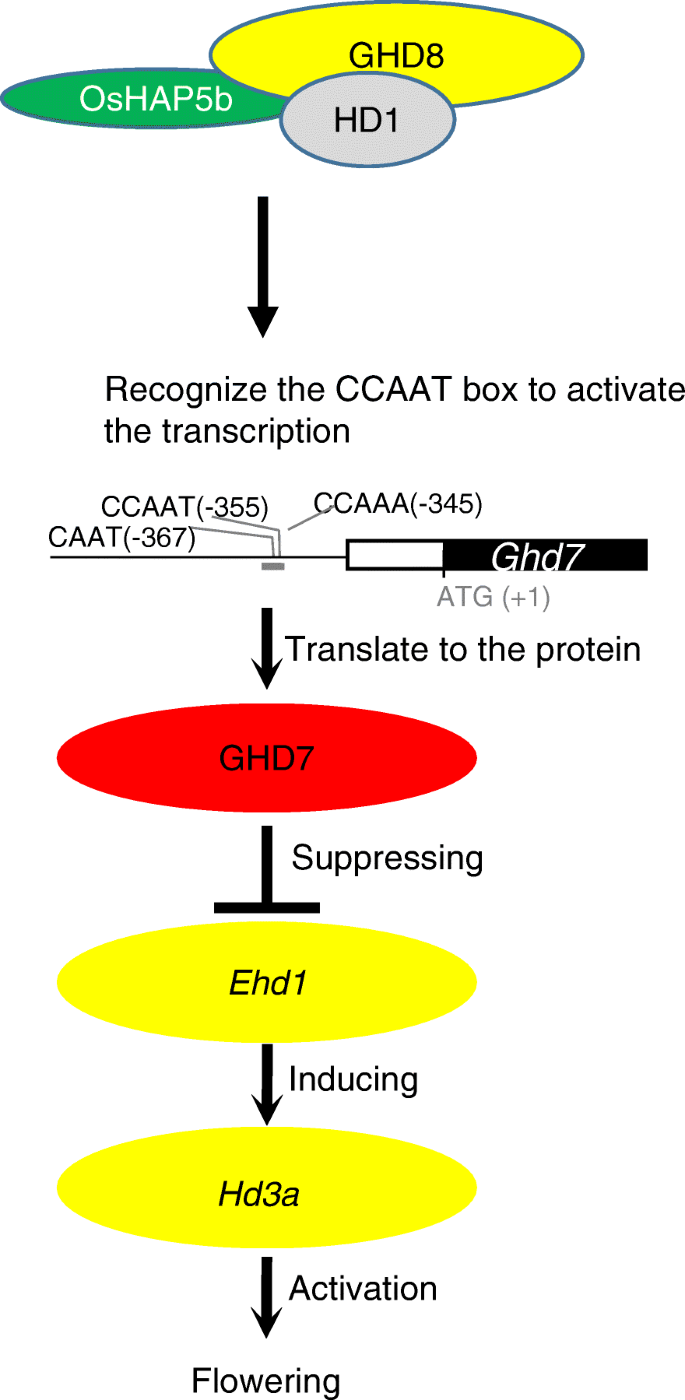
Ghd7而且Ghd8是最近发现的两个对水稻籽粒数、株高和抽穗期具有相同多效作用的主要基因。先前的研究结果表明,两者之间存在很强的遗传相互作用Ghd7而且Ghd8,严重影响水稻自然种群的开花时间[26].这种相互作用的效果可以通过一个功能被强烈地放大即.然而,这两种基因是否存在以及如何存在仍然未知Ghd7而且Ghd8在分子水平上相互作用。为了解决这一问题,首先利用一组近等基因系(NIL)和水稻核心收集板研究了水稻的遗传互作效应Ghd7而且Ghd8。然后,进行转录分析、电泳迁移率漂移试验(EMSA)和染色质免疫沉淀(ChIP)分析,以寻找可能的分子相互作用。我们的研究结果显示Ghd8诱导转录Ghd7通过GHD8-OsHAP5b-HD1复合物绑定到特定的CCAAT-box区域Ghd7启动子。在SD和LD条件下,Ghd8可能与OsHAP5B形成复合物,HD1激活转录Ghd7抑制…的表达Ehd1而且Hd3a,导致花期晚。这两个功能Ghd8而且Ghd7是控制水稻PS的关键即而且Hd3a.这些分子和遗传相互作用的研究结果为研究水稻开花时间和适应的基因调控网络提供了新的思路。
结果
Ghd8根据功能对农艺性状起作用Ghd7
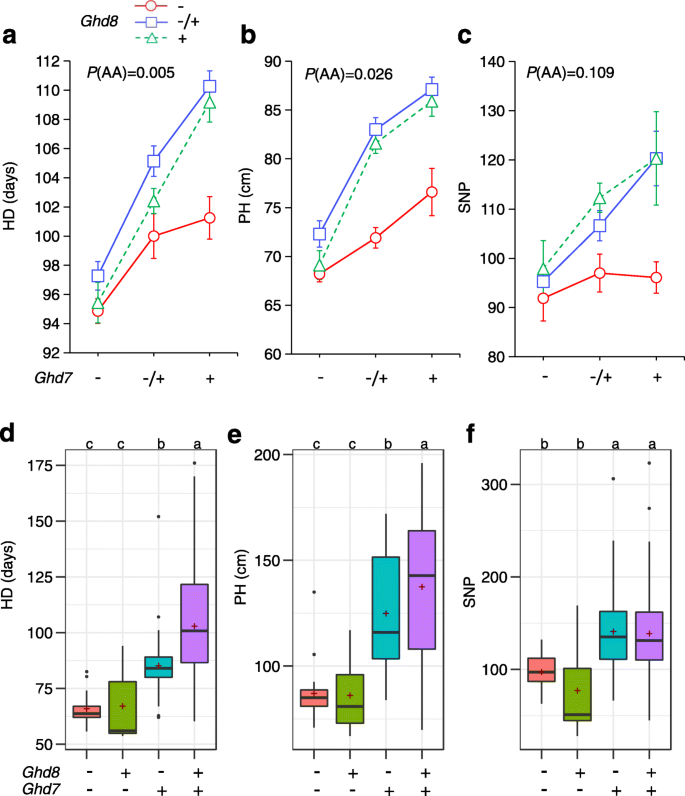
这两个Ghd8而且Ghd7已被确定为主要影响位点,在影响水稻抽穗期(HD)、株高(PH)和籽粒产量方面表现出多效性[11,27].显著的相互作用也影响了抽穗日期[26].为了更好地理解这种相互作用如何作用于不同的农艺性状,我们开发了F2该群体是由珍山97B (ZS97)背景中的近等基因系NIL-Ghd8和NIL-Ghd7杂交而来。基因分析证明了这一点Ghd8而且Ghd7显著影响HD (p= 0.005)和PH值(p= 0.026)。1a和b)。显著差异(p3个基因型在3个性状中均检测到HD、PH和每穗小穗数(SNP) < 0.001)Ghd8在函数中Ghd7背景(图。1a - c)。然而,在非功能性群体中,所测性状无显著差异ghd7背景。
重要的相互作用Ghd8而且Ghd7在196个水稻品种组成的核心收藏板上也发现了这一信息。Tukey诚实度检验(α = 0.05)表明各品种携带Ghd8ghd7(只有Ghd8功能)在HD、PH和SNP上与携带ghd8ghd7(两个等位基因都丧失了功能)在自然LD条件下(图。1d-f)。然而,品种携带Ghd8Ghd7与对照组相比,HD明显延迟,PH和SNP明显升高ghd8ghd7而且Ghd8ghd7品种。特别是品种携带Ghd8Ghd7表现出明显的延迟HD和PH值的增加ghd8Ghd7.这些结果表明Ghd8影响农艺性状的功能Ghd7 -依赖的方式。因此,结果证实了Ghd8基因相互作用Ghd7延迟开花时间和增加株高均质和异质背景。
的相互作用Ghd8而且Ghd7对于即而且Hd3a控制PS
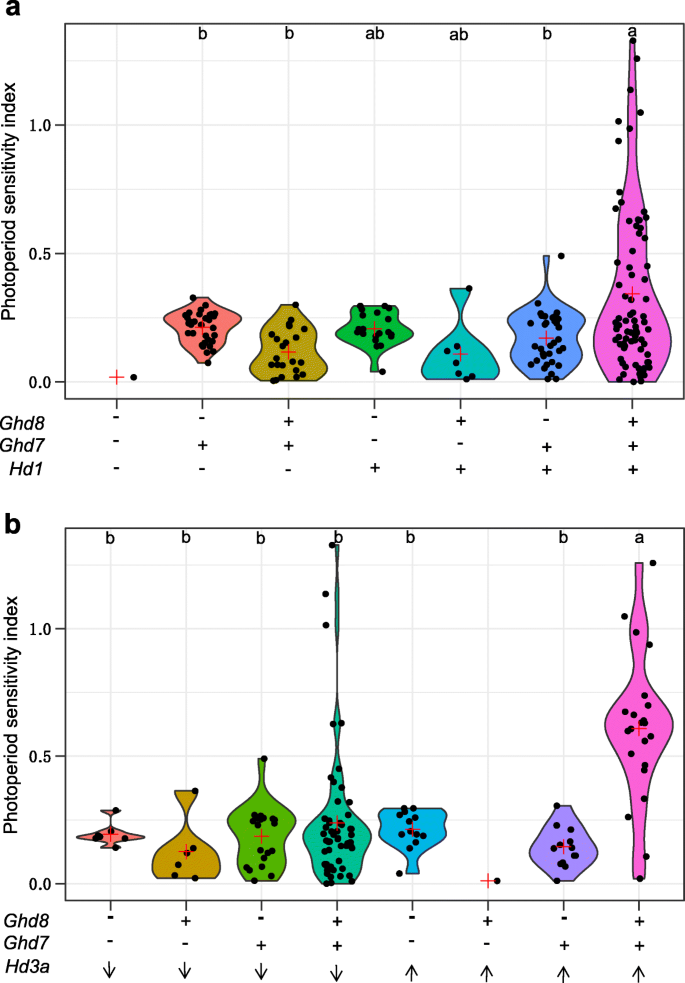
光周期敏感性是水稻品种适应变异环境的重要因素。据报道即是决定水稻PS的关键基因[28].考虑到两者Ghd7而且Ghd8都参与了Hd1-Hd3a调控途径[25,29,30.],我们测试了两者之间的相互作用Ghd7而且Ghd8或Ghd7而且Ghd8单独能影响功能即在SD和LD条件下均种植。各品种PS指数由公式(|HDLD-高清SD|) /高清LD(附加文件1:表S1)。在水稻籽粒收集中,PS存在较大差异。Ghd8Ghd7Hd1(均为功能性等位基因)显示的平均PS显著高于Ghd8Ghd7hd1(即无功能)(图。2A),暗示即是决定PS变异的关键基因,如前所述[28].单体型Ghd8Ghd7Hd1PS也显著高于单倍型ghd8Ghd7Hd1,后者的PS略高于单倍型,但差异不显著Ghd8ghd7Hd1而且ghd8ghd7Hd1.这些结果表明功能性Ghd8而且Ghd7它们之间的相互作用需要即,此外,Hd3a另一个决定水稻PS的基因,也表现出类似的模式(图。2B),表明两者都是功能性的Ghd8而且Ghd7它们的相互作用在影响蛋白表达水平方面起着重要作用Hd3a对PS的控制,品种携带功能Ghd8,Ghd7,Hd3a启动子属于高表达型[31]显示平均PS水平明显高于其他单倍型。而在携带功能性的品种中,未观察到这一显著性Ghd8而且Ghd7与发起人一起Hd3a属于低表达型。
遗传相互作用Ghd7而且Ghd8条件即而且Hd3a影响水稻中PS含量。(a)以三个功能基因划分的七个基因型的光周期敏感性指数比较(Ghd7,Ghd8,即),如小提琴盒所示,共有196种。Ghd8ghd7hd1在核心集合中不可用。(b)以两个基因分类的八种基因型的PS比较(Ghd7,Ghd8)及Hd3a196个品种中有139个品种有启动子。启动子类型Hd3a是根据以前的报告选取的[31].向上和向下箭头表示的高和低表达水平Hd3a类型。57个品种没有功能即不包括在(b)分析中。红色加号表示PS的平均值Ghd8,Ghd7而且即基因,图底的“+”和“-”符号表示功能等位基因和非功能等位基因。图顶部的不同字母表示各单倍型间PS的Tukey 's HSD检验差异显著(α = 0.05)。因为只有一个品种,单倍型ghd8ghd7hd1而且Ghd8ghd7Hd3a(高表达)未用于分析
此外,一个隔离种群在三个位点上隔离,Ghd7,Ghd8而且Hd1,采用齐次背景下的ZS97分析了相互作用之间的影响Ghd8,Ghd7而且即.基因型间的方差分析表明,在自然LD条件下,功能即(ZS97等位基因)对延迟HD的作用最强(平均= 160 d)Ghd8Ghd7Hd1等位基因组合时兼有Ghd7(9311等位基因)和Ghd8(9311个等位基因)具有功能性;然而,ghd8Ghd7Hd1或Ghd8ghd7Hd1携带单一功能的基因型Ghd7或Ghd8显示较早的标题日期(附加文件3.:图S1)。这些结果进一步表明Ghd8而且Ghd7戏剧性地增加了即对水稻抽穗期控制的影响。
Ghd8移植Ghd7抑制表达Hd3a
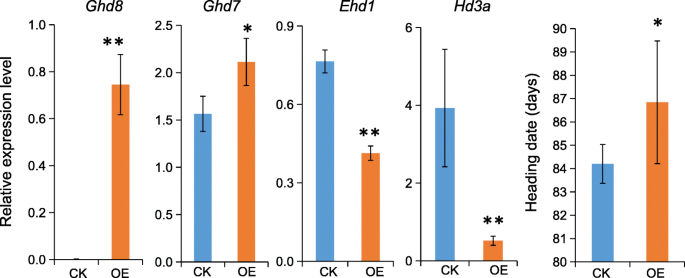
为了探究这种相互作用的分子基础,研究了五个开花相关基因的转录水平(Ghd8,Ghd7,即,Ehd1而且Hd3a)在4种NILs的35日生幼苗叶片(NIL (ghd8ghd7), nil (Ghd8ghd7), nil (ghd8Ghd7), nil (Ghd8Ghd7))(图3.a). NIL (ghd7ghd8)在SD (14 h暗:10 h光)和LD (10 h暗:14 h光)条件下开花时间相似,对光周期变化不敏感(PS指数= 0.01)(图2)。3.B),虽然它携带功能即等位基因。零(Ghd8Ghd7)与其他三种NILs相比,显著延迟HD (ghd8ghd7,Ghd8ghd7,ghd8Ghd7)在SD和LD条件下均表现出最高PS (PS指数= 0.44)。特别是,NIL (Ghd8Ghd7)在LD条件下,即使在180 d后也没有开花(图。3.b).与空值比较(ghd8ghd7), nil (ghd8Ghd7)在SD条件下HD无显著差异,但在LD条件下HD显著延迟。相比之下,NIL (Ghd8ghd7)在LD条件下延迟HD,而在SD条件下促进HD,导致PS高于NIL (ghd8Ghd7).5个开花基因的相对表达量分析证实了该基因的转录水平Ghd7在NIL中几乎没有检测到(ghd8ghd7)及NIL (Ghd8ghd7),因为删除了Ghd7ZS97基因片段[11].然而,Ghd7在北港岛(Ghd8Ghd7)的表达水平显著高于NIL (ghd8Ghd7)在SD和LD条件下(图。3.c).此外,Ehd1而且Hd3aNIL的表达水平(Ghd8Ghd7)表现出了与其他NILs相比严重的抑制作用,这与NIL开花时间严重延迟一致(Ghd8Ghd7)(图。3.b).的相对表达量即在SD和LD条件下,4种NILs均无显著差异,说明Ghd8而且Ghd7的转录水平没有影响即.这些结果表明Ghd8可能在激活花阻遏因子的转录中起作用Ghd7抑制下游基因的表达Ehd1而且Hd3a在LD和SD条件下,导致花期晚。
不同组合的NILs中关键开花基因的表达水平Ghd7而且Ghd8等位基因。(a)在SD (10 h L: 14 h D)和LD (14 h L: 10 h D)条件下,四种无水肥在生长室内抽穗日期的表现。(b)无水肥抽穗日期(ghd8ghd7), nil (Ghd8ghd7), nil (Ghd7ghd8)及NIL (Ghd8Ghd7)在SD(白柱)和LD(黑柱)条件下,光周期灵敏度(PS)指数(灰柱)。(c)的表达水平Ghd8,Ghd7,Ehd1,Hd3a而且即在SD和LD条件下。y轴表示归一化的基因的相对表达量泛素.采用Tukey’s HSD检验在SD和LD条件下检验4个单倍型的抽穗日期或表达的显著性。柱形上方不同的字母表示的意义p< 0.05。平均值±SE (n= 4 - 6)
GHD8介导的HD1结合启动子Ghd7
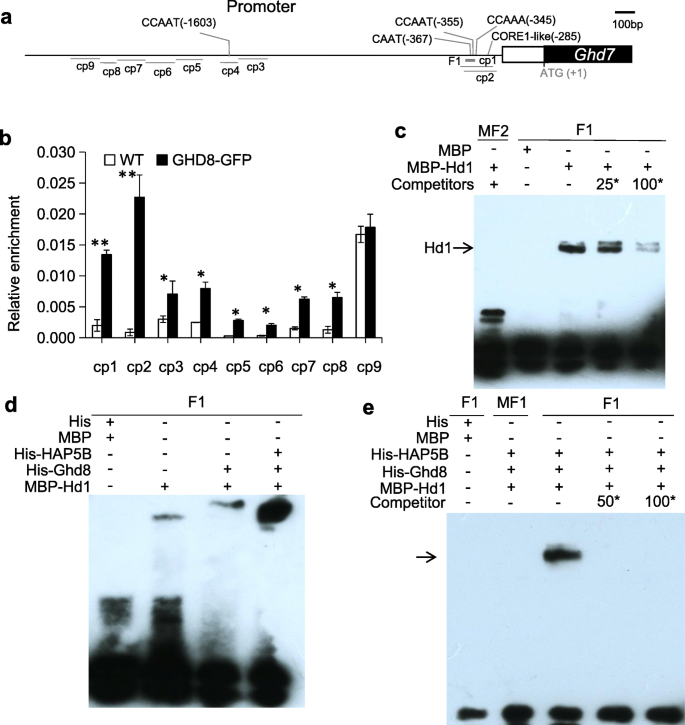
要理解Ghd8与Ghd7在分子水平上,我们首先对GHD8和GHD7之间的蛋白质相互作用进行了酵母双杂交实验。然而,分析并没有揭示他们之间的直接相互作用(附加文件4:图S2a)。有研究表明,核因子A (NF-YA)可以与NF-YB/NF-YC相互作用,形成NF-Y三聚体复合物,参与结合特异性的转录激活独联体-规管要素,例如CCAAT-box或CORE要素[6,32,33].以解决是否Ghd8(NF-YB)调控的表达Ghd7通过直接或间接结合启动子上的特定DNA区域Ghd7的2.5 kb启动子区域内的CCAAT盒和CORE元件Ghd7通过使用在线推广人数据库PLACE [34].的Ghd7启动子区域在近端和远端区域包含两个CCAAT-box基序:起始密码子(ATG)上游的−355 bp和−1603 bp,在−285 bp检测到一个core1样基序CATCCACA/TGTGGATG [35,36].然后,我们开发了GHD8-GFP转基因植物,并用这些转基因株系的提取物进行ChIP分析。在自然LD条件下,过表达GHD8-GFP转基因株系与野生型相比,HD有显著差异,大约延迟3-d(图2)。4),表明GHD8-GFP蛋白具有生物学功能。使用9对引物qPCR分析存在抗体GFP和输入(无抗体)的沉淀产物(图。5A, b)对应于启动子区域的不同区域。ChIP分析显示,在所有引物组中,覆盖CCAAT-box - 355 bp的相邻片段cp1和cp2以及覆盖ATG上游- 285 bp的core1样基序的GHD8-GFP富集程度高于输入对照(图2)。5b).这些结果表明GHD8蛋白可能参与了CCAAT-box和/或CORE-like motif的结合Ghd7启动子激活其转录。
GHD8与启动子结合Ghd7.一个的原理图Ghd7该基因模型显示了起始密码子ATG中两个CCAAT-box motif和一个CORE1-like motif的位置。用于ChIP检测的cp1到cp9片段的相对位置如下所示的基因模型;F1表示凝胶位移分析中覆盖CCAAT-box motif的片段。b使用抗gfp抗体对GHD8-GFP融合蛋白进行ChIP分析。析出的染色质片段使用9个目标区域(cp1至cp9)引物组进行分析,如图(一个).c凝胶位移分析。重组HD1蛋白与生物素- f1孵育,在没有或存在25或100倍摩尔多余的未标记探针作为竞争对手。箭头表示HD1蛋白转移的条带。以麦芽糖结合蛋白(MBP)和His(多组氨酸)标记蛋白作为阴性对照。dGHD8与HD1相互作用绑定F1探针。e复合物GHD8-OsHAP5b-HD1(如箭头所示)与F1探针在未标记探针存在或不存在50或100倍摩尔过量情况下的相互作用。突变体F1 (MF1或MF2)探针缺乏CCAAT盒作为阴性对照
我们还发现,在酵母双杂交实验和下拉实验中,GHD8直接与OsHAP5b相互作用4图S2 b和c).遗传互作研究显示功能Ghd8而且Ghd7都是必不可少的即控制水稻中的PS(图;2,附加文件3.:图S1),这意味着这三个基因可能共同调节开花时间。测试GHD8和OsHAP5b形成的复合物是否在启动子处识别CCAAT-boxGhd7通过与HD1相互作用,使用与cp1和cp2片段重叠的F1探针进行EMSA(图2)。5a, c). EMSA结果显示,单独的重组HD1 (MBP-HD1)在体外可以直接与F1片段结合,结合能力较弱,过量的未标记F1片段(竞争对手)抑制了结合(图。5c, d)。在EMSA实验中,我们发现MBP-HD1与His-GHD8孵育或与His-GHD8和His-HAP5b孵育均能以不同的亲和力与F1片段结合(图。5d)。此外,当GHD8、HD1和OsHAP5b蛋白与探针F1一起孵育时,观察到明显更强的结合信号(图1)。5d),这与之前的研究一致,即HD1与GHD8和OsHAP5b相互作用形成三聚体复合物,结合水稻的CORE motif [30.].这一结果也通过使用未标记的F1片段和探针MF1(缺乏CCAAT元件的突变F1探针)进行竞争分析得到了证实(图。5e)。
讨论
分子相互作用Ghd8而且Ghd7
Ghd7而且Ghd8已被报道为决定开花时间和植物生长的主要基因[11].在本研究中,我们证明了这一点Ghd8基因相互作用Ghd7在近等基因系和籽粒组中,均延迟抽穗期。重要的是,我们发现转录水平Ghd7被激活Ghd8通过GHD8-HAP5b-HD1复合体。
在LD条件下,Ghd7强烈压抑的表达Ehd1,导致花素表达降低Hd3a抑制水稻开花[11].最近的研究表明Ghd7在转录和翻译后水平上受其他开花时间基因控制,如OsELF3而且Hd16[29,37],这表明对Ghd7是长日抑制通路中决定开花时间的关键因素。此前一份报告中的监管途径表明了这一点即的表达水平上调Ghd7,导致的下调Ehd1而且Hd3a在LD条件下[24].此外,Nemoto等人报道HD1和GHD7蛋白之间的相互作用导致协同抑制Ehd1造成花期严重延误[25].GHD7-HD1复合物抑制Ehd1通过绑定到独联体-调节区域Ehd1[6],这表明即被整合到LD抑制途径中。由于的高表达Ghd7,Ehd1而且Hd3a被抑制以推迟开花[27,30.].因此,Ghd7不仅作为信号积分器接收生物钟的输出[37],但也在传递其他与开花相关基因的调控信号中发挥作用,如即来Ehd1,以影响花期。值得注意的是,在Hd3a在NILs中显示表达水平ghd8Ghd7而且ghd8ghd7;有趣的是,Hd3a在NIL被抑制(Ghd8Ghd7),较空区增长约八倍(Ghd8ghd7)在SD条件下(图;3.c).这些结果表明Ghd7是否起到了抑制表达的作用Hd3a函数的依赖方式Ghd8(无花果。6).此外,我们的数据显示了增强的效果Ghd8而且Ghd7在ZS97的遗传背景下,对开花时间进行了互作即;的转录水平即在ZS97背景的NILs中保持不变。这一发现表明Ghd8可能通过GHD8或GHD7蛋白与HD1相互作用的转录后机制将HD1 - GHD7通路整合到水稻开花的调控中。
在此之前,Ghd8所扮演的角色与即在LD或SD条件下开花时间被抑制或激活[27,30.].即被压抑的Hd3a在LD条件下或在SD条件下激活的基因表达存在无功能ghd7[25].在目前的研究中,双重功能为Ghd8开花也被发现依赖于非功能性的存在ghd7(无花果。3.b, c)。在空值(ghd8ghd7)及NIL (Ghd8ghd7)与功能即背景下,Ghd8导致SD条件下提早开花。始终如一,Hd3a表达在NIL中更为活跃(Ghd8ghd7)比NIL (ghd8ghd7).之前的研究也表明,在SD条件下,即能激活的表达吗Ehd1而且Hd3a不管Ghd7函数(11].此外,据报道,含有hd1的NF-Y配合物具有结合保守响应元件的能力Hd3a启动子(6].这些结果表明Ghd8作为一种活化剂,并可能与即调节Hd3aSD条件下(图;3.).如上所述,GHD7-HD1复合物可以结合Ehd1LD条件下的启动子[25].GHD8-HD1复合体通过调控促进开花时间Hd3a表达式[30.].GHD8-HAP5b-HD1复合物可能被激活Ghd7增强其对开花时间的抑制作用。这些数据指向了连接Ghd8与Hd1和Ghd7的开花调控途径。综上所述,这些结果表明即不仅在SD条件下具有重要的激活转录的作用,而且还结合GHD7蛋白,抑制的表达Ehd1在LD抑制途径中。此外,Ghd8能增强抑制作用吗Ghd7SD和LD条件下开花时间的变化(图;3.c).这些研究结果表明即通过与其他转录因子的相互作用,如Ghd8而且Ghd7基因。
GHD8-OsHAP5b-HD1绑定CCAAT-box
Ghd8编码HAP3或NF-YB亚基的同源物,与HAP2和HAP5或NF-YA和NF-YC一起构成三聚体复合物,在启动子处结合CCAAT-box以激活基因转录[33].然而,在缺乏NF-YA的情况下,其他转录因子如CO或bZIP也与NF-YB和NF-YC相互作用形成新的复合物,导致不同的结合位点不严格与CCAAT-box结合[30.,38,39,40,41].例如CO和CO样蛋白的CCT结构域可以与NF-YB和NF-YC的复合物相互作用,将CORE-element结合在其中拟南芥[35,42].据报道,在水稻中,GHD8-OsHAP5b-HD1复合物直接结合CORE1元件在水稻的启动子上Hd3a调节开花[30.].在目前的研究中,发现GHD8-OsHAP5b与HD1相互作用形成三聚体复合物,在- 355 bp位点与CCAAT-box结合Ghd7启动子。HD1单独或HD1- ghd8二聚体能够直接结合到含有CCAAT-box的DNA片段F1上,但该片段没有覆盖core1样motif序列(图2)。5).因此,我们认为GHD8-HD1或HD1蛋白可以识别−355 bp位点的CCAAT基序。
此外,NF-YB-NF-YC-CO的三聚体复合物似乎对CORE motif的结合更为重要拟南芥[35],甚至其中任何一个突变都可以完全消除复合物的结合能力。相比之下,据报道,在水稻胚乳中,仅NF-YB1亚基可以直接结合下游基因,而不需要其他NF-Ys的帮助[40,43].我们的研究揭示了HD1和HD1- ghd8二聚体在CCAAT-box motif上的低结合亲和力,提示HD1蛋白可能能够结合CCAAT-box motif和CORE1 motif,并与OsHAP2/NF-YA具有重叠功能,并与这些亚基竞争识别CCAAT-box motif [44].虽然core1样基序在GHD8-OsHAP5b-HD1配合物结合稳定性中的作用有待进一步研究,但分子间的相互作用Ghd8而且Ghd7控制Hd3a表达支持GHD8-OsHAP5b-HD1调控复合物参与Ghd7镇压通路。这些结果表明,GHD8-OsHAP5b-HD1复合物存在多个靶点,可以调节开花网络中基因表达的时空调控,这可能对水稻适应不同栽培区域有很大的贡献。
的影响Ghd7而且Ghd8交互
亚洲栽培水稻有两个亚种:籼稻而且粳稻,两者分布于不同的生态地理环境[31].在本研究中,Ghd8而且Ghd7,以及它们的相互作用效应,在特定的光周期条件下被检测到。该品种兼有较弱的功能性Ghd7而且Ghd8等位基因主要分布在北纬35°- 45°之间的北部地区,该地区的农民通常在长日照的夏季种植季节进行单株种植(附加文件)5:图S3)。那里种植的大多数品种都是粳稻亚种(11,27]并显示相对较低的PS(平均PS指数= 0.2)(附加文件1:表S1)。同时,该品种具有较强的功能性Ghd7而且Ghd8PS较高的主要分布在25°N ~ 15°N之间的亚热带和热带地区。此外,部分品种同时含有非功能等位基因ghd7而且ghd8主要发生在北纬25°(附加文件)5:图S3)。这一发现表明无功能性ghd7而且ghd8有利于该地区所需品种的快速生长,该地区可进行多次种植。
值得注意的是,几乎所有的北方粳稻的两种功能等位基因的品种Ghd7而且Ghd8有功能即(附加文件5:图S3)。而在自然LD条件下,这些品种开花时间较早(68 ~ 85 d)。这一意想不到的观察结果不同于NILs中与籼稻背景,虽然他们携带所有功能等位基因Ghd7,Ghd8而且即.一种解释是粳稻品种可能会有分歧Ghd7,Ghd8或即具有较弱功能的等位基因粳稻水稻对北方/高纬度地区的适应[11,27,31,45,46].我们的研究表明,一个高度不平衡的连杆Ghd7而且Ghd8存在于粳稻大米(p< 0.01),和Ghd8或Ghd7也发生在连杆不平衡与即和/或Hd3a在这两种籼稻或粳稻.这些基因之间的高度连锁关系表明,调控网络中一些较好的基因可能被共同选择以获得合适的开花(附加文件)6:图S4)。另一种可能的解释是,在水稻中未发现的一些开花基因相互作用有助于抵消由功能导致的严重延迟开花Ghd7,Ghd8而且即[23,29].
水稻花期与籽粒产量之间存在显著的相关性。花期越长,籽粒产量越高。然而,在增加产量潜力和延迟HD之间存在权衡。因此,在动作方面Ghd7而且Ghd8这些基因在花期调控中起着至关重要的作用,因此在高产育种方案中,特别是在低纬度地区使用的品种,应同时考虑这些基因,因为低纬度地区通常采用多次种植来获得高产。由于大米是人体每日热量的主要来源,因此解读两者的综合作用Ghd8,Ghd7,即研究开花过程中的调控途径有助于阐明水稻对各种光周期条件的适应机制,并有助于水稻高产品种的分子设计。
结论
这项研究调查了两个主要基因之间的遗传相互作用,Ghd8而且Ghd7,利用水稻天然种质板与空系杂交产生的分离群体。通过EMSA和ChIP等一系列实验进一步确定了它们相互作用的分子基础。我们发现Ghd8调节转录Ghd7通过GHD8-OsHAP5b-HD1调控复合物。因此Ghd8而且Ghd7在一起即这在很大程度上解释了水稻品种开花时间严重推迟、株高增加和产量潜力提高的原因。我们还发现两者都有功能Ghd8而且Ghd7是控制水稻PS的关键即而且Hd3a这对于水稻品种适应不同环境是非常重要的。这些发现揭示了水稻产量和适应性基因相互作用的分子和遗传基础,揭示了不同功能等位基因的选择性和组合在水稻育种中对提高产量潜力非常有用。
方法
植物材料和生长条件
196份水稻种质用于核苷酸测序分析[47,48].这些资料来自中国水稻研究所和国际水稻研究所。在自然LD条件下武汉(N30.52, E114.3)和自然SD条件下海南(N18.48, E110.02)进行测定。
两条先进的回交系,拥有任一功能的基因组区域Ghd7,Ghd8或即用来生成F1混合动力汽车(20.].F1然后将植株与ZS97回交两次,生成BC2F1的一代。不列颠哥伦比亚省的隔离人口2F2在海南生长了大约200株。利用SSR标记RM5436、PID2和RM121进行杂合片段的筛选Ghd7,Ghd8而且即在穿越计划中。的四种纯合基因型Ghd8Ghd7,Ghd8ghd7,ghd8Ghd7而且ghd8ghd7以ZS97为共同背景,选择近等基因系(NILs)即是功能。
为了比较不同光/暗条件下NILs的HD和PH值,在生长室中分别在LD (14 h光照:10 h暗)和SD (10 h光照:14 h暗)条件下培养10株NILs。开花时间以每株系8株为基准进行测定。HD被定义为第一个圆锥花序从旗叶出现的时间。
DNA测序
在编码区测序,对收集的水稻核进行基因分型Ghd7,即,Ehd1,Hd3a而且Ghd8涵盖最近论文所述的功能场地[11,12,27].PCR扩增片段在按照制造商规范消化和纯化后,直接使用BigDye Terminator Cycle Sequencing v3.1 (Applied Biosystems, Foster, USA)测序。所用引物列在附加文件中2:表S2。
基因表达分析
采集35日生植株NILs主茎叶片,分析其转录水平Ghd8,Ghd7,Hd3a,Ehd1而且即.在SD和LD条件下分别在30°C光照和26°C黑暗的生长室中生长NILs。在SD条件下采集Zeitgeber time (ZT) 4,在LD条件下采集ZT 8,进行基因表达分析。zt0表示黎明。使用RNA提取试剂盒(TRIzol Reagent, Invitrogen)收集样品进行RNA提取。根据报道,采样的时间点对应于每个基因的表达峰值[11,27].用DNase I去除污染基因组DNA后,用SuperScriptII逆转录酶(Invitrogen)提取约2 μl RNA,在20 μl的反应体积内合成cDNA。Real-time PCR (RT-PCR)在总体积为25 μl的Applied Biosystems 7500 Real-time PCR系统上进行,每个反应包含2 μl cDNA、2 μl引物(0.4 μl)、8.5 μl蒸馏水和12.5 μl SYBR®Green PCR Master Mix (Applied Biosystems)。对表达式数据进行规范化处理泛素相对定量法基因[49].所有试验至少进行了3个生物重复和3个技术重复。用于转录分析的引物列在附加文件中2:表S2。
酵母双杂交试验
蛋白质编码区Ghd7,Ghd8而且OsHAP5b分别使用添加限制性内切酶位点的基因特异性引物进行扩增(附加文件2:表S2)。然后,Ghd7或OsHAP5b将PCR扩增的产物融合到激活域(activation domain, AD)载体pGADT7中作为捕食系统EcoR我和Xho我网站,和Ghd8产品EcoR我和BamHI位点被融合到dna结合域(BD)载体pGBKT7上作为诱饵系统。所有结构均通过测序验证。两个质粒的共转化Ghd8,OsHAP5b而且Ghd7根据制造商的协议(Matchmaker Gold yeast Two-Hybrid System, Clontech),将基因注入AH109酵母菌株并进行细胞培养。pGBKT7-53 (pBD-53)和pGADT7-T (pAD-T)作为阳性对照,pGBKT7-Lam和pGADT7-T (pAD-T)作为阴性对照。
体外下拉试验
的编码区Ghd8被克隆到pET-32a载体(Novagen)和pGEX-6P-1载体(GE Healthcare)中EcoR我和XhoI网站,分别。为了获得OsHAP5b蛋白,我们使用了与GHD8相同的方法。重组表达载体表达于大肠杆菌Transetta (DE3)细胞(Transgen)。下拉实验如前所述[50].简而言之,在上清液中加入等量的谷胱甘肽s -转移酶(GST)或OsHAP5b-GST,加入GHD8-His重组蛋白,在4时孵育6小时°C在总体积为2 ml的下拉缓冲液(20 mmol Tris-HCl, pH 8.0, 200 mmol NaCl, 1 mmol EDTA, 0.5% Lgepal CA-630和蛋白酶抑制剂)中加入200 μl GST树脂(GE Healthcare;17-5132-01),并在4下孵育2小时°C.将结合反应冲洗5次(每次10分钟,4°C)使用下拉缓冲器。在大量洗涤后,下拉的蛋白质用95度的沸水洗脱°用12%的SDS-PAGE分离,用抗gst抗体(Abcam;ab19256)和抗his抗体(Abcam;分别ab9108)。
ChIP(染色质免疫沉淀)
对于ChIP检测,使用野生型和GHD8-GFP转基因株系进行染色质提取和免疫沉淀,方法如下[51].简单地说,在LD条件下(光照15小时:暗9小时)收集大约35天大的幼苗的幼叶。在用甲醛处理蛋白质与DNA交联后,用超声波将交联裂解液剪切成更小的片段大小。可溶性染色质片段分离纯化,进行以下步骤。抗gfp免疫沉淀(Abcam;ab290)对野生型和GHD8-GFP转基因株系进行3个重复序列的检测。使用附加文件中列出的特定引物对沉淀DNA进行定量RT-PCR分析2:表S2,设计用于覆盖ATG上游2 kb引物区域内的CCAAT-box元素Ghd7.
为了构建GHD8-GFP融合体,玉米(玉米)泛素用pU1301的启动子- gfp盒替换pCAMBIA1391Xb的GUS片段,得到修饰后的pCAMBIA1391Xb [51].保守领域内Ghd8将涉及结合和相互作用功能的编码区放大并插入Kpn我和BamHI位点修饰pCAMBIA1391Xb,得到用于水稻转化的结构Ubi::GHD8-GFP。的农杆菌属在Nipponbare背景下,利用Ubi::GHD8-GFP构建的转基因植株进行介导遗传转化。
电泳迁移率漂移试验(EMSA)
利用基于pet32的GHD8和OsHAP5b表达载体,在其n端串联表达硫氧还蛋白和His(多组氨酸)标记的重组蛋白。一个大肠杆菌BL21菌株(Transgen)经载体转化,37℃培养。采用pMAL载体(New England Biolabs, E8000S)获得下游带有麦芽糖结合蛋白(MBP)的重组HD1蛋白。用Ni-NTA琼脂糖(QIAGEN;No. 30210)和直链淀粉树脂珠(New England Biolabs)。的Ghd7启动子片段F1(包括假定的结合位点CCAAT-box)分别由3 ' -生物素标记的寡核苷酸Ghd7F/R(生工生物科技)退火产生。DNA结合反应在5 mM Tris、pH 7.5、25 mM KCl、0.5 mM DTT、5 mM MgCl中进行,在室温下20分钟2, 2.5%甘油,0.05% NP-40和50 ng/uL聚(dI-dC)。我们遵循LightShift化学发光EMSA试剂盒(Thermo;No.20148),样品在5%聚丙烯酰胺凝胶上运行。用于EMSA的引物在附加文件中列出2:表S2。
连杆不平衡分析
的连杆不平衡分析Ghd7,Ghd8,OsHAP5b,即而且Hd3a使用TASSEL 3.0.147软件(http://www.maizegenetics.net/).这些基因在532个品种的启动子区(ATG上游1.5 kb)、编码区和3'UTR(终止密码子下游1 kb)的单核苷酸多态性序列从网站(http://ricevarmap.ncpgr.cn/django/snp_id/).将各品种各基因的所有snp输入TASSEL进行连锁不平衡分析。在532个品种中,分为两组,每组295个籼稻和156年粳稻进行连锁不平衡分析,并设置1%的阈值过滤低频snp。
统计分析
各性状间基因互作的方差分析2由空点交叉得到的分离总体(Ghd7) × nil (Ghd8)采用Statistica软件[52].采用JMP软件中的Tukey 's HSD(诚实显著差异)检验来确定哪些组有显著差异[53].
数据和材料的可用性
所有支持性数据都包含在本文中。在当前研究中未包括的其他使用和/或分析的数据集可根据要求从通信作者处获得。
缩写
- 芯片:
-
染色质免疫沉淀反应
- EMSA:
-
电泳迁移率漂移测定
- 机会:
-
血红素激活蛋白
- 高清:
-
标题日期
- LD:
-
工作时间长条件
- NF-Y:
-
核转录因子Y
- 零:
-
近等基因系
- PS:
-
光周期敏感性
- QTL:
-
数量性状位点
- SD:
-
短暂的条件
参考文献
- 1.
拟南芥和水稻自然选择和人工选择对花期的适应。中国机械工程学报,2007;32(12):379 - 379。
- 2.
高红,金敏,郑鑫,陈杰,袁东,辛艳,王敏,黄东,张震,周凯,盛鹏,马军,马伟,邓红,姜林,刘松,王辉,吴超,袁林,万杰。水稻光周期敏感性和区域适应性的主要定量位点Days to标题7。自然科学进展,2014;29(4):344 - 344。
- 3.
郭志刚,李志刚,李志刚。热带玉米种群光周期敏感性分析。中国农业科学,2002;26(5):471-81。
- 4.
特纳A,比尔斯J,福尔S,邓福德RP,劳里DA。伪响应调节因子Ppd-H1对大麦光周期具有适应性。科学。2005;310(5750):1031 - 4。
- 5.
Murphy RL, Klein RR, Morishige DT, Brady JA, Rooney WL, Miller FR, Dugas DV, Klein PE, Mullet JE。假反应调节蛋白37 (PRR37)光和时钟的同步调控控制高粱光周期开花。自然科学进展,2011;29(3):344 - 344。
- 6.
Goretti D, Martignago D, Landini M, Brambilla V, Gomez-Ariza J, Gnesutta N, Galbiati F, Collani S, Takagi H, Terauchi R, Mantovani R, Fornara F.转录和转录后机制限制了水稻的生育期1 (Hd1)功能以适应高纬度。公共科学图书馆,2017;13(1):e1006530。
- 7.
辛普森GG,迪恩c拟南芥,开花时间的罗塞塔石碑?科学。2002;296(5566):285 - 9。
- 8.
杨晓明,张晓明,张晓明,等。拟南芥和水稻光周期开花反应多样性的分子基础。植物科学进展。2004;35(2):344 - 344。
- 9.
由光周期的季节变化诱导开花。中国生物医学工程学报。2004;23(6):1217-22。
- 10.
吴超,游超,李超,龙天,陈刚,Byrne M,张强。Cys2/ his2型锌指转录因子RID1在水稻营养向花性发育中的主开关作用。自然科学进展,2008;29(3):344 - 344。
- 11.
赵翁雪W,邢Y, X, Y,唐W,王L,周H, S,徐C,李X,张问:自然变异Ghd7基因是一个重要的监管机构的标题日期和在水稻产量潜力。中国科学。2008;40(6):761-7。
- 12.
Doi K, Izawa T, Fuse T, Yamanouchi U, Kubo T, Shimatani Z, Yano M, Yoshimura a . Ehd1是水稻b型响应调控因子,具有短日促花作用,独立于Hd1控制ft样基因表达。基因开发,2004;18(8):926-36。
- 13.
山本文,林海红,佐佐木文,矢野明。水稻抽穗期数量性状位点Hd6的鉴定及其与Hd2的上位性互作。遗传学。2000;154(2):885 - 91。
- 14.
Izawa T, Oikawa T, Sugiyama N, Tanisaka T, Yano M, Shimamoto K.光敏色素介导外部光信号抑制水稻光周期开花FT直系化合物。基因工程学报,2002;16(15):2006-20。
- 15.
Ogiso E, Takahashi Y, Sasaki T, Yano M, Izawa T.在进化过程中,酪蛋白激酶II在开花时间调节中的作用是多样化的。中国生物医学工程学报。2010;32(2):344 - 344。
- 16.
Matsubara K, Yamanouchi U, Nonoue Y, Sugimoto K, Wang ZX, Minobe Y, Yano M. Ehd3是水稻开花的关键启动子。植物学报,2011;26(4):344 - 344。
- 17.
Shibaya T, nooue Y, Ono N, Yamanouchi U, Hori K, Yano M.长昼条件下水稻抽穗期QTL和Hd2抑制的遗传交互作用。应用物理学报,2011;23(7):1133-43。
- 18.
林海霞,梁志伟,佐佐木田,矢野明。水稻抽穗期数量性状位点Hd4和Hd5的精细定位与鉴定。中国农业科学(英文版),2003;
- 19.
林海霞,Yamamoto T, Sasaki T, Yano M.利用近等基因系控制水稻抽穗期的3个qtl Hd1、Hd2和Hd3的上位性相互作用的鉴定和检测。应用理论,2000;101:1021-8。
- 20.
王萍,邢玉珍,李志凯,余胜生。利用QTL金字塔改良水稻产量和品质。动物科学,2012;29:903-13。
- 21.
魏旭,徐娟,郭辉,姜玲,陈松,余春,周震,胡萍,翟宏,万娟。DTH8抑制水稻开花,同时影响株高和产量潜力。中国生物医学工程学报。2010;29(4):344 - 344。
- 22.
戴旭、丁勇、谭磊、付勇、刘峰、朱忠、孙旭、孙旭、顾鹏、蔡宏、孙晨。LHD1是DTH8/Ghd8的一个等位基因,控制着普通野生稻(Oryza rufipogon)抽穗期晚。中国生物工程学报,2012;29(3):344 - 344。
- 23.
具波峰,刘世升,朴景文,权春春,李伟德,安刚,张震,李俊,李忠,白忠宁。OsPRR37基因的自然变异调节了抽穗期,并有助于在大范围的纬度地区进行水稻种植。植物学报。2013;6(6):1877-88。
- 24.
张志智,胡伟,沈国杰,刘海宇,胡勇,周晓春,刘天明,邢永忠。在长昼条件下,Hd1抑制或促进头球的替代功能由Ghd7的状态决定。科学通报2017;7(1):5388。
- 25.
Nemoto Y, Nonoue Y, Yano M, Izawa T. Hd1,水稻中的CONSTANS同源物,通过与单cottspecific cct结构域蛋白Ghd7相互作用作为Ehd1抑制因子。植物学报,2016;26(3):344 - 344。
- 26.
植物学报。2015;208(4):1056-66。
- 27.
周陈王阎W, P, H, H,李问,王C,丁Z,张Y, Yu年代,邢Y,张问:一个主要的QTL, Ghd8,扮演多向性的角色在调节粮食生产力、株高和抽穗期水稻。植物学报。2011;4(2):319-30。
- 28.
Yano M, Katayose Y, Ashikari M, Yamanouchi U, Monna L, Fuse T, Baba T, Yamamoto K, Umehara Y, Nagamura Y, Sasaki T. Hd1是水稻主要光周期敏感数量性状位点,与拟南芥开花时间基因CONSTANS密切相关。植物科学进展。2000;12(12):2473-84。
- 29.
Hori K, ogisotanaka E, Matsubara K, Yamanouchi U, Ebana K, Yano M. Hd16是一种酪蛋白激酶I基因,通过调节日长响应来控制水稻开花时间。植物学报,2013;36(1):36-46。
- 30.
杜安,田伟,魏敏,闫伟,何红,周东,黄霞,李松,欧阳霞。DTH8-Hd1模块介导水稻开花日长依赖调控。植物学报,2017;10(7):948-61。
- 31.
Takahashi Y, Teshima KM, Yokoi S, Innan H, Shimamoto K.栽培水稻开花时间多样性与Hd1蛋白、Hd3a启动子和Ehd1表达水平的差异有关。自然科学进展,2009;26(4):357 - 357。
- 32.
朱松,王娟,蔡敏,张宏,吴芳,徐艳,李超,程珍,张鑫,郭旭,盛鹏,吴敏,王杰,雷超,王娟,赵忠,吴超,王宏,万杰。OsHAPL1-DTH8-Hd1复合体作为转录调控因子抑制水稻坐穗期。中国生物医学工程学报,2017;32(3):552-67。
- 33.
Petroni K, Kumimoto RW, Gnesutta N, Calvenzani V, Fornari M, Tonelli C, Holt BF, Mantovani R.植物核因子Y转录因子的混杂生命。植物科学进展。2012;24(12):4777-92。
- 34.
高志强,田川,李志强,李志强。植物顺式作用调控DNA元件(PLACE)数据库。1999.核酸工程学报,1999;27(1):297-300。
- 35.
Gnesutta N, Kumimoto RW, Swain S, Chiara M, Siriwardana C, Horner DS, Holt BF, Mantovani R. CONSTANS赋予组蛋白折叠NF-YB/NF-YC二聚体DNA序列特异性。植物学报。2017;29(6):1516-32。
- 36.
Tiwari SB, Shen Y, Chang HC, Hou Y, Harris A, Ma SF, McPartland M, Hymus GJ, Adam L, Marion C, Belachew A, Repetti PP, Reuber TL, Ratcliffe OJ。开花时间调节剂CONSTANS通过一个独特的顺式元件被招募到开花位点T启动子上。生态学报,2010;37(1):357 - 366。
- 37.
赵娟,黄霞,欧阳霞,陈伟,杜安,朱林,王松,邓小文,李松。拟南芥早花3的同源基因OsELF3-1调控水稻昼夜节律和光周期开花。公共科学学报,2012;7(8):e43705。
- 38.
拟南芥NF-YB亚基LEC1和LEC1- like通过与种子特异性abre结合因子相互作用激活转录。植物学报,2009;36(5):344 - 344。
- 39.
徐俊杰,张晓峰,薛华伟。水稻糊粉层特异的OsNF-YB1通过与ERF转录因子相互作用调节籽粒灌浆和胚乳发育。中国生物医学工程学报,2016;26(3):339 - 344。
- 40.
Bello BK,侯勇,赵娟,焦刚,吴勇,李忠,王勇,童霞,王伟,袁伟,魏旭,张娟。NF-YB1-YC12-bHLH144复合物直接激活Wx调控水稻籽粒品质。植物学报,2019;17(7):1222-35。
- 41.
侯晓玲,周金娟,刘超,刘玲,沈利林,于慧。核因子y介导的SOC1位点H3K27me3去甲基化调控拟南芥开花应答。Nat Commun. 2014;5:4601。
- 42.
熊本RW,张勇,Siefers N, Holt BF。在拟南芥中,NF-YC3, NF-YC4和NF-YC9是constans介导的光周期依赖开花所必需的。植物学报,2010;30(3):379-91。
- 43.
白安,陆晓东,李德强,刘建新,刘明昌。nf - yb1调控糊粉中蔗糖转运蛋白的表达,促进糖向水稻胚乳的装载。Cell res 2016;26(3): 384-8。
- 44.
李春雪,李春雪,李春雨,李春雨,李春雨,李春雨。小麦开花抑制因子VRN2和启动子CO2与核因子- y配合物的相互作用。植物学报,2011;36(5):344 - 344。
- 45.
李志刚,李志刚,李志刚。Hd5基因控制水稻抽穗期的研究进展。应用理论与实践。2013;26(3):611-8。
- 46.
Gomez-Ariza J, Galbiati F, Goretti D, Brambilla V, Shrestha R, Pappolla A, Courtois B, Fornara F.花抑制因子功能的丧失使水稻适应欧洲高纬度地区。中国机械工程学报,2015;26(7):344 - 344。
- 47.
王超,陈松,余山。利用GS3多位点开发水稻粒长精细标记辅助选择的功能标记。应用理论与实践。2011;22(5):531 - 531。
- 48.
温伟,梅红,冯峰,余松,黄忠,吴娟,陈玲,徐霞,罗磊。水稻7号染色体群体结构及关联定位。应用物理学报,2009;19(3):459-70。
- 49.
Livak KJ, Schmittgen TD。使用实时定量PCR和2(−Delta Delta C(T))方法分析相关基因表达数据。方法。2001;25(4):402 - 8。
- 50.
黄赵Y,程年代,歌曲Y, Y,周年代,刘X,周DX。水稻ERF3和WOX11的相互作用通过调控细胞分裂素信号通路中的基因表达促进冠根发育。植物学报。2015;27(9):2469-83。
- 51.
黄戴胡赵Y, Y, M, L,周DX。wuschel相关同源箱基因WOX11是激活水稻茎生冠根发育所必需的。植物学报。2009;21(3):736-48。
- 52.
Statistica。StatSoft Incorporated, Tusla, OK,美国。2015年4月21日访问。
- 53.
JMP,版本12.0.1。SAS Institute Inc.,卡里,北卡罗来纳州。1989 - 2017。2017年7月22日访问。
确认
我们感谢Daniel Schachtman博士对手稿的批判性阅读。感谢王崇荣博士、胡芬义博士和谭成菊女士领导水稻种质资料的收集工作。感谢郭月明博士在数据分析方面的协助。我们感谢Jian Yu在现场管理方面的协助。
资金
国家自然科学基金项目(31671656)、中央高校基本科研业务费专项资金项目(2662018YJ025)、国家高技术研究发展计划项目(No. 2014AA10A600)、国家高等教育博士点研究基金项目(No. 20120146110013)资助。资助机构在研究设计、数据收集、分析和解释以及撰写手稿方面没有任何作用。
作者信息
从属关系
贡献
PW和SY构想了这项研究;PW和RG进行实验;PW和SY对数据进行了分析;PW, YY和SY撰写了手稿。所有作者均已阅读并批准稿件。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1。表S1。
的功能等位基因Ghd8,Ghd7而且即启动子类型Hd3a在面板196个水稻品种。
附加文件2。表S2。
本研究采用PCR引物和EMSA探针。
附加文件3。图S1。
遗传群体的抽穗期(HD)Ghd8,即而且Ghd7.Ghd8,即而且Ghd7表示功能等位基因,小写ghd8,即而且ghd7表示非功能等位基因。Ghd8 / Ghd8,Ghd7 / Ghd7而且Hd1 / Hd1表明杂合子。
附加文件4。图S2。
蛋白质相互作用的检测。(a) GHD8和GHD7相互作用的酵母双杂交试验。(b)酵母GHD8和OsHAP5b双杂交检测。(c)体外GHD8和OsHAP5b的下拉试验。
附加文件5。图S3。
196个水稻品种地理分布。所有196个水稻品种均以4个组合突出Ghd8而且Ghd7并细分为籼稻或粳稻亚种。堆叠柱状图显示了四种组合(单倍型)的分布和频率Ghd7而且Ghd8等位基因。地图图片来自维基共享资源:https://commons.m.wikimedia.org/wiki/File.
附加文件6。图S4。
之间的连锁不平衡模式Ghd8而且Ghd7以及其他相关的开花基因即,Hd3a而且OsHAP5b在532个水稻品种中。以总群体、籼稻亚群和粳稻亚群分别进行分析。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
王鹏,龚荣,杨勇。et al。Ghd8控制水稻的光周期敏感性形成一个复合物,与Ghd7.BMC植物生物学19日,462(2019)。https://doi.org/10.1186/s12870-019-2053-y
收到了:
接受:
发表:
关键字
- 光周期敏感性
- 开花的时间
- 分子间相互作用
- CCAAT-box主题
- 大米