- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
两者之间的相互作用gydF4y2BamiR156 / SPL13gydF4y2Ba和gydF4y2BaDFR / WD40-1gydF4y2Ba调控紫花苜蓿的耐旱性gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba19gydF4y2Ba、物品编号:gydF4y2Ba434gydF4y2Ba(gydF4y2Ba2019gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
发展中gydF4y2Ba紫花苜蓿gydF4y2Ba耐旱品种对苜蓿的可持续生产至关重要。miR156通过沉默SQUAMOSA-PROMOTER BINDING protein like (SPL)转录因子调控多种植物生物学功能。gydF4y2Ba
结果gydF4y2Ba
为了了解miR156调控的苜蓿抗旱性的机制,我们使用了miR156调控的基因型gydF4y2BaSPL13gydF4y2Ba,gydF4y2BaDIHYDROFLAVONOL-4-REDUCTASEgydF4y2Ba(gydF4y2BaDFRgydF4y2Ba)调节gydF4y2BaWD40-1gydF4y2Ba。以前我们报道过miR156参与抗旱,但对这一过程的机制和下游基因的研究并不充分。在这里,我们展示了miR156/SPL13和WD40-1 /DFR之间的相互作用,通过协调基因表达与代谢物和生理策略来调节干旱胁迫。低至中等水平的miR156过表达被抑制gydF4y2BaSPL13gydF4y2Ba和增加gydF4y2BaWD40-1gydF4y2Ba来调整gydF4y2BaDFRgydF4y2Ba增强花青素生物合成的表达。这与其他积累的减轻胁迫的代谢物和生理反应相结合,提高了耐旱性。我们还证明了SPL13在体内与gydF4y2BaDFRgydF4y2Ba启动子调节其表达。gydF4y2Ba
结论gydF4y2Ba
综上所述,我们的研究结果表明,适度的miR156相对转录水平足以通过沉默增强苜蓿的抗旱能力gydF4y2BaSPL13gydF4y2Ba和增加gydF4y2BaWD40-1gydF4y2Ba而miR156高表达导致干旱易感性。gydF4y2Ba
背景gydF4y2Ba
气候变化的影响预计会导致频繁的极端天气事件,对农作物生产造成重大损害[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba]。植物通过在表型、生理和分子水平上发展不同的抗逆性机制来应对这些变化(非生物胁迫)[gydF4y2Ba3.gydF4y2Ba]。为了改善植物的反应,microrna提供了修复苜蓿性状的机会[gydF4y2Ba4gydF4y2Ba]。gydF4y2Ba
microrna是长度约为16-26个核苷酸的小rna,在转录后水平上以序列特异性的方式调节基因表达[gydF4y2Ba5gydF4y2Ba]。数以百计的microrna [gydF4y2Ba6gydF4y2Ba], microRNA156 (miR156)在植物中是高度保守的,它通过下调一组squamasa - promoter BINDING PROTEIN-LIKE (SPL)发挥作用gydF4y2Ba)gydF4y2Ba转录因子[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba]。miR156中至少有8个成员(a ~ h)gydF4y2Ba拟南芥gydF4y2Ba, g和h是这个物种独有的。在其他植物物种中发现了较少数量的miR156成员(A至f),包括gydF4y2BaMedicago truncatulagydF4y2Ba[gydF4y2Ba10gydF4y2Ba]。SPL结合域(SPL binding Domain, SBD)是指SPL结合域(SPL binding Domain, N =任意核苷酸,R = a或G),通过与NNGTACR基因启动子结合,调控影响植物发育和生理的下游基因网络[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba]。在gydF4y2Ba拟南芥,gydF4y2BamiR156调控16个基因中的10个gydF4y2BaSPLgydF4y2BaS,影响植物生长发育的各个方面[gydF4y2Ba15gydF4y2Ba],而在苜蓿中,miR156至少调控7种gydF4y2BaSPLgydF4y2Bas (gydF4y2BaSPL2, 3、4、6、9、12gydF4y2Ba和gydF4y2Ba13gydF4y2Ba) [gydF4y2Ba8gydF4y2Ba]。尽管miR156在植物物种中具有保守性,但它的一些调控输出是物种特异性的[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba16gydF4y2Ba]。我们之前的研究表明,miR156在苜蓿中的过表达延迟了开花时间,促进了根结瘤,并改善了营养和根的生长[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba13gydF4y2Ba]。这些性状中的许多都与非生物抗逆性有关[gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba]。此外,miR156d的过表达被证明可以提高苜蓿的耐热性[gydF4y2Ba19gydF4y2Ba],盐度[gydF4y2Ba20.gydF4y2Ba]和干旱胁迫[gydF4y2Ba21gydF4y2Ba]。mir156介导的沉默gydF4y2BaSPL2, SPL9gydF4y2Ba和gydF4y2BaSPL11gydF4y2Ba提高热、盐和干旱胁迫的恢复能力gydF4y2Ba拟南芥gydF4y2Ba而大米[gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba]。gydF4y2Ba拟南芥gydF4y2BamiR156表达增加的突变体沉默gydF4y2BaSPL9,gydF4y2Ba增强的表达gydF4y2BaDIHYDROFLAVONOL-4-REDUCTASEgydF4y2Ba(gydF4y2BaDFRgydF4y2Ba),gydF4y2Ba花青素色素的生产gydF4y2Ba(gydF4y2BaPAP1gydF4y2Ba),增加了花青素的积累,提高了抗逆性[gydF4y2Ba22gydF4y2Ba]。花青素和原花青素的增强受转录因子如WD40、MYB和bHLH的调控[gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba]。这些次生代谢物在植物非生物胁迫中清除自由基[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba]并与短暂应激相关的初级代谢物如脯氨酸、半乳糖醇、棉子糖和γ -氨基丁酸(GABA)协同作用,以减轻应激症状[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba29gydF4y2Ba]。gydF4y2Ba
我们最近报道,干旱胁迫通过增加叶片气体交换和脱落酸(ABA),同时减少水分损失,增强miR156的表达,从而提高苜蓿对干旱胁迫的适应能力[gydF4y2Ba21gydF4y2Ba]。尽管有这些发现,我们对miR156/SPL网络如何调节下游基因如gydF4y2BaDFRgydF4y2Ba和gydF4y2BaWD40-1gydF4y2Ba影响苜蓿抗逆性的因素尚不清楚,特别是与干旱胁迫和次生代谢有关。本研究探讨了miR156调控紫花苜蓿干旱胁迫响应的机制。为此,我们分析了miR156过表达子,gydF4y2BaSPL13gydF4y2Ba沉默基因型,gydF4y2BaWD40-1gydF4y2Baover-expressors和gydF4y2BaWD40 -gydF4y2Ba1 RNAi在代谢组学、转录组学和生理水平上沉默基因型。此外,我们还研究了SPL13与基因的结合gydF4y2BaDFRgydF4y2Ba调控类黄酮生物合成的启动子。本报告的发现将有助于理解miR156调控干旱胁迫的机制,并可作为标记辅助育种的工具来改良苜蓿和潜在的其他作物。gydF4y2Ba
结果gydF4y2Ba
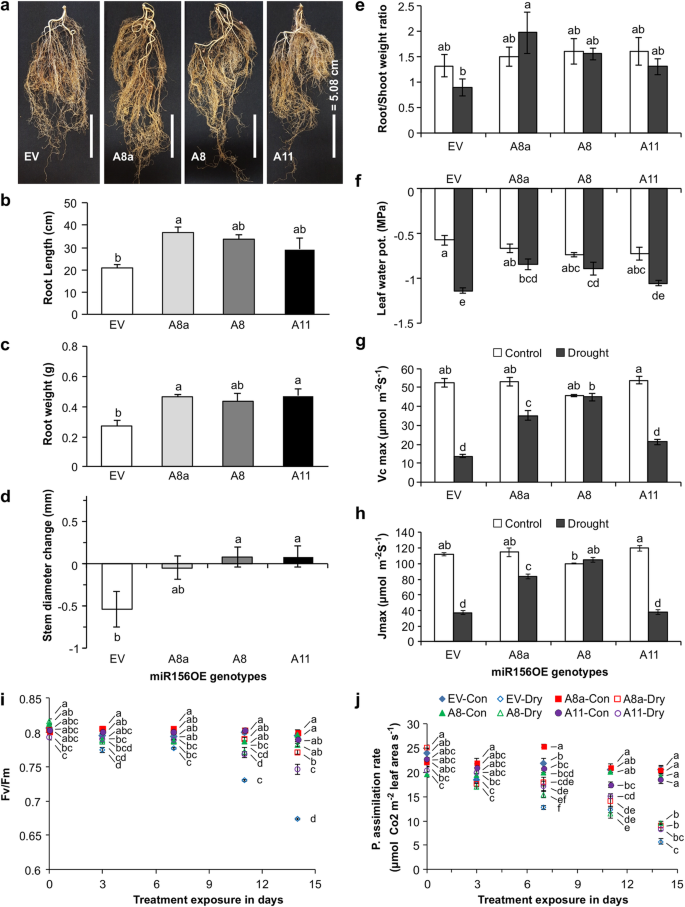
miR156表达的增强通过改变根系结构和持水能力来提高抗旱性gydF4y2Ba
为了确定miR156对干旱胁迫的调控作用,我们使用了miR156相对表达水平较低(A8a = 0.5)、中等(A8 = 1.5)和较高(A11 = 2.5)的1月龄苜蓿植株[gydF4y2Ba13gydF4y2Ba在干旱和水分充足的条件下生长。干旱胁迫对根重、根长、茎基宽和鲜根冠重比的影响随基因型的不同而不同(图2)。gydF4y2Ba1gydF4y2Ba、附加文件gydF4y2Ba2gydF4y2Ba:表S5.1)。与EV相比,A8a的根明显更长,根系生物量明显增加(图2)。gydF4y2Ba1gydF4y2Baa),根长增加了1.8倍(图2)。gydF4y2Ba1gydF4y2Bab)和根重的1.7倍(图2)。gydF4y2Ba1gydF4y2Bac). A8a根系生物量的增加是由于根系较长,而不是由于根系较短较粗(图2)。gydF4y2Ba1gydF4y2Bab, c)。为了了解改良后的根系构型是否影响植物水势,我们测量了叶片水势[gydF4y2Ba30.gydF4y2Ba]和干旱前后茎下直径的变化[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba]。MiR156OE基因型A8a和A8保持较高的叶片水势(图2)。gydF4y2Ba1gydF4y2Baf),也保持或增加了基茎直径(图2)。gydF4y2Ba1gydF4y2Bad)而电动汽车工厂在两周的压力下表现出减少。基部茎粗不变的同时,A8a和A8的根冠生物量比增加(图2)。gydF4y2Ba1gydF4y2Bae)。gydF4y2Ba
miR156过表达对紫花苜蓿抗旱性及生理反应的影响gydF4y2Ba一个gydF4y2Ba干旱胁迫下EV和miR156OE植株根系的变化gydF4y2BabgydF4y2Ba根的长度;gydF4y2BacgydF4y2Ba根重量;gydF4y2BadgydF4y2Ba干旱条件下茎基径的变化;gydF4y2BaegydF4y2Ba根冠生物量比;gydF4y2BafgydF4y2Ba叶片水势;gydF4y2BaggydF4y2BaVcmaxgydF4y2Ba, rubisco羧化酶活性最大值;gydF4y2BahgydF4y2BaJmaxgydF4y2Ba,最大光合电子传递速率;gydF4y2Ba我gydF4y2Ba暗适应叶绿素荧光,Fv/Fm,和gydF4y2BajgydF4y2Ba水分充足(对照)和干旱胁迫植物的光合同化速率。值为样本均值±SE,gydF4y2BangydF4y2Ba= 4株单株,但“gydF4y2BadgydF4y2Ba”、“gydF4y2BaegydF4y2Ba”、“gydF4y2BafgydF4y2Ba”、“gydF4y2Ba我gydF4y2Ba”、“gydF4y2BajgydF4y2Ba”,gydF4y2BangydF4y2Ba= 5。方差分析gydF4y2BapgydF4y2Ba值在附加文件中提供gydF4y2Ba2gydF4y2Ba表S5.1。Post hoc Tukey多重比较检验的显著性差异用不同字母表示。的多时间点数据中的字母gydF4y2Ba我gydF4y2Ba'和'gydF4y2BajgydF4y2Ba是单独分析的gydF4y2Ba
miR156过表达影响光合参数gydF4y2Ba
由于干旱胁迫对光合作用参数有不利影响[gydF4y2Ba34gydF4y2Ba],我们在miR156OE和EV植物中研究了这种效应。据此,测定光系统II (PS II)叶绿素荧光Fv/Fm比值。Fv/Fm受基因型、干旱暴露时间以及两者的综合影响显著gydF4y2Ba2gydF4y2Ba:表S5.1)。与未受胁迫的植株相比,MiR156OE植株在干旱后期(第11天和第14天)保持了较高的Fv/Fm比率(0.75),而EV植株在干旱14天后逐渐降低到0.69(图2)。gydF4y2Ba1gydF4y2Bai).此外,光合同化速率受基因型和干旱暴露时间的显著影响(附加文件gydF4y2Ba2gydF4y2Ba:表S5.1)。我们的数据显示,在干旱胁迫下,光合同化速率在A8中较高,在A8a中逐渐下降,在a11中进一步下降,除了第14天高于EV(图2)。gydF4y2Ba1gydF4y2Baj)。gydF4y2Ba
此外,rubisco羧化酶活性的最大速率gydF4y2BaVcmaxgydF4y2Ba在干旱胁迫下,A8a和A8植株的叶绿素含量维持在较高水平,而EV和A11植株的叶绿素含量则显著降低(64-75%)。gydF4y2Ba1gydF4y2Bag).与此相对应的是最大光合电子传递速率gydF4y2BaJmaxgydF4y2Ba在干旱胁迫下,A8a和A8的含量也保持在较高水平,而EV和A11的含量则降低了(64%)。gydF4y2Ba1gydF4y2Bah)。gydF4y2Ba
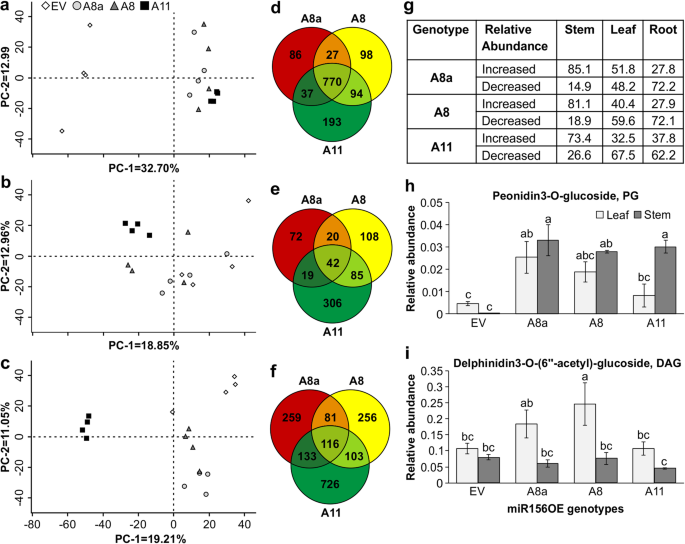
miR156OE植株在干旱条件下积累花青素等与胁迫相关的次生代谢产物gydF4y2Ba
利用4000多种代谢物特征,基于lcms的代谢物谱主成分分析(PCA)图描绘了干旱处理的EV和miR156OE茎组织之间的明显差异(图5)。gydF4y2Ba2gydF4y2Baa).这些代谢物特征是由代谢物产生的光谱数据[gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba]。主成分-1 (PC-1)贡献了32.7%的方差,明确分离了EV和miR156OE基因型,而主成分-2 (PC-2)贡献了13%的方差。gydF4y2Ba
基于lcms的代谢物谱显示了干旱胁迫下miR156OE基因型的独特特征。gydF4y2Ba一个gydF4y2Ba茎代谢物谱的主成分分析;gydF4y2BabgydF4y2Ba叶,gydF4y2BacgydF4y2Ba干旱胁迫下的根组织;gydF4y2BadgydF4y2Ba代谢特征有显著差异gydF4y2BapgydF4y2Ba在EV植株茎部组织中< 0.01;gydF4y2BaegydF4y2Ba叶,gydF4y2BafgydF4y2Ba根组织;gydF4y2BaggydF4y2Ba干旱胁迫下相对于EV显著增加(≥1.5 log 2倍变化)或显著减少(≤- 1.5 log 2倍变化)的代谢物特征比例;gydF4y2BahgydF4y2Ba芍药苷3- o -葡萄糖苷、PG和gydF4y2Ba我gydF4y2Ba飞燕草苷3-O-(6″-乙酰基)-葡萄糖苷代谢产物的相对丰度被归一化为内部标准。值为样本均值±SE,gydF4y2BangydF4y2Ba= 4株单株。方差分析p值在附加文件中提供gydF4y2Ba2gydF4y2Ba表S5。4.Post hoc Tukey多重比较检验的显著性差异用不同字母表示gydF4y2Ba
与茎组织不同(图2)。gydF4y2Ba2gydF4y2Baa),根具有不同基因型的代谢物特征谱,PC-1和PC-2的方差分别为19.21%和11.05%(图2)。gydF4y2Ba2gydF4y2Bac)。另一方面,A8a和EV的叶片代谢更接近(图2)。gydF4y2Ba2gydF4y2Bab),而miR156高表达基因A11具有不同的代谢谱,其PC-1和PC-2的方差分别为18.85%和12.96%。根据其显著性水平和相对于EV的折叠变化,干旱胁迫下miR156OE基因型茎、叶和根中共同或不同的代谢物特征数量如图所示。gydF4y2Ba2gydF4y2Ba分别是D e和f。数字gydF4y2Ba2gydF4y2Bad显示miR156OE和EV植株茎秆之间存在相对较多的代谢物差异丰度特征(770个)。与EV茎相比,大部分差异丰富的茎代谢物(A8a、A8和A11分别为85.1、81.1和73.4%)显著增加(图2)。gydF4y2Ba2gydF4y2Bag)。miR156OE和EV之间代谢物的差异特征可能与miR156OE植物茎基节间常见的色素沉着有关gydF4y2Ba2gydF4y2Ba:图S1)。gydF4y2Ba
干旱胁迫诱导活性氧(ROS)产生[gydF4y2Ba37gydF4y2Ba],植物采用几种策略,包括次级代谢物抗氧化剂来减少ROS [gydF4y2Ba38gydF4y2Ba]。在植物用作抗氧化剂的许多次生代谢物中,花青素被充分证明[gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba]。在这里,花青素如牡丹苷3-O-葡萄糖苷(PG)和飞鸽苷3-O-(6″-乙酰)-葡萄糖苷(DAG)的水平受基因型和组织的显著影响(附加文件)gydF4y2Ba2gydF4y2Ba:表S5.4)。基于lcms的代谢物分析显示,花青素和其他清除ROS的酚类代谢物主要在低至中等miR156表达物(A8a和A8)的茎中增加,尽管PG在A11中也增加(图11)。gydF4y2Ba2gydF4y2Bah、i和附加文件gydF4y2Ba2gydF4y2Ba表2)。花青素中糖部分的酰化增加了代谢物的稳定性[gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba]。这种酰化是否是A8叶片相对于A11和EV具有更高DAG水平从而提高耐旱性的一个因素还有待确定(图11)。gydF4y2Ba2gydF4y2Ba我)。gydF4y2Ba
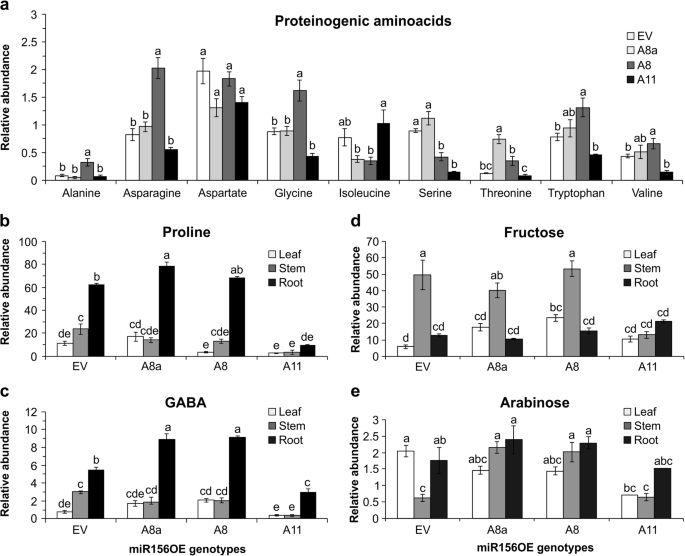
表达中等水平miR156的苜蓿植株在干旱条件下积累与胁迫相关的初级代谢物gydF4y2Ba
植物协调初级和次级代谢物进行严格的代谢物调节和逆境响应[qh]gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba43gydF4y2Ba]。因此,我们使用GCMS分析初级代谢物,以确定它们在干旱胁迫下的水平。结果表明,代谢物水平受组织和基因型的控制gydF4y2Ba2gydF4y2Ba:表S5.5)。总的来说,中等miR156OE植物叶片组织中蛋白质原氨基酸的相对丰度较高,而高表达A11的植物叶片组织中蛋白质原氨基酸的相对丰度较低(图2)。gydF4y2Ba3.gydF4y2Ba和附加文件gydF4y2Ba2gydF4y2Ba表S3)。除缬氨酸在茎、根和叶组织中无显著差异外,蛋白质氨基酸水平受组织类型以及基因型和组织组合的显著影响(另附文件)gydF4y2Ba2gydF4y2Ba:表S5.5)。A8叶片中丙氨酸、天冬酰胺、甘氨酸和色氨酸的丰度相对较高(图8)。gydF4y2Ba3.gydF4y2Baa).有趣的是,脯氨酸作为渗透物维持植物水势[gydF4y2Ba26gydF4y2Ba],在A8a的根组织中含量显著增加,与A8相当,但在A11的叶、茎和根组织中含量与EV相比有所降低(图2)。gydF4y2Ba3.gydF4y2Bab)。gydF4y2Ba
基于gcms的初级代谢物分析证明了miR156的抗旱策略。gydF4y2Ba一个gydF4y2Ba干旱胁迫下叶片组织中蛋白质生成氨基酸的相对水平:丙氨酸、天冬氨酸、天冬氨酸、甘氨酸、异亮氨酸、丝氨酸、苏氨酸、色氨酸和缬氨酸;gydF4y2BabgydF4y2Baγ-氨基丁酸(GABA)代谢物在脯氨酸叶片、茎和根组织中分流的相对水平gydF4y2BacgydF4y2Ba伽马氨基丁酸;gydF4y2BadgydF4y2Ba叶,茎和根组织中果糖的相对含量gydF4y2BaegydF4y2Ba干旱胁迫下的阿拉伯糖。值为样本均值±SE,gydF4y2BangydF4y2Ba= 4株单株。方差分析p值在附加文件中提供gydF4y2Ba2gydF4y2Ba表S5.5。Post hoc Tukey多重比较检验的显著性差异用不同字母表示gydF4y2Ba
γ -氨基丁酸(GABA)的水平,GABA是一种应激反应代谢物,在TCA循环中调节谷氨酸和琥珀酸之间的碳氮平衡[gydF4y2Ba29gydF4y2Ba],在A8和A8a根组织中表达增强(图2)。gydF4y2Ba3.gydF4y2Bac)。另一方面,与EV相比,miR156过表达量较高的A11降低了所有组织中的GABA水平(图2)。gydF4y2Ba3.gydF4y2Bac)。gydF4y2Ba
果糖是下游代谢物碳骨架的主要糖源之一和能量来源,在A8的叶片组织中观察到果糖水平增加,而在茎和根中其水平不变(图2)。gydF4y2Ba3.gydF4y2Bad)。另一方面,A11含有不同水平的果糖(图2)。gydF4y2Ba3.gydF4y2BaD),在茎中水平降低,但在根中相似。gydF4y2Ba
糖的碳源转化为下游途径,包括糖酵解和戊糖磷酸途径(PPP)在逆境响应和耐受性中非常重要[gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba]。阿拉伯糖是细胞壁多糖PPP的重要成分,也是糖蛋白和阿拉伯半乳聚糖蛋白的主要成分,与EV相比,A8a和A8的叶片和根中阿拉伯糖的含量增加,而A11的根中阿拉伯糖的含量减少(图11)。gydF4y2Ba3.gydF4y2Bae和附加文件gydF4y2Ba2gydF4y2Ba:表S5.5)。使用GCMS分析的带注释的代谢物的完整列表在附加文件中提出gydF4y2Ba2gydF4y2Ba:表S3。gydF4y2Ba
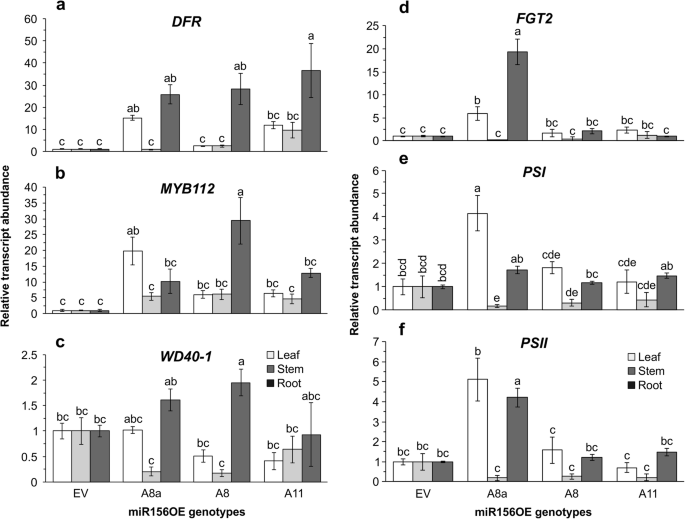
miR156过表达影响光合作用和类黄酮基因的表达gydF4y2Ba
我们的生理和代谢物分析显示,低至中等水平过表达miR156 (A8a和A8)的苜蓿植株具有较高的花青素水平(图8)。gydF4y2Ba2gydF4y2Bah,i),在干旱胁迫下保持较高的光合效率(图2)。gydF4y2Ba1gydF4y2Bag-k)。因此,我们通过确定参与类黄酮和光合途径的基因的相对转录水平,研究了这些是否在分子水平上受到调节。基因型、组织及其相互作用对黄酮类生物合成转录物水平有显著影响gydF4y2BaDFRgydF4y2Ba和gydF4y2BaMYB112gydF4y2Ba基因,尽管gydF4y2BaMYB112gydF4y2Ba组织间差异不大(附加文件)gydF4y2Ba2gydF4y2Ba:表S5.6)。因此,较高的转录水平gydF4y2BaDFRgydF4y2Ba和gydF4y2BaMYB112gydF4y2Ba至少在一些miR156OE植物的茎和叶组织中观察到。gydF4y2Ba
DFRgydF4y2Ba,gydF4y2Ba它催化二氢黄酮醇转化为白花青素,在miR156OE叶组织中的转录量比EV高2至15倍(图2)。gydF4y2Ba4gydF4y2Ba一个)。gydF4y2BaDFRgydF4y2BamiR156OE根样品的转录量也高出25 ~ 35倍。gydF4y2BaMYB112gydF4y2Ba编码一种调节类黄酮生物合成的转录因子[gydF4y2Ba46gydF4y2Ba]。与EV相比,miR156OE叶片组织中其转录水平高出5至19倍,而在miR156OE茎组织中,无论基因型如何,其表达水平都高出4倍(图2)。gydF4y2Ba4gydF4y2Bab).的表达水平略有增加gydF4y2BaWD40-1gydF4y2Ba在A8根组织中观察到苯丙素途径的转录因子(1.9倍),而在茎和叶组织中则减少(图2)。gydF4y2Ba4gydF4y2Ba此外,c)。gydF4y2Ba类黄酮GLUCOSYLTRANSFERASE2gydF4y2Ba(gydF4y2BaFGT2gydF4y2Ba)催化糖基转移到类黄酮上,在A8a叶片中显著增加了6倍,而在根中观察到19倍的增加(图2)。gydF4y2Ba4gydF4y2Bad)。gydF4y2Ba
干旱胁迫下苯丙素途径和光系统中选定基因的差异转录水平。gydF4y2Ba一个gydF4y2Ba基于qRT-PCR的植物叶片、茎和根组织转录物水平分析gydF4y2BaDIHYDROFLAVONOL-4-REDUCTASE, DFRgydF4y2Ba;gydF4y2BabgydF4y2BaMYB112gydF4y2Ba;gydF4y2BacgydF4y2BaWD40-1gydF4y2Ba;gydF4y2BadgydF4y2Ba类黄酮糖基转移酶2,fgt2gydF4y2Ba;gydF4y2BaegydF4y2Ba光系统I p700叶绿素A载脂蛋白APS IgydF4y2Ba,gydF4y2BaψgydF4y2Ba;gydF4y2BafgydF4y2Ba光系统II Q(b)gydF4y2Ba,gydF4y2BaPSIIgydF4y2Ba,gydF4y2BangydF4y2Ba= 4株,数值为样本均值±SE。转录物丰度相对于空载体归一化后的乙酰辅酶a羧化酶,gydF4y2BaACC1gydF4y2Ba,gydF4y2Ba肌动蛋白gydF4y2Ba管家基因。方差分析p值在附加文件中提供gydF4y2Ba2gydF4y2Ba表S5.6。Post hoc Tukey多重比较检验的显著性差异用不同字母表示gydF4y2Ba
光合作用效率相关gydF4y2Ba光系统I p700叶绿素A载脂蛋白APS IgydF4y2Ba(gydF4y2BaψgydF4y2Ba),gydF4y2Ba光系统II Q(b)gydF4y2Ba(gydF4y2BaPSIIgydF4y2Ba)转录水平受基因型和组织型的影响(附加文件gydF4y2Ba2gydF4y2Ba:表S5.6)。gydF4y2BaψgydF4y2Ba和gydF4y2BaPSIIgydF4y2BaA8a叶片和根部的转录本分别高出5倍和4倍(图2)。gydF4y2Ba4gydF4y2Bae, f)。另一方面,这两个基因在miR156OE植株的茎中显著减少(图2)。gydF4y2Ba4gydF4y2Bae, f). miR156OE植株茎基部节间有色素沉着,与花青素积累增强一致,这干扰了典型的绿色叶绿素着色(附加文件)gydF4y2Ba2gydF4y2Ba:图S1) [gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba]。gydF4y2Ba
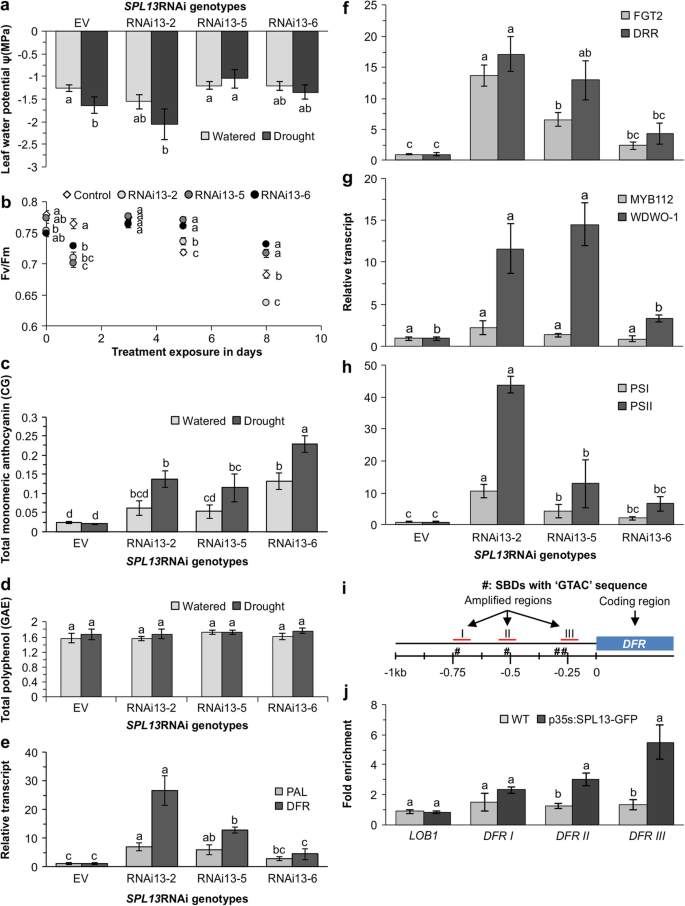
SPL13调控干旱胁迫下紫花苜蓿生理反应和花青素积累gydF4y2Ba
因为miR156在紫花苜蓿中下调起作用gydF4y2BaSPLgydF4y2Ba基因,包括gydF4y2BaSPL13gydF4y2Ba[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba13gydF4y2Ba],我们研究了干旱对rnai沉默的苜蓿植株生理和表型参数的影响gydF4y2BaSPL13。gydF4y2Ba我们以前报道过绿色,正常的表型伴随着根发育的增强gydF4y2BaSPL13gydF4y2Ba干旱条件下RNAi基因型[gydF4y2Ba21gydF4y2Ba]。在本研究中,干旱胁迫下叶片水势受基因型影响显著(附加文件)gydF4y2Ba2gydF4y2Ba:表S5.2)。与此相一致,gydF4y2BaSPL13gydF4y2BaRNAi-5和gydF4y2BaSPL13gydF4y2BaRNAi-6植物在干旱胁迫下保持较高的正午叶片水势(图2)。gydF4y2Ba5gydF4y2Baa).光合效率参数表明gydF4y2BaSPL13gydF4y2BaRNAi-5和gydF4y2BaSPL13gydF4y2BaRNAi-6与中度gydF4y2BaSPL13gydF4y2Ba沉默(gydF4y2Ba21gydF4y2Ba]保持了较高的Fv/Fm比值0.74(图2)。gydF4y2Ba5gydF4y2BaB)干旱胁迫8天后。Fv/Fm水平受基因型、干旱暴露时间长短以及两者综合的显著影响gydF4y2Ba2gydF4y2Ba:表S5.2)。作为一种抗逆性策略,植物利用花青素等类黄酮清除ROS,在我们的研究中我们观察到gydF4y2BaSPL13gydF4y2Ba在水分充足的条件下,RNAi-6植株的基础单体花青素水平显著提高(图2)。gydF4y2Ba5gydF4y2Bac)gydF4y2BaSPL13gydF4y2BaRNAi基因型在干旱胁迫期间积累了更高水平的总单体花青素,而EV中的水平没有变化(图2)。gydF4y2Ba5gydF4y2Bac)。无论植物是在水分充足还是干旱的条件下,所有基因型都保持了相当的总多酚含量(图2)。gydF4y2Ba5gydF4y2Bad)。gydF4y2Ba
SPL13沉默通过协调代谢物、转录和生理调节来调节干旱。gydF4y2Ba一个gydF4y2Ba叶片水势gydF4y2BaSPL13gydF4y2BaRNAi和EV植物;gydF4y2BabgydF4y2Ba干旱胁迫下暗适应叶绿素荧光(Fv/Fm);gydF4y2BacgydF4y2Ba总单体花青素表达为花青素-o-葡萄糖苷当量(CG);和gydF4y2BadgydF4y2Ba总多酚含量以没食子酸当量(GAE)表示;gydF4y2BaegydF4y2Ba转录水平gydF4y2Ba苯丙氨酸AMMONIA-LYASEgydF4y2Ba,gydF4y2Ba朋友gydF4y2Ba,gydF4y2BaDIHYDROFLAVONOL-4-REDUCTASEgydF4y2Ba,gydF4y2BaDFRgydF4y2Ba;gydF4y2BafgydF4y2Ba类黄酮GLUCOSYLTRANSFERASE2gydF4y2Ba, FGT2,和gydF4y2Ba脱水反应性rd -22样gydF4y2Ba,gydF4y2BaDRRgydF4y2Ba;gydF4y2BaggydF4y2BaMYB112gydF4y2Ba和gydF4y2BaWD40-1gydF4y2Ba茎中苯丙素途径的转录因子基因gydF4y2BaSPL13gydF4y2BaRNAi和EV基因型;gydF4y2BahgydF4y2Ba转录水平gydF4y2Ba光系统I p700叶绿素A载脂蛋白APS I, PSIgydF4y2Ba,gydF4y2Ba光系统II Q(b), PSIIgydF4y2Ba在干旱胁迫下;gydF4y2Ba我gydF4y2Ba的启动子区域潜在的SPL13结合位点示意图gydF4y2BaDFRgydF4y2Ba,gydF4y2BajgydF4y2Ba基于ChIP-qPCR的p35S:SPL13- gfp和WT植株SPL13的折叠富集分析,其中n = 3个单株gydF4y2Ba侧边器官边界-1,lob1,gydF4y2Ba作为阴性对照。数值为平均值±SE,浅灰色柱状图gydF4y2Ba一个gydF4y2Ba”、“gydF4y2BacgydF4y2Ba'和'gydF4y2BadgydF4y2Ba'表示水分充足条件下的值,深灰色条表示干旱条件下的值。的相对转录水平gydF4y2BaegydF4y2Ba”、“gydF4y2Baf”、“g”gydF4y2Ba和“gydF4y2Bah”gydF4y2Ba在归一化为乙酰辅酶a羧化酶后,gydF4y2BaACC1gydF4y2Ba,gydF4y2Ba肌动蛋白gydF4y2Ba管家基因。方差分析p值在附加文件中提供gydF4y2Ba2gydF4y2Ba表S5.2、S5.7和S5.8。Post hoc Tukey多重比较检验的显著性差异用不同字母表示。的多时间点数据中的字母gydF4y2BabgydF4y2Ba是单独分析的gydF4y2Ba
黄酮类和光合作用相关基因在黄酮类和光合作用相关基因中增强gydF4y2BaSPL13gydF4y2Ba沉默的植物gydF4y2Ba
为了了解干旱胁迫下总单体花青素水平的增加和光合效率的维持是否在转录水平上受到调控,我们分析了花青素相关基因和脱水反应基因的表达水平。我们的研究结果表明,在干旱和对照条件下,基因型之间存在显著差异(图2)。gydF4y2Ba5gydF4y2Bae-h和附加文件gydF4y2Ba2gydF4y2Ba:表S5.7)。不出所料,成绩单水平为gydF4y2Ba苯丙氨酸AMMONIA-LYASEgydF4y2Ba,gydF4y2Ba朋友,gydF4y2Ba在三分之二的苯丙素途径中,第一个承诺的步骤明显更高gydF4y2BaSPL13gydF4y2BaRNAi基因型(图2)gydF4y2Ba5gydF4y2Bae)。同样的,gydF4y2BaDFRgydF4y2Ba和gydF4y2BaFGT2gydF4y2Ba三分之二的得分也更高gydF4y2BaSPL13gydF4y2BaRNAi基因型(图2)gydF4y2Ba5gydF4y2Bae、f)。这些持续高水平的gydF4y2Ba朋友gydF4y2Ba,gydF4y2BaDFRgydF4y2Ba和gydF4y2BaFGT2gydF4y2Ba转录本表明,干旱胁迫诱导黄酮类化合物的生物合成是由gydF4y2BaSPL13gydF4y2Ba。此外,gydF4y2Ba脱水反应性rd -22样gydF4y2Ba(gydF4y2BaDRRgydF4y2Ba)基因,受MYB和MYC转录因子调控,受干旱和ABA诱导[gydF4y2Ba50gydF4y2Ba,gydF4y2Ba51gydF4y2Ba],其表达量也高出4至17倍gydF4y2BaSPL13gydF4y2BaRNAi植物(图2)gydF4y2Ba5gydF4y2Baf).与之相对应的转录因子gydF4y2BaWD40-1gydF4y2Ba增加了3到14倍gydF4y2BaSPL13RNAigydF4y2Ba干旱胁迫下的植物(图2)gydF4y2Ba5gydF4y2Bag).对于光合作用相关基因,我们分析了gydF4y2BaψgydF4y2Ba和gydF4y2BaPSIIgydF4y2Ba结果发现,基因表达水平分别增加了2 - 10倍和6 - 43倍gydF4y2BaSPL13gydF4y2Ba相对于EV的RNAi植物(图2)gydF4y2Ba5gydF4y2Bah),与A8a和A8基因型的结果一致(图2)。gydF4y2Ba4gydF4y2Bae、f)。gydF4y2Ba
SPL13是一个直接调节因子gydF4y2BaDFRgydF4y2Ba
miR156调控gydF4y2BaSPLgydF4y2Ba年代包括gydF4y2BaSPL13gydF4y2Ba在紫花苜蓿[gydF4y2Ba8gydF4y2Ba]。考虑到gydF4y2BaDFRgydF4y2Ba在启动子区域有4个假定的SBD结合基序与核心GTAC序列(图2)。gydF4y2Ba5gydF4y2Bai和附加文件gydF4y2Ba2gydF4y2Ba(图S3),我们研究了SPL13在的启动子区域的占用gydF4y2BaDFRgydF4y2Ba在p35S:SPL13-GFP植物中使用ChIP-qPCR。转基因(p35S:SPL13-GFP)苜蓿植株是我们课题组前期开发的[gydF4y2Ba52gydF4y2Ba]。我们选择了三个区域(I, II和III),保守的SBD核心序列分别位于翻译起始密码子上游750,544和260 bpgydF4y2BaDFRgydF4y2Ba作为潜在的SPL13结合位点,我们测试了它们的SPL13占用率。gydF4y2Ba侧边器官边界-如1gydF4y2Ba,gydF4y2BaLOB1,gydF4y2Ba作为ChIP-qPCR的阴性对照,因为SPL13与该基因的结合能力较低,尽管存在假定的SBD序列[gydF4y2Ba52gydF4y2Ba]。与WT相比,p35S:SPL13- gfp植株的SPL13与基因的结合显著增加gydF4y2BaDFRgydF4y2Ba启动子区域(图2)gydF4y2Ba5gydF4y2Baj和附加文件gydF4y2Ba2gydF4y2Ba:表S5.8)。SPL13优先结合到两个最下游的假定SBD区域(II和III)gydF4y2BaDFRgydF4y2Ba而I区启动子未表现出强结合(图2)。gydF4y2Ba5gydF4y2Bai, j和附加文件gydF4y2Ba2gydF4y2Ba:图S3)。在这三个区域中,区III与SPL13的结合最强。gydF4y2Ba5gydF4y2Bai, j),表明SPL13可以直接结合到gydF4y2BaDFRgydF4y2Ba调节其表达gydF4y2Ba
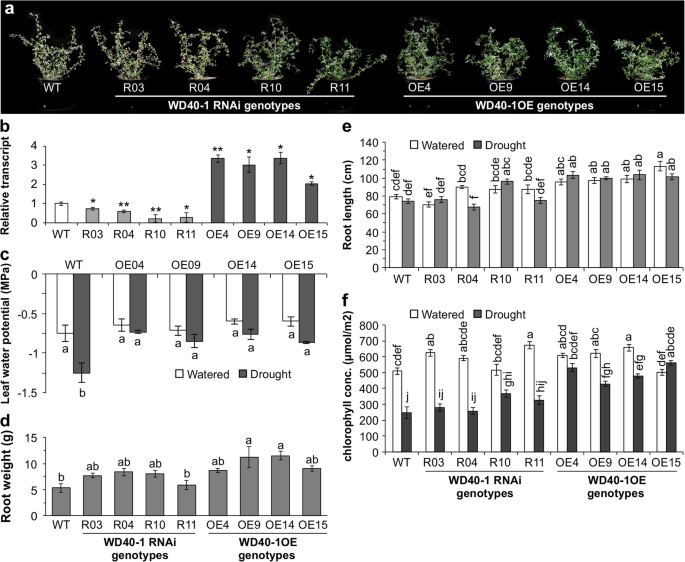
WD40-1正调控gydF4y2BaDFRgydF4y2Ba表达与耐旱性gydF4y2Ba
的表达量较高gydF4y2BaWD40-1gydF4y2Ba干旱胁迫下miR156OE基因型的类黄酮积累和WD40-1参与苯丙素途径的文献发现[j]。gydF4y2Ba53gydF4y2Ba],我们的目的是研究miR156或SPL13是否直接调控gydF4y2BaWD40-1gydF4y2Ba。因此,我们研究了保守的SPL结合(SBD)基序在的启动子区域的存在gydF4y2BaWD40-1gydF4y2Ba。我们使用基因组行走(GenomeWalker克隆技术实验室,Inc.)获得gydF4y2BaWD40-1gydF4y2Ba。然而,我们既没有找到miR156的靶序列,也没有找到SBD基序,因此得出了间接调控的结论gydF4y2BaWD40-1gydF4y2Ba通过miR156或SPL13(附加文件gydF4y2Ba2gydF4y2Ba:图S4)。gydF4y2Ba
为了进一步了解WD40-1在紫花苜蓿抗旱性中的潜在作用,我们培育了具有过表达(OE)或沉默(RNAi)基因的植株。gydF4y2BaWD40-1gydF4y2Ba将这些植物暴露在干旱压力下。我们使用了四种不同的WD40-1OE事件源植物(OE04, OE09, OE14和OE15)和gydF4y2BaWD40-1gydF4y2BaRNAi (RNAi03, RNAi04, RNAi10和RNAi11)与WT植物的比较(图2)。gydF4y2Ba6gydF4y2Baa、b)。gydF4y2BaWD40-1gydF4y2Ba当RNAi沉默时,过表达基因型具有耐旱性gydF4y2BaWD40-1gydF4y2Ba基因型对干旱胁迫敏感(图2)。gydF4y2Ba6gydF4y2Baa、附加文件gydF4y2Ba2gydF4y2Ba:表S5.3)。研究了干旱胁迫和水分充足条件下植物根系发育、叶绿素浓度和叶片水势等表型和生理反应。gydF4y2Ba
WD40-1提高紫花苜蓿抗旱性。gydF4y2Ba一个gydF4y2BaWT的地上表型,4gydF4y2BaWD40-1RgydF4y2Ba干旱胁迫下NAi和4个WD40-1OE基因型;gydF4y2BabgydF4y2Ba转录水平gydF4y2BaWD40-1gydF4y2Ba在WT,gydF4y2BaWD40-1gydF4y2Ba研究使用的RNAi WD40-1OE基因型;gydF4y2BacgydF4y2Ba丰水和干旱胁迫条件下WT和WD40-1OE基因型叶片水势;gydF4y2BadgydF4y2Ba干旱胁迫下WT的根重;gydF4y2BaWD40-1gydF4y2BaRNAi和WD40-1OE植物;gydF4y2BaegydF4y2Ba水分充足和干旱胁迫下WT的根长;gydF4y2BaWD40-1gydF4y2BaRNAi和WD40-1OE植物;和gydF4y2BafgydF4y2Ba水分充足和干旱胁迫下WT的叶绿素浓度;gydF4y2BaWD40-1gydF4y2BaRNAi和WD40-1OE植物。值为平均值±SE;gydF4y2BangydF4y2Ba= 4株gydF4y2BabgydF4y2Ba“to”gydF4y2BaegydF4y2Ba虽然gydF4y2BangydF4y2Ba= 20 in 'gydF4y2BafgydF4y2Ba”。方差分析p值在附加文件中提供gydF4y2Ba2gydF4y2Ba表S5.3。Post hoc Tukey多重比较检验的显著性差异用不同字母表示gydF4y2Ba
WD40-1OE基因型在干旱胁迫下保持较高的叶片水势(图2)。gydF4y2Ba6gydF4y2Bac)相对于WT和gydF4y2BaWD40-1gydF4y2BaRNAi基因型(数据未显示)。WD40-1OE基因型的根更长,根重也相应增加。gydF4y2Ba6gydF4y2Bad, e,附加文件gydF4y2Ba2gydF4y2Ba:表S5.3)。此外,WD40-1OE基因型在干旱胁迫下也保持了较高的叶片叶绿素浓度(图2)。gydF4y2Ba6gydF4y2Baf、附加文件gydF4y2Ba2gydF4y2Ba:表S5.3)。gydF4y2Ba
了解WD40-1在干旱胁迫调控中的作用gydF4y2BaDFRgydF4y2Ba以及苯丙素/类黄酮途径中的其他基因[gydF4y2Ba24gydF4y2Ba],我们在干旱和水分充足的条件下测量了苯丙素相关基因的转录水平gydF4y2BaWD40-1gydF4y2Ba沉默和过表达基因型。因此,增加gydF4y2BaWD40-1gydF4y2Ba表达增强gydF4y2BaDFRgydF4y2Ba,gydF4y2Ba朋友gydF4y2Ba和gydF4y2BaFGT2gydF4y2Ba在干旱胁迫下,植物在水分充足的条件下,转录本的水平与WT相似(图2)。gydF4y2Ba7gydF4y2Baa, b, c,附加文件gydF4y2Ba2gydF4y2Ba:表S5.8)。此外,aba相关的脱水反应基因,gydF4y2BaDRRgydF4y2Ba以及光合作用相关基因,gydF4y2BaψgydF4y2Ba和gydF4y2BaPSIIgydF4y2Ba,在WD40-1OE基因型中与gydF4y2BaWD40-1gydF4y2BaRNAi和WT植物(图2)gydF4y2Ba7gydF4y2Bad, e, f,附加文件gydF4y2Ba2gydF4y2Ba:表S5.8)。gydF4y2Ba
WD40-1gydF4y2Ba干旱胁迫下调节苯丙素途径和光系统基因转录水平。gydF4y2Ba一个gydF4y2Ba转录水平gydF4y2Ba苯丙氨酸AMMONIA-LYASEgydF4y2Ba,gydF4y2Ba朋友gydF4y2Ba;gydF4y2BabgydF4y2BaDIHYDROFLAVONOL-4-REDUCTASEgydF4y2Ba,gydF4y2BaDFRgydF4y2Ba;gydF4y2BacgydF4y2Ba类黄酮GLUCOSYLTRANSFERASE2gydF4y2Ba,gydF4y2BaFGT2gydF4y2Ba;gydF4y2BadgydF4y2Ba脱水反应性rd -22样gydF4y2Ba,gydF4y2BaDRRgydF4y2Ba;gydF4y2Ba(e)gydF4y2Ba光系统I p700叶绿素A载脂蛋白APS I, PSIgydF4y2Ba;gydF4y2BafgydF4y2Ba光系统II Q(b), PSIIgydF4y2Ba。转录物水平显示了在归一化为乙酰辅酶a羧化酶后相对于EV的水平。gydF4y2BaACC1gydF4y2Ba,gydF4y2Ba肌动蛋白gydF4y2Ba管家。数值为平均值±SE, n = 4株植物,方差分析p值在附加文件中提供gydF4y2Ba2gydF4y2Ba表S5.9;gydF4y2BaggydF4y2Ba基于mir156的苜蓿抗旱能力模型系统示意图gydF4y2Ba。gydF4y2Ba实线表示实验证实的机制,虚线表示假设的功能。箭头表示正调节,线头表示负调节。Post hoc Tukey多重比较检验的显著性差异用不同字母表示gydF4y2Ba
讨论gydF4y2Ba
干旱是影响植物生长发育的主要因素之一[gydF4y2Ba54gydF4y2Ba]。植物对干旱的反应是表现出有害的影响,或通过参与包括各种分子、生化和生理策略的适应性反应[gydF4y2Ba55gydF4y2Ba,gydF4y2Ba56gydF4y2Ba,gydF4y2Ba57gydF4y2Ba]。在本研究中,我们使用了miR156OE,gydF4y2BaWD40-1gydF4y2BaOE,gydF4y2BaWD40-1gydF4y2BaRNAi,gydF4y2BaSPL13gydF4y2Ba利用RNAi和gfp标记SPL13基因型研究miR156调控苜蓿干旱胁迫的分子和生理策略。gydF4y2Ba
中度miR156过表达;gydF4y2BaWD40-1gydF4y2Ba超表达或gydF4y2BaSPL13gydF4y2Ba沉默足以诱导苜蓿的表型和生理抗旱策略gydF4y2Ba
在对土壤水分亏缺作出反应的不同植物器官中,根是首先遇到根际变化的。模式植物的研究结果表明,耐旱基因型的侧根萌发和伸长可以提高水分吸收[gydF4y2Ba58gydF4y2Ba,gydF4y2Ba59gydF4y2Ba]。在本研究中,我们观察到适度过表达miR156 (A8a和A8)和miR156的植物的根长显著增加,同时根生物量增加gydF4y2BaWD40-1gydF4y2Ba。据报道,这与ABA水平的提高有关[gydF4y2Ba21gydF4y2Ba干旱胁迫下miR156过表达基因型的变化。ABA通过调节gydF4y2Ba侧根器官缺损gydF4y2Ba(gydF4y2BaLATDgydF4y2Ba基因[gydF4y2Ba60gydF4y2Ba]。此外,miR156通过沉默促进根的发育gydF4y2BaAtSPL10gydF4y2Ba减少:减少…的表达gydF4y2BaAGAMOUS-LIKE MADS盒子蛋白gydF4y2Ba(gydF4y2BaAGL79)gydF4y2Ba在拟南芥中[gydF4y2Ba61gydF4y2Ba]。因此,干旱胁迫下根系发育的增强有助于苜蓿植株更好地从土壤深层取水。这一发现与我们之前的报道一致,即miR156OE和miR156OE的根长度增加gydF4y2BaSPL13gydF4y2Ba干旱条件下RNAi基因型[gydF4y2Ba21gydF4y2Ba]。此外,中等miR156OE,gydF4y2BaSPL13gydF4y2BaRNAi和WD40-1OE基因型在干旱条件下具有较高的叶片水势。miR156OE (A8a和A8)、WD40-1OE和gydF4y2BaSPL13gydF4y2BaRNAi基因型表明,该性状至少部分受SPL13负调控,而受miR156和miR156正调控gydF4y2BaWD40-1gydF4y2Ba。gydF4y2Ba
干旱胁迫对苜蓿和其他植物光合作用的负面影响[j]。gydF4y2Ba34gydF4y2Ba,gydF4y2Ba62gydF4y2Ba]。在众多光合效率参数中,Fv/Fm反映了PSII光化学在黑暗适应状态下可能达到的最大量子效率,被认为是植物良好的胁迫指示因子[j]。gydF4y2Ba63gydF4y2Ba,gydF4y2Ba64gydF4y2Ba,gydF4y2Ba65gydF4y2Ba,gydF4y2Ba66gydF4y2Ba,gydF4y2Ba67gydF4y2Ba]。因此,保持较高的Fv/Fm是选择番茄和小麦非生物抗逆性品种的参数之一[gydF4y2Ba64gydF4y2Ba,gydF4y2Ba68gydF4y2Ba,gydF4y2Ba69gydF4y2Ba]。本研究中观察到的A8a和A8基因型的Fv/Fm较高,表明它们的叶片可能具有功能性光合单位,这与干旱条件下观察到的光合同化率保持一致。观察到的更高gydF4y2BaVcmaxgydF4y2Ba(Rubisco羧化酶活性)gydF4y2BaJmaxgydF4y2Ba(电子传递速率)进一步说明干旱胁迫下A8a和A8的光系统维持能力。这种生理调节在A11植株中较低甚至不存在,表现出对干旱胁迫的敏感性。我们还观察到在gydF4y2BaSPL13gydF4y2BaRNAi-5和gydF4y2BaSPL13gydF4y2BaRNAi-6,这与我们之前报道的干旱处理下光合同化率增加的发现一致gydF4y2BaSPL13gydF4y2BaRNAi基因型[gydF4y2Ba21gydF4y2Ba]。这表明维持较高的光合同化速率,gydF4y2BaVcmaxgydF4y2Ba,gydF4y2BaJmaxgydF4y2BamiR156OE和WD40-1OE基因型在干旱胁迫下的高Fv/Fm比值可能至少部分受到SPL13和SPL13的调控gydF4y2BaWD40-1gydF4y2Ba。gydF4y2Ba
miR156过表达增强应激相关代谢物的积累gydF4y2Ba
环境扰动对植物代谢的影响因植物种类、栽培品种和所考虑的组织而异[gydF4y2Ba70gydF4y2Ba]。不同组织中特定次生代谢物和瞬时初级代谢物(初级代谢物是次生代谢物的直接前体)的积累在一定程度上被用来缓解干旱胁迫[gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba71gydF4y2Ba,gydF4y2Ba72gydF4y2Ba]。Naya等。[gydF4y2Ba73gydF4y2Ba表明碳代谢和氧化损伤对中高干旱胁迫下紫花苜蓿氮酶活性降低的作用。其他研究gydF4y2Bam . truncatulagydF4y2Ba的研究表明,干旱胁迫下的共生固氮减少,导致氮基代谢物水平降低[gydF4y2Ba74gydF4y2Ba]。gydF4y2Ba
在我们的研究中,miR156表达适度增强的苜蓿引起花青素、黄酮醇和蛋白质生成氨基酸在叶片和茎组织中的积累。这些代谢物的积累可能有助于植物清除干旱胁迫下产生的活性氧[gydF4y2Ba40gydF4y2Ba]。此外,这些代谢物可以帮助植物减少水分流失,并通过降低根组织的渗透平衡进一步吸收土壤中剩余的紧密结合水。在A8a和A8的叶片、茎和根组织中,高水平的GABA通过绕开TCA循环的脱羧部分的GABA分流维持碳氮平衡[gydF4y2Ba29gydF4y2Ba]。GABA在介导非生物胁迫中的重要性已经在各种植物物种中得到了很好的证明,包括gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba75gydF4y2Ba],黑胡椒[gydF4y2Ba76gydF4y2Ba]和弯草[gydF4y2Ba77gydF4y2Ba]。脯氨酸在A8a和A8中也有增加,但在A11根中没有增加,以调节渗透稳态[gydF4y2Ba21gydF4y2Ba,gydF4y2Ba26gydF4y2Ba]。miR156高表达基因A11的根部脯氨酸含量相对较低,这可能阻止了这些植物在其系统中保持较高的水分水平(图2)。gydF4y2Ba1gydF4y2Bag).干旱处理的中度miR156表达者叶片和茎组织中较高水平的果糖和阿拉伯糖分别可以提供能量来源和/或渗透物。较高的糖水平表明光合作用的积极作用,有可能补充下游代谢物的碳源。这与之前的一项发现一致,即干旱胁迫下的苜蓿植物会积累糖分[gydF4y2Ba78gydF4y2Ba]。此外,增加的总单体花青素和相当的总多酚水平gydF4y2BaSPL13gydF4y2BaRNAi基因型表明,在干旱胁迫下,黄酮类化合物的靶向增强至少部分由沉默苜蓿SPL13来清除ROS控制。gydF4y2Ba
miR156、WD40-1和SPL13在干旱条件下调控苯丙素和光系统基因gydF4y2Ba
由于多酚在应激反应中发挥着各种作用,人们已经努力提高其在许多植物中的含量,包括苜蓿[gydF4y2Ba79gydF4y2Ba]。紫花苜蓿中黄酮类和原花青素(PA)积累的增加对动物饲料质量具有重要意义,因为适量的PA可以减少反刍动物的腹胀[gydF4y2Ba80gydF4y2Ba,gydF4y2Ba81gydF4y2Ba,gydF4y2Ba82gydF4y2Ba]。在我们的研究中,我们发现在中度过表达miR156的紫花苜蓿植物中,苯丙素途径相关基因增强,这与这些植物花青素和黄酮醇水平的增加是一致的。gydF4y2BaDFR, WD40-1gydF4y2Ba和gydF4y2BaMYB112gydF4y2Ba干旱时A8a和A8含量较高,有利于花青素积累。同样的,gydF4y2BaSPL13gydF4y2BaRNAi基因型显示gydF4y2BaDFR, FGT2gydF4y2Ba和gydF4y2Ba朋友gydF4y2Ba转录本与总单体花青素水平升高相关,表明苯丙素/类黄酮途径增强。在另一项研究中,gydF4y2Ba拟南芥gydF4y2Ba过表达miR156的植物在盐和甘露醇(模拟干旱)处理下积累花青素的数量增加gydF4y2BaDFRgydF4y2Ba表达式[gydF4y2Ba23gydF4y2Ba]。增强的gydF4y2BaDFRgydF4y2Ba表达水平gydF4y2Ba拟南芥gydF4y2Ba是通过沉默来控制的吗gydF4y2BaSPL9gydF4y2Ba[gydF4y2Ba23gydF4y2Ba]。我们的研究结果表明,花青素和其他多酚类物质的积累可能通过SPL13调控。而且,水平的提高gydF4y2BaDFRgydF4y2Ba在WD40-1OE工厂和减少gydF4y2BaWD40-1gydF4y2BaRNAi植物表明gydF4y2BaDFRgydF4y2Ba受到WD40-1的正调控,促进类黄酮的生物合成,但这种调控的机制仍有待研究。gydF4y2Ba
探讨干旱胁迫下植物的光合同化速率是否较高gydF4y2BaSPL13gydF4y2BaRNAi [gydF4y2Ba21gydF4y2Ba]和WD40-1OE,gydF4y2BaWD40-1gydF4y2BaRNAi和miR156OE基因型(目前研究)在转录水平上受到调控,我们研究了介导光合作用的基因的表达。我们发现gydF4y2BaψgydF4y2Ba和gydF4y2BaPSIIgydF4y2Ba中度过表达miR156OE基因型和gydF4y2BaSPL13gydF4y2Ba干旱对RNAi基因型的影响。此前,我们报道了干旱胁迫下miR156OE A8植物中ABA丰度的增加,ABA通过活性水解调节气孔孔径[gydF4y2Ba21gydF4y2Ba]。在本研究中,我们检测了aba诱导的脱水反应基因(gydF4y2BaRD22gydF4y2Ba),并发现它在gydF4y2BaSPL13gydF4y2Ba干旱胁迫下的RNAi植物。在干旱胁迫下,中等miR156OE和中等miR156OE的多酚含量和光合系统同化速率均较高gydF4y2BaSPL13gydF4y2BaRNAi基因型提示miR156的干旱调控策略。gydF4y2Ba
SPL13结合到gydF4y2BaDFRgydF4y2Ba调节其表达和类黄酮的生物合成gydF4y2Ba
目的探讨黄酮类化合物积累和苯丙相关基因的表达是否增加gydF4y2BaDFRgydF4y2Ba,我们进行了ChIP-qPCR分析,以确定SPL13与gydF4y2BaDFRgydF4y2Ba。DFR通过将二氢黄酮醇还原为白花青素催化类黄酮生物合成,在花青素生物合成中起关键作用[j]。gydF4y2Ba83gydF4y2Ba]。先前有报道显示SPL9直接调控gydF4y2BaDFRgydF4y2Ba在NaCl和甘露醇处理下,花青素积累加快gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba23gydF4y2Ba]。在目前的研究中,我们显示了增加gydF4y2BaDFRgydF4y2Ba中度过表达miR156和gydF4y2BaSPL13gydF4y2BaRNAi植物。因此,我们选择gydF4y2BaDFRgydF4y2Ba以测试SPL13的结合,考虑到存在多个潜在的SBD核心GTAC序列gydF4y2BaDFRgydF4y2Ba启动子。ChIP-qPCR扩增结果显示,SPL13结合最强烈的位点位于dna的第III区gydF4y2BaDFRgydF4y2Ba启动子,位于最靠近基因的位置(260 bp)gydF4y2BaDFRgydF4y2Ba编码序列。这与有报道表明,保守的核心SBD元件本身并不足以结合SPL,而是由SBD和侧翼DNA序列的位置决定的[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba84gydF4y2Ba,gydF4y2Ba85gydF4y2Ba]。SPL13作为转录抑制因子gydF4y2BaDFRgydF4y2Ba在干旱胁迫下gydF4y2BaDFRgydF4y2Ba在gydF4y2BaSPL13gydF4y2BaRNAi和miR156OE植物。gydF4y2Ba
结论gydF4y2Ba
我们最近报道了miR156通过沉默调控苜蓿的耐旱性gydF4y2BaSPL13gydF4y2Ba[gydF4y2Ba21gydF4y2Ba]。了解miR156在抗旱性中的作用机制可以作为作物标记辅助育种的工具。在目前的研究中,我们研究了代谢组学、生理学和分子机制,以证明低至中等水平的miR156表达如何足以诱导苜蓿的耐旱性。A8a和A8基因型中中等水平的miR156诱导叶片、茎和根组织中花青素、黄酮醇、GABA、脯氨酸等应激缓解代谢物的积累。这些代谢物可以帮助植物清除活性氧,减少水分流失,并通过降低根组织的渗透平衡进一步吸收土壤中剩余的紧密结合水。此外,植株还表现出提高光合同化速率、维持Fv/Fm比、促进根系生长发育等生理调节。相对较低水平的应激缓解代谢物和减少的生理调节可能导致miR156高表达基因的干旱易感性(A11)。我们还确定了直接绑定gydF4y2BaSPL13gydF4y2Ba到gydF4y2BaDFRgydF4y2Ba启动子gydF4y2Ba。SPL13gydF4y2Ba的转录抑制因子gydF4y2BaDFRgydF4y2Ba在干旱胁迫下gydF4y2BaDFRgydF4y2Ba在gydF4y2BaSPL13gydF4y2BaRNAi和miR156OE植物。类似的观察结果显示,SPLs抑制gydF4y2BaDFRgydF4y2Ba已经在gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba86gydF4y2Ba),gydF4y2BaSPL9gydF4y2Ba沉默gydF4y2BaDFRgydF4y2Ba对盐和甘露醇处理的反应[gydF4y2Ba23gydF4y2Ba]。此外,我们检测到参与苯丙素和光合途径的基因表达增加,包括gydF4y2BaDfr, myb112, psigydF4y2Ba和gydF4y2BaPSIIgydF4y2Ba在干旱条件下miR156OE植物中gydF4y2BaDfr fgt2 psigydF4y2Ba和gydF4y2BaPSIIgydF4y2Ba也增加了gydF4y2BaSPL13gydF4y2Ba干旱胁迫下的RNAi植物。gydF4y2Ba
我们提出了一个由中等水平的miR156过表达调控的耐旱机制模型(图2)。gydF4y2Ba7gydF4y2Bag).图表显示了miR156在紫花苜蓿干旱胁迫调控中的核心作用。MiR156是由干旱胁迫诱导的,而干旱胁迫又使其沉默gydF4y2BaSPL13gydF4y2Ba[gydF4y2Ba21gydF4y2Ba]。的表达减少gydF4y2BaSPL13gydF4y2Ba在miR156的驱动下gydF4y2BaWD40-1gydF4y2Ba增强gydF4y2BaDFRgydF4y2Ba导致花青素的积累。在中等miR156OE植物中,GABA、脯氨酸和糖等初级代谢物也会积累,以维持碳氮平衡和渗透稳态。干旱胁迫下miR156的诱导也增强了表型可塑性,如根系变长,生物量增加,从而从根际获得更多水分。与减少gydF4y2BaSPL13gydF4y2Ba表达,miR156OE和gydF4y2BaWD40-1gydF4y2BaOEgydF4y2Ba,gydF4y2Ba在干旱胁迫下,光合作用效率也更高。我们得出结论,中等水平的miR156表达沉默gydF4y2BaSPL13gydF4y2Ba增加WD40-1表达进行微调gydF4y2BaDFRgydF4y2Ba花青素生物合成的表达调节了苜蓿的各种发育和生理生化过程,从而提高了苜蓿的抗旱性。gydF4y2Ba
方法gydF4y2Ba
遗传物质gydF4y2Ba
miR156过表达和gydF4y2BaSPL13gydF4y2BaRNAi植物gydF4y2Ba
紫花苜蓿gydF4y2BaL. N4.4.2植物[gydF4y2Ba87gydF4y2Ba]从Daniel Brown博士(加拿大农业和农业食品部)那里获得,并用作野生型基因型。miR156 (miR156OE)在不同水平(A8a、A8和A11)过表达的植株和空载体对照(EV)在我们实验室之前已经生成并用于本实验[gydF4y2Ba13gydF4y2Ba]。miR156在A8a中略有升高(0.5),但在A8和A11中分别处于中等(1.5)至较高(2.5)的相对转录水平[gydF4y2Ba13gydF4y2Ba]。这些植物生长在一个全自动温室中,光照时间为16小时(380-450瓦/米)gydF4y2Ba2gydF4y2Ba),相对湿度(RH)为70%,温度为25±2°C,位于加拿大安大略省伦敦的加拿大农业与农业食品伦敦研究与发展中心。鉴于紫花苜蓿是一种强制性的异种杂交,根据Aung等人的说法,我们使用了无性扦插进行繁殖[gydF4y2Ba13gydF4y2Ba在整个研究过程中保持基因型。因为miR156下调了7gydF4y2BaSPLgydF4y2Ba基因(包括gydF4y2BaSPL13gydF4y2Ba)来调节下游基因网络,我们使用gydF4y2BaSPL13gydF4y2BaRNAi基因型(gydF4y2BaSPL13gydF4y2BaRNAi-2,gydF4y2BaSPL13gydF4y2BaRNAi-5和gydF4y2BaSPL13gydF4y2BaRNAi-6) [gydF4y2Ba21gydF4y2Ba因为他们的低而被选中gydF4y2BaSPL13gydF4y2Ba表达水平相对于野生型苜蓿和其他gydF4y2BaSPL13gydF4y2BaRNAi转基因苜蓿植株。gydF4y2Ba
过表达WD40-1和WD40-1RNAi的苜蓿植株的产生gydF4y2Ba
通过生成4个WD40-1OE (OE04、OE09、OE14和OE15)和4个WD40-1RNAi (R03、R04、R10和R11)基因型,研究WD40-1在抗旱性中的作用。利用苜蓿同源物构建WD40-1过表达和下调基因型gydF4y2BaWD40-1gydF4y2Ba(Medtr3g074070),使用Gateway克隆系统(Thermo Fisher Scientific, Mississauga ON)。对于过表达研究,全长gydF4y2BaWD40-1gydF4y2Ba是从紫花苜蓿(gydF4y2Ba紫花苜蓿gydF4y2Ba)利用带AttB位点的引物,正向(B1-WD40-1)和反向(B2-WD40-1) cDNA(附加文件gydF4y2Ba1gydF4y2Ba(表S1)并克隆到pDONR/Zeo入口向量中。对于下调研究,一个253 bp的假设gydF4y2BaWD40-1gydF4y2Ba从苜蓿cDNA中利用AttB位点正向(B1-WD40-1-RNAi)和反向(B2-WD40-1-RNAi)扩增片段(附加文件)gydF4y2Ba1gydF4y2Ba:表S1)引物并克隆到pDONR/Zeo进入载体。gydF4y2Ba
经PCR筛选和测序确认后,对过表达和RNAi构建体进行LR反应,将片段重组为pMDC83(过表达)和pHELLSGATE12 (RNAi)载体。随后,使用过表达和RNAi构建物进行转化gydF4y2Ba根癌土壤杆菌gydF4y2Ba然后用EHA105菌株转化苜蓿。然后用QRT-PCR分析WD40-1基因在WD40-1 - oe中的表达gydF4y2BaWD40-1 -gydF4y2Ba使用引物WD1-qPCR-F和WD1-qPCR-R进行RNAi基因分型gydF4y2Ba1gydF4y2Ba:表1)。gydF4y2Ba
施加干旱压力gydF4y2Ba
在营养繁殖后30天(营养幼期),对苜蓿植株进行干旱胁迫2周,在此期间植株采用完全随机设计。在实验开始前,使用sm100土壤水分传感器(Spectrum Technologies Inc., Jakarta, Indonesia)保持土壤水分水平相等。每个处理每个基因型至少使用4个生物重复进行转录物和代谢物分析,同时使用4至10个植株进行生理分析(每个重复为单个植株)。在相同的生长和干旱胁迫条件下重复整个试验,以检验结果的重复性。收获miR156OE叶片(新发育的上部叶片)、茎(节间下部近土5cm)和根(主、副根尖7.5 cm);gydF4y2BaSPL13gydF4y2BaRNAi,gydF4y2BaWD40-1gydF4y2BaOE,gydF4y2BaWD40-1gydF4y2BaRNAi, EV和野生型植物取决于实验。样品用液氮速冻,保存在−80℃gydF4y2Ba0gydF4y2BaC进行代谢组学和转录组学分析。gydF4y2Ba
代谢物提取用于平行LCMS和GCMS分析gydF4y2Ba
为探究mir156对次生代谢物和瞬时初级代谢物的调控作用,采用液相色谱-质谱(LCMS)和气相色谱-质谱(GCMS)对干旱胁迫下miR156OE和对照植株茎、叶、根组织提取物进行分析。根据Ayenew等的方法提取样品。[gydF4y2Ba28gydF4y2Ba]进行LCMS和GCMS的平行分析。除非另有说明,用于分析的化学物质均来自加拿大Sigma-Aldrich公司。简单地说,冷冻50毫克的组织用RETCH-mill (Retsch Gmbh, 42,787 Haan, Germany)和不锈钢珠粉碎。加入预冷提取液1毫升,甲醇/氯仿/水(2.5/1/1 v/v/v),其中含有内标利比醇/阿多尼醇0.225 mg/mL用于GCMS分析,氨苄西林(Sigma, and Saint Luis, Missouri, USA)和皮质酮1 mg/mL用于LCMS,以标准化提取变异性。将混合物涡旋并超声10分钟。14000 rpm离心10分钟(4gydF4y2Ba0gydF4y2BaC),收集上清,与等体积的300 μL水和氯仿混合。混合物在14000 rpm的转速下短暂旋转并离心5分钟,收集上部水相用于平行LCMS和GCMS分析。gydF4y2Ba
LCMS分析使用Agilent 1290 Infinity LC系统和Thermo Q-Exactive四极轨道阱质谱仪进行。采用Agilent Eclipse Plus C18 ZORBAX快速分辨率高清晰度(RRHD) 1.8 μm颗粒2.1 id X 50 mm色谱柱进行分离。仪器配备电喷雾电离(ESI)界面,工作在负离子和正离子模式,以更好地鉴定代谢物。代谢物是根据质量电荷比(gydF4y2Bam / zgydF4y2Ba)、与商业标准、ChemSpider和ReSpect植物化学数据库(gydF4y2Ba28gydF4y2Ba,gydF4y2Ba71gydF4y2Ba]。MZmine2软件[gydF4y2Ba88gydF4y2Ba]也用于LCMS代谢物质量检测、色谱构建和重叠峰分离。同时,使用Agilent 5975C三轴检测器MSD和7890A气相色谱系统,在无分裂模式下,以75 μL的等分量检测提取样品的瞬时初级代谢物。用Eppendorf Vacufuge™浓缩器(Hamburg, Germany)干燥,衍生量为40 μLgydF4y2BaOgydF4y2Ba-盐酸甲基羟胺吡啶与7 μL标准烷烃混合物(各50 mg/l, 0.029% v/v C10-C20)在37℃下反应2 h,然后加入70 μLgydF4y2BaNgydF4y2Ba甲基-gydF4y2BaNgydF4y2Ba-[三甲基硅基]三氟乙酰胺(MSTFA)用于硅基化。使用标准烷烃混合物的保留时间及其质谱和NIST 2011质谱库对GCMS中的代谢物进行鉴定[gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba72gydF4y2Ba]。gydF4y2Ba
总单体花青素和多酚的测定gydF4y2Ba
总单体花青素(TMA)和总多酚(TPP)采用pH差萃取法测定[gydF4y2Ba89gydF4y2Ba,gydF4y2Ba90gydF4y2Ba]。简单地说,速冻的液氮样品在液氮下用砂浆和杵粉碎,500 mg组织用于TMA和TPP的联合分析。样品用2 ml酸化甲醇(含1% HCL的甲醇)处理,在20 KHz下涡流和超声15分钟。匀浆在3000 RPM下搅拌1 h,在4°C下全速(14000 RPM)离心10 min。收集上清液,加入2 ml氯仿,涡旋,全速离心10 min。收集上水相,用Whiteman 0.2 um过滤器过滤,分成三等份进行TMA (pH 1.0和4.5)和TPP分析。在pH为1.0的条件下,将第一种溶液与等体积的0.025 M氯化钾混合;在pH为4.5的条件下,将第二种溶液与等体积的0.4 M乙酸钠混合,以水为空白,在520和700 nm处测量吸光度。将等量的第三等分物与Folin-chiocalteu试剂(用水1:10稀释)混合,旋转3min,分析TPP。在混合物中加入4 ml碳酸钠(7.5% w/v),然后在黑暗中涡流孵育30分钟。以酸化甲醇为空白,在765 nm处测定其吸光度,确定TPP为没食子酸当量(GAE)。 TMA level is expressed as mg cyanidin-3-o-glucoside (CG) equivalent.
生理和表型数据测量gydF4y2Ba
为了确定干旱缓解策略,我们研究了表型和生理参数。利用LI-6400XT便携式光合作用仪和荧光系统(LI-COR Biosciences, Lincoln, Nebraska, USA),测量了新生长的上部无遮荫叶片的正午光合作用同化率和暗适应叶绿素荧光(Fv/Fm)。光合同化速率在CO梯度上的响应gydF4y2Ba2gydF4y2Ba测定叶肉细胞中rubisco羧化酶活性的最大速率(gydF4y2BaVcmaxgydF4y2Ba)和最大光合电子传递速率(gydF4y2BaJmaxgydF4y2Ba),利用R统计软件plantecophys package [gydF4y2Ba91gydF4y2Ba]。利用Apogee MC100仪器(Apogee instruments, Logan, Utah, USA)测定了新上部叶片的叶绿素浓度指数(CCI) [gydF4y2Ba92gydF4y2Ba]。为了确定植物水分状况,使用SAPS II便携式植物水分状况控制器(土壤水分设备公司,Santa Barbara, CA, USA)测量了黑暗适应叶片的中午叶片水势,用聚乙烯袋和铝箔覆盖叶片20分钟。此外,根据Aung et al.测定了地上地下表型参数,如茎数和茎重、根长和根重。[gydF4y2Ba13gydF4y2Ba],茎基部直径在茎-土界面以上1cm处。gydF4y2Ba
RNA提取及qRT-PCR分析gydF4y2Ba
收集茎、叶和根样品,在液氮中快速冷冻,并保存在-80°C的冰箱中,待进一步使用。根据制造商协议,使用PowerPlant®RNA分离试剂盒(Cat # 13500)提取叶片样品,QIAGEN RNeasy®植物迷你试剂盒(Cat # 74904)提取茎和根组织,使用PowerLyzer®24台式头状均质机(Cat # 13155)提取总RNA,使用约50 mg新鲜重量。提取的RNA用Ambion®TURBO DNA-处理gydF4y2Ba免费™gydF4y2BaDNase (Cat # AM1907),然后是iScript™cDNA合成(Cat # 1708891)。gydF4y2Ba
本研究研究了参与次生代谢物生物合成和光合作用的选定基因的转录水平。利用控制(非胁迫)条件下两种miR156OE苜蓿基因型的公开转录组学数据[gydF4y2Ba8gydF4y2Ba),gydF4y2Bam . truncatulagydF4y2Ba基因组序列Mt4.0 V2 (gydF4y2Bahttp://www.medicagogenome.org/downloadsgydF4y2Ba),在启动子区域2.5 kb内鉴定出具有SBD核心GTAC序列的差异表达基因的转录本。选取其中经基因本体分析显示与类黄酮生物合成、光合效率和胁迫耐受有关的基因进行qRT-PCR表达分析。上述基因的特异引物(附加文件)gydF4y2Ba1gydF4y2Ba:表S1)采用gydF4y2Bam . truncatulagydF4y2Ba对基因组序列和扩增产物进行测序以进行身份检查(附加文件)gydF4y2Ba2gydF4y2Ba:图S2)。公开的Primer3软件(gydF4y2Bahttp://primer3.ut.ee/gydF4y2Ba)设计引物,用梯度退火温度PCR验证不同浓度下引物的效率,然后进行qRT-PCR分析。gydF4y2Ba
采用CFX96™Real-Time PCR检测系统和SsoFast™EvaGreen®Supermixes (Bio-Rad Cat # 1725204)进行QRT-PCR。其中,以2 μL cDNA(相当于200 ng cDNA)、1 μL正向和反向基因特异性引物(各10 μM)、5 μL SsoFast Eva green Supermix和2 μL无核酸酶水为最终反应体积为10 μL。PCR扩增在以下条件下进行:cDNA在95°C变性30 s,然后在95°C变性10 s, 58°C变性30 s和72°C变性30 s(分别为变性,退火和延伸)的40个循环中进行,然后在65°C至95°C的熔化曲线上进行,每5 s逐渐增加0.5。所有反应均进行了3次技术重复和4次生物重复。与乙酰辅酶a羧化酶(gydF4y2BaACC1gydF4y2Ba),gydF4y2Ba肌动蛋白gydF4y2Ba基于紫花苜蓿序列设计的管家基因[j]gydF4y2Ba13gydF4y2Ba,gydF4y2Ba21gydF4y2Ba]。gydF4y2Ba
SPL13-DNA结合的ChIP-qPCR分析gydF4y2Ba
苜蓿茎尖过度表达gydF4y2BaSPL13gydF4y2Ba带有CaMV35S启动子驱动的GFP标记(p35S:SPL13-GFP) [gydF4y2Ba52gydF4y2Ba]来了解SPL13在下游抗旱基因启动子上的占用情况。1月龄SPL13-GFP过表达基因型和WT对照植株根据先前发表的方案进行ChIP-qPCR分析[gydF4y2Ba93gydF4y2Ba做了一些修改。简单地说,收集WT和p35S:SPL13-GFP植株的茎尖500 mg,清洗,用1%甲醛交联DNA结合的蛋白质,并用液氮研磨混合物。萃取试剂和缓冲液列在附加文件中gydF4y2Ba2gydF4y2Ba表S4。粉末状组织用15ml预冷萃取缓冲液1匀浆,并用两层Miracloth (Millipore, Canada)过滤。随后,过滤后的混合物在3000℃离心gydF4y2BaggydF4y2Ba将微球重悬于1ml预冷的萃取缓冲液2中,在12000℃下离心gydF4y2BaggydF4y2Ba10分钟。将微球重悬于300 μL预冷萃取缓冲液3中,16000离心gydF4y2BaggydF4y2Ba1小时。取上清液,用轻移液将染色质颗粒重悬于300 μL的溶核缓冲液中,并使用Sonic dismemator (Fisher Scientific, USA)在冰上以3倍功率剪切2次,持续15 s。保留20微升上清等分作为输入DNA对照,同时使用剩余溶液进行免疫沉淀。使用ChIP稀释缓冲液将染色质溶液调至1.5 mL,分成两等份进行染色质免疫沉淀和阴性对照。每管加入30 μL蛋白a -琼脂糖珠(Millipore, Canada),轻轻搅拌,离心(3500)gydF4y2BaggydF4y2Ba) 1 min,转移上清进行免疫沉淀,弃珠。在其中一种染色质溶液中加入5 μL的Ab290 GFP抗体(另一种作为无抗体阴性对照),在4°C下温和搅拌过夜。12 h后,加入40 μL蛋白a -琼脂糖珠,离心回收免疫复合物,用低正态盐、高盐、LiCl和TE缓冲液循环洗涤。用250 μL洗脱液洗脱免疫复合物,用20 μL 5 M NaCl在65℃下孵育逆转交联gydF4y2Ba0gydF4y2Ba每个样品加入10 μL 0.5 M EDTA、20 μL 1 M Tris-HCl (pH 6.5)和2 μL 10 mg/mL蛋白酶K (Sigma-Aldrich, Canada)。用苯酚:氯仿(1:1,v:v)提取DNA,在-20℃孵卵过夜后,用乙醇、0.3 M乙酸钠(pH = 5.2)和2 μL糖原载体10 mg/mL (Sigma-Aldrich, Canada)沉淀回收。12 h后,将溶液全速离心20 min,使DNA成球,用70%乙醇洗涤,用16 μL蒸馏水重悬,DNA用于ChIP-qPCR分析。要获得gydF4y2BaDFRgydF4y2Ba启动子区序列gydF4y2Bam .漂白亚麻纤维卷gydF4y2Ba, profr1 - mtr引物(附加文件gydF4y2Ba1gydF4y2Ba表S1)采用近亲属设计gydF4y2Bam . truncatulagydF4y2Ba序列和扩增区克隆到TOP10主管gydF4y2Ba大肠杆菌gydF4y2Ba使用CloneJET (Thermo Scientific)进行测序。随后,profr ChIP-qPCR引物(附加文件gydF4y2Ba1gydF4y2Ba表S1)是根据苜蓿序列设计的。使用上述chip沉淀DNA进行QRT-PCR,通过将p35S:SPL13-GFP的Ct值除以WT,并与之比较,计算倍丰度gydF4y2BaLOB1gydF4y2Ba参考基因[gydF4y2Ba52gydF4y2Ba]。gydF4y2Ba
WD40-1启动子核苷酸序列的基因组行走gydF4y2Ba
由于缺乏苜蓿基因组序列,我们使用Clonetech GenomeWalker™(California, USA Cat No. 638904)获得该基因的核苷酸序列gydF4y2BaWD40-1gydF4y2Ba启动子区域。简而言之,我们使用Nucleospin®组织DNA提取试剂盒(MACHEREY-NAGEL Gmbh & Co. KG Germany, Cat)从野生型苜蓿植物中提取基因组DNA。740952号)。基因组沃克“文库”是用四种不同的限制性内切酶(gydF4y2Ba半径标注gydF4y2Ba我,gydF4y2Ba生态gydF4y2Ba房车,gydF4y2BaPvugydF4y2Ba二世和gydF4y2Ba斯图gydF4y2BaI)在37℃下加热2 h,产生钝端。随后,使用试剂盒中的基因特异性引物(GSP1和GSP2)和适配器引物(AP1和AP2)对每个文库依次进行两次巢式PCR扩增(附加文件)gydF4y2Ba1gydF4y2Ba:表1)。PCR产物在1.5%琼脂糖凝胶上分析,克隆到pJET1.2克隆载体上,便于测序。随后,将从四个文库中获得的序列比对,得到了苜蓿WD40-1的一致启动子区序列。gydF4y2Ba
统计数据分析gydF4y2Ba
在进行方差分析(ANOVA)之前,采用Shapiro-Wilk检验检验数据的正态分布。随后,对分子(qRT-PCR和ChIP-qPCR)、代谢组学(LCMS和GCMS)、生理和表型数据进行了Tukey事后多重比较。对WD40-1OE与野生型植物以及WD40-1RNAi植物的WD40-1转录物丰度进行了两两t检验比较。代谢物剖面数据在主成分分析(PCA)之前进行帕累托标度,其中代谢物以均值为中心,然后除以标准差的平方根。所有统计数据分析均采用r -软件环境3.2.5进行。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
本研究中使用的数据作为“附加文件。xlsx”作为补充文件提供。gydF4y2Ba
缩写gydF4y2Ba
- 阿坝:gydF4y2Ba
-
脱落酸gydF4y2Ba
- DAG:gydF4y2Ba
-
花翠素3 -(6“乙酰)葡萄糖苷gydF4y2Ba
- DFRgydF4y2Ba:gydF4y2Ba
-
DIHYDROFLAVONOL-4-REDUCTASEgydF4y2Ba
- DRRgydF4y2Ba:gydF4y2Ba
-
脱水反应性rd -22样gydF4y2Ba
- 电动汽车:gydF4y2Ba
-
空向量gydF4y2Ba
- FGT2gydF4y2Ba:gydF4y2Ba
-
类黄酮GLUCOSYLTRANSFERASE2gydF4y2Ba
- GABA:gydF4y2Ba
-
Gamma-aminobutyric-acidgydF4y2Ba
- 全球大气环流模型:gydF4y2Ba
-
气相色谱质谱法gydF4y2Ba
- LCMS:gydF4y2Ba
-
液相色谱质谱法gydF4y2Ba
- LOB1gydF4y2Ba:gydF4y2Ba
-
侧边器官边界-如1gydF4y2Ba
- miR156:gydF4y2Ba
-
microRNA156gydF4y2Ba
- PA:gydF4y2Ba
-
原花青素gydF4y2Ba
- 朋友gydF4y2Ba:gydF4y2Ba
-
苯丙氨酸AMMONIA-LYASEgydF4y2Ba
- PAP1gydF4y2Ba:gydF4y2Ba
-
花青素色素的生产gydF4y2Ba
- 主成分分析:gydF4y2Ba
-
主成分分析gydF4y2Ba
- 答:gydF4y2Ba
-
Peonidin 3-O-glucosidegydF4y2Ba
- 购买力平价:gydF4y2Ba
-
戊糖磷酸途径gydF4y2Ba
- ψgydF4y2Ba:gydF4y2Ba
-
光系统I p700叶绿素A载脂蛋白APS IgydF4y2Ba基因gydF4y2Ba
- PSII:gydF4y2Ba
-
光系统IIgydF4y2Ba
- PSIIgydF4y2Ba:gydF4y2Ba
-
光系统II Q(b)gydF4y2Ba基因gydF4y2Ba
- ROS:gydF4y2Ba
-
活性氧gydF4y2Ba
- 作为:gydF4y2Ba
-
SPL结合域gydF4y2Ba
- SPL:gydF4y2Ba
-
鳞片-启动子结合蛋白样gydF4y2Ba
- WT:gydF4y2Ba
-
野生型gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
Ray DK, Gerber JS, MacDonald GK, West PC。气候变化解释了全球作物产量变化的三分之一。学报。2015;6:5989。gydF4y2Ba
- 2.gydF4y2Ba
Olesen JE, Trnka M, Kersebaum KC, skjelvamatg AO, Seguin B, Peltonen-Sainio P,等。欧洲作物生产系统对气候变化的影响和适应。植物学报,2011,34(2):96-112。gydF4y2Ba
- 3.gydF4y2Ba
马建军,李建军,李建军,等。气候变化对作物改良的影响。农业粮食安全,2012;1(1):1 - 17。gydF4y2Ba
- 4.gydF4y2Ba
周明,罗慧。microrna介导的基因调控:在植物基因工程中的潜在应用。植物化学学报,2013;31(1):591 - 591。gydF4y2Ba
- 5.gydF4y2Ba
孙刚。microrna及其在植物中的多种功能。植物化学学报,2012;31(1):379 - 379。gydF4y2Ba
- 6.gydF4y2Ba
张宝宝,潘XP, Cannon CH, Cobb GP, Anderson TA。利用EST分析鉴定和鉴定新的植物microrna。Cell Res. 2005; 15:336-60。gydF4y2Ba
- 7.gydF4y2Ba
Aung B, Gruber MY, Amyot L, Omari K, Bertrand A, Hannoufa A.异位表达gydF4y2BaLjmiR156gydF4y2Ba延迟开花,提高茎枝分枝,提高苜蓿饲料品质。植物学报,2015;9(6):379-93。gydF4y2Ba
- 8.gydF4y2Ba
高荣,王丽娟,王丽娟,等。基因表达变化的转录组学研究gydF4y2Ba紫花苜蓿gydF4y2Ba。中国生物医学工程学报,2016;17(1):658。gydF4y2Ba
- 9.gydF4y2Ba
王晓明,王晓明,王晓明,等。微rna - 156系统在植物生物技术研究中的应用。生物催化与农业生物技术,2015;4(4):432-42。gydF4y2Ba
- 10.gydF4y2Ba
谢忠,陈志强,陈志强,陈志强。拟南芥MIRNA基因的表达。植物生理学报,2005;38(4):2145 - 2154。gydF4y2Ba
- 11.gydF4y2Ba
杨玲,吴刚,Poethig RS, Wagner D. microrna调控的SBP-box转录因子SPL3是一种直接的上游激活因子gydF4y2Ba绿叶,FRUITFULLgydF4y2Ba,gydF4y2BaAPETALA1gydF4y2Ba。生态学报,2009;17(2):268-78。gydF4y2Ba
- 12.gydF4y2Ba
魏思,格鲁伯,于波,高明军,哈夏图里安,格鲁伯,赫格杜斯,等。gydF4y2Ba拟南芥gydF4y2Ba突变体gydF4y2Bask156gydF4y2Ba揭示了SPL15在mir156控制的基因网络中的复杂调控。植物学报,2012;12(1):169。gydF4y2Ba
- 13.gydF4y2Ba
Aung B, Gruber MY, Amyot L, Omari K, Bertrand A, Hannoufa A. MicroRNA156在紫花苜蓿改良中的应用。植物学报;2015;13(6):779-90。gydF4y2Ba
- 14.gydF4y2Ba
徐敏,胡涛,赵军,朴明勇,Earley KW,吴刚,等。mir156调控发育功能gydF4y2BaSquamosa启动子结合蛋白样(spl)gydF4y2Ba基因在gydF4y2Ba拟南芥gydF4y2Ba。科学通报,2016;12(8):e1006263。gydF4y2Ba
- 15.gydF4y2Ba
吴刚,Park MY, Conway SR,王建伟,Weigel D, Poethig RS. miR156和miR172的序列作用调控了大鼠发育时间gydF4y2Ba拟南芥gydF4y2Ba。细胞。2009;138(4):750 - 9。gydF4y2Ba
- 16.gydF4y2Ba
王磊,孙生,金杰,付东,杨旭,翁旭,等。水稻营养分支和生殖分支的协调调控。中国科学:自然科学版,2015;37(5):591 - 591。gydF4y2Ba
- 17.gydF4y2Ba
Malik AI, Colmer TD, Lambers H, Setter TL, Schortemeyer M.短期涝渍对小麦生长和生理的长期影响。植物化学学报,2002;32(2):394 - 394。gydF4y2Ba
- 18.gydF4y2Ba
Serraj R.干旱胁迫对豆科植物共生固氮的影响。中国生物医学工程学报(英文版);2003;31(1):1 - 6。gydF4y2Ba
- 19.gydF4y2Ba
马国华,马国华,马国华,等。紫花苜蓿对高温胁迫的响应。植物物理学报,2019;36(4):830 - 842。gydF4y2Ba
- 20.gydF4y2Ba
陈建军,陈建军,李建军,等。紫花苜蓿耐盐性的研究进展。植物科学,2017;8:356。gydF4y2Ba
- 21.gydF4y2Ba
黄春华,李春华,李春华,等。紫花苜蓿抗旱性研究进展[j]。gydF4y2Ba紫花苜蓿gydF4y2Ba)通过沉默SPL13。植物科学,2017,38(2):122 - 126。gydF4y2Ba
- 22.gydF4y2Ba
刘建军,刘建军,刘建军,刘建军,刘建军。gydF4y2Ba拟南芥gydF4y2BamiR156通过SPL转录因子调节对反复环境胁迫的耐受性。植物学报,2014,26(4):1792-807。gydF4y2Ba
- 23.gydF4y2Ba
崔立国,单建新,石敏,高建平,林红霞。miR156-SPL9-DFR通路协调植物发育与非生物胁迫耐受性之间的关系。植物学报,2014,31(6):1108 - 1107。gydF4y2Ba
- 24.gydF4y2Ba
庞勇,Wenger JP, Saathoff K, Peel GJ, Wen J, Huhman D,等。来自长尾紫花苜蓿的WD40重复蛋白是组织特异性花青素和原花青素生物合成所必需的,但不是毛状体发育所必需的。植物生理学报,2009;31(3):1145 - 1145。gydF4y2Ba
- 25.gydF4y2Ba
Verdier J,赵军,Torres-Jerez I,葛松,刘超,何翔,等。MtPAR MYB转录因子作为原花青素生物合成的开关gydF4y2BaMedicago truncatulagydF4y2Ba。科学通报,2012;39(5):1766-71。gydF4y2Ba
- 26.gydF4y2Ba
Nakabayashi R, yoneura - sakakibara K, Urano K, Suzuki M, Yamada Y, Nishizawa T,等。抗氧化类黄酮的过度积累增强拟南芥的抗氧化和抗旱性。植物学报,2014;37(3):367 - 379。gydF4y2Ba
- 27.gydF4y2Ba
Degu A, Ayenew B, Cramer GR, Fait A。葡萄果实对光、温度、氧化胁迫、脱落酸和茉莉酸的多酚响应显示出特定的发育依赖程度。食品化学,2016;22:828 - 36。gydF4y2Ba
- 28.gydF4y2Ba
Ayenew B, Degu A, Manela N, Perl A, Shamir MO, Fait A.代谢谱分析和转录分析揭示了浆果来源细胞培养对非生物胁迫的反应特异性。植物科学,2015;6:728。gydF4y2Ba
- 29.gydF4y2Ba
李建军,李建军,李建军,等。GABA在植物体内代谢中的作用。植物科学进展,2008;13(1):14-9。gydF4y2Ba
- 30.gydF4y2Ba
地中海条件下全亏灌溉棉花叶片水势和作物水分胁迫指数变化。农业科学进展,2015;4:463-70。gydF4y2Ba
- 31.gydF4y2Ba
孔晓梅,高德华,陈晓明,等。灌溉水胁迫对桃树生长和生长的影响。植物学报,2001;36(1):55-60。gydF4y2Ba
- 32.gydF4y2Ba
灌溉调度方案使用连续记录的树干直径测量。水利学报,2001;20(3):115 - 125。gydF4y2Ba
- 33.gydF4y2Ba
李志强,李志强,李志强,等。灌水调度中李子植株和土壤水分状况的连续测量。灌溉科学,2004;23(2):93-102。gydF4y2Ba
- 34.gydF4y2Ba
光合作用与干旱:我们能从现有数据中建立代谢联系吗?实验学报,2011;32(3):869-82。gydF4y2Ba
- 35.gydF4y2Ba
Matsuda F.部分代谢物特征的MS/MS谱正则表达式。代谢组学。2016;12(7):113。gydF4y2Ba
- 36.gydF4y2Ba
Alonso A, Marsal S, julions A.非靶向代谢组学的分析方法:2015年的最新进展。前沿生物科技,2015;3:23。gydF4y2Ba
- 37.gydF4y2Ba
N.活性氧在植物缺水和干燥反应中的作用。植物学报,1993;25(1):27-58。gydF4y2Ba
- 38.gydF4y2Ba
干旱胁迫和活性氧:生产、清除和信号传导。植物信号学报,2008;3(3):156-65。gydF4y2Ba
- 39.gydF4y2Ba
张勇,Butelli E, De Stefano R, Schoonbeek H-j, Magusin A, Pagliarani C,等。花青素通过延缓过熟和减少对灰霉病的易感性,使番茄的保质期延长一倍。当代生物学,2013;23(12):1094-100。gydF4y2Ba
- 40.gydF4y2Ba
张勇,De Stefano R, Robine M, Butelli E, Bulling K, Hill L,等。黄酮类化合物清除活性氧的能力不同,决定了其延长番茄保质期的能力。植物生理学报,2015;32(3):563 - 563。gydF4y2Ba
- 41.gydF4y2Ba
田村,林志刚,菅泽,近藤。用同核哈特曼-哈恩(HOHAHA)光谱和液相色谱-质谱法测定葡萄中酰基化花青素的结构。植物化学学报,1994;5(4):190-6。gydF4y2Ba
- 42.gydF4y2Ba
何峰,穆林,闫国林,梁宁宁,潘庆华,王杰,等。彩色葡萄花青素的生物合成及其调控。分子。2010;15(12):9057。gydF4y2Ba
- 43.gydF4y2Ba
Hochberg U, Degu A, Toubiana D, Gendler T, Nikoloski Z, Rachmilevitch S,等。代谢谱分析和网络分析揭示了葡萄对水分胁迫反应的协调变化。植物学报,2013;13(1):184。gydF4y2Ba
- 44.gydF4y2Ba
欢丽,谢霞,郑忠,孙峰,吴松,李敏,等。潮间带大型藻在盐胁迫下PSI响应与氧化戊糖磷酸途径活性呈正相关。植物生理学报,2014;55(8):1395-403。gydF4y2Ba
- 45.gydF4y2Ba
Stincone A, Prigione A, Cramer T, Wamelink MMC, Campbell K, Cheung E,等。代谢的回归:戊糖磷酸途径的生物化学和生理学。生物学报,2015,39(3):927-63。gydF4y2Ba
- 46.gydF4y2Ba
刘建军,刘建军,刘建军,刘建军,刘建军gydF4y2Ba拟南芥gydF4y2Ba转录因子gydF4y2BaMYB112gydF4y2Ba在盐度和强光胁迫下促进花青素的形成。植物生理学报,2015;39(3):662 - 668。gydF4y2Ba
- 47.gydF4y2Ba
张建军,张建军,张建军,等。化学PARP抑制能促进生长gydF4y2Ba拟南芥gydF4y2Ba并减少花青素的积累和应激保护机制的激活。科学通报,2012;7(5):e37287。gydF4y2Ba
- 48.gydF4y2Ba
Gould KS, Dudle DA, Neufeld HS。为什么有些茎是红色的:茎花青素保护光系统II免受强光胁迫。实验学报,2010;61(10):2707-17。gydF4y2Ba
- 49.gydF4y2Ba
张建军,张建军,张建军,等。花青素色素沉着的研究进展。植物学报。1985;63(6):1066-71。gydF4y2Ba
- 50.gydF4y2Ba
安倍H, Urao T, Ito T, Seki M, Shinozaki K, Yamaguchi-Shinozaki K。gydF4y2Ba拟南芥gydF4y2BaAtMYC2 (bHLH)和AtMYB2 (MYB)在脱落酸信号传导中起转录激活作用。植物学报。2003;15(1):63-78。gydF4y2Ba
- 51.gydF4y2Ba
脱落酸与非生物胁迫信号传导。植物信号学报,2007;2(3):135 - 138。gydF4y2Ba
- 52.gydF4y2Ba
Gao R, Gruber m, Amyot L, Hannoufa A. SPL13调控紫花苜蓿枝条分枝和开花时间。植物化学学报,2017;36(1):119 - 133。gydF4y2Ba
- 53.gydF4y2Ba
高燕,刘健,陈燕,唐华,王燕,何燕,等。番茄SlAN11通过与bHLH蛋白相互作用调控类黄酮生物合成和种子休眠,而不与MYB蛋白相互作用。园艺学报,2018;5(1):27。gydF4y2Ba
- 54.gydF4y2Ba
王晓明,王晓明,王晓明,等。气候变化对气候变化的影响及其对资源管理的影响。气候学报,2008;28(10):1283 - 1292。gydF4y2Ba
- 55.gydF4y2Ba
[j]张建军,张建军,张建军。干旱胁迫对马铃薯生长发育的影响。植物科学,2015;6:542。gydF4y2Ba
- 56.gydF4y2Ba
马凯音,金海涛,Nath UK, Park J-I, Kho KH, Cho yg,等。生物与非生物胁迫相关基因的探索与预测研究gydF4y2Ba芸苔属植物拉伯gydF4y2Ba和gydF4y2Bab . oleraceagydF4y2Ba一篇评论。植物育种与生物技术,2016;4(2):135-44。gydF4y2Ba
- 57.gydF4y2Ba
潘迪V,舒克拉A.通过生理育种提高干旱胁迫下作物产量。In: Hossain MA, Wani SH, Bhattacharjee S, Burritt DJ, Tran L-SP,编辑植物的抗旱性,第1卷。瑞士:生理学和生物化学:斯普林格国际出版;2016.331 - 48页。gydF4y2Ba
- 58.gydF4y2Ba
陈红,李志,熊磊。植物根系对干旱胁迫的适应性调控。生物化学学报。2012;586(12):1742-7。gydF4y2Ba
- 59.gydF4y2Ba
熊磊,王荣国,毛刚,高赞建明。根系对干旱胁迫和脱落酸反应的遗传分析鉴定抗旱性决定因素。植物生理学报,2006;42(3):1065-74。gydF4y2Ba
- 60.gydF4y2Ba
梁毅,Mitchell DM, Harris JM。脱落酸修复了短截紫花苜蓿突变体根分生组织缺陷。中国生物医学工程学报,2009;31(1):391 - 391。gydF4y2Ba
- 61.gydF4y2Ba
高锐,王莹,郭玉梅,韩诺法,等。miR156/SPL10基因表达对拟南芥侧根发育、分枝和叶片形态的调控[j]。植物科学,2018;8:2226。gydF4y2Ba
- 62.gydF4y2Ba
陈建军,陈建军,陈建军,等。紫花苜蓿叶片对干旱的生理响应及蛋白质组学研究[j]。gydF4y2Ba紫花苜蓿gydF4y2Ba).实验学报,2011;32(1):111-23。gydF4y2Ba
- 63.gydF4y2Ba
张志强,张志强,张志强。利用叶绿素荧光评价硬粒小麦光合电子传递量子产率及其耐旱性。中国农业科学学报,1995;25(3):391 - 391。gydF4y2Ba
- 64.gydF4y2Ba
Sharma DK, Andersen SB, Ottosen C-O, Rosenqvist E.在高温胁迫下,选择高Fv/Fm的小麦品种保持较高的光合作用、总叶绿素、气孔导度、蒸腾和干物质。植物物理学报,2015;153(2):284-98。gydF4y2Ba
- 65.gydF4y2Ba
Gautam A, Agrawal D, SaiPrasad SV, Jajoo A.高温下小麦高产、低产品种快速筛选方法。植物物理学报,2014;20(4):533-7。gydF4y2Ba
- 66.gydF4y2Ba
叶绿素荧光分析:一个好的实践指南和理解一些新的应用。实验学报,2013;64(13):3983-98。gydF4y2Ba
- 67.gydF4y2Ba
苏丽,戴志,李生,辛华。利用叶绿素荧光技术评价葡萄抗旱性的新体系。植物学报,2015;15(1):82。gydF4y2Ba
- 68.gydF4y2Ba
李建军,李建军,李建军,等。野生小麦QTL等位基因对小麦产量、生物量和光合作用的影响。植物科学,2016;25(1):23 - 34。gydF4y2Ba
- 69.gydF4y2Ba
Mishra KB, Iannacone R, Petrozza A, Mishra A, Armentano N, La Vecchia G,等。番茄植株的抗旱性反映在叶绿素荧光发射上。植物科学,2012;42(2):79 - 86。gydF4y2Ba
- 70.gydF4y2Ba
陈建军,陈建军,陈建军。植物非生物胁迫对植物生长的影响。植物学报,2011;11(1):163。gydF4y2Ba
- 71.gydF4y2Ba
胡晓明,陈晓明,李晓明,等。葡萄果实皮代谢变化与水分胁迫的关系。植物生理学报,2015;33(2):442 - 452。gydF4y2Ba
- 72.gydF4y2Ba
Batushansky A, Kirma M, Grillich N, Pham PA, Rentsch D, Galili G,等。转运体GAT1在gaba介导的碳氮相互作用中起重要作用gydF4y2Ba拟南芥gydF4y2Ba。植物科学前缘,2015;6(9):785。gydF4y2Ba
- 73.gydF4y2Ba
Naya L, Ladrera R, Ramos J, González EM, Arrese-Igor C, Minchin FR,等。苜蓿根瘤碳代谢和抗氧化防御对干旱胁迫及植株后续恢复的响应植物生理学报,2007;14(2):1104 - 1104。gydF4y2Ba
- 74.gydF4y2Ba
张建军,张建军,张建军,等。碳代谢和类细菌功能参与了植物固氮的调节gydF4y2BaMedicago truncatulagydF4y2Ba在干旱和恢复中。植物学报,2009;22(12):1565-76。gydF4y2Ba
- 75.gydF4y2Ba
雷诺H, Roussel V, El Amrani A, Arzel M,雷诺D, Bouchereau A,等。的gydF4y2Ba拟南芥gydF4y2Bapop2-1突变体揭示GABA转氨酶参与盐胁迫耐受。植物学报,2010;10:20。gydF4y2Ba
- 76.gydF4y2Ba
Vijayakumari K, Puthur JT。γ-氨基丁酸(GABA)激发增强了玉米的渗透胁迫耐受性gydF4y2BaPiper初步gydF4y2Ba林恩。植物受到peg诱导的胁迫。植物学报,2016;78(1):57-67。gydF4y2Ba
- 77.gydF4y2Ba
李忠,于健,彭宇,黄波。γ-氨基丁酸(GABA)调控的匍匐弯草耐热性代谢途径(gydF4y2BaAgrostis多茎目gydF4y2Ba).科学通报2016;6:30338。gydF4y2Ba
- 78.gydF4y2Ba
陈建军,陈建军,陈建军,刘建军,等。紫花苜蓿氮素和碳代谢的初步研究进展(英文)gydF4y2Ba紫花苜蓿gydF4y2Ba)。实验学报,2013;64(4):885-97。gydF4y2Ba
- 79.gydF4y2Ba
Ray H, Yu M, Auser P, Blahut-Beatty L, McKersie B, Bowley S,等。玉米Lc转化苜蓿后花青素和原花青素的表达。植物生理学报,2003;32(3):448 - 456。gydF4y2Ba
- 80.gydF4y2Ba
Dixon RA, Sumner LW。豆科植物天然产物:理解和操纵人类和动物健康的复杂途径。植物生理学报,2003;31(3):878-85。gydF4y2Ba
- 81.gydF4y2Ba
McMahon LR, McAllister TA, Berg BP, Majak W, Acharya SN, Popp JD等。牧草浓缩单宁对放牧牛瘤胃发酵和腹胀影响的研究进展。植物学报,2000;80(3):469-85。gydF4y2Ba
- 82.gydF4y2Ba
Aerts RJ, Barry TN, McNabb WC。多酚与农业:原花青素在牧草中的有益作用。农业生态学报。1999;31(1):1-12。gydF4y2Ba
- 83.gydF4y2Ba
李红,邱军,陈飞,吕霞,付超,赵东,等。的分子特征及表达分析gydF4y2Ba二氢黄酮醇4-还原酶gydF4y2Ba基因gydF4y2Ba光学美杜莎gydF4y2Ba。中华生物医学杂志,2012;39(3):2991-9。gydF4y2Ba
- 84.gydF4y2Ba
王忠,王勇,Kohalmi SE, Amyot L, Hannoufa A。gydF4y2Ba鳞虫启动子结合蛋白样2gydF4y2Ba通过激活控制花器官的发育和植物的生育能力gydF4y2Ba不对称叶片2gydF4y2Ba在gydF4y2Ba拟南芥gydF4y2Ba。植物化学学报,2016;39(6):662 - 662。gydF4y2Ba
- 85.gydF4y2Ba
于宁,蔡文杰,王生,单春明,王丽娟,陈学勇。microrna156靶向SPL基因对毛状体分布的时间调控gydF4y2Ba拟南芥gydF4y2Ba。植物学报,2010;22(7):2322-35。gydF4y2Ba
- 86.gydF4y2Ba
苟建勇,filippes FF,刘成军,Weigel D,王建伟。花青素生物合成的负调控gydF4y2Ba拟南芥gydF4y2Ba靶向mir156的SPL转录因子植物学报,2011;23(4):1512-22。gydF4y2Ba
- 87.gydF4y2Ba
白汉安,金丽,王勇,韩松,Kowalczys K, Brown DC,等。真菌阿魏酸酯酶在苜蓿中的表达改变细胞壁消化率。生物燃料学报,2014;7(1):39。gydF4y2Ba
- 88.gydF4y2Ba
刘建军,刘建军,张建军,等。基于质谱分析的分子谱数据处理方法研究[j]。生物医学信息学报,2010;11(1):395。gydF4y2Ba
- 89.gydF4y2Ba
Cheok CY, Chin NL, Yusof YA, Talib RA, Law CL。山竹中总单体花青素(TMA)和总酚含量(TPC)的提取工艺优化(gydF4y2Ba藤黄属植物mangostanagydF4y2Ba船体使用超声波处理。作物学报,2013;50:1-7。gydF4y2Ba
- 90.gydF4y2Ba
李建军,李建军,李建军,等。pH差法测定果汁、饮料、天然着色剂和葡萄酒中总单体花青素含量的研究。[J]中国生物医学工程学报,2005;33(5):1269 - 1278。gydF4y2Ba
- 91.gydF4y2Ba
Duursma RA。Plantecophys -一个用于分析和模拟叶片气体交换数据的R包。科学通报,2015;10(11):e0143346。gydF4y2Ba
- 92.gydF4y2Ba
Sawada Y, Nakabayashi R, Yamada Y, Suzuki M, Sato M, Sakata A,等。RIKEN植物化学物质串联质谱数据库(ReSpect):植物特异性MS/MS-based数据资源和数据库。植物化学。2012;82:38-45。gydF4y2Ba
- 93.gydF4y2Ba
李建军,李建军,李建军,等。植物组蛋白修饰基因的克隆与分析。地理学报,2005;2(3):213-8。gydF4y2Ba
致谢gydF4y2Ba
作者感谢Justin Renaud博士对LCMS和GCMS的帮助。gydF4y2Ba
资金gydF4y2Ba
这项研究是由加拿大农业和农业食品部以及加拿大自然科学与工程研究委员会向阿赫大学提供的赠款资助的。资助机构在研究的设计中没有任何作用;收集、分析和解释数据;在写手稿的时候。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
BAF和MA开发材料;BAF进行实验;SEK和AH监督项目;BAF和AH设计研究;BAF、MA、MYG、SEK、AH撰写、修改、审定稿件。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
这些要求不适用于当前的手稿。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们没有竞争利益。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:gydF4y2Ba
表S1。gydF4y2Ba所用引物及其核苷酸序列。gydF4y2Ba
附加文件2:gydF4y2Ba
表S2。gydF4y2Ba基于lcms的干旱胁迫紫花苜蓿代谢物谱。gydF4y2Ba表S3gydF4y2Ba干旱胁迫下紫花苜蓿植株gcms的相对代谢物丰度gydF4y2Ba表S4gydF4y2BaChIP试验中使用的缓冲液及其成分。gydF4y2Ba表S5.1gydF4y2Ba方差分析,ANOVA,gydF4y2BaPgydF4y2BamiR156OE基因型和EV植物表型和生理反应数据的价值。gydF4y2Ba表S5.2gydF4y2BaSPL13RNAi基因型和EV植物表型、生理和代谢物应答数据的方差、方差分析和P值分析。gydF4y2Ba表S5.3gydF4y2BaWD40-1OE、WD40-1RNAi和野生型植物表型和生理反应数据的方差分析、方差分析和P值分析。gydF4y2Ba表S5.4gydF4y2Ba基于lcms的miR156OE基因型和EV苜蓿代谢物分析数据的方差、方差分析和P值分析。gydF4y2Ba表S5.5gydF4y2Ba基于gcms的miR156OE基因型和EV苜蓿代谢物谱分析数据的方差、方差分析和P值(P > F)分析。gydF4y2Ba表S5.6gydF4y2BamiR156OE基因型和EV苜蓿植株qRT-PCR转录物水平的方差分析、方差分析和P值分析。gydF4y2Ba表S5.7gydF4y2BaSPL13RNAi基因型和EV苜蓿植株中基于qRT-PCR的转录物水平的方差、方差分析和P值分析。gydF4y2Ba表S5.8gydF4y2Bap35S:SPL13-GFP基因型和野生型苜蓿中ChIP-qPCR转录物水平的方差分析、方差分析和P值分析。gydF4y2Ba表S5.9gydF4y2BaWD40-1RNAi沉默植物和WD40-1RNAi过表达植物中基于qRT-PCR的转录物水平的方差、方差分析和P值分析。gydF4y2Ba图S1gydF4y2Ba干旱胁迫下miR156OE植株的茎色发育gydF4y2Ba图S2gydF4y2Baq-PCR扩增序列比对gydF4y2Ba紫花苜蓿gydF4y2Ba与他们的同行在gydF4y2BaMedicago truncatula。gydF4y2Ba图S3gydF4y2Ba紫花苜蓿启动子序列gydF4y2BaDIHYDROFLAVONOL-4-REDUCTASE (DFR)gydF4y2Ba含有SBD结合元件的基因。gydF4y2Ba图S4gydF4y2Ba紫花苜蓿核苷酸序列gydF4y2BaWD40-1gydF4y2Ba启动子区域。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),它允许在任何媒体上不受限制地使用、分发和复制,前提是您要适当地注明原作者和来源,提供到知识共享许可协议的链接,并注明是否进行了修改。创作共用公共领域免责声明(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Feyissa, b.a., Arshad, M., Gruber, M.Y.gydF4y2Baet al。gydF4y2Ba两者之间的相互作用gydF4y2BamiR156 / SPL13gydF4y2Ba和gydF4y2BaDFR / WD40-1gydF4y2Ba调控紫花苜蓿的耐旱性。gydF4y2BaBMC Plant BiolgydF4y2Ba19日,gydF4y2Ba434(2019)。https://doi.org/10.1186/s12870-019-2059-5gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-019-2059-5gydF4y2Ba
关键字gydF4y2Ba
- 紫花苜蓿gydF4y2Ba
- 干旱gydF4y2Ba
- 微gydF4y2Ba
- miR156gydF4y2Ba
- 鳞片-启动子结合蛋白样蛋白gydF4y2Ba
- WD40-1gydF4y2Ba