- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
Oligo-Painting和Gish揭示了减数分裂染色体偏见并增加了合成的交通型倍增物中的减数分裂稳定性gydF4y2BaCucumisgydF4y2Ba×gydF4y2BahytivusgydF4y2Ba与dysploid亲本核型gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba19gydF4y2Ba文章编号:gydF4y2Ba471gydF4y2Ba(gydF4y2Ba2019gydF4y2Ba)gydF4y2Ba
抽象的gydF4y2Ba
背景gydF4y2Ba
新形成的异源多倍体减数分裂经常遇到由分化和杂交基因组合并引起的扰动。然而,对具有异源多倍体的异源多倍体的减数分裂特性尚未进行详细的研究。的异源四倍体gydF4y2BaCucumisgydF4y2Ba×gydF4y2BahytivusgydF4y2Ba(HHCC, 2n = 38)来自种间杂交gydF4y2Bac .巨大成功gydF4y2Ba(CC, 2n = 14)和gydF4y2Bac . hystrixgydF4y2Ba(HH, 2n = 24),然后染色体加倍。本研究结果为研究异源多倍体的减数分裂特性提供了良好的机会。gydF4y2Ba
结果gydF4y2Ba
在本文中,我们描述了5条染色体(C5, C7, H1, H9和H10)和两个基因组的减数分裂特性gydF4y2BaC。gydF4y2Ba×gydF4y2BahytivusgydF4y2Ba通过寡绘画和原位杂交基因组(GISH)(第4和第14近亲家庭)。我们发现,被八和4日和14日36种植物的基础上C5-和C7-寡绘画,以及可能的细胞学证据的染色体核型染色体上C2和一个14个人的C4检测1)只有两个携带C5-寡信号易位是在第4代的减数分裂观察到2)个体染色体具有对于F中同源配对和单价形成偏见gydF4y2Ba1gydF4y2Ba杂交和同种异体情况;3)在三种缺点F中观察到广泛的H-染色体自动分配(例如,H-H,25.5%PMC)gydF4y2Ba1gydF4y2Ba杂交,而未观察到c染色体自合配对(如C-C);4)两个亚基因组的减数分裂特性在异源四倍体中存在显著偏差:h亚基因组的单价和染色体滞后频率高于c亚基因组;和5)增加减数分裂的稳定性gydF4y2Ba14gydF4y2Ba一代与s相比gydF4y2Ba4gydF4y2Ba一代,包括同步减数分裂行为,减少单价和染色体滞后的事件。gydF4y2Ba
结论gydF4y2Ba
这些结果表明,两个亚基因组的减数分裂行为对种间杂交和异源多倍体化有显著的偏差,亚基因组减数分裂行为的协调是近年来减数分裂进化的一个关键课题gydF4y2BaC。gydF4y2Ba×gydF4y2BahytivusgydF4y2Ba.本研究有助于阐明初生异源多倍体与异源多倍体亲本核型的减数分裂特性和进化。gydF4y2Ba
背景gydF4y2Ba
由于两个或多个发散和杂交基因组的合并,所以杂交杂交和全多聚重现常常导致“基因组休克”导致快速遗传和表观遗传变化的变化[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba].新形成的异源多倍体减数分裂异常,作为异源多倍体发生的直接后果,会导致广泛的染色体配对异常、染色体分离不平衡和核型变异[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba].细胞遗传学研究表明,不同的亚因子具有不同的减数行为稳定性,并且个体染色体具有染色体损失和/或增益的偏差[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].在不同的多倍体物种中,减数分裂不稳定性、基因组结构和遗传/表观遗传变化的程度可能存在很大差异,这表明这些变化取决于亲本物种的起源和进化差异[gydF4y2Ba10gydF4y2Ba].迄今为止,在基因组变异和进化减数分裂大多数研究是在新生的异源多倍体进行与类似的亚基因组核型,如相同或接近的亚基因组染色体数目[gydF4y2Ba11gydF4y2Ba].然而,合成的异源多倍体与dysploid亲本核型的关注较少。gydF4y2Ba
分子细胞遗传学是研究多倍体基因组进化的必要手段,可以直观地看到基因组的动态变化。最重要的是,基于荧光原位杂交(fluorescence in situ hybridization, FISH)的染色体绘制已经被证实是识别染色体和研究进化过程中染色体重排的有力工具[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba].然而,由于复杂的染色体共同性和缺乏合适的探针,特别是在种间杂交种和异源多倍体中,基于染色体绘制的染色体识别和减数分裂行为跟踪问题一直没有得到充分的探讨。植物全基因组测序项目的发展和DNA合成技术的进步为植物染色体绘制探针的开发提供了新的思路。基于单拷贝序列的染色体绘制已经发展并应用于黄瓜、土豆、玉米和杨树的单个染色体鉴定、染色体配对跟踪和重排检测[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba].这种方法极大地方便了同源染色体的鉴定,染色体异常的诊断,以及种间杂交和异源多倍体配对行为的跟踪。gydF4y2Ba
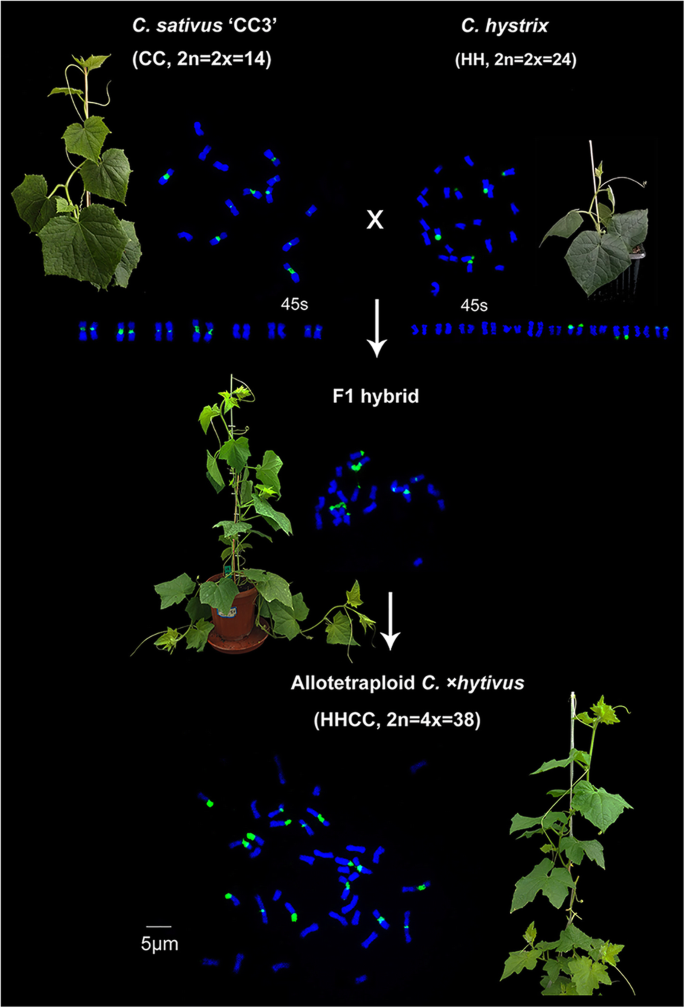
的异源四倍体gydF4y2BaC。gydF4y2Ba×gydF4y2BahytivusgydF4y2Ba陈剑飞、陈志强、陈志强。(HHCC, 2n = 4x = 38)是通过黄瓜(gydF4y2Bac .巨大成功gydF4y2BaL. '北京结头',CC, 2n = 2x = 14)及其姊妹种gydF4y2Bac . hystrixgydF4y2Ba(HH, 2n = 2x = 24)接着染色体加倍[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba(图。gydF4y2Ba1gydF4y2Ba).像其他新形成的异源多倍体一样,异源四倍体gydF4y2BaC。gydF4y2Ba×gydF4y2BahytivusgydF4y2Ba显示出快速的遗传变化和广泛的减数分裂不稳定性[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba].黄瓜和gydF4y2Bac . hystrixgydF4y2Ba是由一个共同的祖先种通过减少异倍性(gydF4y2BangydF4y2Ba= 12gydF4y2BangydF4y2Ba= 7)大约460万年前[gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba].不同的进化命运导致了黄瓜和黄瓜在核型、遗传学、细胞学特征和特异性状上的差异gydF4y2Bac . hystrixgydF4y2Ba.种间杂交种和异源四倍体gydF4y2BaC。gydF4y2Ba×gydF4y2BahytivusgydF4y2Ba独特的亚基因组核型为揭示亲本物种与具有类似亚基因组核型的新异源多倍体之间的遗传关系,确定合成的异源四倍体提供了新的手段gydF4y2BaC。gydF4y2Ba×gydF4y2BahytivusgydF4y2Ba显示新的减数分裂特性,并阐明如何实现稳定的减数分裂。gydF4y2Ba
我们从黄瓜5号染色体(C5)和7号染色体(C7)中建立了两个寡聚探针库,用于识别同源染色体、检测染色体重排和跟踪单个染色体的减数分裂配对gydF4y2Ba1gydF4y2Ba杂种及其衍生的异源四倍体。分析了其减数分裂特性gydF4y2Ba1gydF4y2Ba混血儿和两代不同的gydF4y2BaC。gydF4y2Ba×gydF4y2BahytivusgydF4y2Ba.单一染色体的减数分裂行为在同源配对和单级形成中具有显着差异。这些染色体的减数分裂行为(C5,H9,H10和C7,H1)gydF4y2Ba14gydF4y2Ba在给定染色体上没有广泛的染色体重组的情况下,生成得到了改进。通过GISH实验,研究了SgydF4y2Ba4gydF4y2Ba和SgydF4y2Ba14gydF4y2Ba天生的家庭。两个亚基因组之间存在减数分裂行为偏差gydF4y2Ba4gydF4y2Ba产生,尤指单价形成,染色体滞后和异步减数分裂节律。自花授粉10代后,SgydF4y2Ba14gydF4y2Ba一代,包括同步减数分裂,增加正常的二价和滞后染色体。此外,在F中观察到许多高循环染色剂的H-染色体配对gydF4y2Ba1gydF4y2Ba杂交种。给出明确的亲本遗传背景中,合成的异源四倍体gydF4y2BaC。gydF4y2Ba×gydF4y2BahytivusgydF4y2Ba可以作为一个独特的追溯系统来探索具有不同亲本核型的异源多倍体的异源多倍体化和减数分裂进化。gydF4y2Ba
结果gydF4y2Ba
单个染色体的鉴定使用寡聚画gydF4y2Ba
研究种类杂交和同种异体中的个体染色体的减数分子行为gydF4y2BaC。gydF4y2Ba×gydF4y2BahytivusgydF4y2Ba,我们基于黄瓜基因组建立了两个C5和C7寡聚探针库(见材料和方法)。两种涂层探针的平均寡聚体密度分别为0.86 (C5)和1.32 (C7)每千碱基gydF4y2Ba1gydF4y2Ba:图S2)。正如预期的那样,这两种探针在黄瓜有丝分裂中期和减数分裂粗线染色体上产生了明亮和几乎一致的FISH信号(图。gydF4y2Ba2gydF4y2Baa,b)。在任何其他染色体上检测到不检测到额外的寡头鱼信号(图。gydF4y2Ba2gydF4y2Bac)中,这表明这两种探针是高度特异性的C5和C7。没有关于C5和C7(图6的粗线期染色体一个明确的和大信号间隙。gydF4y2Ba2gydF4y2Bad),包含过滤过的着丝粒区域和45s rDNA位点。gydF4y2Ba
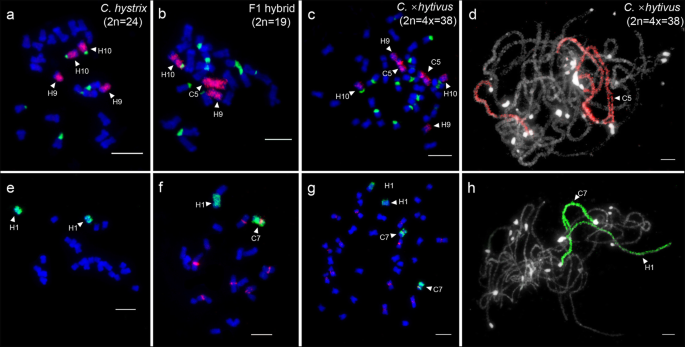
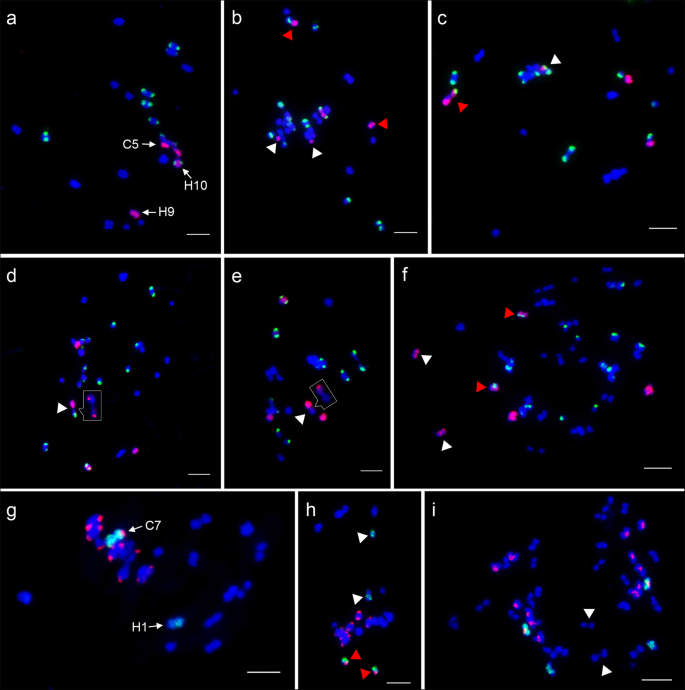
的homoeologous chromosomes of C5 and C7 were identified by C5- and C7-oligo probes, Type III and 45 s rDNA probes at mitosis metaphase ofc . hystrixgydF4y2BaFgydF4y2Ba1gydF4y2Ba杂交和同种异体一体化gydF4y2BaC。gydF4y2Ba×gydF4y2BahytivusgydF4y2Ba(无花果。gydF4y2Ba3.gydF4y2Ba).C5-oligo探针的Oligo-FISH信号在两个探针上被明确检测到gydF4y2Bac . hystrixgydF4y2Ba染色体,9(H9)和10(H10),其被寡聚鱼强度和位于H10的蠕虫熵区域上的45秒信号区别(图。gydF4y2Ba3.gydF4y2BaA, b, c) [gydF4y2Ba11gydF4y2Ba,gydF4y2Ba25gydF4y2Ba].的gydF4y2Bac . hystrixgydF4y2Ba1号染色体(H1)由c7寡聚探针绘制,由黄瓜特异的III型着丝粒探针区分(图)。gydF4y2Ba3.gydF4y2Bae, f, g)。然后,这两个寡聚探针与SgydF4y2Ba14gydF4y2Ba生成gydF4y2BaC。gydF4y2Ba×gydF4y2BahytivusgydF4y2Ba(无花果。gydF4y2Ba3.gydF4y2Bad, h).在减数分裂的粗线期染色体上未观察到明确的信号间隙。因此,这些染色体绘制模式可以快速识别F1杂种和异源四倍体中C5、C7、H1、H9、H10的单个染色体,诊断这些染色体的核型变异和追踪这些染色体的减数分裂配对gydF4y2BaC。gydF4y2Ba×gydF4y2BahytivusgydF4y2Ba.gydF4y2Ba
C5和C7的同源染色体鉴定gydF4y2Bac . hystrixgydF4y2BaFgydF4y2Ba1gydF4y2Ba杂交和同种异体一体化gydF4y2BaC。gydF4y2Ba×gydF4y2BahytivusgydF4y2Ba.gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba用C5-oligo探针(红色)和45s rDNA探针(绿色)绘制同源染色体H9和H10gydF4y2Bac . hystrixgydF4y2BaFgydF4y2Ba1gydF4y2Ba杂交和同种异体一体化gydF4y2BaC。gydF4y2Ba×gydF4y2BahytivusgydF4y2Ba,分别。gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba使用C7-oligo探针(绿色)和Type III探针(红色)绘制同源染色体H1gydF4y2Bac . hystrixgydF4y2BaFgydF4y2Ba1gydF4y2Ba杂交和同种异体一体化gydF4y2BaC。gydF4y2Ba×gydF4y2BahytivusgydF4y2Ba,分别。gydF4y2BadgydF4y2Ba单个染色体在减数分裂粗线上使用c5寡聚探针(红色)。gydF4y2BahgydF4y2Ba使用c7寡聚探针在减数分裂粗线期上绘制单个染色体(绿色)。5 μmgydF4y2Ba
同源染色体配对和F中autosyndetic配对gydF4y2Ba1gydF4y2Ba混合动力gydF4y2Ba
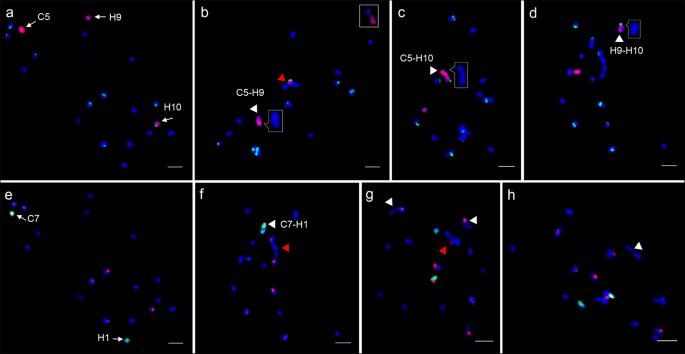
种间杂交种通过对减数分裂染色体配对的评价,为研究亲本染色体间的遗传关系提供了一条新的途径。基于上述oligo-FISH模式,我们研究了C5和C7及其同源染色体在种间杂交后的减数分裂配对(图。gydF4y2Ba4gydF4y2Ba).我们分析了132和106个在减数分裂中期(MI)分离良好的pmcgydF4y2Ba1gydF4y2Ba利用C5和c7寡聚探针分别跟踪植株的染色体配对gydF4y2Ba1gydF4y2Ba).在74个(56.1%)pmc中,C5, H9和H10完全未配对为单价。gydF4y2Ba4gydF4y2Ba一种)。我们发现30(22.7%)PMC患者覆盖了C5和H9的差关MOMIC比例(图。gydF4y2Ba4gydF4y2Bab)和17(12.9%)的PMC窝藏C5和H10(图的二价体。gydF4y2Ba4gydF4y2Bac).在87个(82.1%)pmc中,C7和H1作为单价完全不配对(图。gydF4y2Ba4gydF4y2Bae)。C7和H1的二价体在19(17.9%)的PMC被发现(图gydF4y2Ba4gydF4y2Baf,白色箭头)。同样,在45个(42.5%)pmc中检测到1至3个基因组间二价体(图)。gydF4y2Ba4gydF4y2Bag,白色箭头)。在一个和八个PMC中也检测到四肢级和三价(图。gydF4y2Ba4gydF4y2BaF g,红色箭头)。gydF4y2Ba
F . MI pmc个体染色体配对的追踪gydF4y2Ba1gydF4y2Ba混合动力车。gydF4y2Ba模拟gydF4y2Ba通过C5寡聚体(红色)和45S rDNA探针(绿色)跟踪C5, H9和H10染色体的配对行为。gydF4y2Ba一个gydF4y2Ba染色体C5, H9和H10为单价体。gydF4y2BabgydF4y2BaC5和H9(白色箭头)的同种耦合配对。盒子中显示了与另一种染色体的H9的配对。H10与另一种染色体(红色箭头)配对。gydF4y2BacgydF4y2BaC5和H10(白色箭头)的同种型配对。gydF4y2BadgydF4y2BaH9和H10染色体错配或连在一起形成自联配对(白色箭头)。在没有FISH信号的情况下,将所有的配对配置进行insets放大。gydF4y2BaE-HgydF4y2BaC7- oligo(绿色)跟踪的染色体C7和H1的配对行为和III型探针(红色)。gydF4y2BaegydF4y2Ba染色体C7和H1为单价体。gydF4y2BafgydF4y2BaC7和H1(白色箭头)的同种耦合配对,C-H-H-C骨髓组体四价(红色箭头)。gydF4y2BaggydF4y2Ba两个基因组间二价(白色箭头)和一个H-C-H三价(红色箭头)。gydF4y2BahgydF4y2Ba两条h染色体形成了一个自合配对(白色箭头)。5 μmgydF4y2Ba
有趣的是,我们发现,10(7.6%)的PMC包含H9和H10(图的autosyndetic配对。gydF4y2Ba4gydF4y2Bad,插图)。在一个PMC中检测H9和另一种染色体的配对(图。gydF4y2Ba4gydF4y2Ba而在两个pmc中发现了H10与另一条染色体的配对(图。gydF4y2Ba4gydF4y2Bab,红色箭头)。在27个(25.5%)pmc中,两条h染色体(来自h基因组的染色体)以二价结构自合配对(图)。gydF4y2Ba4gydF4y2BaH)。然而,在调查的106pps中未观察到C-染色体的自染素对。考虑到整个亚基因组,H-亚基组显示出更高的自动对准频率。这些结果表明,H-基因组的减数分子行为更容易受到杂交的休克而不是C-基因组。gydF4y2Ba
基于寡聚涂层检测到两个易位和可能的细胞学证据gydF4y2Ba
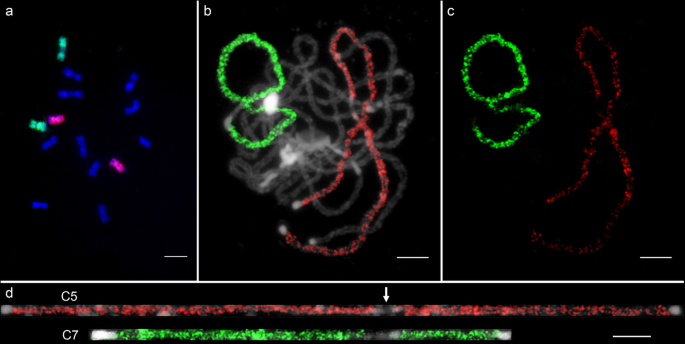
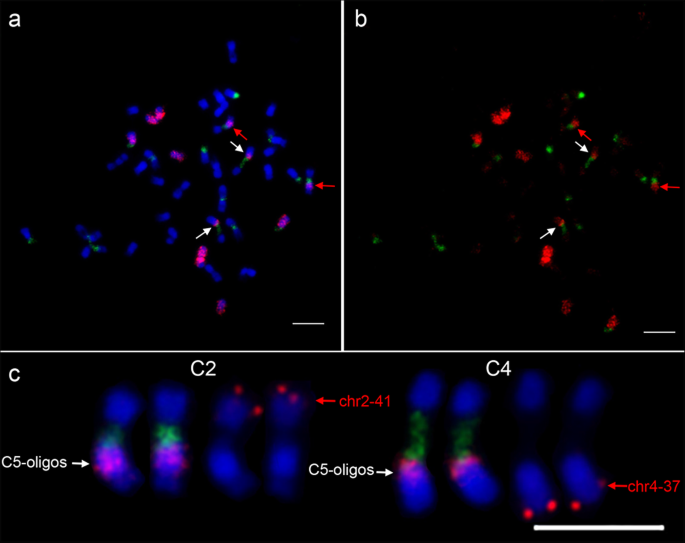
在我们以前的研究中,在来自S的15个个体中未检测到非植物倍性或大规模染色体重排gydF4y2Ba13gydF4y2Ba代的异源四倍体gydF4y2BaC。gydF4y2Ba×gydF4y2BahytivusgydF4y2Ba根据fosmid-FISH测试结果[gydF4y2Ba11gydF4y2Ba].这一结果可能归因于很少的个体调查,和fosmid克隆没有覆盖潜在的染色体重排区域。我们通过8个S的C5和c7寡聚喷涂分析了染色体变异gydF4y2Ba4gydF4y2Ba和36个年代gydF4y2Ba14gydF4y2BaAllotetraploid个人。除了一个s之外,任何个人都没有观察到可见的染色体重排事件gydF4y2Ba14gydF4y2Ba在植株中,检测到两次大的易位(图。gydF4y2Ba5gydF4y2Ba,附加文件gydF4y2Ba1gydF4y2Ba:图S3)。在两对带有大45s rDNA位点的染色体的长臂和着丝点附近检测到额外的c5寡聚体信号(图)。gydF4y2Ba5gydF4y2Baa,b)。根据核型gydF4y2BaC。gydF4y2Ba×gydF4y2BahytivusgydF4y2Ba[gydF4y2Ba11gydF4y2Ba,我们选择了两个fosmid克隆(chr2-41和chr4-37)来识别两条带有额外c5寡聚信号的染色体(图。gydF4y2Ba5gydF4y2Bac).我们没有检测到其他染色体上的额外的C7寡聚信号,这表明在被分析的植物中,C7和/或H1染色体没有经历与其他染色体的非同源重排。gydF4y2Ba
携带C5-Oligo信号的两个易位是基于ONIGO绘画在一个s中的gydF4y2Ba14gydF4y2Ba个人gydF4y2BaC。gydF4y2Ba×gydF4y2BahytivusgydF4y2Ba.gydF4y2Ba一个gydF4y2Ba额外的c5寡聚体信号(红色)在两个携带大的45S rDNA探针(绿色)(白色箭头)的染色体上检测到。gydF4y2BabgydF4y2BaFISH信号进行数字化从分离(gydF4y2Ba一个gydF4y2Ba).gydF4y2BacgydF4y2Ba用黄瓜fosmid克隆(chr2-41和chr4-37)鉴定了两条具有额外c5寡聚体信号的染色体(C2和C4)。5 μmgydF4y2Ba
值得注意的是,在S的两个pmc中观察到C5和其他染色体的错配gydF4y2Ba4gydF4y2Ba一代(图。gydF4y2Ba6gydF4y2Bad, e).我们使用III型探针进行了连续的FISH实验来识别这两条染色体。FISH结果显示,具有强45s rDNA位点的染色体属于c亚基因组(图2)。gydF4y2Ba6gydF4y2Bad,插图),另一条染色体属于h亚基因组(图。gydF4y2Ba6gydF4y2Bae,插图)。这些不正常的配对可能会导致潜在的染色体重排,而这种重排可以稳定地遗传给后代。在异源四倍体中,3个强的45 s rDNA位点位于3条c亚基因组染色体C1、C2和C4上gydF4y2BaC.×休息五gydF4y2Ba[gydF4y2Ba11gydF4y2Ba].其中一个染色体的可能形成与C5一个错配的配置和引起染色体易位,其在一个提供的S可能的证据两个易位gydF4y2Ba14gydF4y2Ba个人(图。gydF4y2Ba5gydF4y2Ba).gydF4y2Ba
个体染色体减数分裂行为的偏差gydF4y2Ba
探讨异源四倍体减数分裂I期染色体间可能的减数分裂配对差异gydF4y2BaC。gydF4y2Ba×gydF4y2BahytivusgydF4y2Ba,我们在减数分裂粗线期、MI和后期I (AI)对减数分裂染色体进行寡聚染色。我们分析了76个pmc的染色体配对gydF4y2Ba4gydF4y2Ba一代(附加文件gydF4y2Ba1gydF4y2Ba:图S4)。C5和H9 / H10部分在24(31.6%)PMC中配对(附加文件gydF4y2Ba1gydF4y2Ba图S4a, b, c)。完全未配对的C7染色体串仅在三个pmc中检测到(附加文件gydF4y2Ba1gydF4y2Ba:图S4d), 5例(6.6%)pmc中C7和H1的长臂未配对(附加文件)gydF4y2Ba1gydF4y2Ba:图S4e, g)和6个(8.7%)pmc(附加文件gydF4y2Ba1gydF4y2Ba:图S4f)。然而,C7和H1部分配对或完全配对并没有在所有pmc中观察到,尽管C7和H1高度同源。此外,我们在S的pmc中观察到大量的未配对的染色体片段和单染色体串gydF4y2Ba4gydF4y2Ba一代(附加文件gydF4y2Ba1gydF4y2Ba:图S4,红色箭头),这可能导致潜在的染色体重排事件和单价。gydF4y2Ba
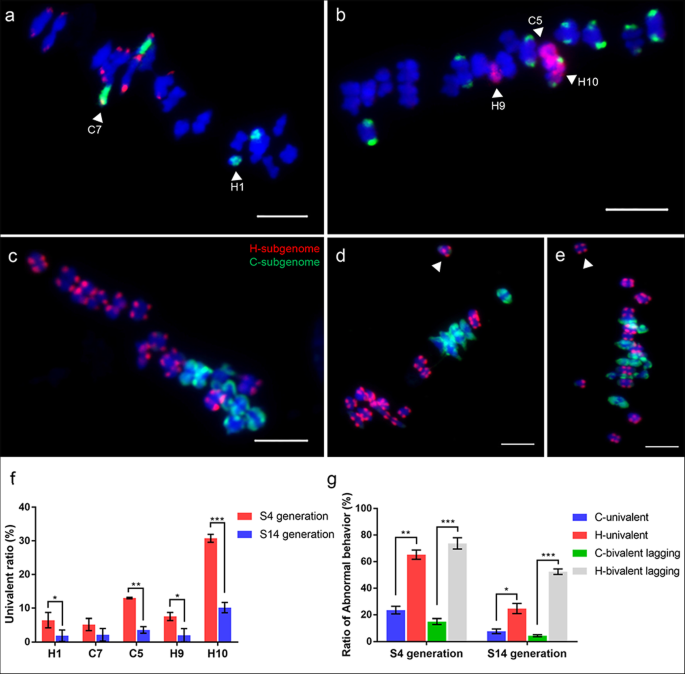
我们在8秒内检查了Mi和MeIens的AI的五种染色体(C5,H9,H10和C7,H1)的剖析行为gydF4y2Ba4gydF4y2Ba个人(图。gydF4y2Ba6gydF4y2Ba).分析了总共123和112次分辨的MI PMC以分别追踪C5,H9,H10和C7,H1的减数分裂判航行为(表gydF4y2Ba1gydF4y2Ba).结果表明,61%的PMC是C5,H9和H10的独占同源偏差者(图。gydF4y2Ba6gydF4y2Baa), 90.2%的pmc中含有C7和H1的同源二价(图1)。gydF4y2Ba6gydF4y2Bag)。然后,我们计算了5条染色体在MI处的单价和同源配对的频率(表gydF4y2Ba1gydF4y2Ba).我们发现这些染色体在单价和同源配对的倾向上有明显的差异(图。gydF4y2Ba8gydF4y2Baf和表gydF4y2Ba1gydF4y2Ba).5条染色体中,H10的单价形成频率最高,而C7和H1的单价形成频率最低。11例(8.94%)PMCs中观察到C5和H10的同源配对(图。gydF4y2Ba6gydF4y2BaC)。然而,在所有PMC中未观察到C5 / H9和C7 / H1的同种型配对作为二价或多价。因此,这些染色体是用于同种型配对和单级形成的偏差。在AI下检测到H9和H10的不等偏析(图。gydF4y2Ba6gydF4y2Baf)。同样,在AI处也检测到滞后h染色体(图。gydF4y2Ba6gydF4y2Ba一世)。gydF4y2Ba
追踪S4代减数分裂中期I和后期I染色体的减数分裂行为。gydF4y2Ba一个gydF4y2Ba-gydF4y2BafgydF4y2BaC5-oligo探针(红色)和45s rDNA探针(绿色)跟踪了C5、H9和H10的减数分裂行为。gydF4y2Ba一个gydF4y2Ba三种独家同源二价C5,H9和H10。gydF4y2BabgydF4y2Ba两个C5单价(红色箭头)和两个H9单价(白色箭头)。gydF4y2BacgydF4y2BaC5和H10的同源配对(红色箭头)和一个H10单价(白色箭头)。gydF4y2BadgydF4y2BaC5与一个45 s rDNA大的c染色体形成异常的二价结构。gydF4y2BaegydF4y2Ba该C5形成与一个H-染色体异常的二价结构。两个染色体的身份可以通过用III型探针(红色)(插图)组合来诊断。gydF4y2BafgydF4y2BaH9和H10在Ahaphase I下是不等的偏析。gydF4y2Ba胃肠道gydF4y2Ba通过C7寡聚探针(绿色)和Type III探针(红色)追踪C7和H1的减数分裂行为。gydF4y2BaggydF4y2BaC7和H1的两个单独的同源二价体。gydF4y2BahgydF4y2Ba两个C7单价(红色箭头)和两个H1单价(白色箭头)。gydF4y2Ba我gydF4y2Ba两个h染色体在后期I滞后(白色箭头)。5 μmgydF4y2Ba
亚基因组的减数分裂染色体偏差导致异源四倍体的低育性gydF4y2BaC.×休息五gydF4y2Ba
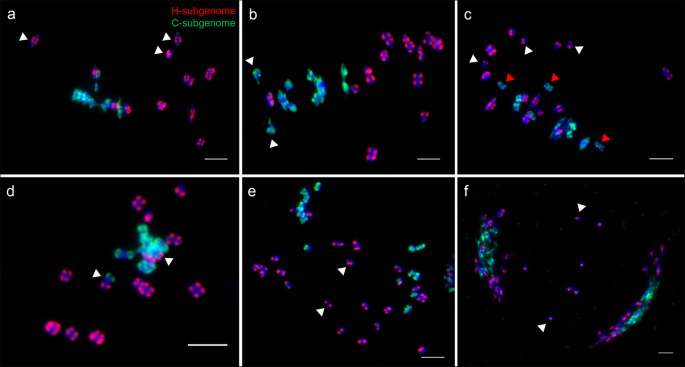
我们研究了8个S的MI和AI pmc中两个亚基因组之间减数分裂行为的可能差异gydF4y2Ba4gydF4y2Ba十年代gydF4y2Ba14gydF4y2Ba通过GISH实验代(表gydF4y2Ba2gydF4y2Ba).我们观察到S的许多pmcgydF4y2Ba4gydF4y2Ba产生明显异常,包括MI时出现的非同步减数分裂(图。gydF4y2Ba7gydF4y2Baa, b),单价(图。gydF4y2Ba7gydF4y2Bac)、基因组间配对(图。gydF4y2Ba7gydF4y2BaD,附加文件gydF4y2Ba1gydF4y2Ba:图S5),并在AI / TI(滞后染色体图。gydF4y2Ba7gydF4y2Bae, f)。正如预期的那样,大多数染色体在每个PMC中仍然保持二价构型。值得注意的是,大多数c -二价体在平伏板上可以精确而紧密地排列,而h -二价体在MI处似乎不规则地分散或落后于c -二价体(图。gydF4y2Ba6gydF4y2Bag,图。gydF4y2Ba7gydF4y2Baa).当c -二价体已经开始分离时,一些h -二价体刚刚到达赤道板(图)。gydF4y2Ba7gydF4y2Bab).此外,73.4%的MI PMCs h -二价滞后,显著高于15.4%的S - c -二价滞后PMCsgydF4y2Ba4gydF4y2Ba一代(图。gydF4y2Ba8gydF4y2BaG)。类似地,滞后的H-比例的频率也显着高于S中的C-比例的频率gydF4y2Ba14gydF4y2Ba一代(图。gydF4y2Ba8gydF4y2BaG)。这些结果表明,2个subgenomes的减数分裂显著异步;即,H-亚基因组需要更多时间来完成比在一个核的C-亚基因组的减数分裂过程。gydF4y2Ba
SgydF4y2Ba4gydF4y2Ba代的异源四倍体gydF4y2BaC.×休息五gydF4y2Ba.gydF4y2Ba一个gydF4y2Ba基因组原位杂交(GISH)图像显示在中期I, h亚基因组(红色)和c亚基因组(绿色)有19个同源二价体。六种h -二价落后于c -二价(白色箭头部分指示)。gydF4y2BabgydF4y2Bac -二价的析离较h -二价早(白箭头)。gydF4y2BacgydF4y2Ba6个h -单价(白色箭头部分表示)和4个c -单价(黄色箭头部分表示)。gydF4y2BadgydF4y2Ba两个基因组间二价体(白色箭头)。gydF4y2BaegydF4y2Ba和gydF4y2BafgydF4y2Ba两个落后的h染色体在后期I和末期I的例子(白色箭头)。5 μmgydF4y2Ba
H-亚基组显示比S中的C型亚群明显高于单价形成和滞后频率gydF4y2Ba4gydF4y2Ba和SgydF4y2Ba14gydF4y2Ba代(表gydF4y2Ba2gydF4y2Ba).结果表明,两个亚基因组的减数分裂倾向有显著差异。h亚基因组的减数分裂行为对异源多倍体更敏感,这最终导致了h染色体在随后阶段的广泛滞后(见表)gydF4y2Ba2gydF4y2Ba, 无花果。gydF4y2Ba7gydF4y2Bae, f).染色体滞后导致雄性配子染色体不完整,导致异源四倍体花粉育性低gydF4y2BaC.×休息五gydF4y2Ba.总之,两种亚因素的减数分裂行为偏差是同种异体四倍体生育率低的主要因素gydF4y2BaC.×休息五gydF4y2Ba.gydF4y2Ba
通过两个亚基因组之间的和谐增加减数分裂的稳定性gydF4y2Ba
我们检测了C5、H9、H10和C7、H1在137和104个分辨良好的PMCs中的减数分裂行为gydF4y2Ba14gydF4y2Ba基于C5/C7寡聚体绘制的无非同源染色体重排的植物(见表1)gydF4y2Ba1gydF4y2Ba).与s相比gydF4y2Ba4gydF4y2Ba在S中,5条染色体的同源二价的频率显著提高gydF4y2Ba14gydF4y2Ba代(表gydF4y2Ba1gydF4y2Ba, 无花果。gydF4y2Ba8gydF4y2Ba相应的,H1、C5、H9和H10的单价频率均显著低于SgydF4y2Ba4gydF4y2Ba一代(图。gydF4y2Ba8gydF4y2Baf)。在5条染色体中,H10染色体的单价频率仍然最高(图5)。gydF4y2Ba8gydF4y2Baf). C7在S之间的单价频率gydF4y2Ba4gydF4y2Ba和SgydF4y2Ba14gydF4y2Ba在统计学上是不显著的(图。gydF4y2Ba8gydF4y2Baf).这些结果表明,在给定染色体上没有广泛的染色体重组时,这些染色体的减数分裂稳定性得到了改善。gydF4y2Ba
在S中中期我减数分裂行为gydF4y2Ba14gydF4y2Ba染色体/亚基因组在中期对单价和滞后的二价的偏倚。gydF4y2Ba一个gydF4y2BaS中C7和H1的两个同源二价体gydF4y2Ba14gydF4y2Ba一代。gydF4y2BabgydF4y2BaS .中中期C5, H9和H10的三个同源二价体gydF4y2Ba14gydF4y2Ba一代。gydF4y2BacgydF4y2BaGISH图像显示中期I中的两种亚因素的正常性行为行为gydF4y2Ba14gydF4y2Ba一代。gydF4y2BadgydF4y2Ba和gydF4y2BaegydF4y2Ba只有一个h二价落后于其他二价,在中期I(白色箭头)没有到达赤道板。柱= 5 μm。5条染色体(H1, C7, C5, H9和H10)和亚基因组偏差导致S的MI出现单价和滞后二价gydF4y2Ba4gydF4y2Ba和SgydF4y2Ba14gydF4y2Ba通过寡酒绘画和GISH量化,并呈现在(gydF4y2BafgydF4y2Ba)和(gydF4y2BaggydF4y2Ba分别)。x轴在(gydF4y2BafgydF4y2Ba)和(gydF4y2BaggydF4y2Ba)参考五种染色体和不同的代(sgydF4y2Ba4gydF4y2Ba和SgydF4y2Ba14gydF4y2Ba),而(gydF4y2BafgydF4y2Ba)和(gydF4y2BaggydF4y2Ba)指单价和滞后二价的频率。误差条表示三个生物重复的±SD。星号表示在*,gydF4y2BapgydF4y2Ba< 0.05;**,gydF4y2BapgydF4y2Ba< 0.01;***gydF4y2BapgydF4y2Ba<0.001gydF4y2Ba
在分析的131份解析的MI PMC中gydF4y2Ba14gydF4y2Ba代,98个(74.8%)pmc中含有19个特异的同源二价体,显著高于SgydF4y2Ba4gydF4y2Ba代(表gydF4y2Ba2gydF4y2Ba).SgydF4y2Ba14gydF4y2Ba与s相比,生成显着降低gydF4y2Ba4gydF4y2Ba代(表gydF4y2Ba2gydF4y2Ba, 无花果。gydF4y2Ba8gydF4y2BaC),包括单价、基因组间配对和染色体滞后。重要的是,包含异步减数分裂的MI pmc频率在SgydF4y2Ba14gydF4y2Ba代(表gydF4y2Ba2gydF4y2Ba).在非同步减数分裂的MI pmc中,只有少数(1 ~ 3个)h -二价体尚未到达S的赤道板gydF4y2Ba14gydF4y2Ba一代(图。gydF4y2Ba8gydF4y2Bad、e),与S相比显著降低gydF4y2Ba4gydF4y2Ba用七个滞后的h -二价体生成(附加文件gydF4y2Ba1gydF4y2Ba:图S6)。结果表明,两个亚基因组在MI发生了一定程度的同步减数分裂gydF4y2Ba14gydF4y2Ba显著高于SgydF4y2Ba4gydF4y2Ba植物,但仍保持在相对较低的水平(平均值小于50%)(附加文件gydF4y2Ba1gydF4y2Ba:图S1)。这些结果表明,通过连续自交和亚基因组之间的协调,可以提高减数分裂的稳定性。gydF4y2Ba
讨论gydF4y2Ba
同源染色体的减数分裂亲和性gydF4y2Ba
评价种间杂交种的同源配对可以为同源染色体之间的亲和性提供重要信息[gydF4y2Ba26gydF4y2Ba].由于缺乏FISH技术来识别单个染色体,在种间杂交种和异源多倍体中,染色体与其潜在伴侣之间的配对偏好较少受到关注。黄瓜染色体C5来源于与H9和H10相似的推测染色体AK9和AK10(祖先核型)的融合gydF4y2Bac . hystrixgydF4y2Ba.黄瓜染色体C7和gydF4y2Bac . hystrixgydF4y2BaH1染色体是从祖先染色体AK1进化而来的。这些染色体经历了截然不同的进化命运[gydF4y2Ba25gydF4y2Ba,gydF4y2Ba27gydF4y2Ba].在分析的PMC中gydF4y2Ba1gydF4y2BaC5与H9的同源配对频率(22.7%)高于C5与H10的同源配对频率(12.9%),这可能与C5亚端粒区域与H9共线性结构有关[gydF4y2Ba25gydF4y2Ba].当一个个体染色体具有多个部分同源染色体,这些染色体可以通过优先染色体配对进行排序,因为染色体中识别亚端粒区之间优先发生[gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba].C7和H1的同源配对仅在19个(17.9%)的F的MI pmc中观察到gydF4y2Ba1gydF4y2Ba尽管C7高度保守,H1为gydF4y2Bac . hystrixgydF4y2Ba.因此,同源染色体中的配对亲和力可归因于在进化期间累积染色体结构的变化。gydF4y2Ba
有趣的是,7.6%的pmc包含H9和H10的自结合配对在F中被观察到gydF4y2Ba1gydF4y2Ba混合动力车。H9和H10分别在一个和两个pmc中与其他h染色体配对。在所有pmc中均未观察到H1与其他h染色体配对。一个基因组内的自合配对暗示了所涉及染色体之间的节段同源性和/或共同起源[gydF4y2Ba30.gydF4y2Ba].结果表明,H9和H10具有一定的减数分裂亲和力,而H1与其他h染色体的减数分裂亲和力较低。这些染色体的减数分裂行为对种间杂交的反应是显著不同的,这似乎与这些染色体的进化命运有关。AK9和AK10有两种截然不同的进化命运:在融合事件或形成H9和H10后进化为一条染色体(C5) [gydF4y2Ba25gydF4y2Ba].H9和H10之间的减数分子亲和力可能会增加我们对AK9和AK10的融合事件的理解。gydF4y2Ba
在两种不同世代分析的五种染色体中,分析了两种不同的同种异体四倍体gydF4y2BaC.×休息五gydF4y2Ba, H10的单价频率高于其他染色体。不对称着丝粒位置(端中心)的H10可能形成不稳定的二价,因为稳定的二价形成需要一定的臂长[gydF4y2Ba31gydF4y2Ba].未配对的H10可以干扰C5的配对,导致C5具有相对高的单价频率并与H10配对。我们的结果表明,C7,H1和H9的单价频率相对较低,NO C7-H1和C5-H9配对。这些结果表明C7,H1和H9通常可以识别同源染色体并形成稳定的二价染色剂。同种耦合配对和重组不仅归因于染色体结构,而且归因于遗传因素的相互作用,例如gydF4y2Baph值1gydF4y2Ba在Allohexaploid小麦中,gydF4y2BaPrBngydF4y2Ba在异源四倍体gydF4y2Ba芸苔属植物显著gydF4y2Ba,gydF4y2Ba通过gydF4y2Ba在异源四倍体gydF4y2Ba拟南芥suecicagydF4y2Ba[gydF4y2Ba5gydF4y2Ba].然而,配对控制基因座可能不足以确保新形成的全多倍体的独特二倍体染色体染色体配对,并且在减数分裂稳定中仍需要额外的修饰[gydF4y2Ba9gydF4y2Ba].此外,染色体凝聚的时机也影响染色体配对[gydF4y2Ba32gydF4y2Ba].gydF4y2Ba
在减数分裂染色体行为亚基因组偏见gydF4y2Ba
三种杂种和各种各样的杂种人面临着不同父母基因组之间的大规模冲突造成的许多挑战,通常被称为与两种或多种发散父母基因组的DE Novo合并相关的“基因组休克”。因为独特的进化序列形状为每个父母,产生物种特异性核型,遗传和表观遗传差异[gydF4y2Ba1gydF4y2Ba].在种间杂交种和异源多倍体中,亚基因组优势似乎是对基因组冲击有不同反应的常见结果,例如表观遗传调控、基因表达和同源交换中的亚基因组偏差[gydF4y2Ba1gydF4y2Ba].同样,亚因素的减数分子染色体行为也有偏见;例如,亚基因表现出更高的单价和染色体丢失的频率或保持相对稳定的减数行为。gydF4y2Ba
在几个中观察到来自同一基因组的染色体的自动干扰配对gydF4y2BaPaphiopedilumgydF4y2Ba和gydF4y2Ba芸苔gydF4y2Ba种间杂交(gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba].类似地,在在F观察到许多的PMC(106两局25.5%)含有H-染色体autosyndetic配对gydF4y2Ba1gydF4y2Ba混合动力车。然而,在任何两条c染色体之间均未观察到自合配对。这些结果表明,两个基因组的减数分裂配对在FgydF4y2Ba1gydF4y2Ba混合动力车。黄瓜和gydF4y2Bac . hystrixgydF4y2Ba已经通过减少异倍性的机制从一个祖先物种衍生出来(gydF4y2BangydF4y2Ba= 12gydF4y2BangydF4y2Ba= 7),导致两个基因组之间高度的进化差异[gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba].响应基因组休克的基因组变化的大小似乎与亚基组进化差异的程度相关[gydF4y2Ba1gydF4y2Ba].H-染色体的自染素对表明,H-基因组的减数分子行为可能更易于比F中的C-基因组更容易受到差异的杂交gydF4y2Ba1gydF4y2Ba混合动力车。因此,H-和c -基因组对基因组冲击或种间杂交的不同反应可能与亲本物种之间的进化差异有关。gydF4y2Ba
大量的细胞学研究表明同源二价体是异源多倍体减数分裂的主要配对结构,个别染色体/亚基因组在某些异源多倍体减数分裂行为方面存在偏差[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].在合成的六倍体小麦和小麦中观察到亚基因组间的减数分裂行为偏差gydF4y2Ba芸苔gydF4y2Ba.的d我stinct subgenome stability was B > A > C in芸苔gydF4y2Ba合成小麦六倍体的四倍体和D > A > B也就是c亚基因组gydF4y2Ba芸苔gydF4y2Ba小麦allohexaploid和b亚基因组的单价形成和染色体丢失频率最高[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].事实上,在异源四倍体中也观察到两个亚基因组之间的减数分裂行为偏差gydF4y2BaC.×休息五gydF4y2Ba,包括非同步减数分裂、单价形成和滞后染色体。减数分裂稳定性为c -亚基因组> h -亚基因组gydF4y2BaC.×休息五gydF4y2Ba中,H-亚基因组显示出更高的单价体和染色体滞后频率。然而,在某些新形成的异源多倍体,如合成异源四倍体小麦异源六倍体和[未观察到明显的异步节奏gydF4y2Ba9gydF4y2Ba,gydF4y2Ba35gydF4y2Ba],gydF4y2Ba芸苔gydF4y2Ba异源四倍体和六倍体[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba34gydF4y2Ba].亚基因组间的异步减数分裂节律,源自亲代亚基因组间减数分裂细胞周期进程的差异[gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba,这可能与亲本物种的独特核型和进化差异有关。h亚基因组需要较长的细胞周期才能完成减数分裂,是h染色体滞后频率高的主要原因gydF4y2BaCucumisgydF4y2Ba异源四倍体(gydF4y2Ba38gydF4y2Ba].只有9.9%,MI两局和两局AI的9.7%,包含intergenomic配对和C-染色体S中落后gydF4y2Ba14gydF4y2Ba分别生成。相反,55.8%的AI pmc含有滞后于S的h染色体gydF4y2Ba14gydF4y2Ba一代,表明H型亚基因的相对不稳定的减数行为主要负责同种异体四倍体的低生育率gydF4y2BaC.×休息五gydF4y2Ba.在f中,两个子组织的减数分子行为在速度下显着不同gydF4y2Ba1gydF4y2Ba混合动力和gydF4y2BaC.×休息五gydF4y2Ba,可能与核型的差异有关,两个家长物种之间的核心型,固有的细胞学特征和进化史。gydF4y2Ba
两个亚基因组的减数分裂协调是研究合成黄瓜异源四倍体减数分裂稳定性的关键gydF4y2Ba
在小麦allopolyploids中观察到广泛的染色体重新洗脱和非整倍性[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba35gydF4y2Ba],gydF4y2Ba芸苔gydF4y2Ba异源多倍体[gydF4y2Ba39gydF4y2Ba),gydF4y2BaTragopogongydF4y2Baneo-allopolyploids [gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41.gydF4y2Ba].但是,在分析的同种异体四倍体中未检测到非整倍性gydF4y2BaC.×休息五gydF4y2Ba,可能是因为含有非整倍性的Zygotes不能发展成全形状种子,然后在收集种子或选择萌发时被忽略。值得注意的是,使用基于寡核苷酸的染色体绘画来检测两个大的易位和可能的证据。然而,在该研究中未检测到C7 / H1和其他染色体的重排事件。我们的结果意味着在多倍体进化过程中,染色体重排和/或结构变化的个体染色体的电位可能不同。最近,一种嵌合基因,负责延迟叶片成熟在同种异体情况下gydF4y2BaC.×休息五gydF4y2Ba的克隆,来源于同源重组[gydF4y2Ba42.gydF4y2Ba].这个结果意味着gydF4y2BaCucumisgydF4y2Ba异源四倍体发生同源交换或重组。我们还观察到许多pmc包含基因组间配对,这是同源交换的细胞学基础gydF4y2BaCucumisgydF4y2Ba异源四倍体。利用oligo-FISH可以追踪到的野生亲缘物种中含有有益基因的重排片段和同源交换可能是通过渐渗育种转移到作物品种中。gydF4y2Ba
鉴于亚基因组对减数分裂染色体行为的偏见,如何协调两个亚基因组之间的减数分裂行为已成为异源四倍体减数分裂稳定的关键课题gydF4y2BaC.×休息五gydF4y2Ba.我们分析了5条染色体(C5, H9, H10和C7, H1)在两代中的行为,发现这些染色体的异常减数分裂行为在没有这些染色体重组的情况下得到了改善。通过持续的自交过程,包括减少单价形成、基因组间配对和染色体滞后,可以显著提高减数分裂的稳定性。最明显的证据是两个亚基因组在减数分裂的MI达到了一定程度的同步gydF4y2Ba14gydF4y2Ba一代(附加文件gydF4y2Ba1gydF4y2Ba:图S6)。与S代相比,S14代未到达赤道板的h -二价体数量显著减少gydF4y2Ba4gydF4y2Ba一代。减数分裂的稳定机制中的几个早期世代可能加速gydF4y2BaC.×休息五gydF4y2Ba,但仍需要多一时才能稳定。类似于其他新全多多百型植物植物征的情况,合成的同种异体四倍体gydF4y2BaC.×休息五gydF4y2Ba也经历了快速的遗传和表观遗传变化[gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba43.gydF4y2Ba,gydF4y2Ba44.gydF4y2Ba].这些变化奠定了基础减数分裂和谐2个subgenomes之间。这项研究的结果将提供一个有趣的案例,探索具有鲜明的亚基因组染色体核型的异源多倍体减数分裂的演变。gydF4y2Ba
结论gydF4y2Ba
本研究结果表明,oligo-FISH是一种有效的染色体鉴定、染色体变异诊断和减数分裂行为追踪技术,特别是在复杂基因组的多倍体中。在种间FgydF4y2Ba1gydF4y2Ba杂种和异源四倍体,5条染色体(C5, H9, H10和C7, H1)的同源配对和单价形成的减数分裂偏差可能与这些染色体的配对亲和力和结构有关。两个基因组在自合配对、异步减数分裂、单价形成和染色体滞后方面的减数分裂特性的差异表明,两个基因组对种间杂交和异源多倍体化的响应存在差异。这些不同的反应与两个亲本物种的核型、固有细胞学特征和进化史的差异有关。因此,协调两个亚基因组之间的差异减数分裂行为已成为异源四倍体减数分裂稳定的关键问题gydF4y2BaC.×休息五gydF4y2Ba.确实,SgydF4y2Ba14gydF4y2Ba产生,包括同步减数分裂,减少单价形成和染色体滞后。我们的分析为具有dysploid亲本核型的新生异源四倍体的减数分裂特性和减数分裂稳定性提供了新的见解。gydF4y2Ba
方法gydF4y2Ba
植物材料gydF4y2Ba
本研究使用的植物材料包括两个二倍体亲本(gydF4y2Bac .巨大成功gydF4y2Ba'cc3'和gydF4y2Bac . hystrixgydF4y2Ba),种间FgydF4y2Ba1gydF4y2Ba混合和合成的异源四倍体C.×gydF4y2BahytivusgydF4y2Ba(无花果。gydF4y2Ba1gydF4y2Ba) [gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba由南京农学院瓜类遗传与种质创新国家重点实验室提供。所有不同世代的c ×gydF4y2BahytivusgydF4y2Ba(SgydF4y2Ba3.gydF4y2Ba)近交系,从单个SgydF4y2Ba0gydF4y2BaC.×××gydF4y2BahytivusgydF4y2Ba通过自体受精。从每一代种子中随机抽取种子(> 20)进行自交育种。我们目前通过不断的自交获得了第14代。4个不同世代(第4代(SgydF4y2Ba4gydF4y2Ba)、5个8号个体(SgydF4y2Ba8gydF4y2Ba),第11位(SgydF4y2Ba11gydF4y2Ba)和36例14岁个体(SgydF4y2Ba14gydF4y2BaC. ×gydF4y2BahytivusgydF4y2Ba随机从最后一代种子组中选择用于花粉活力,核型化和分裂分析。花粉活力分析表明,S的花粉生育率gydF4y2Ba14gydF4y2Ba显著高于SgydF4y2Ba4gydF4y2Ba代,并且有高度的统计学差异显著(gydF4y2BaPgydF4y2Ba= 0.0009). Therefore, we selected all S4gydF4y2Ba和SgydF4y2Ba14gydF4y2Ba植物基于C5和C7- oligo探针进行有丝分裂分析。四fgydF4y2Ba1gydF4y2Ba, 8年代gydF4y2Ba4gydF4y2Ba十年代gydF4y2Ba14gydF4y2Ba(从36s中随机选取gydF4y2Ba14gydF4y2Ba利用oligo-FISH和GISH进行减数分裂分析(附加文件)gydF4y2Ba2gydF4y2Ba表S1)。所有材料均在南京农业大学白马教学研究基地现代农业科技园区的温室中种植。gydF4y2Ba
染色体制备gydF4y2Ba
所有材料的根尖和幼小雄性花蕾在4℃下在Carnoy的溶液中收集并固定至少1天。具体而言,8 s的根尖提示gydF4y2Ba4gydF4y2Ba和36个年代gydF4y2Ba14gydF4y2Ba单独收集个体以通过染色体绘画检测染色体变化。四f的年轻男性花蕾gydF4y2Ba1gydF4y2Ba在开花期间多次收集个体并混合在一起。八个年代gydF4y2Ba4gydF4y2Ba个人和十秒gydF4y2Ba14gydF4y2Ba每个人被分为三组。每组幼龄雄花芽分别采集多次。从每个花芽中分离出一个花药,观察pmc的发育阶段。将同一花蕾的花药收集到相应的组中进行染色体制备。染色体的制备过程如前所述[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba18gydF4y2Ba经过一些修改。固定根尖用含有4% R-10纤维素(益力多)、2%果胶酶(Sigma-Aldrich)和0.1%果胶酶(益力多)的混合酶在0.01 M柠檬酸缓冲液(pH = 4.8)中37℃消化40-60 min。收集花药,用4%纤维素R-10(益力多)、4%果胶酶(Sigma-Aldrich)和2%果胶酶(益力多)混合酶在37℃下消化50-70 min(减数分裂粗线期)和2-3 h(减数分裂中期和后期)。最后,如前所述,将这些消化后的根尖和花药涂抹在玻片上[gydF4y2Ba18gydF4y2Ba].将为鱼类和GISH实验制备具有良好染色体染色体的载玻片。gydF4y2Ba
通过胃蛋白酶处理除去细胞质以促进探针的穿透。具有良好扩展染色体将载玻片视为描述的协议[gydF4y2Ba45.gydF4y2Ba[有一些修饰:洗涤在2×SSC中的2×SSC在Coplin罐中进行3分钟,然后在37℃下用0.1mg / ml百分点(Sigma-Aldrich)用0.1mg / ml蛋白酶(Sigma-Aldrich)处理40 s - 1分钟,并在2×SSC下洗涤两次,在室温下3分钟。最后,用2×SSC的4%甲醛在2×SSC中加入10分钟的后晶,然后在2×SSC中洗涤5分钟,在70,90和100%乙醇中脱水5分钟,然后留下风干。.gydF4y2Ba
探针制备和寡聚鱼gydF4y2Ba
以往的研究表明,C7是高度保守,并保留了一个完整的同线性gydF4y2Bac . hystrixgydF4y2BaH1染色体,而C5染色体对应两个gydF4y2Bac . hystrixgydF4y2Ba染色体H9和H10 [gydF4y2Ba11gydF4y2Ba,gydF4y2Ba25gydF4y2Ba].C5和C7的寡核苷酸探针采用寡核苷酸选择软件Chorus (gydF4y2Bahttps://github.com/forrestzhang/ChorusgydF4y2Ba) [gydF4y2Ba14gydF4y2Ba].黄瓜“中国龙”基因组的重复序列gydF4y2Baftp://cucurbitgenomics.org/pub/cucurbit/genome/cucumber/Chinese_long/v2/gydF4y2Ba, v2 Genome),使用RepeatMasker (gydF4y2Bahttp://www.repeatmasker.org/gydF4y2Ba).过滤后的C5和C7序列被分为45 nt的oligos,步长为5 nt。每个寡核苷酸与黄瓜基因组进行比对,以过滤掉基因组中有重复的基因(>在所有45个nt中有75%的相似性)。保存Oligo与dTm > 10 (dTm = Tm -发夹Tm),建立Oligo探针数据库。我们调整了染色体上寡聚体的数量,以确保寡聚体探针可以覆盖整个染色体。具体来说,对C5和C7染色体选择了每300 kb 100 kb靶向的寡聚体(oligos)gydF4y2Ba3.gydF4y2Ba:表S2)。由Mycroarray (Ann Arbor, MI)平行从头合成每个oligo池共27,392个oligo,并按照公布的协议进行标记[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba19gydF4y2Ba].gydF4y2Ba
利用两个寡聚探针和两个卫星DNA序列(Type III和45s rDNA)鉴定有丝分裂和减数分裂时的染色体。从黄瓜中提取基因组DNAgydF4y2Bac . hystrixgydF4y2Ba使用CTAB方法[gydF4y2Ba46.gydF4y2Ba在异源四倍体C. ×的减数分裂中,标记为GISH探针以区分两个亚基因组gydF4y2BahytivusgydF4y2Ba[gydF4y2Ba11gydF4y2Ba].FISH的所有实验步骤如前所述[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba18gydF4y2Ba].最终的图像对比使用ADOBE PHOTOSHOP CC (ADOBE,gydF4y2Bahttp://www.adobe.com.gydF4y2Ba).图中粗线期染色体。gydF4y2Ba2gydF4y2Ba使用ImageJ软件进行矫直(gydF4y2Bahttps://imagej.nih.gov/ij/gydF4y2Ba).gydF4y2Ba
花粉活力gydF4y2Ba
为测定花粉活力准备了5个生物学重复。每代随机采集异源四倍体C. ×的雄性花15朵gydF4y2BahytivusgydF4y2Ba对于每种生物复制。收集花粉晶粒并用改性的Carbol-Fuchsin溶液染色,并且在立体显微镜下计算每种生物重复的超过2000种花粉晶粒。计算了丰满花粉晶粒的百分比以表示同种异体四倍体C的花粉活力C.×gydF4y2BahytivusgydF4y2Ba.gydF4y2Ba
统计分析gydF4y2Ba
统计了5条染色体和2个亚基因组的减数分裂行为gydF4y2Ba2gydF4y2Ba:表S1。在GraphPad Prism 7中执行每个比较和图形分析的统计测试(gydF4y2Bahttps://www.graphpad.comgydF4y2Ba).使用f检验来检验SD范围的差异,以及两两学生的差异gydF4y2BatgydF4y2Ba- 最低用于比较四种不同世代的花粉活力和两种不同世代的减少染色体行为。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
所有相关的支持数据都可以在本文附带的附加文件中找到。附加文件gydF4y2Ba3.gydF4y2Ba:表S2包含有关Cucumber染色体5和7的所选寡核苷酸的数量和位置的所有信息。用于寡核鱼探头设计的合唱软件可自由使用(gydF4y2Bahttps://github.com/forrestzhang/ChorusgydF4y2Ba).gydF4y2Ba
缩写gydF4y2Ba
- 人工智能:gydF4y2Ba
-
减数分裂后期IgydF4y2Ba
- 鱼:gydF4y2Ba
-
荧光原位杂交gydF4y2Ba
- 吉斯”:gydF4y2Ba
-
基因组原位杂交gydF4y2Ba
- 小姐:gydF4y2Ba
-
减数分裂中期IgydF4y2Ba
- oligo:gydF4y2Ba
-
寡核苷酸gydF4y2Ba
- PMC:gydF4y2Ba
-
花粉母细胞gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
《杂种和近期多倍体的亚基因组优势的原因和后果》。新植醇。2018;220(1):87 - 93。gydF4y2Ba
- 2.gydF4y2Ba
亚当斯KL,文德尔JF。植物的多倍体和基因组进化。植物学报。2005;8(2):135-41。gydF4y2Ba
- 3.gydF4y2Ba
多伊尔JJ,Flagel LE,帕特森AH拉普RA,SOLTIS DE,SOLTIS PS,温德尔JF。基因组兼并植物倍增的进化遗传学。Annu Rev Genet。2008; 42(1):443-61。gydF4y2Ba
- 4。gydF4y2Ba
李志刚,李志刚,李志刚,等。多倍体物种减数分裂的遗传调控:对一个老问题的新认识。新植醇。2010;186(1):29-36。gydF4y2Ba
- 5。gydF4y2Ba
霍利斯特JD。多倍性:对基因组环境的适应。新植醇。2015;205(3):1034 - 9。gydF4y2Ba
- 6。gydF4y2Ba
进化稳定多倍体的挑战:“交叉干扰距离”的增加是否会起到关键作用?Chromosoma。2016;125(2):287 - 300。gydF4y2Ba
- 7。gydF4y2Ba
周J,TAN C,CUI C,GE X,Li Z.综合芸苔类含有的不同亚基因稳定性。Al Appl Genet。2016; 129(7):1257-71。gydF4y2Ba
- 8。gydF4y2Ba
张H,卞Y,苟X,朱B,徐C,齐B,黎嗯,Rustgi S,周H,韩F.持续整个染色体非整倍性通常与异源六倍体新生小麦有关。Proc Natl Acad SCI U S A. 2013; 110(9):3447-52。gydF4y2Ba
- 9。gydF4y2Ba
卞y,杨c,ou x,张z,王b,ma w,龚l,张h,刘b.是一种新形成的allohexaploid小麦的减数分子染色体稳定性,以非生物胁迫为施用。新植物。2018; 220(1):262-77。gydF4y2Ba
- 10.gydF4y2Ba
多倍性:范式的陷阱和路径。[J] .中国生物医学工程学报。2016;33(7):1146-66。gydF4y2Ba
- 11.gydF4y2Ba
王勇,赵强,秦旭,杨松,李智,李军,娄强,陈杰。新合成异源四倍体的同源染色体鉴定gydF4y2BaCucumis×hytivusgydF4y2Ba它的野生父母揭示了稳定的亚基组结构。Chromosoma。2017年; 126(6):713-28。gydF4y2Ba
- 12.gydF4y2Ba
傅立新,王志强,王志强。跨物种染色体绘制。Nat Protoc。2006;1(2):783。gydF4y2Ba
- 13.gydF4y2Ba
聂伟,王军,苏伟,王东,杨飞。基于染色体绘画的食肉动物染色体重排与核型进化。遗传。2012;108(1):17-27。gydF4y2Ba
- 14.gydF4y2Ba
韩义,张t,泰国译,翁y,姜j.染色体特定绘画gydF4y2BaCucumisgydF4y2Ba采用膨体寡核苷酸种类。遗传学。2015; 200(3):771-9。gydF4y2Ba
- 15.gydF4y2Ba
Zhao H ., Zhang T ., Semrau K ., Rouillard JM ., Torres GA ., Jiang J. Comparative oligo-FISH mapping:一种揭示染色体组型和进化的有效方法。遗传学。2018;208(2):513 - 23所示。gydF4y2Ba
- 16。gydF4y2Ba
鑫H,张T,韩Y,吴Y,石Ĵ,西安男,江J.在涂染和比较物理映射的性染色体gydF4y2Ba毛白杨gydF4y2Ba和gydF4y2Ba摘要gydF4y2Ba.Chromosoma。2018; 127(3):313-21。gydF4y2Ba
- 17。gydF4y2Ba
何丽萍,刘建军,刘建军,等。减数分裂的染色体绘制揭示了多倍体中特定染色体的配对gydF4y2Ba茄属植物gydF4y2Ba物种。Chromosoma。2018;127(4):505 - 13所示。gydF4y2Ba
- 18。gydF4y2Ba
李张卢Q, Y, Y, J,贾L, C、关W,杨年代,陈J .单份基于基因的染色体涂染在黄瓜Cucumis染色体重排分析及其应用。植物j . 2014; 78(1): 169 - 79。gydF4y2Ba
- 19。gydF4y2Ba
Albert PS,张T,Semrau K,Rouillard J-M,Kao Y-H,Wang C-JR,Danilova TV,Jiang J,Birchler Ja。玉米的全染色体涂料揭示了重排,核结构和染色体关系。Proc Natl Acad Sci U S A. 2019; 116(5):1679-85。gydF4y2Ba
- 20.gydF4y2Ba
陈建峰,陈建峰。一种新型的合成植物gydF4y2BaCucumisgydF4y2Ba(葫芦科)种间杂交和染色体加倍。52 Brittonia。2000;(4):315 - 9。gydF4y2Ba
- 21.gydF4y2Ba
J-V C,的Staub JE,田代Y,一色S,宫崎S.之间成功种间杂交gydF4y2BaCucumis巨大成功gydF4y2Ba土地gydF4y2Bac . hystrixgydF4y2BaChakr。Euphytica。1997;96(3):413 - 9。gydF4y2Ba
- 22.gydF4y2Ba
陈磊,娄强,庄勇,陈杰,张旭,沃鲁考JN。新合成的异源四倍体的细胞学二倍体和基因组的快速变化gydF4y2BaCucumis×hytivusgydF4y2Ba.足底。2007;225(3):603 - 14所示。gydF4y2Ba
- 23.gydF4y2Ba
江B,娄Q,吴Z,张W,王D,Mbira kg,Weng Y,Chen J. Retrotransposon-和微卫星序列相关的新合成的同种异体四倍体早期几代内序列相关的基因组变化gydF4y2BaCucumis×hytivusgydF4y2Ba陈和科克布莱德。植物学报。2011;77(3):225。gydF4y2Ba
- 24.gydF4y2Ba
塞巴斯蒂安P,Schaefer H,Telford IR,Renner SS。黄瓜 (gydF4y2BaCucumis巨大成功gydF4y2Ba)及甜瓜(gydF4y2Bac·梅洛gydF4y2Ba)在亚洲和澳大利亚有许多野生亲戚,甜瓜的姐妹种类来自澳大利亚。Proc Natl Acad Sci U S A. 2010; 107(32):14269-73。gydF4y2Ba
- 25。gydF4y2Ba
Yang L, Koo DH, Li D, Zhang T, Jiang J, Luan F, Renner SS, Henaff E, Sanseverino W, Garcia-Mas J.下一代测序、FISH定位和共体建模揭示黄瓜异倍性减少的机制。植物j . 2014; 77(1): 30。gydF4y2Ba
- 26。gydF4y2Ba
Naranjo T.使用同种讲解在麦芽岩同源关系中的鉴定。秘密人。1992年; 116(3):219-23。gydF4y2Ba
- 27。gydF4y2Ba
杨丽,顾东辉,李勇,张旭,栾飞,蒋军,翁宇。黄瓜驯化过程中染色体重排的高密度遗传作图和基因组组装。工厂j . 2012, 71(6): 895 - 906。gydF4y2Ba
- 28.gydF4y2Ba
小麦染色体末端区在减数分裂中选择配对伴侣。遗传学。2007;177(2):699 - 706。gydF4y2Ba
- 29.gydF4y2Ba
Grusz AL,西格尔EM,跨越真核生物系统发育Witherup C.部分同源染色体配对。mol phylocyet evol。2017; 117:83-94。gydF4y2Ba
- 30.gydF4y2Ba
关键词:基因组,基因组内,基因组间,同源性gydF4y2Ba芸苔gydF4y2Ba基因组:对其起源和进化的启示。中国科学(d辑:地球科学)1996;93(8):1225-33。gydF4y2Ba
- 31.gydF4y2Ba
《基因组稳定性与进化:尝试整体观点》。植物学报,2016;21(9):749-57。gydF4y2Ba
- 32.gydF4y2Ba
骑士E,Greer E,Draeger T,Thole V,Reader S,Shaw P,Moore G.通过过早缩合诱导染色体配对:小麦间隙杂交种分析。Funct综合基因组学。2010; 10(4):603-8。gydF4y2Ba
- 33.gydF4y2Ba
李亦怡,张福忠,郑慕忠。种间杂交种的染色体配对亲和性反映淑女鞋兰的系统发育距离gydF4y2BaPaphiopedilumgydF4y2Ba).安机器人。2011;108(1):113 - 21所示。gydF4y2Ba
- 34.gydF4y2Ba
崔超,葛晓霞,李志强,康丽丽,等。染色体组和细胞质对水稻减数分裂配对的影响gydF4y2Ba芸苔gydF4y2Ba杂交和异源四倍体从三个培养二倍体对杂交。遗传学。2012;191(3):725 - 38。gydF4y2Ba
- 35.gydF4y2Ba
郭晓霞,卞勇,张安华,王波,吕荣杰,朱波,龚磊,刘波。人工构建的异源四倍体小麦(AADD)的减数分裂不稳定性及其快速核型进化。生物医学进展。2018;35(5):1078-91。gydF4y2Ba
- 36.gydF4y2Ba
西蒙WLC。在父母的染色体之间的战斗,失败重装。国家科学院院刊美A. 2011; 108(33):13361-2。gydF4y2Ba
- 37.gydF4y2Ba
陈建平,陈建平,陈建平。植物染色体不稳定性和倍性变化对植物物种形成的影响。植物学报。2014;1(1):10-33。gydF4y2Ba
- 38.gydF4y2Ba
韩颖,潘杰,李志平,翁玉英gydF4y2BaCucumis hystrixgydF4y2Ba-黄瓜合成四倍体,导致低雄性育性。作物j . 2016; 4(4): 275 - 9。gydF4y2Ba
- 39。gydF4y2Ba
熊泽,Gaeta RT,皮雷斯JC。同源改组和染色体补偿维持了再合成异源多倍体的基因组平衡gydF4y2Ba芸苔属植物显著gydF4y2Ba.中国科学院院刊2011;108(19):7908-13。gydF4y2Ba
- 40。gydF4y2Ba
Chester M, Gallagher JP, Symonds VV, Cruz da Silva AV, Mavrodiev EV, Leitch AR, Soltis PS, Soltis DE.最近形成的天然异源多倍体物种的广泛染色体变异,gydF4y2BaTragopogon miscellusgydF4y2Ba(菊科)。中国科学院院刊2012;109(4):1176-81。gydF4y2Ba
- 41.gydF4y2Ba
陈志强,陈志强,陈志强,等。新异源四倍体的染色体变异模式gydF4y2BaTragopogon Mirus.gydF4y2Ba(菊科)。遗传。2015;114(3):309 - 17所示。gydF4y2Ba
- 42.gydF4y2Ba
俞X,王X,赛德格卡德B,朱Z,周R,KJAER KH,Ouzounis T,Lou Q,Li J,Cai Q等。黄瓜中的全多倍化有助于延迟叶成熟,抑制冗余同源基因。植物J. 2018; 94(2):393-404。gydF4y2Ba
- 43.gydF4y2Ba
庄勇,陈建峰,贾安。黄瓜por基因在异源四倍体中的表达及序列变异gydF4y2BaCucumis×hytivusgydF4y2Ba.中国人民大学学报(自然科学版)2008;36(7):1725。gydF4y2Ba
- 44.gydF4y2Ba
庄烨,陈杰f。早期几代基因表达的基因表达的变化gydF4y2BaCucumis×hytivusgydF4y2Ba陈科克布莱德。植物遗传资源学报。2009;56(8):1071。gydF4y2Ba
- 45.gydF4y2Ba
利用染色体绘制技术分析植物减数分裂染色体。方法2013;990(2):13-24。gydF4y2Ba
- 46.gydF4y2Ba
穆雷MG,汤普森WF。快速分离高分子量植物DNA。核酸学报1980;8(19):4321-6。gydF4y2Ba
致谢gydF4y2Ba
我们感谢奚梦丽博士(中国南京林业大学)的技术支持。我们非常感谢编辑和审稿人对稿件的批判性评价,并为其改进提供建设性意见。gydF4y2Ba
资金gydF4y2Ba
本研究由国家自然科学基金重点项目(31430075)和国家自然科学基金项目(31471872)资助。资助机构为研究项目提供资金,但在研究的设计、收集和分析、数据的解释和手稿的撰写中没有发挥作用。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
JFC和QFL构思并指导了这项研究;QZZ进行了大部分的细胞遗传学实验和数据分析;YZW、YFB、YFZ、XQY和CYC帮助合成寡聚探针;PQW和JL采集并分析花粉活力;QZZ起草了手稿;JFC和QFL修订手稿。所有的作者阅读并批准了手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
提交人声明他们没有竞争利益。gydF4y2Ba
附加信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件:1图S1。gydF4y2Ba
四项世代花粉活力的比较××gydF4y2BahytivusgydF4y2Ba异源四倍体(SgydF4y2Ba4gydF4y2Ba,年代gydF4y2Ba8gydF4y2Ba,年代gydF4y2Ba11gydF4y2Ba和SgydF4y2Ba14gydF4y2Ba).gydF4y2Ba图S2。gydF4y2Ba沿黄瓜染色体5(a)和7(b)的序列图的位置和密度为27,392 oligos。gydF4y2Ba图S3。gydF4y2Ba在同一个体的其他pmc中检测到两个携带c5寡核苷酸信号的易位,如图所示。gydF4y2Ba5gydF4y2Ba.gydF4y2Ba图S4。gydF4y2Ba追踪染色体在S的减数分裂染色gydF4y2Ba4gydF4y2Ba一代。gydF4y2Ba图S5。gydF4y2Ba在S细胞I中期,三个具有代表性的多价pmc和一个滞后的c -二价pmcgydF4y2Ba4gydF4y2Ba一代。gydF4y2Ba图S6。gydF4y2Ba描述S族异步减数分裂pmc中不同滞后二价数频率的热图gydF4y2Ba4gydF4y2Ba和SgydF4y2Ba14gydF4y2Ba一代。gydF4y2Ba
附加文件2:表S1。gydF4y2Ba
F的Meiotic分析gydF4y2Ba1gydF4y2Ba,年代gydF4y2Ba4gydF4y2Ba和SgydF4y2Ba14gydF4y2Ba基于oligo-painting和GISH的植物。gydF4y2Ba
附加文件3:表S2。gydF4y2Ba
C5-和C7-寡核苷酸的位置和序列信息。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条提供的数据,除非另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
赵,Q.,王,Y.,Bi,Y。gydF4y2Ba等等。gydF4y2BaOligo-Painting和Gish揭示了减数分裂染色体偏见并增加了合成的交通型倍增物中的减数分裂稳定性gydF4y2BaCucumisgydF4y2Ba×gydF4y2BahytivusgydF4y2Ba与dysploid亲本核型。gydF4y2BaBMC植物BIOL.gydF4y2Ba19,gydF4y2Ba471(2019)。https://doi.org/10.1186/s12870-019-2060-zgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
迪伊gydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-019-2060-zgydF4y2Ba
关键词gydF4y2Ba
- Allopolyploid.gydF4y2Ba
- 种间杂交gydF4y2Ba
- 减数分裂不稳定gydF4y2Ba
- 核型变异gydF4y2Ba
- Oligo-FISHgydF4y2Ba