摘要
背景
天然有色纤维的形成主要是不同花色苷及其衍生物在纤维中积累的结果陆地棉L. Chalcone synthase (CHS)是黄酮类化合物生物合成的第一个专用酶,花青素生物合成后主要通过花青素还原酶(ANR)和亮色花青素还原酶(LAR)运输到纤维细胞中,呈现出不同的颜色,且具有明显的稳定性。天然有色棉纤维色素形成的生化和分子机制尚不清楚。
结果
的三个关键基因GhCHS,GhANR而且GhLAR主要表达在彩棉的发育纤维中。在GhCHSi,GhANRi而且GhLARi转基因棉花的表达水平GhCHS,GhANR而且GhLAR在发育过程中,棉纤维中花青素含量显著降低,与棉纤维的色深呈负相关。在彩棉中有宗纱1号(ZX1)和GhCHSi,GhANRi而且GhLARi转ZX1、HZ和ZH转基因株系叶片、籽粒、纤维和种皮混合物的花青素含量均发生变化,且与纤维颜色呈正相关。
结论
三种基因GhCHS,GhANR而且GhLAR它们在彩色棉纤维发育早期主要表达,是棉花纤维颜色形成的关键基因。3个基因的表达量影响花青素含量和纤维颜色深度。因此,这3个基因在棉纤维颜色形成过程中起着至关重要的作用,对利用基因工程改善天然彩棉品质和创造新的彩棉种质资源具有重要意义。
背景
棉花作为最重要的经济作物之一,提供了纺织业50%以上的纤维来源[1].但是,印染工艺中含有许多致癌物,导致漂白困难,含有高浓度的卤化物有机物,大多数有机卤化物都具有致癌、致畸和诱变作用[2,3.,4,5,6也是典型的持久性有机污染物[7,8这是很难恢复的。天然彩色棉纤维纱线不经或极少直接染色成布,在纺织工业中具有广阔的应用前景。天然彩色棉及其面料因其绿色、生态、环保的特点,被誉为“21圣世纪达令”,也无疑成为中国纺织产业转型升级的重要选择和途径。但目前在实际生产和纺织行业中,彩棉只有棕色和绿色两种颜色,严重制约了彩棉行业的发展[8,9,10,11,12,13,14,15].天然有色棉纤维是通过合成和积累发育纤维中的天然色素来着色的,以前的报道表明,棉纤维的棕色是由纤维中黄酮类化合物的合成和积累造成的[3.,16],原花青素(proanthocaynidins, PAs)的生物合成和积累对棉纤维的褐变起主导作用[10,11,17,18,19,20.,21].由于彩棉纤维色素组成和结构复杂,从基因上改善棉纤维颜色难度较大,彩棉纤维色素形成机理尚不清楚。
类黄酮是植物中最大的次生代谢物之一,广泛分布于从种子植物到藓类植物[22,23,24].这些苯丙素途径衍生物的主要类别包括黄酮醇、花青素和PAs。花青素是一种水溶性天然色素,是许多吸引传粉者和种子传播者的花朵和果实呈现红色、紫色和蓝色的原因[25].目前已在自然界中鉴定出600多种花青素,其中最常见的是天竺葵素、花青素、飞燕草素、芍药素、芍药素、马尾青素以及6种广泛分布的花青素衍生物,它们是高等植物中占主导地位的核心花青素,在植物的花朵、种子和果实中呈现出橙色、红色、紫色、蓝色等不同颜色[26,27,28,29].植物的花朵和果实有各种各样的颜色,因为它们与花青素密切相关。pa在调节植物多种生物胁迫和非生物胁迫方面发挥着重要作用,在抗紫外线、抗病、清除自由基、调节种子休眠和萌发等生理过程中发挥着重要作用[29,30.,31,32,33,34].花青素合成途径是总黄酮合成途径的一个重要分支,查尔酮合成酶(chalcone synthase, CHS)是第一个介导4-香豆酰基辅酶a和丙二酰辅酶a合成柚皮素查尔酮的关键酶。生物合成后,类黄酮被运输到液泡或细胞壁[35].花色素还原酶(LAR)和花色素还原酶(ANR)分别催化单体生物合成的最后一步。LAR直接将浅色花青素还原为相应的2,3 -反式-(6)-黄烷-3-醇如儿茶素等作为PA生物合成的第一步。花青素合成酶(ANS)将浅色花青素转化为表儿茶素等2,3 -顺式花青素,再通过ANR还原花青素,合成相应的2,3 -顺式黄烷-3-醇[36].花青素分支点酶UDP-glycose: flavonoids -3- o -glycosyltransferase (UF3GT)和PA分支点酶ANR都利用了不稳定的黄酮前体cyanidin作为底物。LAR还将4b-(s -半胱氨酸)-表儿茶素转化为游离表儿茶素,以调节PA聚合物的长度Medicago truncatula[37].LAR和ANR都是依赖于NADPH/ nadh的异黄酮样还原酶,属于还原酶表吡酯酶脱氢酶超家族。
因此,通过沉默花青素生物合成途径中的结构基因,可以相对容易地实现工程苍白色。通过沉默黄酮3,5 -羟化酶基因(F3’5是什么) [38].通过抑制种皮中ANR的活性,获得了新型的红色大豆种子[39].显著抑制的大豆ANR1而且ANR2基因导致红棕色籽粒表型,受沉默的影响ANR1而且ANR2将PA生物合成的代谢通量转化为花青素和黄酮醇-3-O配糖体途径。ANR去除花青素,为原花青素合成提供表儿茶素。在缺乏ANR活性的情况下,以红色花青素为基础的花青素在种皮中积累。LAR和ANR是花青素转运和原花青素合成的关键酶。
对大豆种皮组织中PA分支基因进行沉默处理,为植物色素遗传改良提供了一种新方法。许多经济作物也会在种皮中积累PAs,ANR油菜的转基因籽粒颜色基因可能被抑制(芸苔属植物显著l .)、亚麻(亚麻属植物usitatissimum)和小麦(小麦属植物spp。)40,41,42].
本研究对天然彩色棉中涉及花青素合成和转运的3个关键基因进行了分析。随着3个关键基因转录水平的降低,纤维颜色发生变化,导致花青素含量发生变化。这对基因操作非常重要GhCHS,GhANR而且GhLAR在花青素代谢途径上改善棉纤维的颜色,以满足日益增长的绿色纺织工业的巨大需求。
结果
鉴定与系统发育分析GhCHS,GhLAR而且GhANR基因
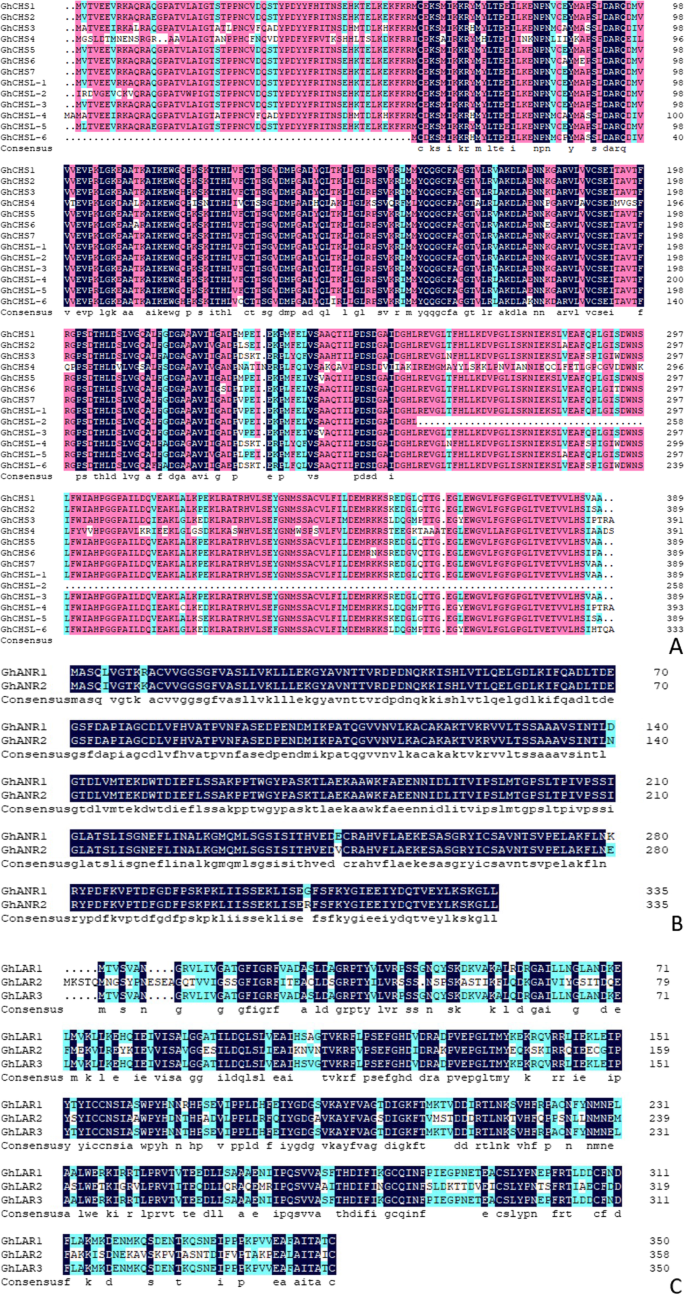
从褐棉及其近同工基因系的转录组中扫描差异表达基因[11].从差异表达基因来看,花青素生物合成途径中的基因包括GhCHS,GhLAR而且GhANR中彩色纤维的进一步分析g .分子。在g .分子7GhCHS基因和6GhCHS-like2 .基因扫描GhANR基因和3GhLAR得到基因(图。1).
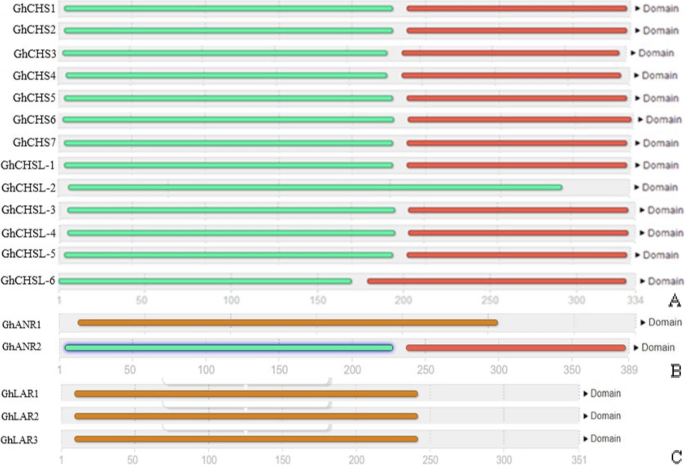
多个ChCHSs氨基酸同源性高,特殊基序同源性达100%GhCHS基因高度保守g .分子(无花果。1一个)。GhLAR基因和GhANR基因也很保守g .分子(无花果。1b, c)。GhCHS家族中除GhCHSL-2外的其他成员都有两个结构域,主要分为n端和c端,而GhCHSL-2只有一个n端结构域(图2)。2a). GhANR1和GhANR2也分为n端和c端(图。2b). GhLARs只有一个n端结构域(图;2c)。
的表达模式GhCHS,GhLAR而且GhANR在发育中的纤维中
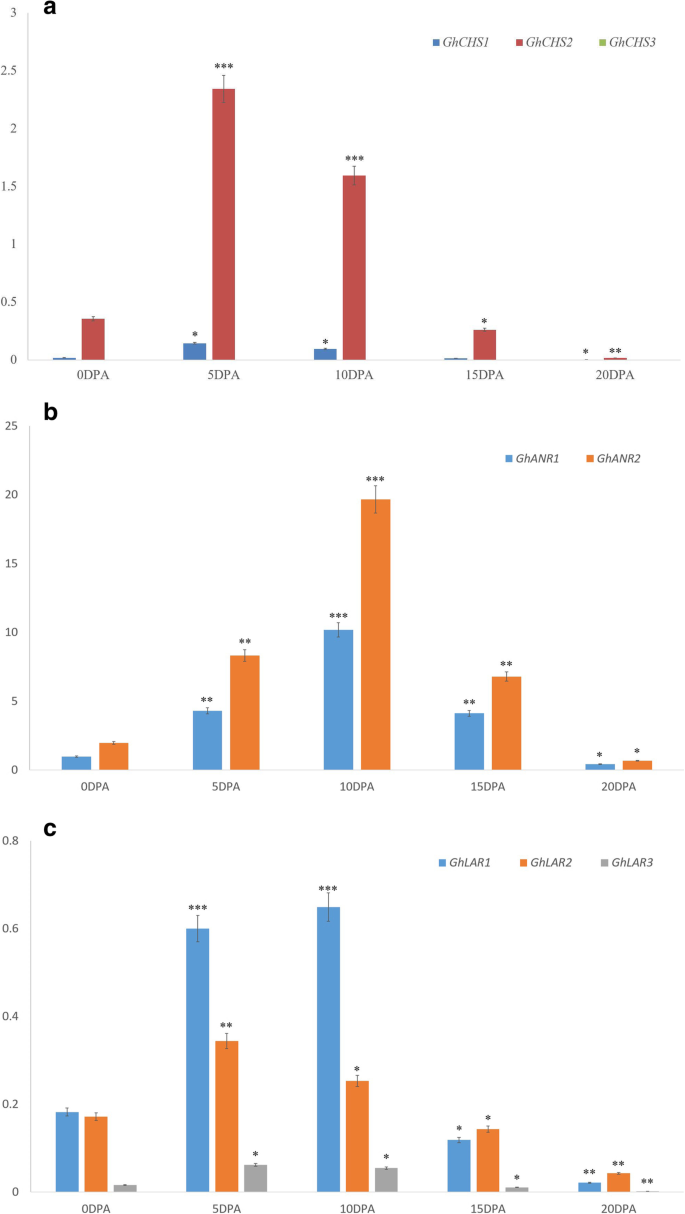
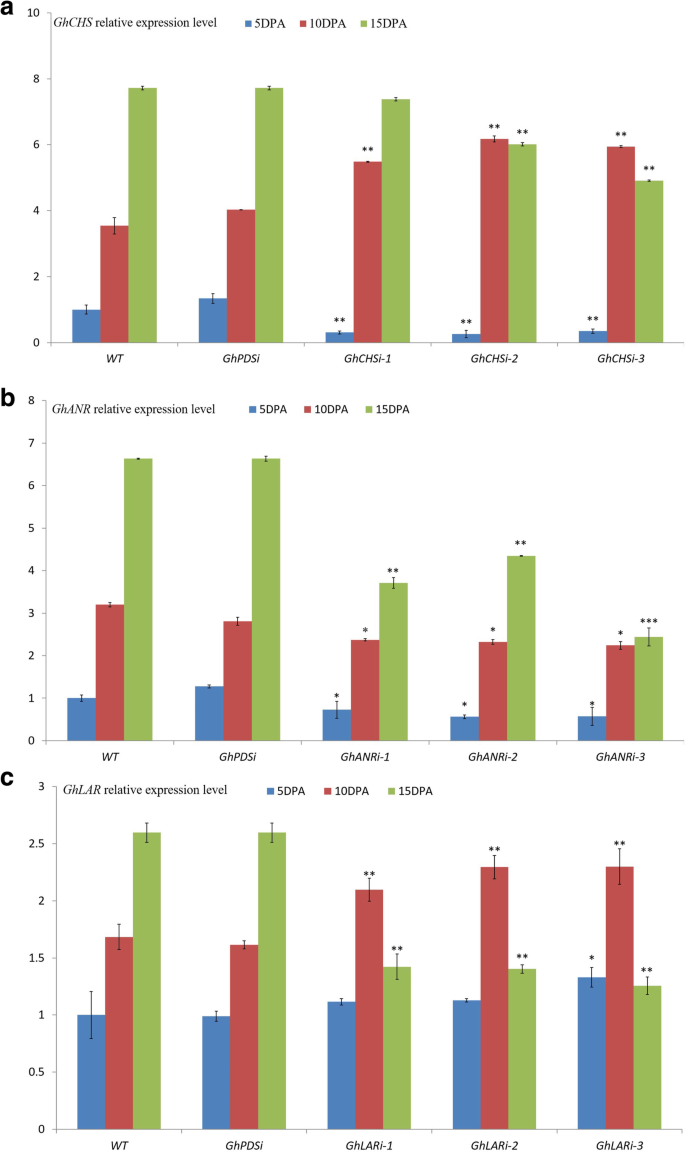
7GhCHS基因和6GhCHS-like基因2GhANR基因和3GhLAR测定了天然彩色棉宗絮1号(ZX1)和不同棉花品种不同发育阶段纤维的转录本水平。3GhCHS基因(命名GhCHS1,GhCHS2,GhCHS3)在ZX1发育纤维中检测到GhCHS2是主要的。表达水平GhCHS2远远高于GhCHS1而且GhCHS3在花后5和10 d的纤维中表现最为明显(图2)。3.a)。这两个概念GhANR基因(GhANR1而且GhANR2)在ZX1发育中的纤维中定量,最大表达水平出现在10 DPA的纤维中(图1)。3.b).的表达水平GhANR基因含量极高于GhLAR在5 DPA的纤维中基因约为10倍,在10 DPA的纤维中为30倍。所有GhLAR0 ~ 20 DPA发育纤维中检测到基因,主要表达在5 DPA和10 DPA发育纤维中(图1)。3.c).从的表达模式GhCHS,GhLAR而且GhANR3个基因均主要在10 DPA纤维中表达,在10 DPA不同颜色纤维的不同棉种中均有不同的表达模式。
选用5个棉花品种(白色纤维和棕色纤维)进行测定GhCHS,GhLAR而且GhANR10dpa在发育纤维中的表达水平。在工厂,查耳酮合酶(CHS)基因是黄酮类化合物生物合成的第一步,其表达水平GhCHS彩色纤维中基因含量显著高于白色纤维,尤其是在10 DPA的ZX1和HZ纤维中(图1)。4的)。GhCHS基因, GhCHS2在有色纤维发展过程中保持了优先表达和趋势,GhCHS1弱表达和GhCHS3几乎可以忽略不计,所以GhCHS2被测量来代表GhCHS利用发育纤维中的基因和保守序列来干扰它们的转录。的表达水平GhANR5个棉种中深棕色纤维着色棉HZ株系基因最高。的表达GhANR2与C312、HS2、ZH和ZX1相比,HZ在深棕色纤维中显著增加;转录水平GhANR1淡棕色的ZH系显著高于C312、HS2和ZX1(图1)。4b).对于花青素的转运,ANR代表了花青素在天然彩棉中流入纤维细胞的主要途径,表达水平GhANR5种植物的发育纤维中基因含量均显著高于其他植物GhLAR基因和GhCHS基因(图。4).与白色棉纤维相比,转录水平GhANR棕色棉纤维中基因含量显著高于白色棉纤维。GhLAR1该基因在5种棉花品种中HZ系深棕色纤维中表达量最高(图;4c),显著高于天然彩色棉ZX1、ZH和白色纤维棉C312、HS2。所以守恒序列GhANR1而且GhANR2,GhLAR1被用来干扰他们的文字记录。
转基因RNAi彩棉的表型分析
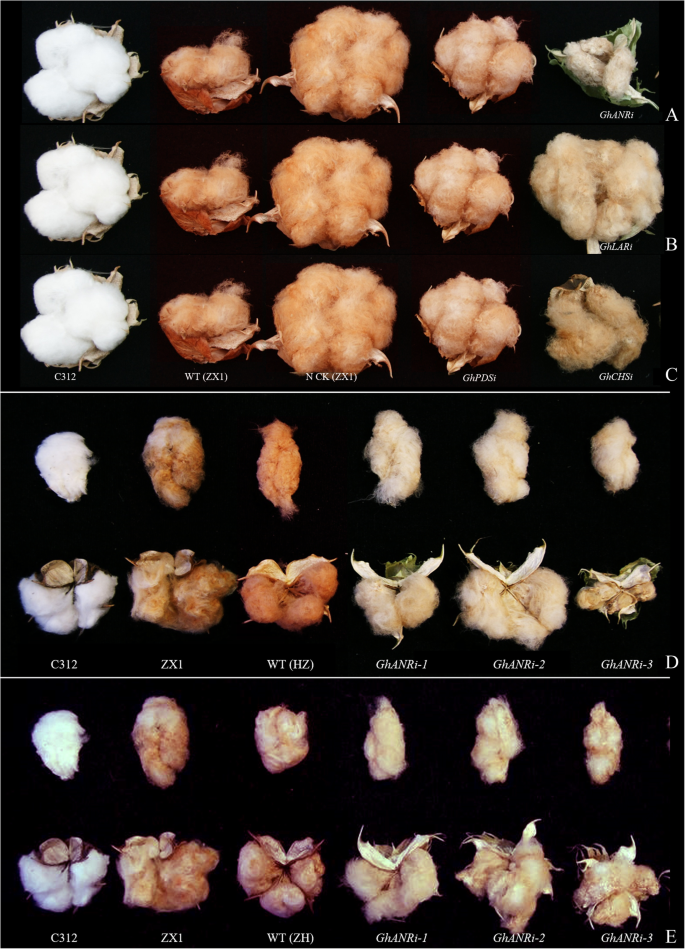
采用天然彩色棉ZX1进行内源沉默GhCHS2,GhLAR1而且GhANR以clcrv为基础的病毒诱导基因沉默系统。转基因阳性对照GhPDS-RNAi植株在叶片、茎秆、棉铃和棉纤维中均出现轻度漂白症状,并在棉花全寿命中持续表现。转基因无载体植株(ZX1 NCK)的阴性对照与野生型相比仅表现为叶片的收缩(图1)。5).纤维的颜色GhCHSi,GhANRi而且GhLARi在深棕色处有明显的褪色(图;5,6).纤维颜色GhANRi与ZX1 (N CK)相比,ZX1 (N CK)明显褪色,呈棕色,光照明显GhLARi植株颜色在深浅变浅为棕色,棉纤维颜色在深浅GhCHSi与ZX1、GhPDSi及其N CK (6a, b, c)。在5种棉种中,HZ的纤维颜色比其他4种棉种的纤维颜色深GhANRiHZ植株明显轻于WT (HZ)和ZX1(图1)。6d).纤维着色GhANRiZH植株也明显轻于WT (ZH)和ZX1(图1)。6e).它表明GhANR而且GhLAR在棉纤维花青素合成和色素积累中起重要作用。
表达式的分析GhCHS,GhANR而且GhLAR在RNAi植物
在基因沉默的ZX1植株中,GhANR,GhLAR而且GhCHS与WT ZX1和GhPDSiZX1植物(图。7).在GhCHSiZX1植株的表达水平GhCHS2在5 DPA和15 DPA下的纤维中,显著低于WT ZX1和GhPDSiZX1,特别是在5dpa的显影纤维中(图;7a).的表达水平GhLAR在GhCHSiZX1植株没有出现显著变化(附加文件1:图S1A);表达水平GhANR15个DPA的发育中纤维含量显著降低(附加文件1:图印地)。纤维的棕色GhCHSiZX1植株轻度褪色(图;5,6).在GhANRiZX1植物,GhANR5DPA、10 DPA和15dpa在发育纤维中的表达量显著低于WT ZX1和GhPDSiZX1(无花果。7B),表达水平GhCHS15 DPA的纤维含量增加,而5 DPA和10DPA的纤维含量变化不明显1:图就是S1C)。表达水平GhLAR有各种各样的变化(附加文件1:图S1D)。褐色纤维的颜色GhANRiZX1植株呈强烈衰落趋势(图1)。5,6).与WT ZX1和GhPDSiZX1植株的表达水平GhLAR在5dpa纤维中GhLARi植株变化不明显,但在10 DPA时纤维明显增加,在15 DPA时纤维急剧减少。7C),表达水平GhCHS在15个DPA纤维中明显增加(附加文件1:图S1E),表达水平GhANR15 DPA在纤维中的含量显著增加GhLARi-1植物(附加文件1:图S1F)。褐色纤维的颜色GhLARiZX1植株明显衰落。5,6).从GhANRi而且GhLARiZX1植株,抑制GhANR而且GhLAR会不会上调的表达GhCHS基因(附加文件1:图S1)。
植物组织中花青素含量与纤维颜色呈正相关
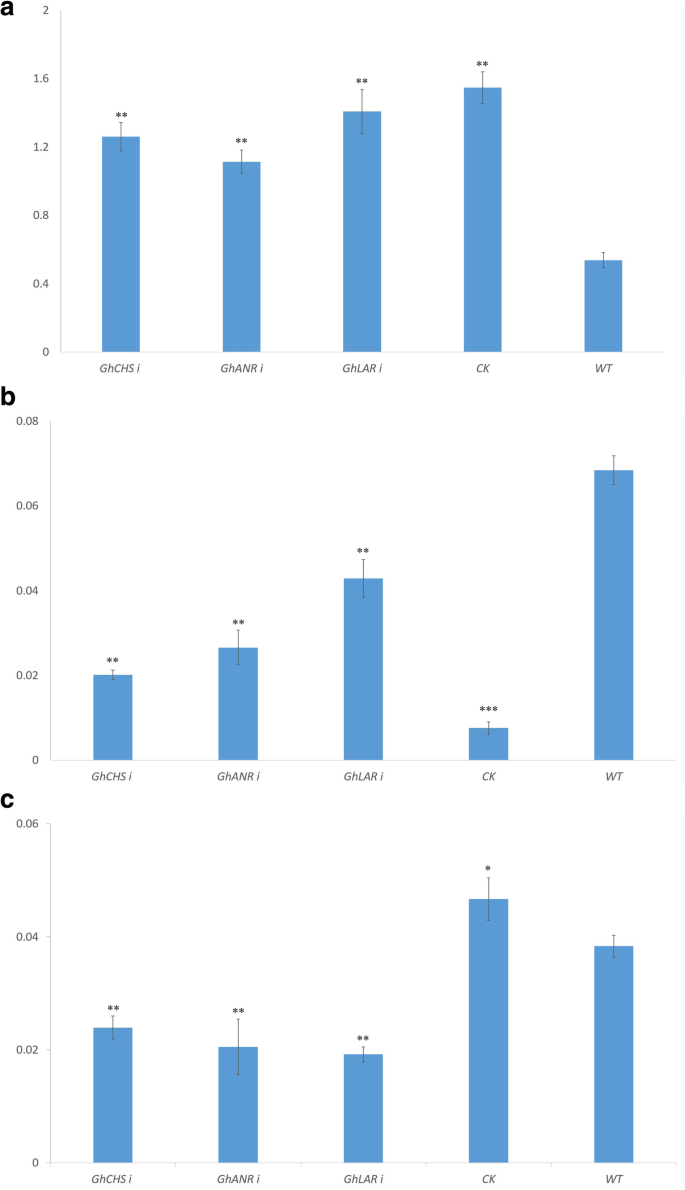
采用棕色纤维大面积种植天然彩色棉ZX1,研究其效果GhANR,GhLAR而且GhCHS花青素积累的表达。WT ZX1籽粒、棉纤维和种皮的花青素含量显著高于其他品种GhANRi,GhLARi而且GhCHSiZX1植物(图。8b, c)。与野生型ZX1相比,RNAi植株籽粒、纤维和种皮中的花青素含量显著降低,而叶片中的花青素含量显著增加(图1)。8a).游离载体对照植株(N CK)叶片和棉籽粒中花青素含量显著高于野生型(图;8a, c)籽粒、棉纤维和种皮中的花青素含量影响棉纤维的颜色,棉籽粒、棉纤维和种皮中的花青素含量越低,纤维颜色越淡GhANRi,GhLARi而且GhCHSi叶片中花青素含量增加。8b, c)。
讨论
鉴定和表达模式GhCHS,GhANR而且GhLAR
在基因组中g .分子, 13GhCHS而且GhCHS-like基因的CHS家庭,2GhANR基因和3GhLAR基因扫描,基因和蛋白质序列GhCHS,GhANR而且GhLAR都是高度保守的,但是GhCHS,GhANR而且GhLAR在棉花植株中具有表达特异性,GhCHS2基因主要表达在彩棉纤维中,GhCHS1而且GhCHS3另一种在发育中的纤维中表达微弱GhCHS而且GhCHS-like未测量发育纤维中的转录本。GhLAR1,GhLAR2而且GhLAR3均在发育中的纤维中表达,但在不同颜色或色深的棉种中表达存在差异,其中3GhLAR基因代表了HZ深颜色纤维中的高表达丰度,也许GhLAR基因可以改善纤维的颜色深度。2GhANR这些基因在发育中的纤维中均有表达,在有色棉中其转录本明显增加,在HZ深颜色的纤维中也表现出高表达丰度。在花青素生物合成和转运的三种基因中,花青素GhANR基因始终保持高表达水平,也代表了花青素进入纤维细胞的主要流动途径[11],并在花青素的运输中起主要作用。
表达水平GhCHS,GhANR而且GhLAR与纤维颜色密切相关
以5个棉花品种为试验材料,测定其对棉铃虫的影响GhCHS,GhANR而且GhLAR基因表达对纤维颜色形成的影响。表达水平GhCHSs而且GhANRs,GhLAR1而且GhLAR3均在有色纤维的发育早期表达,特别是在HZ的深棕色纤维中(图1)。4).表达水平GhCHS,GhANR而且GhLAR对彩棉纤维的成色有积极的影响。因此,要改善棉纤维的颜色,首先要提高棉纤维的色度GhCHS基因表达量的增加会促进花青素的生物合成,从而促进花青素的合成GhANR而且GhLAR增加它们的表达,以运输花青素到纤维细胞。在GhANRi而且GhLARi棉花线,GhCHS基因被抑制上调GhANRi而且GhLARi可能在天然彩棉中,纤维细胞中PA的形成可以反馈花青素的生物合成,纤维细胞中PA的形成主要是通过GhANR和GhLAR运输和积累花青素。相应的,抑制GhCHS在GhCHSi棉花线,GhANR表达下调,可能无法再通过GhANR将花青素转运到纤维细胞中。研究了棉籽粒、棉纤维和种皮中花青素的含量GhANRi,GhLARi而且GhCHSi植物叶片增减模式可以证实这一假说。
的抑制GhCHS,GhANR而且GhLAR对纤维颜色有负面影响吗
的GhANR,GhLAR而且GhCHS天然彩色棉ZX1的基因被沉默,转基因RNAi ZX1植株的纤维颜色与WT和CK显著不同。在转基因ZX1植株中,内源基因GhANR,GhLAR而且GhCHS,尤其是在5 DPA和10 DPA纤维中(图。7)时,转基因ZX1植株的纤维颜色会逐渐变浅,甚至更浅。3个基因的下调水平与纤维颜色呈负相关。在一般的苯丙素途径中,查尔酮合成酶是类黄酮合成的第一个承诺酶,在3个基因中,查尔酮合成酶的保守序列GhCHS1, GhCHS2而且GhCHS3沉默处理对棉纤维颜色影响不显著。首先,它可能是多个成员CHS家庭g .分子,虽然GhCHS2彩色棉主要在纤维发育早期表达,其他成员在发育后存在功能互补GhCHS2,甚至GhCHS1而且GhCHS3抑制;其次,GhCHS基因处于花青素生物合成的上游位置,抑制GhCHS对花青素的下游合成代谢影响不大。在花青素生物合成的早期,CHS,气,F3H是常见的类黄酮途径基因(又称早期生物合成基因,EBGs),负责所有下游类黄酮的生物合成。EBGs表达谱的变化并不直接导致花青素含量的变化茄属的蔬菜(43].的成绩单SmCHS与绿色或白色的浅色突变体相比,在黑色或紫色茄子果实中显著增加[44,45].在马铃薯块茎,CHS在红色和紫色块茎中高度表达,与花青素含量相关性更高[46,47,48,49].
的GhANR而且GhLAR为花青素代谢途径中的花青素运输工作GhANR主要作用为有色花青素进入纤维细胞GhLAR用于在纤维细胞中运输浅色花青素,也可以通过聚合和氧化形成花青素衍生物来增强纤维的颜色[11].的GhLARs在HZ植物的深颜色纤维中优先表达,在GhLAR抑制植物。
PAs(又称缩合单宁)是在LAR和ANR催化下通过花青素生物合成途径的一个分支合成的。LAR催化浅色花青素(黄烷- 3,4 -二醇)转化为儿茶素,ANR催化花青素合成表儿茶素[36,50,51].茶CsLAR烟草中异位表达的基因导致表儿茶素积累水平高于儿茶素,表明LAR可能是对表儿茶素生物合成的响应[52].葡萄和茶叶中的ANRs具有表素酶活性,可以将花青素转化为表儿茶素和儿茶素的混合物[52,53].代谢通量在大豆中进行了基因改造,拟南芥,佩妮通过抑制相应的分支点基因,重定向异黄酮、类黄酮和花青素的生物合成[54,55,56].的过表达Medicago truncatula ANR烟草基因降低了花中花青素的色素沉着,提高了PA水平[51].ANR可能与UF3GT竞争底物花青素,抑制ANR基因导致花青素积累增加。
在种子发育早期,种皮过早积累了氰化物拟南芥ANR(或禁止)敲除突变体[57].种皮中的色素呈透明状短暂累积外种皮(tt)表现型和局限于干粒中缝的黑色色素沉着[57].这与受强烈抑制的红棕粒大豆的表型不同ANR基因(39].不同物种籽粒表型差异的潜在机制和代谢产物。在拟南芥,UF3GT(UGT78D2)为花青素在幼苗和ANR种皮中的pa是相互调节的[58].在大豆,UF3GT基因包括UGT78K1而且UGT78K2, ANR基因包括ANR1而且ANR2同时在种皮中表达[39].大豆籽粒表型差异的原因可能是ANR基因显著抑制。存在和不存在UF3GT表达了拟南芥ANR敲除粮食。因此,大豆红棕色籽粒表型是稳定花青素积累的结果。
LAR和ANR两种不同的酶负责催化pa生产植物中黄烷-3-醇单体生物合成的最后一步[52,59,60].守护神而且ANR基因以单基因的形式出现拟南芥[36,或多基因家族,在葡萄藤[59和茶[52].的分析p . trichocarpa基因组显示3个编码LAR的位点和2个编码ANR的位点[61,62],从酶活性和体外酶活性分析来看,该酶可能参与了本地黑杨黄烷-3-醇生物合成的最后一步的催化。ANRs和LARs属于两类不同的酶,即使进化关系相似,DFR与ANRs的关系比LARs更密切[52,62].LAR枝合成了自由有效的单体儿茶素,并在黑杨中积累,游离依赖于anr的表儿茶素浓度很低。表儿茶素可能有助于延长杨树、葡萄和挪威云杉的PA链[59,63].LARs促进儿茶素单体的生物合成,抑制其聚合。通过上调表达量,增加了儿茶素单体和聚合物的积累NtLAR而且NtANR年代CsMYB5b转基因烟草(64].因此花色苷通过GhANR、GhLAR转运到纤维细胞中,将是有色纤维分子改良基因工程的重要环节。
纤维中花青素的含量直接影响纤维的颜色
在转基因RNAi在棉花植株中,内源抑制降低了花青素含量GhANR,GhLAR而且GhCHS基因,导致纤维褪色。CHS在苯丙氨酸代谢途径、植物生长发育,如胁迫反应、植物育性、植物颜色等方面起着重要作用[65].LAR是苯丙氨酸合成植物类黄酮途径中的关键酶,催化无色花青素转化为儿茶素[51,59,60].LAR1和ANR2基因转录水平分别与儿茶素和表儿茶素含量显著相关,从而调控PA合成。苹果异位表达MdLAR1烟草基因抑制花青素生物合成途径晚期基因的表达,导致花中花青素的丢失[60].
测定了棉籽纤维和种皮中花青素的含量GhLARi植物高于GhANRi植物的纤维颜色也比植物深GhANRiLAR将无色的花青素运输到纤维细胞中。从我们之前的研究来看,转录水平GhLAR在纤维发育过程中,棕棉的纤维颜色高于白棉GhLARi这里的植物稍微褪色了。与白色棉纤维相比,表达量GhANR在棕棉中纤维含量显著较高。的GhANR在褐棉纤维中表达活跃,主要表达在12dpa,当GhANR在棕色棉纤维中高于白色棉纤维的7倍[11].在纤维发育过程中,转录水平GhLAR在褐棉中比在褐棉中低得多GhANR,因此抑制的效果GhLAR对纤维的颜色变化较低GhANR,抑制GhANR在ZX1中,可以使纤维颜色明显变浅。黄烷-3-醇以2,3 -顺式形式存在于棕色和白色棉纤维中。棕色棉纤维中原花青素含量以前飞花素(PD)最多,而白色棉纤维中PD含量与原花青素(PC)相近。原花青素单体组成符合原花青素合成酶基因的表达谱,ANR在棕色纤维原花青素生物合成中起关键作用。原花青素合酶基因在棕色纤维中的表达水平高于白色纤维[11].分别在LAR和ANR分支上合成了顺式和反式黄烷-3-醇[11,36,51,66].质谱(MS)分析表明,棕棉纤维中的主要PA单体在B环上含有三个羟基(没食子儿茶素或表没食子儿茶素)[11,21,67]时,PA在棕色纤维中的积累开始于早期(5 DPA),在30 DPA时达到峰值,成熟的棕色纤维中PA逐渐转化为氧化衍生物(醌类)。因为发育中的棕色纤维在成熟之前不会表现出明显的颜色,缩合的醌可能直接促进棉纤维中的棕色色素沉着,而不是它们的PA前体[11].因此,花青素代谢途径中的3个关键基因对棉纤维着色起着非常重要的作用,成为基因操作改善棉纤维着色的目标基因。
结论
在彩色棉纤维g .分子,GhCHS2该基因主要表达于彩色棉纤维的发育GhCHS和6GhCHS-like基因和代表CHS有色纤维花青素代谢基因。2GhANR基因和3GhLAR基因高度保守,同源性强,在发育中的有色棉纤维中表达显著。的GhCHS2,GhANR而且GhLAR不同颜色深度的彩色棉纤维中基因表达存在差异。的GhCHS,GhANR而且GhLAR在不同颜色深度的彩棉上对基因进行干扰,3个基因的表达量显著下降,RNAi棉花植株花青素含量随着基因表达量的下降而显著降低,纤维颜色显著改变和减弱。三种基因GhCHS,GhANR而且GhLAR这3个基因在棉纤维颜色形成过程中起着至关重要的作用,通过基因工程对这3个基因进行遗传操作,对改善天然彩棉品质,利用基因工程创造新的彩棉种质资源具有重要意义。
方法
植物材料
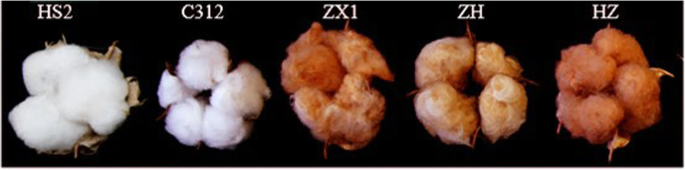
的g .分子l .简历。选用白色纤维的Coker 312 (C312)和HS2,棕色纤维的天然色棉ZX1(宗旭1),深棕色纤维的HZ和浅棕色纤维的ZH(图3)。9).棉花种子g .分子简历。C312、HS2、ZH和HZ保存于浙江理工大学浙江省植物次生代谢与调控重点实验室。C312是国家棉花中期种质资源库(中国农科院棉花研究所)提供的一个广泛用于遗传转化的老商品品种。ZH、HZ和HS2是我们培育的棉花新品系。ZX1棉花种子由中国农业科学院棉花研究所杜雄明博士提供。种子在28°C的温室中萌发生长,光照14 h,黑暗10 h。第二次真正出叶的幼苗用于农业渗透。浸润后的植株在23-25°C的温室中生长,光照/暗周期为14/10 h。棉花是在标准条件下在田间栽培的。分别在0 DPA、5 DPA、10 DPA、15 DPA和20 DPA(花后第1天)采集棉籽、纤维和种皮样品(除去10、15和20 DPA棉籽粒中的纤维和种皮),放入液氮中,−80℃超低温冰箱中提取RNA。
RNAi基因克隆及载体构建
候选基因从褐棉及其近同位基因系(g .分子) [11].的GhANR,GhLAR而且GhCHS扫描棉花基因组中的基因(http://www.cottongen.org),以获取基因及序列。利用BioEdit软件对其氨基酸序列进行多序列比对GhANR1,GhANR2,GhLAR1,GhLAR2,GhLAR3,GhCHS基因。基因编码蛋白的特征采用TMHMM (http://www.cbs.dtu.dk/services/TMHMM-2.0/)对mRNA编码的蛋白质跨膜区进行分析。氨基酸序列的组成、理化性质和等电点用ProtParam (http://web.expasy.org/分别protparam /)。
将CLCrV DNA-A和DNA-B组分分别修改为基于CLCrV的新载体,将其插入pCambia1300载体中,分别生成pCLCrVA和pCLCrVB [68].将候选基因片段插入pCLCrVA中,得到pCLCrVA-GhCHSpCLCrVA -GhANR,pCLCrVA -GhLAR如前所述,在棉花植株中进行VIGS研究[68,69,70].
一个400 ~ 600 bp的候选基因片段GhANR2,GhLAR1而且GhCHS2被放大为我们之前的论文[69].的不足八氢番茄红素desaturase基因(PDS)导致叶绿素和类胡萝卜素损失,表现为典型的光漂白表型,作为阳性标记,可视化内源基因沉默的时间和程度。的PDS用PCR方法从C312基因组DNA中克隆基因片段,构建载体pCLCrV-GhPDS根据之前的论文[69]。
这四个向量分别变换为根癌土壤杆菌应变GV3101 [69].pclcrva -空用于阴性对照(N CK), pCLCrV-PDS用作阳性对照(GhPDSi), pCLCrVA -GhCHSpCLCrVA -GhANRpCLCrVA -GhLAR和pCLCrVB(目的基因沉默)。用pCLCrV-转化植物PDS和空pclcrva载体作为对照。实验中用于克隆和检测的引物列在附加文件中1S1:表。
棉花幼苗在28℃的生长室中生长,光照14 h,黑暗10 h。健康2周龄幼苗用不同浓度的杆菌携带pCLCrVA或它的一个衍生物和pCLCrVB。杆菌将含有pCLCrVA或其衍生物与等量的杆菌窝藏pCLCrVB。混合杆菌用无针注射器向2周龄棉苗子叶背面浸润溶液。农用渗透法至少进行3次,每个载体至少30株。从接种pclcrv的棉花植株叶片中分离到DNA。用特异性引物CLCrVA F和CLCrVA R [69].实验以野生型C312和ZX1或HZ或ZH作为对照。转基因叶片和发育中的铃GhCHSi,GhANRi,GhLARi,GhPDSi分别采集0 DPA、5 DPA、10 DPA和15 DPA处理的ck植株进行花青素含量测定和基因表达分析。
实时荧光定量PCR分析基因表达
根据制造商的说明(RNAprep Pure TIANGEN BIOTECH,中国)从叶片、纤维和种皮的混合物中分离总RNA,并广泛使用无rnase i处理。根据标准的双链cDNA合成协议,使用含gDNase的FastQuant RT试剂盒(TIANGEN BIOTECH,中国)从200 ng RNA中合成双链cDNA。使用SYBR FAST qPCR试剂盒(KAPA SYBR®,USA)进行实时荧光定量PCR (qRT-PCR)检测,使用ABI QS3荧光定量PCR仪(ABI, USA)进行qRT-PCR反应。PCR扩增系统和程序如前所述[69],所有qRT-PCR检测均采用独立分离的RNA进行3次生物复制。用2——ΔΔCt方法(69].的表达GhANR的基因,GhLAR基因和GhCHS基因被标准化以适应构成基因GhUBQ7基因表达水平(棉花Ubiquitin7genbank登录号:DQ116441,作为内参基因)。引物列在附加文件中1S1:表。
转基因植物花青素含量分析
如前所述,对花青素积累进行测量[71,72].(约重样品。100 mg),取1.5 mL微隐管放入液氮中冷冻植物组织。样品在1ml 0.5% (v/v)的HCl甲醇中提取过夜,然后在涡流中剧烈振荡30 s。提取缓冲液在黑暗中以120 rpm的速度摇动1小时。提取缓冲液在20℃下,2630 g离心15分钟。此过程重复3次。上清液用分光光度法(UV-2600,岛津,日本)和花青素吸收单位(A530——一个657)计算每克鲜重。空白应为480 ml甲醇,0.5% (v/v) HCl和320 ml mmilli- q H20为共800毫升。使用分光光度计在530、620和650 nm处进行吸光度测量。结果由以下公式确定:光密度(OD) = (A530——一个620) - [0.1 × (a650——一个620)] [73].
统计分析
至少三次独立实验(每次重复三次)的所有数据均以平均值±标准差表示。采用学生t检验确定差异的统计学意义。当*时,处理之间的差异被认为是显著的P< 0.05, * *P< 0.01和***P在双尾分析中< 0.005。
数据和材料的可用性
在研究过程中产生或分析的所有数据都包含在这篇发表的文章中。
改变历史
2020年1月19日
在本文[1]的原始发表中,作者指出图4b与图4c是相同的。正确的图4b应该在下面。
缩写
- ANR:
-
花青素还原酶
- CHS:
-
查耳酮合酶
- CLCrV:
-
棉花叶片皱折病毒
- 分区:
-
开花后的天数
- 政治:
-
Leucoanthocyanidin还原酶
- PA:
-
原花青素
- PDS:
-
八氢番茄红素desaturase
- UF3GT:
-
UDP-glycose: flavonoid-3-O-glycosyltransferase
参考文献
张志刚,张志刚,张志刚,等。棉花节肢动物抗性机制及其与天敌的相互作用。植物学报。2013;31(3):458 - 463。
埃菲L,奇利F,穆斯塔法耶夫SA。土耳其东地中海地区生态友好型天然彩棉籽棉产量、产量构成及主要皮棉品质性状评价中国生物医学工程学报2009;
华胜,袁胜,沙姆斯IH,赵欣,张欣,刘勇,文光,王欣,张慧。棉花不同纤维颜色产量、品质和光合作用等值线的比较。作物科学。2009;49:983-9。
吉米·LB,国会议员。一种旧纤维的新生命:天然彩色棉的属性和优点。AATCC启2001;1:32-6。
工艺改进对硫酸盐纸浆漂白过程中AOX排放的影响,以智利松和桉树为原料。清洁产品2000;8:233-41。
Sharma A, Thakur VV, Shrivastava A, Jain RK, Mathur RM, Gupta R, Kuhad RC。以木聚糖酶和漆酶为基础的酶硫酸盐纸浆漂白降低漂白废水中可吸附有机卤素(AOX):一项中试研究。生物科技。2014;169:96 - 102。
王振宇,王振宇,刘军,等。氯离子作用下接触辉光放电电解降解活性染料的动力学及AOX生成。Electrochim学报。2011;58:364 - 71。
严强,王颖,李强,张卓,丁华,张颖,刘华,罗敏,刘东,宋伟,刘华,姚东,欧阳新,李颖,李旭,沛宇,肖宇。棉纤维二次壁厚过程中GhTT2-3A上调导致棕色纤维品质改善。植物生物技术学报。2018;16:1735-47。
石永忠,杜晓明,刘国强,强AD,周振林,潘泽,孙金林。棉花天然色织毛绒的遗传分析。棉花科学。2002;14:242-8。
冯慧,田旭,刘艳,李艳,张旭,Jones BJ,孙艳,孙娟。陆地棉棕色纤维中黄酮类化合物及其结构基因分析。《公共科学图书馆•综合》。2013;8:e58820。
冯华,李艳,王松,张玲,刘洋,薛峰,孙燕,孙杰。棕棉纤维色素沉着相关原花青素的分子分析(英文)陆地棉l .)。J Exp Bot. 2014; 65:5759-69。
谭奕玲,周晓泽。天然彩色棉的研究现状及发展趋势。科技进展。2015;2:1-4。
马敏,胡珊,周伟,等。天然绿色棉纤维色素组成结构及自由基清除活性研究。纤维素。2016;23:955 - 63。
Bi YW。天然彩色棉性能分析及发展趋势。山东文科科技。2017;4:4-7。
杜晓明,刘峰,王坤柏,贾永华,周振林,何斯平,龚文福,潘泽,王立人,耿晓林,庞柏。棉花种质资源收集、评价与利用。棉花科学。2017;29:51 - 61。
莫蒂·MS. Never say dye:彩色棉花的故事。共振。2001;6:29-35。
龚伟,何胜,田军,孙军,潘智,贾宇,孙刚,杜鑫。两种不同纤维颜色和品质棉系转录组的比较。《公共科学图书馆•综合》。2014;9:e112966。
Hinchliffe DJ, Condon BD, Thyssen G, Naoumkina M, Madison CA, Reynolds M, Delhom CD, Fang DD, Li P, McCarty J. GhTT2_A07基因与Lc1棉花的棕色和自然阻燃表型有关(陆地棉l .)纤维。中国生物医学工程学报。2016;37(7):591 - 591。
李玉娟,张学勇,王凤霞,杨春林,刘峰,夏桂霞,孙杰。比较蛋白质组学分析为棕色纤维色素生物合成提供新思路。J蛋白质组。2013;78:374 - 88。
肖云华,张志胜,尹明华,罗明,李小斌,侯玲,裴勇。与棕色纤维色素沉积相关的棉花类黄酮结构基因。生物物理学报。2007;358:73-8。
肖玉华,闫强,丁慧,罗敏,侯玲,张敏,姚丹,刘红霞,李欣,赵杰,裴宇。棕棉纤维原花青素合成途径的转录组和生化分析。《公共科学图书馆•综合》。2014;9:e86344。
Tohge T, Watanabe M, Hoefgen R, Fernie AR.苯丙素代谢在绿色谱系中的进化。生物化学杂志2013;48:123-52。
黄酮类化合物对旧分子的新作用。中国生物医学工程学报,2010;20(3):393 - 393。
张志强,张志强,张志强,等。植物酚类物质的生物合成、遗传和生理生态研究进展。植物生理化学。2013;72:1-20。
杨尚,J Venail, Mackay S, Bailey PC, Schwinn KE, Jameson PE, Martin CR, Davies KM。花色素分布脉络的分子基础及其对传粉者吸引力的影响。新植醇。2011;189:602-15。
眼见为实:工程花青素和类胡萝卜素生物合成途径。生物技术。2008;19:190-7。
黄晓明,陈建平,陈建明,等。花青素的化学、药理和健康益处。Phytother杂志2016;30(8):1265 - 86。
孔建明,贾利群,吴丽萍,贾特福,刘志刚。花青素的生物活性分析。Phytochem。2003;64:923-33。
张勇,张志强,张志强,等。植物花青素生物合成工程研究。植物学报。2014;19:81-90。
菲尔德TS,李DW,霍尔布鲁克NM。为什么树叶在秋天变红。花青素在红柳山茱萸叶片衰老中的作用。植物杂志。2001;127:566 - 74。
花青素在叶片中起到抗氧化剂的作用吗?机械损伤后红色和绿色叶片中H2O2的成像。植物生态学报。2010;25:1261-9。
Li J, Ou-Lee TM, Raba R, Amundson RG, Last RL。拟南芥类黄酮突变体对UV-B辐射敏感。植物细胞。1993;5:171-9。
Olsen KM, Slimestad R, Lea US, Brede C, Løvdal T, Ruoff P, Verheul M, Lillo C.温度和氮对类黄酮途径调控因子和产物的影响:实验和动力学模型研究。植物细胞生态学报。2010;32(3):391 - 396。
Rubin G, Tohge T, Matsuda F, Saito K, Scheible W. LBD家族转录因子抑制花青素合成并影响额外的氮响应拟南芥。植物细胞。2009;21:3567 - 84。
黄酮类化合物:生物化学途径调控与进化的彩色模型。植物科学进展。2005;10:36 - 42。
谢镝,沙玛SB,迪克森RA。花青素的还原酶Medicago truncatula而且拟南芥。中国科学:地球科学。2004;
刘晨,王欣,Shulaev V, Dixon RA。浅色花青素还原酶在原花青素延伸中的作用。Nat植物。2016;2:16182。
黄酮类色素基因工程改良花卉植物花色的研究。Biotechnol。2011;33:433-41。
黄晓明,刘志刚,刘志刚,刘志刚,等。通过抑制原花青素基因ANR1和ANR2为转基因大豆着色。转基因研究》2012;21:757 - 71。
McCallum JA, Walker JR.麦麸中的原花青素。谷物化学1990;67:282-5。
Naczk M, Nichols T, Pink D, Sosulski F.油菜籽壳中的浓缩单宁。农业食品化学学报1994;42:2196-200。
王娥,王文亮,王志强,王志强,王志强,王志强,王志强,王志强,王志强,王志强,王志强,王志强,王志强,王志强,王志强,王志强,王志强,王志强,王志强,王志强,王志强,王志强,王志强。植物生物学。2011;11:1-15。
刘海燕,刘志强,刘志强,刘志强,刘志强。花青素的生物合成及降解机理研究茄属的蔬菜:审查。前化学2018;52。
小斯托梅尔,小达姆。茄子果实发育过程中生物合成与调控基因的协同调控与花青素积累相一致。中国生物医学工程学报。2015;24(5):449 - 456。
Gisbert C, Dumm JM, Prohens J, Vilanova S, Stommel JR.自发茄子(茄属植物melongenal)颜色突变条件无花青素水果色素沉着。Hortsci。2016;51:793-8。
André CM, Schafleitner R, Legay S, Lefèvre I, Aliaga CA, Nomberto G, Hoffmann L, Hausman JF, Larondelle Y, Evers D.干旱胁迫下生长的马铃薯块茎中酚类化合物生产相关的基因表达变化。Phytochem。2009;70:1107-16。
郑CS, Griffiths HM, De Jong DM, Cheng S, Bodis M, Kim TS, De Jong WS。马铃薯发育器(D)位点编码一个R2R3 MYB转录因子,调控块茎皮中多种花青素结构基因的表达。Theor applied Gene. 2009; 120:45-57。
Payyavula RS, Singh RK, Navarre DA转录因子、蔗糖和蔗糖代谢基因相互作用调节马铃薯苯丙素代谢。中国生物医学工程学报2013;64:515 - 31。
刘洋,王凯,王林,邓晨,王丽,杨慧,王健,张俊,王丹,王健。白马铃薯和紫马铃薯花青素合成相关基因的比较转录组分析。《公共科学图书馆•综合》。2015;10:e0129148。
Tanner GJ, Francki KT, Abrahams S, Watson JM, Larkin PJ, Ashton AR.植物原花青素生物合成。豆科植物亮色花青素还原酶的纯化及其cDNA的克隆。生物化学。2003;278:31647-56。
谢东东,沙玛SB, Paiva NL, Ferreira D, Dixon RA。BANYULS编码的花青素还原酶在植物类黄酮合成中的作用。科学。2003;299:396-9。
彭勇,阿比辛赫IS,何洁,何晓泽,胡曼D,梅湾KM,苏茂华,尹俊,狄克森RA。茶原花青素途径酶的功能鉴定及其在代谢工程中的应用。植物杂志。2013;161:1103-16。
Gargouri M, Chaudière J, Manigand C, Maugé C, Bathany K, Schmitter JM, Gallois B.葡萄花青素还原酶的近端酶活性及其区域特异性氢化物转移。生物化学杂志。2010;391:219-27。
欧宇,J施,欧海森,CA Maxwell, B McGonigle, JT Odell。提高大豆异黄酮生物合成的代谢工程研究。Phytochem。2003;63:753 - 63。
Besseau S, Hoffmann L, Geoffroy P, Lapierre C, Pollet B, Legrand M.拟南芥木质素合成抑制类黄酮积累影响生长素运输和植物生长。植物细胞。2007;19:148 - 62。
张志勇,张志勇,张志勇,等。黄酮类化合物生物合成基因的基因工程研究及其在红花植物中的应用。植物细胞代表2007;26:1951-9。
Albert S, Delseny M, Devic M. BANYULS,一种新型的类黄酮生物合成负调控因子拟南芥种子的外套。植物j . 1997; 11:289 - 99。
李艳,尹浩,白永华,刘jr, Chung WI, Choi G.拟南芥UGT78D2和BANYULS在种皮发育过程中花青素对缩合单宁的代谢通量调控中起关键作用。植物学报,2005;48:357 - 357。
Bogs J, Downey MO, Harvey JS, Ashton AR, Tanner GJ, Robinson SP.原花青素合成和编码白花青素还原酶和花青素还原酶基因在葡萄浆果和葡萄叶片发育过程中的表达。植物杂志。2005;139:652 - 63。
廖玲,魏刚,周慧,宋文彬,韩云。苹果原花青素合成中亮色花青素还原酶基因的分子特征研究。植物学报(英文版). 2015;
袁丽,王丽,韩智,蒋勇,赵丽,刘慧,杨丽,罗凯PtrLAR3,一个编码亮色花青素还原酶的基因杨树trichocarpa,其组成表达增强了转基因植物对真菌的抗性。中国生物医学工程学报。2012;33(3):393 - 393。
王颖,春OK,宋禾。血浆和膳食抗氧化状态作为心血管疾病危险因素:人体研究综述营养。2013;5:2969 - 3004。
Hammerbacher A, Paetz C, Wright LP, Fischer TC, Bohlmann J, Davis AJ, Fenning TM, Gershenzon J, Schmidt A.挪威云杉的黄烷-3-醇:生物合成、积累和响应树皮甲虫相关真菌Ceratocystis polonica的功能。植物杂志。2014;164:2107-22。
王培强,张丽娟,蒋晓玲,戴晓玲,徐丽娟,李婷,邢大伟,李玉珍,李茂珍,高丽萍,夏婷。紫花苜蓿中亮色花青素还原酶的进化与功能表征茶树。足底。2018;247:139-54。
Koes RE, Quattrocchio F, Mol JN。植物类黄酮生物合成途径:功能与进化。Bioessays。1994;16:123-32。
Takos AM、Ubi BE、Robinson SP、Walker AR.浓缩单宁生物合成基因与苹果果皮中其他类黄酮生物合成基因分别受调控。植物科学。2006;170:487 - 99。
张志刚,张志刚,张志刚,等。双胞病毒介导的基因沉默棉花皱叶病毒在棉花中低温增强。植物杂志。2008;148:41-50。
顾智,黄超,李峰,周旭。棉花基因和微核糖核酸功能分析系统。生物工程学报,2014;12:1234 - 1234。
付文福,沈勇,郝杰,吴建勇,柯丽萍,吴成成,黄凯,罗伯伦,徐文富,程晓峰,周晓平,孙杰,邢辰智,孙雅琴。酰基辅酶an -酰基转移酶通过调节棉花脂质代谢和茉莉酸的生物发生影响育性。Sci众议员2015;5:11790。
Lu R, Martin-Hernandez AM, Peart JR, Malcuit I, baucombe DC。病毒诱导的植物基因沉默。方法。2004;30:296 - 303。
郑sw, Das PK, Jeoung SC, Song JY, Lee HK, Kim YK, Kim WJ, Park YI, Yoo SD, Choi SB, Choi G, Park YI。乙烯对糖诱导花青素色素沉着的抑制作用拟南芥。植物杂志。2010;154(3):1514 - 31所示。
Wade HK, Sohal AK, Jenkins GI。拟南芥ICX1是调控类黄酮生物合成基因的多条途径的负调控因子。植物杂志。2003;131(2):707 - 15所示。
安建平,曲峰杰,姚建峰,王晓宁,尤春霞,王晓峰,郝玉杰。bZIP转录因子MdHY5调控苹果花青素积累和硝酸盐同化。园艺研究。2017;4:17023。
致谢
作者感谢杜雄明博士提供的ZX1种子和有益的讨论。
资金
国家重点研发计划项目(2018YFD0100401)和国家自然科学基金一般项目(31671738)资助。资助机构在研究设计、数据收集和分析或手稿撰写方面没有任何作用。
道德声明
伦理认可和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格《自然》对出版的地图和机构附属关系中的管辖权要求保持中立。
补充信息
附加文件1:表S1。
实验中使用的引物。图S1。相对表达量GhCHS,GhANR,GhANR5 DPA、10 DPA和15 DPA的显影纤维中GhCHSi,GhANRi,GhANRi,GhPDSi转基因棉系和野生棉系ZX1。
权利和权限
开放获取本文根据知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许不受限制地在任何媒体上使用、分发和复制,前提是您要适当地注明原作者和来源,提供创作共用许可的链接,并说明是否进行了更改。知识共享公共领域转让豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
高杰,沈玲,袁杰。et al。的功能分析GhCHS,GhANR而且GhLAR在有色纤维中形成陆地棉lBMC植物杂志19日,455(2019)。https://doi.org/10.1186/s12870-019-2065-7
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-019-2065-7
关键字
- g .分子l
- 纤维的颜色
- 花青素
- GhCHS
- GhANR
- GhLAR