- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
aba诱导的大豆ERF转录因子基因gydF4y2BaGmERF75gydF4y2Ba在提高渗透胁迫耐受性方面起一定作用gydF4y2Ba拟南芥gydF4y2Ba和大豆gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba19gydF4y2Ba、物品编号:gydF4y2Ba506gydF4y2Ba(gydF4y2Ba2019gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
乙烯响应因子(ERFs)在植物生长发育和对不利环境因子(包括非生物和生物胁迫)的响应中起着重要作用。gydF4y2Ba
结果gydF4y2Ba
在本研究中,我们鉴定了160个大豆ERF基因,分布在20条染色体上,根据系统发育关系可分为8类。一个对aba高度敏感的ERF基因,gydF4y2BaGmERF75gydF4y2Ba,属于第七类。亚细胞定位分析显示GmERF75蛋白定位于细胞核,qRT-PCR结果显示gydF4y2BaGmERF75gydF4y2Ba对多种非生物应激和外源激素有反应。gydF4y2BaGmERF75gydF4y2Ba-overexpressinggydF4y2Ba拟南芥gydF4y2Ba在渗透胁迫下,与WT和突变体相比,品系的叶绿素含量更高。两个独立的gydF4y2Ba拟南芥gydF4y2Ba突变的gydF4y2BaAtERF71gydF4y2Ba,同源基因gydF4y2BaGmERF75gydF4y2Ba,下胚轴较短,过表达gydF4y2BaGmERF75gydF4y2Ba在这些突变体中可以挽救短的下胚轴表型。OverexpressinggydF4y2BaGmERF75gydF4y2Ba大豆毛状根在外源ABA和盐胁迫下的生长均有改善。gydF4y2Ba
结论gydF4y2Ba
这些结果表明gydF4y2BaGmERF75gydF4y2Ba是一种重要的植物转录因子,在增强两者的渗透耐受性中起关键作用吗gydF4y2Ba拟南芥gydF4y2Ba和大豆。gydF4y2Ba
背景gydF4y2Ba
植物具有复杂而精细的调节机制来抵御包括非生物和生物胁迫在内的环境因素[j]。gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba]。转录因子是基因表达的调节因子,在信号转导网络中起着关键作用,直接激活或抑制目标基因的表达,从而影响不同信号通路之间的相互作用[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba]。gydF4y2Ba
aptala2 /乙烯响应因子(AP2/ERF)超家族是植物中的一个大基因家族,在信号转导、植物生长发育、生物和非生物胁迫响应等方面发挥重要作用[j]。gydF4y2Ba6gydF4y2Ba]。根据保守结构域的不同,AP2/ERF可分为三大家族:aptala2 (AP2)、乙烯响应因子(ERF)和相关脱落酸不敏感3/VIVIPAROUS 1 (RAV)。gydF4y2Ba7gydF4y2Ba]。AP2家族包含两个AP2/ERF结构域,ERF家族可分为两个亚家族:脱水响应元件结合蛋白(dreb)和ERF,包含一个AP2/ERF结构域,RAV家族包含一个AP2/ERF结构域[gydF4y2Ba7gydF4y2Ba]。erf在植物的不同发育阶段发挥着不同的作用,如种子萌发、组织形成、开花阶段、对生物和非生物胁迫的响应[j]。gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba]。先前的研究发现erf可以特异性结合gc -box和/或脱水反应元件/C-repeat (DRE/CRT)。gydF4y2Ba独联体gydF4y2Ba调控下游基因表达的作用元件,如乙烯(ET)诱导的致病相关(PR)基因和非生物胁迫诱导基因[gydF4y2Ba10gydF4y2Ba]。近年来,研究发现ERFs还可以结合偶联元件1 (CE1: TGCCACCG)、缺氧反应启动子元件(HRPE)和ATCTA [gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba]。erf最初是在烟草中发现的,从那时起,越来越多的erf在不同的植物中被发现,包括gydF4y2Ba拟南芥gydF4y2Ba、大米、gydF4y2Ba滨藜属canescensgydF4y2Ba,花生,向日葵和土豆[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba]。gydF4y2Ba
ERF可以影响植物的生长发育。一些erf的活性受到不同发展阶段的影响[gydF4y2Ba19gydF4y2Ba]。OverexpressinggydF4y2BaLkAP2L2gydF4y2Ba在gydF4y2Ba拟南芥gydF4y2Ba,可影响种子生长、分枝、花发育和角力,显著增加了嫩枝数,减少了角力长度、种子数、转基因莲座叶的大小和数量[gydF4y2Ba8gydF4y2Ba]。gydF4y2BaOsHL6gydF4y2Ba是水稻AP2/ERF转录因子,通过与OsWOX3相互作用调控生长素相关基因的表达,在毛状体形成中起关键作用[gydF4y2Ba9gydF4y2Ba]。gydF4y2Ba
ERF基因也可以在非生物和/或生物应激反应途径中起作用。gydF4y2BaTaERF1gydF4y2Ba在干旱、盐、低温等多种环境胁迫下,以及外源激素如ABA、ET和水杨酸(SA)的诱导下,小麦ERF基因也被鉴定为抗病基因。gydF4y2BaBlumeria茎gydF4y2Ba小麦(F. sp. tritici)。过度的gydF4y2BaTaERF1gydF4y2Ba在gydF4y2Ba拟南芥gydF4y2Ba烟草可以提高对病原体的抵抗力,增强对多种非生物胁迫的耐受性[gydF4y2Ba20.gydF4y2Ba]。gydF4y2Ba海纳藻ERF1-VgydF4y2Ba调控小麦对白粉病和干旱、盐碱的过度表达[gydF4y2Ba21gydF4y2Ba]。同样的,gydF4y2BaTaPIE1gydF4y2Ba是小麦ERF家族的一员gydF4y2Ba丝核菌cerealisgydF4y2Ba通过激活在小麦ET信号通路下游起作用的防御和胁迫相关基因,增加对冰冻胁迫的耐受性[gydF4y2Ba22gydF4y2Ba]。因此,ERF基因可以编码响应多种胁迫的多功能因子,整合潜在的多种信号转导途径,从而在植物的非生物和生物胁迫响应中发挥双重作用[qh]gydF4y2Ba14gydF4y2Ba,gydF4y2Ba23gydF4y2Ba]。gydF4y2Ba
虽然在多种植物中发现了erf,但许多erf尚未被报道,大豆是经济上最重要的作物物种之一。此外,大多数ERF基因的功能尚未确定。在本研究中,我们搜索并整合了所有非冗余的大豆ERF基因集。gydF4y2BaGmERF75gydF4y2Ba选择高度aba诱导的ERF基因进行进一步的表达和功能分析。gydF4y2BaGmERF75gydF4y2Ba受到多种非生物胁迫和外源激素的上调,其过表达可增强两者的渗透耐受性gydF4y2Ba拟南芥gydF4y2Ba和大豆。gydF4y2Ba
结果gydF4y2Ba
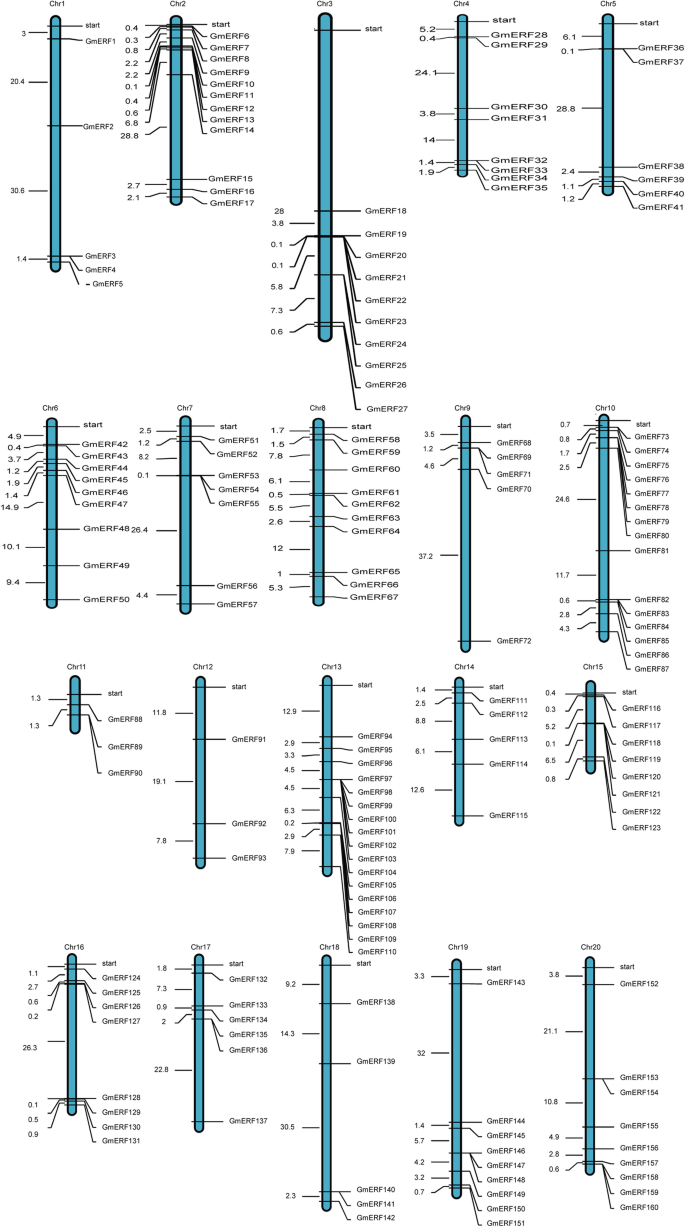
大豆erf的鉴定及物理定位gydF4y2Ba
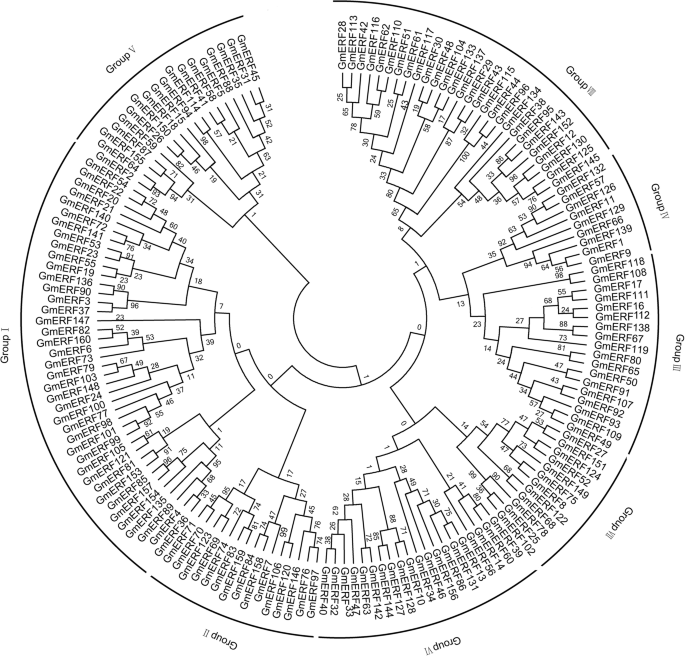
我们使用了Pfam [gydF4y2Ba24gydF4y2Ba]及SMART资料库[gydF4y2Ba25gydF4y2Ba]作为鉴定160个非冗余大豆erf的参考(附加文件)gydF4y2Ba1gydF4y2Ba:表1)。根据大豆基因组数据库,160个大豆erf分布在20条染色体上(图2)。gydF4y2Ba1gydF4y2Ba).每条染色体上ERF基因的数量差异很大。ERF基因分布在13号染色体上有17个,而在12号染色体上只有3个(图2)。gydF4y2Ba1gydF4y2Ba).使用MEGA 5.1对全长氨基酸序列进行多次比对[gydF4y2Ba26gydF4y2Ba]。根据它们的系统发育关系,ERF蛋白可以聚集成8组(I至VIII)。gydF4y2Ba2gydF4y2Ba).几乎四分之一的ERF蛋白聚集在第1组,而只有9个聚集在第4组。gydF4y2Ba
大豆ERF蛋白的无根系统发育树。利用ClustalW软件对160个大豆ERF家族蛋白AP2/ERF结构域的氨基酸序列进行比对,并在MEGA 5.0(附加文件)中采用邻接法构建系统发育树gydF4y2Ba1gydF4y2Ba:表S1)gydF4y2Ba
大豆ERFs的表达谱gydF4y2Ba
为了研究ERF的表达模式,基于从大豆基因组数据库下载的基因芯片数据,绘制了14个不同发育阶段大豆组织和器官的ERF基因表达图谱gydF4y2Ba2gydF4y2Ba:图S1;额外的文件gydF4y2Ba3.gydF4y2Ba表2)。大豆ERFs在21日龄根瘤中表达量最高,在种子中表达量最低。少数大豆ERFs表现出不同的组织特异性表达模式。例如,8个erf仅在一个组织中表达,9个erf仅在两个组织中表达。不同组基因的表达水平也存在差异。II组基因的表达量低于其他组。同一组内erf的表达模式也存在差异。例如,gydF4y2BaGmERF127gydF4y2Ba转录本在花中达到最高水平gydF4y2BaGmERF10gydF4y2Ba转录本在根中含量最高。gydF4y2BaGmERF6gydF4y2Ba,gydF4y2BaGmERF66gydF4y2Ba,gydF4y2BaGmERF84gydF4y2Ba的表达水平较低,而gydF4y2BaGmERF52gydF4y2Ba,gydF4y2BaGmERF112gydF4y2Ba,gydF4y2BaGmERF122gydF4y2Ba,gydF4y2BaGmERF124gydF4y2Ba都以极高的水平表达。有趣的是,四分之三的极高表达的ERF基因聚集在第七组。因此,选择第七组进行进一步研究。gydF4y2Ba
大豆VII族ERFs的保守蛋白基序和基因结构gydF4y2Ba
有12个ERF基因属于第七组。为了研究这些基因编码的蛋白质的模块化结构,使用dog2.0绘制每个蛋白质的结构域。如附加文件所示gydF4y2Ba4gydF4y2Ba:图S2,每个Group VII ERF蛋白都有一个典型的AP2/ERF dna结合域,该结合域高度保守,由57-61个氨基酸组成,包含3个β-sheet区域和1个α-helix。决定dna结合特异性的关键氨基酸残基是位置14、Ala (A)和19、Asp (D) [gydF4y2Ba10gydF4y2Ba]。gydF4y2Ba
通过基因结构分析比较了大豆ERF基因的内含子和外显子分布。几乎所有的ERF基因都含有一个内含子,除了gydF4y2BaGmERF102gydF4y2Ba,gydF4y2BaGmERF25gydF4y2Ba,gydF4y2BaGmERF78gydF4y2Ba其中不包含内含子(附加文件?gydF4y2Ba5gydF4y2Ba:图S3)。gydF4y2Ba
的表达模式gydF4y2BaGmERF75gydF4y2BaABA处理下gydF4y2Ba
ABA在调节植物种子萌发、生长发育及对环境胁迫的响应等方面发挥着重要作用[j]。gydF4y2Ba10gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba]。据报道,大多数干旱诱导和/或盐诱导基因也被外源ABA处理诱导gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba29gydF4y2Ba],这表明ABA与渗透胁迫信号通路之间存在串扰。gydF4y2Ba
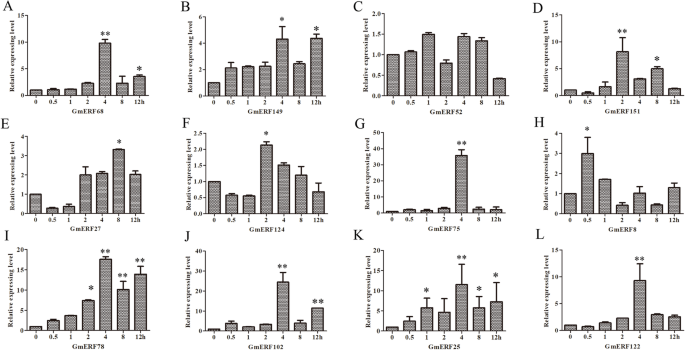
为了研究ABA处理后12个大豆ERFs的表达水平,以ABA处理大豆幼苗下胚轴和根系cDNA为模板,进行了实时荧光定量PCR (qRT-PCR)。如图所示。gydF4y2Ba3.gydF4y2Ba在外源ABA处理下,几乎所有的大豆erf都有不同程度的上调(图2)。gydF4y2Ba3.gydF4y2Bal)。转录水平gydF4y2BaGmERF75gydF4y2Ba表达量最高,在ABA处理后4 h达到最高水平(图2)。gydF4y2Ba3.gydF4y2Ba克)。因此,gydF4y2BaGmERF75gydF4y2Ba被选为进一步研究的对象。gydF4y2Ba
的表达模式gydF4y2BaGmERF75gydF4y2Ba对大豆不同植株组织进行半定量PCR (semi-qPCR)分析。从大豆幼苗的下胚轴、根、茎和叶中提取RNA。平行反应扩增Actin使表达水平正常化。这个结果表明gydF4y2BaGmERF75gydF4y2Ba主要在下胚轴和根中表达,在叶片中表达较少(附加文件gydF4y2Ba6gydF4y2Ba:图S4)。gydF4y2Ba
GmERF75定位于细胞核gydF4y2Ba
的光盘gydF4y2BaGmERF75gydF4y2Ba包含完整的903 bp的开放阅读框(ORF),该框编码300个氨基酸的推定蛋白质(附加文件gydF4y2Ba7gydF4y2Ba:图5)。GmERF75蛋白含有一个假定的碱性氨基酸区(kvpkrqrk),可能作为核定位序列(NLS),以及位于c端区域的酸性氨基酸区EKETEVIEAEEEKNKVLELSEE和EEEEVVVEE,可能作为转录激活域(附加文件)gydF4y2Ba7gydF4y2Ba:图5)。gydF4y2Ba
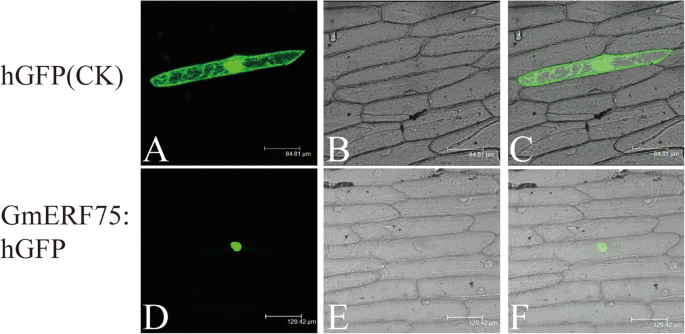
为了研究GmERF75蛋白是否位于细胞核内,研究了GmERF75蛋白的全长ORFgydF4y2BaGmERF75gydF4y2Ba在框架中被放大和融合gydF4y2BahGFPgydF4y2Ba在CaMV 35S启动子调控下,将基因转入洋葱表皮细胞,观察荧光信号(图2)。gydF4y2Ba4gydF4y2Ba).结果表明,GmERF75::hGFP融合蛋白荧光主要在细胞核内观察到。对照细胞的GFP荧光分布于整个细胞。这些结果表明GmERF75融合蛋白是靶向细胞核的。gydF4y2Ba
GmERF75蛋白的亚细胞定位。gydF4y2BaGmERF75gydF4y2Ba-gydF4y2BahGFPgydF4y2Ba病媒与控制gydF4y2BahGFPgydF4y2Ba将载体轰击入活洋葱表皮细胞。利用共聚焦显微镜(Leica)研究了GmERF75在洋葱表皮细胞中的定位。照片是在暗场中拍摄的,以显示绿色荧光(gydF4y2Ba一个gydF4y2Ba和gydF4y2BadgydF4y2Ba)和在强光下观察细胞形态(gydF4y2BabgydF4y2Ba和gydF4y2BaegydF4y2Ba).合并后的暗视场和亮视场图像见(gydF4y2BacgydF4y2Ba和gydF4y2BafgydF4y2Ba).比例尺显示在每张照片的底部gydF4y2Ba
的gydF4y2BaGmERF75gydF4y2Ba启动子区包含多种应激响应元件gydF4y2Ba
进一步研究gydF4y2BaGmERF75gydF4y2Ba, 1809 bp启动子区gydF4y2BaGmERF75gydF4y2BaATG起始密码子上游被分离。假定的gydF4y2Ba独联体gydF4y2Ba-启动子区域的作用元件使用PLACE (gydF4y2Bahttp://www.dna.affrc.go.jp/PLACE/gydF4y2Ba)及植保服务(gydF4y2Bahttp://bioinformatics.psb.ugent.be/webtools/plantcaregydF4y2Ba)数据库。同源的几个不同的调控基序gydF4y2Ba独联体gydF4y2Ba-参与响应非生物和生物胁迫和植物激素的作用元件(表1)gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
许多非生物和生物应激相关gydF4y2Ba独联体gydF4y2Ba-元素分布在的启动子区gydF4y2BaGmERF75gydF4y2Ba。激素响应元件有8个,包括5个ABA相关元件(即一个AERB、两个MYBST1核心结合位点序列、一个DPBF结合位点和一个MYB结合位点)、一个赤霉素响应元件(GARE)、一个SA响应元件(TCA元件)和一个生长素响应元件(TGA元件)。在启动子区域也发现了病原体相关元件(W-box和富含tc的重复序列)。有趣的是,在黄化植物中高度结合而在绿色植物中低结合的REα元素(AACCAA)在黄化植物中被发现gydF4y2BaGmERF75gydF4y2Ba启动子区(表gydF4y2Ba1gydF4y2Ba).此外,还发现了Box-4、G-box、ACE、ACGT-element等一系列光响应元素gydF4y2BaGmERF75gydF4y2Ba启动子区(表gydF4y2Ba1gydF4y2Ba).这些的存在gydF4y2Ba独联体gydF4y2Ba-作用因子提示gydF4y2BaGmERF75gydF4y2Ba可能受到多重压力的调节,这反过来表明gydF4y2BaGmERF75gydF4y2Ba可能参与多种信号转导途径。gydF4y2Ba
的变化gydF4y2BaGmERF75gydF4y2Ba响应非生物胁迫和外源激素的表达gydF4y2Ba
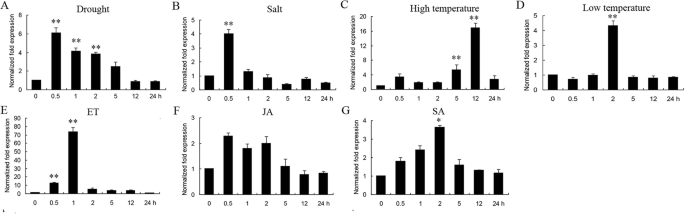
的表达水平gydF4y2BaGmERF75gydF4y2Ba在干旱、盐、高低温等非生物胁迫和外源激素存在下,以大豆幼苗下胚轴和根系中提取的总RNA为模板,进行了qRT-PCR。各处理均增加了gydF4y2BaGmERF75gydF4y2Ba,尤其是ET(大约增加了75倍)。如图所示。gydF4y2Ba5gydF4y2Ba,gydF4y2BaGmERF75gydF4y2Ba在ET作用后1 h内表达量增幅最大,达到75倍,随后表达量逐渐下降至治疗前的正常水平。经高温处理后,gydF4y2BaGmERF75gydF4y2Ba表达量在12 h达到峰值(约18倍),然后在24 h内下降到初始水平(图2)。gydF4y2Ba5gydF4y2Ba).转录的gydF4y2BaGmERF75gydF4y2Ba干旱处理(约6倍)和盐处理(约4倍)也上调了表达量,两种处理的表达量在0.5 h时最高,在24 h内下降到初始水平。低温处理2 h后,GmERF75转录水平提高4倍。表达水平也随着外源SA的增加而增加。这些结果表明gydF4y2BaGmERF75gydF4y2Ba可能在许多与应激相关的信号转导途径中起关键作用[gydF4y2Ba30.gydF4y2Ba]。gydF4y2Ba
的变化gydF4y2BaGmERF75gydF4y2Ba对非生物胁迫处理和外源激素的响应表达。动力学gydF4y2BaGmERF75gydF4y2Ba研究了干旱胁迫下14 d幼苗下胚轴和根系mRNA的积累情况(gydF4y2Ba一个gydF4y2Ba)、NaCl (gydF4y2BabgydF4y2Ba)、高温(gydF4y2BacgydF4y2Ba),以及低温(gydF4y2BadgydF4y2Ba),或用外源激素乙烯(ET,gydF4y2BaegydF4y2Ba)、茉莉酸盐(JA;gydF4y2BafgydF4y2Ba)和水杨酸(SA,gydF4y2BaggydF4y2Ba).每次处理后0、0.5、1、2、5、12和24 h提取总RNA,用于qRT-PCR。数据以三个生物重复的平均值±SD表示gydF4y2Ba
GmERF75gydF4y2Ba过度表达救了两个gydF4y2Ba拟南芥erf71gydF4y2Ba突变体下胚轴伸长gydF4y2Ba
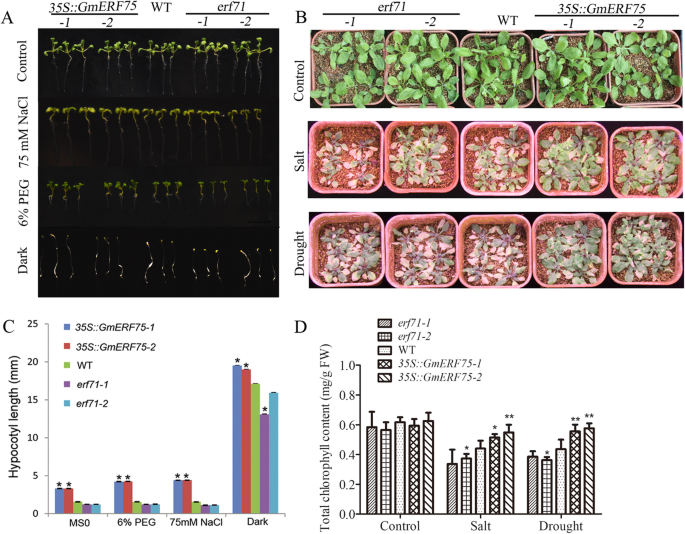
研究…的功能gydF4y2BaGmERF75gydF4y2Ba在gydF4y2Ba拟南芥gydF4y2Ba,gydF4y2BaAtERF71gydF4y2Ba被鉴定为gydF4y2BaGmERF75gydF4y2Ba,与GmERF75相比,具有55.47%的同一性。两个gydF4y2Ba拟南芥erf71gydF4y2Ba突变体(SALK_030459C, CS362782)的根和下胚轴较野生型(WT)短。gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba31gydF4y2Ba[附加文件gydF4y2Ba8gydF4y2Ba:图S6)。评估是否gydF4y2BaGmERF75gydF4y2Ba能拯救的表型gydF4y2Baerf71gydF4y2Ba突变体,gydF4y2BaGmERF75gydF4y2Ba在CaMV 35S启动子控制的两个突变体中引入了gydF4y2BaGmERF75: erf71gydF4y2Ba得到了线条。利用稳定遗传植株T3种子进行进一步表型分析。WT与gydF4y2Baerf71gydF4y2Ba观察到突变体的下胚轴长度。的gydF4y2Baerf71gydF4y2Ba突变体显示较短的下胚轴gydF4y2BaGmERF75: erf71gydF4y2Ba与WT具有相似的表型(附加文件)gydF4y2Ba8gydF4y2Ba:图S6)。这个结果表明gydF4y2BaGmERF75gydF4y2Ba能促进下胚轴生长。gydF4y2Ba
GmERF75gydF4y2Ba转基因植物抗渗透胁迫能力的提高gydF4y2Ba拟南芥gydF4y2Ba植物gydF4y2Ba
的gydF4y2BaGmERF75gydF4y2Ba基因被各种非生物胁迫强烈诱导(图2)。gydF4y2Ba5gydF4y2Ba).评估…的贡献gydF4y2BaGmERF75gydF4y2Ba基因对非生物胁迫的耐受性,二gydF4y2BaGmERF75gydF4y2Ba-overexpressinggydF4y2Ba拟南芥gydF4y2Ba在PEG、NaCl和黑暗条件下培养。的gydF4y2BaGmERF75gydF4y2Ba在不同的非生物胁迫下,过表达系的下胚轴比野生型长gydF4y2Ba拟南芥gydF4y2Ba植物(图。gydF4y2Ba6gydF4y2Baa).下胚轴长度差异最大gydF4y2Ba35 s:: GmERF75gydF4y2Ba用75 mM盐和6% PEG处理5天后,观察细胞系和WT(图2)。gydF4y2Ba6gydF4y2Bac)。gydF4y2Ba
过度的gydF4y2BaGmERF75gydF4y2Ba在gydF4y2Ba拟南芥gydF4y2Ba增强对渗透胁迫的耐受性。gydF4y2Ba一个gydF4y2BaGmERF75gydF4y2Ba-过表达系的下胚轴比WT和2株长gydF4y2Baerf71gydF4y2Ba突变体。gydF4y2Ba拟南芥gydF4y2Ba幼苗的gydF4y2BaGmERF75gydF4y2Ba-过表达、WT和突变体分别在有/没有6% PEG、75 mM NaCl或黑暗条件的MS培养基上生长。gydF4y2BabgydF4y2Ba过度的gydF4y2BaGmERF75gydF4y2Ba在gydF4y2Ba拟南芥gydF4y2Ba增强耐盐、抗旱能力。正常在土壤中生长的3周龄幼苗,用250 mM NaCl浇灌2周或不浇水1周后再浇水1周。gydF4y2BacgydF4y2Ba下胚轴长度为3gydF4y2Ba5 s:: GmERF75gydF4y2Ba,gydF4y2Baerf71gydF4y2Ba, WT。每个处理15 ~ 25个个体计算下胚轴长度。数据以三个生物重复的平均值±SD表示。gydF4y2BadgydF4y2Ba突变体、WT (Col-0)和GmERF75转基因系在干旱和盐处理下的总叶绿素含量。突变体、WT (Col-0)和转基因系的3周龄幼苗分别补充250 mM NaCl或不浇水1周,恢复1周。每个品系采集叶片0.1 g,测定叶绿素含量。数据以每行5次重复的平均值±SD表示。星号表示与WT *有显著差异gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01由学生决定gydF4y2BatgydF4y2Ba测试gydF4y2Ba
目的:试验水稻后期的耐盐性和耐旱性gydF4y2Ba拟南芥gydF4y2Ba,用250 mM NaCl处理3周龄幼苗2周或不浇水1周后重新浇水(图2)。gydF4y2Ba6gydF4y2Bab).记录各品系的叶绿素含量(图2)。gydF4y2Ba6gydF4y2Bad).结果表明,盐处理下转基因植株的叶绿素含量比WT和突变体分别提高了20.11%和39.66%。在干旱处理下,转基因植株的叶绿素含量较WT提高了29.70%gydF4y2BaGmERF75gydF4y2Ba在提高对渗透胁迫的耐受性中起作用gydF4y2Ba拟南芥gydF4y2Ba。gydF4y2Ba
GmERF75gydF4y2Ba转基因大豆毛状根对盐胁迫和外源ABA的耐受性提高gydF4y2Ba
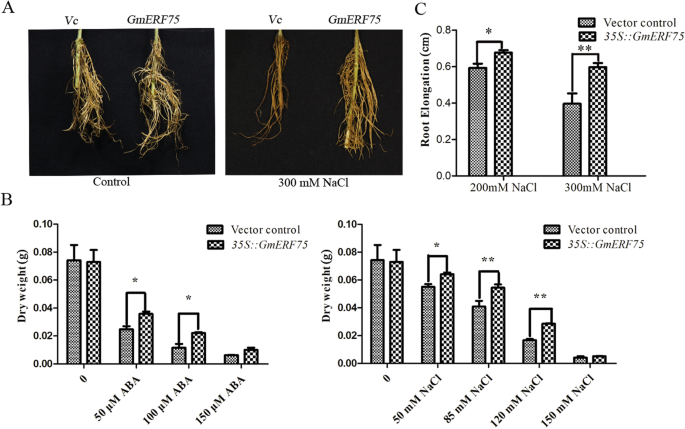
进一步研究的功能gydF4y2BaGmERF75gydF4y2Ba大豆的抗逆性gydF4y2BapgydF4y2BaGFPGUSgydF4y2Ba+gydF4y2Ba用于表达的矢量gydF4y2BapgydF4y2BaGFPGUSgydF4y2Ba+gydF4y2Ba-gydF4y2BaGmERF75gydF4y2Ba构建,然后转化为黄瓜型gydF4y2Ba农杆菌属rhizogenegydF4y2Ba菌株K599,注射到gydF4y2BaSuperrootgydF4y2Ba的gydF4y2BaLotus corniculatusgydF4y2Ba。转基因毛状根在含PEG、NaCl或ABA的1/2 Murashige和Skoog (MS)培养基上培养,并通过GFP荧光进行验证。苗期NaCl处理下转基因毛状根比病媒对照毛状根长得多(图2)。gydF4y2Ba7gydF4y2Baa).转基因毛状根较高的干重也支持了这一结论(图2)。gydF4y2Ba7gydF4y2Bab).如图所示。gydF4y2Ba7gydF4y2BaB,转基因毛状根用gydF4y2BapgydF4y2BaGFPGUSgydF4y2Ba+gydF4y2Ba-gydF4y2BaGmERF75gydF4y2Ba在不同浓度的NaCl和ABA处理下,均表现出比空载体对照更强的生长。转基因毛状根与对照毛状根在85和120 mM NaCl处理下差异极显著,在50和100 μM ABA处理下差异也极显著。而在PEG条件下,转基因毛状根与病媒控制毛状根无明显差异(数据未显示)。这些结果表明gydF4y2BaGmERF75gydF4y2Ba能提高大豆的盐度和外源ABA耐受性。gydF4y2Ba
GmERF75gydF4y2Ba提高大豆毛状根耐盐性。gydF4y2Ba一个gydF4y2Ba毛根分别用二进制向量变换gydF4y2BapgydF4y2BaGFPGUSgydF4y2Ba+gydF4y2Ba-gydF4y2BaGmERF75gydF4y2Ba还有矢量控制gydF4y2BapgydF4y2BaGFPGUSgydF4y2Ba+gydF4y2Ba(Vc)使用gydF4y2Ba答:rhizogenesgydF4y2BaK599在添加或不添加300 mM NaCl的1/2 MS培养基上培养2周。在应力处理结束时拍摄图像。gydF4y2BabgydF4y2Ba根干重gydF4y2BapgydF4y2BaGFPGUSgydF4y2Ba+gydF4y2Ba-gydF4y2BaGmERF75gydF4y2Ba不同浓度NaCl和ABA处理下生长的Vc毛状根。数据以每个处理的三个独立重复的平均值±SD表示。gydF4y2BacgydF4y2Ba长度的gydF4y2BapgydF4y2BaGFPGUSgydF4y2Ba+gydF4y2Ba-gydF4y2BaGmERF75gydF4y2Ba和Vc毛状根。星号表示与*处的病媒控制有显著差异gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01由学生决定gydF4y2BatgydF4y2Ba测试gydF4y2Ba
讨论gydF4y2Ba
转录因子作为激活因子或抑制因子,分别上调或下调一系列靶基因,其过表达可调节植物的胁迫耐受性[gydF4y2Ba32gydF4y2Ba]。据报道,许多转录因子参与植物抵御多种非生物和生物刺激,如WRKY [gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba], myb [gydF4y2Ba35gydF4y2Ba], nac [gydF4y2Ba36gydF4y2Ba]及ERF [gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba37gydF4y2Ba]。因此,新的转录因子基因的鉴定和功能分析对于了解植物抗逆的分子机制具有重要意义,有助于提高作物的产量。ERF转录因子已被证明参与对环境应激的反应[gydF4y2Ba5gydF4y2Ba]。本研究对160个大豆erf进行了鉴定和表征。为了更好地理解ERF介导的应激反应,一个高度aba诱导的大豆ERF,gydF4y2BaGmERF75gydF4y2Ba研究了其在应激信号转导通路中的作用。gydF4y2Ba
GmERF75gydF4y2Ba可能整合SA和ET/JA通路gydF4y2Ba
高等植物在非生物胁迫下的信号转导途径极其复杂和复杂[gydF4y2Ba38gydF4y2Ba]。植物在抗旱、抗盐、抗寒等环境胁迫过程中,激素信号转导途径与不同的环境胁迫有关。已经证实SA和JA通路之间以及JA/ET和ABA通路之间存在拮抗作用,可以精确调控应激相关基因的表达[gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba]。因此,在防御反应过程中,一些植物防御基因的表达水平受到多种信号通路的影响[gydF4y2Ba42gydF4y2Ba]。gydF4y2Ba
已知某些ERF转录因子是不同信号通路的靶点[gydF4y2Ba5gydF4y2Ba]。例如,gydF4y2BaERF1gydF4y2Ba可以被ET或JA快速激活或由两者协同激活[gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba]。gydF4y2BaAtERF4gydF4y2Ba作为转录抑制因子,可以被ET和JA诱导[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba45gydF4y2Ba]。同时,SA信号转导通路可与ET/JA通路拮抗[gydF4y2Ba46gydF4y2Ba,gydF4y2Ba47gydF4y2Ba]。然而,在这项研究中gydF4y2BaGmERF75gydF4y2Ba外源SA、JA和ET均可诱导gydF4y2BaGmERF75gydF4y2Ba可以被SA和JA/ET两种途径激活(图2)。gydF4y2Ba5gydF4y2Ba) [gydF4y2Ba48gydF4y2Ba]。这些结果表明gydF4y2BaGmERF75gydF4y2Ba可能整合来自SA和ET/JA途径的信号,但在大豆苗期不参与它们之间的拮抗相互作用。gydF4y2Ba
的作用gydF4y2BaGmERF75gydF4y2Ba在增加下胚轴长度gydF4y2Ba
下胚轴伸长受外在和内在信号的共同调节,包括光和植物激素[gydF4y2Ba49gydF4y2Ba,gydF4y2Ba50gydF4y2Ba,gydF4y2Ba51gydF4y2Ba]。植物已经进化出一个复杂的光感受器网络和许多下游信号因子,使它们能够响应和适应周围的光环境[gydF4y2Ba52gydF4y2Ba]。vonArnim等人发现gydF4y2Ba拟南芥gydF4y2Ba光照下生长的幼苗通过光形态发生表现出短的下胚轴和开放的子叶,叶绿体具有功能,而黑暗生长的幼苗则表现出长下胚轴和封闭的子叶,并通过黄化或光形态发生的过程发育出黄化体[gydF4y2Ba53gydF4y2Ba]。据报道,光照与下胚轴细胞伸长密切相关[gydF4y2Ba54gydF4y2Ba,gydF4y2Ba55gydF4y2Ba],并且光感受器可以调节下游转录因子,如伸长下胚轴l5 (HY5) [gydF4y2Ba56gydF4y2Ba]。HY5可间接影响ABA、ET、JA等多种激素信号转导通路的转导[gydF4y2Ba57gydF4y2Ba]。在这项研究中,gydF4y2BaGmERF75gydF4y2Ba主要表达在下胚轴(附加文件gydF4y2Ba6gydF4y2Ba:图S4),并可被外源ABA、ET和JA诱导(图4)。gydF4y2Ba5gydF4y2Ba),这表明gydF4y2BaGmERF75gydF4y2Ba这些激素信号通路下游的功能。的gydF4y2Baerf71gydF4y2Ba突变体的下胚轴较短gydF4y2BaGmERF75: erf71gydF4y2Ba品系与WT下胚轴的长度无显著差异(附加文件)gydF4y2Ba7gydF4y2Ba:图5)。这些结果表明gydF4y2BaGmERF75gydF4y2Ba可能参与光感受器- hy5 - aba /ET/JA信号转导通路,调节下胚轴生长。此外,启动子分析显示有6个光响应gydF4y2Ba独联体gydF4y2Ba的启动子区的-元素gydF4y2BaGmERF75gydF4y2Ba这表明该基因可能直接受到光的调节。综上所述,这些结果表明GmERF75可能通过光相关信号通路调节下胚轴的伸长。gydF4y2Ba
GmERF75gydF4y2Ba可能是多种非生物信号通路的重要因素gydF4y2Ba
众所周知,植物中各种激素和胁迫信号通路之间存在着复杂的联系,一个基因可能同时在多种不同的信号通路中发挥作用。过度的gydF4y2BaJcDREB2gydF4y2Ba物理坚果AP2/ERF基因在水稻中可抑制部分赤霉素生物合成基因的表达,诱导耐盐相关基因调控盐胁迫反应[gydF4y2Ba58gydF4y2Ba]。gydF4y2BaAhDREB1gydF4y2Ba是花生AP2/ERF家族的重要成员。gydF4y2Ba拟南芥gydF4y2Ba植物overexpressinggydF4y2BaAhDREB1gydF4y2Ba具有更高的ABA敏感性,下游干旱胁迫相关基因的表达水平发生改变,这表明gydF4y2BaAhDREB1gydF4y2Ba可以通过影响aba依赖途径来提高对干旱的耐受性[gydF4y2Ba59gydF4y2Ba]。同样,转基因烟草植株表达gydF4y2BaGmERF9gydF4y2Ba对干旱和寒冷胁迫的耐受性增强,PR基因如PR1和PR2的表达水平增加[gydF4y2Ba60gydF4y2Ba]。在这项研究中,两者都是转基因的gydF4y2Ba拟南芥gydF4y2Ba植物和大豆毛状根表达gydF4y2BaGmERF75gydF4y2Ba表现出较高的耐盐性和较低的ABA敏感性。这些结果表明gydF4y2BaGmERF75gydF4y2Ba可能参与盐和aba相关的信号通路。基于这些发现,我们的结论是gydF4y2BaGmERF75gydF4y2Ba编码一种转录因子,可能是渗透胁迫信号转导途径的重要决定因素gydF4y2Ba拟南芥gydF4y2Ba和大豆。gydF4y2Ba
结论gydF4y2Ba
GmERF75是一种定位于细胞核的蛋白,对多种非生物胁迫和外源激素有反应。两个独立的gydF4y2Ba拟南芥gydF4y2Ba突变的gydF4y2BaAtERF71gydF4y2Ba,同源基因gydF4y2BaGmERF75gydF4y2Ba,下胚轴较短,过表达gydF4y2BaGmERF75gydF4y2Ba在这些突变体中可以挽救短的下胚轴表型。gydF4y2BaGmERF75gydF4y2Ba-overexpressinggydF4y2Ba拟南芥gydF4y2Ba在干旱和盐胁迫下,叶绿素含量较高。OverexpressinggydF4y2BaGmERF75gydF4y2Ba大豆毛状根在外源ABA和盐胁迫下的生长均有改善。GmERF75是一种重要的植物转录因子,在提高两种植物的渗透耐受性方面起着关键作用gydF4y2Ba拟南芥gydF4y2Ba和大豆。gydF4y2Ba
方法gydF4y2Ba
大豆基因组中ERF基因的数据库检索和染色体分布gydF4y2Ba
大豆全基因组序列和重复序列信息来源于JGI Glyma1.0注释(gydF4y2Bahttp://www.phytozome.net/index.phpgydF4y2Ba) [gydF4y2Ba61gydF4y2Ba]。大豆基因芯片数据来源于SoyBase (gydF4y2Bahttp://www.soybase.org/gydF4y2Ba) [gydF4y2Ba62gydF4y2Ba]。利用Phytozome的染色体位点信息确定其染色体分布。使用MapInspect程序绘制染色体分布图。gydF4y2Ba
比对与系统发育分析gydF4y2Ba
我们使用了Pfam [gydF4y2Ba24gydF4y2Ba) (gydF4y2Bahttp://pfam.sanger.ac.uk/gydF4y2Ba)及SMART资料库[gydF4y2Ba25gydF4y2Ba) (gydF4y2Bahttp://smart.embl-heidelberg.de/gydF4y2Ba)作为鉴定160个非冗余大豆erf的参考(附加文件gydF4y2Ba1gydF4y2Ba:表1)。使用ClustalX进行氨基酸序列比对,并手工校正。利用MEGA 5.1软件采用邻居连接法构建大豆ERFs系统发育树[gydF4y2Ba26gydF4y2Ba]。gydF4y2Ba
表达谱及基因结构分析gydF4y2Ba
利用大豆基因芯片对不同组织和发育阶段的表达数据进行表达分析。12个大豆ERF基因的基因组DNA序列和相应的编码序列已提交给基因结构显示服务器(GSDS)网站(gydF4y2Bahttp://gsds.cbi.pku.edu.cn/gydF4y2Ba)使基因结构形象化[gydF4y2Ba63gydF4y2Ba]。采用多模序激发(MEME)软件对保守基序进行分析。使用DNAMAN软件对序列进行比对。gydF4y2Ba
蛋白质结构域和同源性建模gydF4y2Ba
将12个第VII组ERF基因的氨基酸序列提交到蛋白质折叠识别服务器(PHYRE2) (gydF4y2Bahttp://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=indexgydF4y2Ba)进行结构同源性建模。使用dog2.0绘制蛋白结构域。gydF4y2Ba
植物材料与胁迫处理gydF4y2Ba
大豆苗(gydF4y2Ba大豆gydF4y2Ba简历。铁峰8号在25℃土壤中生长14 d,经受各种非生物胁迫和外源激素处理。为了研究外源ABA对ERF转录家族的影响,将大豆幼苗在100 μM ABA中培养0、0.5、1、2、4、8和12 h [qh]gydF4y2Ba64gydF4y2Ba]。为了研究非生物胁迫对ERF转录家族的影响,我们将幼苗置于0、0.5、1、2、5、12和24小时的胁迫下。为了快速诱导干旱胁迫,将幼苗暴露在滤纸上的空气中[gydF4y2Ba65gydF4y2Ba]。对于冷胁迫,将幼苗置于4°C的室中[gydF4y2Ba66gydF4y2Ba]。高温处理时,将幼苗置于42°C的烘箱中;盐胁迫时,将幼苗置于200 mM NaCl中培养[gydF4y2Ba35gydF4y2Ba]。为了研究外源激素SA和JA对幼苗生理和分子反应的影响,将幼苗分别在50 μM SA和50 μM JA中孵育0、0.5、1、2、5、12和24 h。将幼苗置于密封的塑料箱中,浓度为200 μl 1gydF4y2Ba−1gydF4y2Ba通过注射乙烯0、0.5、1、2、5、12或24小时[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba67gydF4y2Ba,gydF4y2Ba68gydF4y2Ba]。每个处理42只,随机分为3组,每组3个重复。每个时间点采集2个个体的下胚轴和根作为样本,立即在液氮中冷冻,保存于- 80°C,用于提取RNA。每次治疗的每个时间点有三次重复。gydF4y2Ba
RNA提取,半qpcr和qRT-PCRgydF4y2Ba
采用Trizol试剂提取下胚轴和根的总RNA,提取方法参照中国天根标准。经DNase I处理后,用PrimeScript第一链cDNA合成试剂盒(TaKaRa, Japan)合成cDNA。采用半qpcr方法研究gydF4y2BaGmERF75gydF4y2Ba在不同的大豆植物组织中。从大豆幼苗的下胚轴、根、茎和叶中提取RNA。平行反应扩增肌动蛋白使表达水平正常化。采用qRT-PCR分析了大豆ERF基因在不同非生物胁迫和外源激素下的表达规律。大豆erf的qRT-PCR分析使用SYBR Premix Ex Taq™试剂盒(TaKaRa,日本),按照制造商的协议进行。如前所述,使用ABI Prism 7500序列检测系统(ThermoFisher Scientific, USA)分析表达模式[gydF4y2Ba69gydF4y2Ba,gydF4y2Ba70gydF4y2Ba]。利用Primer Premier 5.0软件设计大豆ERF基因qRT-PCR引物,对保守的AP2/ERF结构域外的区域进行预处理,大豆Actin (U60506) [gydF4y2Ba71gydF4y2Ba]作为规范模板cDNA数量的内控。用于qRT-PCR的引物在附加文件中列出gydF4y2Ba9gydF4y2Ba:表S3。gydF4y2Ba
克隆gydF4y2BaGmERF75gydF4y2Ba
的全长ORFgydF4y2BaGmERF75gydF4y2Ba用引物5 ' -ATGGCGAACGCAGCTGAAGTTT-3 '和5 ' - taccaccgccacgagcg -3 '从大豆cDNA中扩增得到。将PCR产物克隆到gydF4y2BapgydF4y2BaEASY-T1载体(TransGen,中国)。gydF4y2Ba
亚细胞定位测定gydF4y2Ba
为了研究推测的NLSs的生物活性,我们对NLSs的cDNA全长序列进行了分析gydF4y2BaGmERF75gydF4y2Ba融合到?的n端gydF4y2Ba人源化绿色荧光蛋白gydF4y2Ba(gydF4y2BahGFPgydF4y2Ba双花椰菜花叶病毒(2 × CaMV) 35S启动子控制的)基因。重组质粒和对照质粒(gydF4y2BahGFPgydF4y2Ba载体)轰击成活的洋葱表皮细胞。的可视化gydF4y2BahGFPgydF4y2Ba在洋葱表皮细胞中的表达如前所述[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba33gydF4y2Ba]。gydF4y2Ba
转基因的产生gydF4y2Ba拟南芥gydF4y2Ba压力治疗gydF4y2Ba
的编码序列gydF4y2BaGmERF75gydF4y2Ba利用引物5 ' -TGATTACGCCAAGCTTATGGCGAACGCAGCTGAAGTTT-3 '和5 ' -CCGGGGATCCTCTAGACACCGCCACGAGCG-3 '进行扩增,在CaMV 35S启动子的控制下克隆到pBI121中,生成gydF4y2Ba35 s:: GmERF75gydF4y2Ba构造。经测序确认,并转化为WTgydF4y2Ba拟南芥gydF4y2Ba植物(Col-0)采用真空渗透法[gydF4y2Ba72gydF4y2Ba,gydF4y2Ba73gydF4y2Ba]。筛选转基因拟南芥种子,利用2个转基因品系T3种子进行进一步表型分析。gydF4y2Ba
对于表型分析,gydF4y2BaGmERF75gydF4y2Ba超表达,gydF4y2Baerf71gydF4y2Ba突变体和WTgydF4y2Ba拟南芥gydF4y2Ba两叶期的幼苗转移到含有6% PEG和75 mM NaCl的MS培养基中,或置于暗处。每次处理,每系15 ~ 25个个体计算下胚轴长度。每种处理进行3次独立的生物重复。gydF4y2Ba
试验了后期抗旱性和耐盐性gydF4y2Ba拟南芥gydF4y2Ba幼苗的gydF4y2BaGmERF75gydF4y2Ba超表达,gydF4y2Baerf71gydF4y2Ba突变体和WT分别在MS培养基上发芽后转入土壤正常生长。每个品系将所有幼苗分成12个盆栽,每个盆栽6株。3周龄的幼苗用250 mM NaCl进行2周的盐处理。通常在土壤中生长的三周大的幼苗没有浇水进行干旱处理。一周后,观察到不同的表型。的gydF4y2Ba拟南芥gydF4y2Ba植株重新浇水,恢复1周,每株收集叶片。通常浇水的植物作为对照。每个处理进行3次独立重复。为了量化表型gydF4y2Ba拟南芥gydF4y2Ba对盐和干旱的响应,根据方案(Cominbio, China)测定各品系的叶绿素含量。取0.1 ggydF4y2Ba拟南芥gydF4y2Ba每条线的叶子,用蒸馏水洗净。加入1毫升80%的丙酮,混合均匀,浸一夜,直到叶子完全变白。向1ml比色皿中加入80%丙酮,调零。测定样品在663 nm和645 nm处的吸光度值,记录为AgydF4y2Ba663gydF4y2Ba和一个gydF4y2Ba645gydF4y2Ba。总叶绿素含量(mg/g FW) = (20.21*A)gydF4y2Ba645gydF4y2Ba+ 8.02 *gydF4y2Ba663gydF4y2Ba)*1 mL/0.05 g/1000gydF4y2Ba
大豆毛状根诱导及胁迫处理gydF4y2Ba
幼苗生长、生根、毛状根诱导和毛状根转化均按照Chen等人的描述进行。[gydF4y2Ba74gydF4y2Ba,gydF4y2Ba75gydF4y2Ba]。用氯气灭菌的大豆种子在B5培养基中萌发。取4日龄幼苗的子叶作为外植体,以K599为载体,用手术刀刺伤gydF4y2BapgydF4y2BaGFPGUSgydF4y2Ba+gydF4y2Ba-gydF4y2BaGmERF75gydF4y2Ba二值向量为5天生长,用于转化gydF4y2BaSuperrootgydF4y2Ba派生的gydF4y2Bal . corniculatusgydF4y2Ba植株生长11天左右观察毛状根。通过荧光荧光法对转基因毛状根进行了验证。然后共256个GFP阳性(GFP)gydF4y2Ba+gydF4y2Ba)毛状根在1/2 MS培养基上培养,培养基中分别添加50、85、120或150 mM NaCl,或50、100或150 μM ABA,在24°C下16/8 h明暗循环培养2周。105℃孵育24 h后,计算干重增量(每单位30根)并记录。gydF4y2Ba
45株大豆幼苗子叶节(gydF4y2Ba大豆gydF4y2Ba简历。铁峰8)在蛭石中25℃培养7天感染gydF4y2BapgydF4y2BaGFPGUSgydF4y2Ba+gydF4y2Ba-gydF4y2BaGmERF75gydF4y2Ba以及病媒控制。在土壤中生长大约20天后,毛茸茸的根就会发芽。将转基因毛状根和对照分别给予不同浓度的NaCl处理1周后,测定其根伸长。每个处理进行3次独立重复。gydF4y2Ba
统计分析gydF4y2Ba
对于单一时间点的实验,进行三次生物重复。对于多时间点的实验,进行了3次独立的生物重复和3次技术重复。数据以所有重复的平均值±SD表示。星号表示与*处的对照有显著差异或极显著差异gydF4y2BaPgydF4y2Ba< 0.05或**gydF4y2BaPgydF4y2Ba< 0.01,由Student’sgydF4y2BatgydF4y2Ba测试。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
本研究使用的数据集可在JGI Glyma1.0存储库中获得。gydF4y2Bahttps://phytozome.jgi.doe.gov/pz/portal.htmlgydF4y2Ba。gydF4y2Ba
缩写gydF4y2Ba
- 阿坝:gydF4y2Ba
-
脱落酸gydF4y2Ba
- ACC:gydF4y2Ba
-
1-aminocyclopropane-l-carboxylic酸gydF4y2Ba
- 广告:gydF4y2Ba
-
激活域gydF4y2Ba
- AP2:gydF4y2Ba
-
APETALA2gydF4y2Ba
- CaMV:gydF4y2Ba
-
花椰菜花叶病毒gydF4y2Ba
- DPBF:gydF4y2Ba
-
启动子结合因子gydF4y2Ba
- DRE / CRT:gydF4y2Ba
-
Dehydration-responsive元素/ C-repeatgydF4y2Ba
- EREBP:gydF4y2Ba
-
乙烯反应元件结合蛋白gydF4y2Ba
- 小块土地:gydF4y2Ba
-
Ethylene-responsive因素gydF4y2Ba
- 等:gydF4y2Ba
-
乙烯gydF4y2Ba
- 绿色荧光蛋白:gydF4y2Ba
-
绿色荧光蛋白gydF4y2Ba
- 格斯:gydF4y2Ba
-
β葡萄糖醛酸酶gydF4y2Ba
- 是:gydF4y2Ba
-
茉莉酸gydF4y2Ba
- 存在:gydF4y2Ba
-
实时定量PCRgydF4y2Ba
- rt - pcr:gydF4y2Ba
-
反转录PCRgydF4y2Ba
- 山:gydF4y2Ba
-
水杨酸gydF4y2Ba
- WT:gydF4y2Ba
-
野生型gydF4y2Ba
参考文献gydF4y2Ba
阿特金森NJ,厄温PE。植物生物和非生物胁迫的相互作用:从基因到田间。实验学报,2012;63(10):3523-43。gydF4y2Ba
李建军,李建军,李建军,等。植物抗逆转录因子的研究进展。植物学报,2002;5(5):430-6。gydF4y2Ba
秦丽萍,王立强,郭艳,李艳,乌慕华,王玉成。柽柳ERF转录因子ThCRF1通过调节渗透电位和活性氧清除能力来提高耐盐性。植物科学,2017;26(5):564 - 564。gydF4y2Ba
冯志军,何光华,郑文杰,卢鹏鹏,陈敏,龚彦明,马永忠,徐志生。谷子NF-Y家族:全基因组调查和进化分析发现了两个在非生物胁迫中重要的功能基因。植物科学,2015;6:1142。gydF4y2Ba
徐志生,陈敏,李丽玲,马永忠。ERF转录因子家族在植物中的功能。植物学。2008;86(9):969 - 77。gydF4y2Ba
李建军,李建军,李建军,等。aptala2 /乙烯反应因子(AP2/ERF)转录因子的研究进展。植物学报,2013,39(3):639-49。gydF4y2Ba
Nakano T, Suzuki K, Fujimura T, Shinshi H.拟南芥和水稻ERF基因家族全基因组分析。植物生理学报,2006;14(2):411 - 432。gydF4y2Ba
李安,于昕,曹宝宝,彭立祥,高燕,冯涛,李宏,任志强。LkAP2L2,一个AP2/ERF转录因子基因gydF4y2Ba落叶松属kaempferigydF4y2Ba,在植物分支和种子发育中具有多效性作用。[J] .热物理学报,2017;53(12):1335-42。gydF4y2Ba
孙文强,高大伟,熊宇,唐晓霞,肖晓峰,王荣荣,于淑萍。水稻AP2/ERF转录因子毛状叶6与OsWOX3B互作调控毛状体形成植物学报,2017;10(11):1417-33。gydF4y2Ba
Allen MD, Yamasaki K, Ohme-Takagi M, Tateno M, Suzuki M. DNA复合体中GCC-box结合结构域溶液结构揭示的β -sheet DNA识别新模式。中华医学杂志。1998;17(18):584 - 596。gydF4y2Ba
Welsch R, Maass D, Voegel T, DellaPenna D, Beyer P.转录因子RAP2.2及其相互作用伙伴SINAT2:拟南芥叶片胡萝卜素生成的稳定因子。植物生理学报,2007;35(3):1073 - 1085。gydF4y2Ba
王晓明,王晓明,王晓明,等。拟南芥erf - 7转录因子与基因表达的关系。植物学报,2016;28(1):160-80。gydF4y2Ba
杨忠,田琳,Latoszek-Green M, Brown D,吴克强。拟南芥ERF4是一种能够调节乙烯和脱落酸反应的转录抑制因子。植物化学学报,2005;31(4):585 - 596。gydF4y2Ba
孙晓华,于刚,李金杰,刘建林,王晓玲,朱国良,张晓华,潘海燕。拟南芥叶根丛乙烯响应因子AcERF2正调控渗透和抗病。植物科学,2018;27(4):332 - 343。gydF4y2Ba
万丽丽,吴永勇,黄建强,戴晓峰,雷勇,闫丽丽,蒋洪华,张建军,Varshney RK,廖宝生。花生ERF基因的鉴定及AhERF008和AhERF019在非生物胁迫响应中的功能分析函数积分。2014;14(3):467-77。gydF4y2Ba
李建军,李建军,李建军,等。向日葵aptala2 /乙烯响应因子(AP2/ERF)转录因子家族的研究。Sci Rep-Uk。2018; 8(1): 11576。gydF4y2Ba
谢晓玲,夏晓军,匡生,张晓玲,尹晓荣,于建强,陈建康。一个新的乙烯响应因子CitERF13在光合作用调控中起作用。植物科学,2017;56(6):1129 - 1129。gydF4y2Ba
田志东,何强,王红霞,刘勇,张勇,邵峰,谢超。马铃薯ERF转录因子StERF3负调控马铃薯对疫霉的抗性和耐盐性。植物生理学报,2015;56(5):992-1005。gydF4y2Ba
朱建军,刘建军,刘建军,刘建军,等。拟南芥erf - 7转录因子活性的年龄依赖性调控。植物学报,2017,40(10):2333-46。gydF4y2Ba
徐志生,夏立强,陈敏,程晓刚,张瑞瑞,李立林,赵永勇,卢勇,倪志勇,刘磊,等。提高小麦多重胁迫耐受性的乙烯响应因子1 (TaERF1)的分离与分子特性研究植物化学学报,2009;36(6):719 - 722。gydF4y2Ba
邢丽萍,狄志成,杨文文,刘建强,李明明,王晓军,崔春春,王学祥,王晓霞,张荣强,等。海纳藻ERF1-V过表达可以增强小麦对白粉病的抗性,提高小麦对盐胁迫和干旱胁迫的耐受性。植物科学,2017;8:1948。gydF4y2Ba
朱晓玲,齐玲,刘霞,蔡世彬,徐红军,黄瑞荣,李晓玲,魏晓娜,张志勇。小麦乙烯反应因子转录因子病原菌诱导的ERF1介导宿主对坏死性病原体玉米根丝核菌和冰冻胁迫的反应。植物生理学报,2014;32(3):559 - 564。gydF4y2Ba
金勇,潘文伟,郑晓峰,程霞,刘明明,马辉,葛晓晨。ERF家族转录因子OsERF101调控生殖组织的干旱胁迫反应。植物化学学报,2018;32(1):391 - 391。gydF4y2Ba
Finn RD, Coggill P, Eberhardt RY, Eddy SR, Mistry J, Mitchell AL, Potter SC, Punta M, Qureshi M, Sangrador-Vegas A,等。Pfam蛋白质家族数据库:迈向更可持续的未来。中国生物医学工程学报,2016;44(1):379 - 379。gydF4y2Ba
张建军,张建军,李建军,等。一种基于模块化结构的信号域识别方法。《美国科学院学报》。1998, 95(11): 5857 - 64。gydF4y2Ba
田村K, Peterson D, Peterson N, stechher G, Nei M, Kumar S. MEGA5:基于最大似然、进化距离和最大简约方法的分子进化遗传学分析。生物医学进展,2011;28(10):2731-9。gydF4y2Ba
郭建明,陈建军,陈建军。保护细胞脱落酸信号传导与植物抗旱性工程研究。大自然。2001;410(6826):327 - 30。gydF4y2Ba
熊立明,Schumaker KS,朱建军。在寒冷、干旱和盐胁迫下的细胞信号。植物学报,2002;14:559 - 559。gydF4y2Ba
Seki M, Ishida J, Narusaka M, Fujita M, Nanjo T, mezawa T, Kamiya A, Nakajima M, Enju A, Sakurai T,等。利用全长cDNA芯片监测ABA处理下约7000个拟南芥基因的表达模式。函数集成基因组学。2002;2(6):282-91。gydF4y2Ba
徐志生,陈敏,李丽玲,马永忠。AP2/ERF转录因子家族在作物改良中的作用及应用植物遗传学报,2011;33(7):557 - 557。gydF4y2Ba
王旭,景玉军,张伯良,周永华,林瑞麟。糖基转移酶样蛋白ABI8/ELD1/KOB1通过调节纤维素生物合成促进拟南芥下胚轴伸长。植物学报,2015;38(3):411-22。gydF4y2Ba
王晓明,王晓明,王晓明,等。植物热胁迫转录调控网络的研究进展。植物科学进展,2017;22(1):53-65。gydF4y2Ba
何国光,徐建勇,王义勇,刘建明,李培平,陈敏,马玉柱,徐志生。小麦WRKY转录因子TaWRKY1和TaWRKY33基因对干旱敏感,从而赋予拟南芥干旱和/或耐热性。植物学报,2016;16(1):116。gydF4y2Ba
王春春,茹金宁,刘云伟,李敏,赵东,杨建峰,傅建东,徐志生。玉米WRKY转录因子ZmWRKY106赋予转基因植株抗旱耐热性中华医学杂志,2018;19(10):3046。gydF4y2Ba
杜玉涛,赵俊杰,王春川,高燕,王永勇,刘云伟,陈敏,陈杰,周玉波,徐志生,等。GmMYB118对干旱和盐胁迫响应的鉴定与表征。植物学报,2018;18(1):320。gydF4y2Ba
王晓明,王晓明,王晓明,等。拟南芥NAC转录因子ANAC087和ANAC046的表达及其对植物生长的调控作用。植物营养学报,2018,29(4):557 - 557。gydF4y2Ba
李建军,李建军,李建军,李建军,李建军。在拟南芥中,高光响应的快速逆行信号涉及代谢物输出、丝裂原激活蛋白激酶6和AP2/ERF转录因子。植物学报,2014,26(3):1151-65。gydF4y2Ba
McGrath KC, Dombrecht B, Manners JM, Schenk PM, Edgar CI, Maclean DJ, Scheible WR, Udvardi MK, Kazan K.拟南芥转录因子基因表达的抑制因子和激活因子型乙烯应答因子在茉莉酸信号传导和抗病性中的作用。植物生理学报,2005;39(2):949 - 959。gydF4y2Ba
Anderson JP, Badruzsaufari E, Schenk PM, Manners JM, Desmond OJ, Ehlert C, Maclean DJ, Ebert PR, Kazan K.脱落酸与茉莉酸-乙烯信号通路的拮抗作用调控拟南芥防御基因的表达和抗性。植物学报,2004;16(12):3460-79。gydF4y2Ba
高桥,金山,郑MS, Kusano T, Hase S, Ikegami M, Shah J.拟南芥对黄瓜花叶病毒的防御基因表达和基因对基因的抗性调控。植物生理学报,2004;45(6):803-9。gydF4y2Ba
Kariola T, Brader G, Li J, Palva ET.叶绿素酶1影响植物防御途径的平衡。植物学报。2005;17(1):282-94。gydF4y2Ba
Shahnejat-Bushehri S, Tarkowska D, Sakuraba Y, Balazadeh S.拟南芥NAC转录因子JUB1调控GA/BR代谢和信号转导。植物学报,2016;2(3):16013。gydF4y2Ba
乙烯响应因子1介导拟南芥对土传真菌尖孢镰刀菌的抗性。植物学报,2004;17(7):763-70。gydF4y2Ba
王晓明,王晓明,王晓明,等。植物防御过程中乙烯响应因子1的表达及其调控机制。植物学报。2003;15(1):165-78。gydF4y2Ba
李建军,李建军,李建军,李建军。GCC-box在茉莉酸介导的拟南芥PDF1.2基因激活中的作用。植物生理学报,2003;32(2):1020 - 1032。gydF4y2Ba
赵玉峰,刘建军,刘建军,刘建军,刘建军。丁香假单胞菌的毒力系统。番茄利用茉莉酸信号通路促进番茄细菌性斑点病的发生。植物学报,2003;36(4):485 - 485。gydF4y2Ba
Glazebrook J,陈文军,Estes B, Chang HS, Nawrath C, Metraux JP, Zhu T, Katagiri F.水杨酸盐和茉莉酸盐信号转导网络的整体表达表型。植物学报,2003;34(2):217-28。gydF4y2Ba
烟草乙烯应答转录因子家族新成员NtERF5的过表达增强了烟草花叶病毒抗性。植物学报,2004;17(10):1162 - 1171。gydF4y2Ba
范德波,陈建军,陈建军,等。植物生长发育过程中激素与乙烯的相互作用。植物生理学报,2015;36(1):61-72。gydF4y2Ba
Vandenbussche F, Vancompernolle B, Rieu I, Ahmad M, Phillips A, Moritz T, Hedden P, Van Der Straeten D.乙烯诱导拟南芥下胚轴伸长依赖于赤霉素而非赤霉素介导。[J] .中国生物医学工程学报,2009;33(5):389 - 391。gydF4y2Ba
范登波,李建军,李建军,等。乙烯在植物生长发育中的作用。植物学报,2012;19(4):895-909。gydF4y2Ba
陈敏,陈建军,范浩,等。植物光信号转导的研究进展。医学学报。2004;38:87-117。gydF4y2Ba
冯阿尼姆A,邓小文。幼苗发育的光控制。植物学报。1996;47:215-43。gydF4y2Ba
柴婉娟,王文峰,朱建勇,吴娥,王志强。植物生长调控中的信息集成与通讯。细胞。2016;164(6):1257 - 68。gydF4y2Ba
王晓明,王晓明,王晓明,等。植物生长发育的光介导激素调控。植物学报,2016;37(2):513 - 537。gydF4y2Ba
罗晓明,林文辉,朱文文,朱建勇,孙勇,范学勇,程明林,郝玉青,吴娥,田敏,等。GATA转录因子在拟南芥中整合光和油菜素内酯信号通路。开发细胞,2010;19(6):872-83。gydF4y2Ba
刘绍文,邓小文。植物激素信号变亮:光和激素的整合者。植物学报,2010;13(5):571-7。gydF4y2Ba
唐永华,刘凯,张军,李晓林,徐kd,张勇,齐军,于德生,王军,李超。物理坚果AP2/ERF基因JcDREB2可改变转基因水稻的生长和盐胁迫反应。植物科学,2017;8:306。gydF4y2Ba
张波,苏丽,胡波,李丽。花生AP2/ERF转录因子AhDREB1基因的表达受组蛋白乙酰化影响,提高拟南芥脱落酸敏感性和渗透胁迫耐受性。中华医学杂志,2018;19(5):1441。gydF4y2Ba
翟Y,邵SL,沙W,赵Y,张J,张任WW, c .过度大豆GmERF9增强了转基因烟草的耐干旱和寒冷。植物学报,2017,32(3):557 - 557。gydF4y2Ba
Goodstein DM, Shu S, Howson R, Neupane R, Hayes RD, Fazo J, Mitros T, Dirks W, Hellsten U, Putnam N,等。Phytozome:绿色植物基因组学比较平台。核酸学报,2012;40(数据库版):D1178-86。gydF4y2Ba
Grant D, Nelson RT, Cannon SB, Shoemaker RC。SoyBase, USDA-ARS大豆基因和基因组数据库。中国生物医学工程学报,2010;38(2):833 - 836。gydF4y2Ba
郭艾,朱庆华,陈旭,罗继杰。GSDS:基因结构显示服务器。Hereditas(北京)。2007; 29日(8):1023 - 6。gydF4y2Ba
刘K,杨问,杨T,吴Y,王G,杨F,王R,林X,李·G·发展农杆菌介导的瞬时表达系统CiDREB1C锦鸡儿中间体和表征的压力反应。植物学报,2019;19(1):237。gydF4y2Ba
李波,刘勇,崔学勇,傅建东,周玉波,郑文杰,兰建华,金丽丽,陈明,马玉柱,等。大豆TGA转录因子的全基因组鉴定和表达分析发现了一个新的TGA基因,该基因与大豆耐干旱和耐盐性有关。植物科学,2019;10:549。gydF4y2Ba
陈志刚,陈志刚。细胞对脱水和冷胁迫的反应和耐受性的转录调控网络。植物学报,2006;37(5):781 - 803。gydF4y2Ba
李伟,马敏,冯毅,李宏,王毅,马毅,李敏,安峰,郭辉。ein2介导的拟南芥乙烯信号转导调控。细胞。2015;163(3):670 - 83。gydF4y2Ba
乔华,沈志,黄世生,Schmitz RJ, Urich MA, Briggs SP, Ecker JR. er -系结EIN2调控对乙烯气体的亚细胞转运和调控。科学。2012;338(6105):390 - 3。gydF4y2Ba
李培生,于福峰,何海光,陈敏,周玉波,柴思聪,徐志生,马永忠。大豆Hsf家族的全基因组分析及GmHsf-34参与干旱和热胁迫的功能鉴定。生物医学工程学报,2014;15:1009。gydF4y2Ba
李振宇,徐志生,何光光,杨国祥,陈敏,李立林,马永忠。拟南芥BSK5编码油菜素类固醇信号激酶蛋白的突变影响对盐度和脱落酸的反应。中国生物医学工程学报,2012;26(4):522 - 527。gydF4y2Ba
王志强,王志强。植物肌动蛋白基因的遗传特征。中华生物医学杂志,1996;13(9):1198 - 1212。gydF4y2Ba
李建军,李建军,李建军,等。拟南芥植株真空浸润转化的研究进展。方法中华医学杂志,1998;82:259-66。gydF4y2Ba
刘鹏,徐志生,潘攀林,胡东,陈敏,李立林,马永忠。小麦PI4K基因的产物具有苏氨酸自磷酸化活性,赋予拟南芥对干旱和盐的耐受性。实验学报,2013;64(10):2915-27。gydF4y2Ba
陈磊,蒋炳军,吴彩霞,孙生,侯文华,韩凤凤。大豆根特异性基因GmTIP的鉴定及其启动子的表达分析。植物学报,2015,31(2):559 - 564。gydF4y2Ba
陈磊,蒋炳军,吴彩霞,孙生,侯文华,韩凤凤。GmPRP2启动子驱动转基因拟南芥和大豆毛状根的根优先表达。植物生态学报,2014;14(2):481 - 481。gydF4y2Ba
致谢gydF4y2Ba
我们感谢明石亮博士提供的gydF4y2BaSuperrootgydF4y2Ba的文化gydF4y2Bal . corniculatusgydF4y2Ba;彼得·格雷肖夫gydF4y2Ba答:rhizogenesgydF4y2Ba菌株K599和二进制载体pGFPGUSgydF4y2Ba+gydF4y2Ba;侯文生博士提供植物材料制备、技术援助和大豆种子。gydF4y2Ba
资金gydF4y2Ba
本研究的设计和数据收集由国家自然科学基金(31871624)资助。本研究数据分析与解释得到农业部国家转基因重点项目(2018ZX0800909B)的支持。本文由安徽科技大学人才引进基金(NXYJ201604)资助完成。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
ZSX协调项目,构思设计实验,编辑稿件;MJZ和LJY进行生物信息学分析、实验并撰写初稿;MJ和YL进行生物信息学分析;jz、JHL和JDF提供了有价值的讨论并对其进行了实质性修改;MC提供分析工具,分析数据;YZM协调项目并编辑稿件。所有作者都阅读并批准了最终稿件。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们没有竞争利益。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:表S1。gydF4y2Ba
大豆ERFs的遗传信息。gydF4y2Ba
附加文件2:图S1。gydF4y2Ba
大豆ERF在不同器官和发育阶段的表达分析。大豆erf的归一化表达数据来自SoyBase (gydF4y2Bahttp://www.soybase.org/gydF4y2Ba)(附加文件gydF4y2Ba3.gydF4y2Ba表2)。表达水平(垂直坐标)以每百万转录本(TPM)报告。横坐标下是不同的组织和发育阶段。不同的颜色表示大豆ERFs的表达水平。gydF4y2Ba
附加文件3:表S2。gydF4y2Ba
大豆erf在不同器官和发育时期的表达数据。gydF4y2Ba
附加文件4:图S2。gydF4y2Ba
12种大豆ERF蛋白的蛋白结构域。使用dog2.0绘制每个蛋白的结构域。保守的AP2/ERF结构域用蓝框表示。gydF4y2Ba
附加文件5:图S3。gydF4y2Ba
12个大豆ERF基因的内含子-外显子结构。内含子-外显子结构图使用GSDS在线工具生成。外显子、内含子和非翻译区(UTRs)分别用黄框、黑线和蓝框表示。gydF4y2Ba
附加文件6:图S4。gydF4y2Ba
GmERF75gydF4y2Ba正常生长条件下大豆特定组织的表达。从大豆幼苗的下胚轴、根、茎和叶中提取RNA。平行反应扩增Actin使表达水平正常化。gydF4y2Ba
附加文件7:图S5。gydF4y2Ba
核苷酸和推导出的氨基酸序列gydF4y2BaGmERF75gydF4y2Ba基因。非翻译区(UTRs)和内含子序列用小写字母表示。推导出的氨基酸序列显示在DNA序列的下面。AP2/ERF域用下划线表示。可能作为核定位信号的碱性氨基酸区域用方框标出,而可能作为转录激活域的酸性氨基酸区域用粗体表示。一个潜在的gydF4y2BaNgydF4y2Ba-连接的糖基化位点用虚线表示。gydF4y2Ba
附加文件8:图S6。gydF4y2Ba
GmERF75gydF4y2Ba拯救了两个短的下胚轴长度表型gydF4y2Baerf71gydF4y2Ba突变体。(一)gydF4y2Baerf71gydF4y2Ba突变体的下胚轴比WT短gydF4y2BaGmERF75gydF4y2Ba在突变体中部分恢复了短的下胚轴长度表型。右边的直方图显示了至少30个幼苗的下胚轴长度分布。gydF4y2Ba
附加文件9:表S3。gydF4y2Ba
第七组大豆erf qRT-PCR引物gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),它允许在任何媒体上不受限制地使用、分发和复制,前提是您要适当地注明原作者和来源,提供到知识共享许可协议的链接,并注明是否进行了修改。创作共用公共领域免责声明(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
赵,乔丹。,Yin, LJ., Liu, Y.et al。gydF4y2Baaba诱导的大豆ERF转录因子基因gydF4y2BaGmERF75gydF4y2Ba在提高渗透胁迫耐受性方面起一定作用gydF4y2Ba拟南芥gydF4y2Ba和大豆。gydF4y2BaBMC Plant BiolgydF4y2Ba19日,gydF4y2Ba506(2019)。https://doi.org/10.1186/s12870-019-2066-6gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-019-2066-6gydF4y2Ba
关键字gydF4y2Ba
- Ethylene-responsive因素gydF4y2Ba
- 下胚轴伸长gydF4y2Ba
- 根系生长gydF4y2Ba
- 响应机制gydF4y2Ba
- 渗透宽容gydF4y2Ba
- 大豆gydF4y2Ba